Desarrollo de un inóculo microbiano empleando lodos activados para la remoción de ácido sulfhídrico (H2S) mediante biofiltración*
Inoculum development by using activated sludge to remove hydrogen sulphide (H2S) through biofiltration*
Palabras clave:
biofilter, activated sludge, adapted microorganisms, sulphur-oxidising bacteria, respirometry, biofiltro, lodos activados, microorganismos adaptados, bacterias sulfooxidantes, respirometría (es)|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 26-34
|
|||
|
|
|||
|
Desarrollo de un inóculo microbiano empleando lodos activados para la remoción de ácido sulfhídrico (H2S)
mediante biofiltración*
Inoculum development by using activated sludge to remove hydrogen sulphide (H2S) through biofiltration*
Z. Alejandra Mora**; Carlos H. Chávez***; Gladys Fonseca****, Jorge A. Cabra*****, Yezid Carmona Salgado******
RESUMEN
Se utilizaron lodos activados de diferentes orígenes para el desarrollo de un inóculo apto para la degradación de ácido sulfhídrico en un sistema piloto de biofiltración con dos unidades de diferentes materiales de soporte: bagazo de caña en un caso y una mezcla de este y piedra pómez en el otro. Mediante la adición a los lodos activados, de medio nutritivo con un sustrato específico, se favoreció el proceso de adaptación y selección de las especies microbianas que degradan el ácido sulfhídrico (H2S). Durante la operación de la planta piloto se realizó el seguimiento de la variación poblacional de los diferentes grupos tróficos presentes en los soportes, observándose una tendencia al crecimiento de las bacterias sulfooxidantes (BSO) y la disminución de heterótrofos, mohos y levaduras. Para la estandarización del proceso de preparación del inóculo se seleccionó el lodo activado que presentó mayor velocidad de degradación del sustrato, proceso en el cual se evaluaron diferentes medios nutritivos. La medición de algunas variables de control permitió escoger el pH como la variable que determinaba el punto óptimo de adaptación de un inóculo para este sustrato. La inoculación y las características de los soportes para el establecimiento y desarrollo de las especies microbianas condujeron a que los biofiltros presentaran eficiencias de remoción mayores de 99% desde su arranque.
Palabras clave: biofiltro, lodos activados, microorganismos adaptados, bacterias sulfooxidantes, respirometría.
ABSTRACT
Different activated sludges were used for developing an inoculum able to degrade hydrogen sulphide in a pilot scale biofiltration plant using two different support materials: sugarcane bagasse and this bagasse mixed with pumice stone. Adapting and selecting microbial species which degrade hydrogen sulphide (H2S) was aided by adding nutrients plus a specific substrate to the activated sludge. Population variation was monitored within the different trophic groups in the biofiter medium during pilot scale plant operation, a general trend towards sulphur-oxidising bacteria (SOB) growth being observed as was a decrease in heterotrophic bacteria, molds and yeasts. The activated sludge which showed the highest substrate degradation speed was selected for standardising inoculum preparation; the different nutritional mediums were evaluated during this process. Measuring some variables for controlling the process led to choosing the pH for determining the proper point of inoculum adaptation for this specific substrate. The inoculation
|
|||
|
|
|||
|
Este artículo es el resultado de un proyecto cofinanciado por Colciencias y desarrollado por un grupo de
investigadores vinculados al proyecto a través de las entidades Corporación Biotec, Sucromiles y Levapan.
Bióloga, investigadora, Corporación Biotec. usi3-biotec@cgiar.org
|
|||
|
|
|||
|
***
|
|
||
|
Ingeniero químico, Gerente de producción, investigación y desarrollo, Pampa Ltda. Participó como tesista y
asistente del proyecto en mención. carchaye@hotmail.com
**** Microbióloga, Gerente en planta de Levapan del Ecuador S.A. gfonseca@levapan.com.ec ***** p^ p en Ciencias Agronómicas - Fitopatología. Agrónomo. MG. Consultores. Investigador del proyecto.
jorcabra@hotmail.com ***** Ingeniero químico, Especialista en gestión ambiental. Docente. Participó como director del proyecto.
yesidcarmona@hotmail.com Recibido: Septiembre 15 de 2004 Aceptado: Mayo 23 de 2005
|
|||
|
|
|||
|
26
|
|||
|
|
|||
|
|
|||
|
DESARROLLO DE UN INÓCULO MICROBIANO EMPLEANDO LODOS ACTIVADOS
|
|||
|
|
|||
|
procedure and support characteristics in terms of establishing and developing the microbial species increased biofilter removal efficiency by up to 99% from start-up.
Key words: biofilter, activated sludge, adapted microorganisms, sulphur-oxidising bacteria, respirometry.
|
|||
|
|
|||
|
INTRODUCCIÓN
Actualmente la biofiltración se presenta a nivel global como una tecnología altamente eficiente y económica para el control de las emisiones de una gran variedad de compuestos orgánicos volátiles (COVs) y compuestos olorosos como el H2S. Este compuesto representa el mayor problema que se asocia a los tratamientos anaerobios de aguas residuales, tanto municipales como industriales, por su alta toxicidad, propiedades corrosivas, mal olor y alta demanda de oxígeno (Carmona et ál., 2000; Janssen et ál., 1987).
Un biofiltro consta de un lecho de material poroso que sirve de soporte a una población microbiana la cual se encarga de degradar el contaminante a medida que este pasa a través del lecho. Dependiendo del material utilizado como soporte y del tipo de corriente a tratar, la población puede ser nativa o inoculada. Independientemente del tipo de soporte, la inoculación ayuda a reducir el tiempo de arranque del biofiltro y a maximizar el funcionamiento del sistema (Dragan, 1994).
El inóculo puede ser un consorcio de diversas especies microbianas, como las que se encuentran en los lodos aerobios de las plantas de tratamiento de aguas residuales, o puede ser un cultivo de microorganismos especializados con afinidad por un compuesto, los cuales pueden conseguirse comer-cialmente o en los laboratorios de centros de investigación en contaminantes. Aunque el riesgo para la salud es mínimo, el uso del lodo está restringido debido a la posible presencia de patógenos; lo más conveniente será utilizar lodos de las plantas de tratamiento de aguas residuales de industrias alimenticias (Devinny et ál., 1999).
En esta investigación se desarrolló, a partir de lodos activados, un inóculo con una población de BSO capaces de maximizar desde su arranque el funcionamiento de un biofiltro piloto para el control de emisiones de H2S, hecho que se reflejó en las eficiencias de remoción superiores al 99% desde su arranque. También se buscó determinar y relacionar
|
los parámetros involucrados durante la alimentación del lodo con la velocidad de degradación del contaminante. Además, se estandarizó una técnica para el recuento de BSO presentes en los soportes.
MATERIALES Y MÉTODOS Descripción de la planta piloto
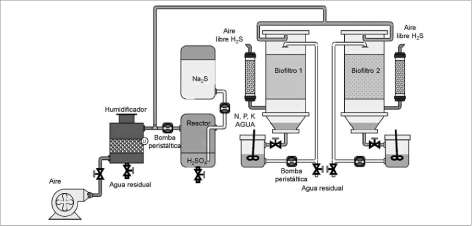
El proceso de adaptación de los lodos activados se llevó a cabo en tanques de polietileno (1.0 m de alto y 0.5 m de diámetro), adecuados con bocatomas para la adición de medio nutritivo, la purga de lodos y el suministro de aire. Los lodos adaptados en este sistema se utilizaron para inocular una planta piloto de biofiltración, conformada por dos biofiltros cilíndricos (0.5 m de diámetro y 2.5 m de alto), cada uno empacado con un lecho de 1.0 m de altura, con los siguientes materiales: bagazo de caña y una mezcla 4:1 (v/v) de este con piedra pomez (figura 1).
Los biofiltros tenían en sus costados tomas para el muestreo del gas y del soporte y en su parte superior se instaló un sistema de aspersión para el control de la humedad de los soportes. El H2S se generó químicamente, por la reacción entre sulfuro de sodio (Na2S) y ácido sulfúrico (H2SO4) y se mezcló con aire previamente humidificado hasta la saturación (humedad relativa 100%) en una cámara cilíndrica (0.5 m de diámetro) construida en acero inoxidable 316 empacada con un lecho de anillos plásticos (1/2" de diámetro, 0.3 m de altura).
Lodos activados y medios utilizados en la preparación del inóculo
Se utilizaron lodos provenientes de las plantas de tratamiento aeróbico de tres industrias: una procesa-dora de alimentos (L1), una productora de bebidas gaseosas (L2) y una destilería (L3). Los tres lodos se mezclaron en cantidades iguales después de ser sometidos a un proceso de selección inducida de las especies microbianas capaces de utilizar azufre como fuente de energía (BSO), mediante la adición diaria de dos medios nutritivos cuya composición se
|
||
|
|
|||
|
27
|
|||
|
|
|||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 26-34
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Figura 1. Diagrama de flujo de la planta piloto de biofiltración.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
presenta en la tabla 1. La mezcla obtenida (L4) se utilizó como inóculo para los biofiltros de la planta piloto.
Recuento en placa
Para realizar el recuento en placa y debido a que el agar ejerce un efecto inhibitorio sobre las BSO (De Bruyn etál., 1990), se empleó la técnica para lavado
|
del agar (Batagglia, 1989). Este procedimiento se realizó depositando en una probeta con 250 mL de agua destilada la cantidad necesaria de agar (15 g/L) en la preparación de medio requerida; la suspensión se dejó decantar por 20 minutos y se descartó el sobrenadante; esta operación se repitió tres veces.
Para realizar los recuentos en los soportes se pesaron 10 g de bagazo de caña (peso seco) o mezcla, en 90 mL de una solución fisiológica estéril (NaCl 0.85%); la suspensión se homogenizó por agitación durante 15 minutos a 370 rpm y se efectuaron las diluciones correspondientes; la siembra se realizó en profundidad, y las cajas se incubaron por un período de 15-20 días a una temperatura de 30 °C.
Para realizar el recuento de los diferentes grupos de microorganismos se utilizaron los medios que se presentan en la tabla 2.
Determinación de la actividad biológica de lodos activados
La actividad biológica, expresada como la capacidad de oxidación de H2S de los lodos, se determinó utilizando la respirometría (Gómez, 1998; Hill et ál., 1991), una técnica que permite medir el consumo de oxígeno utilizado por un cultivo microbiano para me-tabolizar un sustrato específico, a través de las
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 1. Composición de los medios nutritivos utilizados en la adaptación de los lodos
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
28
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
DESARROLLO DE UN INÓCULO MICROBIANO EMPLEANDO LODOS ACTIVADOS
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
velocidades de consumo de oxígeno asociadas con la respiración endógena de los microorganismos (OE) y con las oxidaciones química (OQ) y biológica (OB) del sustrato (tiosulfato de sodio utilizado en la adaptación y selección de las BSO).
Para determinar estas velocidades los lodos se sometieron a un precultivo, se inoculó 10 mL en 90 mL de medio de cultivo Postgate S (pH 4,0) y se incubó a 150 rpm y 30 °C (Agitador Orbital Mora Equipos) durante 5 días, después de los cuales el cultivo fue centrifugado a 10.000 rpm (Centrífuga Hettish, Universal 30F) por 10 minutos, y el precipitado obtenido se resuspendió en 35 mL de solución fisiológica estéril (0.85% NaCl). Esta suspensión y 100 mL de medio de cultivo Postgate (sin tiosulfato de sodio) se airearon durante 15 y 30 minutos, respectivamente, para garantizar la saturación con oxígeno, mediante el burbujeo de aire impulsado por aireadores para pecera. Con el fin de determinar la velocidad de respiración endógena se adicionaban 90 mL del medio y 10 mL de la suspensión de microorganismos a una botella tipo DBO de 100 mL (con un magneto en su interior), dispuesta sobre una plancha de agitación la cual se activaba inmediatamente después de introducir en la botella la sonda del medidor de oxígeno (modelo 5100; YSI Inc., Yellow Springs, OH, EUA); se registraba periódicamente la variación de la concentración de oxígeno disuelto (mg OD/L) a través del tiempo, para posteriormente calcular la velocidad de consumo de oxígeno (mg OD/L x minuto) mediante regresión lineal. Un proceso similar se utilizó para determinar las dos velocidades restantes, con la diferencia que para la velocidad de oxidación biológica (OB) se adicionaban 0.5 g de tiosulfato de sodio a la mezcla medio-suspensión de microorganismos y para la química (OQ) se utilizaba igual cantidad de tiosulfato de sodio pero se reemplazaba la suspensión de
|
microorganismos por agua destilada previamente aireada hasta la saturación. Siguiendo las recomendaciones del fabricante del equipo, en las res-pirometrías se utilizó tiosulfato de sodio (Na2S2O3 x 5H2O) como fuente de azufre, ya que el H2S ocasiona corrosión del electrodo de oxígeno y lecturas erróneas del consumo de oxígeno.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Una vez obtenidas las regresiones lineales, se procedió a calcular el consumo neto de oxígeno (v) en la oxidación del sustrato por la actividad metabólica de los microorganismos utilizando la ecuación 1:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
v =
|
[Vob - VOE - VOq] / [Biomasa]
(mg OD/mg células * min) [Ec. 1]
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Donde:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Vob = Velocidad de oxidación biológica
Voe = Velocidad de oxidación endógena
VOQ = Velocidad de oxidación química
Biomasa: Cantidad de BSO
La biomasa se determinó por el método de Lowry (García y Vázquez, 1998) para proteína (asumiendo que una bacteria típica contiene 15% de su masa total como nitrógeno).
Modificación del proceso de preparación de inóculo
Para disminuir el tiempo de preparación de inóculo se realizaron dos experimentos. En el primero se sometieron al proceso de selección las BSO presentes en los lodos que en la fase preliminar tuvieron la mayor y la menor velocidad de oxidación, (L2) y (L3),
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
29
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 26-34
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
respectivamente, alimentadas con los medios 1 y 2 (tabla 1), para determinar si la diferencia en la actividad biológica se debía a la composición del medio nutritivo o a la fuente de lodo.
Se realizó un segundo experimento para disminuir los costos de preparación del medio, se optó por bajar y modificar la concentración de nutrientes y minerales en la formulación de los medios utilizados durante la preparación del inóculo (tabla 1); tomando como referencia la patente de Torres-Cardona et ál. (1993), se optó por suprimir las fuentes de carbono y calcio, que no estaban presentes en la patente, y modificar las concentraciones de los otros elementos y evaluar el efecto del magnesio (en forma de sulfato de magnesio), presente en la formulación de la patente, sobre la actividad biológica de los lodos. Como resultado de este experimento se establecieron las fórmulas 1 y 2 que se presentan en la tabla 3.
|
Seguimiento a las poblaciones microbianas
Para el seguimiento a los microorganismos presentes en los soportes de los biofiltros piloto, se usó la técnica de recuento en placa, con una periodicidad del muestreo ajustada de acuerdo con los incrementos en la concentración de H2S en las semanas 3, 5, 11, 12, 14, 15, 16, 19y24.
RESULTADOS Y DISCUSIÓN
Actividad biológica de los lodos e inóculos para la planta piloto de biofiltración
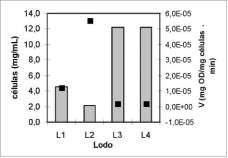
En la figura 2 se muestra la actividad biológica de los lodos antes de mezclarse (L1, L2, L3) y la mezcla (L4) antes de inocular los biofiltros. El mezclado y la posterior adición del medio hicieron que los inóculos presentaran una capacidad de oxidación muy baja en comparación con los lodos antes de la mezcla. El hecho de que los lodos L1, L2 presentaran una actividad mayor que el lodo L3 y el inóculo L4, supone que el medio utilizado en estos últimos no fue tan favorable para las BSO pero favoreció otros grupos tróficos, ya que a pesar de tener una mayor cantidad de células mg/mL (medidas por el método de Lowry), presentan la actividad más baja.
Seguimiento de las poblaciones microbianas en los biofiltros
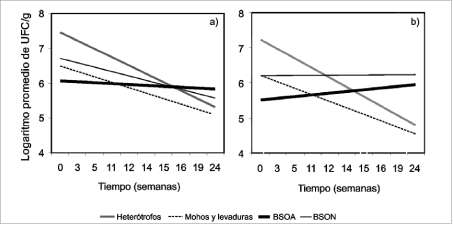
En la figura 3 se muestra la tendencia lineal de crecimiento poblacional que tuvieron a través del tiempo los diferentes grupos tróficos presentes en los soportes de los biofiltros piloto (bagazo y mezcla [bagazo-
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 3. Aporte de nutrientes y minerales utilizados durante la preparación de inóculo y la modificación de este proceso
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Con el objeto de disminuir el tiempo de respuesta y los costos de los análisis, para determinar la actividad biológica se modificó dicha metodología eliminando el cultivo previo de los lodos y estableciendo la relación de la actividad biológica con el pH (medición realizada con el potenciómetro Orion modelo 710A). También se optó por utilizar el contenido de sólidos suspendidos volátiles, análisis que se realizó por duplicado (SSV, mg/L) (Standar methods, 1992) como una medida de la biomasa, esto con el fin de eliminar las dificultades presentadas con el método de Lowry, debidas a la turbidez de los lodos.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Figura 2. Correlación entre la cantidad de células # y la actividad biológica # en lodos antes y después de mezclar.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
30
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||
|
DESARROLLO DE UN INÓCULO MICROBIANO EMPLEANDO LODOS ACTIVADOS
|
|||
|
|
|||
|
piedra pomez]). En términos generales se observó una tendencia a la disminución de los heterótrofos y mohos y levaduras, en ambos soportes, resultado que concuerda con lo reportado por Degorce-Du-mas et ál. (1997), ya que estas poblaciones no pueden degradar el H2S. Las BSO neutrófilas (BSON) tendieron a disminuir o a permanecer estables debido a la acidificación del soporte y/o acumulación de sulfatos y/o a la carencia de nutrientes. Las BSO aci-dófilas (BSOA) presentes en mezcla de bagazo y piedra pomez (figura 3b) tuvieron una tendencia al crecimiento, hecho que refleja que este material mostró ventajas para el establecimiento de la población gracias a su mayor porosidad y capacidad de absorción de acuerdo con los datos de Sucromiles, 1997.
Resultados en planta piloto
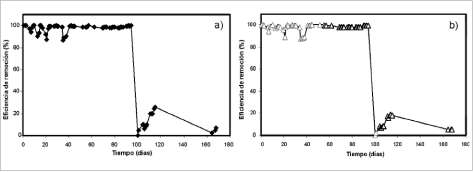
Los estudios de planta piloto se realizaron durante un período de 6 meses, en los cuales los biofiltros operaron continuamente y presentaron eficiencias de remoción superiores al 99% (Chávez et ál., 2004) desde el mismo arranque, como se aprecia en la figura 4 a) y 4 b).
Esto se atribuyó a que los soportes se inocularon con un consorcio de bacterias sulfooxidantes provenientes de la mezcla inicial de lodos (L4), que permitió reducir el período de aclimatación de las
|
especies microbianas con capacidad de utilizar el azufre como fuente de energía.
La caída de la eficiencia de remoción que ocurrió en el día 100 de operación, se debió a un corte imprevisto en el suministro de aire durante 3 días. La falta de oxígeno afectó a tal grado a los microorganismos, que este no se recuperó a pesar de renovar el suministro de aire (figura 4 a) y 4 b)).
Optimización del proceso de preparación de inóculo para los biofiltros
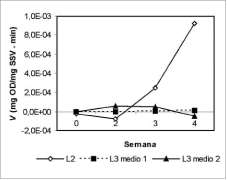
En la figura 5 se presentan los resultados del primer experimento; el lodo 3 tuvo una mayor velocidad de oxidación al ser alimentado con el medio 1 durante las dos primeras semanas de ensayo; al comparar la velocidad del lodo 3 con la del lodo 2, se encontró que este último tuvo la mayor velocidad de oxidación a partir de las semanas tres y cuatro de alimentación.
De acuerdo con este resultado y el de la figura 2, se determinó utilizar el lodo 2 (bebidas gaseosas) como materia prima para preparación del inóculo.
A las velocidades de oxidación obtenidas se-manalmente se les realizó una prueba t de comparación de medias (3 repeticiones); en la tabla 4 se observa que no existen diferencias estadísticamente
|
||
|
|
|||
 |
|||
|
|
|||
|
Figura 3. Logaritmo de los recuentos microbiológicos promedio en los biofiltros piloto con soporte de bagazo a) y mezcla b) a través del tiempo.
|
|||
|
|
|||
|
31
|
|||
|
|
|||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 26-34
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Figura 4. Eficiencia de remoción (%) de H2S en biofiltros piloto con soporte de bagazo a) y mezcla b) a través del tiempo.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
contingencia para remediar esta situación, se optó por hacer una purga del sedimento de los lodos, hecho que logró la recuperación de la actividad biológica en las semanas 5 y 6.
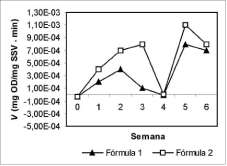
La adición del magnesio (fórmula 1) no proporcionó ninguna ventaja significativa, razón por la cual se seleccionó la fórmula 2 como la alternativa más económica para la adaptación de los lodos.
Independientemente de la presencia del magnesio, la capacidad de oxidación alcanzó velocidades elevadas en tan solo dos semanas, un tiempo relativamente corto que permite producir un inóculo altamente eficiente y de bajo costo.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Figura 5. Variación de la actividad biológica de los lodos L2 y L3 a través del tiempo.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
significativas entre las dos fórmulas (valor p > 0.05 en cada prueba).
El valor negativo de la semana 4 (figura 5) se atribuyó a la acumulación de metabolitos secundarios que permanecieron disueltos en el lodo y alcanzaron concentraciones inhibitorias, lo que condujo a que se incrementara el pH, ocasionando finalmente la muerte celular, como reporta la literatura (Groe-nestijn y Hesselink, 1993); la actividad microbiana está influenciada por la acumulación en altas concentraciones de sales inorgánicas (sulfatos), así como de iones reducidos (azufre) que tienen efecto tóxico en los microorganismos. Como medida de
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
32
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||
|
DESARROLLO DE UN INÓCULO MICROBIANO EMPLEANDO LODOS ACTIVADOS
|
|||
|
|
|||
 |
establecimiento y desarrollo del consorcio microbiano inoculado en ellos, hecho que representa una gran ventaja ya que permite optimizar el funcionamiento de los biofiltros y obtener altas eficiencias de remoción desde el arranque.
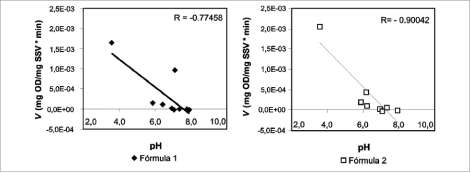
No se observó una correspondencia directa entre la actividad biológica de las BSO y la cantidad de estas presentes en el inóculo. Sin embargo, se pudo establecer una correlación entre la capacidad de oxidación del sustrato que presentaba el inóculo y el pH del mismo, un parámetro que puede medirse fácil y rápidamente, lo que permitió implementar una metodología de seguimiento sencilla y económica.
El tiempo de preparación del inóculo no debe ser superior a tres semanas, ya que la capacidad de degradación de los microorganismos tiende a disminuir, lo que requiere hacer una purga y esperar tiempo adicional de alimentación que incrementa los costos de producción.
Durante el funcionamiento de un biofiltro se debe garantizar el suministro continuo de aire, pues la falta de oxígeno tiene un efecto negativo en la población microbiana, que se refleja en la caída de la eficiencia de remoción.
AGRADECIMIENTOS
Este trabajo fue financiado por Colciencias y las empresas Sucromiles y Levapan, y ejecutado por un grupo de investigadores de la Corporación Biotec y ambas empresas.
|
||
|
Figura 6. Actividad biológica promedio versus tiempo del L2 utilizando dos fórmulas.
|
|||
|
En la figura 7 se observa una correlación inversa entre el pH y la velocidad de oxidación presentadas por el inóculo, utilizando dos formulaciones; la máxima actividad se obtuvo cuando el pH alcanzó el valor más bajo.
CONCLUSIONES
Se encontró que el lodo de la planta de tratamiento de aguas residuales de una industria productora de bebidas gaseosas (refrescantes) fue una fuente apropiada de bacterias sulfooxidantes capaces de degradar H2S.
Los materiales de soporte utilizados, además de tener buenas propiedades estructurales y bajo costo, presentaron características idóneas para el
|
|||
|
|
|||
 |
|||
|
|
|||
|
Figura 7. Correlación entre el pH y la velocidad de oxidación del lodo utilizando dos formulaciones.
|
|||
|
|
|||
|
33
|
|||
|
|
|||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 26-34
|
|||
|
|
|||
|
Los autores agradecen al Dr. Sergio Revah, asesor del proyecto, sus sugerencias en este artículo.
BIBLIOGRAFÍA
American Public Health Association. 1992. Standarmethods for the examination of water and wastewater, 18th edi-tion. Washington: APHA, AWWA,WWCF, pp. 2-56.
Battaglia, F. 1989. Lixiviation bacterienne par Thiobacillus fe-rrooxidans et Thiobacillus thiooxidans d'un concentre de flotation arsenopyriteux aurifere (refractaire a la cya-nuration directe). Tesis de grado, Universidad de Pro-vence, 162 pp.
Carmona, Y.; Cabra, J.; Mora, A.; Chávez, C.; Gnecco, G.; Rojas, M.; Fonseca, G.; Grisales, Y. 2000. Desarrollo de una tecnología de remoción microbiana de ácido sulfhídrico producido en plantas industriales de tratamiento de aguas residuales. Memorias-Seminario Taller Internacional "Soluciones en contaminación de aire", julio 14 y 15, Palmira.
Chávez, C.; Mora, A.; Cabra, J.; Carmona, Y.; Revah, S.; Gnecco, S. 2004. Biofiltración de ácido sulfhídrico (H2S) utilizando bagazo de caña de azúcar y piedra pómez como material de soporte. Ingeniería y Competitividad, volumen 5, No. 2, mayo, pp. 7-15.
De Bruyn, J. C.; Boogerd, F. C.; Bos, P.; Kuenen, J. G. 1990. Floating filters, a novel technique for isolation and enu-meration of fastidious, acidophylic, iron-oxidizing, auto-trophic bacteria. Appl. Environ. Microbiol. Vol. 56 (9): 2891-2894.
Degorce-Dumas, J. R.; Kowal, S.; Cloirec, P. L. 1997. Micro-biological oxidation of hydrogen sulphide in a biofilter. Can. J. Microbiol. 43: 264-271.
|
Devinny, J.; Deshusses, M.; Webster, T. 1999. Biofiltration for air pollution control. USA Lewis Publishers, chapter 5, pp. 81-110; chapter 9, pp. 211-250.
Dragan, A. 1994. La biofiltración de gases contaminados. Ingeniería Química. Enero: 161-167.
García, H.; Vázquez, R. 1998. Cuantificación de proteínas: una revisión. Biotecnología. Vol. 3: 77-88.
Gómez, J. A. 1998. Informe de entrenamiento en CG, HPLC, biofiltración, biolavado. Universidad Autónoma Metropolitana, Laboratorio de Bioprocesos. Iztapalapa. México. Unidad de Servicios de Información, USI (Corporación Biotec), No. bibliográfico 1208A.
Groenestijn, van J. W.; Hesselink, P. G. M. 1993. Biotechni-ques for air pollution control. Biodegradation. 4: 283-301. Netherland.
Hill, J. B.; Bleam, R. D.; Zitrides, T. G.; McDowell, C. S. 1991. Advanced measurement cells for automated quantifica-tion of biodegradative microbial oxygen uptake in fluid, semi-solid and solid media. 45th Purdue industrial waste conference proceedings, pp. 491-499. Michigan, USA.
Janssen, A. J. H.; Sleyster, R.; Kaa, van der C.; Jochemsen, A.; Botsema, J.; Lettinga, G. 1987. Biological sulphide oxidation in a fed-batch reactor. Biotechnol. Bioeng. 47: 249-257.
Sucromiles, datos planta de control ambiental. Estudio realizado en la laguna de tratamiento de aguas residuales, 1997.
Torres-Cardona, M.; Revah-Moissev, S.; Hinojosa-Martínez, A.; Páez-Moreno,A.; Moreno-Baca, V. M. 1993. Biological process for the elimination of sulphur compounds present in gas mixtures. United States Patent. Number 5, 236, 677. Aug. 17.
|
||
|
|
|||
|
34
|
|||
|
|
|||
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2005 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















