Producción de xilitol a partir de levaduras nativas colombianas*
Xylitol production from colombian native yeast strains
Palabras clave:
xilitol, xilosa, levaduras, Candida kefyr, C. tropicalis, C. parapsilosis (es)|
|
||
|
____________________REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 31-36
Producción de xilitol a partir de levaduras nativas colombianas*
Xylitol production from colombian native yeast strains
|
||
|
|
||
|
***
|
||
|
|
||
|
Isleny Andrea Vanegas Córdoba** , María del Socorro Yepes Pérez*** , Orlando Simón Ruiz Villadiego
RESUMEN
El xilitol es un edulcorante alternativo con características similares a la sacarosa que ha despertado gran interés debido principalmente a su uso seguro en pacientes diabéticos y aquellos deficientes en glucosa-6-fosfato-deshidrogenasa. Su síntesis química es costosa y genera subproductos indeseables, mientras que el proceso biotecnológico, utilizando levaduras de diferentes géneros, se perfila como una alternativa viable de producción por ser más seguro y específico. Colombia, por su ubicación geográfica privilegiada, ofrece una gran variedad microbiana que puede aprovecharse con fines académicos y comerciales, por esto, en el presente trabajo se realizó la búsqueda de algunos microorganismos nativos con potencial para la producción de xilitol. Se aislaron 25 especies de levaduras, de las cuales fue posible identificar bioquímicamente el 84% mediante el kit API 20C-AUX. Tres levaduras: Candida kefyr, C. tropicalis y C. parapsilosis presentaron mayor capacidad para degradar xilosa frente a las demás, por lo que fueron seleccionadas para la posterior evaluación de su capacidad productora. Se desarrollaron cultivos celulares discontinuos en matraces agitados a 200 rpm y 35 °C por 30 horas, usando un medio sintético con xilosa como fuente de carbono. La evaluación del consumo de xilosa y la producción de xilitol se realizó por cromatografía de capa fina y cromatografía líquida de alta resolución. Los rendimientos máximos se lograron con Candida kefyr y C. tropicalis (Yp/s 0,5 y 0,43 g/g, respectivamente), utilizando una concentración inicial de 20 g/L de xilosa.
Palabras clave: xilitol, xilosa, levaduras, Candida kefyr, C. tropicalis, C. parapsilosis.
ABSTRACT
Xylitol is an alternative sweetener with similar characteristics to sucrose that has become of great interest, due mainly to its safe use in diabetic patients and those deficient in glucose-6-phosphate-dehydrogenase. Its chemical production is expensive and generates undesirable by-products, whereas biotechnological process, which uses different yeasts genera, is a viable production alternative because it is safer and specific. Colombia has a privilege geographic location and offers a great microbial variety, this can be taken advantage of with academic and commercial goals. Because of this, some native microorganisms with potential to produce xylitol were screened in this work. It were isolated 25 yeasts species, from which was possible to identify 84% by the kit API 20C-AUX. Three yeasts: Candida kefyr, C. tropicalis y C. parapsilosis presented greater capacity to degrade xylose compared to the others, therefore they were selected for the later evaluation of its productive capacity. Discontinuous cellular cultures were developed in shaken flasks at 200 rpm and 35°C by 30 hours, using synthetic media with xylose as carbon source. Xylose consumption and xylitol production were
|
||
|
|
||
|
* Este artículo corresponde a la presentación oral que obtuvo el tercer lugar en la sala de bioprocesos,
bioprospección y ambiental del segundo Congreso Colombiano de Biotecnología. ** Ingeniera química, M. Sc. biotecnología. Universidad Nacional de Colombia, sede Medellín. Correo electrónico:
iavanega@unalmed.edu.co
Química, M. Sc. ciencias químicas, Área Productos naturales. Universidad Nacional de Colombia, sede Medellín.
Correo electrónico: msyepes@unalmed.edu.co **** Químico, M. Sc. ciencia y tecnología del carbón. Universidad Nacional de Colombia, sede Medellín. Correo
electrónico: osruiz@unalmed.edu.co
Recibido: octubre 26 de 2004. Aceptado: octubre 29 de 2004.
|
||
|
|
||
|
31
|
||
|
|
||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 31-36
|
|||
|
|
|||
|
evaluated by thin layer chromatography and high performance liquid chromatography. The maximal efficiency were obtained with Candida kefyr and C. tropicalis (Yp/s 0.5 y 0.43 g/g, respectively), using an initial xylose concentration of 20 g/L.
Key words: Xylitol, xylose, yeasts, Candida kefyr, C. tropicalis, C. parapsilosis.
|
|||
|
|
|||
|
INTRODUCCIÓN
Desde las primeras etapas de su vida, el hombre muestra una fuerte tendencia por el sabor dulce. Se presume que el hombre primitivo lo utilizó como indicador en la selección de sustancias aptas para consumir, haciendo una asociación casi inconsciente del sabor dulce de los alimentos con su inocuidad (Hugill, 1981).
El mercado actual ofrece una gran variedad de edulcorantes con diferentes especificidades y beneficios, considerando aspectos energéticos, económicos y de seguridad alimentaria. Uno de los edulcorantes alternativos que ha despertado el interés de numerosos investigadores a nivel mundial es el xilitol (C5H12O5), un azúcar alcohol que por sus múltiples ventajas se usa en las industrias de alimentos, farmacéutica y en la elaboración de productos de higiene oral. El xilitol es de apariencia y dulzura similares a la sacarosa, pero aporta un 40% menos de calorías (2,4 kcal/g). Por esta razón, es utilizado como sustituto del azúcar en una relación 1:1 peso a peso, con la consecuente disminución calórica. Es muy estable en la fabricación de alimentos, no fermenta y no produce par-deamientode Maillard (Ooi etal., 2002; Emodi, 1978).
En el área de la salud se destaca su inclusión en la dieta y las formulaciones destinadas a pacientes diabéticos, porque su metabolismo no está regulado por la insulina. De igual forma, las personas deficientes en glucosa-6-fosfato deshidrogenasa lo encuentran adecuado, debido a que su biotransformación celular no requiere de esta enzima (Choi et al., 2000; Converti et al., 2000). Otras características importantes del xilitol son su efecto anticariogénico (Martínez etal.,2001; Heikkilaetal., 1992) y en la prevención de la otitis media aguda en la población infantil (Tapiai-nen, 2002; Glasnapp y Tribble, 2000). A nivel experimental, su ingestión se relaciona con el aumento en la absorción ósea de calcio en ratas de laboratorio, previniendo la osteoporosis o mejorando las condiciones de aquellas que ya la padecen (Mattila, 1999).
El xilitol se encuentra de manera natural en numerosas frutas y algunas legumbres como ciruelas
|
amarillas, fresas, coliflor, frambuesa, lechuga, espinaca, zanahoria, banano y cebolla, aunque en muy bajas concentraciones, lo que hace que su extracción de dichas fuentes no sea práctica ni económica (Ooi et al., 2002; Affleck, 2000). En la actualidad, su producción a gran escala se realiza por hidrogena-ción catalítica de la xilosa a altas presiones y temperaturas. Además de los altos costos de producción, se generan impurezas que dificultan la purificación y cristalización del producto final. Otra forma de obtención es a través de procesos biotecnológicos, los cuales son una alternativa de producción limpia, porque no generan subproductos tóxicos debido a su naturaleza específica.
La biotransformación se realiza utilizando bacterias y algunos hongos capaces de asimilar y fermentar la xilosa a xilitol, etanol y otros compuestos. Dentro de todas las especies microbianas, las levaduras son reconocidas como las mejores productoras de xilitol, especialmente los géneros Pichia, Hansenula, Kluyveromyces, Pachysolen, Debar-yomyces, Schizosaccharomyces, Saccharomyces y Candida, considerada en el campo de la investigación como el patrón de referencia (Gronström, 2002; Barbosa et al., 1988; Winkelhausen y Kuzmanova, 1998; Mayerhoff et al., 1997).
En este trabajo de investigación se aislaron 25 cepas de levaduras nativas de diferentes fuentes de Medellín y su área metropolitana, con el fin de hacer una selección de las que presentaran mayor potencial para la producción de xilitol. Mediante procesos discontinuos se procedió a desarrollar el cultivo celular en un medio sintético con xilosa y luego se evaluó el consumo del sustrato y la producción de xilitol para las cepas seleccionadas, por cromatografía de capa fina (TLC: Thin Layer Chromatography) y cromatografía líquida de alta resolución (HPLC: High Performance Liquid Chromatography).
MATERIALES Y MÉTODOS
Aislamiento, selección e identificación de levaduras. Los microorganismos se aislaron de fuentes que
|
||
|
|
|||
|
32
|
|||
|
|
|||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
PRODUCCIÓN DE XILITOL A PARTIR DE LEVADURAS NATIVAS COLOMBIANAS
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
se caracterizan por tener altos contenidos de hemice-lulosa y/o carbohidratos, como bagazo y guarapo de caña de azúcar, suelos de sembrado de caña, de trapiches y de zonas arborizadas. También se aisló de tejido de tomate en descomposición. Las levaduras aisladas se purificaron por medio de repiques sucesivos. Posteriormente se hizo una selección entre las cepas que presentaron mayor potencial para metabolizar la xilosa, como indicativo de su posible producción de xili-tol. Para ello se empleó un medio mínimo selectivo cuya composición en porcentaje p/vfue: xilosa 1,5%, (NH4)2SO4 0,5%, KH2PO4 0.5%, Agar - Agar 2,0%. Luego, las levaduras seleccionadas se identificaron bioquímicamente con el kit API 20C-AUX.
Microorganismos y preparación del inóculo. Las
levaduras seleccionadas se conservaron en tubos de ensayo con agar Sabouraud en bisel a 4 °C. Para las evaluaciones, las levaduras se sembraron en cajas de Petri en medio agar Sabouraud y se incubaron por 24 horas a 35 °C. Después de ese tiempo, se tomó una asada del cultivo fresco y se inoculó en 100 mL de medio Sabouraud líquido, en matraces a 200 rpm por 24 horas a 35 °C. Posteriormente, las células fueron centrifugadas en condiciones ascépti-cas a 20000 rpm por 15 min., lavadas y resuspendi-das en agua destilada estéril. De esta suspensión se tomaron volúmenes adecuados de células hasta obtener concentraciones de inóculo entre 0,5 y 4,0 g/L.
Medios y condiciones de producción. Se realizaron cultivos celulares discontinuos microaeróbicos con el medio de cultivo sintético descrito por Yahashi et al. (1996), cuya composición fue xilosa 20,0 g/L, glucosa 2,0 g/L, KH2PO4 15,0 g/L, (NH4)2SO4 3,0 g/L, MgSO4.7H2O 1,0 g/L. Este medio contiene glucosa como suplemento con el fin de estimular el crecimiento celular y la posterior producción del metabolito. Se tomaron 20 mL de medio en matraces de 50 mL cubiertos con tapones de algodón y se agitaron a 200 rpm a 35 °C. El pH inicial fue de 4,5 y no se controló durante el transcurso de los experimentos. Los cultivos se desarrollaron siguiendo un diseño experimental con un solo factor (variable de estudio: cepa) y cuatro variables de respuesta: crecimiento celular, consumo de xilosa, producción dexilitol y pH del medio. Se realizaron cuatro repeticiones de cada experimento y los resultados fueron sometidos a pruebas de media y análisis de varianza mediante el paquete estadístico SAS.
Métodos analíticos. Se realizó un monitoreo periódico de las corridas experimentales para determinar
|
el consumo de la fuente de carbono y la producción dexilitol. Las muestras fueron diluidas (1:10), sometidas a eliminación de proteínas, lípidos y colorantes de alto peso molecular y posteriormente microfiltra-das a través de membranas de 0,45 |jm. Las concentraciones de glucosa, xilosa y xilitol se monitorea-ron por HPLC (Perkin Elmer series 200), usando un detector de índice de refracción (RI) y la columna Va-rian Carbohydrates Ca, con las siguientes condiciones: eluente H2O, flujo de 0,5 mL/min., temperatura de la columna 90 °C, atenuación en el detector 8, volumen de la muestra 20 \jL.
La determinación de la concentración celular se realizó indirectamente por correlación entre el peso seco de las células y su absorbancia a X = 600 nm.
RESULTADOS Y DISCUSIÓN
Aislamiento de microorganismos. De un total de 128 muestras se aislaron y purificaron 25 cepas de levaduras cuya identificación correspondió a los géneros Candida, Cryptococcus y Rhodotorula (tabla 1).
No fue posible establecer la identificación bioquímica de cuatro de las levaduras aisladas, indicando la necesidad de utilizar un método de identificación diferente para dichos microorganismos.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
33
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 31-36
|
|||
|
|
|||
|
Se seleccionaron las levaduras Candida kefyr, C. tropicalisyC. parapsilosis (figura 1) como las más promisorias, por presentar mayor crecimiento en el medio mínimo con xilosa en un menor tiempo.
|
 |
||
 |
|||
|
Figura 1. Levaduras seleccionadas para la producción de xilitol. a) Candida tropicalis, b) C. kefyr y c) C. parapsilosis observadas en microscopio (objetivo 100X).
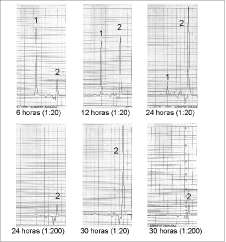
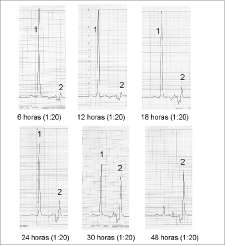
Cultivos celulares. Las tres levaduras seleccionadas fueron sometidas a evaluación de su capacidad productora de xilitol, en cultivos celulares discontinuos. El seguimiento por TLC permitió establecer el tiempo final de los cultivos, el cual fue de 30 horas para C. kefyry C. tropicalis. C. parapsilosis se moni-toreó hasta las 48 horas, tiempo en el cual se finalizó su evaluación, aunque en el medio aún había presencia de xilosa.
Las figuras 2, 3 y 4 representan los resultados de la evaluación cromatográfica de los cultivos, a las 6, 12, 18, 24 y 30 horas. Sólo para C. parapsilosis hasta las 48 horas.
Las muestras fueron diluidas en proporción 1:20 para la cuantificación por HPLC. En las etapas de mayor producción fue necesario realizar diluciones por un factor de 200. Para C. kefyr se hicieron nuevas diluciones a partir de las 24 horas (figura 3) y para C. tropicalis a la hora 30. C. parapsilosis no requirió posteriores diluciones debido a su baja producción.
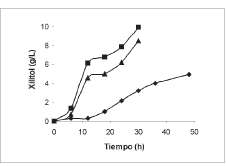
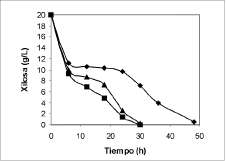
Los resultados del consumo de xilosa y producción de xilitol evaluados por HPLC se presentan en las figuras 5 y 6 para las tres levaduras seleccionadas.
En las seis primeras horas del cultivo ocurrieron los mayores cambios en cuanto a consumo de xilosa por las tres cepas (figuras 2, 3, 4 y 5). Se presume que en este tiempo las células utilizaron la xilosa principalmente para su crecimiento y estimulación de la producción enzimática. Con C. parapsilosis fue notorio el bajo consumo, lo que aparentemente está relacionado de forma directa con su baja producción.
|
|||
|
Figura 2. Producción de xilitol por Candida tropicalis.
|
|||
 |
|||
|
Figura 3. Producción de xilitol por Candida kefyr.
|
|||
|
En relación con la producción de xilitol, Candida kefyr representa un potencial importante seguida muy de cerca por C. tropicalis, mientras que C. parapsilosis tuvo un bajo desempeño con muy poca producción en un periodo bastante largo de tiempo
|
|||
|
|
|||
|
34
|
|||
|
|
|||
|
|
||||||||||||||||||||||||||||||||||||||
|
PRODUCCIÓN DE XILITOL A PARTIR DE LEVADURAS NATIVAS COLOMBIANAS
|
||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||
 |
 |
|||||||||||||||||||||||||||||||||||||
|
Figura 6. Producción de xilitol por Candida tropicalis (A), C. Kefyr (■), y C. parapsilosis (♦).
|
||||||||||||||||||||||||||||||||||||||
|
Tabla 2. Rendimiento de la producción de xilitol
|
||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||
|
Figura 4. Producción de xilitol por Candida parapsilosis.
|
||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||
|
Qp s/s: velocidad volumétrica de producción Yp s/s: rendimiento de xilitol a partir de xilosa
|
||||||||||||||||||||||||||||||||||||||
|
tropicalis y C. parapsilosis a las condiciones de fermentación, partiendo de 20 g/L de xilosa, en un tiempo total de 30 horas.
El mayor rendimiento se obtuvo a partir de C. kefyr, seguida muy de cerca por C. tropicalis. Para C. parapsilosis el valor fue significativamente menor. Es importante entonces considerar estos resultados para una posterior optimización de las variables que pueden afectar la producción del edulcorante por C. kefyry C. tropicalis. También sería oportuno un estudio de las condiciones en las cuales se pueda mejorar la producción a partir de C. parapsilosis, teniendo en cuenta que es una de las más reconocidas en el ámbito investigativo por su producción.
CONCLUSIONES
Las levaduras nativas del género Candida son los microorganismos que presentaron mayor capacidad para metabolizar xilosa, además fueron las más difundidas en las fuentes de muestreo.
|
||||||||||||||||||||||||||||||||||||||
|
Figura 5. Consumo de xilosa por Candida tropicalis (A), C. Kefyr ('), y C. parapsilosis (♦).
|
||||||||||||||||||||||||||||||||||||||
|
(figura 6), lo que es poco deseable para procesos a nivel industrial. El pH pudo haber sido uno de los parámetros de mayor incidencia en el comportamiento de C. parapsilosis, pues se reporta que ésta es una de las cepas de mayor producción (Oh et al., 1998; Winkelhausen y Kuzmanova, 1998; Mayerhoff et al., 1997; Preziosi-Belloy etal., 1997; Kim etal., 1997).
Rendimiento de la producción de xilitol. La tabla 2 sintetiza los valores de productividades volumétricas y rendimientos obtenidos con Candida kefyr, C.
|
||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||
|
35
|
||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 31-36
|
|||
|
|
|||
|
Candida glabrata se aisló de fuentes tan diversas como el compostaje, bagazo y guarapo de caña de azúcar, constituyéndose en la levadura nativa de más amplia distribución.
La cepa nativa Candida kefyr fue la levadura que exhibió la mayor producción de xilitol, durante un tiempo total de 30 horas, lo que la ubica en un lugar especial con respecto a las otras cepas aisladas.
C. tropicalis presentó un buen desempeño en la producción de xilitol bajo las condiciones evaluadas en esta investigación. Este resultado está en concordancia con los reportes que se han hecho sobre ella.
C. parapsilosis no se manifestó como una gran productora de xilitol bajo las condiciones ensayadas. No obstante, esta levadura se reporta en otras investigaciones con una gran capacidad productora. En este caso la cepa que se aisló utilizó la xilosa principalmente para su crecimiento.
La variedad de cepas de levaduras que presentaron potencial para la producción de xilitol se aislaron de fuentes muy diversas, lo que corrobora la biodiver-sidad que existe en el país. Colombia brinda la oportunidad de aislar numerosas cepas microbianas nativas, potencialmente productoras de gran cantidad de metabolitos de interés industrial, como es el xilitol.
AGRADECIMIENTOS
Los autores agradecen muy especialmente a la Dirección de Investigaciones de la Universidad Nacional de Colombia, Sede Medellín (DIME) por su apoyo financiero a esta investigación.
BIBLIOGRAFÍA
Affleck, R. P. 2000. Recovery of xylitol from fermentation of model hemicellulose hydrolysates using membrane technology. Thesis for the degree of Master of Science in Biological Systems Engineering. Virginia Polytechnic Institute and State University. 114.
Barbosa, M. F. S.; De Madeiros, M. B.; etal. 1988. Screening of yeasts for production of xylitol from D-xylosa and some factors which affectxylitol yield in Candida guillier-mondii. Journal of Industrial Microbiology, 3: 241-251.
Choi, J.-H.; Moon, K.-H.; Ryu, Y.-W. and Seo, J.-H. 2000. Production of xilitol in cell recycle fermentations of Candida tropicalis. Biotechnology Letters. 22: 1625-1628.
Converti, A.; Perego, P.; Torre, P. and Silva, S. S. 2000. Mixed inhibitions by methanol, furfural and acetic acid on xylitol
|
production by Candida guilliermondii. Biotechnology Letters. 22: 1861-1865.
Emodi, A. 1978. Xylitol: It's properties and food applications. Food Technology. 28-32.
Glasnapp, A. and Tribble, P. A. 2000. Xylitol in the Prevention of Otitis Media. Xylitol can be useful as prophylaxis in children. International Journal of Pharmaceutical Com-pounding May/June. 1-4.
Granström, T. 2002. Biotechnological production of xylitol with candida yeasts. Dissertation for the degree of Doctor of Philosophy Helsinki University of Technology, Depart-ment of Chemical Technology.
Heikkila, H.; Juha, N.; Rahkila, L. and Tyryla, M. 1992. Method for the production of Xylitol. United States Patent No. 5,081,026.
Hugill, J. A. C. 1981. El ámbito de los edulcorantes. La industria azucarera. 87 (1003): 46-52.
Kim, S. Yo.; Kim, J.-H.e and Oh, D.-K. 1997. Improvement of xylitol production by controlling oxygen supply in Candida parapsilosis. Journal of Fermentation and Bioengi-neering. 83 (3): 267-270.
Martínez, E. A.; Villarreal, M. L. M., Almeida E. Silva, J. B.; Solen-zal, A. I. N.; Canilha, L.; Mussatto, S. I. 2001. Uso de diferentes materias primas para la producción biotecnológica de xilitol. Ciencia y Tecnología de Alimentos. 3 (5): 295-301.
Mattila, P. 1999. Dietary xylitol in the prevention of experimental osteoporosis. Beneficial effects on bone resorption, structure and biomechanics. Oulu, Finland: Oulu University Library. 65.
Mayerhoff Zea, D.V.L.; Roberto, I. C.; Silva, S. S. 1997. Xylitol production from rice straw hemicellulose hydrolysate using different yeast strains. Biotechnology Letters. 19 (5): 407-409.
Oh, D.-K.; Kim, S.-Y.; Kim, J.-H. 1998. Increase of Xylitol Production rate by controlling redox potential in Candida parapsilosis. Biotechnology and Bioengineering. 58 (4): 440-444.
Ooi, B. G.; Le, T. T. B.; Markuszewski, B. M. 2002. The effects of glucose on the yeast conversion of xylose into xylitol by C. Guilliermondii and C. Tropicalis. En: Electronic Journal of Environmental, Agricultural and Food Chemistry. 1 (3).
Preziosi-Belloy, L.; Nolleau, V.; Navarro, J. M. 1997. Fermentation of hemicellulosic sugars and sugar mixtures to xylitol by Candida parapsilosis. Enzime and Microbial Technology. 21: 124-129.
Tapiainen, T. 2002. Microbiological effects and clinical use of xylitol in preventing acute otitis media. Academic Dissertation to be presented with the assent of the Faculty of Medicine, University of Oulu, Department of Pedia-trics, University of Oulu, Finland.
Winkelhausen, E.; Kuzmanova, S. 1998. Review: Microbial conversion of D-xilose to xylitol. Journal of Fermentation and Bioengineering. 86 (1): 1-14.
Yahashi, Y.; Horitsu, H.; Kawai, K.; Suzuci, T. ; Takamizawa, K. 1996. Production of Xylitol from D-Xylosa by Candida tropicalis: the effect of D-Glucose feeding. Journal of Fermentation and Bioengineering. 81 (2): 148-153.
|
||
|
|
|||
|
36
|
|||
|
|
|||
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2004 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















