Jugo de caña verde como sustrato en la producción fermentativa por lotes de ácido láctico
Batch fermentative production of lactic acid from green- sugarcane juices
Palabras clave:
ácido láctico, caña de azúcar verde, jugo de caña, Lactococcus lactis subs. lactis, Lactic acid, green sugar cane (es)|
|
||
|
_____________________REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No. 2 Diciembre 2004 37-42
Jugo de caña verde como sustrato en la producción fermentativa por lotes de ácido láctico
Batch fermentative production of lactic acid from green- sugarcane juices
Liliana Serna Cock*, Aída Rodríguez de Stouvenel**
RESUMEN
El jugo de caña de azúcar variedad CC85-92 cosechada sin quema (caña verde) fue probado como sustrato en la producción de ácido láctico; las fermentaciones fueron realizadas con una cepa homofermentativa aislada de cultivos de caña de la misma variedad. Se evaluó el efecto del pretratamiento del jugo por centrifugación, y se estudió el efecto de la concentración de nitrógeno sobre la concentración máxima de ácido láctico, la conversión de sustrato y el rendimiento en ácido láctico. En fermentaciones con jugo de caña verde llevadas a cabo a 32 °C con la adición de 5% de extracto de levadura como fuente de nitrógeno, se obtuvieron concentraciones de ácido láctico (AL) hasta de 40,78 g/L en 48 horas de fermentación, rendimientos en producto, Yp/s, de hasta 0,58 g/g y 33% de conversión de sustrato (CS). La centrifugación no afectó la producción de ácido láctico.
Palabras clave: ácido láctico, caña de azúcar verde, jugo de caña, Lactococcus lactis subs. lactis.
ABSTRACT
Juice from the CC85-92 variety of green (unburned) sugar cane was tested as a suitable substrate in lactic-acid production. Fermentations were carried out with a homo-fermentative strain isolated from crops of the same variety of cane. Both the centrifugation pre-treatment and concentrated-nitrogen effects on substrate conversion, lactic-acid concentration and yield were evaluated. After a fermentation time of 48 h at 32° C with 5% of yeast extract as nitrogen source, 40,78 g/L of lactic-acid concentration, 0.58 g/g of product yield and 33% of substrate conversion were obtained. Centrifugation did not affect lactic acid production.
Key words: Lactic acid, green sugar cane, Lactococcus lactis subs. lactis.
|
||
|
|
||
|
INTRODUCCIÓN azúcar antes y después de la cosecha se convirtió en una práctica de aceptación mundial
En Colombia y en el mundo, la producción de después de la segunda guerra; sin embargo,
azúcar ha alcanzado niveles récord generando durante las últimas décadas, el desarrollo de
excedentes hasta de 74.084.000 toneladas mé- tecnologías limpias ha conducido a eliminar
tricas de azúcar (International Sugar Organiza- gradualmente la quema para volver a cose-
tion, 2004). De otro lado, la quema de la caña de char la caña verde. En Colombia, la regla-
|
||
|
|
||
|
* Bacterióloga, estudiante doctorado en ingeniería. Departamento de Ingeniería de Alimentos, Facultad de Ingeniería, Universidad del Valle, Cali, Colombia. Correo electrónico: lilicock@univalle.edu.co
** Ingeniera química, doctora en ciencias. Departamento de Ingeniería de Alimentos, Facultad de Ingeniería, Universidad del Valle, Cali, Colombia. Correo electrónico: aidrodri@univalle.edu.co
Recibido: octubre 12 de 2004. Aceptado: octubre 29 de 2004
|
||
|
|
||
|
37
|
||
|
|
||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 37-42
|
|||
|
|
|||
|
mentación ambiental vigente prohíbe la quema de la caña de azúcar a partir del año 2006 (Ministerio del Medio Ambiente, Legislación Ambiental Colombiana, resolución 619 de 1997) lo que entre otras aumentará el contenido de sustancias nitrogenadas en los jugos. El bajo precio internacional del azúcar provocado por las grandes cantidades de existencia del producto, y el aumento del contenido de sustancias nitrogenadas en los jugos, ha motivado la búsqueda de nuevas alternativas de uso a la caña de azúcar que representen alto valor agregado a esta materia prima, de las cuales una viable es la producción de ácido láctico.
El ácido láctico, ácido 2-hidroxipropanoico es el hidroxiácido más sencillo, del cual existen dos isómeros ópticamente activos: el D(-) y L(+) láctico, y una modificación racémica constituida por fracciones equimolares de las formas L(+) y D(-). Es utilizado ampliamente en las industrias alimenticia, química, farmacéutica, textil, del plástico, la agricultura entre otros (Suriderp, 1995), sin embargo, la aplicación más interesante del ácido láctico radica en la posibilidad que ofrece de producir ácido polilactico (PLA) (Hujanen et al., 1996; Chang et al., 1999; Hu-janen et al., 2001; Danneret al., 2002), un biopolíme-ro termoplástico empleado ampliamente en la medicina, en la producción de empaques para alimentos y en la producción de películas para la protección de cultivos en estadios primarios (Vick Roy, 1985; Lit-chfield,1996). La producción de ácido láctico se estima en 50.000 toneladas anuales (Datta y Tsai, 1997) siendo la demanda, para todas las aplicaciones, mayor que la producción (Vishnu et al., 2000; Chen y Lee, 1997; Lipinsky y Sinclair, 1986) con precios comerciales que oscilan entre US$1,40/kg para ácidos con 50% de pureza y US$1,90/kg para 88% de pureza (Chem. Mark Rep, 1999; citado por Akerberg y Zacchi, 2000), precios que resultan altos para aplicaciones a gran escala.
Este ácido láctico puede ser obtenido por vía química o biotecnológica; la producción biotecnoló-gica es indispensable para producir D(-) o L(+) láctico puro. Los microorganismos que llevan a cabo la fermentación pertenecen a los géneros Lactobaci-llus, Carnobacterium, Leuconostoc, Pediococcus, Streptococcus, Tetragenococcus, Lactococcus, Va-gococcus, Enterococcus y Aerococcus (Salminen, 1993); pero además es posible usar cepas de hongos como Rhizopus que producen ácido L(+) láctico (Domínguez y Vásquez, 1999).
|
Industrialmente se utilizan como sustratos, sacarosa pura proveniente de azúcar de caña y remolacha azucarera, lactosa proveniente de lactosuero, y dextrosa procedente de almidón hidrolizado. La sacarosa refinada y glucosa son los más utilizados. Otros posibles sustratos son materiales celulósicos y licores sulfíticos, aunque éstos precisan de pretrata-miento. También es posible usar melazas, aunque plantean problemas en las etapas de recuperación (Menéndez, 1999). Sin embargo, Monteagudo y Aldavero (1999), utilizaron con éxito melazas de remolacha para la producción de ácido láctico. Además, los sustratos amiláceos disponibles en la forma de desechos agrícolas, granos dañados y porciones comestibles de granos y tubérculos sirven como materia prima para la producción del ácido (Fausto y Díaz; 1997; Vick Roy, 1985; Datta et al., 1993).
Otros sustratos reportados en la literatura reciente son: fibras de alfalfa (Sreenath et al., 2001), permea-do de lactosuero (Amrane, 2000; Schepers et al., 2002), almidón de yuca (Xiaodong et al., 1997), paja de trigo y residuos de papa adicionados de residuos generados en el proceso de producción de concentrados para alimentación animal (Garde et al., 2000).
El presente trabajo se realizó a escala de laboratorio para evaluar las condiciones de obtención de ácido láctico por fermentación en lotes a partir de jugos de caña de azúcar cosechada sin quema.
MATERIALES Y MÉTODOS
Obtención de la cepa. La cepa utilizada para las fermentaciones fue obtenida en el ingenio y en la hacienda La Cabaña (Caloto, Cauca) de cultivos de caña de azúcar de 12,3 meses de edad, provenientes de la variedad CC85-92. Se tomaron muestras en el sitio de unión de hojas con el tallo (HUT), en la superficie de las hojas (HS), en exudados producidos por el perforador de caña Diatraea saccharalis (EX) y en el primero, segundo y tercer tercio del tallo de la caña (CPT, CST, CTT). En el ingenio las muestras provenían de molinos y de jugos de cana sin sulfitar y sin encalar (JCSSSE), y de jugos de caña sulfitados y en-clados (JCSyE). Las muestras fueron transportadas bajo refrigeración al laboratorio de bioconversiones de la Universidad del Valle. A cada una de las muestras se les realizó dilución suficiente hasta obtener colonias aisladas, utilizando agua peptona al 0.1%; y cada una de ellas se sembró por duplicado en agar MRS (De Man et al., 1960). El agar MRS se preparó
|
||
|
|
|||
|
38
|
|||
|
|
|||
|
|
||||
|
JUGO DE CAÑA VERDE EN LA PRODUCCIÓN DE ÁCIDO LÁCTICO
|
||||
|
|
||||
|
previamente, según indicaciones comerciales; cuando éste estaba a una temperatura de 50 °C, se adicionó 2ml/L de azul de anilina. El medio se inoculó con 0,1 mL/L de cada una de las diluciones (en superficie) y fueron incubadas a 36 y 45 °C por 48 horas en condiciones aeróbicas. Después de realizar los conteos de colonias productoras presuntivas de ácidos orgánicos (que asimilaron el azul de anilina), se obtuvieron cultivos puros de cada una de las morfologías crecidas, mediante repiques en el mismo medio. Una vez se obtuvieron los cultivos puros, se repicaron en un medio de cultivo líquido, caldo MRS y se incubaron a las mismas condiciones anotadas arriba. Los cultivos líquidos puros de 24 horas fueron centrifugados a 5000 rpm por 10 minutos y luego fueron filtrados con filtros millipore HVLPO2500; el sobrenadante de las muestras centrifugadas fue inyectado en el HPLC. Las cepas productoras de más de 12 g/L de ácido láctico, en las condiciones descritas, se almacenaron en caldo MRS con glycerol y fueron sometidas a congelación para su conservación.
Selección de la cepa. Para llevar a cabo las fermentaciones lácticas se seleccionó la cepa homofermen-tativa más productora de ácido láctico. Esta cepa fue identificada bioquímicamente mediante la técnica API 50 CHL, en el laboratorio de microbiología de alimentos de la Pontificia Universidad Javeriana.
|
fermentaciones se llevaron a cabo con agitación a 120 g; el tamaño del inóculo para todos los casos fue del 10% con respecto al volumen de sustrato, y el tiempo de fermentación fue 48 horas.
Método analítico. Las concentraciones de azúcares y de ácido láctico se midieron por cromatografía líquida de alta eficiencia HPLC (Hitachi L-6000A, inte-grador D-2500) equipada con una columna Animex HPX 87H, 300 mm, utilizando como fase móvil ácido sulfúrico 0,005 M. La biomasa se calculó a partir de datos de densidad óptica a 540 nm. Para ello se realizaron una serie de diluciones a cada una de las muestras para establecer una correlación lineal entre la densidad óptica y la biomasa. Esta correlación se utilizó para convertir todos los valores de densidad óptica a concentración de biomasa. La densidad óptica se midió en un espectrofotómetro Milton Roy 401.
La concentración de hidrogeniones se midió con un pHmeter Orion 710A previamente calibrado.
El porcentaje de conversión de sustrato (CS) y el rendimiento en producto Yp/s, fueron calculados mediante las siguientes expresiones:
|
|||
|
CS =
|
100*(SS)
|
|||
|
S
|
||||
|
|
||||
|
Fermentaciones. La cepa seleccionada presentó para su crecimiento una temperatura y un pH óptimo de 32 °C y 6,0 respectivamente (resultados que no se muestran en este artículo), por lo cual las fermentaciones se llevaron a cabo en estas condiciones en erlemeyer de 500 mL con un volumen de trabajo de 250 mL. La cepa se adaptó a estas condiciones por tres generaciones.
Se utilizó como sustrato jugo de caña de azúcar de primera extracción, proveniente de la variedad CC-8592 cosechada sin quema (verde). El jugo de caña se utilizó con centrifugación y sin centrifugación. El jugo centrifugado se sometió a 5000 g por 10 minutos y se filtró con papel de filtro cualitativo de 125 mm.
El jugo de caña se fermentó con diferentes concentraciones de nitrógeno: jugo de caña verde sin modificar su concentración original de nitrógeno y jugo de caña verde adicionado de 3 y 5 % p/v de extracto de levadura. Para facilitar las transferencias de masa y mantener la homogeneidad en la concentración de sustrato y de microorganismos, todas las
|
P
|
|||
|
% S=SS
La velocidad de consumo de sustrato, rs, y la velocidad de formación de producto, rp, fueron calculados derivando las ecuaciones que ajustan los datos cinéticos obtenidos.
Reactivos. Todos los análisis se realizaron con reactivos grado reactivo.
ANÁLISIS EXPERIMENTAL
Para analizar el efecto de la concentración de nitrógeno (N) sobre la concentración de ácido láctico (AL), el porcentaje de conversión de sustrato y el rendimiento, se utilizó una Anova de un solo factor con tres niveles o categorías: sin adición de extracto de levadura (JCV-0N), adición de 3% p/v de extracto de levadura (JCV-3N) y adición de 5% p/v de extracto de levadura (JCV-5N). Los pares de medias de las variables que mostraron diferencias significativas se analizaron
|
||||
|
|
||||
|
39
|
||||
|
|
||||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 37-42
|
|||
|
|
|||
|
mediante la prueba de diferencia significativa honesta de Tukey (DSH). De igual manera, estas herramientas estadísticas se utilizaron para evaluar la variación en la concentración de ácido láctico cuando el jugo de caña verde era pretratado por centrifugación o no.
RESULTADOS
Selección de la cepa. Se confirmaron 20 cepas aisladas de HUT, HS, EX, CPT, CST, CTT, JCSyE, JCSSSE para producción de ácido láctico, de las cuales solamente una, con metabolismo homofermentati-vo, produjo cantidades significativas de ácido láctico (12,4 g/L) a 36 °C; esta cepa se utilizó para las fermentaciones en JCV y fue identificada bioquímicamente como Lactococcus lactis subespecie lactis.
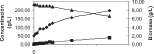
Efecto de la concentración de extracto de levadura. Las cinéticas de producción de biomasa, consumo de sustrato y formación de producto de JCV-0N, JCV-3N y JCV-5N pueden observarse en las figuras 1, 2 y 3, respectivamente, y los parámetros cinéticos, calculados a partir de los datos obtenidos, pueden verse en la tabla 1.
El consumo de sustrato, la concentración de ácido láctico y el rendimiento presentaron un F calculado de 4,64; 816,63 y 304,66 respectivamente; y los F teóricos para los mismos parámetros cinéticos 5,14; 5,14 y 5,1; con estos valores de F, obtenidos en el análisis de la varianza, podemos decir que no hay diferencias significativas entre la conversión de sustrato de los diferentes tratamientos; no obstante, las diferencias entre los tratamientos son significativamente marcadas para las variables de respuesta concentración de ácido láctico y rendimiento en producto. La prueba DSH mostró diferencias significativas para las variables concentración de ácido láctico y rendimiento, entre los tratamientos JCV-0N y JCV-3N y JCV-0N y JCV-5N; sin embargo, no mostró diferencias significativas entre los pares de medias de JCV-3N y JCV5N, con lo que se concluye que es suficiente la adición de extracto de levadura en un 3% p/v a fin de satisfacer las necesidades de nitrógeno para el crecimiento y mantenimiento de la cepa Lactobacillus lactis subs. lactis.
Efecto de la centrifugación. El valor de F calculado para la concentración de ácido láctico fue menor al F teórico, con lo cual podemos concluir que no hay diferencia significativa en la concentración de ácido
|
láctico cuando el JCV es pretratado con centrifugación o no.
DISCUSIÓN
Las concentraciones en ácido láctico reportadas en esta investigación, hasta de 40,78 g/L en 48 horas de fermentación, son comparables con los resultados reportados por Roukas y Kotzekidou (1991), quienes utilizando una mezcla de Lactococcus lactis y Lactobacillus casei inmovilizados en alginato de calcio, en 48 horas de fermentación, obtuvieron concentraciones máximas de ácido láctico de 41,3 g/L empleando como sustrato lactosuero desproteiniza-do. Estos mismos investigadores, utilizando el mismo sustrato y las mismas mezclas de microorganismos, lograron obtener con células libres y con células inmovilizadas, hasta 46 g/L en fermentaciones fed-batch, con concentraciones de sustrato de 100g/L y velocidad de alimentación de 250 mL/h (Roukas y Kotzekidou, 1998). Los resultados pueden ser igualmente comparables con los obtenidos por Akerberg, (1998) quien utilizando como sustrato harina integral hidrolizada adicionada de glucosa pura reporta concentraciones de ácido láctico de 50 g/L con el microorganismo en mención, y difieren enormemente de los resultados reportados por Boonme et al. (2003), quienes evaluaron la producción de ácido láctico en un medio comercial M17 modificado con lactosa pura y obtuvieron concentraciones de 80 g/L de ácido láctico y rendimientos de producto de 0,93 g/g.
La cepa de Lactococcus lactis subs. lactis aislada de las hojas de cultivos de caña variedad CC-8592 presentó muy buen potencial para la producción de ácido láctico, la adaptación de este microorganismo a ecosistemas ricos en sacarosa explica el buen comportamiento de esta cepa en la producción de ácido láctico a partir de jugos de caña. Este microorganismo aislado de productos lácteos, ha sido estudiado ampliamente como cultivo iniciador en la obtención de productos cárnicos y lácteos fermentados, sin embargo, los Lactococcus aislados de material vegetal han tenido menos consideración (Niel y Hagerdal, 1999) y no existen en la literatura reportes de investigaciones donde se cuantifique el potencial de producción en ácido láctico de las bacterias aisladas de los ingenios azucareros, aunque es bien conocido que son ellas las principales involucradas en la inversión de la sacarosa (Samaraweera et al., 1995); por lo anterior, los resultados que aquí se presentan sugieren que es trascendente evaluar el potencial genético y comercial de este
|
||
|
|
|||
|
40
|
|||
|
|
|||
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
JUGO DE CAÑA VERDE EN LA PRODUCCIÓN DE ÁCIDO LÁCTICO
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||
 |
indica que este sustrato puede emplearse como materia prima barata en la producción fermentativa de ácido láctico, pero se requiere de investigación que permita conocer el comportamiento de este sustrato en fermentaciones en continuo y su posterior separación mediante tecnologías de membranas. La adición de extracto de levadura en un 3 y un 5% p/v al jugo de caña provee un contenido de nitrógeno total de 0,21 y 0,32% respectivamente; el hecho de que esta diferencia en adición de nitrógeno no hubiera mostrado en el análisis estadístico diferencias significativas, sugiere que es suficiente la adición de una mínima cantidad de sustancias nitrogenadas para una buena producción en ácido láctico, pero en investigaciones futuras se podrían estudiar fuentes más baratas de nitrógeno para ser adicionadas al JCV, y de igual forma el comportamiento en jugos de caña verde de otras bacterias ácido lácticas comercialmente disponibles.
BIBLIOGRAFÍA
Akerberg, C.; Hofvendahl, K.; Zacchi, G.; Hahn-Hagerdal, B. 1998 Modelling the influenceof pH, temperature, gluco-se and lactic acid concentration on the kinetics of lactic acid production by Lactococcus lactis ssp. Lactis ATCC 19435 in whole wheat flour. Appl Microbiol Biotechnol. 49: 682-690.
Akerberg, C.; Zacchi, G. 2000. An economic evaluation of the fermentative production of lactic acid from wheat flour. Bioresource Technology. 75: 119-126.
Amrane, A. 2000. Effect of inorganic phosphate on lactate production by Lactobacillus helveticus grown on supple-mented whey permeate. J. ofChem Techonol and Biotechnol. 75(3):223-228.
Boonmee, M.; Leksawasdi, N.; Bridge, W.; Rogers, P. 2003. Batch and continuous culture of Lactococcus lactis NZ133: experimental data and model development. Biochemical Engineering Journal. 14: 127-135.
Chang, D.; Jung, H.; Rhee, J.; Pan, J. 1999. "Homofermentati-ve production of D- or L-lactate in metabolically
|
|||||||||||||||||||||||||||||||||||||||||||||
|
JCV180-3N
|
||||||||||||||||||||||||||||||||||||||||||||||
 250,00
60
|
- Ác. Láctico Azúcar total
- Biomasa (g/L)
|
|||||||||||||||||||||||||||||||||||||||||||||
|
20 40
Tiempo (horas)
|
||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||
|
Figuras 1, 2 y 3. Cinéticas de producción de ácido láctico, formación de biomasa y consumo de sustrato para JCV-0N, JCV-3N y JCV-5N respectivamente (promedio de tres ensayos).
|
||||||||||||||||||||||||||||||||||||||||||||||
|
microorganismo así como el de otras bacterias ácido lácticas adaptadas a sustratos ricos en sacarosa y a otros sustratos diferentes a lactosa.
De otro lado, si bien la producción comercial de ácido láctico se ha llevado a cabo a partir de sustratos puros como glucosa, sacarosa y lactosa, la tendencia actual es utilizar residuos o
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
materias primas más baratas y emplear tecnologías de separación de metabolitos que pueden no requerir filtración ni centrifugación previa como es el caso de la elec-trodiálisis (Nomura et al., 1989 y 1991; Ishizaki, 1990; Yao y Toda, 1990 Vonkta-veesuket al., 1994); el hecho de que el JCV pueda ser fermentado sin centrifugación
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
41
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 37-42
|
|||
|
|
|||
|
engineered Escherichia coli RR1". Appl and Environ Mi-crobiol. 65(4):1384-1389.
Chen, R.; Lee, Y. 1997. Membrane-mediated extractive fer-mentation for lactic acid production from cellulosic bio-mass. Appl Biocheml and Biotechnoly. 63-65: 435-448
Danner, H.; Madzingaidzo, L.; Thomasser, C. et al. 2002. Thermophilic production of lactic acid using integrated membrane bioreactor systems coupled with monopolar electrodialysis. App Microbio and Biotechnol. Sprin-ger-Verlag 10.1007/s00253-002-0998-4.
Datta, R.; Tsai, S.; Patrick, B.; Moon, S.; Frank, J. 1993. Tech-nological and economic potential of poly lactic acid and lactic acid derivatives. International Congress on Chemi-calsfrom Biotechnology. Hannover, Germany. p. 1-18.
Datta y Tsai, S. 1997. Lactic acid production and potencial uses: a technology and economics assessment. ACS Symp. Ser. 666 (Fuels and chemicals from Biomass). p. 224-236.
De Man, J. C.; Sharpe, M. E. 1960. A medium for the cultiva-tion of Lactobacilli. J Appl Microbiol. 23: 130-135.
Domínguez, J.; Vásquez, M. 1999. Effectof the operational con-ditions on the L-Lactic acid production by Rhizopus ory-zae. Ciencia y Tecnología de alimentos. 2(3):p.113-118.
Fausto, F.; Díaz, D. 1997. Starch and starch derivatives in India. Starch/Starke. 49 (9):338-340.
Garde, A.; Schmidt, A. ; Jonson, G. et al. 2000. Agricultural crops and residuals as a basis for polylactate production in Denmark. Proceeding of the food Biopack Conferen-ce, Copebhagen, 27-29: 45-51
Hujanen, M.; Linko,Y. 1996. Effectof temperatureand various nitrogen sources on L(+) lactic acid production by Lacto-bacillus casei. Applied Microbiology Biotechnology. 45:307-313.
Hujanen, M.; Linko, S.; Linko, Y. et al. 2001. Optimisation of media and cultivation conditions for L(+)(S)-lactic acid production by Lactobacillus casei NRRL B-441. Applied Microbiology and Biotechnology. Springer-Verlag; DOI 10.1007/s002530000501.
International Sugar Organization. 2004. Informe de mercado y resumen de prensa, 1 Canada Square, Canary Wharf, London E14 5AA, UK. Junio.
Ishizaki, A.; Nomura, Y.; Iwahara, M. 1990. Built-in electrodialysis batch culture, a new approach to release of end product inhibition. J. Ferment. Bioeng. 70, 108-113.
Lipinsky, E. Sinclair, R. 1986. Is lactic acid a commodity che-mical? Cheml. Eng. Prog. 82: 26-32.
Litchfield, J. 1996. Microbial production of lactic acid. Appl Microbiol. 42: 45-95.
Menéndez, I. 1999. El ácido láctico ejemplo del aprovechamiento químico de residuos. En http:\\teleline.tgerra.es/ personal/forma_xxi/cono7.htm Ministerio del Medio Ambiente. 1997. Legislación ambiental colombiana. Resolución 619 del 7 de julio de 1997.
Monteagudo, J.; Aldavero, M. 1999. Production of L-lactic acid by Lactobacillus delbrueckii in chemostat culture using
|
an ion exchange resins system. J. of Chem Techonol and Biotechno. 74(7):627-634.
Niel, E. W.; Hahn-Hagerdal, B. 1999. Nutrient requirements of lactoccocci in defined growth media. Appl Microbiol Biotechnol. 52: 617-627.
Nomura, Y., Iwahara, M.; Hongo, M. 1989. Continuous production of acetic acid by electrodialysis bioprocess with a computerized control of fed batch culture. J. Biotechnol. 12:317-326.
Nomura, Y.; Yamamoto, K.; Ishizaki, A. 1991. Factors affec-ting lactic acid production rate in the built-in electrodialysis fermentation, an approach to high speed batch culture. J. Ferment. Bioeng. 71: 450-452.
Roukas, T.; Kotzekidou, P. 1991. Production of lactic acid from deproteinized whey by coimmobilized Lactobacillus casei and Lactococcus lactis cell. Enzyme and Microbial Technol, 13, Issue 1, January:33-38.
Roukas, T.; Kotzekidou, P. 1998. Lactic acid production from deproteinized whey by mixed cultures of free and coimmobilized Lactobacillus casei and Lactococcus lactis cells using fedbatch culture. Enzyme and Microbial Techno. 22(3):199-204.
Salminen, S. 1993. Lactic acid bacteria. New York: Marcel Dekker. 442 p.
Samaraweera, I.; Samaraweera, U.; Rheault, D.; Mont, R. 1995. Is L lactic acid a true indicator of microbial infec-tion? International sugar J.. Latin American Edition. 97(1162):566-570.
Schepers, A.; Thibault, J.; Lacroix, C. 2002. Lactobacillus hel-veticus growth and lactic acid production during pH-controlled batch cultures in whey permeate/yeast extract medium. Part I. Multiple factor Kinetic analysis. Enzime and Microbial Technol. 30(2): 176-186.
Sreenath, H.; Moldes, A.; Koegel, R. et al. 2001. Lactic acid production by simultaneous saccharification and fermentation of alfalfa fiber. J. Bioscience Bioeng. 92 (6):518-523. .
Suriderp, C. 1995. Ullman's Encyclopedia of industrial chemistry: ácido láctico. 5 edition. De Barbara Elvers, pp. 97-104.
Vick Roy, T. 1985. Lactic acid. Comprehensive Biotechnology. 3:761-789.
Vishnu, C.; Seenayya, G.; Reddy, G. 2000. Direct conversion of starch to L(+) lactic acid by amylase producing Lactobacillus amylophilus GV6. Bioprocess Engineering. 23:155-158.
Vonktaveesuk, M.; Tonoka, W.; Ishizaki, A. 1994. Stimulation of the rate of L-lactate fermentation using Lactococcus lactis IO-1 by periodic electrodialysis. J. Fermentation Bioengineering. 77(5):508-512.
Xiaodong, W.;Xuan, G.; Rakshit, S. 1997. Direct fermentative production of lactic acid on cassava and other starch substrates. Biotechnol. Lett. 19(9):841-843.
Yao, P.; Toda, K. 1990. Lactic acid production in electrodialysis culture. J. Gen. Appl. Microbiol. 36: 111-125.
|
||
|
|
|||
|
42
|
|||
|
|
|||
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2004 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















