Regeneración de brotes adventicios en hojas de guayaba (Psidium guajava L.) cultivadas in vitro
Adventitious shoot regeneration from in vitro cultured leaves of guava (Psidium guava L.)
Palabras clave:
cultivo de tejidos, explantes de hoja, reguladores de crecimiento, organogénesis, guayaba, Tissue culture, leaf explants, growth regulators, organogenesis, guava (es)|
|
||||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 54-61_________________
Regeneración de brotes adventicios en hojas de guayaba (Psidium guajava L.) cultivadas in vitro
Adventitious shoot regeneration from in vitro cultured leaves of guava (Psidium guava L.)
|
||||
|
|
||||
|
|
**
|
|
||
|
Óscar Concepción Laffitte*, Lelurlys Nápoles Borrero** , Aurora Pérez Martínez***, Ninel Peralta Ballbé****, Reinaldo Trujillo Sánchez***
RESUMEN
La regeneración de brotes adventicios es una etapa clave para la aplicación de las técnicas de ingeniería genética. El presente trabajo tuvo como objetivo el desarrollo de un procedimiento para la regeneración de brotes por organogénesis a partir de hojas de microesquejes o brotes de guayaba (Psidium guajava L.) cultivados in vitro. Para ello se estudiaron algunos de los principales factores que afectan la regeneración de brotes, tales como la concentración de reguladores del crecimiento (citoquinina), el estado fisiológico del explante y la herida. En todos los experimentos se utilizaron como explantes hojas de vitroplantas de guayaba de la variedad Enana Roja Cubana EEA18-40 de diferentes subcultivos. El mejor resultado se alcanzó con una concentración de 0,75 mg/L de 6-bencilaminopurina como suplemento hormonal del medio MS. Se comprobó que para las hojas provenientes de microesquejes con mayor número de subcultivo y tomadas de la parte inferior de los brotes, el potencial morfogenético disminuye significativamente (p<0,05). La frecuencia de regeneración de brotes más alta (>60%) y el mayor número de brotes por explante promedio (>3) se alcanzó al realizar varias heridas en forma de punteaduras en el nervio central de las hojas. Este protocolo de regeneración constituye una importante herramienta que puede ser empleada para futuros estudios de transformación genética en esta especie.
Palabras clave: cultivo de tejidos, explantes de hoja, reguladores de crecimiento, organogénesis, guayaba.
ABSTRACT
Adventitious regeneration is a key step in the application of genetic engineering to the breeding programs of plants. In this work a method for adventitious shoot regeneration from leaves of micropropagated guava shoots has been developed and some of main factors to affect the shoot regeneration like, concentration of plant growth regulators (citoquinine), physiological state of explants and the wound are studied. Leaves from guava in vitro cultured of variety Cuban Red Dwarf 18-40 was used like explant in all experiments. The best re-sult was reached with MS basal medium supplemented with 0.75 mg/L of 6-benzylaminopurine. Was de-monstrated that for the leaves with more multiplication subculture number and taken from lower part of shoot (older); the morfogenetic potential falls significantly (p<0.05). The highest shoot regeneration rate (>60%) and the largest number of shoot per regenerating leaf (>3) were obtained with several wounds ca-
|
||||
|
|
||||
|
* Ingeniero agrónomo.
** Magíster en biotecnología vegetal (ingeniero agrónomo).
*** Magíster en biotecnología vegetal (licenciada en biología).
**** Licenciada en bioquímica.
***** Doctor en ciencias biológicas (licenciado en biología).
Laboratorio de Cultivo de Células y Tejidos, Centro de Bioplantas, Universidad de Ciego de Ávila, carretera a Morón, km 9 Va, CP 69450, Ciego de Ávila, Cuba. Correo electrónico: oconcepcion@bioplantas.cu
Recibido: marzo 29 de 2004. Aceptado: octubre 22 de 2004.
|
||||
|
|
||||
|
54
|
||||
|
|
||||
|
|
|||
|
REGENERACIÓN DE BROTES ADVENTICIOS EN HOJAS DE GUAYABA (Psidium guajava L.)
|
|||
|
|
|||
|
rried out in f orm of jabs to the central nerve of leaves. This regeneration protocol constitutes an important tool that can be applied for future studies of genetic transformation in this species.
Key words: Tissue culture, leaf explants, growth regulators, organogenesis, guava.
|
|||
|
|
|||
|
INTRODUCCIÓN
La guayaba es considerada una de las más valiosas frutas tropicales, tanto por su valor alimenticio como por su importancia agroecológica. Posee un elevado contenido de vitamina C, que en ocasiones sobrepasa los 400 mg en 100 g de pulpa (Peña et al., 1996), además de abundantes fibras, vitamina A, pectina, fósforo, calcio y potasio (Yadava, 1994), aspectos que la convierten en un alimento natural muy apetecido. En Cuba su cultivo se ha intensificado con el auge de la industria de productos alimenticios y el turismo.
Muchos son los problemas que afectan este cultivo desde varios puntos de vista. Dentro de los frutales tropicales es uno de los más afectados por plagas y enfermedades. Se señalan más de 70 especies de insectos que inciden de forma perjudicial sobre la guayaba, entre los que se destacan el bicho de San Juan o mosca antillana de la fruta (Anastrepha mom-bipraeoptans Sein) y los nemátodos de los géneros Meloidogyne y Pratylenchus (Peña, 1996). Por otro lado, la maduración de los frutos ocurre de forma rápida, lo cual dificulta las actividades de poscosecha, de almacenamiento y traslado a las áreas urbanas, además de que limita la exportación como fruta fresca por parte de los países productores (McGuire y Hallman, 1995). La biotecnología puede jugar un papel fundamental en la solución de estos problemas a través de herramientas como la transformación genética. Sin embargo, para ello es necesario contar con un sistema de regeneración adventicia de plantas que permita la aplicación de las técnicas de ingeniería genética.
La selección de tejidos somáticos con capacidad regenerativa es imprescindible para los protocolos de transformación genética. En más de una ocasión se han utilizado las hojas como material vegetal con potencial morfogenético capaz de regenerar plantas en especies leñosas tanto por organogénesis (Pérez-Tornero et al., 2000; Liu y Bao, 2003) como por embriogénesis somática (Fernández-Guijarro et al., 1995; Toribio et al., 2004). En guayaba los intentos por llevar a cabo la formación de callos y/o regeneración de brotes a partir de segmentos de hojas de campo han fallado, fundamentalmente a causa de la
|
alta fenolización y poca viabilidad de los explantes (Ramírez y Salazar, 1998).
En la guayaba (Amin y Jaiswal, 1988; Papada-tou et al., 1990; Mohamed-Yassen et al., 1995; Pérez et al., 2002), al igual que en muchas otras Myrta-ceae (Toussaint et al., 1992; List et al., 1996; Sha Valli Khan et al., 1999; Oltramari et al., 2000), se ha llevado a cabo la propagación con el empleo de las técnicas del cultivo in vitro, y se ha demostrado que posee resultados ventajosos con respecto a los métodos convencionales. Trabajos recientes (Nápoles et al., 2003) han permitido cultivar y propagar in vitro brotes de guayaba obtenidos a partir de yemas de rebrotes de la raíz de árboles adultos.
Loh y Rao (1989), señalaron por primera vez la organogénesis a partir de hojas de brotes de guayaba que se multiplicaban in vitro como parte de la observación de experimentos de micropropagación y consideraron que se trataba de un evento poco reproduci-ble. Sin embargo, no realizaron estudios posteriores de optimización que permitieran la utilización de este proceso morfogénico como una herramienta para los especialistas en transformación genética. Por otro lado, la formación de brotes fue observada únicamente a partir del material proveniente de semillas y no a partir de material proveniente de tejidos maduros.
Por último, se debe destacar que para el caso de la guayaba no se conoce de la existencia de un procedimiento de regeneración adventicia de brotes que permita ser utilizado como herramienta para la transformación genética de esta especie.
Por todo lo anterior, este trabajo tiene como objetivo lograr un procedimiento para la regeneración de brotes a partir de hojas provenientes de brotes de guayaba (Psidium guajava L.) cultivados in vitro. Todo ello por medio del estudio de algunos de los factores que intervienen en dicho proceso.
MATERIALES Y MÉTODOS
Procedimientos generales para el establecimiento del cultivo in vitro. Se colectaron yemas de
|
||
|
|
|||
|
55
|
|||
|
|
|||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 54-61
|
|||
|
|
|||
|
rebrotes de la raíz de plantas de guayaba de la variedad Enana Roja Cubana EEA 18-40 cultivadas bajo condiciones de vivero, en una solución de PVPP (0,5%) y se sometieron a un proceso de desinfección con bicloruro de mercurio (0,05%) durante 20 minutos, luego se lavaron con abundante agua destilada estéril. La implantación y el establecimiento in vitro se realizaron de acuerdo con el procedimiento descrito por Nápoles et al. (2003).
Posterior a la desinfección, y después de varios subcultivos de multiplicación, los brotes o microes-quejes de aproximadamente 2,0 cm de altura con dos pares de hojas abiertas se individualizaron y se colocaron en frascos de cultivo que contenían 25 mL de medio de enraizamiento MS (Murashige y Skoog, 1962) sin reguladores del crecimiento y se incubaron en cámara de luz artificial con intensidad de 87,5 |jmol.m~2.s~1 y fotoperiodo de 16 horas luz a una temperatura de 26±1 °C. Al cabo de 45 días se tomaron las hojas de los microesquejes enraizados cortando por el pecíolo, las cuales se utilizaron como explantes para realizar los diferentes experimentos de regeneración de brotes.
Efecto de diferentes concentraciones de la 6-ben-cilaminopurina (BAP). Las hojas intactas separadas por el pecíolo se colocaron con polaridad axial en recipientes de cultivo que contenían 25 mL de medio de cultivo MS suplementado con ácido indol-3-acético (AIA) a 0,1 mg/L y diferentes concentraciones de BAP (0,25; 0,50; 0,75; 1,00; 1,50 y 2,00 mg/L). Se estableció un control sin citoquinina. Las condiciones de incubación fueron similares a las descritas con anterioridad para el enraizamiento de los microesquejes. A los 45 días se realizó la observación y evaluación de los resultados. Se evaluó el porcentaje de explantes muertos, de formación de protuberancias, así como de formación de raíces y/o brotes.
Efecto del estado fisiológico del explante en la formación de brotes. Microesquejes de diferentes edades o generaciones (diferentes números de subcultivos de multiplicación luego del establecimiento in vitro): I- generación con 1 subcultivo; II- generación con 2 subcultivos; III-generación con 5 subcultivos; IV-generación con 6 subcultivos se transfirieron al medio de enraizamiento descrito anteriormente. Al cabo de 45 días se utilizaron los pares de hojas de acuerdo con el orden en que éstos se encuentran en el tallo. Se enumeraron de arriba hacia abajo a partir del ápice hasta el cuarto par de hojas expandidas y sin contacto directo
|
con el medio. Estas hojas se separaron del brote por el pecíolo y se colocaron, manteniendo la clasificación anterior y con polaridad axial, en cultivos que contenían 25 mL de medio de cultivo de regeneración de brotes de acuerdo con el mejor resultado del experimento anterior. Los cultivos se incubaron en iguales condiciones de luz, fotoperiodo y temperatura. Al cabo de 45 días se realizó la evaluación del porcentaje de explantes muertos, de formación de protuberancias (pequeños nódulos meristemáticos) y de formación de brotes. También se determinó el número de brotes emitidos por explante.
Efecto de la herida en la formación de brotes. Se
tomaron hojas de microesquejes de guayaba cultivados in vitro de acuerdo a los mejores resultados de los experimentos anteriores y se procedió a cortarlas de la siguiente forma: Hojas intactas (solamente cortadas por el pecíolo). Hojas cortadas por el pecíolo y seccionadas transversalmente a % del área del limbo. Hojas cortadas por el pecíolo y con 5 punteadu-ras en la nervadura central.
Todos estos explantes se colocaron con polaridad axial en un medio de cultivo de regeneración de brotes y en condiciones de incubación similares al primer experimento. A los 45 días se realizó una evaluación del porcentaje de explantes muertos, de formación de protuberancias, de formación de brotes, así como del número de brotes por explante.
Análisis estadístico de los datos. Todos los experimentos se montaron colocando cinco explantes por frasco y siete frascos por tratamiento. Para las evaluaciones porcentuales se tomó el 100% como el número inicial de explantes puestos en cultivo y los datos se transformaron mediante de la ecuación x'= 2*arcosin(sqrt(x/100)) con el objetivo de lograr distribución normal y homogeneidad de varianza. Con el mismo objetivo se utilizó para los datos de variables discretas la ecuación x'= sqr(x+0.5). A los datos transformados se les realizó un análisis de varianza Anova y la prueba Tukey para un valor de p<0,05. Se utilizó el paquete estadístico SPSS 8,0 para Windows.
RESULTADOS Y DISCUSIÓN
Efecto de diferentes concentraciones de BAP. En
la tabla 1 se muestra el efecto de la concentración de BAP en la respuesta morfogenética de las hojas de guayaba al cabo de 45 días de iniciado el cultivo.
|
||
|
|
|||
|
56
|
|||
|
|
|||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
REGENERACIÓN DE BROTES ADVENTICIOS EN HOJAS DE GUAYABA (Psidium guajava L.)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La supervivencia de los explantes se ve afectada por la concentración de BAP utilizada en el medio de cultivo. El mayor porcentaje de explantes muertos se observó en la dosis de 2.0 mg/L, seguido por el tratamiento testigo. La muerte del explante se caracterizó en todos los casos por una decoloración paulatina del limbo de la hoja hasta tornarse completamente clorótico. Por último la hoja comienza a ennegrecerse y muere. En las concentraciones de 0,50; 0,75 y 1,00 mg/L no ocurrió la muerte de ninguno de los explantes.
|
Tabla 1. Efecto de la concentración de BAP a los 45 días de cultivo
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
El uso de citoquininas en la regeneración de plantas a partir de explantes foliares es una práctica frecuente en el cultivo de tejidos (Lain et al., 1994; Ramírez y Salazar, 1998; Dronne etal., 2003; Genti-le et al., 2003; Liu y Bao, 2003; Toribio et al., 2004).
Loh y Rao (1989) señalaron por primera vez la formación de estructuras nodulares a las que denominaron protuberancias, las cuales se formaban a partir de las hojas provenientes de brotes o microesquejes de guayaba cultivados in vitro. Ellos determinaron que estas protuberancias crecen hasta formar brotes cuando las hojas se separan y se cultivan en medio MS + BA (1 mg/L). También reportaron que luego del subcultivo estas estructuras se convertían en brotes, lo cual indicaba que tales protuberancias (centros me-ristemáticos) guardaban relación con el ápice y el sistema radical del brote. Sin embargo, la formación de estos brotes no fue optimizada ni observada en aquellos momentos como una herramienta para la transformación genética de esta especie.
Los resultados alcanzados permiten obtener valores óptimos del balance hormonal necesario en el medio de cultivo para la formación de brotes mediante organogénesis en hojas provenientes de brotes de guayaba cultivados in vitro, pero otros aspectos relacionados con el estado fisiológico del explante deben ser estudiados.
Efecto del estado fisiológico del explante en la formación de brotes. En la tabla 2 se pueden observar los resultados del efecto de dos factores que describen de alguna manera el estado fisiológico de una hoja in vitro. La edad que tiene el órgano de acuerdo con el tiempo que lleva bajo condiciones in vitro (asociada al número de subcultivos) y la edad
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La formación de protuberancias se observó fundamentalmente en la zona basal del nervio central de la hoja, o sea, en el extremo cortado del pecíolo. Con excepción de 2,0 mg/L, dosis a la cual la aparición de las estructuras se ve afectada en más de un 50%, en el resto de los tratamientos la formación de protuberancias fue del ciento por ciento. Estas protuberancias son precursoras de la formación de otras estructuras más organizadas y están asociadas a la nervadura central de la hoja. Una función primaria de la mitosis en la organogénesis es la formación de un número crítico de células en división activa, las cuales, luego son capaces, de responder a las señales del desarrollo (Villalobos y Thorpe, 1991). Estas zonas de división celular resultan de la capacidad misma de células activamente divisorias que existen en el tejido, que estimulan la división celular en las células adyacentes; éstas toman nutrientes y metabolitos a partir de las células periféricas, limitando la potencialidad divisoria de estas últimas (George, 1993).
La formación de raíces está inhibida por la presencia de la citoquinina a cualquier concentración de las empleadas; únicamente en ausencia de ésta, se observó el crecimiento de raíces surgidas a partir de las estructuras meristemáticas. Por el contrario, la formación de brotes se estimuló en presencia de la citoquinina. El mejor resultado se alcanzó con la dosis de 0,75 mg/L, el cual difiere de manera significativa del resto de los tratamientos. Con el incremento de la concentración de BAP superior a esta dosis, el porcentaje de formación de brotes disminuyó significativamente.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
57
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 54-61
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
que tiene el órgano de acuerdo con su aparición (asociada a la posición que ocupa en el brote).
Se observa que para las variables de porcentaje de explantes muertos y porcentaje de formación de protuberancias no existen diferencias estadísticas significativas entre los tratamientos. Sin embargo, al analizar el porcentaje de brotación y el número de brotes por explante se aprecia que existe una marcada diferencia entre los explantes de acuerdo con su estado fisiológico. Los mejores resultados se alcanzan con los explantes provenientes de la generación II (2 subcultivos de multiplicación) y segunda posición descendente en el tallo, seguido por los explantes de la generación I (1 subcultivo de multiplicación) y segundo par de hoja en orden descendente en el tallo. En sentido general se puede apreciar que los explantes (hojas expandidas sin contacto directo con el medio in vitro) deben ser obtenidos de brotes con pocos subcultivos de multiplicación y preferiblemente del segundo y primer par de hojas en el tallo, lo cual se traduce en órganos más jóvenes.
|
De acuerdo con estos resultados, el número de subcultivos que recibe el brote tiene una mayor incidencia en la regeneración que la posición de las hojas en el tallo, ya que para las generaciones III y IV no se observan diferencias significativas entre las hojas de diferentes posiciones en el tallo, en cuanto al porcentaje de brotación y al número de brotes por explante. Esto puede estar dado por el hecho de que se utilizaron hojas que no eran muy diferentes entre sí en cuanto a la posición y sí en cuanto a los subcultivos. Tal vez si se comparasen estos resultados con hojas de una posición más baja en el brote sí se reflejaría una mayor incidencia por parte de este factor.
En albaricoque (Prunus americana L.), los explantes jóvenes correspondientes a las primeras cuatro hojas apicales expandidas de brotes en proliferación in vitro producen los mejores resultados y superan en el doble el porcentaje de regeneración que las hojas viejas, correspondientes a las últimas cuatro hojas expandidas del tallo (Pérez-Tornero et al., 2000).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 2. Efecto del estado fisiológico del explante a los 45 días de cultivo
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(Medias con letras desiguales difieren significativamente según Anova y Tukey para p<0,05). NS: no significativo para p>0,05.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
58
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
REGENERACIÓN DE BROTES ADVENTICIOS EN HOJAS DE GUAYABA (Psidium guajava L.)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
En sentido general se concluye que para lograr una mayor formación de brotes es necesario utilizar hojas de brotes con pocos subcultivos de multiplicación y ubicadas en el primer y segundo nudo del tallo a partir del ápice. La observación de los explantes demostró que la región de la base de la hoja, por donde se cortó el pecíolo para separarla del tallo, era el lugar por donde surgían los brotes. Esto llevó a que se estudiara el efecto de la herida en la organogénesis.
Efecto de la herida en la formación de los brotes.
En la tabla 3 se observan los resultados obtenidos al evaluar diferentes formas de cortar la hoja de guayaba in vitro. El porcentaje de explantes muertos y el porcentaje de formación de protuberancias no mostraron diferencias significativas entre las hojas intactas y las hojas punteadas en la nervadura central. Sin embargo, para los explantes cortados transversal-mente sí se observó una marcada diferencia estadística en comparación con los anteriores tratamientos.
|
La capacidad morfogénica de algunos tejidos puede pasar desapercibida debido a la asociación de éstos con tejidos diferenciados que están dentro de un sistema organizado (George, 1993). Por ello, en la mayoría de las ocasiones las heridas permiten poner en contacto directo algunos tejidos internos con el medio de cultivo y facilitar la absorción de los reguladores del crecimiento. Por otro lado, el papel de la herida como factor de estrés que promueve el desarrollo morfogenético in vitro es muy conocido en la literatura. Fehéret al. (2003) aseguran que la herida por sí sola es una señal significativa de inducción de la diferenciación celular. Muchos de los genes expresados en protoplastos de hojas recién aislados, no sólo aquellos que están involucrados en la respuesta al estrés, son inducidos generalmente como respuesta a la herida (Pasternak et al., 2002).
En albaricoque, la respuesta morfogénica ocurre principalmente en los bordes cortados y en los nervios de las hojas, asociada siempre a los tejidos
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
El mayor porcentaje de formación de brotes y el mayor número de brotes por explante se alcanzó en las hojas punteadas en el nervio central, los cuales difieren de manera significativa del resto de los tratamientos. Para el caso de las hojas cortadas transver-salmente, todo parece indicar que las condiciones de estrés son muy grandes y el tejido no logra superarlas.
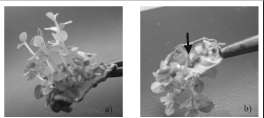
Los mejores resultados se obtienen con las hojas punteadas a lo largo del nervio central, lo cual demuestra que la herida juega un papel fundamental pues en la región de ésta surge la protuberancia y a partir de ella se forma el brote (figura 1a y b).
|
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Figura 1.a) Hoja de guayaba punteada en el nervio central, mostrando el crecimiento de los brotes a lo largo de éste, y b) la misma hoja pero en esta ocasión vista por el envés; se observa la formación de protuberancias o nódulos meristemáticos (flecha) en el lugar punteado del nervio central.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 3. Efecto del tipo de herida en porcentajes obtenidos a los 45 días de cultivo in vitro
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(Medias con letras desiguales difieren significativamente según Anova y Tukey para p<0,05).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
59
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 54-61
|
|||
|
|
|||
|
vasculares (Pérez-Tornero et al., 2000). Algo similar ocurre en la regeneración de brotes de Platanus acerifolia Willd, donde los brotes se originan principalmente a partir de callos formados alrededor de los extremos cortados del pecíolo y a lo largo de los cortes transversales de la nervadura central (Liu y Bao, 2003). Para la guayaba en este trabajo, la principal actividad meristemática ocurre en los tejidos que conforman el nervio central y estuvo siempre asociada a las zonas donde se produjo una herida. Con estos resultados se corrobora una vez más que la herida juega un papel fundamental en la respuesta morfogenética in vitro de las plantas superiores.
CONCLUSIONES
Se logró establecer un procedimiento para la regeneración de brotes adventicios en hojas de guayaba obtenidas a partir de brotes o microesquejes cultivados in vitro. Junto con ello se logró determinar que el BAP en concentración de 0,75 mg/L suplementado al medio de cultivo MS, permite alcanzar hasta un 48% de formación de brotes en las hojas intactas. También se determinó que al utilizar hojas más juveniles (de brotes con 1 o 2 subcultivos de multiplicación y ubicadas en el segundo nudo del tallo, contando a partir del ápice) se logra entre un 38 a un 46% de formación de brotes y de 2,2 a 2,4 brotes por explante. La herida provocada por punteaduras en la nervadura central de las hojas estimuló la formación de brotes hasta alcanzar más de un 60%, mientras que el número de brotes por explantes alcanzó un valor mayor de 3. Este procedimiento se puede utilizar como vía morfogenética para obtener plantas a partir de tejido somático para futuros estudios de transformación genética en esta especie.
BIBLIOGRAFÍA
Amin, M. N.; Jaiswal, V. S. 1988. Micropropagation as an aid to rapid cloning of a guava cultivar. Scientia Horticultu-rae, 36: 89-95.
Dronne, S.; Jullien, F.; Caissard, J. C.; Faure, O. 2003. A simple and efficient method for in vitro shoot regeneration from leaves of lavandin (Lavandula 22 intermedia Eme-ric ex Loiseleur). Plant Cell Reports, 18 (5): 429-433.
Fehér, A.; Pasternak, T. P.; D. Dudits. 2003. Transition of so-matic plant cell to an embryogenic state. Plant Cell, Tis-sue and Organ Culture. 74: 201-228.
Fernández-Guijarro, B.; Celestino, C.; Toribio, M. 1995. Influen-ce of external factors on secondary embryogenesis and germination in somatic embryos from leaves of Quercus suber. Plan Cell Tissue and Organ Culture. 41: 99-106.
|
Gentile, A.; Monticelli, S.; Damiano, C. 2003. Adventitious shoot regeneration in peach [Prunus persica (L.) Batsch]. Plan Cell Reports. 20 (11): 1011-1016.
George, E. F. 1993. Plant Propagation by Tissue Culture. Exe-getics Ltd. 524 p.
Lain, E.; David, A. 1994. Regeneration of plants from leaf ex-plants of micropropagated clonal Eucalyptus grandis. Plant Cell Reports. 13:473-476.
List, S. E.; Brown, P. H.; Low, C. S.; Walsh, K. B. 1996. A micropropagation protocol for Melaleuca alternifolia (tea tree). Aust. J. ofExp. Agriculture. 36: 755-60.
Liu, G.; Bao, M. 2003. Adventitious shoot regeneration from in vitro cultured leaves of London plane tree (Platanus acerifolia Willd). Plant Cell Reports. 20 (7): 640-644.
Loh, C. S.; Rao, A. N. 1989. Clonal propagation of guava (Psi-dium guajava L.) from seedlings and grafted plants and adventitious shoot formation in vitro. Scientia Horticultu-rae. 39:31-39.
McGuire, R. G.; Hallman, G. J. 1995. Coating Guavas with Ce-llulose- or Carnauba-based Emulsions Interferes with Postharvest Ripening. HortScience. 30(2): 294-295.
Mohamed-Yasseen, Y.; Barringer, S. A.; Schnell, R. J.; Splitt-stoesser, W. E. 1995. In vitro shoot proliferation of guava (Psidium guajava L.) from germinated seedlings. Plant Cell Reports. 14: 525-528.
Murashige, T.; Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant. 15: 473-497.
Nápoles, L.; Concepción, O.; Pérez, A.; Hernández, M.; Truji-llo, R. 2003. Efecto de tres agentes antioxidantes en el cultivo in vitro de la guayaba (Psidium guajava L.) y su relación con el origen del explante y el contenido de compuestos fenólicos. IV Taller Internacional de Biotecnología Vegetal. Libro de Reportes Cortos. Pp. 27-28.
Oltramari, A. C.; Dal Vesco, L. L.; Pedrotti, E. L.; Ducroquet, J. P. H. J.; Nodari, R. O.; Guerra, M. P. 2000. Protocolo de micropropagação da goiabeira serrana (Acca sellowia-na (Berg) Burret). Ciência Rural. 30(1):61-68.
Papadatou, P.; Pontikis, C. A.; Ephtimiadou, E.; Lydaki, M. 1990. Rapid multiplication of guava seedlings by in vitro shoot tip culture. Scientia Horticulturae. 45: 99-103.
Pasternak, T. P.; Prinsen, E.; Ayaydin, F.; Miskolczi, P.; Pot-ters, G.; Asard, H.; Van Onckelen, H.; Dudits, D.; Fehér, A. 2002. The role of auxin, pH and stress in the activa-tion of embryogenic cell division in leaf proto-plast-derived cells of alfalfa (Medicago sativa L.). Plant Physiol. 129: 1807-1819.
Peña, H. A.; Díaz, J. A.; Martínez, T. R. 1996. Fruticultura Tropical. ICFES. 2da parte. 208 p.
Pérez, A. T.; Nápoles, L.; Concepción, O.; Trujillo, R. 2002. Multiplicación in vitro de brotes de guayaba (Psidium guaja-va L.) var. Enana Roja Cubana EEA 18-40 obtenidos a partir de semilla. Cultivos Tropicales, 23 (3): 57-61.
Pérez-Tornero, O.; Egea, J.; Vanoostende, A.; Burgos, L. 2000. Assessment of factors affecting adventitious shoot regeneration from in vitro cultured leaves of apri-cot. Plant Science, 158: 61-70.
|
||
|
|
|||
|
60
|
|||
|
|
|||
|
|
|||
|
REGENERACIÓN DE BROTES ADVENTICIOS EN HOJAS DE GUAYABA (Psidium guajava L.)
|
|||
|
|
|||
|
Ramírez, M. C.; Salazar, E. G. 1998. Método de desinfección y efecto de citocininas en el cultivo in vitro de segmentos de hojas de Psidium guajava. L Rev. Fac. Agron. (LUZ). 15:162-173.
Sha Valli Khan, S.; Hausman, J. F.; Rao, K. R. 1999. Clonal multiplication of Syzygium alterniflolium (Wigth.) Walp., through mature nodal segments. Silvae Genetica. 48 (1): 45-50.
Toribio, M.; Fernández, C.; Celestino, C.; Martínez, M. T.; San-José, M. C.; Vieitez, A. M. 2004. Somatic embryo-genesis in mature Quercus robur trees. Plant Cell, Tis-sue and Organ Culture. 76: 283-287.
|
Toussaint, A. N.; Lebrunt, A.; Roggemans, J. 1992. Cutting and in vitro propagation of Eugenia smithii Poir. Hacta Horticulturae. 314: 77-83.
Villalobos, V. M.; Thorpe, T. A. 1991. Micropropagación: conceptos, metodología y resultados. En: Roca, W. M.; Mrogrinski, L. A. (eds.). Cultivo de tejidos en la agricultura. Fundamentos y aplicaciones prácticas. CIAT. pp. 127-142.
Yadava, U. L. 1994. Physicochemical properties of guava pro-duced in Georgia. HortScience. 29: 536-537.
|
||
|
|
|||
 Red Nacional de Biotecnología Forestal
|
|||
|
|
|||
|
www.rebiofor.org
REBIOFOR convocará a la colectividad interesada en biotecnología forestal, para aprovechar el conocimiento generado y la voluntad de muchos por aportar al auge del sector forestal. Por medio de la presentación de grupos, la publicación de proyectos, informes de investigación, noticias y herramientas, se consolidará el surgimiento de una verdadera comunidad biotecno-lógica forestal en el país.
|
|||
|
|
|||
|
Enrique Vega: director
Dagoberto Castro: asesor científico
Edwin Cristancho: asesor institucional
Sonsire Baquero: coordinadora sonsire.baquero@rebiofor.org
|
|||
|
|
|||
|
61
|
|||
|
|
|||
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2004 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















