Cuantificación, aislamiento e identificaciónde comunidades anaerobias amilolíticas de un manantial termomineral de Paipa, Boyacá
Counts, isolation and identification of amilolytic anaerobic communities from a hot spring in Paipa (Boyacá)
Palabras clave:
termofilia, manantiales termominerales, anaerobiosis, Thermoanaerobacter, DGGE, thermophile, hot springs, DGGE. (es)|
|
||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 90-100__________________
Cuantificación, aislamiento e identificación
de comunidades anaerobias amilolíticas de un manantial termomineral de Paipa, Boyacá
Counts, isolation and identification of amilolytic
anaerobic communities from a hot spring
in Paipa (Boyacá)
Yully Posada*, Liliana Pachón*, Alejandra Agudelo**, Elsa Álvarez***, Carolina Díaz****, Marie-Laure Fardeau*****, Catherine Joulian*****, Bernard Ollivier****** , Sandra Baena
RESUMEN
Se cuantif icaron microorganismos anaerobios termofílicos amilolíticos de un manantial termomineral en la región andina (5° 45' 69’’ N, 73° 6' 61’’ W, 2500 msnm) a través del Número Más Probable (NMP). Los recuentos microbianos de las poblaciones presentaron valores entre 1,9*102 células/100 mL y 5.8*102 células/100 mL en presencia de almidón y tiosulfato como aceptor de electrones y 1,4*102células/100 mL y 3,4*102 células/100 mL en presencia solamente de almidón. Se realizaron aislamientos microbianos a partir de las últimas diluciones positivas del NMP y se aislaron 8 cepas bacterianas denominadas P4-6, P4-7, P4-8, P4-9, P4-10, P4-11, P4-12 y P4-13. Estas cepas crecieron a temperaturas óptimas entre 60 y 65 °C, y exhibieron un metabolismo fermentativo. El principal producto de fermentación fue etanol seguido de acetato, CO2 e hidrógeno. El tiosulfato fue utilizado como aceptor externo de electrones, pero el sulfato o el hierro férrico no fue reducido. La diversidad filogenética de estas 8 cepas fue evaluada por medio de geles de electroforesis de gradiente denaturalizante (DGGE). Se analizó la secuencia del gen 16S rRNA de dos de las cepas aisladas (P4-6 y P4-9) y el análisis indicó que éstas pertenecen a la familia Thermoanaerobiaceae del dominio Bacteria. Del análisis fenotípico y genotípico se deduce que estos organismos pertenecen al género Thermoanaerobacter, y con base en el análisis de las secuencias del 16S rDNA se observa una similitud del 98% con Thermoanaerobacter italicus y Thermoanaerobacter mathranii.
Palabras clave: termofilia, manantiales termominerales, anaerobiosis, Thermoanaerobacter, DGGE.
|
||
|
|
||
|
Microbióloga industrial, Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá, Colombia. P.O.B. 56710.
Microbióloga industrial, joven investigadora, Unidad de Saneamiento y Biotecnología Ambiental (USBA),
Departamento de Biología, Pontificia Universidad Javeriana, Bogotá, Colombia. P.O.B. 56710.
M. Sc. Investigadora Unidad de Saneamiento y Biotecnología Ambiental (USBA), Departamento de Biología,
Pontificia Universidad Javeriana, Bogotá, Colombia. P.O.B. 56710. **** Microbióloga industrial, Investigadora Unidad de Saneamiento y Biotecnología Ambiental (USBA), Departamento
de Biología. Pontificia Universidad Javeriana, Bogotá, Colombia. P.O.B. 56710. ***** Ph. D. investigador senior IRD, UR 101 Extremophiles, IFR-BAIM, Universités de Provence et de la Mediterranée,
ESIL, Marseille, France. ****** Ph. D. director unidad UR 101 Extremophiles, IFR-BAIM, Universités de Provence et de la Mediterranée, ESIL,
Marseille, France. ******* Ph. D. ciencias, profesora asociada, Unidad de Saneamiento y Biotecnología Ambiental (USBA), Departamento de
Biología. Pontificia Universidad Javeriana, Bogotá, Colombia. P.O.B. 56710. Tel: +571 3208320 ext. 4089, Fax
+571 3208320, ext. 4056. Correo electrónico: baena@javeriana.edu.co.
Recibido: septiembre 14 de 2004. Aceptado: septiembre 28 de 2004.
|
||
|
|
||
|
90
|
||
|
|
||
|
|
|||
|
CUANTIFICACIÓN, AISLAMIENTO E IDENTIFICACIÓN DE COMUNIDADES ANAEROBIAS AMILOLÍTICAS
|
|||
|
|
|||
|
ABSTRACT
The amilolytic thermophilic anaerobic microorganisms of a mineral hot spring in the Andean region (5° 45' 69’’ N, 73° 6'61’’W, 2500 m) were quantified through the Most Probable Number (MPN) technique. The microbial recounts of the populations presented values between 1.4*102cell/100 mL and 5.8*102 cell/100 mL in the presence of starch and thiosulphate as electron acceptors and 3.4*102 cel/100 mL in the presence of starch alone. Microbial isolations were conducted starting with the last positive dilutions of the MPN and 8 bacterial strains were isolated and denominated P4-6, P4-7, P4-8, P4-9, P4-10, P4-11, P4-12, and P4-13. These strains grew at optimum temperatures between 60 and 65 °C and exhibited fermentative metabolism. The main product of fermentation was ethanol followed by acetate together with hydrogen and CO2. Thiosulphate was used as external acceptor of electrons by all the isolated strains, but not sulphate or ferric iron. The phylogenetic diversity of these 8 strains was evaluated through denaturing gel gradient electrophoresis (DGGE) analysis. The sequence of the gene encoding for the 16S rRNA of two of the isolated strains (P4-6 and P4-9) was analyzed. These analyses showed that they belong to the family Thermoanaerobiaceae, domain Bacteria. From their phenotypical and genotypical characteristics, it is inferred that these organisms belong to the genus Thermoanaerobacter with similarity of 98% of the 16S rDNA with Thermoanaerobic italicus and Thermoanaerobacter mathranii.
Key words: thermophile, hot springs, anaerobiosis, Thermoanaerobacter, DGGE.
|
|||
|
|
|||
|
INTRODUCCIÓN
El estudio de la biodiversidad microbiana de ambientes termofílicos ha tomado un gran auge a nivel mundial principalmente por la utilización de las biomolé-culas termoestables (enzimas y metabolitos) en la industria biotecnológica. En particular, las proteasas, lipasas, celulasas, quitinasas y amilasas han demostrado un amplio espectro de aplicaciones industriales (Van den Burg, 2003). En las últimas décadas se han descrito nuevos microorganismos aerobios y anaerobios termofílicos de los dominios Archaea y Bacteria (Kozianowski et al., 1997; Kim et al., 2001; Fardeau et al., 2000; Cann et al., 2001; Alain et al., 2002a, 2002b, 2002c; Wery et al., 2001; Brisbarre et al., 2003). Estos organismos termofílicos se han detectado en diferentes hábitat termales como manantiales termominerales (MTM), campos solfatáricos, fosas hidrotermales marinas profundas, entre otros (Kim et al., 2001). Dentro de los organismos aerobios termofílicos, los miembros del género Thermus son los más frecuentemente aislados de MTM terrestres (Skirnisdottir et al., 2000; Pedroza et al., 1997). Recientemente se ha descrito un nuevo género denominado Marinithermus, aerobio termofílico aislado de fosas marinas hidrotermales profundas (Sako et al., 2003).
Los organismos anaerobios termofílicos del dominio Bacteria encontrados en ambientes termofílicos son miembros del orden Thermotogales y Clos-tridiales principalmente, y en particular se ha aislado
|
un amplio rango de organismos pertenecientes a los géneros Thermoanaerobacter y Thermoanaerobac-terium(Zeikusetal., 1979; WiegelyLjungdahl, 1981; SchinkyZeikus, 1983; Leeetal., 1993, Kozianowski et al., 1997; Fardeau et al., 2000; Kim et al., 2001; Cann et al., 2001). Otros géneros representativos de organismos anaerobios termofílicos del dominio Bacteria son Clostridium (Brisbarre et al., 2003), Cal-dicellulosiruptor (Rainey et al., 1994), Thermoanae-rovibrio (Zavarzina et al., 2000), Moorella (Slobodkin et al., 1997a), Thermoterrabacterium (Slobodkin et al., 1997b); Thermobrachium (Engle et al., 1996), Anaerobranca (Engle et al., 1995), Caloramator (Pa-tel et al., 1987; Collins et al., 1994) y Caminicella (Alain et al., 2002b).
La mayoría de estos organismos termofílicos anaerobios del dominio Bacteria son objeto de estudio por su alto potencial de bioconversión de sustratos de origen vegetal en productos finales de valor agregado como son el lactato y el etanol, utilizados en la producción de compuestos químicos y combustibles (Cann et al., 2001). Diferentes enzimas termoestables de los géneros Thermoanaerobacter y Thermoanae-robacterium han sido purificadas y/o clonadas. La utilización de enzimas termoestables en procesos que involucran la transformación de almidón ofrece ventajas con respecto al uso de enzimas mesofílicas, porque a elevadas temperaturas la solubilidad de los sustratos poliméricos es más alta y, además, a altas temperaturas los riesgos de contaminación se reducen considerablemente (Gupta et al., 2004).
|
||
|
|
|||
|
91
|
|||
|
|
|||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 90-100
|
|||
|
|
|||
|
Como parte del programa de investigación en ecología y diversidad microbiana de ecosistemas termofílicos se seleccionaron los MTM de Paipa (Colombia) para el estudio de la diversidad microbiana asociada al ciclo del azufre principalmente (organismos sulfato-reductores y tiosulfato-reductores no sulfato reductores). Los muestreos en estos MTM se iniciaron en el año 2002, y en el presente artículo se describen los resultados obtenidos del recuento, aislamiento e identificación de microorganismos termofílicos amilolíticos.
METODOLOGÍA
Muestreos y colección de las muestras. Se recolectaron muestras de agua y sedimento de un MTM localizado en el departamento de Boyacá (5o 45' 30,69’’ N, 73° 6' 50,61’’ W; 2.500 msnm) (PP-10 Hotel Lanceros). La temperatura promedio del sitio de muestreo fue de 65 °C, pH de 7,0 a 7,2 y la salinidad (contenido de NaCl) de 42 g/L aproximadamente. Se realizaron 4 muestreos entre julio de 2002 y febrero de 2003. Se tomaron 10 muestras aleatorias de 200 mL en frascos de vidrios estériles de diferentes zonas abarcando el área total del yacimiento (16 m2) a una profundidad de 25 a 30 cm, y se procesaron 6 horas después de haber sido tomadas.
Preparación de las muestras y recuentos microbianos por la técnica del Número Más Probable (NMP). Las diez muestras tomadas durante cada muestreo se mezclaron en una botella estéril de 1,5 L bajo atmósfera de gas nitrógeno (N2), para obtener una única muestra integrada. Esta muestra integrada se dividió en dos submuestras (M1 y M2), y cada una fue homogeneizada en condiciones anaerobias. Posteriormente se realizaron diluciones seriadas desde 10-1 hasta 10-8 en frascos de penicilina con agua de reducción (Díaz et al., 2002) y seguidamente se sembraron las diluciones de cada submuestra (M1 y M2) en tubos Hungate. Los microorganismos se cuantificaron por NMP con tres tubos por dilución siguiendo las técnicas anaerobias de Hungate (1969), modificadas por Miller y Wolin (1974). El medio básico contenía (g/L): 0,3 g de KH2PO4; 0,3 g de K2HPO4; 1,0 g de NH4Cl; 23 g de NaCl; 0,1 g KCl; 0,1 g de CaCl2.2H2O,1 g de extracto de levadura, 10 mL de solución mineral de elementos traza (Balch et al., 1979); 1 mLde0,1% Resazurin. Antes de inocularse adicionaron 0,05 mL de 2% Na2S.9H2O; 0,1 mL de 10% NaHCO3, y 0,1 mL de MgCl2 (150 g/L) a cada tubo Hungate. Se realizaron 4 series de cultivo: en
|
presencia de almidón (10 g/L), almidón y tiosulfato (20 mM), control (sin almidón pero con tiosulfato) y control absoluto (sin almidón ni tiosulfato). Todos los tubos se incubaron durante cuatro semanas a 60 °C. El resultado de NMP se reportó como NMP/100 mL. El crecimiento positivo de los tubos fue verificado a través del aumento de la densidad óptica (580 nm), producción de H2S (Cord-Ruwish, 1985) medidos contra los tubos de las series de control y observación microscópica.
Aislamiento y caracterización de los organismos dominantes. A partir de las últimas diluciones positivas de los recuentos por NMP se realizaron los aislamientos en medio sólido con agar noble 2% (Sigma) usando la técnica de tubo rodado. Las cepas aisladas se purificaron a través del uso repetido de esta técnica hasta obtener cultivos axénicos. La pureza de las cepas fue verificada por observación al microscopio y repicaje en medio enriquecido con extracto de levadura (2 g) y glucosa (20 mM). Las cepas aisladas se caracterizaron fenotípicamente por su morfología, temperatura óptima de crecimiento, utilización de sustratos, presencia de esporas, anae-robiosis estricta, coloración de Gram y actividad en-zimática, siguiendo los protocolos establecidos en Baena et al. (2000).
Evaluación de sustratos utilizados. Las cepas fueron subcultivadas dos veces sucesivas bajo las mismas condiciones experimentales y por duplicado. Se evaluaron los sustratos: almidón, xilano, a-celulosa, gelatina, peptona, triptona, pepticasa a una concentración de 10 g/L. Maltosa, D-mannosa, D-xilosa, D-manitol, D-fructosa, sacarosa, lactosa, galactosa, pectina, D-arabinosa, D-glucosa, celobio-sa, lactato y glicerol a concentración de 20 mM. Los productos de la fermentación fueron evaluados por cromatografía de gas utilizando un cromatógrafo Va-rian 3350 equipado con columna Nukol de diámetro 30 m x 0,25 mm, diámetro interno de 0,25 m, detector de ionización de llama (FID) y helio como gas transportador. Se trabajó con un gradiente de temperatura de 80 a 170 °C a una tasa de 11 °C por minuto, temperatura de inyector 220 °C y temperatura del detector 220 °C.
Los aceptores de electrones evaluados fueron SO4 (20 mM), S2O3 (20 mM), S° (2%), Fe+3 (20 mM) y O2 (evaluado en medio aerobio). La determinación de sulfuro se realizó mediante el método de Cord-
|
||
|
|
|||
|
92
|
|||
|
|
|||
|
|
|||
|
CUANTIFICACIÓN, AISLAMIENTO E IDENTIFICACIÓN DE COMUNIDADES ANAEROBIAS AMILOLÍTICAS
|
|||
|
|
|||
|
Ruwish (1985) y el Fe+3 mediante el método de la Fe-rrozina (Lovley y Phillips, 1986).
Determinación de la temperatura óptima de crecimiento. Todos los experimentos fueron realizados por duplicado en tubos Hungate utilizando medio básico con glucosa (20 mM), extracto de levadura (1 g/L) y tiosulfato (20 mM). Las cepas fueron subcultiva-das dos veces consecutivas bajo las mismas condiciones experimentales de temperatura. El rango de temperatura para crecimiento evaluado fue de 20 a 85 °C.
Determinación de la actividad amilolítica. Fue
evaluada a pH 7,2 y 60 °C usando la técnica del 3,5 ácido dinitro salisílico (DNS) con 1% (p/v) de almidón como sustrato durante 30 minutos (Legin et al., 1998). La actividad amilolítica se expresó como el número de Unidades Amilolíticas/min/L (UA/min/L), asumiendo que una unidad amilolítica es la cantidad de enzima capaz de liberar 1 mol de gluco-sa/min/L.
Caracterización molecular del gen 16s rRNA de las cepas aisladas. Las cepas aisladas fueron analizadas en electroforesis en gel denaturante (DGGE) para determinar su diversidad filogenética. Se consideró que eran diferentes entre ellas si sus respectivas bandas en el gel no ocupaban posiciones idénticas. Las cepas fueron cultivadas como se describió previamente. El DNA genómico fue extraído siguiendo el protocolo descrito por Baena et al. (1999). Para la amplificación parcial del gen 16S rDNAse utilizaron iniciadores universales del dominio Bacteria 339-357F (GC-Clamp) [( 59 mer) (CGC CCC CCG CGC CCC GCG CCC GTC CCC CCG CCC CGG CCC CGT CCT ACG GGA GGC AGC AG)] y 926-907R [(20 mer) (CCG TCA ATT CCT TTG AGT TT)] para obtener un producto PCR de aproximadamente 630 pb. La amplificación se llevó a cabo en un termociclador MyCyclerTM (BioRad) en las siguientes condiciones: denaturación inicial a 95 °C por 7 minutos, seguido de 35 ciclos de 95 °C por 1 minuto, 50 °C por 2 minutos y 72 °C por 1 minuto 30 segundos y finalmente una elongación a 72 °C por 10 minutos. La concentración final de las reacciones fue 1 X de buffer de Taq (Gibco-BRL), 2,5 mM de MgCl2, 200 ìM de cada deoxinucleótido, 0,4 ìM del iniciador GC-Clamp, 0,2 ìM del iniciador reverso y 0.025 U/ìL de Taq DNA polimerasa (Gibco-BRL) en un volumen final de 25 ìL. La DGGE se realizó en un gel al 6% de poliacrilamida empleando un gradiente denaturante entre 30 y 50%, el cual se corrió a 60 °C, 37 V durante 16 horas.
|
Para el posicionamiento filogenético de las cepas se aisló el DNA genómico siguiendo el protocolo anteriormente descrito. Se utilizaron los iniciadores universales Fd1 (5'-CAGAGTTTGATCCTGGCTCAG-3’) y R6 (5'-TACGGTTACCTTGTTACGAC-3’) para obtener un producto PCR de aproximadamente 1,5 pb corrrespondientes a las posiciones 8 a 1494 del gen 16S rRNA basado en la numeración de E. coli. La reacción de PCR de volumen final 50 uL contenía 5 uL de buffer 10X (Sigma), 2,5 mM de MgCl2 (Sigma), 0,5 uM de cada iniciador, 100 uM de dNTP (Sigma), y 2,5 U de Taq polymerase (Sigma). Se utilizó el siguiente programa de amplificación: 1 min a 96 °C, 30 ciclos de 30 s a 96 °C, 30 s a 55 °C, 2 min a 72 °C, y una extensión final de 5 min a 72 °C. El producto PCR fue purificado utilizando un kit Nucleo Spin Extract y fue enviado para posterior secuenciación a Genome Express (Grenoble, France).
La secuencia de nucleótidos (aproximadamente 1200 pb) del 16S rDNA fue alineada manualmente con secuencias de referencia pertenecientes a organismos de los grupos XI y XII Clostridiales utilizando el programa de alineamiento BioEdit (Hall, 1999). Las secuencias de referencias fueron obtenidas del RDP (Ribosomal Database Project II (Maidaket al., 2001) y de la base de datos del Genbank (Benson et al., 1999). Las posiciones de las secuencias y los alineamientos inciertos fueron omitidos del análisis. El análisis Pairwise de distancias evolutivas se llevó a cabo utilizando el método de distancias Jukes y Cantor (1969). Los dendrogramas se construyeron utilizando el método de neighbor-joining (Saitou y Nei, 1987). La confiabilidad de la topología del árbol filogenético se determinó por el análisis bootstrap usando 100 re-muestreos de las secuencias (Felsenstein, 1993).
RESULTADOS Y DISCUSIÓN
Recuentos microbianos por NMP. Los recuentos de las comunidades microbianas presentaron variaciones estadísticamente significativas entre los muestreos a lo largo del periodo de estudio (p< 0,05), obteniéndose valores entre 1,9*102 células/100 mL y 5,8*102 células/100 mLen presencia de almidón y tiosulfato como aceptor de electrones, y 1,4*102 células/100 mL y 3,4*102 células/100 mL en presencia solamente de almidón (tabla 1). Aunque los recuentos en presencia de tiosulfato como aceptor de electrones, son mayores que en su ausencia, no se observó una diferencia estadísticamente significativa (p>0,05). Sin embargo, los valores de H2S
|
||
|
|
|||
|
93
|
|||
|
|
|||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 90-100
|
|||
|
|
|||
|
obtenidos demuestran que el tiosulfato fue reducido en las diferentes series de cultivo donde éste se adicionó, y las especies dominantes (en términos de abundancia), aisladas de las últimas diluciones positivas del NMP fueron organismos fermentadores tiosulfato reductores. Otros estudios (Fardeau et al., 1994; Fardeau et al., 1996) demostraron que la presencia de tiosulfato sí aumenta la velocidad de crecimiento y la tasa de degradación de sustratos (pépti-dos, aminoácidos y azúcares) de organismos anaerobios termofílicos fermentadores del género Thermoanaerobacter aislados de yacimientos petroleros y MTM.
Se han identificado miembros del dominio Archaea reductores de tiosulfato y azufre elemental (Thermoproteus, Pyrodictium y Pyrobaculum spp) y del dominio Bacteria (familia Thermoanaerobiaceae y orden Thermotogales) (Lee et al., 1993; Stetter et al., 1990; Subbotina et al., 2003; Ravot et al., 1995), pero incapaces de reducir el sulfato. Este tipo de organismos reductores de tiosulfato, no sulfato-reductores se han reportado en los MTM y en reservorios de petroleo (Fardeau et al., 2000) y están involucrados en el ciclo del azufre y del carbono en sus respectivos hábitat.
Los compuestos de azufre oxidado como el tiosulfato o el sulfato son usados por diferentes organismos heterótrofos miembros de los dominios Archaea y Bacteria como aceptores de electrones para la degradación de la materia orgánica (Sievertet al., 1999). Aunque la concentración de tiosulfato no fue medida en este ecosistema, se conoce la concentración de sulfato de sodio (19.250 mg/L) (Alfaro, 2002). Este sulfato puede ser reducido a H2S por la actividad biológica de las bacterias sulfato-reductoras, presentes en este ecosistema (Thevenieau, 2003). En la interfa-se óxica-anóxica del MTM, el H2S puede ser oxidado biológicamente a sulfato o tiosulfato o puede ser igualmente oxidado químicamente a tiosulfato en condiciones microaerofílicas. Cabe anotar que durante el periodo de estudio no fue evidente la presencia de H2S, que genera olores característicos, es probable entonces que éste se oxidara continuamente a medida que se generaba. Por tanto, la presencia de tiosulfato y/o sulfato en este ecosistema puede ser producto del ciclo del azufre y su formación y utilización dependen de la acción e interacción de diferentes microorganismos (organismos azufre-reductores y organismos sulfato y tiosulfato-reductores).
|
Aislamiento y caracterización preliminar de microorganismos dominantes. Durante el recuento por NMP se observaron al microscopio diferentes morfologías microbianas destacándose principalmente formas bacilares. A partir de las últimas diluciones positivas de las diferentes series de cultivo se realizaron medios sólidos para el aislamiento microbiano y se obtuvieron numerosas colonias redondas, pequeñas y blancas de centro café, después de 5 a 7 días de incubación. Se aislaron diferentes cepas y finalmente se seleccionaron 8 cepas anaerobias estrictas denominadas P4-6, P4-7, P4-8, P4-9, P4-10, P4-11, P4-12 y P4-13 para su posterior estudio.
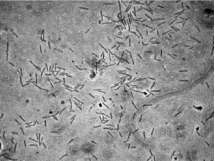
Morfología. Las cepas aisladas presentaron morfologías similares, siendo bacilos finos entre 2 y 5 ìm de largo, que forman cadenas de 2 a 4 células (figura 1). Todas las cepas presentaron coloración Gram positiva y no se encuentran variaciones en su morfología que permitan establecer diferencias entre ellas. Se observó movilidad y presencia de esporas en posición terminal.
Características fisiológicas. Las 8 cepas aisladas son anaerobias estrictas y quimioorganótrofas. La temperatura óptima de crecimiento osciló entre 60 y 65 °C con un rango de temperatura de crecimiento entre 55 y 75 °C. Estas cepas exhibieron una mayor afinidad por los azúcares y fermentaron glucosa, galactosa, lactosa, mannosa, maltosa, xilosa, mani-tol, pero no utilizaron arabinosa. El principal meta-bolito final producido fue etanol, seguido por bajas concentraciones de acetato, hidrógeno y CO2.
|
||
 |
|||
|
Figura 1. Fotomicrografía de contraste de fase de la cepa P4-9 en fase exponencial de crecimiento. Barra = 5 \im
|
|||
|
|
|||
|
94
|
|||
|
|
|||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
CUANTIFICACIÓN, AISLAMIENTO E IDENTIFICACIÓN DE COMUNIDADES ANAEROBIAS AMILOLÍTICAS
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 1. NMP de las comunidades anaerobias amilolíticas del yacimiento termal mineral PP-10
"Pozo Hotel Lanceros".
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
* Promedio aritmético de dos réplicas después de transformación del NMP a log10.
MB: medio básico para bacterias termofílicas-halotolerantes suplementado con 1 g/L de extracto de levadura.
Alm: Almidón 10 g/L; Tio: tiosulfato 20 mM.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
También utilizaron compuestos complejos como pectina, almidón y xilano. No utilizaron a-celulosa, triptona, peptona, pepticasa, gelatina ni casaminoá-cidos. A partir de pectina se produjo metanol adicional al etanol y acetato. La evaluación de aceptores de electrones mostró que el oxígeno, hierro férrico, azufre elemental y el sulfato no fueron utilizados como aceptores finales de electrones, solamente se observó reducción de tiosulfato produciéndose sulfuro de hidrógeno.
La actividad amilolítica de las cepas aisladas fluctuó entre 563,89 y 905,65 UA/min/L utilizando la técnica de DNS, como control medio básico estéril para bacterias termofílicas-halotolerantes suple-mentado con almidón (10g/L).
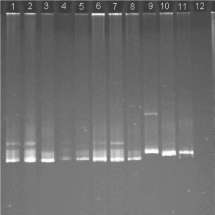
Análisis molecular del gen 16S rRNA de las cepas aisladas. Se utilizó la técnica de electroforesis en gel con gradiente desnaturalizante (DGGE) (Muyzer, 1999) para determinar la diversidad filoge-nética entre las cepas aisladas. Este análisis mostró que las 8 cepas ocuparon la misma posición en el perfil de bandas del gel (figura 2), lo cual indica que podrían agruparse en un único filogrupo y que están, posiblemente, cercanas filogenéticamente. Después se seleccionaron las cepas P4-6 y P4-9 para el análisis completo del gen 16S rRNA. El alineamiento de las secuencias y las comparaciones subsecuentes con miembros representativos del dominio Bacteria permitieron ubicar a las cepas P4-6 y P4-9 dentro de la familia Thermoanaerobia-ceae, específicamente dentro del género Thermoa-naerobacter, subgrupo II según Subbotina et al. (2003). La cepa P4-6 presentó una similitud del 97% con Thermoanaerobacter mathranii, y P4-9 una similitud del 98,3% con Thermoanaerobacter italicus (figura 3). Cabe agregar que T. mathranii y T.
|
italicus presentan entre ellas una alta similitud. Pese a las similitudes observadas del análisis filogenético existen diferencias fenotípicas entre las cepas aisladas, T. mathranii y T. italicus (tabla 2). En el caso de T. italicus este organismo exhibe un rango de temperatura más amplio que el presentado por las cepas aisladas (45 a 78 °C); la temperatura óptima de crecimiento es de 70 °C, no presenta movilidad a diferencia de lo observado en los aislamientos, y utiliza la arabinosa. De otra parte, el producto de la
|
||||||||||||||||||||||||||||||||||||||||||||
 |
|||||||||||||||||||||||||||||||||||||||||||||
|
Figura 2. Análisis por DGGE de las cepas bacterianas aisladas. El gel contiene los productos amplificados del gen 16S rRNA con los iniciadores F1-GC y R4. Carril 1: cepa P4-6; carril 2: cepa P4-7; carril 3: cepa P4-8; carril 4: cepa P4-9; carril 5: cepa P4-10; carril 6: cepa P4-11; carril 7: cepa P4-12; carril 8: cepa P4-13; carril 9: Desulfacinum sp; carril 10: Desulfacinum sp; carril 11: Escherichia coli; carril 12: control negativo de reacción.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
95
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 90-100
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 2. Características de las especies de Thermoanaerobacter cercanamente relacionadas (subgrupo II según Subbotina etal., 2003) con las cepas aisladas (P4-6 a P4-13)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
n.d. : no determinado n.r.: no reportado
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
reducción del tiosulfato en T. italicus es azufre elemental y en las cepas aisladas es H2S. En el caso de T. mathranii también se observan diferencias fenotí-picas con respecto a las cepas aisladas: la temperatura óptima de crecimiento está entre 70 y 75 °C, y T. mathranii no utiliza galactosa ni pectina como fuente de carbono. Del análisis de metabolitos producidos se observó que el butirato no se formó durante la fermentación de azúcares, característica también compartida con T. mathranii y T. italicus.
|
Los miembros del género Thermoanaerobacter incluyen especies termofílicas, aunque se han identificado algunas especies hipertermofílicas (Xue et al., 2001; Kim et al., 2001). Otras características del género son: anaerobiosis, tinción Gram positiva, metabolismo fermentativo y algunas especies son capaces de reducir aceptores de electrones inorgánicos como el tiosulfato, azufre elemental o el hierro férrico. Igualmente, estos organismos son capaces de fermentar azúcares con la formación de acetato, etanol, lactato,
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
96
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
CUANTIFICACIÓN, AISLAMIENTO E IDENTIFICACIÓN DE COMUNIDADES ANAEROBIAS AMILOLÍTICAS
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
H2 y CO2 principalmente, la mayoría de especies del género forman esporas. A este género pertenecen 15 especies validadas: T. acetoethylicus (Ben-Bassat y Zeikus 1983; Rainey y Stackebrandt, 1993), T. brockii (Lee et al., 1993), T. ethanolicus (Wiegel y Ljungdahl, 1981); T. finnii (Schmid etal., 1986); T. italicus (Kozia-nowski etal., 1997), T. kivui(Leigh y Wolfe 1983; Co-llins etal., 1994); T. mathranii(Larsen etal., 1997); T. siderophilus(Slobodkin etal., 1999); T. subterraneus (Fardeau etal., 2000); T. sulfurophilus (Bonch-Osmo-lovskaya et al., 1997); T. tengcongensis (Xue et al., 2001); T. thermocopriae (Jin etal., 1988; Collins etal., 1994); T. thermohydrosulfuricus (Lee etal., 1993); T. wiegelii (Cook et al., 1996) y T. yonseiensis (Kim et al., 2001). Estos organismos han sido aislados de diferentes ecosistemas como MTM, cyanobacterial mats, lagos volcánicos, reservorios de petróleo, entre otros (Subbotina etal., 2003). Los miembros de este género han sido utilizados en diferentes procesos biotec-nológicos a través de la utilización de sus enzimas hi-drolíticas (amilasas, proteasas y keratinasas) (Kozianowski et al., 1997; Riessen y Antranikian, 2001;Jangetal., 2002).
El potencial de utilización de Thermoanaerobacter radica en la producción industrial de etanol y en sus genes que codifican para una amplia variedad de enzimas termoestables únicas, tales como alcohol deshidrogenasa, amilasas y glucosa isomerasa, entre otras. A nivel biotecnológico T. mathranii es utilizada
|
por su alta tolerancia al etanol (4% p/v a 70 °C) lo cual permite la producción industrial del mismo a partir de azúcares y polímeros complejos (Larsen etal., 1997). De otra parte, las enzimas pectinolíticas (pectato lia-sas)de T. italicusson utilizadas en la industria alimentaria (Kozianowski etal., 1997).
CONCLUSIONES
Los organismos amilolíticos cuantificados en este estudio son organismos fermentadores termofílicos capaces de utilizar el tiosulfato como aceptor externo de electrones en presencia de azúcares y sustratos complejos como el almidón, y pueden estar implicados directamente en la transformación de la materia orgánica (ciclo del carbono) en su hábitat. Las poblaciones dominantes dentro de estos fermentadores termofílicos tiosulfato reductores pertenecen al género Thermoanaerobacter cercanamente relacionados con T italicus y T mathranii. Estas poblaciones dominantes crecen a temperaturas óptimas entre 60 y 65 °C y tienen una actividad amilolítica considerable. La presencia de organismos del género Thermoanaerobacter capaces de reducer el tiosulfato no es sorprendente en este tipo de ecosistemas porque los sedimentos de los MTM son ricos en formas oxidadas de azufre. El MTM estudiado está asociado con actividades volcánicas y a la zona de subduc-ción en la region andina.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
97
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 90-100
|
|||
|
|
|||
|
Este estudio permite ampliar el conocimiento sobre la distribución de organismos anaerobios termofíli-cos del género Thermoanaerobacter en ecosistemas termales colombianos, y deja abierta la posibilidad de utilización de las cepas aisladas como fuentes valora-bles de nuevas enzimas termoestables.
Las cepas aisladas se encuentran depositadas en el registro de colecciones del Departamento de Biología de la Pontificia Universidad Javeriana con los siguientes números de colección: PUJ-Bio-M-USBA-28 al PUJ-Bio-M-USBA-35.
AGRADECIMIENTOS
Este estudio fue realizado gracias al apoyo financiero del IFS (Internacional Foundation for Sciences), Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología (Colciencias) y el Programa Ecosnord.
BIBLIOGRAFÍA
Alain, K.; Querellou, J.; Lesongeur, F.; Pignet, P.; Crassous, P.; Raguénes, G.; Cueff, V.; Cambon-Bonavita, M. 2002a. Caminibacter hydrogeniphilus gen. nov., sp. nov., a novel thermophilic, hydrogen - oxidizing bacte-rium isolated from an East Pacific Rise hidrotermal vent. Int. J. Syst. Evol. Microbiol. 52: 1317-1323.
Alain, K.; Pignet, P.; Zbinden, M.; Quillevere, M.; Duchiron, F.; Donval, J. P.; Lesongeur, F.; Raguénés, G.; Crassous, P.; Querellou, J.; Cambon-Bonavita, M. 2002b. Caminicella sporogenes gen. nov., sp. nov., a novel thermophilic spore-forming bacterium isolated from an East- Pacific Rise hydrothermal vent. Int. J. Syst. Evol. Microbiol. 52: 1621-1628.
Alain, K.; Marteinsson, V. T.; Miroshnichenko, M. L.; Bonch-Osmolovskaya, E. A.; Prieur, D.; Birrien, J. L. 2002c. Marinitoga piezophila sp. nov., a rod-shaped, thermo-piezophilic bacterium isolated under high hydro-static pressure from a deep-sea hydrothermal vent. Int. J. Syst. Evol. Microbiol. 52: 1331-1339.
Alfaro, C. 2002. Geoquímica del sistema geotérmico de Paipa. Ingeominas-OIEA. Bogotá, Colombia. 42 p.
Baena, S.; Fardeau, M.-L.; Woo, T. H. S.; Ollivier, B.; Labat, M.; Patel, B. K. C. 1999 Phylogenic relationship of three amino acid utilising anaerobes Selenomonas acidaminovorans, Selenomonas acidaminophila and Eubacterium acidaminophilum as inferred from partial 16S ribosomal DNA nucleotide sequences. Int J Syst Bacteriol. 49: 969-974.
Baena, S.; Fardeau, M.-L.; Labat, M.; Ollivier, B.; Patel, B. K. C. 2000. Aminobacterium mobile sp. nov., a new anaer-obic amino acid degrading bacterium. Int. J. Syst. Evol. Microbiol. 50: 259-264.
|
Balch, W. E.; Fox, G. E.; Magrum, L. J.; Woese, C. R.; Wolfe, R. S. 1979. Methanogens: reevaluation of a unique bio-logical group. Microbiol. Rev. 43: 260-296.
Ben-Bassat, A.; Zeikus, J. G. 1983. Thermobacteroides acetoethylicus gen. nov. and spec. nov., a new chemoorganotrophic, anaerobic, thermophilic bacterium. Arch. Microbiol. 128: 365-370.
Benson, D. A.; Boguski, M. S.; Lipman, D. J.; Ostell, J.; Ouellette, B. F. .; Rapp, B. A.; Wheeler, D. L. 1999. GenBank. Nucleic Acids Res. 27: 12-17.
Bonch-Osmolovskaya, E. A.; Miroshnichenko, M. L.; Chernykh, N. A.; Kostrikina, N. A.; Pikuta, E. V.; Rainey, F. A. 1997. Reduction of elemental sulfurby moderately thermophilic organotrophic bacteria and the description of Thermoanaerobacter sulfurophilus sp. nov. Mikrobiologiya, 66: 581-587 (in Russian). English tranlation: Microbiology. 66: 483-489.
Brisbarre, N.; Fardeau, M. L.; Cueff, V.; Cayol, J. L.; Barbier, G.; Cilia, V.; Ravot, G.; Thomas, P.; García, J. L.; Olliver, B. 2003. Clostridium caminithermale sp. nov., a slightly halophilic and moderately thermophilic bacterium isolated from an Atlantic deep-sea hydrothermal chimney. Int. J. Syst. Evol. Microbiol. 53: 1043-1049.
Cann, I. K.; Stroot, P. G.; Mackie, K. R.; White, B. A.; Mackie, R. I. 2001. Characterization of two novel saccharolytic, anaerobic thermophiles, Thermoanaerobacterium polysaccharolyticum sp. nov. Thermoanaerobacterium zeae sp. nov., emendation of the genus Thermoanaerobacterium. Int. J. Syst. Evol. Microbiol. 51:293-302.
Collins, M. D.; Lawson, P. A.; Willems, A.; Córdoba, J. J.; Fernández-Garayzabal, J.; García, P.; Cai, J.; Hippe, H.; Farrow, J. A. E. 1994. The phylogeny of the genus Clostridium: proposal of five new genera and eleven new species combinations. Int. J. Syst. Bacteriol. 44: 812-826.
Cook, G. M.; Rainey, F. A.; Patel, B. K. C.; Morgan, H. W. 1996. Characterization of a new obligately anaerobic thermophile, Thermoanaerobacter wiegelii sp. nov. Int. J. Syst. Bacteriol. 46: 123-127.
Cord-Ruwish, R. 1985. Aquickmethodof determinationof dissolved and precipitates sulfides in cultures of sul-fate-reducing bacteria. J. Microbiol. Methods. 4: 33-36.
Díaz, M. C.; Espitia, S. E.; Pérez, F. 2002. Digestión anaerobia, una aproximación a la tecnología. Bogotá, Colombia: Universidad Nacional de Colombia. pp. 162.
Engle, M.; Li, Y.; Woese, C.; Wiegel, J. 1995. Isolation, characterization of a novel alkalitolerant thermophile, Anaerobranca Horikoshii gen. nov., sp. nov. Int. J. Syst. Bacteriol. 45:454-461.
Engle, M.; Li, Y.; Rainey, F.; DeBlois, S.; Mai, V.; Reichert, A.; Mayer, F.; Messner, P.; Wiegel, J. 1996. Thermobrachium celere gen. nov., sp. nov., a rapidly growing thermophilic, alkalitolerant, proteolytic obligate anaerobe. Int. J .Syst. Bacteriol. 46:1025-1033.
Fardeau, M. L.; Cayol, J. L.; Magot, M.; Ollivier, B. 1994. Hydrogen oxidation abilities in the presence of thiosulfate
|
||
|
|
|||
|
98
|
|||
|
|
|||
|
|
|||
|
CUANTIFICACIÓN, AISLAMIENTO E IDENTIFICACIÓN DE COMUNIDADES ANAEROBIAS AMILOLÍTICAS
|
|||
|
|
|||
|
as electron acceptor within the genus Thermo-anaerobacter. Current Microbiol. 29: 269-272.
Fardeau, M. L.; Faudon, C.; Cayol, J. L.; Magot, M.; Patel, B. K. C.; Ollivier, B. 1996. Effect of thiosulfate as electron acceptor on glucose and xylose oxidation by Thermoanaerobacter finnii, a Thermoanaerobacter sp isolated form oil field water. Res. Microbiol. 147: 159-165.
Fardeau, M. L.; Magot, M.; Patel, B. K. C.; Thomas, P.; Garcia, J. L.; Ollivier, B. 2000. Thermoanaerobacter subterraneus sp. nov., a novel thermophile isolated from oilfield water. Int. J. Syst. Evol. Microbiol. 50: 2141-2149.
Felsenstein, J. P. 1993. Phylogenetic Inference Package version 3.51c. Distributed by the author. Seattle, USA: De-partment of Genetics, University of Washington.
Gupta, R.; Gupta, N.; Rathi, P. 2004. Bacterial lipase: an over-viewof production, purification and biochemical proper-ties. Appl Microb Biotechnol. 64: 763-781.
Hall, T. A. 1999. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. NucleicAcids Symp Ser. 41: 95-98.
Hungate, R. E. 1969. Aroll tube method for cultivation of strict anaerobes. P. 117-132. En: J. R. Norris and D. W. (ed). Methods in Microbiology, vol. 36. London: Academic press, inc. London, Ltd.
Jang, H. J.; Kim, B. C.; Pyun, Y. R.; Kim, Y. S. 2002. A novel suntilisin-like serine protease from
Thermoanaerobacteryonseiensis KB-1: its cloning, ex-pression and biochemical properties. Extremophiles. 6: 233-243.
Jin, F.; Yamasato, K.; Toda, K. 1988. Clostridium thermocopriae sp. nov., a cellulolytic thermophile from animal faces, compost, soil and a hot spring in Japan. Int. J. Syst. Bacteriol. 38: 279-281.
Jukes, T. H.; Cantor, C. R. 1969. Evolution of proteins mole-cules. En: H.N.Murno (ed.). Mammalian protein metab-olism. N.Y.: Academic Press, p: 21-132.
Kim, B. C.; Grote, R.; Lee, D. W.; Antranikian, G.; Pyun, Y. R. 2001. Thermoanaerobacter yonseiensis sp. nov., a novel extremely thermophilic, xylose-utilizing bacterium that grows at up to 85 °C. Int. J. Syst. Evol. Microbiol. 51: 1539-1548.
Kozianowski, G.; Canganella, F.; Rainey, F. .; Hippe, H.; Antranikian, G. 1997. Purification and characterization of thermostable pectate-lyases from a newly isolated thermophilic bacterium, Thermoanaerobacter italicus sp. nov. Extremophiles. 1:171-182.
Larsen, L.; Nielsen, P.; Ahring, B. K. 1997. Thermoanaerobacter mathranii sp nov, an etha-nol-producing, extremely thermophilic anaerobic bacterium from a hot spring in Icel. Arch. Microbiol. 168: 114-119.
Lee, Y. E.; Jain, M. K.; Lee, C.; Lowe, S. E.; Zeikus, J. G. 1993. Taxonomic distinction of saccharolytic thermophilic anaerobes: description of Thermoanaerobacterium xylanolyticum gen. nov., sp. nov., and Thermo-
|
anaerobacterium saccharolyticum gen. nov., sp. nov.; re-classification of Thermoanaerobium brockii, Clostridium thermosulfurogenes, and Clostridium thermohydro-sulfuricum E100-69 as Thermoanaerobacter brockii comb. nov., Thermoanaerobacterium thermosul furigenes comb. nov., and Thermoanaerobacter thermohydro-sulfuricus comb. nov., respectively; and transfer of Clostridium thermohydrosulfuricum 39 E to Thermoanaerobacter ethanolicus. Int. J. Syst. Bacteriol. 43:41 -51.
Leigh, J.; Wolfe, R. S. 1983. Acetogenium kivui, a thermophilic acetogenic bacterium. Int. J. Syst. Bacteriol. 33: 886.
Lovley, D. R.; Phillips J. P. 1986. Organic matter mineraliza-tion with reduction of ferric iron in anaerobic sediments. Appl Environ Microbiol. 51: 683-689.
Maidak, B. L,; Cole, J. R.; Lilburn, T. G.; Parker, C. T.; Saxman, P. R.; Farris, R. J.; Garrity, G. M.; Olsen, G. J.; Schmidt, T. M.; Tiedje, J. M. 2001. The RDP-II (Ribo-somal Database Project). Nucleic Acids Res. 29:173-174.
Miller, T. L.; Wolin, M. J. 1974. A serum modificatium of the Hungate technique for cultivating obligate anaerobes. Appl. Microbiol. 27: 985-987.
MuyzerG. 1999. DGGE/TGGE a method for identifying genes from natural ecosystems. Curr. Opin. Microbiol. 2: 317-322.
Patel, B. K. C.; Monk, C.; Littleworth, H.; Morgan, H. W.; Daniel, R. M. 1987. Clostridium fervidus sp. nov., a new chemoorganotrophic acetogenic thermophile. Int. J. Syst. Bacteriol. 37: 123-126.
Pedroza, A. M.; Álvarez, N. C.; Poutou, R. A. 1997. Diseño de un medio definido para el cultivo discontinuo de cepas autóctonas de Thermus spp. Universistas Scientarium. 4(2): 130-134.
Rainey, F. A.; Stackebrandt, E. 1993. Transfer of the type spe-cies of the genus Thermobacteroides to the genus Thermoanaerobacter as Thermoanaerobacter aceto-ethylicus (Ben-Bassatand Zeikus 1981) comb. nov., description of Coprothermobactergen. nov., and reclassi-fication of Thermobacteroides proteolyticus as Coprothermobacter proteolyticus. Int. J. Syst. Bacteriol. 43: 857-859.
Rainey, F. A.; Donnison, A. M.; Janssen, P. H.; Saul, D.; Rodrigo, A.; Bergquist, P. I.; Daniel, R. M.; Stackebrandt. E.; Morgan, H. W. 1994. Description of Caldicellulosiruptor saccharolyticus gen. nov., sp. nov.: an obligately anaerobic, extremely thermophilic, cellulolytic bacterium. FEMS Microbiol. Lett. 120: 263-266.
Ravot, G.; Ollivier, B.; Magot, M.; Patel, B. K. C.; Crolet, J. L.; Fardeau, M. L.; Gracia, J. L. 1995. Thiosulfate Reduction, an Important Physiological Feature Shared by Members of the Order Thermotogales. Appl. Environ. Microbiol. 61:2053-2055.
Riessen S.; Antranikian, G. 2001. Isolation of Thermoanaerobacter keratinophilus sp. nov., a novel thermophilic, anaerobic bacterium with keratinolytic ac-tivity. Extremophiles. 5-6: 399-408.
|
||
|
|
|||
|
99
|
|||
|
|
|||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 90-100
|
|||
|
|
|||
|
Saitou, N.; Nei, M. 1987. The neighbor-joining method: a new method for reconstructing Phylogenetic trees. Mol. Biol. Evol. 4: 406-425.
Sako, Y.; Nakagawa, S.; Takai, K.; Horikoshi, K. 2003. Marinithermus hydrothermalis gen. nov., sp. nov., a strictly aerobic, thermophilic bacterium from a deep-sea hydrothermal ventchimney. Int. J. Syst. Evol. Microbiol. 53: 59-65.
Schink, B.; Zeikus, G. 1983. Clostridium thermosulfurogenes sp. nov., a New Thermophile that Produces Elemental Sulphur from Thiosulphate. J. General Microbio. 129: 1149-1158.
Schmid, U.; Giesel, H.; SChoberth, S. M.; Sahm, H. 1986. Thermoanaerobacter finnii spec. nov., a new ethanologenic sporogenous bacterium. Syst. Appl. Microbiol. 8: 80-85.
Sievert, S. M.; Brinkhoff, T.; Muyzer, G.; Ziebis, W.; Kuever, J. 1999. Spatial Heterogeneity of Bacterial Populations along an Environmental Gradient at a Shallow Subma-rine Hydrothermal Vent near Milos Island (Greece). Appl. Environ. Microb. 65: 3834-3842.
Skirnisdottir, S.; Hreggvidsson, G. O.; Hjorleifsdottir, S.; Marteinsson, V. T.; Petursdottir, S. P.; Holst, O.; Kristjansson, J. K. 2000. The influence of sulfide and temperature on the species composition and commu-nity structure of hot spring microbial mats. Appl. Environ. Microbiol. 66: 2835-2841.
Slobodkin,A.; Reysenbach, A. L.; Mayer, F.; Wiegel, J. 1997a. Isolation and characterization of the homoacetogenic thermophilic bacterium Moorella glycerini sp. nov. Int. J. Syst. Bacteriol. 47: 969-974.
Slobodkin, A. I.; Reysenbach, A. L.; Strutz, N.; Dreier, M.; Wiegel, J. 1997b. Thermoterrabacterium ferrireducens gen. nov., sp. nov., a thermophilic anaerobic dissimilatory Fe(III)-reducing bacterium from a continental hot spring. Int. J. Syst. Bacteriol. 47: 541-547.
Slobodkin, A. I.; Tourova, T. P.; Kuznetsov, B. B.; Kostrikina, N. A.; Chernyh, N. A.; Bonch-Osmolovskaya, E. A. 1999. Thermoanaerobacter siderophilus sp. nov., a novel dissimilatory Fe(III)-reducing, anaerobic, thermophilic bacterium. Int. J. Syst. Bacteriol. 49: 1471-1478.
|
Stetter, K. O.; Fiala, G.; Huber, G.; Huber, R.; Segerer, A. 1990. Hyperthermophilic microorganisms. FEMS Microbiol. Rev. 75: 117-124.
Subbotina, I. V.; Chernyh, N. A.; Sokolova, T. G.; Kublanov, I. V.; Bonch-Osmolovskaya, E. A.; Lebedinsky, A. V. 2003. Oligonucleotide Probes for the Detection of Rep-resentatives of the Genus Thermoanaerobacter. Micro-biology. 72:331-339.
Thevenieau, F. 2003. Écologie moleculaire et quantification par PCR compétitive des bactéries sulfato-réductrices d'une source chaude colombienne. Dea de microbiologie moleculaire et biotechnologies. 20 p.
Van den Burg. 2003. Extremophiles as a source for novel en-zymes. Current Opinion in Microbiology. 6: 213-218.
Wery, N.; Lesongeur, F.; Pignet, P.; Perennes, V.; Cambon-Bonavita, M. A.; Godfroy, A.; Barbier G. 2001. Marinitoga camini gen. nov., sp. nov., a rod-shaped bacterium belonging to the order Thermotogales, isolated from a deep-sea hydrothermal vent. Int. J. Syst. Evol. Microbiol. 51: 495-504.
Wiegel, J.; Ljungdahl, L. G. 1981. Thermoanaerobacter ethanolicus gen. nov., spec. nov., a new, extreme thermophilic, anaerobic bacterium. Arch. Microbiol. 128: 343-348.
Xue, Y.; Xu, Y.; Liu, Y.; Ma, Y.; Zhou, P. 2001. Thermoanaerobacter tengcongensis sp. nov., a novel anaerobic, saccharolytic, thermophilic bacterium isolated from a hot spring in Tengcong, China. Int. J. Syst. Evol. Microbiol. 51:1335-1341.
Zavarzina, D. G.; Zhilina, T. N.; Tourova, T. P.; Kuznetsov, B. B.; Kostrikina, N. A.; Bonch-Osmolovskaya, E. A. 2000. Thermanaerovibrio velox sp. nov., a new anaerobic, thermophilic, organotrophic bacterium that reduces elemental sulfur, and emended description of the genus Thermanaerovibrio. Int. J. Syst. Evol. Microbiol. 50: 1287-1295.
Zeikus, J. G.; Hegge, P. W.; Ersson, M. A. 1979. Thermoanaerobacterium brockii gen. nov. sp. nov., A new chemoorganotrophic, Caldoactive, Anaerobic Bacterium. Arch. Microbiol. 122: 44 - 48.
|
||
|
|
|||
|
100
|
|||
|
|
|||
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2004 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















