Análisis térmico y espectrometría de masas en conductores protónicos (PVDF/H3PO2) para implementación en celdas de combustible
Thermal analysis and mass spectrometry in protonic conductors (PVDF/H3PO2) for implementation in fuel cells
DOI:
https://doi.org/10.15446/dyna.v85n204.66968Palabras clave:
celda de combustible, electrolito solido, polímero, calorimetría DSC, termogravimetría, espectrometría MS (es)fuel cell, solid electrolyte, polymer, calorimetry DSC, thermogravimetry, spectrometry MS (en)
Recibido: 10 de agosto de 2017; Revisión recibida: 21 de noviembre de 2017; Aceptado: 11 de diciembre de 2017
Resumen
Se prepararon membranas de Polivinil Difluoruro y Acido Hipofosforoso (PVDF/H3PO2) con diferentes concentraciones de ácido. Los resultados de calorimetría diferencial de barrido (DSC), presentan un escalón característico de la transición vítrea alrededor de 250 K. También se observan dos anomalías endotérmicas: una cercana a 357 K debido a la evaporación de agua, y otra cerca a los 422 K atribuida a la fusión de la fase cristalina del PVDF. Los análisis de Espectrometría de masas (MS) acoplado con Termogravimetría (TGA), revelan la posible presencia de moléculas de (C2H2O) y ácido fluorhídrico (HF), esto plantea la posibilidad de que el H3PO2 perdió un átomo de hidrógeno y se enlazó a la cadena polimérica del PVDF desplazando un átomo de flúor. Se evidencia la presencia de moléculas de agua a diferentes temperaturas, que sugiere la formación de agua superficial, interna y estructural en el sistema polímero-acido. Esta característica, hace que el sistema PVDF/H3PO2 sea propuesto como electrolito solido en celdas de combustible.
Palabras clave:
celda de combustible, electrolito solido, polímero, calorimetría DSC, termogravimetría, espectrometría MS.Abstract
Polyvinyl Difluoride and Hypophosphorous Acid (PVDF/H3PO2) membranes were prepared with different concentrations of acid. The differential scanning calorimetry (DSC) results showed a typical step of the glass transition around 250 K. Two endothermic anomalies were observed: one closed to 357.6 K due to the evaporation of water, and another closed to 422 K attributed to the melting of the crystalline phase of PVDF. The mass spectrometry (MS) coupled with thermogravimetry analysis (TGA) reveal the possible presence of (C2H2O) and hydrofluoric acid (HF) molecules, thereby raises the possibility that H3PO2 lost a hydrogen atom and bonded to the polymer chain of the PVDF by displacing an atom of fluorine. The presence of water molecules at different temperatures suggests the formation of superficial, internal and structural water in the polymer-acid system. This feature makes the PVDF/H3PO2 system to be proposed as solid electrolyte in fuel cells.
Keywords:
fuel cell, solid electrolyte, polymer, calorimetry DSC, thermogravimetry, spectrometry MS.1. Introducción
En la actualidad, existe la necesidad de generar y almacenar energía favoreciendo la protección ambiental. Esto, ha impulsado la investigación de energías alternativas, tales como las celdas de combustible. El bajo nivel de contaminación, la alta eficiencia y los bajos costos de mantenimiento hacen que las celdas de combustible sean destacadas respecto a otros dispositivos de conversión de energía [1,2]. Investigaciones recientes, revelan que las celdas de combustible de membrana de intercambio protónico (PEMFC) (Proton Exchange Membrane Fuel Cells) y las celdas de combustible de metanol directo (DMFC) (Direct-Metanol Fuel Cells), son las más prometedoras para aplicaciones energéticas en equipos portátiles y automotrices [3,4].
Las PEMFC, funcionan a baja temperatura (entre 333 K y 373 K), pero la acidez de las soluciones empleadas, pueden generar corrosión en las partes metálicas y reducir el tiempo de vida de la celda, por tal motivo, es importante controlar la humedad retenida por la membrana así como la temperatura de funcionamiento, debido a que estas variables influyen considerablemente en la eficiencia, [5,6].
Las membranas de intercambio protónico (PEM) más relevantes hoy en día son las membranas de Nafión® y sus modificados como (Nafión 115 y Nafión 117), los cuales son polímeros sintéticos con buena estabilidad química, térmica y alta conductividad protónica (10−2 a 10−1 S.cm−1) [7,8]. Sin embargo, el alto costo y problemas de permeabilidad de gases o metanol en la membrana, han llevado a generar otras alternativas en las PEMs que muestren buenas propiedades conductoras de protones, a temperaturas intermedias (T>373 K) para usarse en PEMFC y DMFC.
Debido a que se requieren altos valores de conductividad iónica (( ( 10-5 S cm-1), se han propuesto como electrolitos solidos poliméricos, diferentes combinaciones de polímero-ácido, como por ejemplo: polivinil alcohol (PVAOH) con ácido hipofosforoso (H3PO2) [9,10] y PVDF con ácido sulfónico de poliestireno (PVDF/PSSA) con las que se han obtenido membranas de alta conductividad iónica, baja permeabilidad a gases o metanol y densidades de corriente comparables a las obtenidas con Nafión 115 [11].
Estos antecedentes, muestran la necesidad de encontrar nuevos electrolitos solidos poliméricos con combinaciones de fase aptas para brindar propiedades de conductores protónicos que puedan usarse en celdas de combustible a temperaturas inferiores de 373 K. Con este objetivo se sintetizaron membranas PVDF/H3PO2 y se realizaron análisis térmicos para determinar cambios en las fases por efecto de la concentración de ácido.
2. Procedimiento y técnicas experimentales
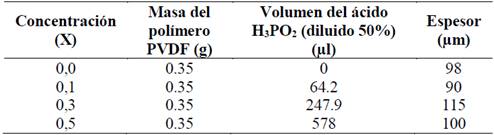
En este trabajo, se prepararon membranas de PVDF y H3PO2 a concentraciones en fracción de masa de 0,10, 0,30 y 0,50 de ácido, con el fin de estudiar las fases de dichas membranas.
2.2. Preparación de muestras
Para la preparación de las membranas, se tuvo en cuenta el procedimiento utilizado por Vásquez y colaboradores [12], en el cual el PVDF de la casa Aldrich, se disuelve en Tetrahidrofurano (THF) y se adiciona H3PO2 diluido al 50% de la casa Merck; siguiendo el proceso que se describe a continuación.
En un balón de vidrio de boca esmerilada se deposita THF y se agrega el PVDF en una proporción de 8.4 ml de disolvente por cada 0.1 g de polímero. Se somete a agitación magnética durante 4 horas a una temperatura de 333 K; durante la siguiente hora, se reduce la temperatura a 313 K con el fin de agregar el H3PO2 conforme a lo descrito por Vilčiauskas y colaboradores [13] para evitar que el ácido se desproporcione térmicamente por encima de los 323 K. La solución se agita magnéticamente por 2 horas a 313 K. Para evitar la evaporación del solvente durante este proceso, se instaló en el balón de vidrio un condensador para mantener el volumen constante durante todo el proceso.
Las soluciones se depositan en Petri de vidrio y se ubican en un desecador a baja humedad (RH < 30%), el cual contiene sílica gel para evaporar el solvente y el excedente de agua. Finalmente se obtienen membranas aparentemente secas con espesores entre 90-115 µm.
2.3. Análisis térmico
2.3.1. Análisis por calorimetría diferencial de barrido (DSC) y termogravimetría (TGA)
Para los análisis de DSC se utilizó un calorímetro DSC Q2000 marca TA-Instruments, en un rango de temperatura entre 233 K y 773 K, con una rata de calentamiento de 10 K/min, con nitrógeno como gas de purga. Se utilizaron porta muestras de aluminio selladas con muestras entre 3 mg y 3,5 mg. Para los Análisis de TGA, se utilizó un analizador termogravimétrico TGA Q500 marca TA-instruments, en un rango de temperatura entre 298 K y 973 K con una rata de calentamiento de 10 K/min, se utilizó nitrógeno como gas de purga y portamuestras de aluminio con muestras entre 3 mg y 3,5 mg. El análisis de los termogramas se realizó con el software Universal Analysis 2000.
2.4. Análisis espectrometría de masas (MS)
Estos análisis se realizaron en un espectrómetro de masa cuadrupolar MS Discovery, el cual tiene una capacidad de rango de masas de 1-300, sensibilidad mayor de 0.005 unidad de masa atómica (uma), fuente de ionización menor de 100 ppb, con temperatura de línea de transferencia de 300°C. Este sistema funciona como sistema recolector de muestras acoplado con el TGA.
3. Resultados y discusión
3.1. Calorimetría diferencial de barrido (DSC)
Los termogramas de DSC de la Fig. 1, muestran las anomalías encontradas entre 233 K y 733 K, en una membrana de PVDF puro y en las diferentes combinaciones analizadas del sistema PVDF/H3PO2. En la membrana de PVDF puro, pueden observarse dos anomalías: la primera en forma de pico endotérmico (hacia abajo) a una temperatura de 433 K, atribuida a la fusión de la fase cristalina del polímero o Tm, [14-17]. La segunda anomalía por encima de 670 K, es atribuida a la degradación del polímero PVDF. El hombro observado en la anomalía de 433 K, se atribuye al efecto del solvente (THF) utilizado en el proceso de elaboración de las membranas.
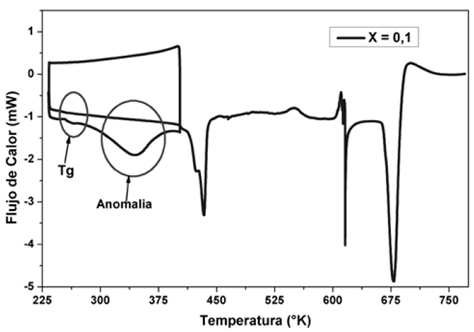
Figura 1: Termogramas de DSC para diferentes concentraciones X de H3PO2 en PVDF (X=0,0; 0,1; 0,3; 0,5), entre 233 K y 773 K.
En los termogramas de la Fig. 1, también se pueden observar nuevas anomalías en forma de picos para las membranas de polímero PVDF que contienen H3PO2. La primera anomalía endotérmica, entre 330 K y 380 K, se puede asociar posiblemente a la perdida de agua superficial en la membrana, ya que, por efecto H3PO2, este sistema se torna higroscópico, lo que puede corroborarse con los análisis de MS / TGA, mostrados en la Fig. 5, en los que las pérdidas de masa del complejo polimérico corresponden a la unidad de masa atómica de agua (ver tabla 3). Además, un segundo barrido de DSC entre 233 K y 403 K, inmediatamente después de un primer barrido mostrado en la Fig. 2, no presenta esta anomalía lo que confirma que el contenido de agua superficial en las membranas se ha evaporado por el primer calentamiento.
Figura 2: Segundo barrido de DSC, para la membrana de (PVDF/H3PO2) con concentración acida de X=0,1
El pico endotérmico observado en los termogramas de la Fig. 1 alrededor de 433 K, fue asociado a la fusión de fase cristalina de PVDF, esto también se presenta para las tres concentraciones de ácido analizadas en la combinación PVDF/H3PO2. La tercera anomalía exotérmica, la cual se presenta entre temperaturas de 600 K hasta 650 K, es asociada a interacciones entre H3PO2 y PVDF, este hecho se puede deducir del termograma de TGA (Fig. 4) donde se observa pérdida de masa alrededor de dichas temperaturas. Por último, se observa una cuarta anomalía endotérmica alrededor de 660 K hasta 700 K para las concentraciones de X=0,1 y X=0,3 que se asocia a la de degradación de las membranas de PVDF/H3PO2. Esta anomalía no se presenta para la concentración de X=0,5. En la tabla 2, se relacionan las concentraciones de ácido (X) de las membranas utilizadas para este análisis, las temperaturas en las que se observa cada una de estas anomalías y la variación de entalpía (Δh). Como puede observarse en la figura 1 la anomalía correspondiente a la fusión de la fase cristalina del PVDF (433 K) disminuye su intensidad a medida que la concentración de H3PO2 se incrementa, lo que también puede verse en el decrecimiento de los valores de entalpía correspondientes, mostrados en la tabla 1. Esto indica que la fase cristalina del PVDF decrece con la concentración de H3PO2 mientras se incrementa su fase amorfa [18].
Fuente: Los autores.Tabla 1: Membranas de PVDF/H3PO2 a diferentes concentraciones de ácido y espesor obtenido.
Fuente: Los autores.Tabla 2: Entalpías para el complejo (PVDF/H3PO2) a diferentes concentraciones (X) de ácido.
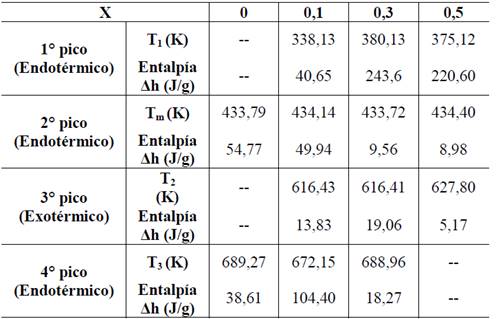
En la Fig. 3 se presentan termogramas de DSC en un rango de temperaturas entre 230 y 300 K para las combinaciones del sistema PVDF/H3PO2. El escalón observado en este rango es característico de la transición vítrea (Tg) de las membranas. Como puede observarse en el termograma correspondiente a la membrana de PVDF puro, no se observa el escalón característico de la Tg ya que según otros estudios, esta transición se reporta a una temperatura inferior a este rango [19,20]. Para las membranas con diferentes concentraciones de ácido, se observa un corrimiento de la Tg entre 252 K y 259 K, este fenómeno es un indicativo de que se ha formado un nuevo complejo polimérico al adicionar H3PO2 al polímero PVDF.
Figura 3: Termograma (DSC), para la membrana de (PVDF/H3PO2), entre 230 y 300 K.
3.2. Termogravimetría (TGA)
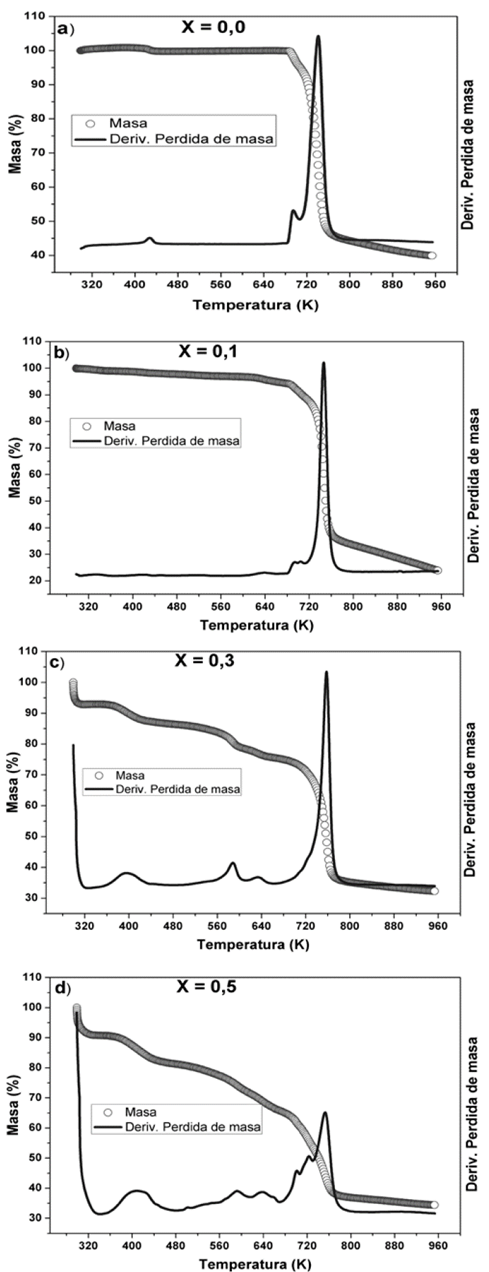
En la Fig. 4, se pueden observar los termogramas de TGA del complejo polimérico PVDF/H3PO2 con diferentes concentraciones de ácido. Las curvas de TGA muestran el porcentaje de masa perdido en función de la temperatura, además se puede identificar las temperaturas donde ocurre la máxima pérdida en la derivada de dicha perdida. Como se puede observar en el primer termograma (Fig. 4 a), la cual corresponde a PVDF puro, presenta dos perdidas, la primera de 0,4% desde 298 K hasta 472 K y la segunda 60,1% a partir de 729 K hasta 753 K, lo que indica que el PVDF es estable hasta 729 K aproximadamente.
Figura 4: Termogramas TGA para membranas de: a) PVDF puro y el complejo polimérico PVDF/H3PO2 b) X=0,1; c) X=0,3 y d) X=0,5.
En los termogramas de las figuras 4b, 4c y 4d; se observan cuatro variaciones significativas del porcentaje de masa del nuevo complejo polimérico PVDF/H3PO2. La primera pérdida de masa, aproximadamente a 298 K, la cual está presente en todas las concentraciones, se incrementa conforme aumenta la concentración de ácido, lo que se atribuye a la pérdida de agua superficial. La segunda pérdida de masa, es observada en todas las concentraciones se presenta alrededor de 370 K, en la cual también aumenta su porcentaje de pérdida de masa, conforme aumenta su concentración de ácido. Esta pérdida se puede atribuir a la evaporación de moléculas de agua absorbidas por la membrana y que de alguna forma están atrapadas dentro de las cadenas del polímero [12,21].
La tercera pérdida de masa, se presenta alrededor de 580 K, el porcentaje de pérdida de masa no es proporcional a la concentración de ácido y se asocia a una reacción del ácido hipofosforoso (H3PO2) a altas temperaturas, según lo reportado por L. Vilčiauskas y colaboradores [13]. Finalmente, se presenta la cuarta pérdida de masa aproximadamente a 700 K, la cual se asocia a la degradación total del complejo polimérico (PVDF/H3PO2).
3.3. Espectrometría de masa (MS)
Se realizó MS a membranas de (PVDF/H3PO2) con concentraciones de X=0,3 y X=0,5. En las dos muestras se registraron 14 moléculas, que se identificaron por la relación carga-masa (m/z) propuestas en la tabla 3, junto con las temperaturas en las que se presentó el máximo desprendimiento de estas moléculas. En la Fig. 5, se presenta el espectro de MS para el complejo (PVDF/H3PO2) con una concentración de ácido de X=0,3.
Fuente: Los autores.Tabla 3: Relación carga-masa de todos los elementos desprendidos del complejo polimérico (PVDF/H3PO2).

Figura 5: a) y b): Espectros de MS acoplados a TGA como función de la temperatura para el complejo polimérico (PVDF/H3PO2) para la concentración de ácido X=0,3
Se detectó la presencia de moléculas de hidrógeno, grupo metilo (CH3) y vinilo etenilo (C2H3). A baja temperatura (<373 K) se presenta el posible desprendimiento de grupos hidroxilos (OH), oxigeno, acetileno (C2H2), formaldehído (CH2O), agua (H2O) y ethynol (C2H2O); la presencia de agua es atribuida a la higroscopicidad del ácido, que hace que se forme una capa superficial de agua en la membrana. A temperaturas intermedias (373 K - 676 K) se detectó la posible presencia de moléculas de acetileno (C2H2) y fosforo (P), también se detectó la presencia de agua. Por último, a temperaturas superiores a 673 K, donde se presenta la degradación total del complejo, se detectó una presencia fuerte de la mayoría de las moléculas.
Las moléculas observadas con MS para la concentración X=0,3 también se presentan para la concentración X=0,5 y se reportan en la tabla 3, junto con las temperaturas a las cuales se presenta su desprendimiento.
Como se evidenció mediante TGA y MS, la presencia de moléculas de agua a diferentes temperaturas sugiere, que se forma una capa superficial de agua y se evapora por debajo de 373 K, también se forman moléculas de agua internamente en la membrana del complejo polímero-acido, las cuales se desprenden entre 403 K a 423 K. Por último, se evidencia la formación de agua estructural en el complejo polímero-acido, donde estas moléculas se desprenden a temperaturas superiores de 703 K. Los picos máximos que indican los desprendimientos de moléculas de agua, son coincidentes con las pérdidas de masa mostradas por el TGA. La inestabilidad térmica ocasionada por la pérdida de agua superficial (temperatura < 370 K) en las membranas PVDF/H3PO2, puede minimizarse adicionando nanopartículas inertes en el sistema durante el proceso de preparación. Diferentes investigaciones muestran que electrolitos sólidos poliméricos, mejoran sus propiedades térmicas y mecánicas sin afectar las propiedades conductoras de iones [22,23].
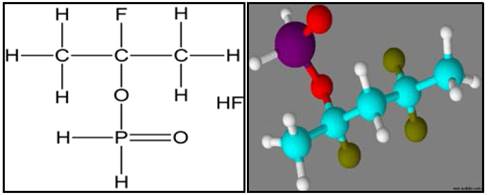
La posible presencia de moléculas de (C2H2O) y ácido fluorhídrico (HF), plantea la posibilidad de que el ácido hipofosforoso (H3PO2) perdió el hidrógeno de su grupo hidroxilo (OH) y se enlazó a la cadena polimérica del PVDF desplazando un átomo de flúor (F), formando así la molécula de ácido fluorhídrico (HF) presente en los espectrogramas de masas. La Fig. 6, muestra la posible estructura del complejo PVDF/H3PO2 en la que se observa en color cian los átomos de carbono, color rojo los átomos de oxígeno, verde oliva los átomos de flúor, en violeta el átomo de fosforo y por último en color blanco los átomos de hidrógeno. La forma de la cadena polimérica corresponde a la fase cristalina β [16], ya que la membrana se formó a una temperatura inferior de 343 K en presencia de solvente.
Figura 6: Posible estructura molecular del nuevo complejo polimérico (PVDF/H3PO2).
4. Conclusiones
Los análisis de DSC, muestran el corrimiento del escalón característico de la transición vítrea (Tg) alrededor de 254 K para las membranas de PVDF/H3PO2. Este fenómeno indica que se ha formado un nuevo electrolito polimérico al adicionar ácido hipofosforoso (H3PO2) al polímero (PVDF).
El decrecimiento observado en el pico correspondiente a la Tm o fusión de la fase cristalina del PVDF conforme aumenta la concentración de ácido, indica un decrecimiento en la fracción de la fase cristalina y un incremento en la fase amorfa de las membranas PVDF/H3PO2.
Los análisis TGA muestran diferentes pérdidas de masa en las membranas de PVDF/H3PO2, a diferentes temperaturas, lo que evidencia la existencia de humedad superficial que se desprende con facilidad a temperatura de 298 K. También se observa desprendimiento de moléculas de agua a mayor temperatura debido al carácter hidrofilico que le proporciona el H3PO2 al polímero, esto sugiere que las moléculas de agua quedan atrapadas en las cadenas del polímero. Esta hipótesis se puede soportar con los resultados de TGA acoplado a MS, donde se observa dicho desprendimiento a temperaturas superiores de 400 K.
Los análisis de TGA, muestran pérdidas de masa considerables a temperaturas superiores de 373 K, lo que indica que las membranas del sistema PVDF/H3PO2 son estables térmicamente hasta este valor.
La presencia de moléculas de agua que se desprenden a diferentes temperaturas, de acuerdo a los análisis de TGA y MS, sugieren que existe una capa superficial de agua, la cual se desprende por debajo de 373 K. También hay moléculas de agua en el interior de la membrana de PVDF/H3PO2, la cual se desprende a 370 K aproximadamente. Por último, se evidencia la formación de agua estructural en el sistema polímero-acido, donde estas moléculas se desprenden a temperaturas superiores de 703 K. También, la posible presencia de moléculas de (C2H2O) y ácido fluorhídrico (HF), plantea la posibilidad de que el sistema PVDF/H3PO2 se formó cuando H3PO2 perdió el hidrógeno de su grupo hidroxilo (OH) y se enlazó a la cadena polimérica del PVDF desplazando un átomo de flúor (F).
Agradecimientos
Agradecemos a la Universidad del Tolima por la financiación de este trabajo mediante proyectos con códigos 290214 y 310114, a través de la oficina central de investigaciones, al laboratorio de investigación en análisis térmico de la Universidad Autónoma de Occidente por su colaboración y al grupo de química aplicada a procesos ecológicos de la Universidad del Tolima QUAPE por sus aportes.
Referencias
Referencias
Smitha, B., Sridhar, S. and Khan, A.A., Solid polymer electrolyte membranes for fuel cell applications - A review, J. Memb. Sci. 259, pp. 10-26, 2005. DOI: 10.1016/j.memsci.2005.01.035.
Renzi, M., Agostini, M., Navarra, M.A. and Nobili, F., An innovative membrane-electrode assembly for efficient and durable polymer electrolyte membrane fuel cell operations, Int. J. Hydrogen Energy, 42, pp. 16686-16694, 2017. DOI: 10.1016/j.ijhydene.2017.05.168.
Krishnan, N.N., Henkensmeier, D., Park, Y.H., Jang, J.H., Kwon, T., Koo, C.M., Kim, H.J., Han, J. and Nam, S.W., Blue membranes: Sulfonated copper(II) phthalocyanine tetrasulfonic acid based composite membranes for DMFC and low relative humidity PEMFC, J. Memb. Sci. 502, pp. 1-10, 2016. DOI: 10.1016/j.memsci.2015.12.035.
Noponen, T. and Kohonen, A., An alternative concept for DMFC - Combined electrolyzer and H2 PEMFC, International Journal of Hydrogen Energy. 41, pp. 2154-2164, 2016. DOI: 10.1016/j.ijhydene.2015.12.007.
Alvarado-Flores, J., Estudio comparativo de las diferentes tecnologias de celdas de combustible, Bol. La Soc. Esp. Ceram. Y Vidr, 52, pp. 105-117, 2013. DOI: 10.3989/cyv.142013.
Jeon, S.W., Cha, D., Kim, H.S. and Kim, Y., Analysis of the system efficiency of an intermediate temperature proton exchange membrane fuel cell at elevated temperature and relative humidity conditions, Appl. Energy, 166, pp. 165-173, 2016. DOI: 10.1016/j.apenergy.2015.12.123.
Clochard, M.C., Berthelot, T., Baudin, C., Betz, N., Balanzat, E., Gébel, G. and Morin, A., Ion track grafting: A way of producing low-cost and highly proton conductive membranes for fuel cell applications, J. Power Sources, 195, pp. 223-231, 2010. DOI: 10.1016/j.jpowsour.2009.07.016.
Zakil, F.A., Kamarudin, S.K. and Basri, S., Modified Nafion membranes for direct alcohol fuel cells: An overview, Renewable and Sustainable Energy Reviews, 65, pp. 841-852, 2016. DOI: 10.1016/j.rser.2016.07.040.
Vargas, M.A., Vargas, R.A. and Mellander, B., More studies on the PVAl+H3PO2+H2O proton conductor gels, Electrochimica, 45, pp. 1399-1403, 2000.
Fernández, M.E., Murillo, G., Vargas, R.A., Peña Lara, D. and Diosa, J.E., Improvement of Proton-Exchange Membranes Based on (1−x)(H3PO2/PVA)-xTiO2, Ingeniería y Ciencia, 13, pp. 153-166, 2017. DOI: 10.17230/ingciencia.13.25.6.
Byun, J., Sauk, J. and Kim, H., Preparation of PVdF/PSSA composite membranes using supercritical carbon dioxide for direct methanol fuel cells, Int. J. Hydrogen Energy, 34, pp. 6437-6442, 2009. DOI: 10.1016/j.ijhydene.2009.06.025.
Vásquez-Bonilla, R.A., Síntesis y caracterización de conductores protónicos polifluoruro de vinilideno/ácido hipofosforoso (PVDF/H3PO2), Tesis (MSc. Ciencia-Física), Universidad del Tolima, Ibagué, Colombia, 2015, 46 P.
Vilčiauskas, L., De Araujo, C.C. and Kreuer, K.D., Proton conductivity and diffusion in molten phosphinic acid (H3PO2): The last member of the phosphorus oxoacid proton conductor family, Solid State Ionics, 212, pp. 6-9, 2012. DOI: 10.1016/j.ssi.2012.02.019.
Muniyandi, N., Kalaiselvi, N., Periyasamy, P., Thirunakaran, R., Ramesh, B., Gopukumar, S., Premkumar, T., Renganathan, N.G. and Raghavan, M., Optimisation of PVdF-based polymer electrolytes, J. Power Sources, 96, pp. 14-19, 2001.
Shen, Y.J., Reddy, M.J., Chu, P.P. Porous PVDF with LiClO 4 complex as d solid T and d wet T polymer electrolyte, Solid State Ionics, 175, pp. 747-750, 2004. DOI: 10.1016/j.ssi.2003.10.020.
Tornga, S.C., Yang, D., Orler, B. and Welch, C., Aging of poly (vinylidene fluoride) hollow fibers in light hydrocarbon environments environments, J. Memb. Sci., 409-410, pp. 302-317, 2012. DOI: 10.1016/j.memsci.2012.03.067.
Jia, N., He, Q., Sun, J., Xia, G. and Song, R., Crystallization behavior and electroactive properties of PVDF, P(VDF-TrFE) and their blend fi lms, Polym. Test., 57, pp. 302-306, 2017. DOI: 10.1016/j.polymertesting.2016.12.003.
Baskaran, R., Selvasekarapandian, S., Kuwata, N., Kawamura, J., Hattori, T., ac impedance, DSC and FT-IR investigations on (x) PVAc –( 1 − x ) PVdF blends with LiClO4, Mater. Chem. Phys., 98, pp. 55-61, 2006. DOI: 10.1016/j.matchemphys.2005.08.063.
Polu, A.R. and Rhee, H., Ionic liquid doped PEO-based solid polymer electrolytes for lithium-ion polymer batteries, Int. J. Hydrogen Energy, 42, pp. 7212-7219, 2017. DOI: 10.1016/j.ijhydene.2016.04.160.
Singha, S. and Jana, T., Effect of composition on the properties of PEM based on polybenzimidazole and poly (vinylidene fluoride) blends, Polymer (Guildf), 55, pp. 594-601, 2014. DOI: 10.1016/j.polymer.2013.12.021.
González-Trujillo, Y.F. y Vargas-Zapata, R.A., Estudio de las propiedades termodinámicas y eléctricas de materiales compuestos póliméricos basados en el poli(vinil alcohol) (PVA) + H3PO2 + TiO2, Rev. Iberoam. Polímeros, 12, pp. 64-75, 2011.
Hezma, A.M., Elashmawi, I.S., Abdelrazek, E.M., Rajeh, A. and Kamal, M., Enhancement of the thermal and mechanical properties of polyurethane/polyvinyl chloride blend by loading single walled carbon nanotubes, Prog. Nat. Sci. Mater. Int., 27, pp. 338-343, 2017. DOI: 10.1016/j.pnsc.2017.06.001.
Lin, Y., Jia, Y., Alva, G. and Fang, G., Review on thermal conductivity enhancement, thermal properties and applications of phase change materials in thermal energy storage, Renew. Sustain. Energy Rev., 10, pp. 1-13, 2017. DOI: 10.1016/j.rser.2017.10.002.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Jolman Stiven Díaz Ortiz, Miguel Iban Delgado Rosero, N. M. Jurado Meneses. (2023). Electrical Properties of Polyvinylidene fluoride‐H3PO2 Protonic Conductor; a Novel Electrolyte for Use in Fuel Cells. physica status solidi (a), 220(9) https://doi.org/10.1002/pssa.202200614.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2018 DYNA

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
El autor o autores de un artículo aceptado para publicación en cualquiera de las revistas editadas por la facultad de Minas cederán la totalidad de los derechos patrimoniales a la Universidad Nacional de Colombia de manera gratuita, dentro de los cuáles se incluyen: el derecho a editar, publicar, reproducir y distribuir tanto en medios impresos como digitales, además de incluir en artículo en índices internacionales y/o bases de datos, de igual manera, se faculta a la editorial para utilizar las imágenes, tablas y/o cualquier material gráfico presentado en el artículo para el diseño de carátulas o posters de la misma revista.