Evaluación del efecto genotóxico y mutagénico en linfocitos humanos expuestos a nanotubos de carbono modificados
Evaluation of the genotoxic and mutagenic effect in human lymphocytes exposed to modified carbon nanotubes
DOI:
https://doi.org/10.15446/dyna.v85n205.68767Palabras clave:
nanotubos de carbono, genotoxicidad, pruebas de mutagenicidad, linfocitos (es)carbon nanotubes, genotoxicity, mutagenicity tests, lymphocytes (en)
Recibido: 8 de noviembre de 2017; Revisión recibida: 27 de abril de 2018; Aceptado: 16 de mayo de 2018
Resumen
Objetivo: evaluar efecto genotóxico y mutagénico en linfocitos humanos expuestos a nanotubos de carbono (NTC) prístinos y dopados con Nitrógeno. Métodos: linfocitos humanos fueron expuestos a NTC dopados y prístinos (0.08, 0.09, 0.1mg/mL), se evaluó alteraciones cromosómicas e intercambio de cromátidas hermanas (ICH). Resultados: se presentaron rupturas cromatídicas y cromosómicas en linfocitos expuestos a 0.1mg/mL y 0.08mg/mL de NTC prístinos. NTC dopados, indujeron cromosomas dicéntricos y anillos cromosómicos. Se presentó diferencia significativa en el porcentaje de ICH de células tratadas con NTC dopados versus control negativo y NTC prístinos (p<0.0001). Conclusión: la concentración más alta de NTC prístinos indujo daños cromatídicos y cromosómicos; aunque el porcentaje de la población con daño fue inferior al 10%, se consideran perjudiciales para las células. Linfocitos tratados con NTC dopados presentaron menores porcentajes de AC y altos valores en ICH, lo que muestra mayor reparación de material genético con estos compuestos.
Palabras clave:
nanotubos de carbono, genotoxicidad, pruebas de mutagenicidad, linfocitos.Abstract
Objective: evaluate the genotoxic and mutagenic effect in human lymphocytes exposed to pristine and N-doped carbon nanotubes. Methods: Methods: human lymphocytes were exposed to pristine and N-doped carbon nanotubes (NTC) (0.08, 0.09, 0.1mg/mL). Sister chromatid exchange (SCE) and chromosomal alterations (CA) tests were evaluated. Results: chromatid breaks and chromosomal breaks (double strand breaks) were identified in lymphocytes exposed to 0.1 and 0.08 mg/mL of the pristine CNT. N-doped CNT, induced dicentric chromosomes and chromosomal rings. There was significant difference in the percentage of SCE of cells treated with doped NTC versus negative control and pristine NTC (p<0.0001). Conclusion: the highest concentration of pristine CNTs induced the most chromatid and chromosomal damage. Although the percentage was less than 10%, such degree of damage is considered harmful to cells. Lymphocytes treated with N-doped CNT presented lower percentages of CA and high percentage of SCE, which shows a greater repair of genetic material with these compounds.
Keywords:
carbon nanotubes, genotoxicity, mutagenicity tests, lymphocytes.1. Introducción
Los nanotubos de carbono (NTC) son estructuras polares, hidrófobas e insolubles, miden entre 1 y 100 nm, fueron sintetizados originalmente por Sumio Lijima en 1919 como cilindros de grafeno relacionados con el fullereno y consisten en una matriz hexagonal de átomos de carbono que son enrollados por capas; dependiendo del número de éstas, pueden ser nanotubos de carbono de pared simple (NTCPS), si sólo tienen una capa, y nanotubos de carbono de pared múltiple (NTCPM), si tienen más de dos capas[1-6]. En su estado puro o prístino, los NTC son químicamente inertes e incompatibles con la mayoría de solventes orgánicos, por lo que suelen ser funcionalizados de forma covalente a través del tratamiento con ácidos, o de forma no covalente por medio de la interacción con ciertas proteínas, ácido desoxirribonucleico (ADN), surfactante u otros polímeros [7-10].
Su modificación permite aprovechar al máximo todas sus propiedades. La funcionalización es un conjunto de reacciones químicas mediante las cuales los grupos funcionales se unen covalentemente a la pared del tubo. Los grupos funcionales hacen que los CNT sean biocompatibles a diferencia de los nanotubos no modificados (prístinos) [11]. Otro método alternativo para cambiar la estructura del nanotubo se realiza mediante reacciones de sustitución, también conocidas como dopaje, donde otros átomos de diferentes electrones de valencia (nitrógeno o boro) reemplazan los átomos de carbono en el nanotubo. Estas sustituciones generalmente cambian el estado de equilibrio de los nanotubos de carbono y la morfología y reactividad química cuando se usa nitrógeno como agente dopante. Los nanotubos dopados con nitrógeno son extremadamente fuertes [12,13].
La funcionalización y el dopaje de los NTC pristinos, aumentan su solubilidad y abren un conjunto de nuevas propiedades que permiten usarlos en medicina en diagnósticos, agentes de administración de fármacos y dispositivos implantables, entre otros [1-5,7,8,14,16].
Múltiples estudios a nivel mundial han reportado el daño genotóxico y mutagénico en diferentes líneas celulares por exposición a NTC y en individuos por exposición accidental [3,7,10,17-19]. Incluso algunos de ellos han catalogado los NTC como posibles agentes carcinógenos [5,18,20-22]. Sin embargo, los resultados siguen siendo contradictorios, pues otras investigaciones no han encontrado que se produzca un daño significativo sobre el material genético expuesto a los NTC [3-5]. Dentro de las razones para justificar los diferentes hallazgos se encuentra el tipo de ensayo empleado para evaluar la genotoxicidad, la longitud y diámetro de las fibras de carbono utilizadas, propiedades y reacciones causadas sobre su superficie, tendencia a aglomerarse, dispersabilidad en el medio, funcionalización, mayor proporción de grupos ácidos que básicos y presencia de impurezas, entre otras [1,7,10,16,19,23].
Por su fácil obtención, la sangre venosa se ha convertido en uno de los tejidos más utilizados para los estudios de alteraciones cromosómicas, siendo los leucocitos y en especial los linfocitos T, las células a partir de las cuales es posible realizar la obtención cromosómica y aplicación de ensayos de citotoxicidad y genotoxicidad inducida por diferentes compuestos [18,19,20]. El objetivo del presente artículo es describir la evaluación del efecto genotóxico y mutagénico en linfocitos humanos expuestos a NTC prístinos y dopados con nitrógeno (NTC-N), mediante los ensayos de aberraciones cromosómicas (AC) e intercambio de cromátidas hermanas (ICH) con el fin de comparar el efecto inducido por ambos tipos de NTCs.
2. Materiales y métodos
2.1. Nanotubos de Carbono
Para el desarrollo de este estudio fueron utilizados NTC, elaborados por deposición química de vapor en el laboratorio de síntesis y procesos especiales de la Universidad Pontificia Bolivariana. Todos los NTC fueron catalizados con cobalto, algunos fueron dopados con nitrógeno y otros permanecieron sin ser modificados (prístinos). Además, fueron purificados por microfiltración con 10% de ácido fluorhídrico y 1M de ácido clorhídrico. La caracterización se realizó mediante espectroscopia Raman, por resonancia magnética y microscopía electrónica de transmisión. A partir de 1mg/mL de NTC se realizaron diez diluciones seriadas con un rango de 0,01mg/mL, utilizando medio de cultivo RPMI-1640; este procedimiento se realizó con ambos tipos de nanotubos [24].
2.2. Valoración de viabilidad
Se realizó un análisis de viabilidad con concentraciones de NTC desde 0,1 mg/mL hasta 0,01 mg/mL con el fin de seleccionar concentraciones subletales para llevar a cabo los demás ensayos. La viabilidad celular se evaluó con azul de tripano y se corroboró por citometría de flujo. Los análisis de genotoxicidad y mutagenicidad se realizaron utilizando las tres concentraciones subletales 0,08, 0,09, 0,1 mg/mL de cada uno de los NTC (dopados y prístinos). Con el fin de evaluar la reproducibilidad de los resultados, se realizaron tres experimentos independientes de cada tratamiento [25].
2.3. Cultivo y tratamiento de linfocitos humanos
El cultivo se realizó a partir de 1mL de sangre heparinizada de un adulto sano, no fumador sin ningún tipo de tratamiento clínico, no deportista de alto rendimiento, quien firmó el consentimiento informado, aprobado por el Comité de Ética de la Escuela de Ciencias de la Salud (UPB). Los cultivos se mantuvieron en medio RPMI-1640 suplementado con 10% de suero bovino fetal (SBF), antibiótico (penicilina 1000U/mL - estreptomicina 100µg/mL) y fitohemaglutinina (PHA, 0,2g/mL), a 37°C y en una atmósfera de 5% CO2 por 56 horas [23, 31]. Posteriormente, los cultivos celulares fueron tratados con cada una de las concentraciones de ambos tipos de NTC (0,08, 0,09, 0,1 mg/mL) durante 24 horas. Como control negativo se utilizó medio de cultivo RPMI-1640 y como control positivo se usó Mitomicina C (MMC, 10µg/mL).
2.4. Obtención de extendidos cromosómicos
Al finalizar el tiempo de tratamiento, se obtuvieron los extendidos cromosómicos según el protocolo de Speit et al. [24], 1985 y Mamur et al., 2012[26]. En resumen, dos horas antes de la obtención de los extendidos cromosómicos, se agregó el antimitótico Colcemid (10µg/mL). Posteriormente, las muestras se homogenizaron y centrifugaron a 1200 rpm por 7 minutos, luego se hizo tratamiento hipotónico con KCl (0,075M). Las células se fijaron con Carnoy (Metanol - Ácido Acético, 3:1) por 15 minutos a temperatura ambiente. Luego de lavar las muestras con fijador, se obtuvieron los extendidos cromosómicos para la coloración diferencial de cromátidas hermanas con un pretratamiento con solución Hoechst 33258 (0,05mg/mL) durante 10 minutos, para luego iluminarlas con luz directa a una temperatura de 65°C durante 20 minutos y finalmente, hacer la tinción con Giemsa (4%). De cada tratamiento se obtuvieron cuatro placas, dos para el análisis de AC y las otras dos para el conteo de ICH. Las lecturas fueron realizadas por una persona capacitada y entrenada durante un año y constantemente, el experto revisaba el trabajo.
2.5. Valoración de aberraciones cromosómicas (AC)
El análisis de AC fue realizado utilizando un microscopio de luz con un aumento 100X. Para cada muestra de NTC, dopados y prístinos, se obtuvo el índice mitótico realizando un conteo total de 500 células por placa, equivalente a 2000 células por muestra, pues por cada muestra se prepararon 4 placas. La evaluación de las aberraciones cromosómicas se realizó mediante el conteo de 100 células en metafase 1 (M1) en cada una de las placas, haciendo especial énfasis en la presencia de alteraciones estructurales en los cromosomas (quiebres cromatídicos (B), quiebres cromosómicos (BB), cromosomas dicéntricos (DC), cromosoma en anillo (R) y figuras multirradiales (MR). El daño basal en un individuo sano ha sido reportado entre 2 y 5% [26].
2.6. Valoración de intercambio de cromátidas hermanas
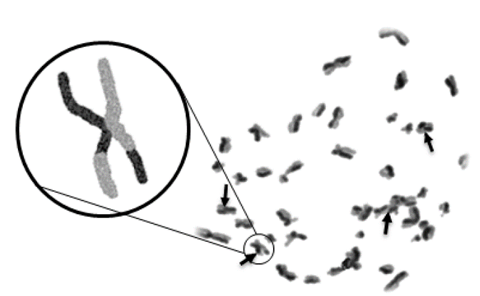
El análisis de ICH se hizo mediante el conteo de 50 células en metafase 2 (M2) por tratamiento. Para cada una de ellas se contó el número total de ICHs presentes en células mitóticas. La frecuencia de ICH en un individuo sano ha sido previamente establecida entre 5 y 7 intercambios en un total de 30 células [27]. En la Fig. 1 se ilustra el intercambio entre las cromátidas hermanas.
Figura 1: Intercambio de cromátidas hermanas en linfocitos humanos expuestos a NTC. Como control negativo se usó medio RPMI-1640, cada una de las flechas señala un intercambio de cromátidas hermanas.
2.7. Análisis estadístico
El análisis estadístico fue realizado utilizando el paquete estadístico IBM SPSS versión 23. Se realizaron las pruebas de normalidad de Kolmogorov-Smirnov, D'Agostino y Pearson Omnibus o Shapiro Wilk, para determinar el tipo de análisis estadístico a utilizar. Los resultados obtenidos de las pruebas de AC e ICH fueron analizados con la prueba no paramétrica Chi-cuadrado (X2), debido a la poca cantidad de daño encontrado en el ADN evaluado, se analizó esta variable de forma cualitativa, estimando frecuencias relativas.
3. Resultados
3.1. Aberraciones cromosómicas
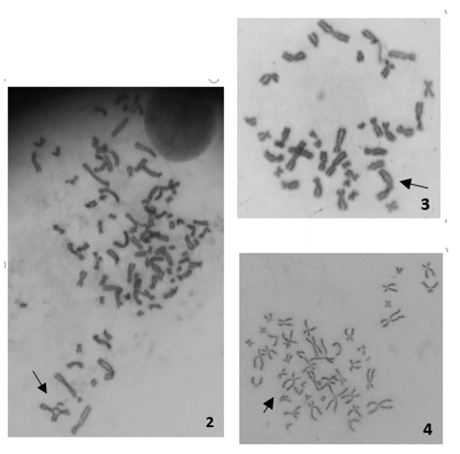
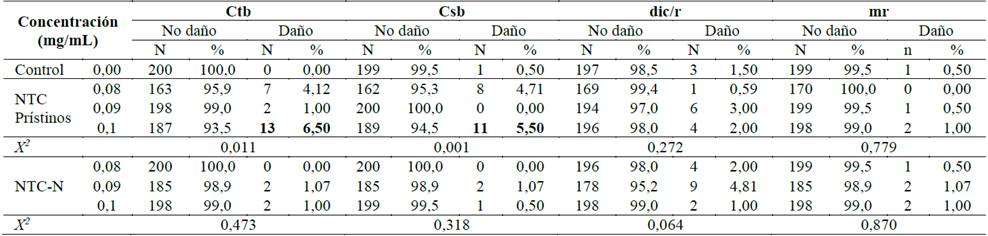
En las Figs. 2-4 se muestran las aberraciones cromosómicas encontradas en linfocitos humanos tratados con concentraciones subletales de NTC-N y prístinos [0,08, 0,09 y 0.1mg/mL] durante 24 horas. Los NTC prístinos presentaron 13 (6,5%) quiebres cromatídicos y 11 (5,5%) quiebres cromosómicos, a la concentración de 0,1 mg/mL; evidenciándose una diferencia estadísticamente significativa, cuando fueron comparados con el control negativo, con un valor p de 0,011 y 0,001, respectivamente.
Figuras 2, 3 y 4: Aberraciones cromosómicas observadas en cromosomas obtenidos a partir de linfocitos humanos expuestos a NTC (Figura 2: figura multirradial, Figura 3: cromosoma dicéntrico, Figura 4: quiebre cromatídico).
El porcentaje de quiebres cromatídicos y cromosómicos expuestos a bajas concentraciones de NTC prístinos [0,08 y 0,09 mg/mL] fue también significativo cuando se comparó con el control negativo.
Con respecto a los NTC dopados con nitrógeno no se encontró una diferencia estadísticamente significativa para ningún tipo de daño, cuando se comparó con el control negativo y las concentraciones subletales.
Fuente: los autores.Tabla 1: Aberraciones cromosómicas identificadas en linfocitos humanos expuestos durante 24h a NTC dopados con nitrógeno y pristinos. ctb: quiebre cromatídico, csb: quiebre cromosómico, dic: cromosoma dicéntrico, r: anillo y mr: figura multiradial (por sus siglas en ingles). Como control negativo se utilizó RPMI-1640, el control positivo correspondio a mitomicina-c (10µM) y las concentraciones de los NTC fueron 0,08, 0,09 y 0,1mg/mL.
3.2. Intercambio de cromátidas hermanas
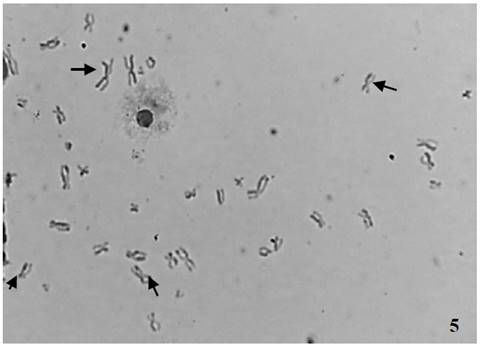
Los NTC dopados con N indujeron una cantidad estadísticamente significativa de ICH (Fig. 5) con las tres concentraciones utilizadas, en comparación con el control negativo, mientras que las células expuestas a NTC prístinos presentaron un aumento significativo en el número de ICH para la concentración 0.09mg/mL (p = 0,0001) (Tabla 2 y Fig. 6).
Figura 5: Intercambio de cromátidas hermanas en linfocitos humanos expuestos a NTC.
Fuente: los autores.Tabla 2: Intercambio de cromátidas hermanas en linfocitos humanos expuestos a NTC prístinos y NTC-N durante 24h. (Min: valor mínimo, Max: valor máximo, X : media, DE: desviación estándar, M: mediana). Como control negativo se usó RPMI-1640 y como control positivo Mitomicina-C (10µM). Valor p < 0,0001 para ambos tipos de NTC.
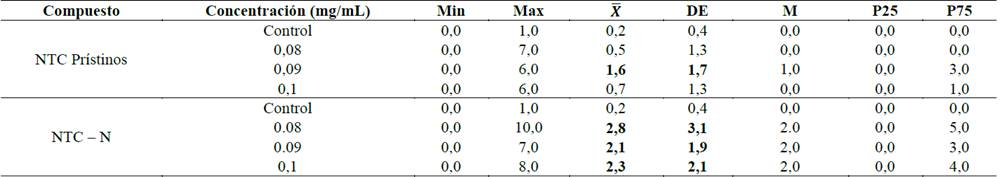
Figura 6: ICH en linfocitos humanos expuestos a NTC prístinos (barras negras) p<0,0001 y NTC-N (barras grises) p<0,0001. C-1 y C-2 corresponden al control negativo RPMI-1640.
4. Discusión
El conocimiento de la toxicidad inducida por los NTC al material genético es de suma importancia, pues el advenimiento de la nueva tecnología y de los nanomateriales a la industria biomédica y su utilización genera preguntas sobre el daño celular que estos pueden inducir. En la literatura biomédica se encuentra mucha controversia por los múltiples y diferentes resultados obtenidos en las investigaciones en el campo de la genotoxicidad y mutagenicidad, sin llegar a una conclusión clara y concisa relacionada con el daño en el material genético [22, 28], por lo que nuevos resultados relacionados con el tema ayudan a esclarecer los efectos propiamente dichos de estos compuestos.
En este estudio se evidenció daño cromatídico, cromosómico e ICH, posiblemente causados por la producción de especies reactivas de oxígeno (ERO) inducidas por el tratamiento con los NTC. Las principales especies reactivas de oxigeno inducidas por los NTC son radicales hidroxilo y anión superóxido, las cuales dañan el ADN [28, 29]. Trazas de los catalizadores hierro y cobalto usados en la síntesis de los NTC también pueden inducir la producción de radicales libres, generando daño indirecto sobre el ADN vía la reacción de Fenton [30]. Finalmente, la respuesta innata de la célula al tratamiento con los NTC, podría aumentar la producción de ERO con el efecto que estos causan sobre el ADN previamente mencionado.
La prueba de aberraciones cromosómicas realizada en linfocitos humanos expuestos a tres concentraciones subletales de NTC prístinos reveló que hubo una diferencia significativa (p = 0,001 y p = 0,011) correspondiente a rupturas cromosómicas y cromatídicas, respectivamente. La mayor concentración utilizada de NTC prístinos en este estudio, indujo daño a cromatídico y cromosómico, y aunque, el porcentaje de daño cromosómico se mantuvo por debajo del 10%, estos daños siguen siendo perjudiciales para la célula, debido a que ésta tiene una mayor capacidad de reparación de rupturas de una sola cadena, mientras que las roturas de doble cadena son más difíciles de reparar [2]. Estos daños provocados por los NTC prístinos podrían convertirse en mutaciones dado que las células afectadas no disminuyen su viabilidad, sino que, continúan el ciclo celular perpetuando el daño en el material genético.
El ensayo de intercambio de cromátidas hermanas (ICH) proporciona información sobre la reparación celular después de sufrir daño y refleja una lesión existente en el ADN. Los resultados de ICH obtenidos para las células tratadas con todas las concentraciones ensayadas de NTC dopados con nitrógeno (NTC N-dopados) mostraron una diferencia significativa en el porcentaje de ICH en comparación con el control negativo p <0,0001. Las células tratadas con NTC prístinos sólo mostraron una diferencia significativa cuando se empleó una concentración de 0,09 mg/mL en comparación con el control negativo con un valor p <0,001. Una posible causa en el aumento de ICH en linfocitos humanos expuestos a NTC N-dopados se podría explicar por la interacción que se presenta ente los NTC con el ADN mediante la formación de aductos estructurales [7].
Los aductos podrían formarse en toda la extensión de los NTC o en regiones estructurales defectuosas de los NTC que interactúan con el ADN [29]. Cabe señalar que los NTC N-dopados no indujeron ningún tipo de alteración cromosómica a las concentraciones evaluadas respecto al control negativo (p > 0,05). Con el fin de probar esta hipótesis, sería necesario realizar otra prueba para identificar el aducto de NTC que se une al ADN. Por otro lado, los NTC prístinos a una concentración 0,09 mg/mL causaron un aumento en el porcentaje de ICH en linfocitos humanos, esta misma concentración no induce rupturas cromosómicas y sólo induce un 1% de rupturas cromatídicas. Los NTC prístinos indujeron ICH de manera menos frecuente en comparación con los NCT N-dopados, posiblemente por el mismo mecanismo (formación de aductos). Sin embargo, estos hallazgos no son despreciables, pues según Orecchioni M et al. [30], hasta las más bajas concentraciones de NTC prístinos pueden generar activación en el sistema inmune del ratón provocando un proceso inflamatorio donde la única salida de las células dañadas por los NTC es la apoptosis [30]. Por otra parte, los NCT N-dopados tienen mayor interacción con el ADN debido a que la incorporación de nitrógeno aumenta su afinidad por el mismo [31], por lo tanto, es posible que los NTC N-dopados aumenten la formación de aductos con el ADN, reflejándose en el aumento de ICH.
La presencia de daño cromatídico en linfocitos humanos expuestos a NTC pristinos a una concentración de 0,09 mg/mL podría reflejarse en la frecuencia ICH para linfocitos humanos expuestos a esta misma concentración ya que como se indicó anteriormente el ICH refleja la presencia de una lesión del ADN [29]. El daño del ADN podría dar resultados variables dependiendo del tipo de célula utilizada, por ejemplo, K Szendi et al. (2008) [32], y Van Berlo et al. (2012) [2], no encontraron ICH con NTC en otras líneas celulares (CHO A88 y A549 células) diferente a los linfocitos humanos, lo que demuestra que cada línea celular tiene una susceptibilidad al daño en el material genético provocado por los NTC. Es así como Vales G et al. (2016) [5], lograron identificar que las células epiteliales pulmonares (BEAS-2B) eran más susceptibles al daño genético frente a otros tipos celulares, cuando eran expuestas de forma crónica a concentraciones de 0,02 mg/mL de NTC de pared múltiple; este estudio concluyó que la exposición crónica por más de 4 semanas a estas concentraciones inducen daños en el material genético que terminan en la expresión de protooncogenes involucrados en el cáncer de origen broncogénico, esto llama la atención, pues si los NTC logran generar estos fenómenos en las células pulmonares, también podrían generarlo en otras líneas celulares [5].
Los NTC pueden actuar como un agente de doble filo, por un lado, pueden disminuir la cantidad de agentes antioxidantes presentes en la célula y de esta manera generar daño en el ADN, pero también, por los defectos estructurales de los NTC pueden atrapar los ERO producidos por la célula, disminuyendo de esta manera el daño en el ADN [19, 33].
En conclusión, se evidenció daño en el ADN (quiebres en una o ambas cromátidas) y como la viabilidad celular no se vio alterada, estos daños pueden pasar a otras generaciones con la posibilidad de fijar mutaciones que pueden llevar a desarrollo de cáncer. Además, el ICH evidencia que los NTC N-dopados pueden tener mayor afinidad por el ADN debido a su modificación química, ya que éstos tienen átomos de nitrógeno incrustados en su red. Por consiguiente, existe la posibilidad de generar mutaciones que pasarían a generaciones futuras. Sin embargo, el estudio y conocimiento de los daños al material genético causado por los NTC da nuevas herramientas y conocimiento para la utilización de los nanomateriales, generando expectativas relacionadas con su uso y aprovechamiento en la industria biomédica.
A nivel mundial se han publicado múltiples estudios que reportan el daño genotóxico y mutagénico ocasionado por la exposición de diferentes líneas celulares a estos nanomateriales, por lo que es fundamental la realización de estudios que garanticen la seguridad de los mismos y los diferentes impactos sobre la salud de los individuos expuestos a ellos. De igual forma, al presentarse tanta controversia sobre la toxicidad de estos compuestos y sus diferentes modificaciones [18], no se puede excluir estos materiales como fuente de futuros tratamientos, instrumentos y posibles ayudas en el área de la bioingeniería y su aplicación a la medicina.
5. Conclusión
La concentración más alta de NTC prístinos indujo la mayor parte de daños cromatídicos y cromosómicos; aunque el porcentaje fue inferior al 10%, se consideran perjudiciales para las células. Los linfocitos tratados con NTC dopados presentaron menores porcentajes de AC y altos valores en el ICH, lo que muestra una mayor reparación de material genético con estos compuestos.
Agradecimiento
Los autores agradecen a la Universidad Pontifica Bolivariana por su apoyo en el desarrollo de esta investigación.
Los autores declaran no tener conflictos de interés.
Referencias
Referencias
Chatterjee, N., Yang, J., Kim, S., Woo, S. and Choi, J., Diameter size and aspect ratio as critical determinants of uptake, stress response, global metabolomics and epigenetic alterations in multi-wall carbon nanotubes. Carbon, 108, pp. 529-540, 2016. DOI: 10.1016/j.carbon.2016.07.031
Van Berlo, D., Clift, M.J., Albrecht, C. and Schins, R.P., Carbon nanotubes: an insight into the mechanisms of their potential genotoxicity. Swiss Med Wkly, 142, pp. 136-198, 2012. DOI: 10.4414/smw.2012.13698
Thurnherr, T., Brandenberger, C., Fischer, K., Diener, L., Manser, P., Maeder-Althaus, X., et al., A comparison of acute and long-term effects of industrial multiwalled carbon nanotubes on human lung and immune cells in vitro. Toxicol Lett [online]. 200(3), 2011. DOI: 10.1016/j.toxlet.2010.11.012. [Date of reference: June 07th of 2017]. Available at: http://www.sciencedirect.com/science/article/pii/S037 8427410017728?via%3Dihub
Al Moustafa, A.E., Mfoumou, E., Roman, D.E., Nerguizian, V., Alazzam, A., Stiharu, I., et al., Impact of single-walled carbon nanotubes on the embryo: a brief review. Int J Nanomedicine, 11, pp. 11, pp. 349-355, 2016. DOI: 10.2147/IJN.S96361
Vales, G., Rubio, L. and Marcos, R., Genotoxic and cell-transformation effects of multi-walled carbon nanotubes (MWCNT) following in vitro sub-chronic exposures. J Hazard Mater [online]. 306, 2016. DOI: 10.1016/j.jhazmat.2015.12.021. [Date of reference: June 07th of 2017]. Available at: http://europepmc.org/abstract/med/26736170
Lijima, S., Helical microtubules of graphitic carbon. Nature, 354, pp. 56-58, 1991. DOI: 10.1038 / 354056a0
Ursini, C.L., Cavallo, D., Fresegna, A.M., Ciervo, A., Maiello, R., Buresti, G., et al., Comparative cyto-genotoxicity assessment of functionalized and pristine multiwalled carbon nanotubes on human lung epithelial cells. Toxicol in Vitro, 26(6), pp. 831-840, 2012. DOI: 10.1016/j.tiv.2012.05.001
Lanone, S., Andujar, P., Kermanizadeh, A. and Boczkowski, J., Determinants of carbon nanotube toxicity, Adv Drug Deliv Rev [online]. 65(15), 2013. DOI: 10.1016/j.toxrep.2016.01.011. [Date of reference: June 07th of 2017]. Available at: http://www.sciencedirect.com/science/article/pii/S0169409X13001737?via%3Dihub
Nagaraju, K., Reddy, R. and Reddy, N., A review on protein functionalized carbon nanotubes. J Appl Biomater Funct Mater [online]. 13(4), 2015. DOI: 10.5301/jabfm.5000231. [Date of
reference: June 07th of 2017]. Available at: http://www.jab-fm.com/article/a-review-on-protein-functionalized-carbon-nanotubes
Vitkina, T.I., Yankova, V.I., Gvozdenko, T.A., Kuznetsov, V.L., Krasnikov, D.V., Nazarenko, A.V., et al., The impact of multi-walled carbon nanotubes with different amount of metallic impurities on immunometabolic parameters in healthy volunteers. Food Chem Toxicol, 87, pp. 138-147, 2016. DOI: 10.1016/j.fct.2015.11.023.
Ghosh, M., Chakraborty, A. and Mukherjee, A., Cytotoxic, genotoxic and the hemolytic effect of titanium dioxide (TiO2) nanoparticles on human erythrocyte and lymphocyte cells in vitro. J Appl Toxicol, 33(10), pp. 1097-1110, 2013. DOI: 10.1002/jat.2863.
Kuzmany H., Kukovecz A., Simon F., Holzweber M., Kramberger C. and Pichler T., Functionalization of carbon nanotubes, Synth. Met., 141(1), pp. 113-122, 2004.
Glerup M., Krstić V., Ewels C., Holzinger M. and Van Lier 6, Doping of Carbon Nanotubes, in: Doped nanomaterials and nanodevices, 2007, pp. 1-66.
Koós A.A., Dillon F., Obraztsova E. A., Crossley A. and Grobert N., Comparison of structural changes in nitrogen and boron-doped multi-walled carbon nanotubes, Carbon N. Y., 48(11), pp. 3033-3041, Sep. 2010.
Wong B.S., Yoong S.L., Jagusiak A., Panczyk T., Ho H.K., Ang W.H. and Pastorin G., Carbon nanotubes for delivery of small molecule drugs., Adv. Drug Deliv. Rev., 65(15), pp. 1964-2015, 2013.
Werengowska-Ciećwierz, K., Wiśniewski, M., Terzyk, A.P., Roszek, K., Czarnecka, J., Bolibok, P., et al., Conscious changes of carbon nanotubes cytotoxicity by manipulation with selected nanofactors. Appl Biochem Biotechnol, 176(3), pp. 730-741, 2015. DOI: 10.1007/s12010-015-1607-1.
Nakanishi, J., Morimoto, Y., Ogura, I., Kobayashi, N., Naya, M., Ema, M., et al., Risk assessment of the carbon nanotube group. Risk Anal [online]. 35(10), 2015. DOI: 10.1111/risa.12394. [Date of reference: June 07th of 2017]. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4736668/
Louro, H., Pinhão, M., Santos, J., Tavares, A., Vital, N. and Silva, M.J., Evaluation of the cytotoxic and genotoxic effects of benchmark multi-walled carbon nanotubes in relation to their physicochemical properties. Toxicol Lett, 262, pp.123-134, 2016. DOI: 10.1016/j.toxlet.2016.09.016.
Dong, J. and Ma, Q., Advances in mechanisms and signaling pathways of carbon nanotube toxicity. Nanotoxicology [online]. 9(5), 2015. DOI: 10.3109/17435390.2015.1009187. [Date of reference: June 07th of 2017]. Available at: http://onlinelibrary.wiley.com/doi/10.1111/risa.12394/full
Takagi, A., Hirose, A., Futakuchi, M., Tsuda, H. and Kanno, J., Dose-dependent mesothelioma induction by intraperitoneal administration of multi-wall carbon nanotubes in p53 heterozygous mice. Cancer Sci, 103(8), pp. 1440-1444, 2012. DOI: 10.1111/j.1349-7006.2012.02318.x
Grosse, Y., Loomis, D., Guyton, K.Z., Lauby-Secretan, B., El Ghissassi, F., Bouvard, V., et al., International agency for research on cancer monograph working group. Carcinogenicity of fluoro-edenite, silicon carbide fibres and whiskers, and carbon nanotubes. Lancet Oncol, 15(13), pp. 1427-1428, 2014. DOI: 10.1016/S1470-2045(14)71109-X.
Møller P. and Jacobsen N.R., Weight of evidence analysis for assessing the genotoxic potential of carbon nanotubes. Critical Reviews in Toxicology 47(10), pp 871-888, 2017. DOI: 10.1080/10408444.2017.1367755.
Khalili Fard, J., Jafari, S. and Eghbal, M.A., A review of molecular mechanisms involved in toxicity of nanoparticles. Adv Pharm Bull, 5(4), pp.447-454, 2015. DOI: 10.15171/apb.2015.061.
Hoyos-Palacio, L.M., Efecto de los catalizadores hierro, cobalto, níquel, molibdeno, y mezclas soportadas sobre sílice sol gel, para la síntesis de nanotubos de carbono mediante deposición química de vapor, Tesis de Doctorado en Ingeniería. Universidad Pontificia Bolivariana, Medellín, Colombia 2010, 204 P.
Uhl, M., Christoph, H. and Siegfried, K., Single-cell gel electrophoresis assays with human-derived hepatoma (Hep G2) cells. Mutat Res [online]. 441(2), 1999. [Date of reference: June 07th of 2017]. Available at: http://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.21.9716&rep=rep1&type=pdf
Yüzbaşıoğlu, D., Ünal, F., Koç, F., Öztemel, S., Aksoy, H., Mamur, S., et al., Genotoxicity assessment of vaccine adjuvant squalene. Food Chem Toxicol, 56, pp. 240-246, 2013. DOI: 10.1016/j.fct.2013.02.034.
Mamur, S., Yüzbaşıoğlu, D., Unal, F. and Aksoy, H., Genotoxicity of food preservative sodium sorbate in human lymphocytes in vitro. Cytotechnology [online]. 64(5), 2012. DOI: 10.1007/s10616-012-9434-5. [Date of reference: June 07th of 2017]. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3432536/
Tavares, A.M., Louro, H., Antunes, S., Quarré, S., Simar, S., De Temmerman, P.J., et al., Genotoxicity evaluation of nanosized titanium dioxide, synthetic amorphous silica and multi-walled carbon nanotubes in human lymphocytes. Toxicol In Vitro, 28(1), pp.60-69, 2014. DOI: 10.1016/j.tiv.2013.06.009.
Cruz-Vallejo, V.L., Reparabilidad durante G1 de las lesiones inductoras de intercambios entre cromatidas hermanas producidas por mitomicina C en células de la glándula salival de raton in vivo. México DF: Universidad Nacional Autónoma de México [en línea] 1991. [Fecha de consulta: 7 de junio de 2017]. Disponible en: https://inis.iaea.org/search/search.aspx?orig_q=RN:24063560
Orecchioni, M., Bedognetti, D., Sgarrella, F., Marincola, F., Bianco, A. and Delogu, L., Impact of carbon nanotubes and graphene on immune cells. J Transl Med [online] 12(1), 2014. DOI: 10.1186/1479-5876-12-138. [Date of reference: June 07th of 2017]. Available at: https://translational-medicine.biomedcentral.com/ articles/10.1186/1479-5876-12-138
Zhao, M.L., Li, D.J., Yuan, L., Yue, Y.C., Liu, H. and Sun, X., Differences in cytocompatibility and hemocompatibility between carbon nanotubes and nitrogen-doped carbon nanotubes. Carbon, 49(9), pp. 3125-3133, 2011. DOI: 10.1016/j.carbon.2011.03.037.
Szendi, K. and Varga, C., Lack of genotoxicity of carbon nanotubes in a pilot study. Anticancer Res [online]. 28(1A), 2008. [Fecha de consulta 7 de junio de 2017]. Disponible en: http://ar.iiarjournals.org/content/28/1A/349.long
Shvedova, A.A., Yanamala, N., Kisin, E.R., Tkach, A.V., Murray, A.R., Hubbs, A., Castranova, V., et al., Long-term effects of carbon containing engineered nanomaterials and asbestos in the lung: one year postexposure comparisons. Am J Physiol Lung Cell Mol Physiol. 306(2), pp. L170-L182, 2014. DOI: 10.1152/ajplung.00167.2013
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Licencia
Derechos de autor 2018 DYNA

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
El autor o autores de un artículo aceptado para publicación en cualquiera de las revistas editadas por la facultad de Minas cederán la totalidad de los derechos patrimoniales a la Universidad Nacional de Colombia de manera gratuita, dentro de los cuáles se incluyen: el derecho a editar, publicar, reproducir y distribuir tanto en medios impresos como digitales, además de incluir en artículo en índices internacionales y/o bases de datos, de igual manera, se faculta a la editorial para utilizar las imágenes, tablas y/o cualquier material gráfico presentado en el artículo para el diseño de carátulas o posters de la misma revista.