Ceratobasidium como hongo micorrízico de orquídeas en Colombia
Ceratobasidium as orchid mycorrhizal fungi in Colombia
Palabras clave:
Ceratobasidium, Rhizoctonia, hongos endófitos, micorríza en orquídeas, ITS, Orchidaceae. (es)Ceratobasidium, Rhizoctonia, fungal endophytes, orchid mycorrhiza, ITS, Orchidaceae. (en)
1Doctorado en Ciencias Agropecuarias énfasis en Suelos, Universidad Nacional de Colombia sede Palmira. Autor para correspondencia: E-mail: fitopatologia@hotmail.com. 2Departamento de Biología, Universidad de Puerto Rico - Río Piedras. P. O. Box 23360, San Juan, PR 00931-3360. 3Departamento de Ciencias Biológicas, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia sede Palmira.
Las orquídeas se caracterizan por su relación micorrízica obligada para la germinación de las semillas. El micosimbionte es principalmente del género-forma Rhizoctonia, al igual que sus teleomorfos de los géneros Ceratobasidium, Tulasnella, Thanatephorus y Sebacina. En Colombia hasta la fecha son muy pocos los reportes sobre hongos micorrízicos de orquídeas. Para el presente estudio se planteó el aislamiento e identificación de hongos micorrízicos de algunas orquídeas de diferentes hábitats en Colombia, siguiendo la metodología de contaje de núcleos en células de hifas jóvenes y la secuenciación de la región ITS de los genes ribosomales nucleares. Se identificaron doce aislamientos provenientes de ocho plantas de especies diferentes de orquídeas. Tanto búsquedas BLAST del GenBank como el número de núcleos los agruparon en el género Ceratobasidium. Los resultados sugieren que este género se asocia con una amplia diversidad de orquídeas de hábitats variados en Colombia, además que para esta planta puede ser un importante hongo micorrízico. Sin embargo, surgen preguntas relacionadas con la patogenicidad de los Ceratobasidium micorrízicos sobre otros hospederos y su posible potencial biocontrolador de hongos patógenos en plantas cultivadas como arroz.
Palabra clave: Ceratobasidium, Rhizoctonia, hongos endófitos, micorríza en orquídeas, ITS, Orchidaceae.
Orchids require a mycorrhizal relationship for seed germination. Many mycorrhizal fungi are in the form-genus Rhizoctonia, with teleomorphs in the genera Ceratobasidium, Tulasnella, Thanatephorus and Sebacina. So far there are very few reports of orchid mycorrhizal fungi in Colombia. The objectives of the present study were to isolate mycorrhizal fungi of orchids from different habitats in Colombia, and identify them by counting nuclei in young hyphae and sequencing the ITS region of nuclear ribosomal genes. We identified 12 isolates from 8 plants of different species of orchids. BLAST searches in GenBank and binucleate cellsplaced all isolates in the genus Ceratobasidium. The results suggest that this genus is associated with a wide variety of orchids from various habitats in Colombia. However, the consistency of the association raise questions about the pathogenicity of mycorrhizal Ceratobasidium on other plants, and their potential for biocontrol of pathogenic fungi in crops such as rice.
Key words: Ceratobasidium, Rhizoctonia, fungal endophytes, orchid mycorrhiza, ITS, Orchidaceae.
Todas las orquídeas requieren para su germinación y desarrollo de plántula una asociación con hongos micorrízicos. Algunas conservan dicha relación hasta su estado adulto, principalmente aquellas que no son fotosintéticas (Bernard, 1909; Arditti, 1992; Otero y Bayman, 2009). Sin embargo, en las zonas tropicales predominan las orquídeas fotosintéticas, las cuales son micoheterotróficas durante los primeros estadios de desarrollo y algunas podrían ser myxotróficas en estado adulto, ya que parte del carbono que requieren lo suplen de sus hongos micorrízicos (Dearnaley, 2007).
La micorríza orquidioide se caracteriza porque la mayoría de los hongos que participan en esta asociación son miembros del género-forma Rhizoctonia. En las células corticales de las raíces el hongo origina una estructura denominada pelotón' que es un enrollamiento hifal, el cual es degradado por la planta para obtener nutrientes (Hadley y Williamson, 1972). En muchos casos las orquídeas llegan a formar una relación tan dependiente del hongo que se considera que la planta parasita al hongo, sin embargo el costo energético de esta interacción puede ser poco importante para el hongo (McKendrick et al., 2000; Sanders, 2003).
El género-forma Rhizoctonia en su fase asexual (anamorfo) se caracteriza por presentar un micelio estéril incoloro, que se torna oscuro a medida que va madurando. Presenta células largas y ramificaciones en ángulo recto con respecto a la hifa principal; en ocasiones se estrecha ligeramente a nivel de la bifurcación y posee un septo cerca a ella (Agrios, 2002). En ciertas condiciones, el hongo produce ramilletes de células cortas y anchas, de forma oval o triangular, denominadas células monilioides, de las cuales se pueden desarrollar pequeños esclerocios (Sneh et al., 1991).
La fase sexual (teleomorfo) que corresponde a Rhizoctonia incluye los géneros Ceratobasidium, Tulasnella, Sebacina y Thanatephorus, los cuales pueden diferenciarse por sus estructuras reproductivas conformadas por los basidiocarpos donde se producen las basidiosporas. Desafortunadamente, es difícil conseguir estructuras reproductivas de Rhizoctonia en condiciones de laboratorio (Sneh et al., 1991), lo que complica su diferenciación taxonómica.
Una característica de clasificación para el género-forma Rhizoctonia es el número de núcleos en células de hifas jóvenes, que pueden ser uni-, bi- o multinucleadas. Muchas de las rhizoctonias micorrízicas de orquídeas son binucleadas con su teleomorfo en Ceratobasidium y son menos frecuentes las multinucleadas, cuyo teleomorfo se expresa en el género Thanatephorus (Carling et al., 1999; Rubio et al., 2000); otro grupo de Rhizoctonia binucleada corresponde al teleomorfo Tulasnella (Rubio et al., 2000).
No obstante, existen tres inconvenientes básicos al trabajar la taxonomía del géneroforma Rhizoctonia de orquídeas a partir de aislamientos en cultivo puro: (1) al aislar los hongos en medios de cultivo artificial estos no esporulan y dificultan su identificación, por lo cual se agrupan en morfotipos; (2) la mayoría que logran crecer en medios artificiales son indistinguibles morfológicamente y se deben identificar por técnicas de sistemática molecular; y (3) algunos no crecen en medios artificiales, por lo cual la única manera de identificarlos es por amplificación directa de su ADN con primers específicos para hongos (Bayman y Otero, 2006).
En la última década han aumentado los estudios relacionados con hongos micorrízicos de orquídeas epífitas tropicales (Otero y Bayman, 2009; Suárez et al., 2006; Otero et al., 2002, 2004, 2005; Pereira et al., 2003, 2005a, 2005b). En el trabajo realizado con orquídeas epífitas de Puerto Rico se encontró variación en la especificidad micorrizal entre plantas y la preferencia marcada de ciertos grupos de orquídeas por hongos del género Ceratobasidium (Otero et al., 2002, 2004, 2005, 2007); mientras que algunas especies de orquídeas andinas en el Ecuador presentaron hongos micorrízicos en los géneros teleomórficos Tulasnella y Sebacina (Suárez et al., 2006). En el caso de orquídeas epífitas de la selva del Brasil se reportan los géneros anamórficos Epulorhiza y Ceratorhiza (sus teleomorfos son Tulasnella y Ceratobasidium, respectivamente) (Pereira et al., 2003, 2005a, 2005b).
Poco se conoce acerca de hongos micorrízicos de orquídeas terrestres tropicales (Pereira et al., 2005a). Según Porras-Alfaro y Bayman (2007) en las últimas décadas se han realizado más trabajos con hongos micorrízicos de orquídeas epífitas de zonas templadas y tropicales, que de orquídeas terrestres tropicales. Estos autores trabajaron con Vanilla, una orquídea hemiepifítica, es decir, que presenta raíces tanto terrestres como aéreas. En cuatro especies provenientes de Puerto Rico, Costa Rica y Cuba el hongo más común en raíces terrestres fue Ceratobasidium, mientras que Tulasnella lo fue para raíces aéreas, igualmente se reportó Thanatephorus; estos resultados son contrarios a lo encontrado en otras investigaciones. En la evaluación de germinación de semillas y desarrollo de plántula Ceratobasidium tuvo un efecto positivo y consistente.
Colombia es uno de los países más biodiversos y en cuanto a orquídeas posee el 15% (más de 3500 spp.) del total de las especies del mundo (Senghas, 2001; Ortiz et al., 1994; Dressler, 1993; Arditti, 1992). Sin embargo, hasta la fecha en Colombia son muy pocos los estudios relacionados con hongos micorrízicos de orquídeas (Díaz et al., 2000). Su importancia radica en el papel ecológico que cumplen, ya que contribuyen a la conservación de la población de orquídeas y por ende a la de la biodiversidad (Dearnaley, 2007). Por lo anterior se planteó como objetivo del presente estudio identificar aislamientos del género-forma Rhizoctonia obtenidos a partir de diferentes especies de orquídeas, basándose en el número de núcleos de células de hifas jóvenes y la secuenciación del gen del ITS.
Aislamiento de rhizoctonias micorrízicas de orquídeas (RMO)
Se siguió la metodología propuesta por Otero et al. (2002). Entre junio del 2007 y noviembre del 2008 se realizaron 19 muestreos para recolectar 71 plantas de 31 géneros y 7 individuos sin identificar (Cuadro 1). Se coleccionaron en diferentes hábitats (terrestres, epífitas, hemiepifíticas y litofíticas) en los departamentos de Antioquia y Valle del Cauca (Colombia), en zonas de reserva forestal y zonas intervenidas. Las muestras se conservaron en bolsas plásticas para mantener la humedad y fueron transportadas en nevera de icopor hasta procesarlas en laboratorio, en un período no mayor a dos días después de su recolección.

En laboratorio se seleccionaron al azar cuatro raíces con apariencia sana, que estuvieron en contacto con el sustrato consistente en suelo para las orquídeas terrestres y corteza para las epífitas, para de esta forma asegurar una mayor probabilidad de la presencia de hongos micorrízicos (Suárez et al., 2006). De dichas raíces se realizaron cortes transversales para obtener seis trozos de aproximadamente 0.5 cm, los cuales se montaron en portaobjetos con agua destilada para verificar la presencia de pelotones viables. Cuando las raíces eran demasiado delgadas, el corte se hizo de forma longitudinal sembrando directamente trozos de 0.5 cm de largo.
Los cortes se desinfestaron con etanol al 70% por 1 min, hipoclorito de sodio al 2.5% por 30 seg, etanol al 70% por 1 min y finalmente, fueron lavados con agua destilada estéril por 1 min (Otero et al., 2002); el tejido se secó con toallas de papel estériles para realizar su siembra en medio de papa, dextrosa y agar (PDA) acidulado con ácido láctico al 0.2% para evitar el crecimiento bacteriano. Las muestras se incubaron a temperatura ambiente (27 °C) hasta observar desarrollo micelial de los endófitos presentes. Con base en características macroscópicas y microscópicas se aislaron en PDA los hongos que correspondieron al género-forma Rhizoctonia y se mantuvieron en cultivo puro. La técnica de preservación que permitió su posterior reactivación consistió en conservar trozos de PDA con crecimiento micelial suspendidos en agua destilada estéril.
Tinción de núcleos en células de hifas jóvenes
Para las micropreparaciones fueron utilizados aislamientos de Rhizoctonia con cinco y ocho días de crecimiento, en medio de PDA acidulado. El montaje de la muestra se hizo sobre porta y cubre objeto utilizando safranina al 0.5% e hidróxido de potasio (KOH) al 3%, depositando simultáneamente una gota de cada solución para lograr que el tinte penetrara el tejido del hongo y lograr así la tinción de núcleos (Sneh et al., 1991). Las micropreparaciones se observaron con microscopio de luz a 40x y 100x. El número de núcleos por célula fue determinado con base en la lectura de 20 células jóvenes de dos placas diferentes (Goh et al., 1992).
Identificación molecular de RMO
El DNA genómico de los diferentes aislamientos puros obtenidos de rhizoctonias micorrízicas de orquídeas se extrajo utilizando la metodología de Lee y Taylor (1990). La región ITS de los genes ribosomales nucleares se amplificó por reacción en cadena de la polimerasa (PCR) y los primers fungosos ITS1 e ITS4 (White et al., 1990).
El procedimiento consistió en crecer los hongos en caldo de papa y dextrosa por ocho días. Transcurrido este tiempo se lavaron para concentrar y obtener el micelio limpio pasando el micelio por papel filtro 90 mmø, embudo de porcelana, agua destilada estéril y equipo de succión, posteriormente el micelio fue macerado con nitrógeno líquido hasta pulverizarlo. El producto fue transferido a un tubo ependorf de 1.5 ml, al que se adicionaron 500µl del buffer de lisis (buffer de lisis = 50mM tris-HCl (pH 7.2) + 50 mM EDTA + 3% SDS + 1% 2-mercaptoethanol); las muestras fueron incubadas a 65 °C por 30 a 60 min. A cada muestra se le adicionaron 400 µl de fenol-cloroformo; se centrifugó a 13,000 r.p.m. por 15 min, desechando el precipitado. El sobrenadante se colocó en un nuevo tubo al cual se le adicionaron 400 µl de cloroformo y se centrifugó a 13,000 r.p.m. por 5 min. El nuevo sobrenadante se llevó a un tubo con 5 µl de acetato de Na 5M y 250 µl de isopropanol, y se hizo una homogenización suave para no romper el DNA y lograr su precipitación, se centrifugó a 14,000 r.p.m. por 2 min; el sobrenadante se eliminó y en el fondo del tubo quedó un pelet que se lavó dos veces con 400 µl de etanol al 70% el cual se dejó secar por 24 h. La suspensión del DNA se hizo con 100 µl TE, de allí se resuspendió en una relación 1:100 (suspensión de DNA: agua) para medir la concentración en el espectrofotómetro.
Para realizar PCR se utilizaron 10 µl de DNA y 10 µl de Master Mix (5 µl de agua + 2 µl de buffer + 2 µl de MgCl2 + 0.4 µl de DNTPs + 0.2 TAQ + 0.5 µl 20µM de primer ITS1 +0.5 µl 20µM de primer ITS4 (White et al., 1990) y se programó el termociclador para la secuenciación (94 °C x 2'30", 94 °C x 45", 53 °C x 30",72 °C x 1'/5 ciclos; después 94 °C x 30", 53 °C x 30", 72 °C x 1'15"/30 ciclos; después 72 °C x 10'.). En tubos se dispusieron 5 µl de cada una de las muestra de DNA que contenía los amplicones obtenidos del proceso de PCR, los cuales se limpiaron con EXOSAP de la marca fermentas (es un Master Mix de 0.3 µl de Exo = exonuclease I, E. coli (# EN0582) + 0.45 µl SAP = Shrimp Alkaline Phosphatase (# EF0511) + 2.25 ml de agua); el proceso se realizó en el termociclador durante 30 min a 37 °C y la desnaturalización de las enzimas se hizo por 10 min a 80 °C. El proceso de secuenciación se realizo en el Laboratorio Sequencing & Genotyping Facility (SGF), del Dpto. de Biología de la Universidad de Puerto Rico, recinto de Río Piedras.
Las secuencias de los nucleótidos de la región ITS obtenidas de los aislamientos de Rhizoctonia micorrízica de orquídeas de Colombia se editaron usando el programa Sequencher 3.0 (Gene Code Corporation, Ann Arbor, Michigan, USA), posteriormente se compararon con la información existente en la base de datos del GenBank (http://www.ncbi.nlm.nih.gov) utilizando las búsquedas BLAST (Altschul et al., 1990). Para la identificación se consideraron aquellos organismos fungosos cuyas secuencias se mostraron más cercanas a las de los desconocidos, teniendo en cuenta los porcentajes de similitud más altos arrojados por las búsquedas BLAST.
Aislamiento de rhizoctonias micorrízicas de orquídeas (RMO)
Se seleccionaron sólo hongos micorrízicos con características microscópicas y macroscópicas correspondientes al género-forma Rhizoctonia (Sneh et al., 1991; Agrios, 2002). De acuerdo con lo anterior, fue posible obtener 12 aislamientos provenientes de 8 plantas, para hacer el conteo de núcleos e identificación molecular (Cuadro 1).
Se comprobó que en medio de cultivo artificial no siempre es posible aislar los hongos micorrízicos de orquídeas o se pierden después de lograrlo (Rasmussen, 2002). Cuando se sembraron en medio de PDA pelotones de células del cortex, los resultados sugieren que los aislamientos obtenidos del género-forma Rhizoctonia posiblemente corresponden a hongos con acción micorrízica, según lo indican Hadley y Williamson (1972) (Foto 1). No obstante, se debe tener en cuenta que pueden existir varios hongos en un mismo pelotón pertenecientes o no a un mismo género (Kristiansen et al., 2001, 2004), como también R. solani como micorrízico de orquídeas (Carling et al., 1999).
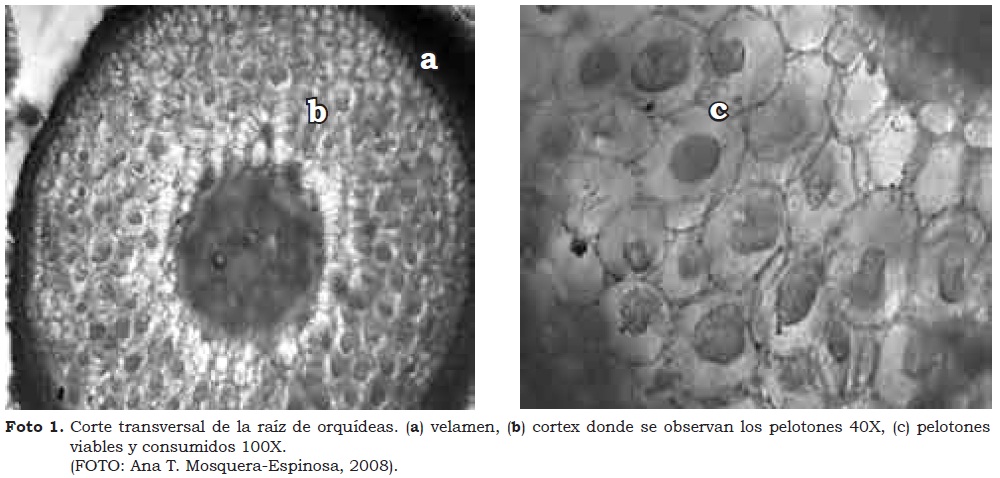
Número de núcleos en células de hifas jóvenes
Entre los doce aislamientos revisados, once fueron binucleados y de estos, ocho produjeron células monilioides en las cuales se pudo observar con mayor facilidad la presencia de núcleos; sólo un aislamiento fue uninucleado e igualmente produjo células monilioides (Carling et al., 1999; Rubio et al., 2000) (Cuadro 2 y Foto 2).
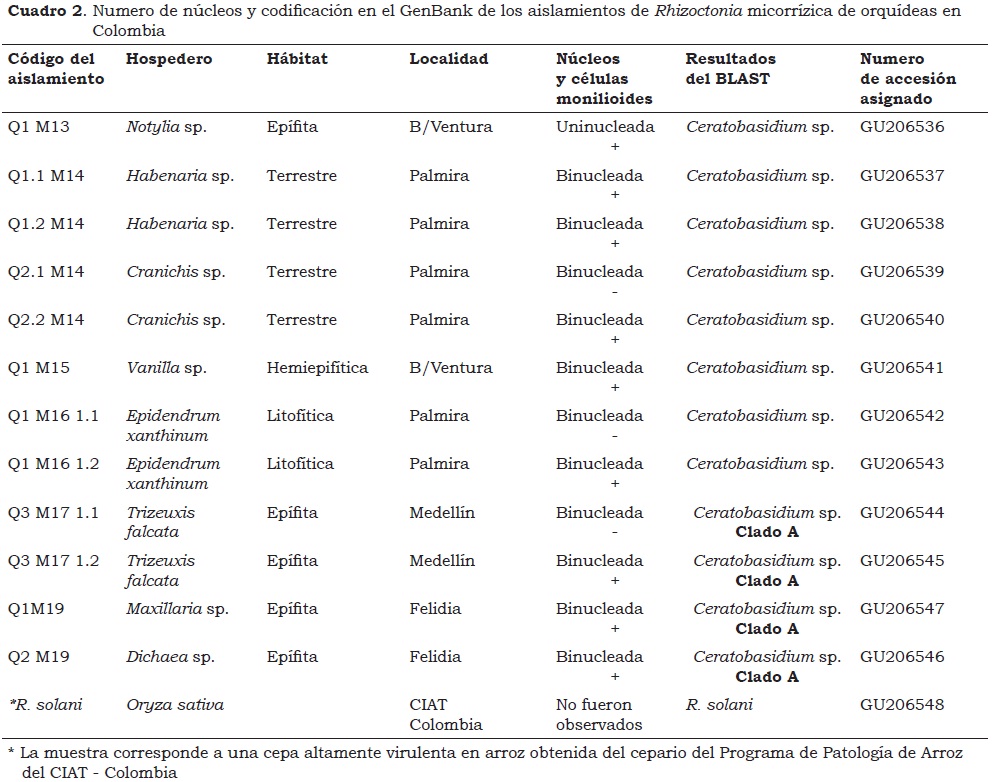
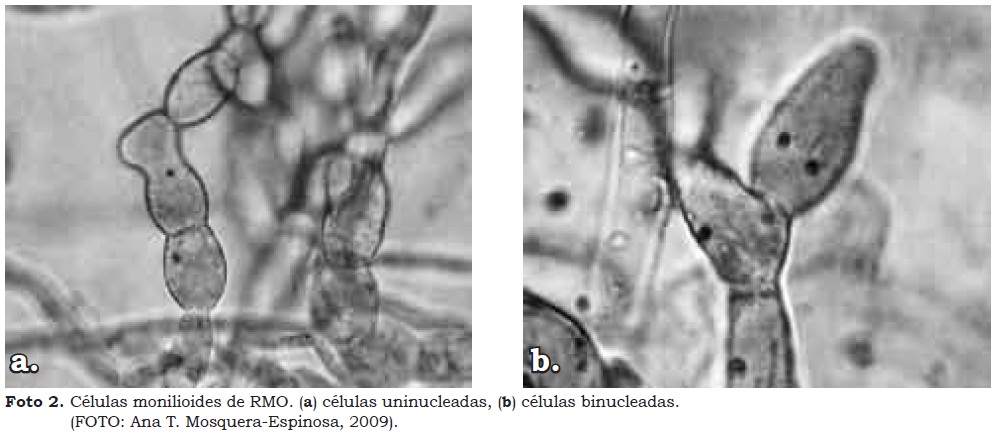
Estos resultados coinciden con los de Otero et al. (2002) quienes en nueve muestras de orquídeas epífitas aislaron 108 hongos, de los cuales estudiaron 26 que resultaron ser bi y uninucleados, siendo éste el primer reporte del género-forma Rhizoctonia uninucleado como hongo endófito de orquídeas. Esta condición no fue buena como característica filogenética para los hongos micorrízicos de Puerto Rico; ya que Rhizoctonia spp. uninucleada y binucleada pertenecieron al mismo clado. En este estudio, en Colombia aparece de nuevo el género-forma Rhizoctonia uninucleado como hongo endófito de orquídeas (Notylia sp.), aunque en muy baja proporción (1 aislamiento de 12).
Identificación por secuenciación
Las secuencias de los doce aislamientos de orquídeas en Colombia, según las búsquedas BLAST (GenBank), mostraron que el organismo más cercano en la mayoría de los casos fue Ceratobasidium sp., con valores de porcentaje de similitud entre 93 y 100% (Cuadro 3). Estos resultados posiblemente están relacionados con el hecho de haber utilizado como medio de cultivo PDA, puesto que ciertos medios artificiales pueden limitar o excluir el crecimiento de algunos hongos micorrízicos que se encuentran presentes en las raíces de las orquídeas (Porras-Alfaro y Bayman, 2007).
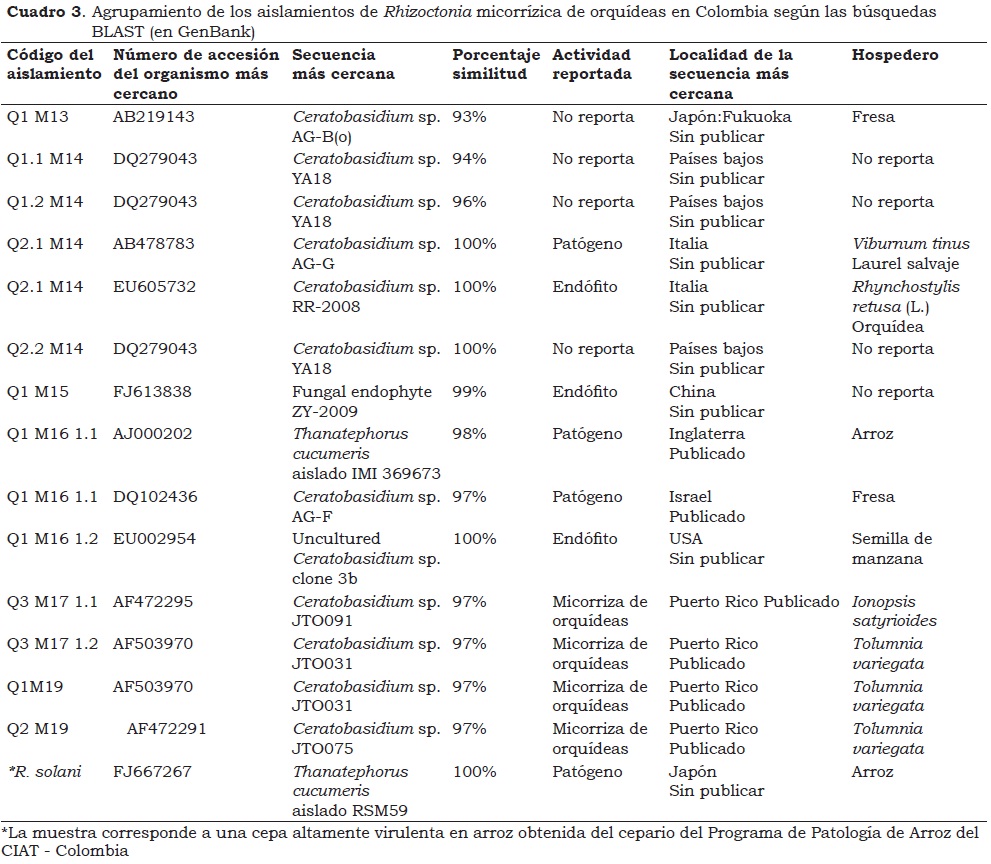
La secuencia del aislamiento Q2.1M14 proveniente de la orquídea Cranichis sp. presentó 100% de similitud con dos hongos de hospederos y acciones diferentes, uno de Viburnum tinus (laurel salvaje) con actividad patogénica y el otro de una orquídea Rhynchostylis retusa, en este caso como endófito, ambas plantas ubicadas en Italia. Igualmente la secuencia de Q1M161.2, proveniente de Epidendrum xanthinum mostró 100% de similitud con la secuencia de un endófito aislado de semillas de manzano en E.U. Sin embargo, la secuencia del aislamiento Q1M161.1, que proviene del mismo muestreo y planta (Palmira - Epidendrum xanthinum), presentó menor porcentaje de similitud con dos organismos sugeridos por las búsquedas BLAST (98% y 97%, Cuadro 3): En ambos casos patógenos provenientes de localidades y hospederos diferentes (arroz de Inglaterra y fresa de Israel, respectivamente). El aislamiento de R. solani también presentó secuencia con 100% de similitud, siendo una cepa altamente virulenta en arroz en Colombia, la cual se relacionó con Thanatephorus cucumeris proveniente de arroz del Japón (Cuadro 3).
Estos resultados pueden deberse a las diversas formas de acción que presenta el género-forma Rhizoctonia, además de su amplia distribución (Agrios, 2002). En este estudio los aislamientos fueron micorrízicos para las orquídeas muestreadas en Colombia, mientras que según las búsquedas BLAST algunas de estas secuencias fueron similares con las de organismos patógenos obtenidos de otros hospederos y países.
Igualmente se generan preguntas relacionadas con la patogenicidad de los hongos micorrízicos del género-forma Rhizoctonia sobre hospederos diferentes a orquídeas; así como su posible potencial biocontrolador, principalmente de los Ceratobasidium binucleados (Cartwright y Spurr, 1998; Rubio et al., 2000; Burns y Benson, 2000; González et al., 2000; Sneh et al., 2004).
Sin embargo, en los estudios con hongos micorrízicos de orquídeas se enfatizan más hacia programas de conservación de esta planta en condiciones naturales, para así contribuir a disminuir el impacto antropogénico presente en selvas tropicales (Pereira et al., 2003, 2005a, 2005b; Suárez et al., 2006).
Las búsquedas BLAST igualmente contribuyeron para precisar el agrupamiento de los aislamientos de epífitas en Medellín y Felidia (Cuadro 2) con el clado A de Ceratobasidium de orquídeas epífitas de Puerto Rico (Otero et al., 2002); lo cual muestra la preferencia marcada de ciertos grupos de orquídeas por hongos del género Ceratobasidium y posiblemente por un clado en particular (Otero et al., 2002, 2004, 2005, 2007).
Al comparar los resultados de este estudio con los obtenidos en Brasil en relación con hongos micorrízicos de orquídeas epífitas nativas, se observa que en este país se reportan los géneros Ceratorhiza y Epulorhiza que son las expresiones anamorfas de los géneros Ceratobasidium y Tulasnella, respectivamente (Pereira et al., 2003, 2005a, 2005b). Lo anterior muestra que el género Ceratobasidium aparece como hongo micorrízico de orquídeas neotropicales, ya sea en su fase anamorfa o teleomorfa. Sin embargo, no se descarta la presencia en Colombia de otros grupos micorrízicos de orquídeas tales como Thanatephorus, Tulasnella y Sebacina, aun cuando no se hayan encontrado en el presente trabajo.
Caso contrario ocurrió con un estudio en Ecuador, donde los hongos micorrízicos de orquídeas epífitas se ubicaron en 7 clados diferentes del género Tulasnella, teniendo en cuenta que en este país aún no existen registros de la presencia de Ceratobasidium (Suárez et al. 2006).
Con respecto a la orquídea hemiepifítica Vanilla fue posible aislar Ceratobasidium como micorrízico, pero solo de las raíces terrestres (Cuadro 3), similar a lo obtenido por Porras-Alfaro y Bayman (2007).
Igualmente se comprobó que es poco lo que se conoce sobre hongos micorrízicos de orquídeas terrestres tropicales (Pereira et al., 2005a), ya que al realizar la revisión de literatura la información encontrada es escasa. Por tanto, se compararon los resultados de orquídeas terrestres en Colombia donde se presentó el género Ceratobasidium, con los datos de orquídeas terrestres de Hong Kong según el estudio de Shan et al. (2002), el cual reportó como géneros asociados Ceratorhiza y Epulorhiza. Lo anterior muestra la presencia de esta asociación en zona neotropical o templada, lo cual puede ocurrir por ubicuidad del simbionte, adaptación y requerimientos de las orquídeas o especificidad en la relación micorrízica en orquídeas (Bernard, 1909; Arditti, 1992; Carling et al., 1999; Agrios, 2002; Otero y Bayman, 2009).
Como lo plantean Otero et al. (2007) la alta frecuencia en la asociación de las orquídeas neotropicales con hongos del género Ceratobasidium sugiere que éste puede ser un importante hongo micorrízico con una amplia diversidad de orquídeas, y para este estudio en particular, no solo epífitas sino de otros hábitats.
- De doce aislamientos de RMO obtenidos, once fueron binucleados y uno uninucleado, todos pertenecientes al género teleomorfo Ceratobasidium.
- En este estudio el género Ceratobasidium fue común para todas las orquídeas, independiente de su hábitat. Para algunas epífitas las búsquedas BLAST sugirieron de manera más específica el clado A de los estudios de Otero (Otero et al., 2002, 2004, 2005, 2007) con orquídeas epífitas neotropicales.
- Para la mayoría de las secuencias de las rhizoctonias micorrízicas de orquídeas, aquéllas más parecidas provinieron de hongos patógenos de otros hospederos de zonas templadas. Sin embargo, no es claro que esto corresponda a la variada actividad del hongo o a las limitaciones de información disponible en el GenBank.
- Se plantean etapas complementarias de esta investigación para evaluar la patogenicidad de las rhizoctonias micorrízicas de orquídeas aisladas, como también su potencial biocontrolador sobre R. solani patógeno en arroz.
Al Instituto Colombiano Agropecuario (ICA) - Palmira por facilitar el laboratorio para el procesamiento de las muestras y obtención de aislamientos de los hongos micorrízicos. A la Universidad de Puerto Rico, Recinto de Río Piedras, Dpto. de Biología, igualmente a CREST CATEC proyecto que financió la identificación molecular de los aislamientos. A Colciencias-Icetex por el apoyo financiero a la estudiante en el Programa de Doctorados Nacionales - 2006.
Agrios, N. G. 2002. Fitopatología. Editorial Limusa, S.A., Segunda edición traducción de Plant Pathology, México. 830 p.
Altschul, S. F.; Gish, W.; Miller, W.; Myers, E. W.; y Lipman, D. J. 1990. Basic local alignment search tool. J. Mol. Biol. 215:403 - 410.
Arditti, J. 1992. Fundamentals of orchid biology. John Wiley, Nueva York. 483 p.
Bayman, P. y Otero, J. T. 2006. Microbial endophytes of orchid roots. Soil Biol. vol. 9. En: © Springer-Verlag Berlin Heidelberg. 2006.
Bernard, N. 1909. Levolution dans la symbiose. Annales des sciences naturelles botanique, Paris. 9:1 - 196.
Burns, J. y Benson, M. 2000. Biocontrol de damping-off of Catharanthus roseus caused by Pythium ultimum with Trichoderma virens and binucleate rhizoctonia fungi. Plant Disease 84:644 - 648.
Carling, D.; Pope, E.; Brainard, K.; y Carter, D. 1999. Characterization of mycorrhizal isolates of Rhizoctonia solani from an orchid, including AG-12, a new anastomosis group. Phytopath. 64: 492-496.
Cartwright, K. y Spurr, H. 1998. Biological control of Phytophthora parasìtica var. nicotianae on tobacco seedlings with nonpathogenic binucleate rhizoctonia fungi. Soil Biol. Biochem. 30(14):1879 - 1884.
Dearnaley, J. D. 2007. Further advances in orchid mycorrizal research. Review. Mycorrhiza 17:475 - 486.
Díaz, G.; Sánchez de Prager, M.; Gómez, E.; y Mier, C. 2000. Endomicorrizas y metabolitos secundários en Orquidáceas de hábitats terrestres. Fitopatologia Colombiana 24:5 - 9.
Dressler, R.L. 1993. Phylogeny and classification of the orchid family. Cambridge Univ. Press. Londres. 313 p.
Goh, C. J.; Sim, A. A.; y Lim, G. 1992. Mycorrhizal associations in some tropical orchids. Lindleyana 7:13 - 17.
González, V.; Portal, M.; Acero, J.; Sánchez- Ballesteros, J.; y Rubio, V. 2000. Biological control properties of a new Rhizoctonia- Like species (BNR),Ceratobasidium albasitensis isolated in Spain. Third International Symposium Rhizoctonia. National Chung Hsing University. p. 21 - 23.
Hadley, G. y Williamson, B. 1972. Features of mycorrhizal infection in some Malayan Orchids. New Phytol. 71:1111 - 1118.
Kristiansen, K. A.; Taylor, D. L.; Kjoller R.; Rasmussen, H. N.; y Rosendahl, S. 2001. Identification of mycorrhizal fungi from single pelotons of Dactylorhiza majalis (Orchidaceae) using single-strand conformation polymorphism and mitochondrial ribosomal large subunit DNA sequences. Mol. Ecol. 10:2089 - 2093.
Kristiansen, K. A; Freudenstein J.V; Rasmussen F.N; Rasmussen, H.N. 2004. Molecular identification of mycorrhizal fungi in Neuwiedia veratrifolia (Orchidaceae). Mol. Phylog. Evol. 33:251 - 258.
Lee, S. B. y Taylor, J. W. 1990. Isolation of DNA from fungal mycelia and single spore. En: M. A., Innis; D. H., Gelfand; J. J., Sninsky and White, J. (eds.). PCR protocols: a guide to methods and applications. Academic Press, San Diego, California, E.U. p. 282 - 287.
McKendrick, S. L.; Leake, J. L.; Taylor, D. L.; y Read, D. J. 2000. Symbiotic germination and development of myco-heterotrophic plants in nature: ontogeny of Corallorhiza trifida and characterization of its mycorrhizal fungi. New Phytol. 145:523 - 537.
Ortiz, P.; Aguirre, G.; Arango, A.; Arango, C.; Bock, I.; et al. 1994. Native Colombian Orchids. Sociedad Colombiana de Orquideología. Editorial Colina. Medellín Colombia. vol. 1. 53 p.
Otero, T.; Ackerman, J. y Bayman, P. 2002. Diversity and host specificity of endophytic Rhizoctonia - Like fungi from tropical Orchids. Am. J. Bot. 89(11):1852 - 1858.
Otero, T.; Ackerman J. y Bayman, P. 2004. Differences in mycorrhizal preferences between two tropical orchids. Mol. Ecol. 10:207 - 212.
Otero, J. T.; Bayman P.; y Ackerman, J. D. 2005. Variation in mycorrhizal perfor - mance in the epiphytic orchid Tolumnia variegata in vitro: the potential for natural selection. Evol. Ecol. 19:29 - 43.
Otero, J.; Flanagan, N.; Herre, A.; Ackerman, J.; y Bayman, P. 2007. Widespread mycorrhizal specificity correlates to mycorrhizal function in the neotropical, epiphytic orchid Ionopsis utricularioides (orchidaceae). Am. J. Bot. 94(12):1944 - 1950.
Otero, J. T. y Bayman, P. 2009. Germinación simbiótica y asimbiótica en semillas de orquídeas epífitas. Acta Agronómica 58(4):270-276.
Pereira, O. L; Rollemberg, C. D; Borges, A; Matsuoka, K; y Kasuya, M. C. 2003. Epulorhiza epiphytica sp. nov. isolated from mycorrhizal roots of epiphytic orchids in Brazil. Mycoscience 44:153 - 155.
Pereira, O; kasuya, M.; Borges, A.; y Fernandes de Araujo, E. 2005a. Morphological and molecular characterization of mycorrhizal fungi isolated from neotropical orchids in Brazil. Can. J. Bot. 83:54 - 65.
Pereira, O. L; Kasuya, M. C. M.; Rollemberg, C. D.; y Chaer, G. M. 2005b. Isolation and identification of Rhizoctonia-like mycorrhizal fungi associated with three species of neotropical epiphytic orchids in Brazil. Rev. Bras. Ciencia do Solo 29:191 - 197.
Porras-Alfaro, A. y Bayman, P. 2007. Mycorrhizal fungi of Vanilla: diversity, specificity and effects on seed germination and plant growth. Mycol. 99(4):510 - 525.
Rasmussen, H. N. 2002. Recent developments in the study of orchid mycorrhiza. Plant Soil 244:149 - 163.
Rubio, V.; González, V.; Portal, M.; Acero, J.; Salazar, O.; y Sneh, B. 2000. Molecular phylogeny of Ceratobasidium spp. (BNR) based on rDNA-ITS sequences. Third international symposium Rhizoctonia. National Chung Hsing University. p. 12 - 13.
Sanders, I. 2003. Preference, specificity and cheating in the arbuscular mycorrhizal symbiosis. Trends Plan Sci 8:143 - 154.
Senghas, K. 2001. Die orchideen. Third edition. Vol I/C. fasc 44/45. Parey Buchverlag. Berlin. p. 2828.
Shan, X.; Liew, E.; Weatherhead, M.; Hodgkiss, I. 2002. Characterization and taxonomic placement of Rhizoctonia-like endophytes from orchid roots. Mycologia 94 (2): 230- 239.
Sneh, B.; Burpee, L.; y Ogoshi, A. 1991. Identification of Rhizoctonia species. The American Phytopathological Society. 133 p.
Sneh, B.; Yamoah, E.; y Stewart, A. 2004. Hypovirulent Rhizoctonia spp. isolates from New Zealand soils protect radish seedlings against Damping-off caused by R. solani. New Zeal. Plant Prot. 57:54 - 58.
Suarez, JP; Michael, W; Abele, A; Garnica, S; Oberwinklerb, F; y Kottke, I. 2006. Diverse tulasnelloid fungi form mycorrhizas with epiphytic orchids in an Andean cloud forest. Mycol. Res. 110:1257 - 1270.
White, T. J.; Bruns, T; Lee, S; y Taylor, J. W. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis M.A., Gelfand D.H., Snisnsky J.J., White T.J. (eds.). PCR Protocols: a Guide to Methods and Applications (eds), Academic Press, San Diego CA. pp. 315 - 322. http://www.ncbi.nlm.nih.gov
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2010 Acta Agronómica

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Política sobre Derechos de autor:Los autores que publican en la revista se acogen al código de licencia creative commons 4.0 de atribución, no comercial, sin derivados.
Es decir, que aún siendo la Revista Acta Agronómica de acceso libre, los usuarios pueden descargar la información contenida en ella, pero deben darle atribución o reconocimiento de propiedad intelectual, deben usarlo tal como está, sin derivación alguna y no debe ser usado con fines comerciales.



























