DISEÑO Y CONSTRUCCION DE UN POTENCIOSTATO PARA PROCESOS DE SINTESIS DE MATERIALES USANDO ELECTRODEPOSICIÓN QUÍMICA
DESIGN AND CONSTRUCTION OF A POTENTIOSTAT FOR MATERIAL SYNTHESIS PROCESS USING CHEMICAL ELECTRODEPOSITION
Keywords:
Potenciostato, electrodeposición química, técnicas electroanalíticas. (es)Potentiostat, chemical electrodeposition, electroanalytical techniques. (en)
Downloads
El presente trabajo se enfoca al diseño y desarrollo de un potenciostato, el cual pueda utilizarse en diferentes áreas incluyendo síntesis de materiales usando electro-deposición química, estudios de procesos de corrosión y pruebas de voltamperometria cíclica. El potenciostato desarrollado es versátil, estable, opera en el rango de micro-amperios y provee un alto rendimiento como el de un potenciostato comercial pero es de menor costo. En la construcción del potenciostato, se utilizaron amplificadores operacionales que presentan bajas corrientes de polarización, alta impedancia de entrada y baja tensión de offset, así como simulación de cargas con resistencias reales. Este potenciostato fue usado para caracterizar el proceso de óxido-reducción que ocurre en la electrodeposición química de paladio sobre un substrato. Los resultados de voltametria y deposición final son comparables con resultados reportados en la literatura para el paladio.
This work focuses on the design and development of a potentiostat, which can be used in different areas including synthesis of materials by chemical electrodeposition, studies of corrosion processes and tests of cyclic voltammetry. The developed potentiostat is versatile, stable, operates in the range of micro-ampere and pro-vides high performance as a commercial potentiostat but is lowest cost. Operational amplifiers featuring low currents of polarization, high impedance input and low offset voltage, as well as simulation of real resistance loads were used in the construction of the potentiostat. This potentiostat was used to characterize the process of redox occurring in the chemical electrodeposition of PD on a substrate. Voltammetry and final deposition results are comparable with results reported in the literature for the palladium.
DISEÑO Y CONSTRUCCIÓN DE UN POTENCIOSTATO PARA PROCESOS DE SINTESIS DE MATERIALES USANDO ELECTRODEPOSICIÓN QUÍMICA
DESIGN AND CONSTRUCTION OF A POTENTIOSTAT FOR MATERIAL SYNTHESIS PROCESS USING CHEMICAL ELECTRODEPOSITION
Diego F. Gómez¹, Andrés Rosales–Rivera¹ y Alvaro Gómez–Peña²
¹ Laboratorio de Magnetismo y Materiales Avanzados, Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Colombia, Sede Manizales.
² Grupo de Procesos Químicos Catalíticos y Biotecnológicos, Facultad de Ingeniería y Arquitectura, Universidad Nacional de Colombia, Sede Manizales.
Contacto: Diego F. Gómez dfgomezm@unal.edu.co
Contacto: Andrés Rosales–Rivera arosalesr@unal.edu.co
Contacto: Alvaro Gómez–Peña alvgomezp@unal.edu.co
(Recibido: 06/2011. Aceptado: 12/2011)
Cómo citar: Torres, D.F., Rosales–Rivera, A., Gómez–Peña, A., Momento, 43, 57 (2012)
Resumen
El presente trabajo se enfoca al diseño y desarrollo de un potenciostato, el cual pueda utilizarse en diferentes áreas incluyendo síntesis de materiales usando electro–deposición química, estudios de procesos de corrosión y pruebas de voltamperometria cíclica. El potenciostato desarrollado es versátil, estable, opera en el rango de micro–amperios y provee un alto rendimiento como el de un potenciostato comercial pero es de menor costo. En la construcción del potenciostato, se utilizaron amplificadores operacionales que presentan bajas corrientes de polarización, alta impedancia de entrada y baja tensión de offset, así como simulación de cargas con resistencias reales. Este potenciostato fue usado para caracterizar el proceso de óxido–reducción que ocurre en la electrodeposición química de paladio sobre un substrato. Los resultados de voltametria y deposición final son comparables con resultados reportados en la literatura para el paladio.
Palabras clave: Potenciostato, Electrodeposición quí Técnicas Electroanalíticas
Abstract
This work focuses on the design and development of a potentiostat, which can be used in different areas including synthesis of materials by chemical electrodeposition, studies of corrosion processes and tests of cyclic voltammetry. The developed potentiostat is versatile, stable, operates in the range of micro–ampere and pro-vides high performance as a commercial potentiostat but is lowest cost. Operational amplifiers featuring low currents of polarization, high impedance input and low offset voltage, as well as simulation of real resistance loads were used in the construction of the potentiostat. This potentiostat was used to characterize the process of redox occurring in the chemical electrodeposition of PD on a substrate. Voltammetry and final deposition results are comparable with results reported in the literature for the palladium.
Keywords: Potentiostat, chemical electrodeposition; electroanalytical techniques.
Introducción
Un potenciostato es un dispositivo electrónico que cumple con las siguientes condiciones: (1) es una fuente de potencia de corriente continua de potencial conocido, (2) suministra corrientes eléctricas que pueden variar desde nano a miliamperios, sin que el potencial altere su valor. Los potenciostatos se emplean en diferentes contextos, incluyendo técnicas electroanalíticas, tales como Culombimetría y Voltamperometría, y en procesos de electrodeposición química enfocada hacia la síntesis de materiales [1]. En el último caso, el potenciostasto se emplea para controlar una celda y sus respectivos electrodos, donde se realiza la síntesis de los materiales. Existen diferentes tipos de potenciostatos–galvanostatos comerciales cada uno con caracteristicas específicas y ventajas comparativas [2], pero debido a sus costos nos hemos enfocado como objetivo principal en este trabajo, en el desarrollo de un potenciostato de bajo costo en comparación con los comerciales, orientado hacia la síntesis de materiales usando la técnica de electrodeposición química, estudios de procesos de corrosión y pruebas de voltamperometria cíclica, que cumpla con especificaciones técnicas de un potenciostato comercial en el rango de microamperios. A continuación, se presenta una breve revisión sobre aspectos teóricos y experimentales de la técnica de eletrodeposición química, además algunas caracteristicas del potenciostato desarrollado. En en la parte final se presentarán algunos resultados obtenidos de voltametria y cronoamperometria en la solución de PdCl2 60mM usada para verificar el funcionamiento del potenciostato mencionado.
Aspectos teóricos
El fenómeno de la electrólisis consiste en una reacción química, la cual es desencadenada por la aplicación de un potencial eléctrico. En ella ocurren los procesos de reducción y oxidación. Cuando se aplica esa diferencia de potencial a una carga resistiva, se obtiene un flujo de electrones o corriente, pudiendo así modelar el sistema químico como una serie de impedancias y conectarlas a un circuito eléctrico (potenciostato), el cual suministra una diferencia de potencial controlada y a su vez mide la corriente que circula por la celda electroquímica, ayudándose de un computador para registrar y visualizar los valores en forma automática a lo largo del proceso electroquímico [3, 4]. El proceso de electrodeposición química es ampliamente utilizado para realizar recubrimientos metálicos sobre productos semielaborados. Experimentalmente el proceso de recubrimiento se lleva a cabo por inmersión de los productos semielaborados en un baño electrolítico acuoso cuyos elementos principales son compuestos solubles del metal deseado para el recubrimiento. Las piezas a recubrir se conectan al polo negativo de una fuente de alimentación de corriente, constituyendo los cá los ánodos son generalmente placas o barras de un material insoluble e inerte con el electrolítico utilizado, aunque pueden utilizarse otros materiales conductores [5]. El paso de corriente provoca la deposición sobre los cátodos del metal de interés. Durante el proceso de electrodeposición se produce sobre la pieza que actúa como cátodo una reacción electroquímica de reducción.
Los iones del metal deseado se reducen por acción del paso de la corriente, recubriendo así la pieza metálica sumergida en el baño. Para que esta reacción pueda tener lugar debe suministrarse al sistema la energía eléctrica necesaria para superar el potencial de reducción del ión metálico y ello se realiza controlando la diferencia de potencial que se aplica sobre los electrodos. La cantidad de sustancia electrodepositada es proporcional al valor de la correinte eléctrica circulante en la solución.
Procedimiento Experimental
El esquema básico del sistema desarrollado para la síntesis de materiales usando la técnica de electrodeposición química se ilustra en la Fig 1. El sistema consiste principalmente de los 3 bloques siguientes:
- Celda electroquímica y sistema de electrodos.
- Circuito eléctrico (Potenciostato).
- Tarjeta de adquisición de datos y conexión con el computador.
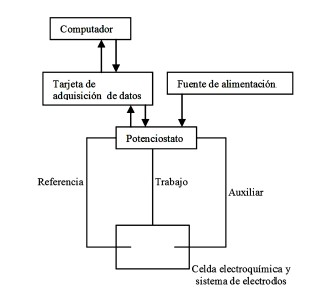
Figura 1. Esquema básico del sistema de electrodeposición química desarrollado en el presente trabajo.
Celda electroquímica y sistema de electrodos
En los sistemas de dos electrodos, el potencial es aplicado a través del electrodo de referencia y el de trabajo, tal como se indica en la Fig. 2a. Aunque el electrodo de referencia suele escogerse de alto grado de no polarizabilidad, el paso de corrientes elevadas provoca la aparición, en este terminal, de un sobrevoltaje. Lo que hace inoperable la utilización del electródo de referencia. Además, debido
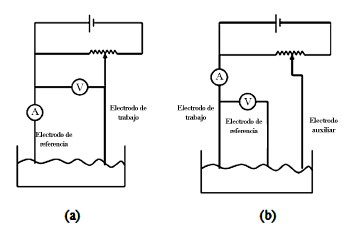
Figura 2. Sistemas de dos y tres electrodos.
a la resistencia eléctrica presentada por la disolución, la diferencia de potencial utilizada, no toda se destina al electrodo de trabajo, sino que existe una pérdida ohmnica a lo largo de la disolución que origina que el voltaje real existente en la solución entre los electrodos sea inferior al voltaje aplicado. Debido a que el electrodo de referencia debe mantener un potencial constante, no debe haber paso de coriente por allí con el fin de evitar que su potencial varíe. Por ello, en el diseño presentado en este trabajo, se hace necesario introducir un tercer electrodo (auxiliar) que proporcione la corriente necesaria para polarizar al electrodo de trabajo a la tensión deseada como se indica en la Fig. 2b, sin que esto afecte el electrodo de referencia, el cual se conecta a un amplificador con una corriente de polarización muy baja y resistencia de entrada muy alta procurando que la corriente que lo atraviese sea mínima.
El sistema experimental se configuró con una celda electroquímica conformada por tres electrodos, y una solución electrolítica de PdCl2 (60mM), unida al potenciostato, tal como se observa en
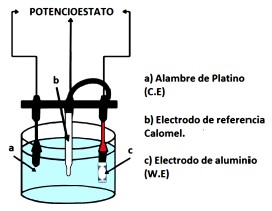
Figura 3. Montaje experimental de una celda electroquímica de tres electrodos.
la Fig. 3. La celda electroquímica para la electrodeposición de metales está compuesta por tres electrodos , el cátodo constituido por los sustratos de grafito u oxido de alúmina anodizada (AAO), alambre de platino de 99.999% de pureza como contra–electrodo y un electrodo de referencia el cual puede ser de Ag/AgCl o Calomel dependiendo de las zonas de potencial que se necesiten. Se utilizó la técnica electroquímica de voltametría cíclica [6] para determinar la densidad de corriente que se generaba en la electrodeposición sobre cada soporte y la ubicación de la zona donde es posible la reducción y la oxidación del paladio.
Etapa de alimentacion de los sensores (Potenciostato)
El circuito básico implementado para la adquisición de datos se muestra en la Fig. 4, el cual se considera que tiene ancho de banda infinito, respondiendo totalmente a una señal de cualquier frecuencia [7, 8].
El circuito fue simulado utilizando el programa Multisim Versión 8, con los siguientes valores: Vin = 0.5V, VCC = 15V, VEE = –15V, R1 = 60Ω y R2 Ω 40. El resultado de la simulación se observa en la Fig. 5. En la cual se aprecia el mantenimiento constante del voltaje. Los valores de R1 y R2 representan la resistividad entre el electrodo Auxiliar y el de Referencia y entre el electrodo Referencia y el de Trabajo respectivamente. El circuito fue simulado con otros valores de R1 y R2 y se observó que el voltaje de realimentación permaneció aproximadamente igual en
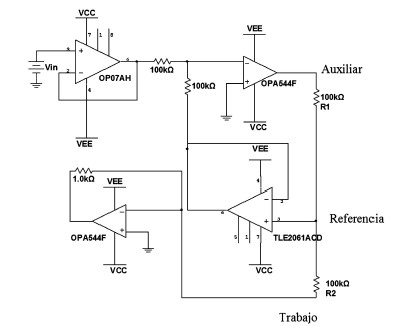
Figura 4. Circuito básico implementado.
valor absoluto al voltaje de entrada, con una variación no mayor a –2% . El voltaje de realimentación aparece negativo, debido a que el amplificador operacional desfasa la salida de la señal 180° con respecto a la señal de entrada. El circuito fue implementado,

Figura 5. Simulación usando multisim del circuito básico desarollado para la adquisición de datos.
reemplazando R1 y R2 por resistencias variables y con un Vin = 1.2V. Se observa un similar comportamiento al obtenido por la simulación. Donde el CH1 es la señal de entrada y CH2 es la señal de realimentación (ver Fig. 6), allí se puede observar la tension de

Figura 6. Imagen obtenida con el osciloscopio digital fluke 192.
salida constante en realimentación con la señal de entrada, el cual es el comportamiemnto esperado en el diseño del equipo. La imagen se obtuvo con la ayuda de un osciloscopio digital fluke 192.
Tarjeta de adquisición de datos y conexión con el computador.
El uso del computador se debe a la necesidad de automatizar el proceso, ya que mediante este, el usuario programa el valor del voltaje de alimentación para los electrodos y obtiene las diferentes gráficas de voltaje y corriente contra tiempo. La comunicación entre el computador y el circuito de alimentación se realiza mediante una tarjeta de adquisición D/A y A/D AT–MIO–16E [9], la cual a su vez debe ir acompañada del tablero de conexiones SCB 100 [10] El programa que controla la tarjeta de adquisición fue desarrollado en Matlab. El código está estructurado en dos partes fundamentales: La primera, es el programa principal, desde el cual se realizan las llamadas a las diferentes funciones, y la segunda, es el conjunto de funciones que permiten realizar tareas concretas y ofrecen mayor orden en la estructura del programa. En la Fig. 7 se aprecia una de las curvas Voltaje–Corriente obtenidas del circuito.
El circuito desarrollado permite realizar la síntesis de metales por electrodeposición química y estudiar el proceso de oxidación anódica.

Figura 7. Gráfica de Voltaje Vs Corriente obtenida con el programa en Matlab.
Resultados y discusión.
Las zonas en las cuales se da el proceso de oxidación y reducción, se pueden determinar a través de estudios de voltametría cíclica. Un ejemplo de una curva de voltametría cíclica obtenida en el presente trabajo, se ilustra en la Fig. 8. Esta se llevó a cabo a 50mV/s

Figura 8. Caracterización de la solución de PdCl2 60mM
desde –1.4V a 1.4V con un electrodo de calomel, como sustrato AAO y contra electrodo alambre de platino 99.999% de pureza, ø= 0.25mm. En esa curva se encuentra que la zona de reducción

Figura 9. Grafica de cronoamperometría simple para determinar tiempo y potencial de nucleación.
de paladio, demarcada con un círculo punteado, está comprendida entre los potenciales de –0.136V hasta –0.425V. Partiendo de estos datos, se procede a encontrar los tiempos y voltajes de nucleación en la superficie porosa de AAO, lo cual se realizó por medio de cronoamperometria. La cronoamperometría se realizó tomando potenciales de forma aleatorias pero que se encuentren dentro de la zona de reducción [11]. En la Fig. 9, se muestran los potenciales escogidos y su respectivo comportamiento. Para determinar el voltaje y tiempo de nucleación, se tomaron valores de aquella prueba, en la que muestre mayor corriente en la cronoamperometría [12]. En este caso la corriente mayor fue encontrada a –0.425V y con un tiempo de nucleación de 0.2 segundos.
Conclusiones
Para el desarrollo del potenciostato presentado en este trabajo, se usaron amplificadores operacionales caracterizados por un valor alto de potencia, ya que la tensión de alimentación para rangos pequeños limita el funcionamiento del circuito al terminar en su etapa de saturación y una baja corriente no logra alimentar los electrodos. Así mismo, deben ser amplificadores operacionales que tengan impedancia de entrada muy alta y corriente de polarización muy baja, para afectar lo menos posible al funcionamiento de las mallas a las que están conectados sus terminales de entrada. La influencia de la corriente de polarización es muy importante cuando las resistencias entre los electrodos toman valores muy grandes, siendo las corrientes que las atraviesan muy pequeñas. En este caso, los terminales de entrada absorberían parte de la corriente necesaria para el correcto funcionamiento del circuito. Ese potenciostato fue usado para caracterizar el proceso de óxido–reducción que ocurre en la electrodeposición química de paladio sobre un substrato. Los resultados de voltametria y deposición final son comparables con resultados reportados en la literatura para el paladio.
Agradecimientos
Este estudio, llevado a cabo en la Universidad Nacional de Colombia, Sede Manizales, fue apoyado por la Oficina de investigación (DIMA) y COLCIENCIAS bajo el proyecto 20201004804.
Referencias
[1] D. Skoog, F. Holler, T. Nieman, and M. Gómez, Principios de análisis instrumental, 5th ed. (McGraw–Hill, 2001) pp. 673–688.
[2] CYENITEC LTDA, "Potenciostatos. gamry instruments," (2011), acceso 20–10–2011.
[3] J. Barrero, Rev. Ingenierias 3, 1 (2009).
[4] Fundación Itma, "Potenciostato galvanostato," (2010), acceso 20–08–10.
[5] Y. Guerasimov, Curso de Quimica Fisica, Vol. 2 (1998) pp. 293–293.
[6] A. Bard and L. Faulkner, Electrochemical Methods: Fundamentals and Applications (Wiley, 2000).
[7] R. Boylestad, Electrónica: Análisis de Circuitos. (Prentice Hall Hispanoamerica, S.A, 1997) p. 655.
[8] D. Schilling, M. García, C. Belove, T. Apelewicz, and R. Sacardi, Circuitos electrónicos discretos e integrados (McGraw–Hill, 1993) p. 963.
[9] National Instruments, DAQ ATMIOAI E Series. User Manual, Tech. Rep. (1996).
[10] J. Engberg, "www.engberg.dk/cbi/terminals/scb-100.htm," Acceso 5–06–2010.
[11] I. Danaee, J. Electroanal. Chem. 662, 415 (2011).
[12] S. H. Ahn, I. Choi, O. J. Kwon, and J. J. Kim, (Private communication).
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Article abstract page views
Downloads
License
Those authors who have publications with this journal, accept the following terms:
a. The authors will retain their copyright and will guarantee the publication of the first publication of their work, which will be subject to the Attribution-SinDerivar 4.0 International Creative Commons Attribution License that permits redistribution, commercial or non-commercial, As long as the Work circulates intact and unchanged, where it indicates its author and its first publication in this magazine.
b. Authors are encouraged to disseminate their work through the Internet (eg in institutional telematic files or on their website) before and during the sending process, which can produce interesting exchanges and increase appointments of the published work.



















