FORMULACIÓN MECÁNICA DE LA TERMODINÁMICA DE HELMHOLTZ
MECHANICAL FORMULATION OF HELMHOLTZ'S THERMODYNAMICS
Keywords:
Termodinámica, Helmholtz, Modelo Mecánico de Monociclos. (es)Thermodynamics, Helmholtz, Unicycles Mechanical Model. (en)
Downloads
En el siglo XIX la idea mecanicista de los fenómenos naturales se había consolidado hasta el punto de creer que era posible describir todas la física a partir de la teoría mecánica. En este trabajo se mostrará como la termodinámica es influenciada por este prejuicio; iniciando con la hipótesis fundamental que motivó y llevó a Helmholtz a darle una interpretación mecánica a los principios de la termodinámica basándose en el modelo mecánico de monociclos que finalmente pierde relevancia al entrar en crisis el modelo mecanicista del mundo natural.
In the nineteenth century, the mechanistic idea of natural phenomena had been consolidated to the point of believing that it was possible to explain all the physical from the mechanical theory. In this paper we show how thermodynamics is influenced by this prejudice, beginning with the fundamental hypothesis that motivated and led Helmholtz to give a mechanical interpretation of the principles of thermodynamics based on the mechanical model of unicycles that finally loses relevance when entering crisis the mechanistic model of the natural world.
FORMULACIÓN MECÁNICA DE LA TERMODINÁMICA DE HELMHOLTZ
MECHANICAL FORMULATION OF HELMHOLTZ'S THERMODYNAMICS
Brenda P. Rodríguez†, Henry Núñez‡.
†Grupo PRODUCOM, Facultad de Ingeniería Industrial, Universidad de la Costa CUC, Barranquilla, Colombia.
‡Grupo Ciencia de Materiales, Facultad de Matem_atica Astronomía y Física, Universidad
Nacional de Córdoba, Córdoba, Argentina.
Resumen
En el siglo XIX la idea mecanicista de los fenómenos naturales se había consolidado hasta el punto de creer que era posible describir toda la física a partir de la teoría mecánica. En este trabajo se mostrará como la termodinámica es influenciada por este prejuicio; iniciando con la hipótesis fundamental que motivó y llevó a Helmholtz a darle una interpretación mecánica a los principios de la termodinámica basándose en el modelo mecánico de monociclos que finalmente pierde relevancia al entrar en crisis el modelo mecanicista del mundo natural.
Palabras clave: Termodinámica, Helmholtz, Modelo Mecánico de Monociclos.
Abstract
In the nineteenth century, the mechanistic idea of natural phenomena had been consolidated to the point of believing that it was possible to explain all the physical from the mechanical theory. In this paper we show how thermodynamics is inuenced by this prejudice, beginning with the fundamental hypothesis that motivated and led Helmholtz to give a mechanical interpretation of the principles of thermodynamics based on the mechanical model of unicycles that finally loses relevance when entering crisis the mechanistic model of the natural world.
KeywordsThermodynamics, Helmholtz, Unicycles Mechanical Model.
Introducción
En el ámbito de la Física del siglo XVIII el calórico, al igual que el éter y la luz, se consideraba como una sustancia que no se podía mantener encerrada en un recipiente (sustancia incoercible) y que podía fluir hacia y desde todas las sustancias. [1]. A partir de la hipótesis del calórico se da origen a muchos de los fenómenos físicos que hoy día son propios de la termodinámica, entre los que se destacan el teorema de Carnot a comienzos del siglo XIX. Para entonces era de amplio uso las maquinas térmicas. Sin embargo, no se tenía conocimiento acerca de qué dependía su rendimiento hasta que en 1824 Sadi Carnot hizo toda una teoría para explicar tal fenómeno. [2]. Tal vez el hecho que diera inicio a un nuevo campo de la física que hoy día conocemos como Termodinámica.
En 1849 Joule presenta ante Kelvin los resultados de un trabajo en el que afirma que ha comprobado, en su fábrica, que el calor se puede transformar en energía mecánica. Kelvin se da cuenta de la prácticamente inaceptable afirmación de Joule: "que el calor se transforma en trabajo". Pues esto se salía de la hipótesis del calórico que aún predominaba en ese momento. Para Kelvin, aceptar lo dicho por Joule tiene una implicación inmediata; en el teorema de Carnot hay algo que físicamente no es correcto. Sin embargo, el teorema en la práctica funciona adecuadamente. En consecuencia, si se acepta lo que dice Joule, hay que demostrar el teorema de Carnot saliéndose del marco de la teoría del calórico. Es decir, usando una nueva hipótesis de calor. De aquí que Kelvin se ve en la necesidad de crear un segundo principio para demostrar el teorema de Carnot borrando la idea de calor. Y hay que borrar esa vieja idea porque Joule ha demostrado que el calor se transforma en trabajo. En consecuencia, los cuerpos no tienen calor, sino que este es una forma de energía. De esta forma se acepta un primer principio que es la experiencia de Joule para borrar la teoría anterior del calor y se da origen a un segundo principio, porque de otra forma el teorema de Carnot quedaría en el "aire", pero se sabe que el teorema de Carnot en la práctica anda bien [2]. La termodinámica se basa en estos dos principios, los cuales se pueden expresar matemáticamente de la siguiente forma: Si se aplica a un sistema la cantidad de calor dQ y el trabajo externo ⅀Ada, la energía interna del sistema E, se aumenta en una cantidad dE. Es decir, la primera ley queda expresada en la forma:
(1)
dE = dQ + ⅀Ada
En 1854 Rudolf Clausius, introduce el concepto de entropía, y de acuerdo a la segunda ley, formulada por Clausius, el calor añadido está relacionado con el cambio de esta función de estado mediante la expresión:
(2)
dQ = θdS;
donde θ es la temperatura absoluta a la cual el calor es agregado y S la entropía.
El fuerte arraigo que había en el siglo XIX de pensar que la mecánica era el fundamento de todas las ramas de la física hasta el punto que muchos físicos de la época solo consideraban válidas a aquellas teorías físicas basadas en principios mecánicos [3]. Influyó en los dos trabajos mediante los cuales Helmholtz hizo los principales aportes a la termodinámica, ambos publicados en 1884 [4]. En ellos expone su modelo mecánico de la termodinámica y sobre todo del segundo principio, dado que el primero se puede interpretar como la extensión a la termodinámica del principio de conservación de la energía.
En el presente trabajo se mostrará la versión mecánica de la termodinámica según Helmholtz a partir de un modelo teórico que se describe a continuación.
Termodinámica de Helmholtz
Helmholtz recurre para su interpretación mecánica al modelo de Monociclos, los cuales consisten en el movimiento circular de las moléculas, análogo al de una rueda que gira sobre su propio eje, la energía del sistema estaría asociada a la velocidad angular de la rueda. Monociclos con un movimiento se llamaban monociclos simples y con más de un movimiento, monociclos compuestos [4]. Además, basaba su modelo a partir de tres tesis fundamentales:
- Todos los procesos en la naturaleza satisfacen la ley de conservación de la energía.
- Todos los procesos en la naturaleza satisfacen a un conjunto de ecuaciones diferenciales derivadas del principio de mínima acción de Hamilton.
- El calor consiste en el movimiento estacionario, oculto de las moléculas [3]
A partir de la ecuación (2) es posible mostrar que el equilibrio térmico de dos cuerpos está indicado por la igualdad de las temperaturas. Por lo tanto, toda función de la temperatura tendrá esta propiedad. Esto conlleva a que existan muchas alternativas de plantear esta ecuación. En consecuencia, Helmholtz, en su objetivo de describir mecánicamente el calor, reescribe la ecuación (2) en la forma:
(3)
dQ = δdσ
donde δ es una función de T y de unos parámetros del sistema y s es una función de S. Para obtener la estructura de la ecuación (3) se requiere la condición de equilibrio termodinámico y parte del hecho que: un sistema a temperatura idéntica en todos sus puntos, puede ser construido a partir de dos sistemas parciales, 1 y 2. Así para el calor agregado se tiene:
(4)
dQ = dQ1 + dQ2 = _dS1 + θdS2 = θd(S1 + S2) = θdS
Lo que significa que la ecuación (2) es válida para todo el sistema al igual que para dos sistemas parciales tomados individualmente.
Helmholtz así enfrenta el problema encontrando la contraparte mecánica de la ecuación (4). La idea de los monociclos de Helmholtz está basada en las ecuaciones de Lagrange las cuales se derivan del principio de mínima acción de Hamilton. En particular empieza con la ecuación de Lagrange en la forma:
(5)
![]()
donde F es la fuerza actuando sobre la coordenada generalizada q, ![]() es la velocidad generalizada, L es la función Lagrangiana que se define como la diferencia entre la energía cinética y potencial de notadas por T y U respectivamente
es la velocidad generalizada, L es la función Lagrangiana que se define como la diferencia entre la energía cinética y potencial de notadas por T y U respectivamente
(6)
L = T - U
La energía potencial U es una función de la coordenada y T tiene la forma:
(7)
![]()
donde ![]() es el momento generalizado.
En el marco de su hipótesis, Helmholtz, divide los parámetros que describen el sistema monocíclico en dos clases que llamaremos (a) y (b). Los parámetros (a) varían muy lentamente y están relacionados con el movimiento del sistema en su conjunto; los parámetros (b) varían rápidamente y corresponden a los movimientos moleculares.
Ahora la ecuación (5) se puede expresar en término de los parámetros (a) y (b), haciendo un cambio de coordenadas qa y qb; donde la coordenada qb representa el movimiento estacionario de las moléculas, que en términos termodinámicos consiste en el movimiento molecular del calor.
es el momento generalizado.
En el marco de su hipótesis, Helmholtz, divide los parámetros que describen el sistema monocíclico en dos clases que llamaremos (a) y (b). Los parámetros (a) varían muy lentamente y están relacionados con el movimiento del sistema en su conjunto; los parámetros (b) varían rápidamente y corresponden a los movimientos moleculares.
Ahora la ecuación (5) se puede expresar en término de los parámetros (a) y (b), haciendo un cambio de coordenadas qa y qb; donde la coordenada qb representa el movimiento estacionario de las moléculas, que en términos termodinámicos consiste en el movimiento molecular del calor.
Dado que L es independiente de la coordenada cíclica qb, el primer término de la ecuación (5) se hace cero por lo que se reduce a:
(8)
![]()
Por su parte las coordenadas qa del sistema monocíclico, varían muy lentamente en comparación a qb y como las qa son infinitamente pequeñas, entonces en términos de los parámetros (a), de la ecuación (5) se obtiene que:
(9)
![]()
Como qa no contribuye a la energía cinética del sistema monocíclico, la energía cinética T sólo depende de la velocidad cíclica qb, entonces la ecuación (7) queda simplificada a:
(10)
![]()
El trabajo cíclico dQb, debido a la fuerza Fb que actúa sobre la coordenada qb, es:
(11)
![]()
(12)
![]()
De igual forma el trabajo dQa, que constituye el análogo del trabajo termodinámico externo, Helmholtz lo expresa como:
(13)
![]()
Entonces la energía dE total añadida al sistema monocíclico está compuesta por dos diferentes trabajos, los expresados en las ecuaciones (12) y (13). Por lo que la primera ley queda expresada en la forma:
(14)
![]()
Para obtener el equivalente mecánico de la segunda ley, Helmholtz reescribe dQb, en términos de la energía cinética. Al dividir ambos lados de la ecuación (12) por la energía cinética T, se obtiene:
(15)
![]()
Reemplazando T en la ecuación anterior, en la forma expresada en (10)
(16)
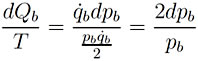
Se llega a que la razón dQb![]() T es una diferencial exacta, la cual corresponde a la entropía
T es una diferencial exacta, la cual corresponde a la entropía
(17)
![]()
Por lo tanto, el equivalente mecánico de la segunda ley de la termodinámica, según Helmholtz, queda expresado en la forma:
(18)
![]()
En consecuencia, la entropía para el modelo de los monociclos está dada por:
(19)
![]()
Al despejar el momento generalizado en (10) y reemplazarlo en (19), la entropía es ahora igual a:
(20)
![]()
Si tomamos como ejemplo el sistema de gas ideal donde pV = Rθ, dE = CV dθ y combinando las ecuaciones (1) y (2) se obtiene CV dθ = θdS - pdV ; al dividir esta ecuación por la temperatura, θ, se tiene que la entropía para un gas ideal es:
(21)
![]()
Al comparar estas dos últimas ecuaciones, se observa que la energía cinética en (20) corresponde a la temperatura en (21) y la magnitud extensivas pb q_b (momento de inercia rotacional del sistema monocíclico) se hace corresponder con el volumen V del sistema de gas ideal.
Conclusión
Uno de los principales aportes de Helmholtz a la ciencia es la formulación de la ley de conservación de la energía. Y aunque sus ideas sobre sistema monocíclico fueron fundamentales para desarrollar su modelo mecánico de los principios de la termodinámica, este fue perdiendo importancia en la medida que el mecanicismo fue desapareciendo a finales del siglo XIX. Sin embargo, se torna interesante estudiar su contexto histórico porque pone de manifestó la influencia que tuvieron sus ideas sobre investigadores de la época. Por ejemplo, la idea de monociclos es tomada por Boltzmann para hacer una representación mecánica de la teoría de Maxwell. Boltzmann mediante la noción de ciclo genera un modelo funcional de dos circuitos eléctricos en interacción [5].
Referencias
[1] J. Desai, H. Pathan, S.-K. Min, K.-D. Jung, and O.-S. Joo, Appl. Surf. Sci. 252, 2251 (2006).
[2] R. Strobel and S. E. Pratsinis, Adv. Powder Technol. 20, 190 (2009).
[3] Y. C. Kang and S. B. Park, J. Aerosol Sci. 26, 1131 (1995).
[4] A. Gurav, T. Kodas, T. Pluym, and Y. Xiong, Aerosol Sci. Tech. 19, 411 (1993).
[5] S. E. Pratsinis and S. Vemury, Powder Technol. 88, 267 (1996).
[6] N. Reuge, J. Dexpert-Ghys, M. Verelst, and B. Caussat, Chem. Eng. Process. 47, 731 (2008).
[7] C. T. Yavuz, A. Prakash, J. Mayo, and V. L. Colvin, Chem. Eng. Sci. 64, 2510 (2009).
[8] J. Mayo, C. Yavuz, S. Yean, L. Cong, H. Shipley, W. Yu, J. Falkner, A. Kan, M. Tomson, and V. Colvin, Sci. Technol. Adv. Mat. 8, 71 (2007).
[9] S. Lin, D. Lu, and Z. Liu, Chem. Eng. J. 211-212, 46 (2012).
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Article abstract page views
Downloads
License
Those authors who have publications with this journal, accept the following terms:
a. The authors will retain their copyright and will guarantee the publication of the first publication of their work, which will be subject to the Attribution-SinDerivar 4.0 International Creative Commons Attribution License that permits redistribution, commercial or non-commercial, As long as the Work circulates intact and unchanged, where it indicates its author and its first publication in this magazine.
b. Authors are encouraged to disseminate their work through the Internet (eg in institutional telematic files or on their website) before and during the sending process, which can produce interesting exchanges and increase appointments of the published work.



















