Identificación de QTLs para carotenos en el genoma de yuca,(Manihot esculenta Crantz), y validación en poblaciones S1
Identification of QTLs for carotene content in the genome of cassava (Manihot esculenta Crantz) and S1 population validation
Palabras clave:
Carotenos, Manihot esculenta Crantz, mapeo genético, QTLs, SSR. (es)Carotenes, Manihot esculenta Crantz, genetic mapping, QTLs, SSR (en)
Descargas
Agronomía
1Docente, Universidad de los Llanos, Villavicencio (Meta, Colombia); 2Docente Universidad Francisco de Paula Santander, Cúcuta (Santander, Colombia), 3Investigador Programa de Mejoramiento de Yuca, CIAT-Palmira (Valle, Colombia). *Autor para correspondencia: amorillo@unillanos.edu.co
El contenido de b-caroteno en yuca (Manihot esculenta Crantz) es importante para suplir las deficiencias de vitamina A en regiones donde esta raíz es la principal fuente de alimento. Las familias de esta especie utilizadas para el análisis molecular del contenido de carotenos fueron: GM 708, GM 734 y CM 9816. Se utilizó el Análisis de Grupos Segregantes (Bulked Segregant Analysis, BSA por su sigla en inglés) para la evaluación de 800 marcadores microsatélites. Para determinar la asociación con el color del parénquima de la raíz se hizo un análisis de correlación y regresión simple entre los datos fenotípicos y los genotípicos de cada marcador. Se hizo, además, un análisis de QTLs con estas familias y se validó su presencia en descendencias S1. Se encontró que los marcadores SSRY 313, NS717, SRRY 251 están fuertemente asociados con los altos contenidos de carotenos. Los análisis de mapeo mostraron que existen cinco QTLs que controlan la expresión del contenido de b-caroteno y tres el color de pulpa de la raíz, lo cual fue validado en poblaciones S1. En general, el conocimiento de la herencia y la acción del gen de acumulación del b- caroteno en yuca puede ser usado para guiar eficientemente los procesos que buscan mejorar la calidad nutricional de la yuca.
Palabras clave: Carotenos, Manihot esculenta Crantz, mapeo genético, QTLs, SSR.
The b-carotene content in cassava is important to reach supply vitamin deficiencies, in regions where this is the main source of food. The families used for molecular analysis of carotenoid content were: GM 708, GM 734 and CM9816. We used Bulk Segregant Analysis (Bulked Segregant Analysis, BSA) for evaluation of 800 microsatellite markers, to determine the association with de color of the root parenchyma was a correlation analysis and simple regression between phenotypic and genotypic data from each marker. An analysis was made of QTLs with these families and validated its presence in S1 progenies. We found that SRRY 313, NS7171, SSRY 251 were strongly associated with the high content. The mapping analysis showed that five QTLs which are controlling the expression of b-carotene content and three color root pulp, which was validated in populations S1. In general, knowledge of inheritance and gene action accumulation of b-carotene in cassava, can be used to efficiently guide improvement processes aimed at improving the nutritional quality of cassava.
Key words: Carotenes, Manihot esculenta Crantz, genetic mapping, QTLs, SSR.
La yuca, Manihot esculenta Crantz, es una de las fuentes de carbohidratos mayormente consumida por gran parte de la población de los países en desarrollo (Ceballos y De la Cruz, 2002). La deficiencia de vitamina A es un problema importante en la salud pública de los países en vías de desarrollo, ya que anualmente causa ceguera prevenible en un estimado entre 20,000 y 100,000 niños o jóvenes (Tanumihardjo y Yang 2005).
La síntesis de los carotenoides es un proceso metabólico importante para el entendimiento de la biología molecular de la carotenogénesis (Cunnigham y Gantt, 1998). La ruta inicia con la formación del fitoeno a partir de la condensación de dos moléculas trans de GGPP (Geranyl-geranylpirofosfato). La reacción es catalizada por la enzima Fitoeno sintasa, y el gen (PSY) sufre cuatro desaturaciones, para formar licopeno (Fraser y Bramley, 2004). La Licopeno b-ciclasa (LCY-b) cataliza la formación del b-caroteno y de un anillo de a-caroteno a partir de licopeno (Cunningham, 2002). Los genes (PSY, PDS, ZDS, CRT ISO) y las enzimas involucradas en la biosíntesis de los pigmentos carotenoides han sido ampliamente estudiados (Tian y Dellapenna 2004a; T ian et al., 2004b; Park et al., 2002; Tucker, 2003; Laule et al., 2003).
En el Centro Internacional de Agricultura Tropical (CIAT) se han desarrollado investigaciones relacionadas con la construcción de mapas y búsqueda de QTLs asociados a características de interés en yuca (Jorge et al., 2000; Ferguson et al., 2012; Okogbenin y Fregene, 2002; 2003). Muchas de las características de importancia económica son gobernadas por estos Loci de herencia cuantitativa, por tanto, el objetivo en este trabajo fue identificar esas regiones genómicas del mapa de yuca, asociadas con el contenido de carotenos y validarlas en poblaciones S1.
Análisis molecular
El trabajo se realizó en el Laboratorio de Genética de Yuca del CIAT, Palmira. Para el efecto se seleccionaron las familias GM 708 (MBR A1A * MM AL66), GM 734 (MT AI2*CM3750-7) y la CM9816 (MCOL 2295*SM980-4) del Programa de Mejoramiento de Yuca. Para el análisis molecular se usaron 800 microsatélites (Mba et al., 2001) que fueron analizados usando la metodología de Análisis de Grupos Segregantes (BSA) descrita por Mba et al. (2001). La extracción de ADN se hizo con el protocolo de Dellaporta et al. (1983) y se cuantificó con un espectrofotómetro (Shimadzu UV-VIS 160). La amplificación de los microsatélites se realizó en un termociclador MJ research PTC-100TM Programmable Thermal Controller con hot bonnet (MJ Research, Inc – USA), las temperaturas y el cóctel de amplificación se hicieron según Mba et al. (2001). Para la detección y visualización de los microsatélites se hizo una electroforesis de tipo vertical en geles de poliacrilamida al 4% (McCouch et al., 1997), usando un equipo de secuenciación Sequi-Gen GT Nucleic Acid Electrophoresis Inc U.S.A. Bio-Rad 2001.
Para el análisis de regresión simple, entre el contenido de carotenos, el color de pulpa de la raíz y el número de alelos en el locus marcador, se usó el comando Un Punto (Single Point) del programa MapMaker. El análisis de mapeo por intervalo se hizo usando el comando regresión por intervalo (interval regresion) y para visualizar los resultados de la regresión simple se utilizó el comando multiplot del programa Mapmaker.
Análisis de QTLs
Para crear el mapa de QTLs y hacer el mapeo por intervalos se usó el programa Mapmaker/ QTL, para lo cual se tomaron como referencias el mapa de yuca (Fregene et al., 1997) y el desarrollado para la característica de carotenos (Marín et al., 2009). Un QTL fue declarado significativo cuando a < 0.05 y explicaba gran parte de la variación fenotípica dado por el valor de R2. Para el mapeo de QTLs por intervalos asociados con características como contenido de carotenos y color de pulpa de la raíz en yuca, se usó un LOD 3.0 para declarar la presencia de un QTL, lo que se confirmó usando un modelo de QTL múltiple de mapeo por intervalo (Mapmaker/ QTL) y regresiones múltiples (Zeng, 1993) usando 10,000 permutaciones.
Validación de QTLs en familias S1
Las familias S1 utilizadas (Cuadro 1) para evaluar los marcadores microsatélites polimórficos asociados con el contenido de carotenos en raíces de yuca encontrados en las evaluaciones realizadas con poblaciones segregantes (Morillo et al., 2011), fueron obtenidas a partir de una población de más de 50 familias de hermanos completos y de un grupo de cinco familias seleccionadas (Morillo et al., 2012).

Análisis de distribución de frecuencias de carotenos totales en las familias S1
Los contenidos de carotenos totales y b-caroteno se analizaron usando estimaciones de promedio correlación, regresión y desviaciones estándar (Microsoft Excel, SAS (SAS, 2005). Se construyeron histogramas de frecuencia y gráficas de dispersión. Las asociaciones entre el contenido de carotenos totales y la intensidad de color del parénquima, fueron analizadas con regresión lineal.
Evaluación de marcadores microsatélites polimórficos en las familias S1 evaluadas
Se utilizaron 56 marcadores microsatélites (SSRY ) polimórficos (Morillo et al., 2011) para hacer análisis de correlación con el fin de determinar el grado de asociación entre el contenido de carotenos y el marcador molecular. Para determinar las posiciones relativas en el mapa y validar los QTLs encontrados se usaron los programas Mapmaker y QTLCartographer.
Análisis de QTLs
Con las informaciones del mapa genético y molecular de yuca (Fregene et al., 1997) y el de QTLs para carotenos (Marín et al., 2009) se ubicaron los microsatélites asociados con QTLs en los grupos de ligamiento formados, utilizando los Análisis de Simple Marcador (A.S.M), Análisis de Mapeo por Intervalo (A.M.I) y Análisis de Mapeo por Intervalo Compuesto (A.M.I.C). Para la familia GM 708, con el análisis de regresión entre los microsatélites evaluados y el contenido de b-caroteno, se obtuvieron valores de correlación entre 23% (SSRY -226) y 44% (SSRY -313) y de regresión entre 0.05 y 0.19, respectivamente (Cuadro 2).
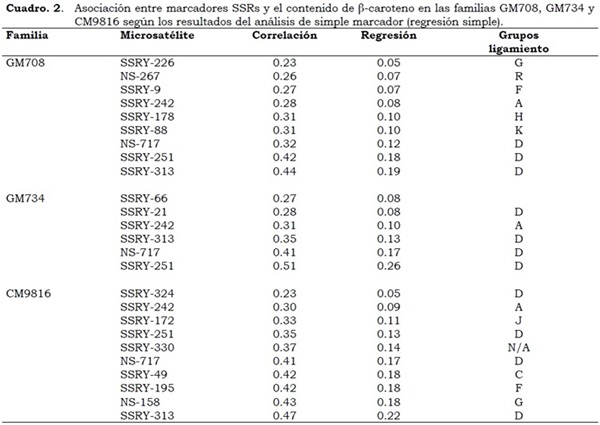
Para la familia GM 734 las correlaciones con b-caroteno variaron entre 0.27 (SSRY -66) y 0.51 (SSRY-251) con valores de regresión entre 0.08 y 0.26. (Cuadro 2). En la familia CM9816, el SSRY-313 ubicado en el grupo de ligamiento D, presentó los mayores valores de correlación y regresión. Para las tres familias fueron identificados cinco QTLs en el grupo ligamiento D, sugiriendo posiblemente que los QTLs mayores, que incrementan el contenido de b-caroteno, residen en este grupo de ligamiento (Cuadro 2).
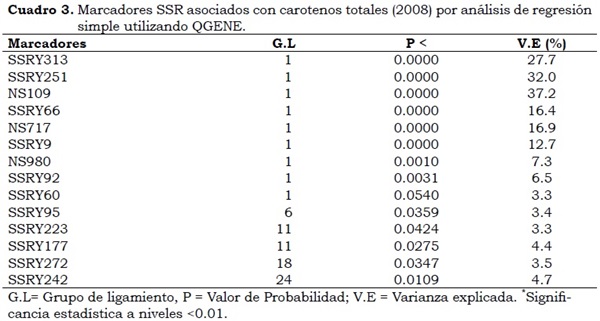
Las familias GM 708 y CM9816 presentaron QTLs en el grupo de ligamiento G (Cuadro 3), mientras otros seis QTLs fueron únicos entre las familias estudiadas. Con los análisis de regresión utilizando el programa QGENE, mapdisto y WinQTLcart, se identificaron cinco grupos de ligamiento los cuales presentan marcadores asociados con posibles QTLs para carotenos totales con efecto significativo (a = 0.005) y con siete marcadores microsatélites ubicados en el grupo de ligamiento-1 del mapa genético para la característica contenido de carotenos, con una probabilidad P ( a < 0.001) los cuales explican desde 7.3% hasta 37.2% de la variación fenotípica observada para los marcadores microsatélites que presentaron mejor comportamiento (Cuadro 3).
En la Figura 1 se observa que los marcadores con color rojo, entre ellos NS-717, SSRY-9, SSRY-251 y SSRY-313, tienen un efecto altamente significativo en el grupo de ligamiento-1 con una probabilidad a < 0.001. En el grupo de ligamiento 22 se ubica el marcador SSRY -242, el cual ha mostrado consistencia cuando se ha evaluado el polimorfismo en diferentes poblaciones de yuca de raíces amarillas (Marín et al., 2009).
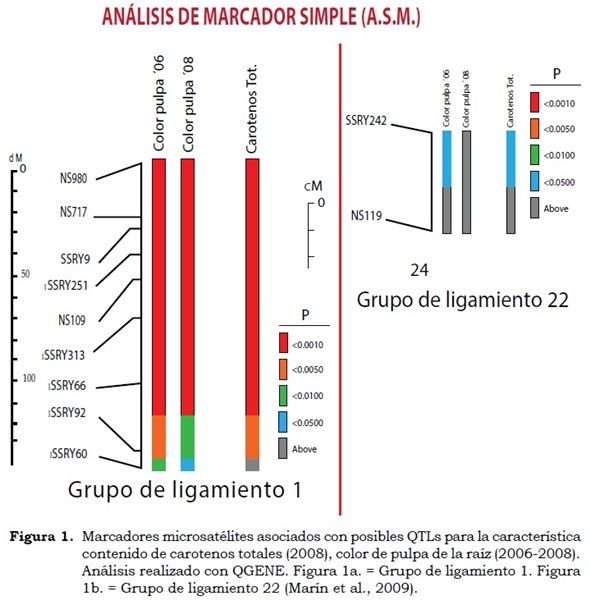
En el mapeo por intervalo se encontró que los marcadores SSRY-313, SSRY-251, SSRY- 66, SSRY -242, NS-717 y SSRY -9 explicaron entre 20 y 40% de la variación fenotípica (a< 0.001) (Cuadro 3), con cinco posibles QTLs, los cuales se encuentran en los intervalos QCCT1 (SSRY60-SSRY66), QCCT2 (SSRY66- SSRY 313), QCCT3 (SSRY 313-NS109), QCCT4 (NS109-SSRY 251), QCCT5 (SSRY 251-NS717) y en el grupo de ligamiento-1 del mapa genético que se tiene para la característica (Figura 1). Para la característica color de pulpa de la raíz, usando un LOD score > 3.0 se encontraron cinco posibles QTLs ubicados en el grupo de ligamiento-1 entre los intervalos QCPR8-1 (SSRY60-SSRY66), QCPR8-2 (SSRY66-SSRY313), QCPR8-3 (SSRY313- NS109), QCPR8-4 (NS109-SSRY -251) y QCPR (SSRY 251-NS717).
Los análisis de mapeo de intervalo compuesto muestran que tres QTLs, ubicados entre los intervalos QCCT1 (SSRY66-SSRY313), QCCT2 (SSRY313-NS109) y QCCT3 (NS109- SSRY251), controlan el contenido de carotenos totales y explican alrededor del 40% de la variación fenotípica. Para el color de pulpa de la raíz se han encontrado cuatro QTLs localizados en los intervalos QCPR8-1 (SSRY66-SSRY313), QCPR8-2 (SSRY313- NS109), QCPR8-3 (NS109-SSRY251), QCPR8- 4 (SSRY 251-NS717) y ubicados en el grupo de ligamiento 1.
Validación de QTLs en familias S1
En el análisis de frecuencias del contenido de carotenos totales en las familias AM-691, AM-697, AM-698 y AM-720, muchos genotipos S1 con progenitores con bajo contenido de carotenos totales muestran contenidos de carotenos totales más altos que su respectivo progenitor (Figura 2). En las familias AM-689, AM-692, AM-712 y AM-718, se observaron distribuciones más simétricas, en donde la mayoría de los individuos presentan contenido de carotenos intermedios (Figura 3).


Análisis de marcadores microsatélites en las familias S1
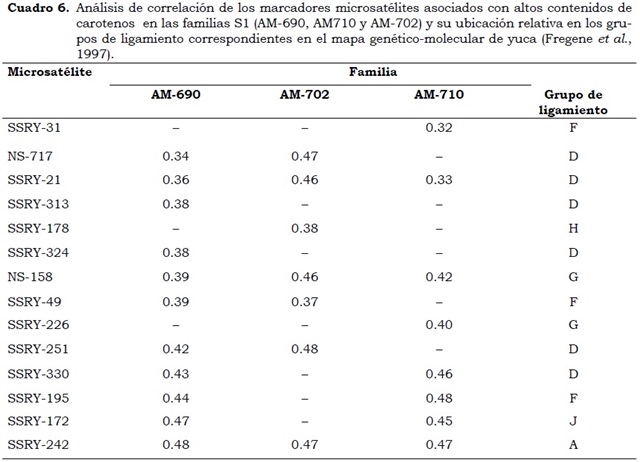
Los análisis de correlación y regresión del contenido de b-caroteno y los microsatélites evaluados corroboran la presencia de Loci de herencia cuantitativa (QTLs), que permitieron identificar microsatélites asociados con bajos, intermedios y altos contenidos de b-caroteno. En las familias S1: AM-691, AM-697, AM- 698 y AM-720 de progenitores con contenidos bajos de b-caroteno, se encontraron microsatélites altamente correlacionados como el SSRY -49 , SSRY -88 y SSRY -178 ubicados en el mapa de yuca en los grupos de ligamiento F, K y H. (Cuadro 4). Se encontraron regiones del genoma asociadas con contenidos intermedios de b-caroteno en las familias S1: AM-689, AM692, AM-712 y AM718 con los microsatélites SSRY -172, SSRY -195 y SSRY -49, los cuales se encuentran en los grupos de ligamiento J, F y F, respectivamente (Cuadro 5). Los marcadores SSRY -313, SSRY -251, NS717, SSRY -21, SSRY -242, NS-158 han mostrado, no sólo en este estudio sino en evaluaciones con otras poblaciones estar correlacionados con altos contenidos de carotenos (Cuadro 6).

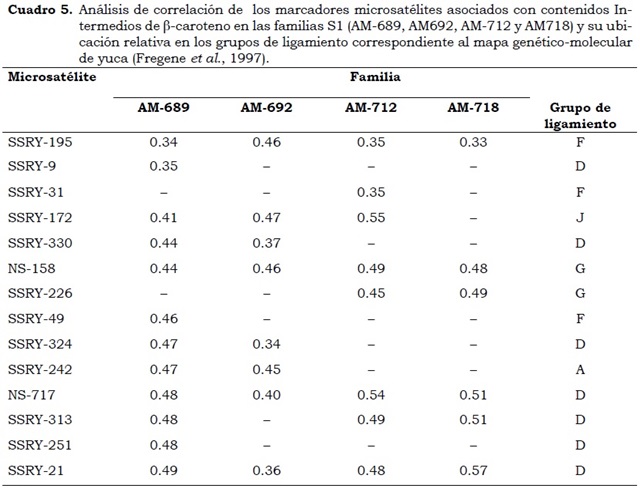
En las familias GM 708 y CM9816 se encontraron QTLs en el grupo de ligamiento G, mientras que otros seis fueron únicos entre las tres familias evaluadas, por lo cual las regiones del genoma que controlan el contenido de b-caroteno en las raíces de yuca son comunes para diferentes fuentes que incrementan los contenidos, pero también pueden ser únicas con respecto a la fuente evaluada. La acción de los genes para todos los QTLs anteriormente mencionados ocurre a través de efectos aditivos (Marín et al., 2009).
Existen factores aún no identificados relacionados con el contenido de carotenos, pero los estudios de QTLs han contribuido significativamente al descubrimiento de nuevos factores que están modificando esta ruta metabólica en diferentes especies (Pérez et al., 2012). En tomate (L. esculentum), por ejemplo, líneas de introgresión presentaron un mayor contenido de carotenoides que sus respectivos progenitores. Lo mismo se ha observado en yuca donde se manifiestan los efectos genéticos aditivos de la característica y se han identificado QTLs para el análisis de la resistencia en campo a Xanthomonas axonopodis pv. manihotis (Jorge et al., 2001), características morfológicas (Boonchanawiwat et al., 2011), de producción (Okobenin et al., 2002), calidad (Akinbo et al., 2012; Marín et al., 2009), resistencia a enfermedades (Marín et al., 2004; Lokko et al., 2005), contenido de cianuro (Whankaew et al., 2011) y los valores de varianza fenotípica observada en general son menores al 40% por la naturaleza misma de las características y la influencia del ambiente.
Un segundo posible QTL para carotenos fue reportado en el grupo de Ligamiento A del mapa de yuca (Fregene et al., 1997) y explica 7% de la varianza fenotípica observada. Los resultados encontrados en este estudio corroboran los obtenidos por Fregene et al. (1997) y Marín et al. (2009) que muestran que los factores genéticos que gobiernan el contenido de carotenoides en yuca se encuentran en el grupo de ligamiento D.
El mapeo por intervalo mostró que: SSRY -313, SSRY -251, SSRY -66, SSRY -242, NS-717 y SSRY -9 explicaron entre 20 y 40% de la variación fenotípica. Marín (2002) encontró que estos mismos marcadores explicaban entre 13 y 37% de la varianza fenotípica y que se localizaban en el grupo de ligamiento 1. Todos los marcadores que se encuentran en el grupo de ligamiento 1 del mapa para la característica contenido de carotenos totales (Marín et al., 2009) corresponden al grupo de ligamiento D del mapa de yuca (Fregene et al.,1997) y en varios estudios muestran que controlan tanto el contenido de carotenos totales como el color de la pulpa en las raíces de yuca, lo cual se puede observar claramente en la Figura 1, donde cada color representa la probabilidad de que un microsatélite esté o no ligado a un QTL.
En los últimos años, en yuca amarilla se han identificado promotores específicos de raíz (Zhang et al., 2003, Arango et al., 2010a; Beltrán et al., 2010) y se ha comprobado la presencia de tres genes PSY (PSY1, PSY2 y PSY3) de los cuales dos (PSY1 y PSY2) se expresan en condiciones normales y en estrés por sequía y salinidad (Arango et al., 2010b). Los análisis de expresión cuantitativa han mostrado que la expresión del PSY2 en raíces de yuca es aproximadamente diez veces mayor que la del PSY1 (Arango et al., 2010b). Welsch et al. (2010) demostraron que, una variación alélica en el gen PSY permite mejorar su actividad enzimática y un polimorfismo de un solo nucleótido (SNP) en el gen PSY2, producido por un cambio en un aminoácido no-conservado, permite incrementar notablemente la formación y acumulación de carotenoides en las raíces de yuca.
El control genético de la característica contenido de carotenos totales y de b-caroteno en las raíces de yuca es complejo, ya que se han encontrado desde alelos múltiples interactuando con genes dominantes y varios genes con efectos aditivos, hasta efectos epistáticos entre los diferentes QTLs identificados (Marín et al., 2009). El mapeo genético y el análisis de QTLs utilizados para estudiar el contenido de carotenos totales y el color de pulpa en la raíz de yuca, son fundamentales para entender la genética de esta característica, la interacción genotipo x ambiente, la heredabilidad y para la identificación de regiones del genoma asociadas, mediante el uso de marcadores microsatélites con el fin de mejorar la calidad nutricional de la yuca.
- Se encontraron tres QTLs que controlan el contenido de carotenoides y cuatro QTLs que controlan el color de pulpa de las raíces de yuca, lo cual explica gran parte de la variación fenotípica observada y confirma que la herencia de la característica no es simple.
- Se validó la presencia de estos QTLs en poblaciones S1, lo que permitió identificar marcadores asociados con bajos, intermedios y altos contenidos de carotenoides, que pueden ser incorporados dentro de un programa de selección asistida por marcadores para la identificación de genotipos superiores y con buen contenido nutricional.
- La región del genoma asociada con el contenido de carotenoides en las raíces de yuca se encuentra en el grupo de ligamiento D del mapa genético, el cual debe ser estudiado más detalladamente con el fin de identificar los genes responsables de la síntesis, transporte y acumulación de estos pigmentos en las raíces de yuca.
Los autores agradecen la colaboración del Programa de Mejoramiento de Yuca y los laboratorios de Calidad, Genética de Yuca y Marcadores Moleculares del Centro Internacional de Agricultura Tropical (CIAT); y a la Universidad Nacional de Colombia sede Palmira.
Arango, J.; Salazar, B.; Welsch, R.; Sarmiento, F.; Beyer, P.; y Al-Babili, S. 2010a. Putative storage root specific promoters from cassava and yam: Cloning and evaluation in transgenic carrots as a model system. Plant Cell Rep. 29:651 - 659.
Arango, J.; Wüst, F.; Beyer, P.; y Welsch, R. 2010b. Characterization of phytoene synthases from cassava and their involvement in abiotic stressmediated responses. Planta 232:1251 - 1262.
Akinbo, O.; Labuschagne, M.; Marín, J.; Ospina, C.; Santos, L.; Barrera, E.; Gutiérrez, J.; Ewa, F.; Okogbenin; y Fregene, M.; 2012. QTLs analysis for root protein in a backcross family of cassava derived from Manihot esculenta spp. flabellifolia. Trop. Plant. Biol.5:161 - 172.
Beltrán, J.; Prías, M.; Al-Babili, S.; Ladino, Y.; López, D.; Beyer.; P, Chavarriaga, P.; y Tohme, J. 2010. Expression pattern conferred by glutamic acidrich protein gene promoter in field-grown transgenic cassava (Manihot esculenta Crantz). Planta 231:1413 - 1424.
Boonchanawiwat, A.; Sraphet, S.; Boonseng, O.; Lightfoot, D.; y Triwitayakorn. 2011. QTL underlying plant and first branch height in cassava (Mahihot esculenta Crantz). Field Crops. Res. 121:343 - 349.
Ceballos, H. y De La Cruz, H. 2002. Taxonomía y morfología de la yuca. En: Ospina, B. y Ceballos, H. (Comps.). La yuca en el tercer milenio. Sistemas modernos de producción, procesamiento, utilización y comercialización. Centro Internacional de Agricultura Tropical (CIAT). Cali, Colombia. p. 17 - 33.
Cunningham, F. y Gantt. 1998 Genes and enzymes of carotenoid biosynthesis in plants. Plant. Mol. Biol. 49:557 - 583.
Cunningham, F. 2002. Regulation of carotenoid synthesis y accumulation in plants. Pure Appl. Chem. 74(8):1409 - 1417.
Dellaporta, S. L.; Wood, J.; y Hicks, J. R. 1983. A plant DNA minipreparation: versión II. Plant. Mol. Biol. Rep. 1:19 - 21.
Ferguson, M.; Rabbi, I.; Kim, D.; Gedil, M.; Becerra, L.; y Okogbenin, E. 2012. Molecular markers and their application to cassava breeding. Past, presente and future. Trop. Plant. Biol. 5:95 - 109.
Fraser, D. y Bramley, P. 2004. The biosynthesis and nutritional uses of carotenoids. Progress Lipid Res. 43:228 - 265.
Fregene, M.; Angel, F.; Gómez, R.; Rodríguez, F.; Chavarriaga, P.; Roca, W.; Tohme, J. M.; y Bonierbale. 1997. A molecular genetic map of cassava (Manihot esculenta Crantz). Theor. Appl. Genet. 95:431 - 441.
Jorge, V.; Fregene, M.; Duque, M.; Bonierbale, M.; Tohme, J.; y Verdier, V. 2000. Genetic mapping of resistance to bacterial blight disease. Theor. Appl. Genet. 101:865 - 872.
Jorge, V.; Fregene, M.; Vélez, C.; Duque, M.; Thome, J.; y Verdier, V. 2001. QTL analysis of field resistance to Xanthomonas axonopodis pv. manihotis in cassava. Theor. Appl. Genet. 102:564 - 571.
Laule, O.; Furholz, A.; Chang, H.; Zhu, T.; Wang, X.; Heifetz, P.; Gruissem, W.; y Lange, M. 2003. Crosstalk between cytosolic y plastidial pathways of isoprenoid biosynthesis in Arabidopsis thaliana. Proc. Natl. Acad. Sci. 100:6866 - 6871.
Lokko, Y.; Danquah, Y.; Offei, S.; Dixon, A.; y Gedil, M. 2005. Molecular markers associated with a new source resistance to the cassava mosaic disease. Afric. J. Biotech. 4:873 - 882.
Marín, J. A. 2002. Mapeo genético y análisis asistido por marcadores microsatélites de genética del rendimiento en una población F2 de yuca (Manihot esculenta Crantz). Tesis de pregrado. Universidad del Tolima, Facultad de Ciencias, Programa de Biología.
Marin, J.; Loke, J.; Alvaréz, E.; Vallejo, F.; Fregene, M.; y Llano, G. 2004. Análisis de QTLs de la resistencia a la pudrición de raíz causada por Phytophthora tropicalis en una población segregante de yuca (Manihot esculenta Crantz). Acta Agronómica 53:314 - 318.
Marín, J.; Ramírez, H.; y Fregene, M. 2009. Mapeo genético y análisis de QTLs para carotenos en una población S1 de yuca. Acta Agronómica 58:15 - 21.
Mba, R. E.; Stephenson, P.; Edwards, K.; Melzer, S.; Nkumbira, J.; Gullberg, U.; Apel, K.; Gale, M.; Tohme, Thome, J.; y Fregene, M. 2001. Simple sequence repeat (SSR) markers survey of the cassava (Manihot esculenta Crantz) genome: towards an SSR-based molecular genetic map of cassava. Theor. Appl. Genet. 102:21 - 31.
McCouch, S. R.; Chen, X. L.; Panaud, O.; Temnykh, S.; Xu, Y. B.; Cho, Y. G.; Huang, N.; Ishii, T.; y Blair, M. 1997. Microsatellite marker development, mapping and applications in rice genetics and breeding. Plant. Mol. Biol. 35:89 - 99.
Morillo. A.; Morillo, Y.; Fregene, M.; Ramírez, H.; Chávez, A.; Sánchez, T.; Morante, N.; y Ceballos, H. 2011. Diversidad genética y contenido de carotenos totales en accesiones de yuca (Manihot esculenta Crantz). Acta Agronómica 60:97 - 107.
Morillo, Y.; Sánchez, T.; Morante, N.; Chávez, A.; Morillo, A.; Bolaños, A.; y Ceballos, H. 2012. Estudio preliminar de herencia del contenido de carotenoids en raíces de poblaciones segregantes de yuca (Manihot esculenta Crantz). Acta Agronómica 61:253 - 264.
Okogbenin, E. y Fregene, M. 2002. Genetic analysis and QTL mapping of early root bulking in an F1 population of non-inbred parents in cassava (Manihot esculenta Crantz). Theor. Appl. Genet. 106:58 - 66.
Okogbenin, E. y Fregene, M. 2003. Genetic mapping of QTLs affecting productivity and plant architecture in a full-sib cross from non-inbred parents in Cassava (Manihot esculenta Crantz). Theor. Appl. Genet. 107:1452 - 1462.
Park, H.; Kreunen, S. S.; Cuttriss, A. J.; Dellapenna, D.; y Pogson, B. J. 2002. Identification of the carotenoid isomerase provides insight into carotenoid biosynthesis, prolamellar body formation and photomorphogenesis. Plant. Cell. 14:321 - 332.
Pérez, V.; Gómez, C.; García, J.; Ferreira, J.; Santacruz, A.; Palacios, N.; y Tiessen, A. 2012. QTLs asociados al contenido de carotenos en hojas de maíz (Zea mays L.). Agroc. 46:333 - 345.
SAS Institute Inc.2005. SAS OnlineDoc® 9.1.3. Cary, NC: SAS Institute Inc; Available in : http://support.sas.com/onlinedoc/913/docMainpage.jsp.
Tanumihardjo, S. A. y Yang, Z. 2005. Carotenoids: epidemiology of health effects. En: Caballero, B.; Allen, L.; y Prentice, A. (eds.). Encyclopedia of human nutrition, 2nd ed. Oxford: Elsevier Ltd; 2005. p. 339 - 45.
Tian, L. y Dellapenna, D. 2004a. Progress in understying the origin y functions of carotenoid hydroxylases in plants. Arch. Bioch. Biophys. 430:22 - 29.
Tian, L.; Musetti, V.; Kim, J.; Magallanes-Lundback, M.; y Dellapenna, D. 2004b. The Arabidopsis LUT1 locus encodes a member of the cytochrome P450 family that is required for e-ring hydroxylation activity. Proc.Nat. Acad. Sci. 101:402 - 407.
Tucker, G. 2003. Nutritional enhancement of plants. Curr. Opin. Biot. 14:221 - 225.
Welsch, R.; Arango, J.; Bär, C.; Salazar, B.; Al-Babili S.; Beltrán, J.; Chavarriaga, P.; Ceballos, H.; Tohme, J.; y Beyer, P. 2010. Provitamin A accumulation in cassava (Manihot esculenta Crantz) roots driven by single nucleotide polymosphism in a phytoene synthase gene. Plant. Cell. 22:3348 - 3356.
Whankaew, S.; Poopear, S.; Kanjanawattanawong, S.; Tangphatsornruang, S.; Boonseng, O.; Lightfoot, D.; y Triwitayakorn, K. 2011. A genome scan for quantitative trait loci affecting cyanogenic potential of cassava root in an outbred population. Genomics 266 - 278.
Zeng, Z. B. 1993. Theoretical basis for separation of multiple linked gene effects in mapping quantitative trait loci. Proc. Natl. Acad. Sci. 90:10972 - 10976.
Zhang, P.; Bohl-Zenger, S.; Puonti-Kaerlas, J.; Potrykus, I.; y Gruissem, W. 2003. Two cassava promoters related to vascular expression and storage root formation. Planta 218:192 - 203.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2013 Acta Agronómica

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Política sobre Derechos de autor:Los autores que publican en la revista se acogen al código de licencia creative commons 4.0 de atribución, no comercial, sin derivados.
Es decir, que aún siendo la Revista Acta Agronómica de acceso libre, los usuarios pueden descargar la información contenida en ella, pero deben darle atribución o reconocimiento de propiedad intelectual, deben usarlo tal como está, sin derivación alguna y no debe ser usado con fines comerciales.



























