Estandarización de un protocolo de regeneración in vitro para pitahaya amarilla (Selenicereus megalanthus (K. Schum. ex Vaupel) Moran)
DOI:
https://doi.org/10.15446/acag.v63n1.36051Palabras clave:
cultivo in vitro, callo regenerante, meristemos axilares, Thidiazuron, organogénesis indirecta (es)Descargas
Biotecnología
1Universidad Nacional de Colombia sede Palmira, Facultad de Ciencias Agropecuarias. 2Centro Internacional de Agricultura Tropical (CIAT). Autor para correspondencia: jcvacav@unal.edu.co
A partir de meristemos axilares (aréolas) cultivados en medio MS (Murashige y Skoog) se estandarizó un protocolo de regeneración in vitro vía organogénesis indirecta en pitahaya amarilla (Selenicereus megalanthus). Se ensayaron tres concentraciones de 2,4–D (2.26, 3.26 y 4.26 µM) y 2,4–D suplementado con 6–BAP al 2.21 µM; y tres concentraciones de TDZ (200, 300 y 400 µM) o TDZ con 6–BAP, para un total de 12 tratamientos. Las condiciones de crecimiento evaluadas incluyeron el uso de luz (fotoperiodo de 16/8) y oscuridad (0/24). El 2,4–D indujo callo, pero la eficiencia en regeneración para la especie fue nula. A su vez, el TDZ o TDZ suplementado con BAP se mostró más eficiente en la inducción de callos compactos, de color verde-morado, con capacidad de regeneración vía organogénesis indirecta. Con el TDZ a 300 µM se observó mayor eficiencia de respuesta, ya que el número de brotes formados por punto de regeneración fue el más alto. Un análisis histológico confirmó la vía de regeneración en S. megalanthus, evidenciando estructuras primordiales características de la formación de brotes a partir de callos.
Palabras clave: Callo regenerante, cultivo in vitro, organogénesis indirecta, thidiazuron.
A protocol for in vitro regeneration in yellow pitahaya by using indirect organogenesis pathway was standardized from axillary meristem grown on MS medium. The medium was supplemented with three concentrations of 2,4–D (2.26, 3.26 and 4.26 µM) or 2,4–D + 6– BAP to 2.21 mM, or with three concentrations of TDZ (200, 300 and 400 µM) or TDZ + 6– BAP, a total of 12 treatments. Growing conditions evaluated included the use of light (photoperiod of 16/8) and darkness (0/24). The 2.4–D induced calli but regeneration efficiency for the species was nil. In turn, the TDZ or TDZ + BAP were more efficient in inducing compact calli, green–purple, with capacity of regeneration following indirect organogenesis. With 300µM of TDZ more efficiency of response was observed, because the number of buds formed by regeneration point was the highest. Histological analysis confirmed the route of regeneration in S. megalanthus, showing primary structures characteristic of the formation of shoots from calli.
Key words: Indirect organogenesis, in vitro culture, regenerating calli, thidiazuron.
Las cactaceae son una familia con aproximadamente 1.600 especies, distribuidas en forma nativa desde Argentina hasta Canadá. Las especies que la conforman se caracterizan por el uso eficiente de agua –cinco a diez veces más que en otros cultivos convencionales– en relación con la ruta fotosintética CAM (Metabolismo Ácido de las Crasuláceas) (Wallace y Gibson 2002).
Varias especies de los géneros Hylocereus, Selenicereus, Cereus, Leptocereus, Escontria, Myrtilloactus, Stenocereus y Opuntia se conocen como pitahaya, pitaya, pitajaya, 'dragonfruit', flor de cáliz, entre otros, y alrededor de 35 tienen potencial como cultivo. La parte comestible es el fruto, que se consume en fresco o procesado; además su elevado contenido de sólidos solubles le confiere gran potencial comercial y agroindustrial. En algunas especies, a partir de la cáscara o de la pulpa se extraen colorantes y pectinas (Esquivel, 2004).
Selenicereus megalanthus es conocida en Colombia como pitahaya amarilla debido al color de su exocarpio. Presenta numerosas brácteas, de las cuales nacen entre 10 y 15 acúleos; el endocarpio es blanco (diferencia primordial de las otras especies que se cultivan en otros países) y las semillas numerosas. Se encuentra distribuida en Perú, Bolivia, Ecuador, Colombia y Venezuela (Britton y Rose 1920).
Las pitahayas amarillas se propagan por estacas (cladodios) y de forma natural por semillas diseminadas por aves y otros animales. Para fines de cultivo la propagación sexual no es recomendable, ya que las plántulas requieren demasiados cuidados y tardan entre 4 y 6 años para alcanzar su etapa reproductiva (Suárez–Román 2011).
El cultivo de tejidos es un método adecuado para la propagación de esta especie. Según Roca y Mrogisnki (1991) esta técnica consiste en aislar una porción de planta (explante) y proporcionarle artificialmente las condiciones físicas y químicas para que las células expresen su potencial intrínseco o inducido. Este método exige la adopción de procedimientos estrictos de asepsia para mantener los cultivos libres de contaminación. La técnica de cultivo de tejidos ha sido descrita en diferentes cactáceas (Pérez–Molphe–Balch et al., 1998; Malda et al., 1999; Bhau 1999; Giusti et al. 2002; Mohamed–Yasseen2002; Pérez–Molphe–Balch y Dávila–Figueroa 2002; Rubluo et al., 2002; Pelah et al., 2002; Medeiros et al., 2006; Ferreira Gomes et al., 2006; Angulo–Bejarano y Paredes–López 2011). No obstante son escasos los estudios en S. megalanthus. Con base en los antecedentes antes mencionados, en la presente investigación se desarrolló un protocolo de propagación clonal y de regeneración de la pitahaya amarilla, con el objetivo de implementar en un futuro un sistema de producción de plántulas y un programa de mejoramiento asistido vía transformación genética.
Localización del área de estudio
La investigación se realizó entre agosto de 2010 y junio de 2012 en el Laboratorio de Cultivo de Tejidos Vegetales, invernadero y colección de trabajo de germoplasma de pitahaya amarilla, de la Universidad Nacional de Colombia sede Palmira (UNAL–P), a 3° 32' 5" N y 76° 17' 44" O, 1001 m.s.n.m., con una precipitación, promedio anual, de 1.000 mm y 24°C.
Material vegetal
Consistió de un genotipo de pitahaya amarilla, de la colección de la Universidad Nacional sede Palmira (UNAL–P), con características morfo–agronómicas sobresalientes como peso de fruto, relación pulpa:cáscara, sólidos solubles (°Brix), carbohidratos, extracto etéreo, energía y pH, entre otras.
Tipo de explantes
Los explantes utilizados correspondieron a zonas de tejido meristemático (aréolas laterales que forman estructuras vegetativas y reproductivas) obtenidas de plántulas cultivadas in vitro originadas de semillas germinadas en cajas Petri con papel filtro estéril húmedo, y de plantas adultas desinfectadas.
Desinfección de material vegetal
Los filocladodios provenientes de plantas adultas fueron cortados en 'V' en esquejes de 60 cm de largo, lavados por 10 min con detergente Tween–20 al 1% en agua destilada estéril, seguido de una desinfección con el fungicida Captan® en concentración de 0.5 g/lt aplicado con atomizador. Los esquejes fueron plantados en invernadero con temperatura promedio de 30 °C, en materas plásticas conteniendo sustrato de turba y arena en proporción 2:1, previamente esterilizadas en autoclave durante 20 min a 121 °C y 103 kPa. El riego con agua sin fertilizantes se hizo con intervalos de 3 días. Con el fin de obtener los ex–plantes, las plántulas fueron mantenidas en invernadero hasta el desarrollo de nuevos brotes.
Inducción de organogénesis indirecta
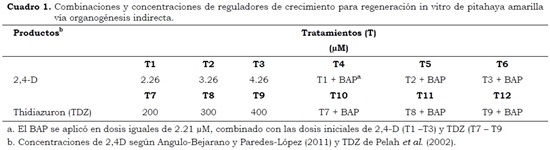
A partir de los brotes previamente crecidos in vitro se utilizaron aréolas como explantes para obtener callos, con los cuales se ensayaron diferentes combinaciones y concentraciones de reguladores de crecimiento con el objeto de inducir la regeneración in vitro de pitahaya amarilla vía organogénesis indirecta. Como reguladores se utilizaron: una auxina (Ácido 2,4–diclorofenoxiacético 2,4–D) y dos citoquininas (6–benzilaminopurina 6–BAP y Thidiazuron TDZ) en medio MS (Murashige y Skoog, 1962), con un total de 12 tratamientos (T1 – T12) (Cuadro 1) más un control (13). En cajas de Petri se vertieron 25 ml de medio estéril y en cada una de ellas, previa solidificación del medio, se sembraron seis explantes. Los tratamientos, con cinco repeticiones, se sometieron a condiciones de luz (fotoperiodo 16/8h) y oscuridad (0/24) por 21 días a partir de la siembra. Transcurrido este tiempo, los materiales expuestos a la luz siguieron en la misma condición y los que estaban bajo oscuridad fueron expuestos al fotoperiodo 16/8h.
Mantenimiento de callos, proliferación y enraizamiento de brotes
Se utilizaron callos obtenidos a partir de los tratamientos de inducción en oscuridad (T8 – 12). Para liberar la presión ejercida por los fitorreguladores que indujeron callos; los explantes fueron sembrados en medio MS por 30 días y luego se ensayó la siembra de esas estructuras en tres composiciones de medios (MS1 – MS3) por 30 días más (Cuadro 2). Para el enraizamiento de los brotes se utilizó el medio MS que contenia 5.3 µM de NAA, según lo recomendado por Pelah et al., 2002.

Análisis histológico de los callos
Las muestras de callos donde se desarrollaron brotes fueron fijadas en FAA, almacenadas en alcohol etílico a 75% y a continuación fueron deshidratadas en una serie gradual de alcoholes, aclaradas en alcohol butílico e incluidas en parafina (Paraplast). Los cortes se realizaron en micrótomo y se llevaron a secado antes de hacer la tinción con Safranina y Fast Green (Roth, 1964).
Análisis estadístico
Se empleó un análisis de varianza para un diseño experimental completamente aleatorizado con cinco repeticiones por tratamiento. Cada repetición consistió en seis explantes, en un arreglo factorial 2 x 6 con dos factores controlados: reguladores (2,4–D, TDZ y BAP, los dos primeros solos o combinados con BAP) y concentraciones (2,4–D: 2.26 µM, 3.26 µM y 4.26 µM; TDZ 200 µM, 300 µM y 400 µM; las tres concentraciones de 2,4–D + 2.21 µM de BAP; las tres concentraciones de TDZ + 2.21 µM de BAP (Cuadro 1). Se realizó la prueba de promedios de rango múltiple de Duncan, con nivel de significancia de 0.05 y una correlación lineal simple. Se empleó el programa Statistical Analysis System SAS ® versión 9.0. Las variables de respuesta evaluadas fueron el porcentaje de supervivencia o explantes que sobrevivieron produciendo callos y el porcentaje de formación de callo o callos formados por explante en cada tratamiento.
Organogénesis indirecta
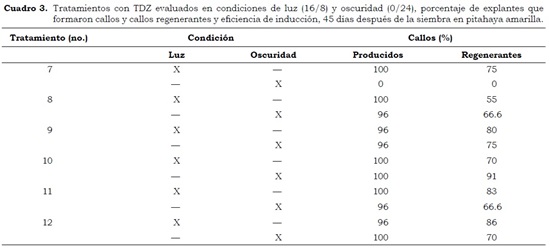
En los tratamientos T1 – T6, tanto en luz como en oscuridad, cuando se utilizaron 2,4–D y 2,4– D más BAP en diferentes concentraciones, se observó formación de callos entre 70 y 100%, sin embargo, no tenían capacidad de regeneración a nuevos órganos en la planta. Por el contrario, cuando se utilizaron TDZ y TDZ más BAP (T7 – T12) se observó la formación de callo regenerante (Cuadro 3).
Según Bhau (1999), Llamoca–Zárate et al. (1999), Medeiros et al. (2006), Angulo– Bejarano y Paredes–López (2011) el Ácido 2,4–diclorofenoxiacético (2,4–D) es un herbicida que actúa como auxina y favorece la formación de callos en tejidos vegetales; ha sido usado en algunas especies de cactáceas, con distintas concentraciones o combinado con otros reguladores de crecimiento, actuando en diferentes explantes o tejidos. Estos autores coinciden con Zhao et al. (2005) en que la formación de callos se produce cuando la misma concentración de auxina y citoquinina se añade al medio de cultivo; por tanto, la relación entre ambos reguladores de crecimiento constituye el factor crítico que desencadena las reacciones de desarrollo in vitro.
En el presente trabajo, con pitahaya amarilla, no se observó una respuesta favorable de diferentes concentraciones de 2,4–D ó 2,4–D + BAP, ya que no indujeron el desarrollo de callos regenerantes en condición tanto de luz como en oscuridad. Los callos formados, no regenerantes, presentaron características variables en color y textura.
Es posible que el 2,4–D, aunque actúe de forma similar a una auxina, no tiene la propiedad de inducir regeneración en pitahaya amarilla, debido a un factor desconocido que podría ser intrínseco a esta especie. Por el contrario, BAP en combinación con el TDZ se mostró eficiente para la regeneración en S. megalanthus, en condiciones tanto de luz como de oscuridad. Aunque es una citoquinina que promueve la formación de brotes en diferentes cactáceas (Pérez–Molphe–Balch et al. 1998; Pérez–MolpheBalch y Dávila–Figueroa 2002; Dávila–Figueroa et al. 2005) no mostró efecto para pitahaya amarilla cuando fue combinada con 2,4–D. El tratamiento T8 (300 µM de TDZ), entre los tratamientos con TDZ y TDZ + BAP, fue el que más favoreció la producción de brotes, por tanto no ocurrió una respuesta potenciada por el uso de ambos reguladores, o un efecto de sinergia pronunciado.
El fitorregulador TDZ es estructuralmente diferente de la auxina y de la citoquinina, pero puede 'imitarlas' en sus efectos sobre el crecimiento y la diferenciación de los explantes cultivados. In vitro se ha demostrado que TDZ tiene un alto nivel de actividad a concentraciones tan bajas como 10 µM (Preece et al., 1991a; Murthy et al., 1998). La exposición de tejido vegetal a TDZ por un tiempo relativamente corto es suficiente para estimular la regeneración (Visser et al. 1995; Hutchinson y Saxena 1996; Murthy et al. 1998).
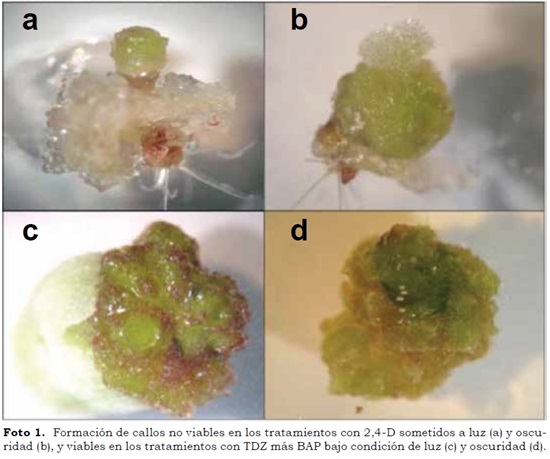
En el presente trabajo, el TDZ fue el fitorregulador con mejor comportamiento en la formación de callos de pitahaya amarilla, siendo capaz, solo o en combinación con BAP, de inducir regeneración a partir de los explantes tanto en presencia de luz como en oscuridad. Las concentraciones utilizadas indujeron la formación de callos regenerantes, lo cual evidencia que la especie es sensible al TDZ, en especial en su acción sobre la diferenciación organogénica. A diferencia de los callos formados por suplementación con el 2,4–D, estos se presentaron compactos, de colores verde y morado (Foto 1c).
Este es el primer trabajo donde se logra la inducción de organogénesis indirecta en S. megalanthus utilizando como explantes las aréolas laterales de filocladodios y como fitorregulador TDZ o la combinación TDZ + BAP, en condiciones de luz y oscuridad. La eficiencia de regeneración, que corresponde al número de callos regenerantes por tratamiento, en promedio fue de 1.3 para los tratamientos sometidos a luz, mientras en oscuridad fue de 1.4, ambas con TDZ.
Características de los callos
Los callos en los tratamientos de luz y oscuridad tuvieron apariencias similares. No obstante, aquellos sometidos a luz con TDZ y TDZ + BAP, además de revelar callos regenerantes, presentaron porciones no-regenerantes, posiblemente por efecto de la luz. Adicionalmente y según el regulador, se observaron diferentes respuestas en el tejido ensayado, como se describe a continuación: (1) En los tratamientos 1 – 3 (2,4–D) se evidenció la formación de callos sin capacidad para formar brotes (no-regenerantes), de color verde claro a blanquecino en luz y blanco en oscuridad (Foto 1a) y textura esponjosa en ambas condiciones de luminosidad. Según Angulo Bejarano y Paredes–López (2011) los callos verde–claros a amarillos tienen visible reducción en la producción de clorofila, mientras que las zonas marrones pueden ser el resultado de oxidación fenólica. De igual manera, en los tratamientos 4 – 6 (2,4–D + BAP) se observó la formación de callos, también sin capacidad de regeneración, verde-claro a blanco y esponjosos para los sometidos a la luz, y blancos esponjosos para los mantenidos en oscuridad (Foto 1b).
Las combinaciones en los tratamientos 7 – 9 (TDZ) mostraron formación de callos regenerantes; no obstante, como se mencionó antes, aquellos sometidos a la luz presentaron parte regenerante verde–morada, compacta con partes viable y no–viable, blanca esponjosa (Foto 1c); los sometidos a oscuridad revelaron color verde-morado, sin parte noregenerante. Los callos en los tratamientos 10 – 12 (TDZ + BAP) también fueron viables. Cuando se mantuvieron en condiciones de luz mostraron parte regenerante verde–morada, compacta viable y parte no–viable, blanca esponjosa. Los callos en condiciones de oscuridad eran regenerantes, de color verde, con textura compacta (Foto 1d). Por tanto, los tratamientos donde ocurrió regeneración coincidieron con aquellos en los cuales se lograron callos compactos, de color verdemorado, condiciones halladas en los tratamientos con TDZ y TDZ + BAP, en condiciones de luz u oscuridad.
En controles expuestos a luz, en el C1, se observó la formación de brote y un callo no organogénico blanco, mientras en el C2, se presentaron las formaciones de un brote, un callo no organogénico y una raíz. Por otro lado, en cada uno de los controles en condición de oscuridad, C3 y C4, se observó la formación de un callo no–organogénico y una raíz. Lo anterior muestra que para la regeneración exitosa se debe suplementar el medio con un regulador de crecimiento, ya que no sólo es la presencia de callo, sino que además, éste debe ser competente, con tejido capaz de dar origen a órganos determinados, de tal manera que sea posible conocer la ruta morfogénica que se debe tomar.
Según Murthy et al. (1998) bajas concentraciones de TDZ forman callo nodular compacto de color verde. Pelah et al. (2002) al trabajar con hojas cotiledonares e hipocótilo de pitahaya amarilla, con concentraciones de TDZ de 100, 200 y 440 mM, observaron formación de callo verde amarillento organogénico en la base proximal de los cotiledones. En el presente trabajo, con explantes diferentes a los de Pelah et al. (2002) consistentes en aréolas laterales de brotes provenientes de filocladodios maduros de pitahaya amarilla, también se observó organogénesis indirecta. Los callos verdes y verde-morados, de consistencia compacta, obtenidos a partir de TDZ y TDZ + BAP presentaron regeneración. Estos dos estudios en organogénesis en S. megalanthus son los únicos reportados hasta la fecha. No obstante la importancia comercial de esta especie, no existen materiales propagados según los estándares fitosanitarios, por tanto, esta puede ser una vía de propagación para atender los requerimientos del sector productivo.
Mantenimiento de callos y proliferación de brotes
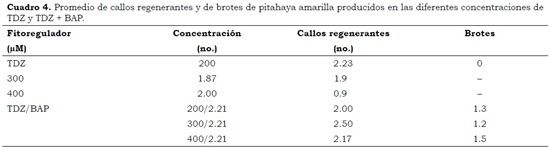
Para este fin se utilizaron callos originados en los tratamientos T8 – T12, en condiciones de oscuridad. El MS3, en el cual no se adicionó regulador, presentó un promedio de 0.13 y 0.23 brotes/callo más que en MS1 y MS2, respectivamente (Figura 1). Esto es posible porque estos callos provenían de un medio con alta concentración de regulador de crecimiento, siendo una respuesta de aclimatación a las nuevas condiciones y una expresión tardía del efecto del tratamiento previo. En algunos casos esto es útil para la inducción de brotes, por efecto del cambio de nivel de reguladores de crecimiento en el explante. No se encontraron diferencias (P > 0.05) entre MS1 y MS2, ni entre MS1 y MS3. Sin embargo, entre MS2 y MS3 sí ocurrieron diferencias significativas (P < 0.05) (Figura 1). Resultados similares fueron obtenidos por Pelah et al. (2002) en S. megalanthus, quienes encontraron la mejor producción de brotes y elongación con medio MS sin reguladores vs. medio MS suplementado con diferentes concentraciones de BAP o GA. En este trabajo, también con S. megalanthus utilizando el mismo medio sin reguladores, se halló, en promedio, un brote/explante; mientras que Angulo–Bejarano y Paredes–López (2011) en Opuntia ficus–indica, encontraron 2 brotes/ explante utilizando medio MS1.

En el presente estudio, los mayores promedios en la producción de brotes y elongación por explante (en paréntesis) se observaron en el T12 (1.124) y el T8 (1.123), seguidos de los tratamientos T11 (1.099) y T10 (1.097). Por el contrario, los menores valores se encontraron en el T9 (0.862). Pelah et al. (2002) en S. megalanthus hallaron el mayor número de explantes con al menos un brote y el mayor número de brotes, cuando cultivaron la parte proximal de los cotiledones en medio con TZD a una concentración de 200 µM, logrando 80% de explantes con brotes. En este trabajo se observó que las aréolas cultivadas en TDZ a 300 µM presentaron un promedio de 1.123 brotes/aréola.
El mayor promedio de brotes se dio en el tratamiento T8 (1.876) seguido de los tratamientos T12 (1.549) y T10 (1.336), que conformaron un grupo. Los tratamientos T11 (1.2398) y T9 (0.934) formaron otro grupo. Bhau (1999) en Coryphantha elephantidens obtuvo la formación de 1.7 brotes/callo cuando utilizó 2,4–D a una concentración de 2.2 mM y Kn a 4.6 mM, después de cuatro semanas de la siembra. Por tanto, la eficiencia en los tratamientos con TDZ fue mayor en el presente estudio, en especial el tratamiento T8, que produjo más brotes/callo (1.9 brotes) en concentraciones más bajas de fitorregulador (300 µM de TDZ).
El número de brotes/callo y por tratamiento varió desde 1 hasta 4, dentro y entre tratamientos; por ejemplo, en el tratamiento T8 (TDZ -300µM) algunos callos presentaron 1 brote (Foto 2a), mientras otros mostraron 4 brotes (Foto 2b), con un promedio superior al de los demás tratamientos (Foto 2c). Después del tratamiento T8 aparecen los tratamientos T12 (400 µM de TDZ + 2.21 µM de BAP) y T10 (200 µM de TDZ + 2.21 µM de BAP). La diferencia en el número de brotes entre los tratamientos T12 y T10 (Foto 2d) es debida, principalmente, a un efecto de concentración del fito–regulador TDZ, la cual fue de 400 µM en el primero y de 200 µM en el segundo, y no a la sinergia de los reguladores de crecimiento TDZ y BAP. La eficiencia de la respuesta presentada por el tratamiento T8 muestra que TDZ solo es capaz de inducir regeneración a la concentración de 300 µM y que no siempre hay efecto positivo de sinergia TDZBAP positivo.

Efecto del tipo de explante
En cactáceas es posible utilizar diferentes estructuras como explantes. Bhau (1999) logró regeneración en Coryphantha elephantidens a partir de explantes de raíces. Llamoca–Zárate et al. (1999) obtuvieron callos a partir de cotiledones e hipocótilos de Opuntia ficus indica. Pelah et al. (2002) utilizaron hojas cotiledonares y hipocótilo de S. megalanthus y con la parte proximal de la hoja cotiledonar obtuvieron una regeneración efectiva. Para la regeneración de O. ficus–indica a través de embriogénesis somática, Ferreira Gomes et al. (2006) indujeron el cultivo de brotes de ápices en solución MS. En la variedad Blanco sin Espinas de esta misma especie, Bejarano y Paredes–López (2011) lograron un protocolo de regeneración por organogénesis indirecta, a partir de cladodios.
El explante evaluado en este trabajo, aréola lateral del filocladodio, mostró ser una buena alternativa para la regeneración y propagación de S. megalanthus ya que es una zona meristemática que se presenta en forma abundante; además, mostró ser efectivo cuando se sometió a diferentes tratamientos con varios fito–reguladores (TDZ, o TDZ + BAP) en tres concentraciones y la combinación de ambos factores (Cuadro 4).
Análisis histológico de los callos regenerantes
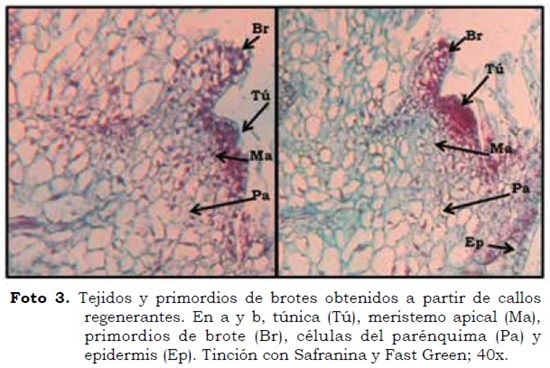
El protocolo convencional aplicado para el análisis histológico de los callos regenerantes no reveló buena definición de las estructuras primordiales de pitahaya amarilla, debido a que los procesos de fijación y deshidratación no fueron suficientes para contrarrestar el alto contenido de agua, lo que dificultó el corte y la tinción. Al contrario, con un protocolo desarrollado en este trabajo, se evidenciaron los tejidos de base y primordios de brotes en los callos regenerantes; la etapa clave consistió en un secado en horno a 60 °C, entre el corte en micrótomo y la tinción con Safranina y Fast Green.
En la Foto 3 es posible distinguir las células de callo, células parenquimatosas desorganizadas con grandes espacios en su interior (Pa), células de la túnica (Tú), meristemo apical (Ma), primordios de un brote (Br) y epidermis (Ep). Las células parenquimatosas son evidencia de que el tejido desorganizado en la base (callo) pudo dar origen a estructuras diferenciadas (brotes), lo cual confirma la regeneración vía organogénesis indirecta; y evidencia, además, el papel de los reguladores en el proceso de diferenciación celular.
Protocolo de regeneración en Selenicereus megalanthus
Este protocolo utiliza como explante las aréolas laterales de filocladodios jóvenes, preferentemente recolectados de plantas desarrolladas por germinación de semillas.
Organogénesis en pitahaya amarilla a partir de meristemos de brotes obtenidos de plántulas desarrolladas de semillas.
El procedimiento consiste en separar las semillas de la pulpa a partir de frutos maduros y seguir los siguientes pasos:
- Lavado con solución de Tween 20 (0.1%) por 10 min, en un 'Baecker',
- Lavado con agua destilada estéril y posteriormente con alcohol (70%) por 30 s,
- Lavado con agua destilada estéril y posteriormente con hipoclorito de sodio (2%) por 10 min,
- Lavado con agua destilada estéril por 30 segundos,
- Siembra de semillas de pitahaya amarilla en cajas Petri con papel filtro humedecido con agua como medio de germinación, a una temperatura promedio de 26 °C y humedad relativa entre 70% y 80%,
- Propagación in vitro de hojas cotiledonares y hipocótilos para formación de brotes (Suárez Román, 2011), de los cuales se extraerán las aréolas como explantes,
- Transferencia de los explantes para medio de inducción a callo, compuesto por solución MS suplementado con TDZ en la concentración de 200 µM, y distribuido en cajas Petri a razón de 25 ml/caja. Los explantes se mantienen 20 días en condiciones de oscuridad a 26 °C, y 25 días en luz (fotoperiodo 16/8) a 26 °C,
- Siembra de los callos formados en medio MS sin reguladores de crecimiento, distribuidos y conservados en frascos (30 ml/ frasco) por 60 días, para la formación de brotes, en fotoperiodo 16/8 a 26 °C,
- Siembra de los brotes resultantes de los callos regenerantes en medio MS suplementado con 5.3 µM de NAA (Pelah et al. 2002), distribuido en frascos (30 ml/ frasco), en fotoperiodo 16/8 a 26 oC, hasta la producción de raíces, y
- Transferencia de las plántulas a un sustrato en materas para iniciar la fase de aclimatación.
Organogénesis en pitahaya amarilla a partir de meristemos de brotes obtenidos de plantas adultas.
En este caso se requiere:
- Recolectar en campo filocladodios maduros de pitahaya amarilla, haciendo cortes en 'V', para la obtención de esquejes de 60 cm de largo,
- Transportar los esquejes a invernadero,
- Desinfectar los esquejes en solución detergente Tween–20 (1%) en agua destilada estéril, por 10 min,
- Desinfectar los esquejes con atomizador utilizando el fungicida Captan® en concentración de 0.5 g/lt,
- Mantener los esquejes en invernadero con temperatura promedio de 30 °C, en materas plásticas con sustrato turba–arena 2:1, previamente tratadas en autoclave durante 20 min a 121 °C y una presión de 103 kPa,
- Aplicar riego a cada planta en las materas con intervalos de tres días. Las plantas permanecen en invernadero entre 1 y 4 meses hasta el desarrollo de nuevos brotes,
- Desinfectar por sumersión aquellos filocladodios jóvenes (brotes) de pitahaya amarilla, desarrollados de las estacas mantenidas en invernadero; para ello se debe seguir una secuencia de lavados alternados en detergente Tween 20 (1%) durante 10 min, agua destilada por 1 min, alcohol etílico (70%) por 1 min, agua destilada por 1 min, hipoclorito de sodio (3%) por 10 min y finalmente en agua destilada por 1 min,
- Hacer cortes en 'V' para obtener los explantes –aréolas laterales que corresponden a zonas meristemáticas– en cada brote joven desarrollado en las condiciones de invernadero,
- Sembrar los explantes en frascos de 30 ml de capacidad con medio MS y adición del fungicida Vitavax diluido en agua destilada, en la concentración de 7.4 µM. Esos explantes deben permanecer durante tres semanas en el medio con el fungicida, en cuarto de crecimiento en laboratorio de cultivo in vitro con fotoperiodo 16/8 a 26°C,
- Sembrar los mismos explantes en nuevos frascos con 30 ml de medio MS por un periodo de un mes, en las mismas condiciones ambientales antes mencionadas,
- Transferir los explantes para medio de inducción a callo, compuesto por medio MS suplementado con TDZ en la concentración de 200 µM. Los explantes se mantienen durante veinte días bajo oscuridad (0/24) a 26 °C, y veinticinco días en fotoperiodo 16/8 a 26 °C,
- Sembrar los callos formados en un medio MS sin reguladores de crecimiento, por sesenta días para la formación de brotes, en fotoperiodo 16/8 a 26 °C,
- Sembrar los brotes resultantes de los callos regenerantes en medio MS suplementado con NAA, tal como lo proponen Pelah et al. (2002), en fotoperiodo 16/8 a 26 °C, hasta la producción de raíces, y
- Transferir las plántulas a un sustrato en materas para aclimatación.
- La ruta de regeneración observada, la organogénesis indirecta, constituye el primer paso para establecer ensayos de transformación genética de la pitahaya por estrategias biotecnológicas.
- Por primera vez se estandarizó el protocolo de organogénesis indirecta en pitahaya amarilla. El explante evaluado (aréola), una zona meristemática presente en gran cantidad en la estructura vegetativa de la planta, mostró una respuesta efectiva a los estímulos.
- A diferencia de 2,4–D, el TDZ fue eficiente en la regeneración vía organogénesis indirecta en pitahaya amarilla, con mejor comportamiento a una concentración de 300 µM.
Angulo–Bejarano, P. I.; y Paredes–López, O. 2011. Development of a regeneration protocol through indirect organogenesis in prickly pear cactus (Opuntia ficus–indica (L.) Mill). Sci. Hort. 128:283 – 288.
Bhau, B. S. 1999. Regeneration of Coryphantha elephantidens (Lem.) Lem. (Cactaceae) from root explants. Sci. Hort.81:337 – 344.
Britton, N. L. y Rose, J. N. 1920. The Cactaceae: descriptions and illustrations of plants of the Cactus Family. Vol. 2. The Carnegie Institution of Washington. 212 p.
Esquivel, P. 2004. Los frutos de las Cactáceas y su potencial como materia prima. Agron. Mesoam. 15:215 – 219.
Ferreira–Gomes, F. L.; Heredia, F. F.; Silva, P. B.; Faco, O.; y Campos, F. A. 2006. Somatic embryogenesis and plant regeneration in Opuntia ficusindica (L.) Mill. (Cactaceae). Sci. Hort. 108:15 – 21.
Giusti, P.; Vitti, D.; Fiocchetti, F.; Colla, G.; Saccardo, F.; y Tucci, M. 2002. In vitro propagation of three endangered cactus species. Sci. Hort. 95:319 – 332.
Hutchinson, J. M. y Saxena, P. K. 1996. Acetylsalicylic acid enhances and synchronizes Thidiazuroninduced somatic embryogenesis in geranium tissue cultures. Plant Cell Rep. 15:512 – 515.
Llamoca–Zarate, R. M.; Studart-Guimarães, C.; Landsmann, J.; y Campos, F. A. 1999. Establishment of callus and cell suspension cultures of Opuntia ficus–indica. Plant Cell, Tissue Organ Culture 58:155 – 157.
Malda, G.; Suzán, H.; y Backhaus, R. 1999. In vitro culture as a potential method for the conservation of endangered plants possessing crassulacean acid metabolism. Sci. Hort. 81:71 – 87.
Medeiros, L. A.; Ribeiro, R. C.; Gallo, L. A.; Oliveira, E. T.; y Dematte, M. E. 2006. In vitro propagation of Notocactus magnificus. Plant Cell, Tissue Organ Culture 84:165 – 169.
Mohamed–Yasseen, Y. 2002. Micropropagation of pitaya (Hylocereus undatus Britton et Rose). In Vitro Cell. Dev. Biol. Plant 38:427 – 429.
Murashige, T. y Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15:473 – 497.
Murthy, B. N.; Murch, S. J.; y Saxena, P. K. 1998. Thidiazuron: a potent regulator of in vitro plant morphogenesis. In Vitro Cell. Dev. Biol. Plant 34:267 – 275.
Pelah, D.; Kaushik, R.; Mizrahi, Y.; y Sitrit, Y. 2002. Organogenesis in the vine cactus Selenicereus megalanthus using Thidiazuron. Plant Cell, Tissue Organ Culture 71:81 – 84.
Pérez–Molphe–Balch, E. y Dávila–Figueroa, C. A. 2002. In vitro propagation of Pelecyphora aselliformis Ehrenberg and P. strobiliformis Werdermann (Cactaceae). In Vitro Cell. Dev. Biol. Plant 38:73 – 78.
Pérez–Molphe–Balch, E.; Reyes, M. E.; Rangel–Amador, E. V.; Ruiz, L. R.; y Viramontes, H. J. 1998. Micropropagation of 21 species of mexican cacti by axillary proliferation. In Vitro Cell. Dev. Biol. Plant 34:131 – 135.
Preece, J. E.; Huetteman, C. A.; Ashaby, W. C. y Roth, P. L. 1991a. Micro– and cutting propagation of sil–ver maple. 1. Results with adult and juvenile propagules. J. Am. Soc. Hort. Sci 116:142 – 148.
Roca, W. y Mroginski, L. 1991. Establecimiento de un laboratorio para el cultivo de tejidos vegetales. En: Roca, W. y Mroginski L. A. (eds.). Cultivo de tejidos en la agricultura. Centro Internacional de Agricultura Tropical (CIAT). Unidad de Investigación en Biotecnología y Unidad de Comunicaciones, Cali, Colombia. 969 p.
Roth, I. 1964. Microtécnica vegetal. Escuela de Biología, Facultad de Ciencias, Universidad Central de Venezuela. 87 p.
Rubluo, A.; Marín–Hernández, T.; Duvala, K.; y Márquez–Guzmán, A. J. 2002. Auxin induced morphogenetic responses in long–term in vitro subcultured Mammillaria sanangelensis Sánchez- Mejorada (Cactaceae). Sci. Hort. 95:341 – 349.
Suárez Román, R. S. 2011. Evaluación de métodos de propagación en pitahaya amarilla Selenicereus megalanthus (Haw.) Britt y Rose y pitahaya roja Hylocereus polyrhizus (Haw.) Britt y Rose. Trabajo de grado para optar al título de Magister en Ciencias Agrarias – Fitomejoramiento. Universidad Nacional de Colombia, sede Palmira. 250 p.
Visser, C.; Fletcher, R. A.; y Saxena P. K. 1995. TDZ stimulates expansion and greening in cucumber cotyledons. Physiol. Mol. Biol. Plant 1:21 – 26.
Wallace, R. S. y Gibson, A. C. 2002. Evolution and systematics. En: Nobel P.S. (ed.). Cacti: biology anduses. University of California Press, Berkeley, CA.
Zhao, C.; Zhang, G.; Huang, Z.; y Liu, M. 2005. Effects of media and IBA on stem cutting rooting of Hylocereus undatus cv. Vietnam. Southwest China J. Agric. Sci. 18:370 – 372.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Rocío Stella Suarez Román, Creuci María Caetano, Hernando Ramírez, Juan Gonzalo Morales Osorio. (2014). Multiplicación de Selenicereus megalanthus (pitahaya amarilla) e Hylocereus polyr-hizus (pitahaya roja) vía organogénesis somática. Acta Agronómica, 63(3), p.272. https://doi.org/10.15446/acag.v63n3.40980.
2. Ana Cruz Morillo Coronado. (2016). Morphological Characterization of Selenicereus megalanthus (K. Schum. ex Vaupel) Moran in the Province of Lengupá / Morphological Characterization of Selenicereus megalanthus (K. Schum. ex Vaupel) Moran in the Province of Lengupá. Ciencia en Desarrollo, 7(2), p.23. https://doi.org/10.19053/01217488.v7.n2.2016.4072.
3. Mariane Aparecida Rodrigues, Flávia Aparecida da Silveira, Renata Amato Moreira, Marlúcia Souza Pádua, José Eduardo Brasil Pereira Pinto, Leila Aparecida Salles Pio, Dalilhia Nazaré dos Santos, Júlio Sílvio de Sousa Bueno Filho, Letícia Alves Carvalho Reis. (2022). Regeneration of pitaya by indirect organogenesis evaluated by scanning electron microscopy and flow cytometry. Pesquisa Agropecuária Brasileira, 57 https://doi.org/10.1590/s1678-3921.pab2022.v57.02312.
4. Songul Comlekcioglu. (2024). In vitro propagation and rooting strategies for Hylocereus undatus and Hylocereus polyrhizus. Plant Biotechnology Reports, 18(7), p.829. https://doi.org/10.1007/s11816-024-00935-z.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2014 Acta Agronómica

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Política sobre Derechos de autor:Los autores que publican en la revista se acogen al código de licencia creative commons 4.0 de atribución, no comercial, sin derivados.
Es decir, que aún siendo la Revista Acta Agronómica de acceso libre, los usuarios pueden descargar la información contenida en ella, pero deben darle atribución o reconocimiento de propiedad intelectual, deben usarlo tal como está, sin derivación alguna y no debe ser usado con fines comerciales.



























