Situación actual en el control de Fusarium spp. y evaluación de la actividad antifúngica de extractos vegetales
Current situation of Fusarium spp in the control and evaluation of the antifungal activity on vegetables extracts
DOI:
https://doi.org/10.15446/acag.v64n2.43358Palabras clave:
Aceites esenciales, efectividad biológica, hongos fitopatógenos, metabolitos secundarios. (es)Essential oils, biological effectivity, pathogenic fungi, secondary metabolites. (en)
doi: https://doi.org/10.15446/acag.v64n2.43358 e–ISSN 2323–0118
Situación actual en el control de Fusarium spp. y evaluación de la actividad antifúngica de extractos vegetales
Current situation of Fusarium spp in the control and evaluation of the antifungal activity on vegetables extracts
Alejandra Villa–Martínez1, Ramona Pérez–Leal1*, Hugo Armando Morales–Morales2, Moisés Basurto–Sotelo2, Juan Manuel Soto–Parra3 y Esther Martínez–Escudero 3
1Universidad Autónoma de Chihuahua (UACH).Facultad de Ciencias Agrotecnológicas (FACIATEC). 2Catedrático–Investigador. Universidad Autónoma de Chihuahua (UACH). Facultad de Ciencias Agrícolas y Forestales. 3Universidad Autónoma de Chihuahua (UACH), Campus 1 s/n Ciudad Universitaria. Calle Pascual Orozco c.p. 31310, Chihuahua, Chihuahua, México. Autora para correspondencia: perezleal@hotmail.com
Rec.: 06.05.2014 Acep.:08.07.2014
Resumen
Ante la incesante búsqueda de alternativas más confiables y benéficas para el control de plagas y enfermedades en cultivos, se ha abierto un amplio panorama de investigación en torno al uso de extractos vegetales, aceites esenciales y metabolitos secundarios presentes en plantas, que constituyen hoy en día una alternativa promisoria para contrarrestar el efecto negativo de algunos microorganismos fitopatógenos, por su bajo costo, por ser amables con el medioambiente y la salud en general. En el presente documento se discuten y presentan algunos de los muchos estudios realizados alrededor del mundo con las evidencias pertinentes sobre la efectividad biológica de diversas especies vegetales para el control de Fusarium spp., ya que ha sido uno de los géneros de hongos fitopatógenos más incidentes y devastadores de cultivos en el planeta en los últimos años.
Palabras clave:Aceites esenciales, efectividad biológica, hongos fitopatógenos, metabolitos secundarios.
Abstract
Due to the relentless search for more reliable and beneficial (sustainable?) alternatives for the control of pests and diseases in crops, it has been opened a broad overview of research on the use of plant extracts, essential oils and secondary metabolites from plants, which are today an alternative to decrease the negative effect of some pathogenic microorganisms, because they have low costs, are kind with the environment and animal health. This paper shows and discusses some of the many studies have done around the world with relevant evidence on the biological effectivity of some plant species used in control of Fusarium spp., as it is one of the fungi genres most devastating in crops, on the planet in last years.
Key words: Essential oils, biological effectivity, pathogenic fungi, secondary metabolites.
Introducción
Los hongos del género Fusarium son ascomicetos filamentosos y cosmopolitas, tienen un micelio bien desarrollado, septado y conidióforos característicos, aunque algunas especies tienen un talo unicelular. Son considerados principalmente como hongos de campo (Sumalan et al., 2013), ya que causan un sinnúmero de enfermedades en cultivos. Sus daños desencadenan en el hospedante una serie de afecciones generalmente de carácter irreversible, originando pérdidas económicas considerables (García et al., 2007). Desde hace años, el control de las enfermedades fúngicas ha dependido, en gran medida, de los tratamientos con agroquímicos. Sin embargo, su uso representa un severo riesgo para la salud humana y contribuye al aumento de la contaminación al medioambiente (Abdel–Monahim et al., 2011). Además, han dado lugar a la aparición de microorganismos altamente resistentes que conducen a enfermedades fúngicas con mayor incidencia que antes. Para reducir este problema, existe la necesidad de buscar y adoptar estrategias que sean accesibles, sencillas de aplicar y no tóxicas para seres humanos y animales (Naeini et al., 2010). Estudios alrededor del mundo revelan la actividad biológica de algunos metabolitos encontrados en las plantas que pueden ofrecer una alternativa promisoria para el control de plagas y enfermedades. La presente revisión resalta la importancia de estudios realizados mundialmente en torno a la efectividad de plantas para el control de las enfermedades en cultivos causadas por los hongos del género Fusarium.
Interacción Fusarium–planta
Los hongos del género Fusarium son ampliamente conocidos alrededor del mundo, y se han convertido en un problema serio ya que producen metabolitos tóxicos que ponen en peligro la salud de los seres humanos y de los animales. Además, incluye muchos patógenos de plantas de importancia agrícola que en conjunto ocasionan enfermedades caracterizadas por marchitez, tizones, pudriciones en cultivos ornamentales y forestales en ecosistemas agrícolas y naturales (Ma et al., 2013). Como otros fitopatógenos, este hongo emplea diversas estrategias de infección, así también, la especificidad del hospedero depende de cada especie de Fusarium. El hongo puede sobrevivir en el suelo como micelio o como esporas en ausencia de sus anfitriones, y si se encuentra cerca una planta hospedera, la infección puede iniciar en las raíces, en partes de la planta por encima del suelo, a través del aire o el agua (Ma et al., 2013). Para que la infección se logre con éxito, la interacción entre hongo–planta responde a un proceso donde se deben movilizar diferentes conjuntos de genes para la señalización temprana del hospedero, la adhesión a la superficie de este, la descomposición enzimática de barreras físicas, la defensa contra los compuestos antifúngicos del anfitrión, y la inactivación y la muerte de las células huésped por micotoxinas segregadas. (Agrios, 2005).
Patogenicidad del hongo
Numerosos estudios acerca de una amplia gama de hongos convergen en la identificación de genes básicos de patogenicidad que codifican para componentes esenciales de las vías involucradas para las señales exógenas o endógenas, tales como proteínas Ras (pequeñas GTPasas) los componentes de señalización de proteína G y sus vías descendentes, diversos complejos proteínicos (Ma et al., 2013) y las cascadas de señales de transducción que son reguladores para el desarrollo del hongo y su virulencia: el sistema de señalización de la adenosin monofosfato cíclico dependiente de proteín quinasa (cAMP–PKA) y la cascada de proteín quinasas activadas por mitógenos (MAPK) (Groenewald, 2006). Estas vías juegan un papel crucial en la formación de estructuras infectivas, tales como los apresorios y la secreción de una mezcla de enzimas hidrolíticas para penetrar el complejo de barreras físicas del huésped, que incluyen quitinasas, celulasas, pectinasas y proteasas. (Groenewald, 2006).
Las primeras señales de reconocimiento planta–hongo incluyen un factor de transcripción CTF1β, que medía constitutivamente la expresión del gen de quitinasa (cut2) que libera unos pocos monómeros de quitina de la planta. Esto desencadena la transcripción de CTF1a, este es mediador de la activación rápida del gen fúngico de quitinasa extracelular (cut1) para segregar esta enzima que sirve como un factor de virulencia (Agrios, 2005). Las principales reacciones que genera la planta son la producción de especies reactivas de oxígeno (ERO), el incremento en el flujo de Ca+2, de genes de defensa y la producción de compuestos con propiedades antimicrobianas como las fitoalexinas, o con capacidad de reforzar la estructura de la pared celular, como la callosa o la lignina (García y Ruiz, 2005). Cuando la activación de estas respuestas es suficiente para evitar el crecimiento y reproducción del patógeno en el sitio de penetración, se produce la respuesta de hipersensibilidad (HR), que causa la muerte celular localizada en la región de invasión. Esta respuesta ocurre en la mayoría de las interacciones incompatibles que se establecen entre un patógeno avirulento y una planta resistente, según la teoría gen por gen. (García y Ruiz, 2005).
Las especies de Fusarium causantes de marchitez siguen un patrón similar de infección; penetran por la raíz y colonizan en el tallo de las plantas el sistema vascular. Sin embargo, la colonización se restringe en cultivares tanto resistentes como susceptibles, a la región de entrada inicial del patógeno, debido a la oclusión de los vasos por geles, deposiciones de calosa y tilosas. En los cultivares susceptibles la colonización continúa en una distribución secundaria cuando los geles y calosas son degradados por el efecto de enzimas pectolíticas del patógeno y el crecimiento de las tilosas es inhibido. En los cultivares resistentes, flavonoides del tipo de las catequinas y sus productos de oxidación inactivan las enzimas, y la distribución secundaria es confinada a los puntos de infección inicial (González et al., 2012). Fusarium oxysporum, por ejemplo, penetra inicialmente por raíz de forma asintomática; posteriormente, coloniza tejido vascular y desencadena un marchitamiento masivo, necrosis y clorosis de las partes aéreas de la planta. En contraste, F. graminearum, la principal causa de fusariosis de la espiga de cereales en todo el mundo, produce una necrosis limitada. (Ma et al., 2013).
Metabolitos tóxicos de Fusarium spp.
Las especies de Fusarium no sólo inactivan sustancias tóxicas producidas por el anfitrión, sino que también producen toxinas propias que aumentan su virulencia. Algunas, tales como eniatinas y ácido fusárico, son fitotoxinas, es decir, que son tóxicos para las plantas, mientras que otros, las micotoxinas, como tricotecenos y fumonisinas, son tóxicas para los animales (Agrios, 2005), pues sus efectos van desde carcinogénicos, mutagénicos, teratogénicos, citotóxicos, neurotóxicos, nefrotóxicas, hasta inmuno– supresores y estrogénicos, por lo que representan un riesgo para la salud pública (Wagacha y Muthomi, 2007). Actualmente se conocen cerca de 300 micotoxinas, y las más relevantes son las aflatoxinas (AFs), la ocratoxina A (OTA), la patulina (PAT), las fumonisinas (FBs), la zearalenona (ZEA), los tricotecenos y los alcaloides del ergot. Estas son producidas por especies que pertenecen a los géneros Aspergillus spp., Penicillium spp., Fusarium spp. y Claviceps spp. (Abrunhosa et al., 2012). Los tricotecenos son el mayor grupo de micotoxinas y son contaminantes comunes de los cereales, en conjunto con las fumonisinas (FBs) (Wagacha y Muthomi, 2007). Los primeros constituyen una familia de más de 180 metabolitos producidos principalmente por Fusarium, y el deoxinivalenol (DON) es uno de los tricotecenos más frecuentemente encontrado en cebada, maíz, centeno, semillas de girasol y trigo (Abrunhosa et al., 2012). Por otro lado, las fumonisinas (FBs) se dividen en grupos estructurales distintos, la fumonisina B1 (FB1) es la más abundante, constituyendo cerca de 70% del total de las FBs del género Fusarium y se encuentra principalmente en el maíz. La ZEA es una micotoxina sintetizada por cepas toxicogénicas de Fusarium, incluyendo F. graminearum y contamina cultivos de cereales en todo el mundo. (Abrunhosa et al., 2012).
Complicidad con otros microorganismos fitopatógenos
Las especies de Fusarium son causantes de una gran cantidad de enfermedades en cultivos de todo el mundo y generan importantes pérdidas económicas. En México, según Senasica (2012), una subespecie de F. oxysporum causa pérdidas del 10% a 53% del cultivo de papa en el mundo, y la literatura no refiere condiciones ambientales que limiten el desarrollo de este patógeno en las zonas productoras de México, por lo que es considerado de alto riesgo. Además, especies de Fusarium como F. oxysporum y F. solani se han reportado como unos de los principales agentes causales de marchitez en Chile y en México desde 1967, junto a géneros como Phytophthora spp., Rhizoctonia spp., Phytium spp., entre otros, que han sido considerados como un complejo fitopatogénico, que en condiciones favorables causan la enfermedad y provocan pérdidas económicas devastadoras al afectar del 60% al 100% de la superficie cultivada. (Rivera, 2009). Otro complejo fitopatogénico importante es Fusarium con nematodos. Hadian et al. (2011) encontraron una asociación sinérgica de Meloidogyne incognita y F. oxysporum en cultivo de tomate, en Irán. Esta asociación causante de marchitez representa una grave pérdida de rendimiento para este cultivo y también para leguminosas en Medio Oriente.
Situación actual del control de Fusarium spp.
El control de los organismos fitopatógenos del suelo es de los más difíciles de lograr; para ello se han desarrollado prácticas culturales, control biológico y control químico, siendo este último el más utilizado por ser económico y eficaz, en comparación con otras medidas. (Rubio et al., 2008). Las enfermedades de las plantas causadas por este tipo de hongos se hallan entre los factores más importantes que aumentan las pérdidas y afectan los rendimientos de los cultivos.
En el tratamiento de enfermedades causadas por Fusarium spp. y otros hongos se utilizan fungicidas sistémicos como los benzimidazoles, en este grupo se incluyen el benomil, carbendazim, tiabendazol, y tiofanato. (Agrios, 2005). Sin embargo, es probable que estos fungicidas sean agentes mutagénicos de las plantas, así como que pudieran incrementar el grado de resistencia de los patógenos ante su efecto. (Agrios, 2005). Dane y Dalgic (2005) demostraron el efecto genotóxico del benomil (Metil–1–(butilcarbomoil) benzimidazol– 2il–carbamato) en raíces de cebolla (Allium cepa) al ser tratadas con diferentes dosis de este fungicida y haber observado algunas anomalías, en la interfase y en las divisiones mitóticas de las células meristemáticas. Estas anormalidades fueron los defectos en el husillo mitótico y cariocinesis sin citocinesis. Por otra parte, también observaron los efectos negativos sobre la cromatina como la condensación y descondensación y algunas vacuolas anormales en la interfase.
Defensa de las plantas contra hongos fitopatógenos
Como parte de los mecanismos bioquímicos de defensa, las plantas responden al ataque de patógenos a través de una gran cantidad de mecanismos para resistir la colonización. Estos mecanismos físicos y bioquímicos se clasifican en defensas constitutivas o preformadas, e inducibles. (Durrant y Dong, 2004).
Defensa constitutiva. Incluye barreras físicas, procesos de lignificación, suberización y formación de calosas formadas antes de la presencia de algún patógeno. Las primeras pueden estar presentes en determinadas etapas o en todo el ciclo biológico de la planta, o bien formarse en respuesta al inicio del proceso infectivo (Montes, 2009). Una capa cerosa en la cutícula de las hojas de algunas especies de plantas, impide la formación de películas de agua en la superficie foliar después de las lluvias, lo que desfavorece la germinación de las esporas de hongos fitopatógenos (Agrios, 2005). Así también, las defensas químicas de las plantas son de diversa índole y poseen una elevada actividad biológica tóxica o inhibidora, algunas de ellas se presentan previas al reconocimiento del patógeno, como fenoles, lignina, taninos, saponinas, antocianinas, flavonoides, glucocinatos, lectinas, glucanasas y quitinasas, entre otros. (Kliebeinstein, 2004). Estos compuestos se pueden encontrar siempre en concentraciones suficientes para inhibir el desarrollo de los hongos como el ácido protocatéquico y catecol que se hallan en cebollas moradas resistentes a antracnosis, y que pueden estar en concentraciones bajas normalmente, pero también pueden incrementarse con la infección, como ocurre con la cumarina escopolina y el ácido clorogénico en papas infectadas con Phytophthora infestans. (Montes, 2009).
Defensa inducida. Por otro lado, la defensa inducida es activada únicamente como respuesta al ataque de patógenos durante el proceso infectivo. Las plantas emplean una gran cantidad de señales, originadas por los patógenos o por el medio circundante que les permiten reconocer al agresor y activar sus mecanismos de defensa. (Durrant y Dong, 2004). Son los llamados elicitores las sustancias químicas o factores bióticos que desencadenan un cambio en el metabolismo de la planta. La primera manifestación es la hipersensibilidad (HR) y consiste en una muerte celular localizada en el sitio de infección (Laloi et al., 2004). ésta se desencadena gracias a la presencia del ácido salicílico (AS) y a la explosión oxidativa por las especies reactivas de oxígeno (ROS), como el peróxido de hidrógeno (H2O2) y al radical súper óxido (O2 –). Inicialmente se consideró que la HR era una respuesta característica de plantas resistentes y que se activaba únicamente en aquellas situaciones en las que existía una relación gen a gen. Por otro lado, se asumía que el producto del gen de avirulencia (avr), que actúa como elicitor específico de raza, interaccionaba con el producto del gen de resistencia (R) correspondiente; esto es, que únicamente se presentaba en interacciones de tipo incompatible.
Los metabolitos secundarios son compuestos que sin ser esenciales para la supervivencia de células individuales, tienen un papel importante en la vida y supervivencia de la planta en su entorno ecológico (Palacios et al., 2004) y considerando las complejas rutas biosintéticas que los originan, se pueden agrupar en terpenos, alcaloides y fenilpropanoides. Los primeros son unidades de isopreno provenientes del ácido mevalónico (Sanmartín, 2008) y son los terpenos la familia más amplia de compuestos sintetizados en la planta. (Valares, 2011). También los diterpenos y triterpenos suelen ser constituyentes comunes de gomas, resinas y otros exudados vegetales; los tetraterpenos engloban un amplio grupo de carotenoides. (Sanmartín, 2008).
Los alcaloides, por su parte, son compuestos nitrogenados derivados de aminoácidos, por ejemplo, los alcaloides isoquinolinos, como morfina y berberina, son sintetizados a partir de tirosina; los alcaloides indol, como vinblastina, son derivados del triptófano; los alcaloides tropanos, como cocaína y escopolamina, son derivados de ornitina (Palacios et al., 2004). Algunos de estos compuestos, como la nicotina, cafeína y a–solanina son insecticidas, esta última encontrada en la patata, inhibe la acetilcolinesterasa. (Salgado, 2012). Además de servir de precursores para la síntesis de alcaloides, los aminoácidos aromáticos también se utilizan para la síntesis de compuestos fenólicos (lignanos, flavonoides, ácidos hidroxicinámicos) a través de la vía del shikimato, como son los fenilpropanoides, un grupo muy variado tanto química como funcionalmente, y se han relacionado en las actividades de defensa, como el endurecimiento de pared celular (ligninas), actividad antimicrobiana (furanocumarinas, isoflavonoides y estilbenos), repelentes (taninos), y en la señalización (ácido salicílico y ácido gentísico) (Taiz y Zeiger, 2006).
Respuesta sistémica de defensa. A la diseminación de la resistencia a través de los tejidos de la planta se le denomina Resistencia Sistémica Adquirida (SAR) y resulta duradera para la planta, a veces por el resto de su vida, y combate contra un amplio espectro de patógenos como virus, hongos, bacterias y oomicetos. (Durrant y Dong, 2004). Se acuñó este concepto durante 1960 y años siguientes, cuando Ross observó que plantas de tabaco infectadas con TMV (Tobacco Mosaic Virus) mostraban resistencia a una infección secundaria en tejidos distales al sitio de infección inicial (Salgado, 2012).
La reacción sistémica se caracteriza por activarse después de la infección por parte de un patógeno necrosante o tras la aparición de HR (Valares, 2011) y va acompañada por el incremento de la expresión de un gran número de genes de proteínas PR ('pathogeneis related') y son armas de la planta para el ataque contra el patógeno y por lo tanto, componentes de la propia respuesta (Valares, 2011) como agentes antimicrobianos y como moléculas señalizadoras. Estas, aunque son expresadas en plantas enfermas, su síntesis puede ser inducida también por reguladores de crecimiento como el etileno, ácido absícico, ácido indol acético, varios productos biológicos, como toxinas y enzimas; factores ambientales como el ozono, la luz y la temperatura (Vidhyasekaran, 2010). En algunos casos, se han detectado PR's en tejido sano sin ningún estrés, como en plantas de tabaco (Nicotiana tabacum), fríjol (Phaseolus vulgaris) y papa (Solanum tuberosum), donde aparecen en etapas de floración o madurez, o de forma constitutiva en hojas (Vidhyasekaran, 2010). Se han clasificado en 17 familias de PR's que se localizan intra y extracelularmente. Algunas de estas son reconocidas con actividad de glucanasas, peroxidasas, oxalato–oxidasas, quitinasas, ribonucleasas, inhibidoras de proteínas, así como en la transferencia de lípidos. (Vidhyasekaran, 2010).
Plantas con propiedades antifúngicas en el control de Fusarium spp.
En la agricultura los primeros agroquímicos que se usaron fueron polvos o extractos de plantas, que se utilizaron antes del surgimiento de los compuestos orgánicos sintéticos en la primera mitad del siglo XX; entre estas plantas estuvieron el tabaco, el crisantemo y la rotenona que fueron usadas contra distintos insectos plaga. (Montes, 2009). Por todas las implicaciones negativas acerca del uso inadecuado de plaguicidas y sus efectos secundarios indeseables, tanto en el costo de estos y de la resistencia de patógenos, como en el desgaste ambiental y peligro a la salud pública, se vuelve cada vez más necesario desarrollar nuevos sistemas de gestión para reducir la dependencia de los plaguicidas sintéticos.
Los métodos alternativos para el control de enfermedades se han estudiado con énfasis en nuevos compuestos derivados de fuentes vegetales, como aceites esenciales y extractos vegetales, como en el principio de los tiempos, ya que son más seguros para los consumidores y el medioambiente, su uso eficaz es contra patógenos resistentes a los plaguicidas y enfermedades de poscosecha. Numerosos estudios alrededor del mundo han contado sobre la eficacia de las plantas en el control de enfermedades causadas por los hongos del género Fusarium, que son incidentes en diversos cultivos.
Extractos vegetales
Las mezclas de compuestos con propiedad antifúngica encontrados en las plantas pueden afectar a patógenos diferencialmente, ya sea de manera individual o por las mezclas en determinadas concentraciones y proporciones. Así mismo, diversos métodos de extracción son estudiados para salvaguardar las propiedades extraídas de la mejor y más viable manera posible. En el 2006, Jasso y et al., estudiaron las propiedades fungicidas de extractos etanólicos de tres especies de la llamada maravilla de campo (Flourensia spp.), contra F. oxysporum, donde el desarrollo micelial fue inhibido más del 90% con el uso de los tres extractos. Así también, otros estudios han sido buenos para la comparación contra fungicidas sintéticos y otros más, como Alkahil (2005), que probó extractos acuosos, por arrastre de vapor y etanólicos de ajo (Allium sativum), semilla de neem (Azardiachta indica), hierba de limón (Cymogopogon proxims), comino (Carum carvi) y clavo (Eugenia caryophyllus), así como el uso de benomilo, y cepas de Trichoderma spp., contra Fusarium oxysporum, donde los extractos acuosos de todas las especies vegetales se destacaron con una eficacia mayor del 60%, pero fue el extracto acuoso de ajo el mejor con casi 95% de actividad fungicida, resultados iguales que los obtenidos con el benomilo y superó al control biológico. En el 2008, Joseph et al., trabajaron con extractos acuosos de diversas especies de plantas para el control de marchitez en berenjena (Solanum Melongena) causado por Fusarium solani f. sp. Melongenae. Neem (Azardiachta indica), ajenjo (Artemessia annua), eucalipto (Eucalyptus globulus); albahaca (Ocimum sanctum) y ruibarbo (Rheum emodi) fueron probadas con alto porcentaje de inhibición del hongo, siendo el extracto de neem el más efectivo y recomendado por los autores como un buen tratamiento preventivo aplicado directamente en las semillas de berenjena.
Es importante mencionar que se ha vuelto una tarea difícil elaborar productos naturales eficientes y estables que brinden protección a las plantas, sin embargo, se han probado formulaciones botánicas comerciales, en conjunto con extractos vegetales y con microorganismos de control biológico para estudiar las interacciones. Los resultados han sido alentadores como los de Akila et al., (2011) que evaluaron en banana la eficacia de una formulación comercial a base de trompeta del diablo (Datura metel), que contenía también agentes emulsificantes, estabilizadores y solventes, así como los extractos metanólicos de hoja de esta misma planta, y algunos microorganismos de control biológico que controlaron sinérgicamente a F.oxysporum f. sp. cubense. El extracto metanólico redujo el crecimiento micelial en un 90%, mientras que en condiciones de campo, la mezcla del fungicida botánico comercial, con microorganismos de control biológico y los extractos vegetales, mostraron una reducción hasta del 65% de la marchitez de banana (Musa sapientum), resultados que superan la efectividad de cada uno por separado. Se han explotado las diversas metodologías de extracción de propiedades antifúngicas de las plantas y se ha experimentado para crear técnicas integrales buscando mejorar la producción de alimentos inocuos y la protección ambiental.
En el 2009, Usha et al., estudiaron la actividad antifúngica de dos mezclas: la primera elaborada a partir de estramonio (Datura stramonium), algodón de seda (Calotropis gigantea), neem (Azardiachta indica) y estiércol de vaca; y la otra mezcla de extractos metanol–acuosos de las mismas plantas, evaluados contra la malformación floral del mango causada por Fusarium mangiferae. El estudio demostró la eficacia de la primera mezcla en la inhibición del hongo, el porcentaje de frutos y la retención, en comparación con el control y la mezcla dos. Esto se debió a las propiedades antifúngicas de las especies de plantas, y por otro lado, a los niveles más altos observados de macro y micronutrientes aportados por el conjunto de extractos–composta. Se ha demostrado también, la capacidad de algunos extractos vegetales en la inducción de síntesis de enzimas propias de la planta huésped y fortalecer así su respuesta defensiva ante el ataque de patógenos. Fue el caso demostrado de Hanaa et al. (2011) que emplearon extractos acuosos de neem (Azardiachta indica) y sauce (Salix babylonica) en plántulas de tomate (Solanum lycopersicum); estos redujeron la incidencia de la enfermedad de la marchitez por F. oxysporum en plántulas de tomate hasta casi un 30%, mediante el aumento de las actividades de las enzimas defensivas antioxidantes secretadas por la planta de tomate, como la peroxidasa (POX), la catalasa (CAT) y la súper óxido dismutasa (SOD). Estos y muchos otros métodos estudiados han resultado de bajo costo, fáciles de preparar y con niveles altos de efectividad contra algunas especies de Fusarium (Cuadro 1).

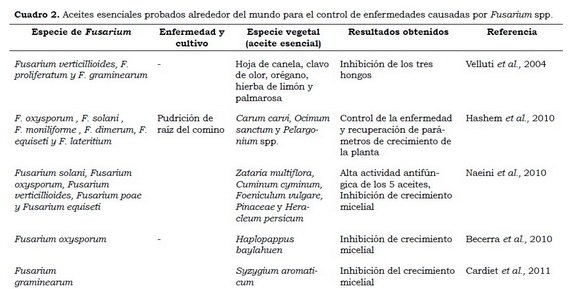
Aceites esenciales
La mayoría de los aceites esenciales de plantas son químicamente complejos, lo que aumenta su eficacia debido a la sinergia entre los componentes, como recientemente se ha demostrado (Cuadro 2). Pawar y Thaker (2007) emplearon 75 aceites esenciales para el control de Fusarium oxysporum f. sp. cicer, entre ellos los más eficaces fueron de canela (Cinnamomum zeylanicum), casia (Cinnamomum cassia), clavo de olor (Syzygium aromaticum) y hierba de limón (Cymbopogon citratus), pues tuvieron un alto efecto inhibitorio. La contaminación por micotoxinas ha sido un problema fuerte en cereales, y en el 2013 Sumalan y colaboradores estudiaron los efectos de aceites esenciales de toronjil (Melissa officinalis), salvia (Salvia officinalis), cilantro (Coriandrum sativum), tomillo (Thymus vulgaris), hierbabuena (Mentha piperita) y canela, todos con efecto inhibitorio, sin embargo, el último registró la mejor actividad en contra de fumonisinas en semillas de trigo. Necha y Barrera (2009), reportaron la actividad antifúngica de 6 de 9 aceites esenciales probados contra Fusarium spp. Los aceites evaluados fueron de epazote (Teloxys ambrosioides), hierbabuena, ruda (Ruta chalepensis), tomillo, canela, clavo, ajo, limón (Citrus aurantifolia) y eucalipto; de los cuales, los aceites de canela, epazote, hierbabuena, ruda, tomillo y clavo tuvieron un alto porcentaje de inhibición del hongo; los aceites de limón, ajo y eucalipto no tuvieron la misma actividad antifúngica.
Metabolitos secundarios
Los extractos vegetales y aceites esenciales de cada planta pueden tener hasta más de sesenta componentes y de ellos puede haber varios con propiedades antifúngicas. Generalmente están presentes como mezclas de compuestos y los patógenos pueden ser afectados diferencialmente por los compuestos individuales o por las mezclas en determinadas concentraciones y proporciones. (Montes, 2009) (Cuadro 3). Sahin et al. (2004) determinaron la composición del aceite esencial de orégano (Origanum vulgare spp. vulgare), y obtuvieron como resultado la identificación de 62 compuestos que representaron aproximadamente el 89 % del aceite. Cariofileno (14.4 %), espatulenol (11.6 %), germacreno–D (8.1 %) y aterpineol (7.5 %). Así mismo, los componentes del aceite esencial se compararon contra los efectos de anfotericina B contra tres especies de Fusarium: F. acuminatum, F. oxysporum y F. tabacinum, donde tuvieron los mismos resultados favorables de inhibición de 50% al utilizar una concentración igual de 2 mg/ml. En el 2011, Moreno–López estudió la actividad antifúngica de los metabolitos secundarios mayoritarios encontrados en Zanthoxylum monophyllum y Piper eriopodon, como la berberina y gibbilimbol B, respectivamente, sobre F. oxysporum f. sp. dianthi, en clavel (Dianthus caryophyllus), por medio de la técnica de bioautografía en cromatografía en placa delgada (CCD), obteniendo como resultado un efecto fungicida del gibbilimbol B sobre el hongo con concentraciones de 5, 10, 25, 50 y 100μg. No así con la berberina, que resultó con halos de inhibición apenas visibles con la más alta concentración de esta de 100 μg. Por otro lado, Contreras–Arredondo et al. (2011) encontraron taninos hidrolizables y condensados como principios activos contra F. oxysporum en papa (Solanum tuberosum L.), estos obtenidos de extractos etanólicos de flor de Alejandría (Cowaniaplicata D. Don.) donde obtuvieron resultados de (CI50) de 3,000 ppm y una (CI90) de 28,000 ppm sobre el hongo.

Referencias
Abdel–Monaim, M. F.; Abo–Elyousr K. A. M., y Morsy, K. M. 2011. Effectiveness of plant extracts on suppression of damping–off and wilt diseases of lupine (Lupinus termis Forsik). Crop protection, 30(2), 185–191.
Abrunhosa, L.; Morales, H.; Soares, C.; Calado, T.; Vila–Chã, A. S.; Pereira, M., y Venâncio, A. 2012. Micotoxinas detectadas en productos alimenticios en Portugal: revisión. Rev. Bio Ciencias, 2 (1), 5–31.
Agrios, G. 2005. Plant Pathology. 5ed. Nueva York. Elsevier Academic Press. 922 p.
Akila, R.; Rajendran, L.; Harish, S.; Saveetha, K.; Raguchander, T., y Samiyappan, R. 2011. Combined application of botanical formulations and biocontrol agents for the management of Fusarium oxysporum f. sp. Cubense (Foc) causing Fusarium wilt in banana. Biological Control, 57(3), 175–183.
Alkhail, A. A. 2005. Antifungal activity of some extracts against some plant pathogenic fungi. Pak. J. Biol. Sci. 8(3), 413–417.
Becerra, J.; Bittner, M.; Hernández, V.; Brintrup, C.; Becerra, J., y Silva, M. 2010. Actividad de aceites esenciales de canelo, queule, bailahuen y culén frente a hongos fitopatógenos. Bol Latinoam Caribe Plant Med Aromat, 9, 212–215.
Cardiet, G.; Fuzeau, B.; Barreau, C., y Fleurat–Lessard, F. 2012. Contact and fumigant toxicity of some essential oil constituents against a grain insect pest Sitophilus oryzae and two fungi, Aspergillus westerdijkiae and Fusarium graminearum. Journal of Pest Science, 85(3), 351–358.
Contreras–Arredondo, M. E.; Hernández–Castillo, F. D.; Sánchez–Arizpe, A.; Gallegos–Morales, G., y Jasso de Rodríguez, D. 2011. Actividad fungicida de extractos de Cowania plicata D. Don. contra Fusarium oxysporum Schlechtend. Fr. y de Pistacia lentiscus L. contra Colletotrichum coccodes Wallr. Hunghes. Rev. Agraria Nueva época, 8(1), 6–13.
Dane, F., y Dalgiç, ö. 2005. The effects of fungicide benomyl (benlate) on growth and mitosis in onion (Allium cepa L.) root apical meristem. Acta Biológica Hungarica, 56(1), 119–128.
De León, M. á.; Sáenz, A.; Jasso–Cantú, D.; Rodríguez, R.; Pandey, A., y Aguilar, C. N. 2013. Fermented Flourensia cernua extracts and their in vitro assay against Penicillium expansum and Fusarium oxysporum. Food Technology y Biotechnology, 51(2), 233–239.
Durrant, W. E., y Dong, X. 2004. Systemic acquired resistance. Annual Review Phytopathology. 42, 185–209.
García, D.; Ramos, A. J.; Sanchis, V., y Marín, S. 2012. Effect of Equisetum arvense and Stevia rebaudiana extracts on growth and mycotoxin production by Aspergillus flavus and Fusarium verticillioides in maize seeds as affected by water activity. Predictive mycology and use of natural antifungals to prevent the mycotoxin food hazard, 153, 73.
García, M. S., y Ruíz, M. G. 2005. Las MAP cinasas: Elementos de señalización en la defensa de las plantas contra patógenos. Revista de Educación Bioquímica, 24(1), 4–11.
García, J. M. D.; Shagarodsky, T.; Fresneda, J. A.; Fundora, Y. H., y González, J. 2007. Caracterización de especies del género Fusarium en el cultivo del garbanzo (Cicer arietinum) en las provincias ciudad Habana y La Habana. Temas de Ciencia y Tecnología 32 (11), 63–66.
González, I.; Yailén, A., y Peteira, B. 2012. Aspectos generales de la interacción Fusarium oxysporum f. sp. Lycopersici–tomate. Revista de Protección Vegetal, 27(1), 1–7.
Groenewald, S. 2006. Biology, pathogenicity and diversity of Fusarium oxysporum f. sp. cubense . Tesis doctoral, Universidad de Pretoria, Gauteng, Sudáfrica. 158 p.
Hadian, S.; Rahnama, K.; Jamali, S., y Eskandari, A. 2011. Comparing neem extract with chemical control on Fusarium oxysporum and Meloidogyne incognita complex of tomato. Advances in Environmental Biology, 5(8), 2052–2057.
Hanaa, R. F.; Abdou, Z. A.; Salama, D. A.; Ibrahim, M. A., y Sror, H. A. M. 2011. Effect of neem and willow aqueous extracts on Fusarium wilt disease in tomato seedlings: Induction of antioxidant defensive enzymes. Annals of Agricultural Sciences, 56(1), 1–7.
Hashem, M.; Moharam, A. M.; Zaied, A. A.; y Saleh, F. E. M. 2010. Efficacy of essential oils in the control of cumin root rot disease caused by Fusarium spp. Crop protection, 29(10), 1111–1117.
Jasso, D.; Hernandez, C. D.; Angulo, S. J. L.; Rodríguez, G. R.; Villarreal, Q. J., y Lira S., R. 2007. Antifungal activity in vitro of Flourensia spp. extracts on Alternaria sp., Rhizoctonia solani, and Fusarium oxysporum. Industrial Crops and Products, 25(2), 111–116.
Joseph, B.; Dar, M. A., y Kumar, V. 2008. Bioefficacy of plant extracts to control Fusarium solani f. sp. melongenae incitant of brinjal wilt. Global Journal of Biotechnology y Biochemistry, 3(2), 56–59.
Kliebenstein, D. J. 2004. Secondary metabolites and plant/environment interactions: a view through Arabidopsis thaliana tinged glasses. Plant, Cell y Environment, 27(6), 675–684.
Laloi, C.; Apel, K., y Danon, A. 2004. Reactive oxygen signalling: the latest news. Current opinion in plant biology, 7(3), 323–328.
Ma, L. J.; Geiser, D. M.; Proctor, R. H.; Rooney, A. P.; O'Donnell, K., Trail, F. y Kazan, K. 2013. Fusarium Pathogenomics. Annual review of microbiology, 67, 399–416.
Montes B. R. 2009. Diversidad de compuestos químicos producidos por las plantas contra hongos fitopatógenos. Revista Mexicana de Micología, 29, 73–82.
Moreno–López J. P. 2011. Actividad antifúngica de los extractos vegetales de Piper eriopodon y Zanthoxylum monophyllum y sus metabólicos secundarios mayoritarios sobre dos hongos fitopatógenos de clavel (Dianthus caryophyllus). Tesis de maestría, Universidad Nacional de Colombia. Bogotá, Colombia. 141 p.
Murillo–Arango, W.; Acevedo–Ruíz, J. M. y Peláez– Jaramillo, C. A. 2011. Actividad antimicótica del aceite esencial a partir de Eucalyptus tereticornis sobre el hongo patógeno Fusarium oxysporum. Revista Cubana de Farmacia. 45(2). 264–274.
Naeini, A.; Ziglari, T.; Shokri, H., y Khosravi, A. R. 2010. Assessment of growth–inhibiting effect of some plant essential oils on different FusariumZ isolates. Journal de Mycologie Médicale/Journal of Medical Mycology, 20(3), 174–178.
Necha, L. L. B., y Barrera, L. J. G. 2009. Actividad antifúngica de aceites esenciales y sus compuestos sobre el crecimiento de Fusarium sp. aislado de papaya (Carica papaya). Revista UDO Agrícola, 8 (1), 33–41.
Pawar, V. C. y Thaker, V. S. 2007. Evaluation of the anti–Fusarium oxysporum f. sp cicer and anti– Alternaria porri effects of some essential oils. World Journal of Microbiology and Biotechnology, 23(8), 1099–1106.
Rivera, J. M. N. 2009. Marchitez del chile poblano (Capsicum annuum L.): identificación molecular del agente causal, detección en semillas, histopatología y alternativas de control. Tesis doctoral. Colegio de Postgraduados, Texcoco, México, 98 p.
Palacios R. N. Biología molecular, una herramienta para la bioprospección del metabolismo secundario de plantas en Colombia. Revista Colombiana de Biotecnología, 6(2), 67–77.
Rodríguez, P. A. T.; Ramírez, A. M. A.; Bautista, B. A.; Cruz, T.A., y Rivero, D. 2012. Actividad antifúngica de extractos de Acacia farnesiana sobre el crecimiento in vitro de Fusarium oxysporum f. sp. lycopersici. Rev. Científica UDO Agrícola. 12(1). 91–96.
Rubio, R. G.; Baltodano S. F.; Abanto C. L.; Wilson K. J.; y Muñoz R. M. 2008. Resistencia in vitro de Rhizoctonia solani y Fusarium oxysporum a los fungicidas Benzomil 500, Rhizolex–T y Homai– WP. Revista Biológica de la Universidad de Trujillo, Perú. 28 (2), 34–46.
Şahin, F.; Güllüce, M.; Daferera, D.; Sökmen, A.; Sökmen, M.; Polissiou, M., y özer, H. 2004. Biological activities of the essential oils and methanol extract of Origanum vulgare ssp. Vulgare in the Eastern Anatolia region of Turkey. Food Control, 15(7), 549–557.
Salgado, S. L. 2012. Inductores de resistencia a TuMV en Arabidopsis thaliana (L). Heynh. Tesis doctoral. Colegio de Postgraduados, Texcoco, México. 82 p.
Sanmartín, L. Z. 2008. Nuevas aportaciones al metabolismo secundario del tomate. Identificación y estudio de moléculas implicadas en la respuesta a la infección con pseudomonas syrinagae pv. tomato Tesis doctoral. Universitat Politècnica de València, Valencia, España. 163 p.
Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (SENASICA). 2012. Análisis de riesgo de plagas para la importación de tubérculos de papa (Solanum tuberosum L.) a México. Dirección general de Sanidad Vegetal. Secretaría de Agricultura y Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA). México.
Sharma, B., y Kumar, P. 2009. In vitro antifungal potency of some plant extracts against Fusarium oxysporum. International Journal of Green Pharmacy, 3(1), 63–65.
Singha, I. M.; Kakoty, Y.; Unni, B. G.; Kalita, M. C.; Das, J.; Naglot, A., y Singh, L. 2011. Control of Fusarium wilt of tomato caused by Fusarium oxysporum f. sp. lycopersici using leaf extract of Piper betle L.: a preliminary study. World Journal of Microbiology and Biotechnology, 27(11), 2583–2589.
Sumalan, R. M.; Alexa, E., y Poiana, M. A. 2013. Assessment of inhibitory potential of essential oils on natural mycoflora and Fusarium mycotoxins production in wheat. Chemistry Central Journal, 7(1), 1–12.
Taiz L., y Zeiger E. 2006. Plant Physiology. Fifth Edition. Sinauer Associates Sunderland. Inc. USA, 1265 p.
Tenorio, R.; Terrazas, E.; Alvarez, M. T.; Vila, J. L., y Mollinedo, P. 2010. Concentrados de saponina de Chenopodium quinoa y de Caiphora andina: alternativas como biocontroladores de hongos fitopatógenos. Revista Boliviana de Química. 27, 33.
Usha, K.; Singh, B.; Praseetha, P.; Deepa, N.; Agarwal, D. K.; Agarwal, R., y Nagaraja, A. 2009. Antifungal activity of Datura stramonium, Calotropis gigantea and Azadirachta indica against Fusarium mangiferae and floral malformation in mango. European journal of plant pathology, 124(4), 637–657.
Valares M. C. 2011. Variación del metabolismo secundario en plantas debida al genotipo y al ambiente. Tesis doctoral. Universidad de Extremadura, Bajadoz, España. 216 p.
Velluti, A.; Marı́n, S.; Gonzalez, P.; Ramos, A. J., y Sanchis, V. 2004. Initial screening for inhibitory activity of essential oils on growth of Fusarium verticillioides, F. proliferatum and F. graminearum on maize–based agar media. Food microbiology, 21(6), 649–656.
Vidhyasekaran, P. 2010. Fungal pathogenesis in plants and crops: molecular biology and host defense mechanisms. CRC Press. 499 p.
Wagacha, J. M., y Muthomi, J. W. 2007. Fusarium culmorum: Infection process, mechanisms of mycotoxin production and their role in pathogenesis in wheat. Crop Protection, 26(7), 877–885.
Wang, X. G.; Wei, X. Y.; Tian, Y. Q.; Shen, L. T., y Xu, H. H. 2010. Antifungal Flavonoids from Ficus sarmentosa var. henryi (King) Corner. Agricultural Sciences in China, 9(5), 690–694.
Zhou, B. L.; Yao, T.; Zhang, J., y Ye, X. L. 2009.Effects of Flavonoids of Sophora flavescens to Fusarium Wilt and Resistance Physiology of Cucumber [J]. Acta Agriculturae Boreali–Sinica, 6, 018.
Referencias
Abdel-Monaim, M. F.; Abo-Elyousr K. A.; M., & Morsy, K. M. 2011. Effectiveness of plant extracts on suppression of damping-off and wilt diseases of lupine (Lupinus termis Forsik). Crop protection, 30(2), 185-191.
Abrunhosa, L.; Morales, H.; Soares, C.; Calado, T.; Vila-Chã, A. S.; Pereira, M. & Venâncio, A. 2012. Micotoxinas detectadas en productos alimenticios en Portugal: revisión. Revista Bio Ciencias, 2.
Agrios, G. 2005. Plant Pathology. 5ed. Nueva York. Elsevier Academic Press. 922 p.
Akila, R.; Rajendran, L.; Harish, S.; Saveetha, K.; Raguchander, T.; & Samiyappan, R. 2011. Combined application of botanical formulations and biocontrol agents for the management of Fusarium oxysporum f. sp. Cubense (Foc) causing Fusarium wilt in banana. Biological Control, 57(3), 175-183.
Alkhail, A. A. 2005. Antifungal activity of some extracts against some plant pathogenic fungi. Pak. J. Biol. Sci. 8(3), 413-417.
Badii, M., & Landeros, J. 2007. Plaguicidas que afectan a la salud humana y la sustentabilidad. CULCyT, 4(19), 21-34.
Becerra, J.; Bittner, M.; Hernández, V.; Brintrup, C.; Becerra, J., & Silva, M. 2010. Actividad de aceites esenciales de canelo, queule, bailahuen y culén frente a hongos fitopatógenos. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 9, 212-215.
Cardiet, G.; Fuzeau, B.; Barreau, C. & Fleurat-Lessard, F. 2012. Contact and fumigant toxicity of some essential oil constituents against a grain insect pest Sitophilus oryzae and two fungi, Aspergillus westerdijkiae and Fusarium graminearum. Journal of Pest Science, 85(3), 351-358.
Dane, F., & Dalgiç, Ö. 2005. The effects of fungicide benomyl (benlate) on growth and mitosis in onion (Allium cepa L.) root apical meristem. Acta Biológica Hungarica, 56(1), 119-128.
De León, M. Á., Sáenz, A., Jasso-Cantu, D., Rodríguez, R., Pandey, A., & Aguilar, C. N. 2013. Fermented Flourensia cernua extracts and their in vitro assay against Penicillium expansum and Fusarium oxysporum. Food Technology & Biotechnology, 51(2).
Devine, G. J.; Eza, D.; Ogusuku, E.; & Furlong, M. J. 2008. Uso de insecticidas: contexto y consecuencias ecológicas. Revista Peruana de Medicina Experimental y Salud Publica, 25(1), 74-100.
Durrant, W. E., & Dong, X. 2004. Systemic acquired resistance. Annual Review Phytopathology. 42, 185-209.
García, D.; Ramos, A. J.; Sanchis, V., & Marín, S. 2012. Effect of Equisetum arvense and Stevia rebaudiana extracts on growth and mycotoxin production by Aspergillus flavus and Fusarium verticillioides in maize seeds as affected by water activity. Predictive mycology and use of natural antifungals to prevent the mycotoxin food hazard, 153, 73.
García, M. S., & Ruíz, M. G. 2005. Las MAP cinasas: Elementos de señalización en la defensa de las plantas contra patógenos. Revista de Educación Bioquímica, 24(1), 4-11.
García, J. M. D.; Shagarodsky, T.; Fresneda, J. A.; Fundora, Y. H., & González, J. 2007. Caracterización de especies del género Fusarium en el cultivo del garbanzo (Cicer arietinum) en las provincias ciudad Habana y la Habana. Temas de Ciencia y Tecnología 32 (11), 63-66.
González, I.; Yailén, A., & Peteira, B. 2012. Aspectos generales de la interacción Fusarium oxysporum f. sp. Lycopersici-tomate. Revista de Protección Vegetal, 27(1), 1-7.
Groenewald, S. 2006. Biology, pathogenicity and diversity of Fusarium oxysporum f. sp. cubense . Tesis doctoral, Universidad de Pretoria, Gauteng, Sudáfrica. 158 p.
Hadian, S.; Rahnama, K.; Jamali, S. & Eskandari, A. 2011. Comparing neem extract with chemical control on Fusarium oxysporum and Meloidogyne incognita complex of tomato. Advances in Environmental Biology, 5(8).
Hanaa, R. F.; Abdou, Z. A.; Salama, D. A.; Ibrahim, M. A., & Sror, H. A. M. (2011). Effect of neem and willow aqueous extracts on Fusarium wilt disease in tomato seedlings: Induction of antioxidant defensive enzymes. Annals of Agricultural Sciences, 56(1), 1-7.
Hashem, M.; Moharam, A. M.; Zaied, A. A.; & Saleh, F. E. M. 2010. Efficacy of essential oils in the control of cumin root rot disease caused by Fusarium spp. Crop protection, 29(10), 1111-1117.
Hernández G. M.; Jiménez G. C.; Jiménez A., F. & Arceo G. M. 2007. Caracterización de las intoxicaciones agudas por plaguicidas: perfil ocupacional y conductas de uso de agroquímicos en una zona agrícola del Estado de México, México. Revista internacional de contaminación ambiental, 23(4), 159-167.
Jasso D.; Hernandez C. D.; Angulo S. J. L.; Rodríguez G. R.; Villarreal Q. J., & Lira S., R. 2007. Antifungal activity in vitro of Flourensia spp. extracts on Alternaria sp., Rhizoctonia solani, and Fusarium oxysporum. Industrial Crops and Products, 25(2), 111-116.
Joseph, B., Dar, M. A., & Kumar, V. 2008. Bioefficacy of plant extracts to control Fusarium solani f. sp. melongenae incitant of brinjal wilt. Global Journal of Biotechnology & Biochemistry, 3(2), 56-59.
Kliebenstein, D. J. 2004. Secondary metabolites and plant/environment interactions: a view through Arabidopsis thaliana tinged glasses. Plant, Cell & Environment, 27(6), 675-684.
Laloi, C.; Apel, K., & Danon, A. 2004. Reactive oxygen signalling: the latest news. Current opinion in plant biology, 7(3), 323-328.
Ma, L. J.; Geiser, D. M.; Proctor, R. H.; Rooney, A. P.; O'Donnell, K., Trail, F. & Kazan, K. 2013. Fusarium Pathogenomics. Annual review of microbiology, 67, 399-416.
Montes B. R. 2009. Diversidad de compuestos químicos producidos por las plantas contra hongos fitopatógenos. Revista Mexicana de Micología, 29, 73-82.
Naeini, A.; Ziglari, T.; Shokri, H., & Khosravi, A. R. 2010. Assessment of growth-inhibiting effect of some plant essential oils on different Fusarium isolates. Journal de Mycologie Médicale/Journal of Medical Mycology, 20(3), 174-178.
Necha, L. L. B., & Barrera, L. J. G. 2009. Actividad antifúngica de aceites esenciales y sus compuestos sobre el crecimiento de Fusarium sp. aislado de papaya (Carica papaya). Revista UDO Agrícola. 8 (1). 33-41.
Pawar, V. C., & Thaker, V. S. 2007. Evaluation of the anti-Fusarium oxysporum f. sp cicer and anti-Alternaria porri effects of some essential oils. World Journal of Microbiology and Biotechnology, 23(8), 1099-1106.
Rivera J. M. N. 2009. Marchitez del chile poblano (Capsicum annuum L.): identificación molecular del agente causal, detección en semillas, histopatología y alternativas de control. Tesis doctoral. Colegio de Postgraduados, Texcoco, México.
Rojas, N. P.; Burtin, D., & Leech, M. 2004. Biología molecular, una herramienta para la bioprospección del metabolismo secundario de plantas en Colombia. Revista Colombiana de Biotecnología, 6(2), 67-77.
Rubio R. G.; Baltodano S. F.; Abanto C. L.; Wilson K. J. & Muñoz R. M. 2008. Resistencia in vitro de Rhizoctonia solani y Fusarium oxysporum a los fungicidas Benzomil 500, Rhizolex-T y Homai-WP. Revista Biológica de la Universidad de Trujillo, Perú. 28 (2).
Şahin, F.; Güllüce, M.; Daferera, D.; Sökmen, A.; Sökmen, M.; Polissiou, M., & Özer, H. 2004. Biological activities of the essential oils and methanol extract of Origanum vulgare ssp. Vulgare in the Eastern Anatolia region of Turkey. Food Control, 15(7), 549-557.
Salgado S. L. 2012. Inductores de resistencia a TuMV en Arabidopsis thaliana (L). Heynh. Tesis doctoral. Colegio de Postgraduados, Texcoco, México. 82 p.
Sanmartín, L. Z. 2008. Nuevas aportaciones al metabolismo secundario del tomate. Identificación y estudio de moléculas implicadas en la respuesta a la infección con pseudomonas syrinagae pv. tomato Tesis doctoral. Universitat Politècnica de València, Valencia, España. 163 p.
Sanzón G. D., & Zavaleta M. E. 2011. Respuesta de Hipersensibilidad, una Muerte Celular Programada para Defenderse del Ataque por Fitopatógenos. Revista Mexicana de Fitopatología, 29(2).
Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (SENASICA). 2012. Análisis de riesgo de plagas para la importación de tubérculos de papa (Solanum tuberosum L.) a México. Dirección general de Sanidad Vegetal. Secretaría de Agricultura y Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA). México.
Sharma, B., & Kumar, P. 2009. In vitro antifungal potency of some plant extracts against Fusarium oxysporum. International Journal of Green Pharmacy, 3(1).
Singha, I. M.; Kakoty, Y.; Unni, B. G.; Kalita, M. C.; Das, J.; Naglot, A., & Singh, L. 2011. Control of Fusarium wilt of tomato caused by Fusarium oxysporum f. sp. lycopersici using leaf extract of Piper betle L.: a preliminary study. World Journal of Microbiology and Biotechnology, 27(11), 2583-2589.
Sumalan, R. M.; Alexa, E., & Poiana, M. A. 2013. Assessment of inhibitory potential of essential oils on natural mycoflora and Fusarium mycotoxins production in wheat. Chemistry Central Journal, 7(1), 1-12.
Taiz L., & Zeiger E. 2006. Plant Physiology. Fifth Edition. Sinauer Associates Sunderland. Inc. USA.
Torres, D., & Capote, T. 2004. Agroquímicos un problema ambiental global: uso del análisis químico como herramienta para el monitoreo ambiental. Revista Ecosistemas, 13(3).
Usha, K.; Singh, B.; Praseetha, P.; Deepa, N.; Agarwal, D. K.; Agarwal, R., & Nagaraja, A. 2009. Antifungal activity of Datura stramonium, Calotropis gigantea and Azadirachta indica against Fusarium mangiferae and floral malformation in mango. European journal of plant pathology, 124(4), 637-657.
Valares M. C. 2011. Variación del metabolismo secundario en plantas debida al genotipo y al ambiente. Tesis doctoral. Universidad de Extremadura, Bajadoz, España. 216 p.
Velluti, A.; Marı́n, S.; Gonzalez, P.; Ramos, A. J., & Sanchis, V. 2004. Initial screening for inhibitory activity of essential oils on growth of Fusarium verticillioides, F. proliferatum and F. graminearum on maize-based agar media. Food microbiology, 21(6), 649-656.
Vidhyasekaran, P. 2010. Fungal pathogenesis in plants and crops: molecular biology and host defense mechanisms. CRC Press. 499 p.
Wagacha, J. M., & Muthomi, J. W. 2007. Fusarium culmorum: Infection process, mechanisms of mycotoxin production and their role in pathogenesis in wheat. Crop Protection, 26(7), 877-885.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Ma. Angeles Valencia de Ita, Conrado Parraguirre Lezama, Alfredo Baez Simon, Luis A. Morales Mora, Manuel Huerta Lara, Beatriz Laug Garcia, Omar Romero-Arenas. (2020). In vitro Antagonism of Strains of Trichoderma spp., on Pathogenic Fungi of Nopal Vegetable. Journal of Pure and Applied Microbiology, 14(2), p.1345. https://doi.org/10.22207/JPAM.14.2.31.
2. Lourdes Adriano-Anaya, Luis Fernando Pardo-Girón, Miguel Salvador-Adriano, Miguel Salvador-Figueroa, Isidro Ovando-Medina, Benjamin Moreno-Castillo. (2024). Effectiveness of Bacillus subtilis ANT01 and Rhizobium sp. 11B on the control of fusarium wilt in pineapple (Ananas comosus). PeerJ, 12, p.e16871. https://doi.org/10.7717/peerj.16871.
3. Karla Lizbeth Macías Sánchez, Hiram Deusdedut Rashid González Martínez, Raúl Carrera Cerritos, Juan Carlos Martínez Espinosa. (2023). In Vitro Evaluation of the Antifungal Effect of AgNPs on Fusarium oxysporum f. sp. lycopersici. Nanomaterials, 13(7), p.1274. https://doi.org/10.3390/nano13071274.
4. Eduardo Mena-Rodríguez, Mailen Ortega-Cuadros, Luciano Merini, Aslenis Emidia Melo-Ríos, Adriana Tofiño-Rivera. (2018). Effect of agricultural inputs and essential oils on the soil of vegetables in Colombia's Caribbean region. Ciencia y Tecnología Agropecuaria, 19(1) https://doi.org/10.21930/rcta.vol19_num1_art:849.
5. Lorena Barra-Bucarei, Javiera Ortiz. (2020). Capsicum. https://doi.org/10.5772/intechopen.93509.
6. Ingrid Rocio Fonseca-Guerra, Jhojan Camilo Chiquillo-Pompeyo, Martha Elizabeth Benavides Rozo, Javier Fernando Díaz Ovalle. (2022). Fusarium spp. associated with Chenopodium quinoa crops in Colombia. Scientific Reports, 12(1) https://doi.org/10.1038/s41598-022-24908-w.
7. Norma Yadira Zacamo Velázquez, Javier Ireta Moreno, Yolanda Salinas Moreno, Ricardo Zacamo Velázquez. (2025). Efecto antifúngico de compuestos fenólicos del grano de maíz sobre el desarrollo in vitro de Fusarium verticillioides. TECNOCIENCIA Chihuahua, 19(1), p.e1754. https://doi.org/10.54167/tch.v19i1.1754.
8. Eduardo Mena-Rodríguez, Mailen Ortega-Cuadros, Luciano Merini, Aslenis Emidia Melo-Ríos, Adriana Tofiño-Rivera. (2017). Efecto de agroinsumos y aceites esenciales sobre el suelo de hortalizas en el Caribe Colombiano. Ciencia y Tecnología Agropecuaria, 19(1) https://doi.org/10.21930/rcta.vol19_num1_art:535.
9. Karla Deyanira Ayón-Macías, Anely Johanna Castañeda-Andrade, Juan Arturo Ragazzo-Sánchez, Montserrat Calderón-Santoyo. (2024). Application of nanofibers with jackfruit leaf extract via electrospinning to control phytopathogens in Averrhoa carambola L. Polymer Bulletin, 81(3), p.2601. https://doi.org/10.1007/s00289-023-04815-4.
10. Louis NEBIE, Abdalla DAO, Tobdem Gaston DABIRE, Schémaéza BONZI, Jacob SANOU, Irénée SOMDA. (2024). Diagnosis of fungal diseases in quinoa (Chenopodium quinoa Willd) in Burkina Faso. Scientific Reports, 14(1) https://doi.org/10.1038/s41598-024-71839-9.
11. Ernesto Cerna Chávez, Irasema del Rosario Malacara Herrera, Yisa Maria Ochoa Fuentes, Antonio Orozco Plancarte, Jerónimo Landero Flores , Luis Alberto Aguirre Uribe. (2024). Actividad antifúngica in vitro de nanoformulados para el control de Fusarium solani . Revista Mexicana de Ciencias Agrícolas, 15(2), p.e3076. https://doi.org/10.29312/remexca.v15i2.3076.
12. Wilson Ceiro-Catasú, Edgar Rueda-Puente, Richard Rondón-Fonseca, Oandis Sosa-Sánchez, Ramón Holguín-Peña. (2022). Growth inhibition of Fusarium oxysporum f. sp. nicotianae by two in vitro poisoning methods with fungicides of different toxicological groups. Revista de la Facultad de Agronomía, Universidad del Zulia, 39(3), p.e223944. https://doi.org/10.47280/RevFacAgron(LUZ).v39.n3.10.
13. NEBIE Louis, DAO Abdalla, Soutonnoma NIKIEMA Zara, BONZI Schémaéza, SANOU Jacob, SOMDA Irénée. (2025). Morphological, molecular and pathogenic characterization of Fusarium species infecting quinoa (Chenopodium quinoa Willd) in Burkina Faso. African Journal of Microbiology Research, 19(10), p.224. https://doi.org/10.5897/AJMR2025.9826.
14. Ricardo Aravena, Ximena Besoain, Natalia Riquelme, Aldo Salinas, Miryam Valenzuela, Eduardo Oyanedel, Wilson Barros, Yusser Olguin, Alejandro Madrid, Matias Alvear, Iván Montenegro. (2021). Antifungal Nanoformulation for Biocontrol of Tomato Root and Crown Rot Caused by Fusarium oxysporum f. sp. radicis-lycopersici. Antibiotics, 10(9), p.1132. https://doi.org/10.3390/antibiotics10091132.
15. Kinyoda Alexander B.A.M, Mghalu Joseph Mwafaida, Guyo Paul Mwashimba, Muti Simon Mbuvi. (2022). Effects of Solvent Extracted Bioactive Compounds from the Bark, Roots and Leaves of Croton jatrophoides on Tomato Wilt Disease (Fusarium. oxysporum f. sp. lycopersici). Journal of Natural Products and Resources, 8(1), p.276. https://doi.org/10.30799/jnpr.103.22080101.
16. Rita Luz Márquez Vizcaíno, Marlen Stella Espitia Beltrán, María Stella Parejo Alcocer, Javier Darío Beltran Herrera. (2022). Composición química y efecto antifúngico del extracto total de corteza de Protium aracouchini sobre cepas Colletotrichum.. Revista Productos Naturales, 5(2), p.123. https://doi.org/10.3407/rpn.v5i2.6881.
17. Paola Borrego-Muñoz, Ericsson Coy-Barrera, Diego Quiroga. (2024). New Strategies in the Chemical Control of Fusarium oxysporum Using Synthetic Bioisosteres of Secondary Metabolites: A Review of the Synthetic Methods for Novel Compounds with Potential Antifungal Activity. Mini-Reviews in Organic Chemistry, 21(8), p.794. https://doi.org/10.2174/1570193X20666230516144539.
18. Wenceslao Santiago García, Omar Paz Aquino, Elías Santiago García, Gerardo Rodríguez Ortiz , Arturo Félix Hernández Díaz. (2024). EFECTIVIDAD DE FUNGICIDAS ORGÁNICOS PARA EL CONTROL DE Fusarium EN TRES ESPECIES DE PINO. Revista Mexicana de Agroecosistemas, 11(1) https://doi.org/10.60158/rma.v11i1.416.
19. Mateo León Durán, Myriam Ximena Mancheno Cárdenas. (2020). Actividad antifúngica de compuestos fenólicos de tara (Caesalpinia spinosa) frente a Fusarium graminearum. Revista de Investigación Agraria y Ambiental, 12(1), p.39. https://doi.org/10.22490/21456453.3755.
20. Giovanni Alberto Cuervo-Osorio, Diego Alberto Salazar-Moncada, Claudia Patricia Ossa-Orozco. (2024). Aplicación de nanopartículas metálicas como alternativa en Colombia para el control del “Mal de Panamá”: revisión. Revista ION, 37(1) https://doi.org/10.18273/revion.v37n1-2024004.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2015 Acta Agronómica

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Política sobre Derechos de autor:Los autores que publican en la revista se acogen al código de licencia creative commons 4.0 de atribución, no comercial, sin derivados.
Es decir, que aún siendo la Revista Acta Agronómica de acceso libre, los usuarios pueden descargar la información contenida en ella, pero deben darle atribución o reconocimiento de propiedad intelectual, deben usarlo tal como está, sin derivación alguna y no debe ser usado con fines comerciales.



























