Mutagénesis inducida en microbulbos de Allium sativum L.
Induced mutagenesis in microbulbs of Allium sativum L.
DOI:
https://doi.org/10.15446/acag.v64n3.44792Palabras clave:
cultivo de tejidos, ajo, Allium sativum, bulbificación, radiación gamma, dosimetría (es)tissue culture, bulb induction, Allium sativum, gamma irradiation, radio sensitivity. (en)
Descargas
 un diseño de bloques al azar con cinco tratamientos y 20 repeticiones por tratamiento. En el ensayo mutagénico los microbulbos fueron irradiados con 8 y 10 Krad y almacenados durante 45 días a 10 °C en condiciones de oscuridad En este caso se utilizó un diseño de bloques al azar con tres tratamientos (0, 8 y 10 Krad) y 20 repeticiones por tratamiento. En ambos ensayos, los microbulbos irradiados con 8 y 10 Krad registraron los mayores promedios para peso y diámetro, lo cual permite concluir que estas dosis son adecuadas para favorecer la producción de mutantes con características agronómicas deseables en el clon Boconó.
un diseño de bloques al azar con cinco tratamientos y 20 repeticiones por tratamiento. En el ensayo mutagénico los microbulbos fueron irradiados con 8 y 10 Krad y almacenados durante 45 días a 10 °C en condiciones de oscuridad En este caso se utilizó un diseño de bloques al azar con tres tratamientos (0, 8 y 10 Krad) y 20 repeticiones por tratamiento. En ambos ensayos, los microbulbos irradiados con 8 y 10 Krad registraron los mayores promedios para peso y diámetro, lo cual permite concluir que estas dosis son adecuadas para favorecer la producción de mutantes con características agronómicas deseables en el clon Boconó.Mutagénesis inducida en microbulbos de Allium sativum L.
Induced mutagenesis in microbulbs of Allium sativum L.
Adriana Pardo Roldán
Universidad Centroccidental “Lisandro Alvarado”, Decanato de Agronomía. Departamento de Ciencias Biológicas. Cátedra de Genética. Unidad de Biotecnología Vegetal (UCLA). Tarabana, estado Lara, Venezuela. Autor para correspondencia: apardo@ucla.edu.ve
Rec.: 05.08.14 Acep.:06.04.15
Resumen
Se estableció un protocolo de mutagénesis en microbulbos de ajo (Allium sativum L.) clon Boconó cultivado in vitro. Para el efecto se realizaron dos ensayos, uno de radiosensibilidad para establecer la dosimetría apropiada de radiación gamma y otro de mutagénesis para determinar el comportamiento de los materiales hasta la etapa de almacenamiento. En el primero los microbulbos fueron tratados con cuatros dosis de radiación gamma (6, 8, 10 y 12 Krad), más un control. Para establecer la dosis óptima se consideró la sobrevivencia del 50% de los microbulbos (DL50). Se empleó un diseño de bloques al azar con cinco tratamientos y 20 repeticiones por tratamiento. En el ensayo mutagénico los microbulbos fueron irradiados con 8 y 10 Krad y almacenados durante 45 días a 10 °C en condiciones de oscuridad En este caso se utilizó un diseño de bloques al azar con tres tratamientos (0, 8 y 10 Krad) y 20 repeticiones por tratamiento. En ambos ensayos, los microbulbos irradiados con 8 y 10 Krad registraron los mayores promedios para peso y diámetro, lo cual permite concluir que estas dosis son adecuadas para favorecer la producción de mutantes con características agronómicas deseables en el clon Boconó.
Palabras claves: Cultivo de tejidos, ajo, Allium sativum, bulbificación, radiación gamma, dosimetría.
Abstract
A protocol for induced mutagenesis in clone Boconó (Allium sativum) microbulb cultured in vitro was established. For this, two assays were realized: test or radio sensitivity assays were performed to determine the appropriate gamma radiation dose and test or mutagenesis assays to determine the behavior of the plant material up to storage stage. In order to determine radio sensitivity, microbulbs grown were irradiated with four gamma ray doses (6, 8, 10 and 12 Krad) more control. Optimal dose was established considering 50% microbulb survival (LD50). In this assays a randomized blocks design with 5 treatments and 20 replications per treatment was used. After mutagenic treatment, microbulbs were irradiated with 8 and 10 Krad and then stored at 10 °C in darkness for 45 days. In this assays a randomized blocks design with 3 treatments considered two doses (8 and 10 Krad) more control and 20 replications per treatment was used. In both trials, higher mean weight and diameter were shown in microbulbs irradiated with 8 and 10 Krad, suggesting gamma irradiation to be applied with 8 and 10 Krad in order to facilitate mutant production with desirable agronomic traits in clone Boconó.
Key words: Tissue culture, bulb induction, Allium sativum, gamma irradiation, radio sensitivity.
Introducción
El ajo (Allium sativum L.) es un cultivo ampliamente utilizado por sus cualidades culinarias y medicinales (Brewster, 2008). Durante el proceso de domesticación de la especie se ha favorecido la selección hacia el desarrollo vegetativo y el rendimiento de los bulbos en detrimento del sistema de reproducción y la formación de inflorescencias en las plantas. Lo anterior explica por qué la mayoría de los cultivares de ajo desarrollados a nivel mundial son estrictamente de propagación asexual o vegetativa, siendo éste el único sistema de producción utilizado comercialmente, limitando el mejoramiento a la selección de la variabilidad genética preexistente, al uso de las mutaciones inducidas y a las técnicas del cultivo de tejidos como estrategias para generar nuevas variantes. (Zheng et al., 2007; Matijevic et al., 2013). La aplicación de mutágenos implica evaluar los efectos biológicos producidos en una determinada célula o tejido, por lo que se deben considerar factores como el tipo de mutágeno, la dosis de radiación empleada, y el tamaño y procedencia de los explantes y su radiosensibilidad (Taner y Kunter, 2004). Debido a que la respuesta a un determinado mutágeno se mide principalmente en función del porcentaje de sobrevivencia y la tasa de regeneración y/o multiplicación del material irradiado, es necesario determinar la dosis de radiación que permite la sobrevivencia de los materiales y posteriormente seleccionar entre estos el mayor número de mutantes con características deseables. Ahloowalia y Maluszynski (2001) realizaron ensayos de radiosensibilidad con el fin de establecer el rango de radiación que puede ser aplicado a un determinado cultivo. Dentro de los mutágenos físicos, las radiaciones gamma son las más utilizadas para generar variabilidad en los cultivos agrícolas, así como para reducir las pérdidas poscosecha, eliminar la brotación precoz, minimizar la contaminación, controlar enfermedades y plagas, extender la vida útil de los cultivos, entre otros (Piri et al., 2011). En este campo, los rayos gamma son considerados un tipo de radiación ionizante usualmente obtenidos por radioisótopos, con cobalto 60 (60Co) y cesium 137 (137Cs) como principales fuentes de radiación, siendo la unidad comúnmente utilizada para medir la cantidad de exposición a la radiación el Grays (Gy) o sus equivalentes el rads (1 rads = 0.01 Grays) y/o el Krad (1 Krad = 1000 rads) (IAEA, 2005). En el cultivo de ajo se han realizado investigaciones a partir de bulbos tratados con radiación gamma con el objeto de mejorar características como resistencia a enfermedades (Al–Safadi et al., 2000; Nabulsi et al., 2001), inhibición de la brotación (Croci et al., 1987; Taner y Kunter, 2004; Pérez et al., 2007), ganancia en peso (Croci y Curzio, 1983), durabilidad en almacenamiento (AL–Safadi, 2000), cambios morfológicos (Pellegrini et al., 2000; Wi et al., 2007) y modificaciones en el sabor (Ceci et al., 1991), entre otras características. Por otra parte, la combinación de técnicas como el cultivo de tejidos y la mutagénesis ha facilitado, en una gran diversidad de cultivos agrícolas, la regeneración de un alto número de variantes deseados, la obtención de materiales libres de plagas y enfermedades y la posibilidad de irradiar un alto número de explantes (Zhen, 2001; Zheng et al., 2007). Por lo anteriormente señalado, en este estudio se planteó como objetivo desarrollar un protocolo para la mutagénesis in vitro en el clon Boconó de A. sativum, a través de las técnicas de cultivo de tejidos y la aplicación de radiación gamma.
Materiales y métodos
Establecimiento del cultivo in vitro
Las etapas de iniciación y posterior propagación de bulbos de A. sativum mediante el cultivo in vitro se realizaron en el Laboratorio de Biotecnología de Posgrado de Horticultura de la Universidad Centroccidental Lisandro Alvarado (UCLA), en Tarabana, Estado Lara, Venezuela. En el comienzo los ápices caulinares fueron cultivados en medio Murashige y Skoog (MS) con 0.1 mg/l de ácido naftalenacético (ANA) y 0.5 mg/l de 2–isopenteniladenina (2ip). Para alcanzar la fase de propagación (bulbificación), los brotes procedentes del cultivo de ápices caulinares fueron cultivados en medio MS con 2 mg/l de 2ip más 90 g/l de sacarosa y 8 g/l de agar de acuerdo con el protocolo de Mujica et al. (2008). Para los ensayos de radiosensibilidad y mutagénesis se utilizaron microbulbos de ajo clon Boconó, con un peso entre 0.5 y 0.8 g y diámetro ecuatorial comprendido entre los 0.5 y 1 cm.
Ensayo de radiosensibilidad
El experimento se realizó en la Unidad de Planta Pegamma, del Instituto Venezolano de Investigaciones Científicas (IVIC) ubicado en los Altos de Pipe, los Teques, Estado Miranda, Venezuela. Los microbulbos fueron colocados a 75 cm de distancia y 8 cm de altura de la fuente de radiación gamma (60Co). El poder y la velocidad de la fuente el día de radiación fue de 9813 Curie y 195 Krad/h, respectivamente. De acuerdo con estos valores, se aplicaron cinco dosis de radiación: 0, 6, 8, 10 y 12 Krad, correspondientes a un tiempo de exposición de 0, 1 min 50 s, 2 min 28 s, 3 min 41 s, y 4 min 16 s, respectivamente.
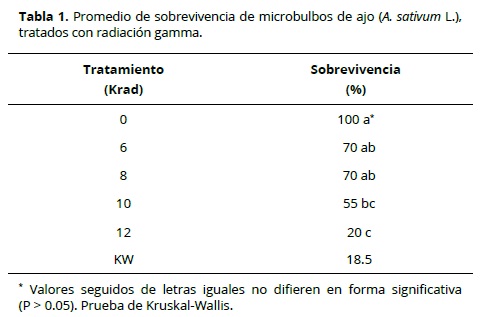
Los microbulbos, una vez irradiados, fueron trasferidos a medio fresco de bulbificación MS con 2 mg/l de 2ip más 90 g/l de sacarosa y 8 g/l de agar, con dos subsiguientes subcultivos a 45 y 90 días. En ambas épocas (edades) se evaluaron las variables: peso seco (g), diámetro ecuatorial (cm) y diámetro polar (cm) de los microbulbos. Al final del experimento, se determinó el porcentaje de sobrevivencia según la escala 1 – 0, donde 1 = microbulbos que permanecieron viables y/o turgentes, y 0 = microbulbos inviables o totalmente secos (Figura 1). Para determinar la radiosensibilidad de los materiales se estableció como dosis óptima aquella que permitió la sobrevivencia de 50% de los microbulbos (DL50).
Para las variables evaluadas (peso, diámetro y sobrevivencia) se aplicó un diseño de bloques al azar con cinco tratamientos (0, 6, 8, 10, 12 Krad), 20 repeticiones por tratamiento y un microbulbo por tubo de ensayo como unidad experimental.
Ensayo de mutagénesis
Una vez determinada la radiosensibilidad, los microbulbos provenientes del cultivo in vitro seleccionados con base en su peso (0.5 a 0.9 g) y diámetro ecuatorial (0.8 a 1 cm), fueron tratados con 8 y 10 Krad de radiación gamma, siguiendo el protocolo anteriormente descrito.
Una vez irradiados, los microbulbos fueron trasferidos a medio fresco de bulbificación MS con 2 mg/l de 2ip más 90 g/l de sacarosa y 8 g/l de agar y dos subcultivos posteriores a 45 y 90 días para evaluar las variables peso seco (g), diámetro ecuatorial (cm) y polar (cm) de los microbulbos. Una vez finalizada la etapa de cultivo in vitro, los microbulbos fueron colocados en bandejas plásticas 20 x 10 x 10 cm provistas de tapa antes de su almacenamiento a 10 °C y condiciones de oscuridad durante 45 días, para nuevamente medir las variables peso seco (g), diámetro ecuatorial (cm) y polar (cm) de los microbulbos. Tanto en la etapa de bulbificación, como en la etapa de almacenamiento, se aplicó un diseño de bloques al azar con tres tratamientos (0, 8, 10 Krad), 20 repeticiones por tratamiento y un microbulbo por tubo de ensayo como unidad experimental.
Análisis de datos
Los datos de sobrevivencia fueron analizados por el método no paramétrica (Kruskal–Wallis, 1952) con la prueba de medias por comparación de rangos múltiples, indicando sus respectivos promedios; mientras que para el peso y el diámetro de los microbulbos se aplicó la prueba de Tukey. En todos los casos, el nivel de significancia fue de 5%. Para el análisis se utilizó el programa estadístico Infogen, versión 2012.
Resultados y discusión
Establecimiento del cultivo in vitro
La iniciación ocurrió en el 98% de los ápices cultivados en MS con 0.1 mg/l de ANA y 0.5 mg/l de 2ip, permitiendo el desarrollo de un solo brote por tubo de ensayo con promedios de altura entre 4 y 4.6 cm. Por otra parte, la microbulbificación a partir de brotes cultivados en MS suplementado con 2 mg/l de 2ip y 90 mg/l de sacarosa, permitió el desarrollo de un solo microbulbo por tubo de ensayo, evidenciando la eficiencia del protocolo de regeneración de microbulbos de A. sativum utilizado.
Ensayo de radiosensibilidad
Durante la determinación de la radiosensibilidad a la radiación gamma en microbulbos de A. sativum, tanto los testigos como los bulbos irradiados con 6, 8 y 10 Krad presentaron porcentajes de sobrevivencia superiores a 50% (DL50), mientras que los tratados con 12 Krad mostraron el menor promedio (20%) al final del experimento (Tabla 1). El comportamiento similar de los tratamientos 6, 8 y 10 Krad de radiación gamma vs. testigo, indican que estos favorecen el desarrollo y/o crecimiento de microbulbos del clon Boconó de ajo.
Al–Safadi et al. (2000); Nabulsi et al. (2001); Zheng et al. (2007) y Wi et al. (2007) encontraron en bulbillos o ‘dientes’ de A. sativum que las dosis óptimas de irradiación con gamma variaban entre 0.1 a 0.7 Krad. Para materiales provenientes de cultivo de tejidos, Zhen (2001) encontró como rango óptimo entre 0.5 y 1 Krad sobre callos irradiados con rayos gamma. En otras investigaciones (Croci y Curzio, 1983; IAEA, 1997; Taner y Kunter, 2004 y Pérez et al., 2007) encontraron que dosis entre 3 y 9 Krad estimulaban el desarrollo y/o crecimiento de bulbos formados de A. sativum, indicando que cada tipo de estructura, bien sea dientes, microbulbos o bulbos, requiere de una dosis de radiación específica para su sobrevivencia y posterior regeneración.
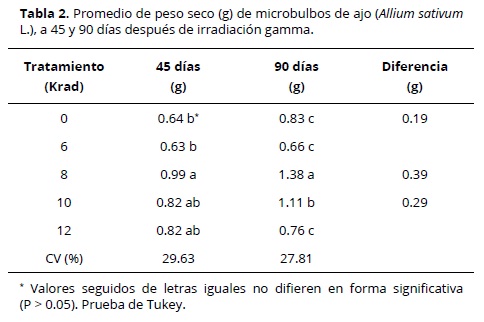
Los análisis del peso seco de los microbulbos mostraron diferencias (P < 0.05) entre tratamientos. En este caso, a los 45 días utilizando la prueba de Tukey fue posible conformar tres grupos (Tabla 2). Los microbulbos irradiados con 8 Krad presentaron el mayor valor promedio seguido por los tratamientos con 10 y 12 Krad. Por el contrario, los microbulbos testigo y los irradiados con 6 Krad presentaron los menores valores para esta variable. En comparación con el testigo, los materiales irradiados con 8, 10 y 12 Krad experimentaron una ganancia en peso de 0.35, 0.18 y 0.18 g, respectivamente.
Noventa días después del tratamiento mutagénico la prueba de Tukey permitió conformar tres grupos, con un valor promedio máximo observado en los microbulbos irradiados con 8 Krad, seguido por el tratamiento con 10 Krad. En el último grupo se encontraron los microbulbos testigo y los irradiados con 12 y 6 Krad. Igual que en el caso anterior, los materiales irradiados con 8 y 10 Krad experimentaron una ganancia en peso de 0.55 y 0.28 g, en relación con el testigo.
En los materiales tratados con 6 Krad la ganancia de peso fue baja (0.03 g) y en los irradiados con 12 Krad se observó una reducción de 0.06 g. Pellegrini et al. (2000) y Wi et al. (2007) encontraron que bajas dosis de radiación (6 Krad) no afectan los materiales irradiados, mientras que altas dosis (12 Krad) reducen de forma drástica el desarrollo o crecimiento debido a alteraciones en el proceso de mitosis en las células tratadas. Wi et al. (2007) determinaron que altas dosis de radiación pueden afectar células, tejidos e inclusive organelos como los cloroplastos. También es ampliamente conocido que las radiaciones gamma con frecuencia producen mutaciones tanto génicas como cromosómicas (Donini, 1997), que no solo inhiben los procesos de división celular, sino también la multiplicación y consecuentemente el crecimiento o desarrollo de los tejidos.
En el presente estudio el diámetro ecuatorial del microbulbo no mostró diferencias (P > 0.05) por efecto de los tratamientos; lo que sí se observó para el diámetro polar (cm) a 45 y 90 días de evaluación (Tabla 3). En este caso a los 45 días la prueba de Tukey separó los tratamientos en tres grupos, con un valor máximo observado en los materiales irradiados con 8, 10 y 6 Krad. En relación con el tratamiento testigo, la elongación de los microbulbos irradiados varió entre 0.13 y 0.16 cm. Noventa días después de la irradiación se conformaron cuatro grupos para esta misma variable, correspondientes a los microbulbos tratados con 8, 10, testigo y 6 y 12 Krad. Cabe destacar, que los materiales tratados con 8 y 10 Krad, experimentaron una elongación, con respecto al testigo, de 0.27 y 0.21 cm, respectivamente.
En una misma edad de evaluación, se encontró mayor elongación en los materiales irradiados con 8 y 10 Krad (0.26 y 0.22 cm), en relación con el testigo, lo que no se observó en los tratamientos con 6 y 12 Krad. Estos resultados indican que la aplicación de 8 y 10 Krad de radiación gamma estimuló la actividad mitótica en las yemas apicales ubicadas en la base del tallo o disco caulinar, dirigiendo el proceso de bulbificación más hacia la elongación y/o la producción de reservas para el desarrollo o emergencia posterior de brotes en detrimento del volumen o grosor de los microbulbos.
Ensayo de mutagénesis
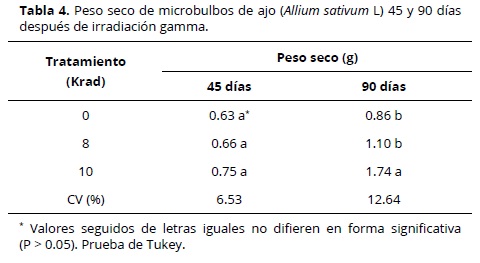
En este ensayo el análisis para el peso de microbulbos no mostró diferencias (P > 0.05) 45 días después de la irradiación; no obstante, a 90 días si se detectaron diferencias a este mismo nivel de probabilidad. De acuerdo con este resultado la prueba de Tukey permitió la separación en dos grupos, observando los mayores promedios con la aplicación de 10 Krad, seguido por 8 Krad y el testigo o control (Tabla 4). En este caso, los microbulbos irradiados con 8 y 10 Krad experimentaron una ganancia en peso seco de 0.24 y 0.88 g, respectivamente.
Los resultados en la Tabla 4 muestran que entre 45 y 90 los microbulbos presentaron ganancias de peso de 0.44 y 0.99 g cuando fueron irradiados, respectivamente, con 8 y 10 Krad, mientras que en el testigo o control la ganancia en peso fue de 0.23 g. Pellegrini et al. (2000) y Al–Safadi et al. (2000), reportaron mínimas perdidas de peso en bulbos de ajo irradiados con gamma en comparación al testigo o control. Asimismo, los cultivares “Rosado Paraguayo” y “Red” de A. sativum, experimentaron una mínima perdida de peso cuando fueron irradiados con 5 y 3 Krad de gamma, respectivamente (IAEA, 1997). Para los diámetros ecuatorial y polar no se encontraron diferencias a 45 y 90 días entre los tratamientos y el testigo (Tabla 5).
Por los resultados antes mencionados y para fines prácticos, se eligieron las dosis de 8 y 10 Krad, como dosis óptimas para microbulbos de ajo, ya que con ellos se garantiza una alta penetración en los tejidos (Donini, 1997; IAEA, 1997; Piri et al., 2011).
Durante la etapa de almacenamiento de los microbulbos bajo condiciones ex vitro (10 °C y condiciones de oscuridad) se encontraron diferencias (P < 0.05) para las variables peso seco y diámetros, observando los mayores promedios con la aplicación de 10 Krad, seguido por 8 Krad y el testigo o control (Tabla 6).
Estos resultados muestran las ventajas de las condiciones de almacenamiento de ajo en este estudio y coincide con los resultados de Donini (1997) sobre la importancia de evaluar períodos y temperaturas de almacenamiento en materiales sometidos a un tratamiento mutagénico.
Conclusiones
- Con el uso de la irradiación gamma, los microbulbos de ajo como semilla pre–básica, pueden ser llevados directamente a condiciones controladas de invernadero, disminuyendo los costos en insumos y mano de obra requeridos para la regeneración mediante otras técnicas de cultivo.
- El procedimiento ofrece una ventaja adicional ya que facilita la selección y el mantenimiento por vía vegetativa de mutantes sólidos o estables, con características deseables en cortos períodos de tiempo (1 – 2 años).
Se estableció un protocolo para la mutagénesis in vitro en el clon Boconó de A. sativum. De esta manera, la irradiación de microbulbos provenientes del cultivo de tejidos, con dosis de 8 y 10 Krad, favorece el desarrollo y crecimiento de microbulbos de ajo, que luego de un proceso de selección pueden formar parte de programas de mejoramiento genético en la producción de semilla básica de A. sativum.
Agradecimientos
A Paúl Azuaje, Dr. Basilio Donini e Ing. Jaime Jaspe por la colaboración prestada y al CDCHT–UCLA por el financiamiento otorgado.
Referencias
Ahloowalia, B. y Maluszynski, M. 2001. Induced mutation: A new paradigm in plant breeding. Euphytica 118:167 – 173.
Al–Safadi, B.; Mir–Ali, N.; y Arabi, M. 2000. Improvement of garlic (Allium sativum L.) resistance to white rot and storability using gamma irradiation induced mutation. J. Gen. Breed. 54:175 – 181.
Brewster, J. 2008. Onions and other vegetable Alliums. 2da Ed. CABI. Cambridge. 413 p.
Ceci, L.; Curzio, O.; y Pomilio, A. 1991. Effects of irradiation and storage on the flavor of garlic bulbs cv. Red. J. Food Sci. 56(1):44 – 46.
Croci, C. y Curzio, O. 1983. The influence of gamma irradiation on the storage life of red variety garlic. J. Food Proc. Preserv. 7(3):179 – 183.
Croci, C.; Arguello, J.; y Orioli, G. 1987. Effect of gamma rays on seed cloves of garlic (Allium sativum) at post–harvest: reversion by exogenous growth regulators. Environ. Exp. Bot. 27(1):1 – 6.
Donini, B. 1997. Mutaciones inducidas en el mejoramiento genético de los cultivos. Universidad de Oriente. Ediciones UDO, Maturín, Venezuela. 36 p.
IAEA (International Atomic Energy Agency). 1997. Irradiation of bulbs and tuber crops. International Atomic Energy Agency. Vienna, Austria. 108 p.
IAEA (International Atomic Energy Agency). 2005. Gamma irradiations for radiation processing. International Atomic Energy Agency. Vienna, Austria. 40 p.
Kruskal, W. y Wallis, W. 1952. Use of ranks in one–criterion variance analysis. Journal of the American Statistical Association. 47 (260): 583–621.
Matijevic, M.; Bado, S.; Lagoda, P.; y Foster, B. 2013. Impact of induced mutations in plant breeding. Plant Genetics and Breeding Technologies. Monduzci. Vienna, Austria. P. 45 – 47.
Mujica, H.; Sanabria, M.; Mogollón, N.; y Perozo, Y. 2008. Formación in vitro del bulbo de ajo morado (Allium sativum L.). Rev. Facultad Agronomía, Universidad del Zulia. 25(2):197 – 210.
Nabulsi, I.; Al–Safadi, B.; Mir, N.; y Arabi, M. 2001. Evaluation of some garlic (Allium sativum L.) mutants resistant to white rot disease by RAPD analysis. Ann. Appl. Biol. 138(2):197 – 202.
Pellegrini, C.; Croci, C.; y Orioli, G. 2000. Morphological changes induced by different doses of gamma irradiation in garlic sprouts. Rad. Phys. Chem. 57(3 – 6):315 – 318.
Pérez, M.; Aveldaño, M.; y Croci, M. 2007. Grown inhibition by gamma rays affects lipids and fatty acids in garlic sprouts during storage. Postharv. Biol. Techn. 44(2):122 – 130.
Piri, I.; Babayan, M.; Tavassoli, A.; y Javahen, M. 2011. The use of gamma irradiation in agriculture. Afr. J. Microb. Res. 5(32):5806 – 5811.
Taner, Y. y Kunter, B. 2004. Determining effective radiation mutagen dose for garlic (Allium sativum L.). Bahçe. 33: 95 – 99.
Zhen, H. 2001. In vitro technique for selection of radiation induced mutants in garlic. En: IAEA. In vitro techniques for selection of radiation induced mutations adapted to adverse environmental conditions. Vienna, Austria. p. 75 – 78.
Zheng, S.; Kamenetsky, R.; Féreol, L.; Barandiaran, X.; y Rabinowitch, D. 2007. Garlic Breeding System innovations. Med. Aromatic Plant Sci. Biotechn. 1(1):6 – 15.
Wi, S.; Chung, B.; Kim, J.; Kim, J.; Baek, M.; y Lee, J. 2007. Effects of gamma irradiation on morphological changes and biological response in plants. Micron. 38(6):553 – 564.
Referencias
Ahloowalia, B y Maluszynski, M. 2001. Induced mutation: A new paradigm in plant breeding. Euphytica. 118: 167-173.
Al-Safadi, B; Mir-Ali, N; Arabi, M. 2000. Improvement of garlic (Allium sativum L.) resistance to white rot and storability using gamma irradiation induced mutation. Journal of Genetic and Breeding. 54: 175-181.
Ceci, L; Curzio, O y Pomilio, A. 1991. Effects of irradiation and storage on the flavor of garlic bulbs cv “Red”. Journal of Food Science. 56(1): 44-46.
Croci, C y Curzio, O. 1983. The influence of gamma irradiation on the storage life of red variety garlic. Journal of Food Processing and Preservation. 7(3): 179-183.
Croci, C; Arguello, J y Orioli, G. 1987. Effect of gamma rays on seed cloves of garlic (Allium sativum) at post-harvest: reversion by exogenous growth regulators. Environmental Experimental Botany. 27(1): 1-6.
Donini, B. 1997. Mutaciones inducidas en el mejoramiento genético de los cultivos. Universidad de Oriente. Ediciones UDO, Maturín, Venezuela. 36 pp.
IAEA. 1997. Irradiation of bulbs and tuber crops. International Atomic Energy Agency. Vienna, Austria. 108 pp.
IAEA. 2005. Gamma irradiations for radiation processing. International Atomic Energy Agency. Vienna, Austria. 40 pp.
Matijevic, M; Bado, S; Lagoda, P y Foster, B. 2013. Impact of induced mutations in plant breeding. Plant Genetics and Breeding Technologies. Ed. Monduzci. Vienna, Austria. pp: 45-47.
Mujica, H; Sanabria; M; Mogollón, N y Perozo, Y. 2008. Formación in vitro del bulbo de ajo morado (Allium sativum L). Revista de la Facultad de Agronomía de la Universidad del Zulia. 25(2): 197- 210.
Nabulsi, I; Al-Safadi, B; Mir, N y Arabi, M. 2001. Evaluation of some garlic (Allium sativum L.) mutants resistant to white rot disease by RAPD analysis. Annals of Applied Biology. 138(2): 197-202.
Pellegrini, C; Croci, C y Orioli, G. 2000. Morphological changes induced by different doses of gamma irradiation in garlic sprouts. Radiation Physics and Chemistry. 57(3-6): 315-318.
Pérez, M; Aveldaño, M y Croci; M. 2007. Grown inhibition by gamma rays affects lipids and fatty acids in garlic sprouts during storage. Postharvest Biology and Technology. 44(2): 122-130.
Piri, I; Babayan, M; Tavassoli, A y Javahen, M, 2011. The use of gamma irradiation in agriculture. African Journal of Microbiology Research. 5(32): 5806-5811.
Taner, Y y Kunter, B. 2004. Determining effective radiation mutagen dose for garlic (Allium sativum L.). Bahce. 33: 95-99.
Thomson, M y Ali, M. 2003. Garlic (Allium sativum): A review of ills potential use as an anticancer agent. Current Cancer Drug Target. 3: 67-81.
Zhen, H. 2001. In vitro technique for selection of radiation induced mutants in garlic. In: IAEA. In vitro techniques for selection of radiation induced mutations adapted to adverse environmental conditions. Vienna, Austria. pp: 75-78.
Zheng, S, Henken, B; Krens, F y Kik, C. 2003. The development of an efficient cultivar independent plant regeneration system from callus derived from apical and non-apical segments of garlic (Allium sativum L.). In Vitro Celular and Developmental Biology. 39 (3): 288-292.
Zheng, S; Kamenetsky, R; Féreol, L; Barandiaran, X y Rabinowitch, D. 2007. Garlic Breeding System innovations. Medicinal and Aromatic Plant Science and Biotechnology. 1(1): 6-15.
Wi, S; Chung, B; Kim, J; Kim, J; Baek, M y Lee, J. 2007. Effects of gamma irradiation on morphological changes and biological response in plants. Micron. 38(6): 553-564.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Sergio Ahumada-Flores, María Fernanda Briceño-Zamora, Jesús Alberto García-Montoya, Carolina López-Cázarez, Angel Esequiel Pereo-Galvez, Fannie Isela Parra-Cota, Sergio de los Santos-Villalobos. (2020). Gamma radiosensitivity study on wheat (Triticum turgidum ssp. durum). Open Agriculture, 5(1), p.558. https://doi.org/10.1515/opag-2020-0057.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2015 Acta Agronómica

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Política sobre Derechos de autor:Los autores que publican en la revista se acogen al código de licencia creative commons 4.0 de atribución, no comercial, sin derivados.
Es decir, que aún siendo la Revista Acta Agronómica de acceso libre, los usuarios pueden descargar la información contenida en ella, pero deben darle atribución o reconocimiento de propiedad intelectual, deben usarlo tal como está, sin derivación alguna y no debe ser usado con fines comerciales.