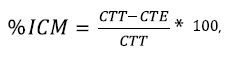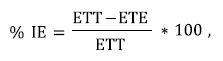Efecto del tiempo y la temperatura de almacenamiento en la actividad de extractos etanólicos de Lantana camara L. y Heliotropium indicum L. sobre Colletotrichum gloeosporioides
Effect of time and temperature of storage on the activity of the etanolic extracts of Lantana camara L. and Heliotropium indicum L. on Colletotrichum gloeosporioides
DOI:
https://doi.org/10.15446/acag.v64n4.47608Palabras clave:
Antracnosis, control biológico, estabilidad, extractos naturales, metabolitos secundarios (es)Natural extracts, secondary metabolites, biological control, anthracnose, stability (en)
Descargas
En el estudio se evalúo el efecto del tiempo y la temperatura de almacenamiento de extractos etanólicos (EE) de Lantana camara L. (Verbenacea) y Heliotropium indicum L. (Boraginaceae) sobre Colletotrichum gloeosporioides. Los EE se almacenaron durante 1 año a 8 ± 2 y 26 ± 2 °C. Cada 2 meses se diluyeron en agar papa dextrosa (PDA) a concentraciones de 0, 0.5, 1 y 1.5% (v/v) sobre las cuales se colocó el hongo para medir la inhibición del crecimiento micelial (ICM) y la esporulación (IE); y en microcultivos en PDA, la germinación de conidios. Los EE almacenados a 8 ± 2 °C conservaron su efectividad durante 12 meses en todas las variables evaluadas, mientras que aquellos a 1.5% de concentración a 26 ± 2°C comenzaron a perder su efectividad a los 6 y 8 meses después de preparados, llegando hasta 3% de ICM, 4% de IE y 18% de germinación. Los resultados indicaron que la temperatura y el tiempo de almacenamiento son determinantes para la efectividad de los EE.
The effect of time and temperature of storage of ethanolic extracts (EE) of Lantana camara and Heliotropium indicum on Colletotrichum gloeosporioides was investigated. The EE were stored at 8±2 and 26±2°C, during one year. Every 2 months they were diluted in potato dextrose agar (PDA) at 0; 0.5; 1 y 1.5% (v/v) concentrations, fungus disks were placed onto the media, mycelial growth (ICM) and sporulation (IE) inhibition were measured, as well as conidia germination. The EE stored at 8±2°C maintained their effectiveness on all variables during the 12 months storage, while those stored at 26±2°C started to lose their effectiveness at 6 to 8 months, ending up to 3% ICM, 4% IE and 18% conidia germination at 1.5% concentration. Results indicated that storage temperature and time are determinant for extracts effectiveness.
Efecto del tiempo y la temperatura de almacenamiento en la actividad de extractos etanólicos de Lantana camara L. y Heliotropium indicum L. sobre Colletotrichum gloeosporioides
Effect of time and temperature of storage on the activity of the etanolic extracts of Lantana camara L. and Heliotropium indicum L. on Colletotrichum gloeosporioides
Rafael Alejandro Infante1, Dorian Alcides Rodriguez2*, Maria Elena Sanabria2, Dilcia Ulacio2 y Rosario Emperatriz Valera2.
1 Fundación Azucarera para el Desarrollo, la Productividad y la Investigación, Fundacaña. Chivacoa, Estado Yaracuy, Venezuela; 2 Universidad Centroccidental Lisandro Alvarado, Barquisimeto, Venezuela. *Autor para correspondencia: rdorian@ucla.edu.ve, rainfante86@gmail.com
Rec.: 01.12.2014 Acep.: 09.02.2015
Resumen
En el estudio se evalúo el efecto del tiempo y la temperatura de almacenamiento de extractos etanólicos (EE) de Lantana camara L. (Verbenacea) y Heliotropium indicum L. (Boraginaceae) sobre Colletotrichum gloeosporioides. Los EE se almacenaron durante 1 año a 8 ± 2 y 26 ± 2 °C. Cada 2 meses se diluyeron en agar papa dextrosa (PDA) a concentraciones de 0, 0.5, 1 y 1.5% (v/v) sobre las cuales se colocó el hongo para medir la inhibición del crecimiento micelial (ICM) y la esporulación (IE); y en microcultivos en PDA, la germinación de conidios. Los EE almacenados a 8 ± 2 °C conservaron su efectividad durante 12 meses en todas las variables evaluadas, mientras que aquellos a 1.5% de concentración a 26 ± 2°C comenzaron a perder su efectividad a los 6 y 8 meses después de preparados, llegando hasta 3% de ICM, 4% de IE y 18% de germinación. Los resultados indicaron que la temperatura y el tiempo de almacenamiento son determinantes para la efectividad de los EE.
Palabras clave: Antracnosis, control biológico, estabilidad, extractos naturales, metabolitos secundarios.
Abstract
The effect of time and temperature of storage of ethanolic extracts (EE) of Lantana camara and Heliotropium indicum on Colletotrichum gloeosporioides was investigated. The EE were stored at 8±2 and 26±2°C, during one year. Every 2 months they were diluted in potato dextrose agar (PDA) at 0; 0.5; 1 y 1.5% (v/v) concentrations, fungus disks were placed onto the media, mycelial growth (ICM) and sporulation (IE) inhibition were measured, as well as conidia germination. The EE stored at 8±2°C maintained their effectiveness on all variables during the 12 months storage, while those stored at 26±2°C started to lose their effectiveness at 6 to 8 months, ending up to 3% ICM, 4% IE and 18% conidia germination at 1.5% concentration. Results indicated that storage temperature and time are determinant for extracts effectiveness.
Keywords:Natural extracts, secondary metabolites, biological control, anthracnose, stability
Introducción
Los extractos etanólicos de muchas plantas silvestres tienen un marcado efecto fungitóxico sobre diversos patosistemas (García y Pérez, 2009). Por mucho tiempo se consideró que los compuestos derivados del metabolismo secundario eran sustancias de desechos sin función fisiológica definida. El efecto fungitóxico es debido a la participación de metabolitos secundarios (MS) en las interacciones entre las plantas y factores bióticos, resultando en la inhibición del crecimiento de otros organismos vegetales (alelopatía) y en la protección contra infecciones y depredadores (Azcón–Bieto y Talón, 2000).
Las investigaciones para desarrollar antifúngicos naturales con estabilidad en el tiempo son escasas y la mayoría de ellas se centran en el efecto fitoquímico que ejercen los MS sobre los patosistemas y no sobre aquellos factores que afectan su estabilidad química (Montes, 2009). Sharapin (2000) sugiere que si se considera la composición química compleja de los extractos vegetales (EV), se debe analizar y controlar el comportamiento de sus componentes durante el almacenamiento, considerando métodos de conservación efectivos para los principios activos que ellos contengan.
Colletotrichum gloeosporioides es un hongo fitopatógeno de amplia distribución, señalado como agente causal de antracnosis en diferentes cultivos de importancia agrícola. El daño por este hongo se manifiesta por necrosis foliar con manchas irregulares, ligeramente hundidas sobre la lámina y bordes de la hoja, y circulares y oscuras en los frutos (Agrios, 2005).
Lantana camara L. (Verbenaceae) y Heliotropium indicum L. (Boraginaceae), conocidas en Venezuela como cariaquito blanco y rabo de alacrán, respectivamente, presentan MS con propiedades antimicrobianas que afectan el desarrollo de distintas especies de hongos fitopatógenos (Silva et al., 1999; Rodríguez et al., 2004). Debido a la acción efectiva que tienen los extractos vegetales sobre algunos hongos fitopatógenos, es necesario conocer el efecto del tiempo y la temperatura de almacenamiento sobre la estabilidad de los principios activos de dichos extractos, lo que permitirá definir las mejores condiciones para su preservación. Para tal fin, en este ensayo se evaluó el efecto del tiempo y la temperatura de almacenamiento sobre los extractos etanólicos de Lantana cámara L. y Heliotropium indicum L. y su acción sobre Colletotrichum gloeosporioides.
Materiales y métodos
Para la obtención del extracto etanólico se utilizaron ramas y hojas de plantas silvestres adultas de L. camara y H. indicum en estado de prefloración, recolectadas en los terrenos del Postgrado de Agronomía de la Universidad Centroccidental Lisandro Alvarado (UCLA), municipio Palavecino, Estado Lara, Venezuela. Las ramas y las hojas fueron secadas bajo sombra y trituradas en una licuadora Oster®. El material resultante fue macerado y diluido en etanol (96%) en una relación de 800 g de materia seca en 3 lt de solvente. Transcurridas 48 h el líquido fue filtrado a través de cuatro capas de gasa y con la ayuda de un Rotavaporador Brinkmann® se separó el alcohol, para obtener así el EE puro, el cual fue transferido a viales de 1.5 ml cubiertos con papel aluminio para evitar la incidencia de la luz. Finalmente fue almacenado durante 12 meses a temperaturas de 26 ± 2°C (ambiente) y 8 ± 2°C (refrigerada).
Para realizar las evaluaciones in vitro se tomaron muestras de EE cada 2 meses hasta 12 meses después de preparados, las cuales fueron utilizadas para medir el efecto sobre el crecimiento micelial y la esporulación de C. gloeosporioides, siguiendo la metodología de Araujo et al. (2007), además, se evaluó el efecto sobre la germinación de los conidios, siguiendo la metodología de Ortiz (2010). En ambos casos se utilizó una cepa del hongo aislada de mango (Mangifera indica L.), perteneciente a la colección del Laboratorio de Micología de Postgrado de Fitopatología de la UCLA, la cual se cultivó, previamente, por 4 semanas en agar–papa–dextrosa (PDA).
Los EE fueron mezclados en PDA previamente esterilizado en autoclave, a las concentraciones de 0, 0.5, 1 y 1.5% (v/v). El medio con EE fue dispensado en cápsulas Petri y una vez solidificado se colocó en él un disco de 0.5 cm de diámetro de agar con micelio, y luego se incubó a 26 ± 2°C. El diámetro de la colonia fue medido cada 2 días hasta que la colonia en el testigo sin EE cubrió totalmente la cápsula. Se empleó un diseño factorial 6 x 2 x 3 con cinco repeticiones para cada uno de los EE. Finalmente, se calculó el porcentaje de inhibición del crecimiento micelial en cada tratamiento, aplicando la fórmula:
donde: ICM = inhibición del crecimiento micelial, CTT = crecimiento micelial en el tratamiento testigo (0%); CTE = crecimiento micelial en el tratamiento evaluado.
Para medir el efecto de los EE sobre la esporulación del hongo, de cada tratamiento con la ayuda de un sacabocado de 0.5 cm de diámetro se sacaron tres discos de PDA con colonia de C. gloeosporioides, los cuales fueron colocados en tubos de ensayo con la adición de 10 ml de agua destilada estéril y agitación por 1 min. Con ayuda de un hematocímetro se determinó la cantidad de conidios en suspensión y se procedió a calcular el porcentaje de inhibición de cada tratamiento en relación con el testigo (sin EE) utilizando la ecuación siguiente:
donde: IE = Inhibición de la esporulación, ETT = esporulación en el tratamiento testigo (0%); ETE = esporulación en el tratamiento evaluado.
Para medir el efecto de los EE sobre la germinación de conidios de C. gloeosporioides se prepararon microcultivos con medio PDA enmendado con los EE almacenados en las concentraciones de 0; 0,5; 1 y 1.5% (v/v) que fueron aplicados en láminas porta–objetos, utilizando tres repeticiones por tratamiento. Se preparó una suspensión de 2.8 x 105 conidios/ml, siguiendo la metodología del experimento anterior y se aplicó una alícuota de 20 µl a las láminas, luego se incubaron en cámaras húmedas a 26 ± 2°C. Transcurridas 12 h se realizaron seis observaciones aleatorias de las láminas con microscopio óptico a 400X y se contabilizaron los conidios germinados en cada tratamiento. Con los datos obtenidos se calculó el porcentaje de germinación para realizar el análisis de varianzas, utilizando el programa Statistix®, versión 8.0, y la comparación de medias mediante la prueba Tukey (P < 0.01).
Resultados y discusión
Los resultados del análisis de varianza indicaron diferencias (P < 0.01) entre tratamientos para tiempo, temperatura de almacenamiento, concentración y sus interacciones. Al realizar la comparación de medias (Tabla 1) se observó que el efecto sobre la ICM no varió para los extractos almacenados a 8 ± 2°C, con una inhibición de 67% a los 12 meses en las máximas concentraciones del EE (1.5 %) de L. cámara y de 62% de H. indicum. El almacenamiento a 26 ± 2°C ocasionó una pérdida del efecto de los EE a partir de los 6 meses, en el caso de L. camara, y de 8 meses en H. indicum; con valores de 4% para el primero y de 2% para el segundo al finalizar el experimento después de 12 meses de almacenamiento.

En la evaluación de la esporulación, el análisis de varianza mostró, igualmente, diferencias significativas (P < 0.01) entre los tratamientos para cada variable y las interacciones. En el extracto almacenado a 8 ± 2°C, la prueba de medias reveló que los EE mantuvieron su efecto sobre la IE a través del año de estudio (Tabla 2), con valores de 78% para L. cámara y 68% para H. indicum. Los EE almacenados a 26 ± 2°C, por el contrario, disminuyeron su efecto a partir de 6 meses de almacenados, en el caso de L. camara y de 8 meses en el caso de H. indicum, cuando las pérdidas de efectividad fueron drásticas, llegando hasta 4% de IE al final de los 12 meses.

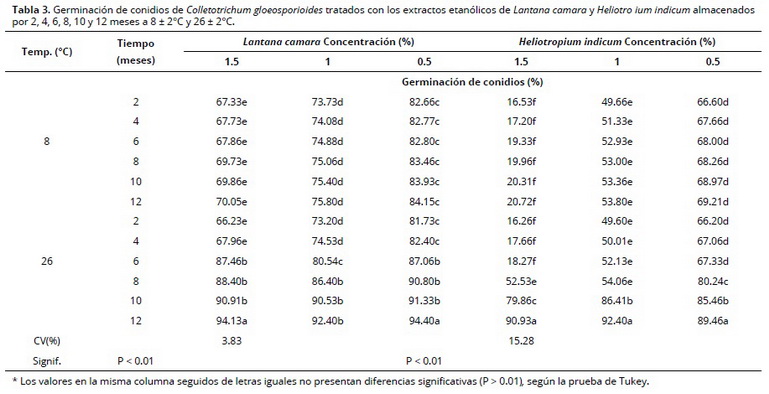
El porcentaje de germinación, al igual que la ICM y la IE, varió significativamente (P < 0.01) entre los tratamientos para las variables evaluadas y sus interacciones (Tabla 3). Los extractos de ambas especies conservados a 8 ± 2°C no mostraron diferencias (P > 0.05) dentro de cada concentración durante los 12 meses de evaluación. Los menores porcentajes de germinación a esta temperatura se obtuvieron con la más alta concentración (1.5%) de los EE, especialmente con H. indicum, los cuales alcanzaron un valor de 20.7%, después de 12 meses de almacenamiento; mientras que con la misma concentración de EE de L. camara se alcanzaron valores de 70%. Los EE conservados a 26 ± 2°C presentaron una pérdida creciente de efectividad, a partir de 6 meses, en el caso de L. camara, y de 8 meses, en el caso de H. indicum. A los 12 meses, la germinación de los conidios en todas las concentraciones de EE variaron entre 89.4 y 94.4%.
Los resultaron mostraron que la temperatura tiene un efecto directo sobre la efectividad de los extractos vegetales, lo cual puede estar relacionado con el carácter termolábil de los MS (Sharapin, 2000). Bayer et al. (1987) explicaron que los MS, especialmente los fenoles, pueden descomponerse total o parcialmente a temperatura ambiente, debido a la ruptura de los anillos de benceno, los cuales son la base estructural de muchos de ellos. Por otro lado, Rosas (2004) indicó que las bajas temperaturas favorecen la conservación de las características químicas de los EV, explicando por qué los extractos almacenados a 8 °C no perdieran su efectividad.
La literatura no reporta evaluaciones sobre la efectividad en el tiempo y bajo diferentes temperaturas de los EE sobre hongos fitopatógenos, sin embargo, los resultados de este estudio indicaron que existe una relación directa entre ambos factores; lo que indica que el tiempo de almacenamiento depende de las condiciones de temperatura del mismo.
Conclusiones
- Los EE de L. camara y H. indicum almacenados a 8 ± 2°C no perdieron su efectividad en el control de C. gloeosporioides durante 12 meses de almacenamiento; no obstante almacenados a 26 ± 2°C disminuyeron sus efecto sobre el crecimiento micelial, la esporulación y la germinación de conidios del hongo, para L. camara a los 6 meses y para H. indicum a los 8 meses, después de preparados.
- El EE de H. indicum tuvo mayor efectividad sobre la germinación de conidios, mientras que el de L. camara lo tuvo sobre el crecimiento micelial y la esporulación.
Agradecimientos
Los autores desean agradecer al Consejo de Desarrollo Científico, Humanístico y Tecnológico (CDCHT) de la Universidad Centroccidental Lisandro Alvarado (UCLA) por el soporte financiero de esta investigación a través de los Proyectos 044–AG–2009 y 019–AG–2012.
Referencias
Agrios, G. 2005. Fitopatología. Segunda edición. Editorial Limusa. México. p. 838 – 850.
Araujo, D.; Rodríguez, D.; y Sanabria, M.E. 2007. Respuesta del hongo Fusarium oxysporum f.sp cubense, causante del mal de Panamá a algunos extractos vegetales y fungicidas. Fitop. Ven. 21(1):2 – 8
Azcón–Bieto, J. y Talón, M. 2000. Fundamentos de fisiología vegetal. Primera edición interamericana, MG Graw–Hill de España, Madrid. p. 169 – 171.
Bayer H.; Barluenga, J.; y Wolfgan, W. 1987. Manual de química orgánica. Editorial Reverte S.A. p. 548 – 579.
García, A. y Pérez, E. 2009. Metabolismo secundario de plantas. Reduca (Biología). Serie Fisiología Vegetal. 2(3):119 – 145.
Montes, R. 2009. Diversidad de compuestos químicos producidos por las plantas contra hongos fitopatógenos. Rev. Mex. Micol. 29:73 – 82.
Ortiz, F. 2010. Etiología del tizón tardío del celery (Apium graveolens L.) y evaluación de extractos vegetales bajo condiciones controladas. Tesis de Grado para optar al título de Magister Scientiarum. Universidad Centroccidental Lisandro Alvarado. Venezuela. 95 p.
Rodríguez, D.; Sanabria, M. E.; y Rodríguez, J. 2004. Inhibición de Fusarium oxysporum f.sp lycopersici, Phytophtora infestans y Rhizoctonia solani con extracto etanólico de Heliotropium indicum. Fitop. Ven. 16(2):1 – 80.
Rosas, A. 2004. Nuevas fuentes de antioxidantes vegetales. Subprograma IV–Biomasa como fuente de productos químicos y energéticos. Ministerio de Ciencia y Tecnología. Cooperación Iberoamericana CYTED. Caracas. 416 p.
Sharapin, N. 2000. Fundamentos tecnológicos fitoterapéuticos. Primera edición. Cooperación Iberoamericana, Ciencia y Tecnología para el Desarrollo. Colombia. p. 18 – 29.
Silva, M.; Andrade, E.; y Zoghbi, M. 1999. The essential oils of Lantana camara occurring in north Brazil. Flavour Fragr. 4(14):208 – 210
Referencias
Agrios, G. 2005. Fitopatología. Segunda edición. Editorial Limusa. México. 838 -850p.
Araujo, D.; Rodríguez, D.; Sanabria, M.E. 2007. Respuesta del hongo Fusarium oxysporum f.sp cubense, causante del mal de Panamá a algunos extractos vegetales y fungicidas. Fitopatología Venezolana. (21) 1:2-8
Azcón-Bieto, J. y Talón, M. 2000. Fundamentos de Fisiología Vegetal. Primera edición interamericana, MG Graw-Hill de España, Madrid. 169-171p
Bayer H.; Barluenga, J.; Wolfgan, W. 1987. Manual de Química Orgánica. Editorial Reverte S.A. 548-579.
García, A.; Pérez, E. 2009. Metabolismo Secundario de Plantas. Reduca (Biología). Serie Fisiología Vegetal. 2 (3): 119-145.
Montes, R. 2009. Diversidad de compuestos químicos producidos por las plantas contra hongos fitopatógenos. Revista Mexicana de Micología 29:73-82.
Ortiz, F. 2010. Etiología del tizón tardío del celery (Apium graveolens L.) y evaluación de extractos vegetales bajo condiciones controladas. Tesis de de Grado para optar al título de Magister Scientiarum. Universidad Centroccidental “Lisandro Alvarado”. 95p
Rodríguez, D.; Sanabria, M. E.; Rodríguez, J. 2004. Inhibición de Fusarium oxysporum f.sp lycopersici, Phytophtora infestans y Rhizoctonia solani con extracto etanolico de Heliotropium indicum. Fitopatología Venezolana. 16(2): 80p.
Rosas, A. 2004. Nuevas fuentes de antioxidantes vegetales. Subprograma IV-Biomasa como fuente de productos químicos y energéticos. Ministerio de ciencia y tecnología. Cooperación Iberoamericana CYTED. Caracas. 416p.
Sharapin, N. 2000. Fundamentos Tecnológicos Fitoterapeuticos. Primera edición. Cooperación Iberoamericana, ciencia y tecnología para el desarrollo. Colombia. 18-29p.
Silva, M.; Andrade, E.; Zoghbi, M. 1999. The essential oils of Lantana camara occurring in north Brazil. Flavour Fragr. 4(14): 208-210.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Deluxeani Sureshkumar, Christy Jeyaseelan Emmanuel, Devika M. De Costa. (2025). Anthracnose of grapevines in Sri Lanka: Pathogen identification, epidemiological insights, and in vitro evaluation of bioactive extracts. Physiological and Molecular Plant Pathology, 139, p.102771. https://doi.org/10.1016/j.pmpp.2025.102771.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2015 Acta Agronómica

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Política sobre Derechos de autor:Los autores que publican en la revista se acogen al código de licencia creative commons 4.0 de atribución, no comercial, sin derivados.
Es decir, que aún siendo la Revista Acta Agronómica de acceso libre, los usuarios pueden descargar la información contenida en ella, pero deben darle atribución o reconocimiento de propiedad intelectual, deben usarlo tal como está, sin derivación alguna y no debe ser usado con fines comerciales.