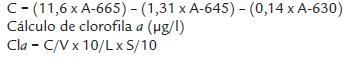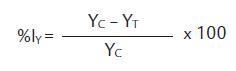EVALUACIÓN DEL EFECTO DEL HIDROCARBURO FENANTRENO SOBRE EL CRECIMIENTO DE Chlorella vulgaris (CHLORELLACEAE)
Se evaluó el efecto del hidrocarburo policíclico aromático fenantreno sobre el crecimiento de la microalga Chlorella vulgaris bajo condiciones de laboratorio. Las microalgas fueron expuestas a diferentes concentraciones de fenantreno (0, 1, 10, 100, 1000 y 10000 μg/l). El tiempo de exposición fue de 72 h, determinándose diariamente la densidad algal mediante recuento en cámara de Neubauer. Se determinó la tasa promedio de crecimiento, la biomasa total y el porcentaje de inhibición de la biomasa. También se evaluó el contenido de clorofila a, al inicio y final del experimento. Los ensayos fueron realizados en recipientes de vidrio de 0,4 l, utilizando como medio de cultivo fertilizante inorgánico del complejo NPK (REMITAL® m – 17-6-18) a razón de 1 g/l. Los resultados mostraron que el fenantreno inhibió progresivamente el crecimiento de la microalga, observándose el menor crecimiento celular en el medio con la mayor concentración de fenantreno, el cual alcanzó un porcentaje de inhibición del crecimiento del 59 %. Las tasas de crecimiento diario se mantuvieron relativamente constantes en los demás tratamientos. La concentración de clorofila a, medida mediante espectrofotometría, no se afectó por las diferentes concentraciones del hidrocarburo. En conclusión, el crecimiento de la microalga C. vulgaris puede afectarse negativamente por la exposición a concentraciones nominales superiores a 1 μg/l de fenantreno.
EVALUACIÓN DEL EFECTO DEL HIDROCARBURO FENANTRENO SOBRE EL CRECIMIENTO DE Chlorella vulgaris (CHLORELLACEAE)
Effect of the Hydrocarbon Phenanthrene on Chlorella vulgaris (Chlorellaceae) Growth
ANGÉLICA OTEROPATERNINA1, M.Sc.; PABLO E. CRUZCASALLAS1, Ph. D.; YOHANA M. VELASCOSANTAMARÍA1, Ph. D.
1Grupo de Investigación sobre Reproducción y Toxicología de Organismos Acuáticos GRITOX, Facultad de Ciencias Agropecuarias y Recursos Naturales, Universidad de los Llanos, km 12, vía Puerto López, Villavicencio, Colombia. Autor de correspondencia: Yohana Velasco Santamaría. ymvelascos@unillanos.edu.co. Tel.: +57 8 6 616 800, ext. 158.
Presentado 25 de septiembre de 2012, aceptado 20 de noviembre de 2012, correcciones 7 de febrero de 2013.
RESUMEN
Se evaluó el efecto del hidrocarburo policíclico aromático fenantreno sobre el crecimiento de la microalga Chlorella vulgaris bajo condiciones de laboratorio. Las microalgas fueron expuestas a diferentes concentraciones de fenantreno (0, 1, 10, 100, 1000 y 10000 µg/l). El tiempo de exposición fue de 72 h, determinándose diariamente la densidad algal mediante recuento en cámara de Neubauer. Se determinó la tasa promedio de crecimiento, la biomasa total y el porcentaje de inhibición de la biomasa. También se evaluó el contenido de clorofila a, al inicio y final del experimento. Los ensayos fueron realizados en recipientes de vidrio de 0,4 l, utilizando como medio de cultivo fertilizante inorgánico del complejo NPK (REMITAL® m – 17-6-18) a razón de 1 g/l. Los resultados mostraron que el fenantreno inhibió progresivamente el crecimiento de la microalga, observándose el menor crecimiento celular en el medio con la mayor concentración de fenantreno, el cual alcanzó un porcentaje de inhibición del crecimiento del 59 %. Las tasas de crecimiento diario se mantuvieron relativamente constantes en los demás tratamientos. La concentración de clorofila a, medida mediante espectrofotometría, no se afectó por las diferentes concentraciones del hidrocarburo. En conclusión, el crecimiento de la microalga C. vulgaris puede afectarse negativamente por la exposición a concentraciones nominales superiores a 1 µg/l de fenantreno.
Palabras clave: biomasa, clorofila, hidrocarburo, microalgas, toxicidad.
ABSTRACT
The effects of the polycyclic aromatic hydrocarbon phenanthrene on the growth of Chlorella vulgaris alga were evaluated under laboratory conditions. The algae were
exposed during 72 h to different concentrations of phenanthrene (0, 1, 10, 100, 1000 and 10000 µg/l). The alga density was daily determined by a Neubauer chamber. The average growth average, total biomass and inhibition percentage of the biomass were also determined. In addition, the content of chlorophyll a was determined at the beginning and the end of the experiment. The assays were carried out in glass bottles of 0,4 l using the complex NPK (REMITAL® m – 17-6-18) at 1 g/l as an organic fertilizing. The results showed that phenanthrene inhibited progressively the alga growth being the lowest cellular growth observed in the medium with the highest phenanthrene concentration, reaching an inhibition percentage of 59 %. In the other treatments, the daily growth rate was relatively constant. The chlorophyll a concentration evaluated by spectrophotometry was not affected by the phenanthrene concentration. In conclusion, the growth of the alga C. vulgaris was affected negatively by the exposure to nominal concentrations of the polycyclic aromatic hydrocarbon phenanthrene higher than 1 µg/l.
Keywords: biomass, chlorophyll, hydrocarbon, microalgae, toxicity.
INTRODUCCIÓN
Durante las últimas décadas, las diferentes actividades antropogénicas han generado un deterioro progresivo en los ambientes naturales, siendo los cuerpos de agua uno de los ecosistemas más afectados. Dentro de las fuentes de contaminación, los desechos generados por la extracción de petróleo, son causales potenciales de contaminación ambiental (Gómez y Ramírez, 2004). Colombia posee una alta riqueza petrolera y por ende una alta explotación de este mineral; no obstante, son casi nulos los estudios orientados a determinar los efectos que compuestos derivados del petróleo ocasionan en organismos acuáticos.
Los hidrocarburos aromáticos policíclicos (HAPs) son compuestos generados durante la destilación de la madera, el funcionamiento de las obras de gas, las refinerías de petróleo, el escurrimiento de pavimentos asfálticos, las emisiones vehiculares, los derrames de petróleo y la combustión incompleta de combustibles fósiles y de materia orgánica (Canet et al., 2001; Tang et al., 2005), los cuales se encuentran en el ambiente como mezclas complejas de diferentes sustancias químicas, generalmente constituidas por dos a diez anillos aromáticos (Hylland, 2006). Estas sustancias son consideradas tóxicas para los organismos con efectos mutagénicos, teratogénicos y carcinógenos (Gelboin, 1980; Lehr y Jerina, 1997; Henkler et al., 2012). El fenantreno es uno de los hidrocarburos más frecuentes en el ambiente (Shimada et al., 2004; Nizetto et al., 2008), clasificado por la US Enviromental Protection Agency (EPA) como un contaminante prioritario que contribuye con más del 49 % del total de HAPs en el ambiente, y considerado junto con el fluoranteno y pireno, como los principales hidrocarburos contaminantes atmosféricos (Orli ski, 2002; Shimada et al., 2004). Al ser un hidrocarburo aromático pequeño (tres anillos aromáticos), el fenantreno se emplea frecuentemente para desarrollar estudios sobre el metabolismo de hidrocarburos aromáticos policíclicos con efecto carcinogénico (Pelkonen y Nebert, 1982; Narro et al., 1992). La toxicidad y letalidad de los HAPs se ha determinado para algunas especies de organismos terrestres y para una gran variedad de organismos acuáticos, tales como copépodos, anfípodos y otros organismos zooplanctónicos, macroalgas, microalgas, gusanos de arena, cangrejos, camarones y algunas especies de peces como trucha (Oncorhynchus mykiss), Chinook salmón (O. tshawytscha), catfish (Ictalurus punctatus) y salema (Sarpa salpa), eelpout (Zoarces viviparous), entre otras (Reynaud y Deschaux, 2006).
Los resultados de los monitoreos de la calidad de agua utilizada en los procesos de extracción de hidrocarburos, indican que en la región de la Orinoquia colombiana los niveles de fenantreno pueden llegar hasta 134 µg/l en el agua residual asociada a la producción. Sin embargo, una vez esta agua es sometida a los tratamientos establecidos en los campos petroleros, estas concentraciones de fenantreno bajan a valores no detectables (<0,22 µg/l), aunque en ocasiones se han reportado concentraciones cercanas a 7 µg/l (datos no publicados). Uno de los factores que sustentan el uso de algas en los bioensayos es su abundancia en los ecosistemas acuáticos. Si estos microorganismos se ven afectados por una sustancia tóxica, el ecosistema circundante percibe la falta de esa fuente de alimento (Wang y Zheng, 2008). Entre las microalgas utilizadas en ensayos de toxicidad encontramos las algas verdes como Scenedesmus sp., que ha sido utilizada como bioindicador para valorar los efectos del petróleo o efluentes derivados de su extracción, reportando una disminución en la concentración de clorofila a, en el porcentaje de materia seca, en la densidad celular o la tasa de crecimiento (Aguilar et al., 2010; Gómez y Ramírez, 2004). Por su parte, algas marinas expuestas a concentraciones de 5 a 1000 µg/l de fenantreno han presentado disminución en la tasa de crecimiento de manera proporcional a la concentración (Echeveste et al., 2010). Chlorella vulgaris se ha usado eficientemente para evaluar el efecto de HAPs, al respecto, se han observado efectos negativos en su estructura celular debido a la exposición a fluoranteno (Yu et al., 2013), así como daño oxidativo de las algas por exposición a concentraciones inferiores a 10 mg/l de naftaleno (Kong et al., 2010); no obstante, no se conocen reportes de toxicidad de fenantreno en C. vulgaris. Chlorella vulgaris es un alga verde unicelular, frecuentemente utilizada como bioindicador debido a su alta sensibilidad a sustancias tóxicas (Ma et al., 2004) y a su facilidad de cultivo en el laboratorio. Además, es muy sensible a los cambios en su entorno, presenta un ciclo de vida corto facilitando la evaluación de los efectos tóxicos sobre varias generaciones. Sumado a esto, C. vulgaris ha sido identificada como el alga ideal para realizar pruebas de inhibición del crecimiento con bioensayos de duración de 72 h, según las normas de la Organización para la Cooperación Económica y el Desarrollo (OECD, 2011). El objetivo de este estudio fue evaluar el efecto del hidrocarburo aromático policíclico fenantreno sobre el crecimiento de la microalga C. vulgaris, bajo condiciones de laboratorio en la Orinoquia Colombiana.
MATERIALES Y MÉTODOS
LOCALIZACIÓN Y DESCRIPCIÓN DEL ÁREA DE ESTUDIO
La investigación se llevó a cabo en el laboratorio de producción de alimento vivo del Instituto de Acuicultura de la Universidad de los Llanos, localizado a 12 km de la ciudad de Villavicencio, Colombia. La altura promedio es de 418 msnm, con una temperatura máxima de 33,3 °C y una temperatura mínima promedio de 18,8 ºC, precipitación anual entre 1900 y 2300 mm y humedad relativa del 75 % (IDEAM, 2010).
CULTIVO DE Chlorella vulgaris
La cepa de microalga C. vulgaris fue obtenida del laboratorio de alimento vivo del Instituto de Acuicultura de la Universidad de los Llanos. El stock del cultivo se conservó en recipientes de vidrio de 3 l, previamente esterilizados en autoclave (45 min a una temperatura de 121 ºC, Tuttnauer® 2540 MK, Holanda). Se utilizó un medio de cultivo fertilizante inorgánico del complejo NPK (REMITAL® m – 17-6-18) a razón de 1 g/l, el cual ha mostrado los mejores resultados con respecto al crecimiento poblacional (Muñoz et al., 2012). Las microalgas se mantuvieron bajo condiciones controladas de laboratorio con iluminación blanca artificial constante de 72 W y una intensidad lumínica de 2629 ± 300 lux (31,8 ± 3,6 µmol m-2.s-1), temperatura de 18 ± 1 ºC y aireación permanente, manteniéndose el cultivo hasta que alcanzó la fase exponencial.
ENSAYO PRELIMINAR
Teniendo en cuenta las características lipofílicas del fenantreno (98 % pureza, SigmaAldrich, Alemania), se realizó un ensayo evaluando el uso de dos solventes: dimetilsulfóxido (DMSO v/v Sigma Chemical Co., St. Louis, MO, USA) y acetona (Merck, Darmstadt, Alemania). Para este fin, se evaluaron para los dos solventes concentraciones de 0,05 % a 1 % durante un periodo de 24 h, obteniéndose el mejor resultado de solubilidad con acetona al 0,05 %, lo cual minimizó los posibles efectos secundarios del solvente.
EXPOSICIÓN DE LAS ALGAS AL HIDROCARBURO FENANTRENO
Los ensayos se llevaron a cabo en recipientes de vidrio de 0,4 l esterilizados. Las condiciones de cultivo se mantuvieron constantes durante todo el periodo de exposición. Las microalgas fueron expuestas a las siguientes concentraciones de fenantreno (98 %, Sigma Aldrich): 0, 1, 10, 100, 1000 y 10000 µg/l, considerando la concentración de 0 % como el tratamiento control, adicionando únicamente 0,05 % de acetona (solvente control). Los ensayos de exposición se realizaron dos veces con intervalo de 15 días y cada tratamiento tuvo cinco réplicas, para un total de diez replicas. En cada unidad experimental (recipientes) se inoculó una concentración algal inicial de 2,0 x 104cel/ml de medio de cultivo. El tiempo de exposición fue de 72 h según lo recomendado por la OECD (2011), determinándose diariamente la densidad algal mediante recuento en cámara de Neubauer. De igual modo, se determinaron la tasa promedio de crecimiento, biomasa total y el porcentaje de inhibición de la biomasa (OECD, 2011), los cuales se describen a continuación.
VARIABLES EVALUADAS
Densidad algal. La densidad algal fue determinada mediante recuento en cámara de Neubauer bajo un microscopio óptico (40x) (Nikon® Eclipse E200, Japón). Para cada réplica el conteo se realizó por duplicado. Para disminuir el error del método se calculó el promedio de los recuentos y se utilizó la fórmula propuesta por SipaúbaTavares y Rocha (2003):
Contenido de clorofila a. Por cada réplica, 50 ml del medio con las micro algas fue filtrado y posteriormente el filtro fue transferido a tubos de ensayo protegidos de la luz, en cuyo interior se habían adicionado previamente 10 ml de acetona al 90 %. Posteriormente, el filtro fue macerado y las muestras mantenidas bajo refrigeración (4 ºC) durante 24 h en una nevera convencional. Transcurrido este tiempo la absorbancia del sobrenadante fue determinada a 665, 645 y 630 nm de longitud de onda (espectrofotómetro, 6405 UV/VIS de Jenway, Reino Unido), para así calcular el contenido de clorofila a aplicando la fórmula propuesta por Strickland y Parsons (1972):
Donde:
Cla: clorofila a
C: resultado de la ecuación de Strickland y Parsons
V: volumen de la muestra de agua filtrada (0,05l)
L: longitud de la boca de la cubeta (1cm)
S: volumen de acetona utilizado (0,01l)
Tasa promedio de crecimiento diario
Es el incremento logarítmico de la biomasa durante la duración del ensayo, para lo cual se empleó la siguiente ecuación :
Donde:
µi-j = promedio de la tasa de crecimiento especifico desde el tiempo i hasta j
Xi = biomasa en el tiempo i
Xf = biomasa en el tiempo f
El porcentaje de inhibición de la tasa de crecimiento. Se calculó teniendo en cuenta la tasa específica de crecimiento así:
%IT =por centaje de inhibición del promedio de la tasa especifica de crecimiento
µC =promedio de la tasa especifica de crecimiento (µ) en el grupo control
µT =promedio de la tasa especifica de crecimiento en el tratamiento.
La biomasa total. Se calculó teniendo en cuenta la biomasa al final del periodo de ensayo (tres días) tanto del grupo control como de los tratamientos, menos la biomasa inicial de cada uno.
BT=Bf–Bi
Porcentaje de inhibición de la biomasa % Iy. Fue calculado teniendo en cuenta la biomasa húmeda total, así:
YC = valor medio de la biomasa en el grupo control
YT = valor medio de la biomasa en el tratamiento
El porcentaje de inhibición de la tasa de crecimiento algal fue usado para calcular la concentración efectiva 50 (CE50) y concentración efectiva 20 (CE20).
ANÁLISIS ESTADÍSTICO
Se realizó estadística descriptiva para expresar los resultados como media ± error estándar de la media (SEM). La homogeneidad de varianza y la normalidad de los datos fueron analizadas por medio de la prueba de Bartlett y la prueba de KolmogorovSmirnov, respectivamente. Para comparar las diferencias entre el grupo control y los tratamientos de fenantreno, las variables de densidad, la clorofila a, el TPCD y la biomasa total fueron sometidas a un análisis de varianza de una vía (ANOVA), seguido de la prueba de Dunnett. En las variables de % ITC y % de inhibición se realizó un análisis de varianza de una vía (ANOVA) seguido del test de comparación múltiple Tukey. Un valor de p <0,05 fue utilizado como criterio para considerar diferencias estadísticas significativas. La CE fue calculada por el método de probit. Los datos fueron analizados con el software SAS versión 9.2 para Wndows (2002-2008 por SAS Institute Inc, Cary, NC, USA).
RESULTADOS
DENSIDAD CELULAR DE C. vulgaris EXPUESTA A FENANTRENO
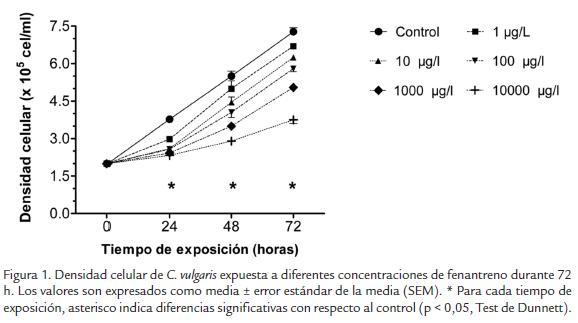
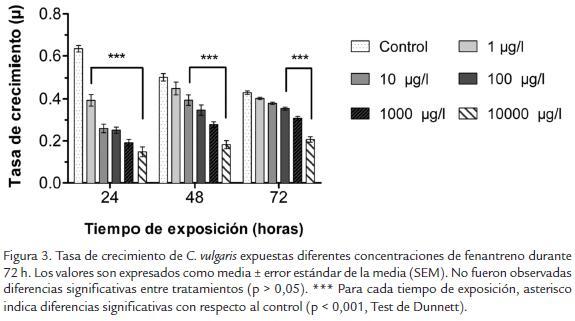
En la figura 1 se ilustra el efecto del fenantreno sobre la densidad celular a lo largo de las 72 h de exposición. A partir de las 24 h de exposición, todas las concentraciones de fenantreno presentaron una densidad celular significativamente menor que el grupo control (p < 0,05). El tratamiento control presentó las mayores densidades con valores de 3,8 x 105 ± 5833; 5,5x 105 ± 20069 y 7,3 x 105 ± 16436 cel/ml a las 24, 48 y 72 h de exposición, respectivamente, seguido de las concentraciones de fenantreno de 1 y 10 µg/l con valores entre los 2,7 y 6,7 x 105 cel/ml. Por otro lado, la concentración de 10000 µg/l, fue el tratamiento que presentó la menor tasa de crecimiento durante el ensayo, con densidades de 2,3 x 105 ± 5336; 2,9 x 105 ± 11304 y 3,8 x 105 ± 15366 cel/ ml a las 24, 48 y 72 h de exposición, respectivamente.
CONCENTRACIÓN DE CLOROFILA a
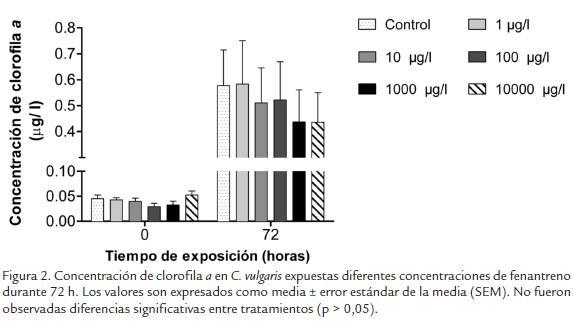
La concentración de clorofila a no se afectó por efecto de las diferentes concentraciones de fenantreno (Fig. 2). Aunque por tratamiento se observaron diferencias significativas entre las 0 y 72 h de exposición (p < 0,05), para una misma hora no se presentaron diferencias significativas entre los tratamientos evaluados (p > 0,05). A las 72 h, los valores de mayor y menor contenido de clorofila a se presentaron en las concentraciones de 1 µg/l y 1000 µg/l con valores promedios de 1,05 ± 0,14 µg/l y 0,74 ± 0,15 µg/l, respectivamente, aunque sin diferencias significativas. Por su parte, cuando la concentración de clorofila a fue expresada en pg/célula no se observaron diferencias significativas entre tratamientos ni entre horas con valores de 2,02x10-4 ± 1,7 x10-5 y 9,19x10-4 ± 7,1 x10-5pg clorofila/célula a las 0 y 72 h, respectivamente.
VARIABLES DE CRECIMIENTO EVALUADAS
Para calcular las variables de crecimiento se tuvo en cuenta la densidad inicial a las cero horas, la cual tuvo una densidad 200,000 cel/ml en todos los tratamientos. En la figura 3 se muestra una progresiva disminución en el crecimiento de C. vulgaris en todos los tratamientos a lo largo del tiempo. Las algas expuestas a fenantreno presentaron una reducción significativa del crecimiento con respecto al control a las 24 h de exposición (reducción mayor al 38 %, p <0,05). El crecimiento de las algas expuestas a 1 µg/l de fenantreno fue similar al control después de 48 h de exposición (p >0,05). Después de las 72 h de exposición, las algas expuestas a 100, 1000 y 1000 µg/l presentaron una tasa de crecimiento significativamente menor con respecto al control (reducción mayor al 18 %, p <0,05).
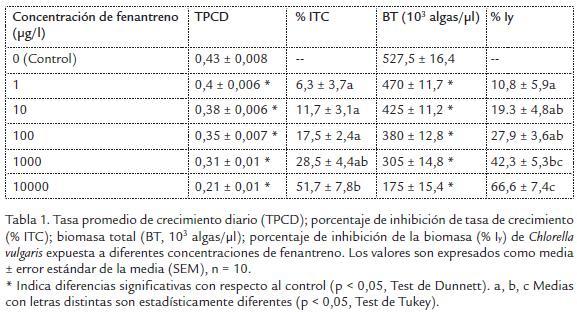
Los resultados de crecimiento e inhibición algal en C. vulgaris expuestas a fenantreno son mostradas en la Tabla 1. Las tasas de crecimiento diario y la biomasa total fueron menores en las algas expuestas a las cinco concentraciones de fenantreno cuando com parado con el control (p < 0,05, Tabla 1). La concentración de 1000 y 10000 µg/l afec taron drásticamente el crecimiento algal, con una inhibición del crecimiento e inhibición de la biomasa mayor al 29 % y 42 %, respectivamente (p < 0,05). El porcentaje de inhi bición se incrementó a medida que aumentó la concentración de fenantreno en el medio de cultivo (Tabla 1). Los resultados de las concentraciones efectivas para este ensayo fueron CE20 de 2587 µg/l y la CE50 de 11004 µg/l.
DISCUSIÓN
El presente estudio demostró que fenantreno, un HAPs incluido en la lista de compuestos tóxicos prioritarios, genera un efecto tóxico en C. vulgaris durante exposiciones agudas con significativas alteraciones en la densidad celular, la biomasa y las tasas de crecimiento. Los HPAs son compuestos altamente estables en la naturaleza, conservando sus propiedades tóxicas, pudiendo ser retenido fácilmente por adsorción a materiales particulados inertes o absorbido por organismos vivos, siendo por lo tanto clasificados por la US EPA y por la Agency for Toxic Substances and Disease Registry (USA) como sustancias que presentan un alto riesgo para la salud humana y animal. Aunque los HAPs se encuentran como mezclas complejas, conocer los efectos de manera individual a diversos niveles es importante para entender su dinámica y comportamiento en el ambiente (ATSDR, 1995). Los efectos tóxicos de los hidrocarburos derivados del petróleo sobre el fitoplancton son generalmente determinados comparando las tasas de crecimiento y la actividad fotosintética de cultivos del fitoplancton expuestos a dichos hidrocarburos (Cortez-Mago et al., 2007). Los resultados del presente estudio mostraron una disminución en la biomasa y la tasa de crecimiento en las algas expuestas a las cinco concentraciones de fenantreno, siendo mayor el efecto negativo a medida que la concentración de fenantreno aumentó. Estos resultados son similares a los reportados por Qingxia et al. (2010), quienes evaluaron la toxicidad del HAPs naftaleno sobre la microalga marina C. vulgaris, a concentraciones de 5, 10, 50 y 100 mg/l en diferentes medios de cultivo con N y P y cuyos resultados mostraron una relación negativa entre la tasa de crecimiento y la concentración del hidrocarburo. Igualmente, se han reportado efectos negativos de los hidrocarburos sobre la tasa de crecimiento de Prochlorococcus marina, Synechococcus sp., Micromonas pusilla, Chlorella sp., Phaeodactylum tricornutum y Thalassiosira sp., expuestas a diferentes concentraciones de pireno y fenantreno (5, 10, 50, 100, 500 y 1000 µg/l), con una disminución en la tasa de crecimiento más acentuada a medida que aumentó la concentración de los hidrocarburos, hallazgos similares a lo observado en el presente estudio con fenantreno (Echeveste et al., 2010). Adicionalmente, estos autores reportaron que el tamaño de las algas afecta la respuesta a sustancias tóxicas, siendo las algas más pequeñas las más sensibles, mientras que algas de mayor tamaño como Chlorella sp., M. pusilla y P. tricornutum, presentaron efectos leves en sus poblaciones.
De igual manera, Pokora y Tukaj (2010), evaluaron los efectos de 0,25 mg/l de antraceno por un tiempo de exposición de 24 h en tres especies de Desmodesmus (D. microspina, D. subspicatus y D. obliquus), observando una disminución en la tasa de crecimiento en las tres especies a partir de la sexta hora. Esta disminución en la tasa de crecimiento junto con alteraciones en la tasa fotosintética se deben a que los hidrocarburos producen daños en la capa lipofílica de la membrana celular, afectando su capacidad para controlar adecuadamente el transporte de iones dentro y fuera de la célula (Vila, 2003). Las algas fijan eficientemente nitrógeno y carbono, compuestos íntimamente relacionados con el metabolismo oxiradical, por tanto, la producción de especies reactivas de oxígeno en estos organismos fotosintéticos es parte fundamental de su sobrevivencia (Torres et al., 2008). Sumado a esto, el flujo de oxígeno y de iones en las mitocondrias y los cloroplastos es muy alto, lo que conlleva a que estas estructuras sean blanco potencial de estrés oxidativo (Torres et al., 2008). Aunque en el presente estudio no se determinaron marcadores de estrés oxidativo, es posible que las concentraciones de fenantreno utilizadas hayan inducido un tipo de respuesta similar, reflejándose en la reducción de densidad celular, inhibición de biomasa y tasa de crecimiento a medida que la concentración de fenantreno aumentó. Estudios en plantas han demostrado que los HAPs son capaces de inducir la actividad de enzimas como superoxido dismutasa, catalasa, peroxidasa así como peroxidación lipídica y alteraciones de las vías metabólicas que regulan las especies reactivas de oxígeno (ROS), lo que conllevaría a alteraciones en el sistema metabólico algal y por tanto efectos negativos sobre el crecimiento y la integridad celular (Liu et al., 2009; Weisman et al., 2010).
En el presente estudio la cantidad de clorofila a no se vio afectada por las diferentes concentraciones de fenantreno, a pesar que se observó una tendencia a disminuir con la mayor concentración. Contrario a lo observado en el presente estudio, se ha reportado una disminución de la cantidad de clorofila a cuando algas eucarióticas (Scenedesmus y Dunaliella tertiolecta) fueron expuestas a hidrocarburos (Guerra Martínez et al., 2004). Este corresponde a uno de los primeros estudios en reportar la concentración efectiva de fenantreno en C. vulgaris. Investigaciones previas con esta alga reportan una CL50 de 2060 µg/l de pireno, una concentración menor a la observada en el presente estudio (CE50 11004 µg/l), esta diferencia puede estar asociada al mayor número de anillos aromáticos que tiene el pireno y por tanto su toxicidad podría ser mayor que la del fenantreno (Echeveste et al., 2010). Por otro lado, en algas pequeñas como P. marina y Synechococcus sp. se ha reportado una CL50 muy por debajo de la observada en el presente estudio (77 y 40 µg/l, respectivamente), cuya sensibilidad está asociada a su reducido tamaño celular (Echeveste et al., 2010). Aunque la CE20 y CE50 de fenantreno en este estudio fueron relativamente altas, los resultados indican que por encima de la concentración de 1 µg/l se observan efectos negativos sobre el crecimiento en C. vulgaris. Los resultados de la presente investigación demuestran que el crecimiento de la microalga C. vulgaris puede ser afectado negativamente por la exposición a concentraciones nominales mayores a 1 µg/l del hidrocarburo policíclico aromático fenantreno, una concentración cercana a la detectada en aguas de producción asociada a la extracción petrolera.
AGRADECIMIENTOS
El presente trabajo fue financiado por el Instituto Colombiano de Petróleo ICPEcopetrol S.A. y la Universidad de los Llanos (contrato n.º 008/08). Los autores agradecen al Grupo de Investigación sobre Reproducción y Toxicología de Organismos Acuáticos del Instituto de Acuicultura de la Universidad de los Llanos por el apoyo logístico ofrecido para la realización de los bioensayos.
BIBLIOGRAFÍA
AGUILAR-LEÓN D, OTERO-PATERNINA AM, CRUZCASALLAS PE, VELASCO-SANTAMARÍA YM. Scenedesmus sp.: microalga bioindicadora de toxicidad de efluentes de una campo petrolero en la Orinoquia colombiana. Universidad de los Llanos. En: XVI Jornada de Acuicultura. Villavicencio, Colombia; 2010. p. 14-18.
ATSDR. Agency for Toxic Substances and Disease Registry, USA. Public Health Statement for Polycyclic Aromatic Hydrocarbons (PAHs). 1995. [Citado, diciembre 10 de 2012] Disponible en: URL: http://www.atsdr.cdc.gov/phs/phs.asp?id=120&tid=25.
CANETR, BIRNSTINGL JG, MALCOLM DG, LOPEZ JM, BECK AJ. Biodegradation of polycyclic aromatic hydrocarbons (PAHs) by native microflora and combinations of white-rot fungi in a coal-tar contaminated soil. Bioresour Technol. 2001;76(2):113-117.
CORTEZ-MAGO R, GUEVARA M, VÁSQUEZ A, LLODEIROS-SEIJO C. Influencia del petróleo crudo en el crecimiento de microalgas del nororiente de Venezuela. Boletín del Centro de Investigaciones Biológicas. Universidad del Zulia, Maracaibo, Venezuela. 2007;41(4):471-483.
ECHEVESTE P, AGUSTÍ S, DACHS J. Cell size dependent toxicity thresholds of polycyclic aromatic hydrocarbons to natural and cultured phytoplankton populations. Environ Pollut. 2010;158(1):299-307.
GELBOIN HV. Benzo[a] pyrene metabolism, activation, and carcinogenesis: role and regulation of mixed-function oxidases and related enzymes.Physiol Rev. 1980;60(4):1107-1167.
GÓMEZ LM, RAMÍREZ Z. Microalgas como biomonitores de contaminación. Rev Cubana Quím. 2004;XVI(2):34-48.
GUERRA-MARTÍNEZ S, MARTÍNEZ E, RÍOS E, OLVERA R. Efecto tóxico del petróleo crudo sobre Dunaliella tertiolecta. En: I Congreso Latinoamericano sobre Biotecnología Algal. Universidad de Buenos Aires. Buenos Aires, Argentina; 2004. p. 89.
HENKLER F, STOLPMANN K, LUCH A. Exposure to Polycyclic Aromatic Hydrocarbons: Bulky DNA Adducts and Cellular Responses. En: Luch, A, Editor. Molecular, Clinical and Environmental Toxicology. Springer Basel; 2012. p. 107-131.
HYLLAND K. Polycyclic aromatic hydrocarbon (PAH).Ecotoxicology in marine ecosystems. J Toxicol Environ Health Part A. 2006;69(1-2):109-123.
IDEAM (Instituto de Hidrología Meteorología y Estudios Ambientales) [Online]. Colombia. Ministerio de Ambiente Vivienda y Desarrollo Territorial. [Citado, junio 01 de 2010]. Disponible en: URL: http://institucional.ideam.gov.co/jsp/index.jsf.
KONG Q, ZHUA L, SHENA X. The toxicity of naphthalene to marine Chlorella vulgaris under different nutrient conditions. J Hazard Mater. 2010;178(1-3):282-286.
LEHR RE, JERINA DM. Metabolic activations of polycyclic hydrocarbons. Arch Toxicol. 1977;39(1-2):1-6.
LIU H, WEISMAN D, YE Y.-B, CUI B, HUANG Y.-H, COLÓN A, WANG Z.-H. An oxidative stress response to polycyclic aromatic hydrocarbon exposure is rapid and complex in Arabidopsis thaliana. Plant Sci. 2009;176(3):375-382.
MA J, LIN F, ZHANG R, YU W, LU N. Differential sensitivity of two green algae, Scenedesmus quadricauda and Chlorella vulgaris to 14 pesticides adjuvants. Ecotoxicol Environ Saf. 2004;58(1):61-67.
MUÑOZ-PEÑUELA M, RAMÍREZ-MERLANO JA, MEDINA-ROBLES VM, CRUZ-CASALLAS PE, VELASCO-SANTAMARÍA YM. Efecto del medio de cultivo sobre el crecimiento y el contenido proteico de Chlorella vulgaris. Rev Col Cienc Pec. 2012;25(3):438-449.
NARRO ML, CERNIGLIA CE, VAN BAALEN C, GIBSON DT. Metabolism of phenanthrene by the marine cyanobacterium Agmenellum quadruplicatum PR-6. Appl Microbiol Biotechnol. 1992;58(4):1351-1359.
NIZETTO L, LOHMANN R, GIOIA R, JAHNKE A, TEMME C, DACHS J, HERCKES P, et al. PAHs in air and seawater along a north south Atlantic transect: trends, processes and possible sources. Environ Sci Technol. 2008;42(5):1580-1585.
PELKONEN O, NEBERT D.W. Metabolism of polycyclic hydrocarbon: etiologic role in carcinogenesis. Pharmacol Rev. 1982;34(2):189-222.
OECD. Organization for Economic Cooperation and Development. Freshwater alga and cyanobacteria Growth Inhibition Test. Guidelines for the testing of chemicals. 2011. p. 201.
OECD. Organization for Economic Co-operation and Development. Daphnia magna Reproduction Test. Guidelines for testing of chemicals. 1998. p. 211.
ORLI SKI R. Multipoint moss passive samplers assessment of urban airborne polycyclic aromatic hydrocarbons: concentrations profile and distribution along Warsaw main streets. Chemosphere. 2002;48(2):181-186.
POKORA W, TUKAJ Z. The combined effect of anthracene and cadmium on photosynthetic activity of three Desmodesmus (Chlorophyta) species. Ecotoxicol Environ Saf. 2010;73(3):1207-1213.
REYNAUD S, DESCHAUX P. The effects of polycyclic aromatic hydrocarbons on the immune system of fish: A review. Aquat Toxicol. 2006;77(2):229-238.
QINGXIA K, LIZHONG Z, XUEYOU S. The toxicity of naphthalene to marine Chlorella vulgaris under different nutrient conditions. J Hazard Mater. 2010;178(1-3):282-286.
SHIMADA H, OGINUMA M, HARA A, IMAMURA Y. 9,10-Phenanthrenequinone, a component of diesel exhaust particles, inhibits the reduction of 4-benzoylpyridine and all-trans-retinal and mediates superoxide formation through its redox cycling in pig heart. Chem Res Toxicol. 2004;17(8):1145-1150.
SIPÁUBA - TAVARES L, ROCHA O. Produção de plâncton (Fitoplâncton e Zooplâncton) para alimentação de organismos aquáticos. São Carlos, RIMA; 2003. p. 45.
STRICKLAND JHD, PARSONS TR. A practical handbook of seawater analysis. Bull Fish Res. 1972;167:189-190.
TANG L, TANG XY, ZHU YG, ZHENG MH, MIAO QL. Contamination of polycyclic aromatic hydrocarbons (PAHs) in urban soils in Beijing, China. Environ Int. 2005;31(6):822-828.
TORRES MA, BARROS MP, CAMPOS SCG, PINTO E, RAJAMANI S, SAYRE RT, COLEPICOLO P. Biochemical biomarkers in algae and marine pollution: A review. Ecotoxicol Environ Saf. 2008;71(1):1-15.
VILA M. Efectos das mareas negras en organismos e comunicades vexetais. Asociación de Ensinantes de Ciencias de Galicia. 2003;52:103-118.
WANG L, ZHENG B. Toxic effects of fluoranthene and copper on marine diatom Phaeodactylum tricornutum. J Environ Sci. 2008;20(11):1363-1372.
WEISMAN D, ALKIO M, COLÓNCARMONA A. Transcriptional responses to polycyclic aromatic hydrocarboninduced stress in Arabidopsis thaliana reveal the involvement of hormone and defense signaling pathways. BMC Plant Biol. 2010;10:59.
YU F, GE F, ZHOU W, TAO N, LIANG Z, ZHU L. Subcellular distribution of fluoranthene in Chlorella vulgaris with the presence of cetyltrimethylammonium chloride. Chemosphere. 2013;90(3):929-935.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2013 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).