Evaluación de un sistema de regeneración por embriogénesis somática de Neem (Azadirachta indica)
Evaluation of a somatic embryogenesis regenetation system for Neem (Azadirachta indica)
DOI:
https://doi.org/10.15446/abc.v21n3.52626Palabras clave:
cotiledones, embriogénesis somática secundaria, hoja. (es)cotyledon, leaf, secondary somatic embryogenesis. (en)
Descargas
Azadirachta indica, también conocida como neem, es una especie arbórea leñosa perteneciente a la familia Meliaceae, de gran importancia en diversas disciplinas científicas, tales como la forestal y la médico-farmacéutica. Se estableció un método para la propagación in vitro de esta planta, evaluándose como explantes, secciones foliares de vitro-plantas, cotiledones y esquejes. Se emplearon medios semisólidos con combinaciones variables de la citocinina 6-benzylaminopurina (BAP) y las auxinas ácido 2,4-diclorofenoxiacético (2,4-D) y ácido indolacético (AIA). Se observó la formación de callo regenerativo, a partir del cual se generó embriogénesis somática primaria y secundaria, mediante los reguladores de crecimiento BAP (1,0 mg.L-1) y 2,4-D (0,2 mg.L-1), mientras que la formación de callo no regenerativo fue promovida por concentraciones mayores a 0,3 mg.L-1 de 2,4-D. De los explantes evaluados, la mayor frecuencia de regeneración de plantas (~67 %) se presentó con secciones cotiledonares.
Azadirachta indica, also known as neem, is a woody tree species belonging to the Meliaceae family, of great importance in various scientific disciplines, such as forestry, medicinal and pharmacist. It was established a method for in vitro propagation of this plant, evaluating explants as leaf sections of vitro-plants, cotyledons and stem cuttings, using semi-solid medium with various combinations of cytokinin 6-benzylaminopurine (BAP) and auxins 2,4-dicholorophenoxyacetic acid (2,4-D) and indol-3-acetic acid (IAA). Regenerative callus formation was observed, from which primary and secondary somatic embryogenesis was generated by growth regulators BAP (1.0 mg.L-1) and 2,4-D (0.2 mg.L-1), whereas non-regenerative callus formation was promoted by concentrations higher than 0,3 mg.L-1 of 2,4-D. Between the used explants, the highest frequency of plant regeneration (~ 67%) presented from cotyledon sections.
DOI: https://doi.org/10.15446/abc.v21n3.52626
EVALUACIÓN DE UN SISTEMA DE REGENERACIÓN POR EMBRIOGÉNESIS SOMÁTICA DE NEEM (Azadirachta indica)
Evaluation of a Somatic Embryogenesis Regenetation System for Neem (Azadirachta indica)
Rafael FERNÁNDEZ DA SILVA1; Adrian VILLARROEL1; Liaska CUAMO1; Vincenzo STORACI1.
1 Centro de Biotecnología aplicada (CBA), Departamento de Biología, Facultad Experimental de Ciencias y Tecnología (Facyt), Universidad de Carabobo. Valencia, Venezuela.
For correspondence. rafaelfer2103@hotmail.com
Received: 31st October 2015, Returned for revision: 22nd February 2016, Accepted: 31st March 2016.
Associate Editor: Xavier Marquinex Casas.
Citation/Citar este artículo como: Fernández Da Silva R, Villarroel A, Cuamo L, Storaci V.Evaluación de un sistema de regeneración por embriogénesis somática de Neem (Azadirachta indica). Acta biol. Colomb. 2016;21(3):581-592. DOI: https://doi.org/10.15446/abc.v21n3.52626
RESUMEN
Azadirachta indica, también conocida como neem, es una especie arbórea leñosa perteneciente a la familia Meliaceae, de gran importancia en diversas disciplinas científicas, tales como la forestal y la médico-farmacéutica. Se estableció un método para la propagación in vitro de esta planta, evaluándose como explantes, secciones foliares de vitro-plantas, cotiledones y esquejes. Se emplearon medios semisólidos con combinaciones variables de la citocinina 6-benzylaminopurina (BAP) y las auxinas ácido 2,4-diclorofenoxiacético (2,4-D) y ácido indolacético (AIA). Se observó la formación de callo regenerativo, a partir del cual se generó embriogénesis somática primaria y secundaria, mediante los reguladores de crecimiento BAP (1,0 mg.L-1) y 2,4-D (0,2 mg.L-1), mientras que la formación de callo no regenerativo fue promovida por concentraciones mayores a 0,3 mg.L-1 de 2,4-D. De los explantes evaluados, la mayor frecuencia de regeneración de plantas (~67 %) se presentó con secciones cotiledonares.
Palabras clave: cotiledones, embriogénesis somática secundaria, hoja.
ABSTRACT
Azadirachta indica, also known as neem, is a woody tree species belonging to the Meliaceae family, of great importance in various scientific disciplines, such as forestry, medicinal and pharmacist. It was established a method for in vitro propagation of this plant, evaluating explants as leaf sections of vitro-plants, cotyledons and stem cuttings, using semi-solid medium with various combinations of cytokinin 6-benzylaminopurine (BAP) and auxins 2,4-dicholorophenoxyacetic acid (2,4-D) and indol-3-acetic acid (IAA). Regenerative callus formation was observed, from which primary and secondary somatic embryogenesis was generated by growth regulators BAP (1.0 mg.L-1) and 2,4-D (0.2 mg.L-1), whereas non-regenerative callus formation was promoted by concentrations higher than 0,3 mg.L-1 of 2,4-D. Between the used explants, the highest frequency of plant regeneration (~ 67%) presented from cotyledon sections.
Keywords: cotyledon, leaf, secondary somatic embryogenesis.
INTRODUCCIÓN
Azadirachta indica A. Juss., también conocido como "Nim", "Neem", "Margosa", o "árbol del paraíso", es un árbol de la familia Meliaceae, de origen Asiático, que crece en las regiones más secas del sur de la India y de Myanmar (Parrotta y Chaturvedi, 1994), siendo introducida en Venezuela para programas de reforestación de zonas áridas, uso ornamental, como repelente de plagas y como alimento de animales de forrajeo (Urdaneta, 2001; Reyes et al., 2003). Asimismo, es un árbol muy versátil en el ámbito medicinal, siendo empleada en el tratamiento de distintas enfermedades (Allan et al., 1994), por sus propiedades antivirales y antimicrobianas (Kintzios, 2006; Rajasekaran et al., 2008; Sunday y Atawodi, 2009); también se emplea para producción de abonos, insecticidas y fungicidas (Meisner et al., 1981; Pai et al., 2004; Trujillo et al., 2008). Su propagación se realiza a través de esquejes o, mayormente, de plántulas obtenidas por germinación de semillas, las cuales son recalcitrantes, presentando rápidas pérdidas de viabilidad durante el almacenamiento. Los métodos de cultivo de tejidos permiten propagar masivamente esta especie empleando diversos tipos de explantes (Su et al., 1997; Zypman et al., 2001; Chaturvedi et al., 2004; Gairi y Rashid, 2005a; Gairi y Rashid, 2005b). Este trabajo tuvo como objetivo evaluar el proceso de propagación por embriogénesis somática de A. indica a partir de los resultados obtenidos y publicados previamente (Artigas y Fernández, 2015) a fin de seleccionar el tipo de explante apropiado y el medio de cultivo con mayor frecuencia regenerativa.
MATERIALES Y MÉTODOS
Explantes
Se obtuvieron deplantas adultas de diez años de A. indica, ubicadas en el Campus de la Universidad de Carabobo, Venezuela. Se seleccionaron esquejes de 4 cm de las ramas jóvenes de la parte apical de la copa, secciones cotiledonares extraídas de frutos inmaduros (30 días post antesis; a los cuales se les retiró el epicarpio, mesocarpio y endocarpio) y secciones foliares sin nervadura de vitro-plantas (obtenidas de la germinación in vitro de semillas).
Desinfección de explantes
Las semillas extraídas de frutos y los esquejes fueron lavados con jabón líquido comercial disuelto agua estéril por dos minutos y posteriormente con alcohol isopropílico al 70 % durante 30 segundos. Se enjuagaron con agua estéril y desinfectaron con hipoclorito de sodio (Cloro comercial) al 20 % y Tween 20 (1 gota 10 mL -1) durante cinco minutos. Se realizaron cuatro lavados con agua destilada estéril (1 min c/u), seguidos de un último lavado con solución estéril de cisteína al 1%, con el objeto de minimizar la oxidación de los explantes.
Diseño experimental
Se utilizó un diseño completamente aleatorizado con 20 réplicas por tratamiento (tres repeticiones), para los tres tipos de explantes utilizados. Cada unidad experimental fue inoculada con tres secciones según el tipo de explante: en frascos para secciones cotiledonares y de esquejes, y en placas de Petri para las secciones foliares.
Condiciones de incubación y regeneración
Durante la etapa de inducción los cultivos se mantuvieron en oscuridad continua un mes, entre 25 y 30 °C, y entre 40 y 60 % de humedad relativa. En la etapa de regeneración se mantuvieron bajo el mismo régimen térmico y de humedad, con un fotoperíodo de 16 h luz y ochos horas de oscuridad.
Medios de cultivo
Se emplearon las sales de Murashige y Skoog (1962; MS), suplementadas con las vitaminas tiamina-HCl (1 mg.L-1), piridoxina (0,5 mg.L-1) y el aminoácido glicina (2 mg.L-1), se utilizó cisteína-L como agente anti-oxidante (100 mg.L-1), sacarosa al 3 % como fuente de carbono y Agar Powder (Sigma) al 1,8 % como agente gelificante.El pH de los medios se ajustó a 5,8, y se esterilizaron mediante autoclave a 121 °C y 15 Lb pulg-2 durante 25 min. Para la inducción, se evaluó la formación de callos en los distintos explantes, utilizando como reguladores de crecimiento, la citocinina bencilaminopurina (BAP) en combinación con las auxinas ácido indolacético (AIA) o ácido 2,4-diclorofenoxiacético (2,4-D), en las concentraciones indicadas en la Tabla 1, tomando como referencia las concentraciones usadas por Chaturvedi et al. (2004) y Rafiq y Dahot (2010). Mientras que para la fase de regeneración, los callos se repicaron en el medio antes descrito con solo 0,5 mg.L-1 de BAP como regulador de crecimiento.
Evaluación del proceso de inducción
Se realizóluego de cuatro semanas de iniciado el cultivo, para ello, se calculó la frecuencia de inducción de callos totales (Ct), callos no regenerativos (CNE), callos regenerativos (CR) y plantas regeneradas (PR) para todos los explantes, siguiendo las fórmulas planteadas por Zaidi et al. (2006): Callo total (Ct): número de callos * número de explantes -1; Callo no regenerativo (CNR): número de callos no regenerativos * número de explantes -1; callo regenerativo (CR): número de callos regenerativos * número de explantes -1; Plantas regeneradas (PR): número de plantas regeneradas * número de callos regenerativos -1.
Evaluación del proceso de regeneración
Los callos provenientes de la fase anterior se repicaron en el medio previamente descrito con solo 0,5 mg.L-1 de BAP como regulador de crecimiento. Cuatro semanas después se evaluó la frecuencia de inducción de callos totales (Ct), callos no regenerativos (CNE), callos regenerativos (CR) y plantas regeneradas (PR) siguiendo las fórmulas planteadas por Zaidi et al. (2006).
Caracterización morfoanatómica
Se realizaron análisis morfológicos e histológicos a las muestras (callos regenerativos y no regenerativos, brotes y embriones somáticos) las cuales fueron fijadas en FAA (formaldehído, ácido acético y etanol 10 %:50 %:5 %) al 50 %, deshidratadas en una batería de alcoholes con cambios cada hora (10 %, 30 %, 50 %, 70 %, 90 % y 100 %) y aclarado de las muestras en xilol al 100 % durante tres horas. Transcurrido este tiempo se colocaron en parafina sintética "Paraplast" fundida a 63 °C durante 24 horas, Las muestras se colocaron en bandejas de corte a 4 °C generando bloques que fueron cortados con un micrótomo de rotación automático Leica RM2265. Los micropreparados con secciones de 10 μm de grosor, fueron sometidas nuevamente a tres cambios de xilol al 100 % (cinco minutos cada uno) y dos cambios de alcohol al 100 % (tres minutos cada uno). Por último fueron teñidos empleando la coloración mixta de hematoxilina-eosina de preparación instantánea para lo cual se coloreó primero con las muestras durante cinco minutos con hematoxilina, seguida de un lavado en agua destilada, luego se le agregó alcohol acidificado (una gota de HCl concentrado en 30 mL de alcohol al 100 %) por unos segundos seguido de otro lavado con agua destilada. Luego se le agregó eosina durante 30 segundos retirando el excedente de dicho colorante con agua destilada. El montaje realizado fue semi permanente, sellando los cortes con gelatina glicerina. Para el registro fotográfico de las estructuras formadas en distintas etapas del cultivo se empleó un microscopio estereoscópico Leica MZ75 y para el estudio anatómico se empleó un microscopio compuesto Leica DM1000.
Análisis estadístico
Se realizaron análisis de las variables Ct, CNR, CR y PR, para cada explante; se aplicó una ANOVA simple y una prueba a posteriori de comparación de medias de Tukey (5 % de confianza) en la evaluación de la diferencia del efecto de los distintos medios, las distintas condiciones aplicadas y el tipo de explante, utilizando el programa de análisis estadístico PAST (Hammer et al., 2001).
RESULTADOS
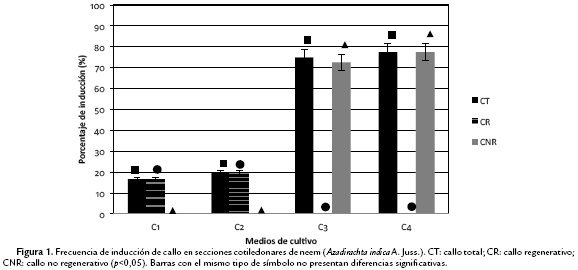
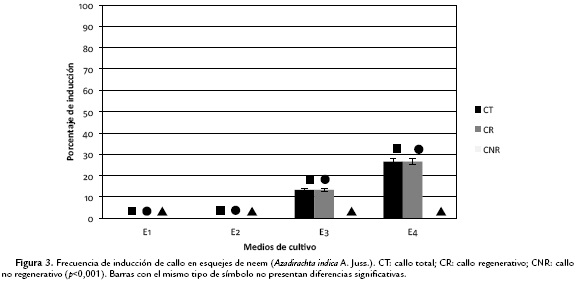
Las frecuencias de inducción de callo total a partir de cotiledones (Ct) osciló entre 16 y 75 %, con una frecuencia de callo regenerativo (CR) entre 0 y 20 % y de no regenerativo (CNR) fluctuando entre 0 y 78 % (Fig. 1). En cuanto a las secciones foliares de vitro-plantas se apreció una frecuencia de formación de callo total entre 23 y 78 %, evidenciándose también la formación de callos regenerativos con frecuencias entre 23 y 77 % y de callos no regenerativos con frecuencias entre 0 y 10 % (Fig. 2). Para los esquejes se encontró una frecuencia de formación de callo total entre 0 y 26 % siendo éste solo del tipo regenerativo, el cual fue el más bajo en comparación a los otros explantes ensayados (Fig. 3).
En relación a la formación de callo, según los análisis morfoanatómicos, se encontró que los explantes podían seguir dos vías principales de desarrollo: organogénesis y embriogénesis somática. Se observó el desarrollo de callo regenerativo de tipo embriogénico (CE), de forma compacta y de coloración verdosa en la superficie de los bordes de las secciones cotiledonares (Fig. 4A), de hoja (Fig. 4B) y de esquejes (Fig. 4C), así como callo no embriogénico (CNE), de apariencia friable, de color marrón opaco (Figura 4D). Del callo embriogénico se diferenciaron embriones somáticos de distintos estadios, hasta llegar a la etapa de germinación (Fig. 4E-F). Otro tipo de callo regenerativo observado, fue el caulogénico, de coloración verdosa en el caso del cotiledón, o blanca en el caso de las secciones foliares, caracterizado por presentar estructuras primarias similares a hojas, denominadas primordios foliares o brotes (Fig. 4G). El callo CNE se caracterizó por presentar células grandes laxamente distribuidas en la masa del callo, de forma irregular con poca densidad citoplasmática (Fig. 4H), mientras que el callo CE presento células isodiamétricas, pequeñas y densas en citoplasma (Fig. 4I). A partir del callo CE, caracterizado por presentar grandes masas proembriogénicas, se diferenciaron de manera indirecta en segmentos cotiledonares y foliares, embriones somáticos, ya sea en grupo (Fig. 4J) o individual de forma fusionada (Fig. 4K) o aislada (Fig. 4L).
Con respecto al proceso regenerativo de plantas, se encontraron respuestas variadas según el tipo de explante empleado, oscilando entre 0 y 66 % de aparición. Las mejores respuestas se obtuvieron a partir de cotiledones, con frecuencias entre 43 y 66 %, seguidos por las secciones foliares de vitro-plantas con frecuencias de 22 a 27 %. Bajo nuestras condiciones experimentales no fue posible regenerar plantas a partir de callos provenientes de esquejes, debido a que dicho explante no presentó formación de embriones somáticos o brotes (Fig. 5). En la mayoría de los casos se observó el desarrollo de plantas a partir de la germinación de embriones somáticos diferenciados en el callo embriogénico desarrollado tanto en explantes foliares como cotiledonares (Fig. 6A-6D).
DISCUSIÓN
Proceso de inducción de callo
Se evaluó un sistema de regeneración in vitro de A. indica empleando diversos explantes, tales como cotiledones, esquejes de plantas maduras y secciones foliares de vitro-plantas. Se observaron en cada uno respuestas distintas según el medio en el cual se establecieron los cultivos. Si bien se observó una gran variabilidad en la frecuencia de formación de callo en los medios evaluados para cotiledones, solo aquellos con combinaciones relativamente bajas en la concentración de BAP y 2,4-D presentaron procesos de embriogénesis somática y organogénesis, llegando a diferenciarse embriones somáticos y brotes. En este sentido, Ranjan (2005) indica que el empleo de citocininas como BAP en combinación con 2,4-D potencian la formación de callos en cotiledones de A. indica, sin embargo, señala que una vez inducida la callogénesis es necesario el cambio de los mismos a medios con concentraciones menores de estos reguladores de crecimiento con el fin de inducir en los explantes procesos de embriogénesis somática, así mismo señala que aquellos callos repicados a medios con altas concentraciones de citocininas (1,5 a 2,4 mg.L-1) responden con la formación de callo no regenerativo. Otros autores indican que el empleo de bajas concentraciones auxinas como reguladores de crecimiento promueve procesos de formación de callos regenerativos de tipo organogénicos, con desarrollo de raíces y que altas concentraciones de estos reguladores, promueven la formación de callo no regenerativo (Su et al., 1997; Kota et al., 2006; Vila et al., 2009; Das, 2011).
Al contrastar las frecuencias de inducción de callo por explante, obtenidas en este trabajo en A. indica, con las indicadas en otras meliáceas, encontramos resultados similares. Así en secciones foliares, Vila et al. (2003) describen un 45 % de callos caulogénicos al emplear 1 mg.L-1 de BAP con 0.1 mg.L-1 de cinetina y 3.5 mg.L-1 de Sulfato de adenina en Melia azederach, de igual manera, Da Rocha y Quoirin (2004) para este tipo de callo señalan 90 % de caulogénesis al utilizar 1 mg.L-1 de BAP con 1 mg.L-1 ANA en Swietenia macrophylla, asimismo, You et al. (2011) en Cyclamen persicum indican el mismo valor para este tipo de callo con 2 mg.L-1 de 2,4-D y 0.2 mg.L-1 de BAP. Mientras que la formación de callo embriogénico oscila entre 37.5-44.5 % en Toona ciliata empleando solo la citocinina tidiazuron en concentraciones de 0.1-0.25 mg.L-1 (Daquinta et al., 2003; Daquinta et al., 2005). No obstante, De Oliveira et al. (2015) en Carapa guianensis plantean una elevada frecuencia caulogénica (sin indicar el porcentaje) empleando de 1-10 mg.L-1 de 2,-4-D con 1.1 mg.L-1 de BAP. En el caso de los cotiledones, el desarrollo de callos regenerativos que se describe en su mayoría es de tipo embriogénico, así, en el caso del callo caulogénico o con brotes, se induce entre un 87 y 100 % con 1.1 mg.L-1 de BAP y 1 mg.L-1 ANA en Cedrela fissilis (Nunes et al., 2002), mientras que el callo nodular compacto o embriogénico se desarrolla en un 80 % utilizando 3 mg.L-1 de 2,4-D con 3 mg.L-1 ANA en Melia azedarach (Deb, 2001) y con solo 0.05 a 1 mg.L-1 de tidiazuron en Melia volkensii (Mulanda et al., 2014; Mulanda et al., 2015), potenciándose el desarrollo de callo con embriones somáticos secundarios en un 68 % con 1.6 mg.L-1 de TDZ en Semecarpus anacardium (Panda y Hazea, 2012) o 61 % con 0.7 mg.L-1 de ANA en Sorbus pohuashanensis (Yang et al., 2012). Por último, en secciones nodales o esquejes se desarrollaron 85% de callos con brotes con solo 0.5 mg.L-1 de BAP en Melia dubia (Ram et al., 2014).
El alto nivel de formación de callo regenerativo registrado en secciones foliares es atribuido por diferentes autores a los niveles de auxinas presentes (AIA) en el medio, demostrando que, a niveles relativamente altos (0,5 a 1,5mg.L-1) se potencian los procesos de callogénesis y embriogénesis (Te-Chao y Rugnoi 2000; Giagnacovo et al., 2001; Daquinta et al., 2003; Daquinta et al., 2005). Shekhawat et al. (2009), señalan que el desarrollo del callo embriogénico en hojas puede ser conflictivo cuando hay combinaciones de auxinas como 2,4-D o AIA con citocininas como el BAP, demostrando que al tener concentraciones altas de ambos reguladores de crecimiento, la frecuencia de formación de este tipo de callo se ve mermada, esto puede explicar la disminución observada en el medio H4.
Del callo regenerativo producido por el explante tipo esqueje, se encontró únicamente callo embriogénico, sin desarrollo de embriones o brotes. Este tipo de procesos, según Chaicharoen et al. (1996), es variable e influenciado mayormente por el empleo de concentraciones mayores de citocininas en combinación con auxinas, sin embargo, diversos autores señalan tener mayores frecuencias de producción de callos al emplear citocininas como el tidiazurón (TDZ) en sustitución del BAP o el 2,4-D (Gairi y Rashid, 2005a; Gairi y Rashid, 2005b; Vila et al., 2009). Asimismo, la adquisición de la competencia embriogénica está determinada dinámicamente a nivel molecular, particularmente por la auxina, como el 2,4-D, que favorece fenómenos de hipermetilación en el ADN de dichas células a nivel de estadios tempranos embriogénicos (Karami y Saidi, 2010).
Un factor importante a tener en cuenta en el análisis de la frecuencia de inducción es que, luego de la siembra, una gran parte de los explantes resultaba contaminado por hongos, aún luego de haber pasado por un proceso de desinfección, este se desarrollaba desde el explante y luego se extendía al medio, volviendo inviable los cultivos, de tal manera que Parrotta y Chaturvedi (1994) señalan que este tipo de procesos puede ser debido a la contaminación endógena del explante, situación que viene dada por la condición ambiental y genética del mismo.
Los procesos de inducción pueden variar según el tipo de explante empleado, edad, condición del mismo y el genotipo que éste posea, estos factores son determinantes para la formación de callos regenerativos o no regenerativos, tal como lo señalan Chaturvedi et al. (2003) y Kota et al. (2006) para Actinia indica y Goralski et al. (2005) y Popielarska et al. (2006) para A. deliciosa, otra meliáceae. Así mismo, diversos autores indican que, en cotiledones de A. indica, la formación de masas celulares en la superficie del tejido es un requisito previo para la formación de callos regenerativos (Salvi et al., 2001; Chandra et al., 2010; Das, 2011; Artigas y Fernández, 2015).
Regeneración de plantas
Webster et al. (2006) y Shekhawat et al. (2009), señalan que en secciones foliares, la formación de callos embriogénicos es anticipada por el abultamiento del tejido y una consiguiente formación de células pequeñas al borde del explante, lo que facilita el contacto de las células con las sustancias reguladoras de crecimiento, y luego, en la periferia de estas células, se desarrollan embriones somáticos, proceso que fue observado de la misma manera en esta investigación. Pijut et al. (2012), indican también que la formación de callos en esquejes es dada por el abultamiento del tejido en contacto con el medio, seguido por la proliferación de células embriogénicas y de éstas la formación de embriones somáticos, así como también se pueden dar procesos de embriogénesis somática directa, sin embargo, en este estudio no se apreció la formación de embriones somáticos por parte de este tipo de explante.
Martínez et al. (2001), Gairi y Rashid (2005a), Gairi y Rashid (2005b) y Rodrigues (2009) en A. indica y Rai y McComb (2002) en Santalum album (otra meliácea), señalan que los procesos de embriogénesis somática directa, como los reportados anteriormente, son relativamente raros, no obstante, representan una alternativa ventajosa para los procesos de clonación, ya que, la formación de embriones somáticos directamente sobre el explante, minimiza los cambios genotípicos que se puedan dar por procesos indirectos.
Por otra parte, la obtención de callo no regenerativo es atribuida a factores hormonales, jugando un papel importante la concentración endógena de hormonas en los explantes y el equilibrio entre auxinas y citocininas en el medio (Te-Chao y Rungnoi, 2000; Das, 2011).
En líneas generales en cuanto a lo que regeneración se refiere, según el tipo de explante usado, el único tejido en presentar diferencias fue el esqueje por no lograr regenerar plantas en ninguno de sus tratamientos. En relación a esto, Chaturvedi et al. (2003), Rodrigues (2009), Srivastava et al. (2009), Vila et al. (2010), mencionan que en el caso de los cotiledones, la edad del explante condiciona la respuesta de los mismos y que la frecuencia de regeneración es mayor en cotiledones jóvenes o inmaduros ya que no crean asociación al embrión, sin embargo, señalan que la capacidad regenerativa de los mismos no varía en gran medida y que ésta siempre responde de manera positiva con frecuencias de regeneración satisfactorias (60 a 90 %), tal como lo reflejado en este trabajo, sin embargo, el porcentaje de regeneración de plantas está por debajo al reportado por Artigas y Fernández (2015) donde señalan una alta regeneración por embriogénesis somática primaria (96 %) y secundaria (71 %) utilizando secciones cotiledonares de A. indica. Esta respuesta regenerativa por embriogénesis somática primaria es similar a la reportada en otras meliáceas, tales como Melia azedarach con un 90,5 % (Deb, 2001) y Melia volkensii con un 100 % (Mulanda et al., 2014).
Varios autores (Chaturvedi et al., 2003; Thomas y Chaturvedi, 2008; Srivastava et al. 2009), señalan que para diversas familias vegetales leñosas, entre ellas las Meliáceas, presentan problemas en cuanto a los procesos regenerativos, específicamente en el desarrollo de callos regenerativos, ya que normalmente, por la naturaleza de los tejidos y la condición genética de los mismos, se produce en mayor frecuencia la formación de órganos (raíces y hojas), a través de los cuales se dificulta la regeneración de plantas completas, sin embargo, se ha encontrado que en tejidos como el cotiledón, específicamente en las zonas celulares ricas en sustancias de reserva, se puede obtener callo regenerativo de tipo embriogénico y a partir de éste inducir la formación de embriones somáticos, a través de los cuales es posible la regeneración de plantas completas, lo que concuerda con el proceso establecido en este trabajo.
Por otra parte, Giagnacovo et al. (2001), Shekhawat et al. (2009), Vila et al. (2009), indican que las secciones foliares poseen también una buena respuesta regenerativa y que ésta viene dada por las concentraciones hormonales y el estado del explante luego de los tratamientos de desinfección, los cuales pierden gran parte de la viabilidad celular, una solución a este tipo de problemas ha sido sugerida por Foan y Othman (2006), mediante la obtención del material vegetal de plantas germinadas in vitro, metodología que fue adoptada para este estudio, exhibiendo buenos resultados, pero en un menor porcentaje de plantas regeneradas que el 76-89 % indicado por Vila et al., (2003) en Melia azederach, lo cual puede atribuirse a que no se incluyó una fase adicional para el enraizamiento de los brotes diferenciados en los callos. En el caso de los procesos regenerativos en esquejes, los resultados obtenidos en este trabajo difieren con los presentados por Salvi et al., (2001), Gairi y Rashid (2005a), Gairi y Rashid (2005b), quienes han logrado la regeneración con frecuencias relativamente buenas (40 a 70 %), aunado a esto, Martínez et al., (2001) han empleado esquejes de vitro-plantas, lo que supone una ventaja al momento del cultivo, pues no están sujetos a condiciones ambientales que puedan afectar su estado fisiológico. En este trabajo, la baja frecuencia de formación de callo, puede atribuirse a los procesos de contaminación endógena o también a la necrosis que presentaron los explantes, los cuales afectan directamente el desarrollo del mismo, tal como señalan Zypman et al., (2001) y Srivastava et al., (2009).
De los tres explantes empleados, solo dos (cotiledón y secciones foliares de vitro-plantas) tuvieron formación de embriones o brotes de los cuales se pudieron regenerar plantas, así mismo se evidenció que en los cotiledones los procesos de formación de callo regenerativo y embriogénesis, son promovidos por BAP (1mg.L-1) y 2,4-D (0,2 mg.L-1), mientras que mayores concentraciones de 2,4-D inducen a la formación de callo no regenerativo.
CONCLUSIONES
Se lograron establecer sistemas de regeneración eficientes mediante embriogénesis somática directa e indirecta, a partir de cotiledones y secciones foliares de vitro-plantas en A. indica. Los esquejes solo desarrollaron callo regenerativo en medios con altas concentraciones de AIA (1,5 y 2 mg L-1) sin formación de embriones somáticos o brotes. En los cotiledones se presentó la mayor frecuencia regenerativas, observándose que los procesos de formación de callo regenerativo y de embriogénesis somática, tanto directa como indirecta, son promovidos por la citocinina BAP a una concentración de 1 mg L-1 y el por el 2,4-D a una concentración de 0,2 mg L-1, mientras que el desarrollo de callos no regenerativos es favorecida por concentraciones altas de 2,4-D (> 0,3 mg L-1). Con las secciones foliares de vitro-plantas se determinó que el tiempo mínimo en el proceso de regeneración de la planta es de 30 días, pudiendo así establecer un sistema a mayor escala como en bio fábricas, a fin de propagar masivamente plantas con características elite, tales como el mayor rendimiento del importante bio insecticida azadiractina.
AGRADECIMIENTOS
Al Consejo de Desarrollo Científico y Humanístico de la Universidad de Carabobo (CDCH-UC) por el financiamiento de este trabajo, a través de los proyectos de inversión menor CDCH-06I-178-2009 y CDCH-AM-020-12. Asimismo al personal asistente del Centro de Biotecnología Aplicada (CBA) del Departamento de Biología de la Universidad de Carabobo (Naguanagua-Edo. Carabobo) por el apoyo en el estudio morfológico y anatómico en esta investigación.
REFERENCIAS
Allan E, Eeswara J, Johnson S, Mordue A, Morgan D, Stuchbury T. The production of azadirachtin by in vitro tissue cultures of neem Azadirachta indica. Pesticide Sci. 1994;42(1):147-152. Doi: https://doi.org/10.1002/ps.2780420302.
Artigas MD, Fernández R. Establecimiento del sistema de regeneración por embriogénesis somática de Azadirachta indica A. Juss. Acta biol Colomb. 2015;20(2):73-83. Doi: https://doi.org/10.15446/abc.v20n2.44200.
Chaicharoen S, Jansaengsri S, Umprai T, Kruatrachue M. Utilization of tissue culture technique for propagation of Melia azedaracht. J Sci Soc Thailand. 1996;22(1):217-226. Doi: https://doi.org/10.2306/scienceasia1513-1874.1996.22.217.
Chandra S, Bandopadhyay R, Kumar V, Chandra R. Acclimatization of tissue cultured plantlets: from laboratory to land. Biotech Lett. 2010;32(1):1199-1205. Doi: https://doi.org/10.1007/s10529-010-0290-0.
Chaturvedi R, Razdan M, Bhojwani S. An efficient protocol for the production of triploid plants from endosperm callus of neem, Azadirachta indica A. Juss. J Plant Physiol. 2003;160(1):557-564. Doi: https://doi.org/10.1078/0176-1617-00884.
Chaturvedi R, Razdan M, Bhojwani S. In vitro morphogenesis in zygotic embryo cultures of Neem (Azadirachta indica A. Juss.). Plant Cell Rep. 2004;22(1):801-809. Doi: https://doi.org/10.1007/s00299-004-0768-0.
Da Rocha SC. Quoirin M. Calogeneses e rizogenese em explantes do mogno (Swietenia macrophylla King) cultivados in vitro. Cienc Florest. 2004;14(1):91-101.
Daquinta M, Lezcano Y, Cid M, Pina D, Rodríguez R, Escalona M. Callogénesis en meliáceas exóticas (Khaya nyasica stapf y Toona ciliata). Biotecnol Veg. 2003;3(2):123-125.
Daquinta M, Lezcano Y, Cid M, Pina D, Rodríguez R. Morfogénesis in vitro de Toona ciliata a partir de raquis de hojas jóvenes con tidiazuron. Rev Col Biotecnol. 2005;7(2):5-9.
Das P. In Vitro somatic embryogenesis in some oil yielding tropical tree species. Am J Plant Sci. 2011;2(1):217-222. Doi: https://doi.org/10.4236/ajps.2011.22023.
De Oliveira LL, Henriques BA, Macedo FA. The effect growth regulators on two different in vitro cultured explants of Carapa guianensis. J Med Plant Res. 2015;96(6):169-178. Doi: https://doi.org/10.5897/JMPR2014.5644.
Deb C. Somatic embryogenesis and plantlet regeneration of Melia azedarach L (Ghora Neem) from cotyledonary segments. J Plant Biochem Biotechnol. 2001;10(1):63-65. Doi: https://doi.org/10.1007/BF03263110.
Foan C, Othman R. In vitro direct shoot organogenesis and regeneration of planlets from leaf explants of Sentang (Azadirachta excelsa). Biotecnology. 2006;5(3):337-340. Doi: https://doi.org/10.3923/biotech.2006.337.340.
Gairi A, Rashid A. Direct differentiation of somatic embryos on cotyledons of Azadirachta indica. Biol Plant. 2005a;49(2):169-173. Doi: https://doi.org/10.1007/s10535-005-0173-8.
Gairi A, Rashid A. Direct differentiation of somatic embryos on different regions of intact seedlings of Azadirachta in response to thidiazurón. J Plant Physiol. 2005b;161(1):1073-1077. Doi: 10.1016/j.jplph.2004.05.001.
Goralski G, Popielarzka M, Slesak H, Siwinska D, Batycka M. Organogénesis in endosperm of Actinidia deliciosa cv. Hayward cultured in vitro. Acta Biol Gracoviensia Ser Bot. 2005;47(2):121-128.
Giagnacovo G, Pasqua G, Monacellis B, Van Der Esch A, CMaccioni O, Vitali F. Organogenesis and embryogenesis from callus cultures of Azadirachta excelsa. Plant Biosyst. 2001;135(1):13-18. Doi: https://doi.org/10.1080/11263500112331350590.
Hammer O, David A, Harper T, Ryan P. 2001. PAST: Paquete de programas de estadística paleontológica para enseñanza y análisis de datos. Version. 2.17. Palaeontologia Electronica. 4(1):9.
Karami O, Saidi A. The molecular basis for stress-induced acquisition of somatic embryogenesis. Mol Biol Rep. 2010;37(1):2493-2507. Doi: https://doi.org/10.1007/s11033-009-9764-3.
Kintzios S. Territorial plant derived anticancer agents and plant species used in anticancer research. Critic Rev Plant Physiol. 2006;25(2):79-113. Doi: https://doi.org/10.1080/07352680500348824.
Kota S, Rao R, Chary P. In vitro response of select regions of Azadirachta indica A. Juss (Meliaceae) as elucidated by biochemical and molecular variations. Curr Sci. 2006;91(6):770-776.
Martínez R, Rodríguez J, Vargas J, Azpiroz H. Embriogénesis somática a partir de callos de nim (Azadirachta indica A. Juss). Rev Chapingo Ser Cienc ForAmbient. 2001;7(2):107.114. Doi: https://doi.org/1111.
Meisner J, Ascher K, Aly R. Warthen J. Response of Spodoptera littoralis (Boisd.) and Earias insulana (Boisd.) larvae to azadirachtin and salannin. Phytoparasitica. 1981;9(1):27-32. Doi: https://doi.org/10.1007/BF03158326.
Mulanda E, Adero M, Wepukhulu D, Amogune N, Akunda E Kinyamario I. Thidiazuron-induced somatic embryogenesis and shoot organogenesis in cotyledon explants of Melia volkensii (Gürke). Propag Ornam Plants. 2014;14(1):40-46.
Mulanda E, Chuhila Y, Awori R, Adero M, Amogune N, Akunda E, Kinyamario I. Morphological and RAPD-marker characterization of Melia volkensii (Gürke) in vitro plants regenerated via direct and indirect somatic embryogenesis. Afr J Biotechnol. 2015;14(15):1261-1274. Doi: https://doi.org/10.5897/AJB2014.14372.
Murashige T, Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant. 1962;15(1):473-497. Doi: https://doi.org/10.1111/j.1399-3054.1962.tb08052.x.
Nunes E, de Castilho C, Moreno F, Viana A. In vitro culture of Cedrela fissilis Vellozo (Meliaceae). Plant Cell Tissue Organ Cult. 2002;70(3):259-268. Doi: https://doi.org/10.1023/A:1016509415222.
Pai MR, Acharya L, Udupa N. Evaluation of antiplague activity of Azadirachta indica leaf extracts gel - a 6 week clinical study. J Ethnopharmacol. 2004;90(1):99-103.
Panda B, Hazea S. In vitro morphogenic response in cotyledon explants of Semecarpus anacardium L. Plant Biotechnol Rep. 2012;6(2):141-148. Doi: https://doi.org/10.1007/s11816-011-0207-y.
Parrotta A, Chaturvedi A. Azadirachta indica A. Juss. neem, margosa Meliaceae. Mahogany family. New Orleans: USDA Forest Service, International Institute of Tropical Forestry. 1994;8 p.
Pijut P, Beasley R, Lawson S, Palla K, Stevens M, Wang Y. In vitro propagation of tropical hardwood tree species- A review (2001-2011). Propag Ornam Plants. 2012;12(1):25-51.
Popielarska M, Slesak H, Goralski G. Histological and SEM studies on organogenesis in endosperm-derived callus of kiwifruit (Actinidia deliciosa cv. Hayward). Acta Biol Gracoviensia Ser Bot. 2006;48(2):97-104.
Rafiq M, Dahot M. Callus and azadiractin related limonoids through in vitro culture of Neem (Azadirachta indica A. Juss.). Afr J Biotechnol. 2010;9(4):449-453.
Rai V, McComb J. Direct somatic embryogenesis from mature embryos of sandalwood. Plant Cell Tissue Organ Cult. 2002;69(1):65-70. Doi: https://doi.org/10.1023/A:1015037920529.
Ranjan G. In vitro somatic embryogenesis in callus cultures of Azadirachta indica A. Juss. A multipurpose tree. J Forest Res. 2005;10(1):263-267. Doi: https://doi.org/10.1007/s10310-004-0130-y.
Rajasekaran C, Meignanam E, Vijayakumar V, Kalaivani T, Ramya S, Premkumar N, Siva R, Jayakumaraj R. Investigations on antibacterial activity of leaf extracts of Azadirachta indica A. Juss. (Meliacea): A traditional Medicinal plant of India. Ethnobot Leafl. 2008;12(1):1213-1217.
Ram B, Rathore TS, Bopanna BD. An efficient protocol for micropropagation and genetic stability analysis of Melia dubia Cav.-an important multipurpose tree. Int J Curr Microb App Sci. 2014;3(7):533-544.
Reyes E, Styles W, Garay D. Estudio preliminar de las propiedades físicas de la especie Azadirachta indica (neem), procedentes del estado Falcón (Venezuela). Rev For Venezuela. 2003;47(2):23-29.
Rodrigues M. Morfogênese in vitro, análise fitoquímica e caracterizaçao anatómica de nim (Azadirachta indica A. Juss) (tesis de maestría). Universidad Federal de Vicoça; 2009. 89 p.
Salvi N, Singh H, Tivarekar1 S, Eapen S. Plant regeneration from different explants of neem. Plant Cell Tissue Organ Cult. 2001;65(1):159-162. Doi: https://doi.org/10.1023/A:1010672809141.
Shekhawat G, Mtahur S, Batra A. Role of phytohormones and nitrogen in somatic embryogenesis induction in cell culture derived from leaflets of Azadirachta indica. Biol Plant. 2009;53(4):707-710. Doi: https://doi.org/10.1007/s10535-009-0127-7.
Srivastava P, Singh M, Mathur P, Chaturvedi R. In vitro organogenesis and plant regeneration from unpollinated ovary cultures of Azadirachta indica. Biol Plant. 2009;53(2):360-364. Dpi: https://doi.org/10.1007/s10535-009-0067-2.
Su W, Hwang W, Se Y, Sagawa Y. Induction of somatic embryogenesis in Azadirachta indica. Plant Cell Tissue Organ Cult. 1997;50(1):91-95. Doi: https://doi.org/10.1023/A:1005891113815.
Sunday E, Atawodi J. Azadirachta indica (neem): a plant of multiple biological and pharmacological activities. Phytochem Rev. 2009;8(1):601-620. Doi: https://doi.org/10.1007/s11101-009-9144-6.
Te-Chao S, Rungnoi O. Induction of somatic embryogenesis from leaves of Sadao Chang (Azadirachta excelsa (Jack) Jacobs). Sci Hortic. 2000;86(4):311-321. Doi: https://doi.org/10.1016/S0304-4238(00)00153-9.
Thomas T, Chaturvedi R. Endosperm culture: a novel method for triploid plant production. Plant Cell Tissue Organ Cult. 2008;93(1):1-14. Doi: https://doi.org/10.1007/s11240-008-9336-6.
Trujillo P, Zapata L, Hoyos R, Yepes F, Capataz J, Orozco F. Determinación de la dl50 y tl50 de extractos etanólicos de suspensiones celulares de Azadirachta indica sobre Spodoptera frugiperda. Rev Fac Nac Agron. 2008;61(2):4564-4575.
Urdaneta M. Neem Un Árbol Milagroso. 1st ed. Maracaibo: Universidad del Zulia, Facultad de Agronomía; 2001. p.1-49.
Vila S, González A, Rey H, Mroginsky L. In vitro plant regeneration of Melia azederach L.: shoot organogenesis from leaf explants. Biol Plant. 2003;47(1):13-19. Doi: https://doi.org/10.1023/A:1027364427795.
Vila S, Gonzalez A, Rey H, Mroginski L. Effect of morphological heterogeneity of somatic embryos of Melia azedaracht on conversion into plants. Biocell. 2010;34(1):7-13.
Vila S, Rey H, Gonzalez A, Mroginski L. Somatic embryogenesis and plant regeneration in Cedrella fissilis. Biol Plant. 2009;53(2):382-386. Doi: https://doi.org/10.1007/s10535-009-0072-5.
Webster S, Mitchell S, Reid W, Ahmad, M. Somatic embryogenesis from leaf and zygotic embryo explants of Blighia sapida 'cheese' ackee. In Vitro Cell Devbiol-Plant. 2006;42(1):467-472. Doi: https://doi.org/10.1079/IVP2006795.
Yang L, Wang J, Bian L, Li Y, Shen H. Cyclic secondary somatic embryogenesis and efficient plant regeneration in mountain ash (Sorbus pohuashanensis). Plant Cell Tissue Organ Cult. 2012;111(2):173-182. Doi: https://doi.org/10.1007/s11240-012-0181-2.
You C, Fan T, Gong X, Bian F, Liang L Qu F. A high-frequency cyclic secondary somatic embryogenesis system for Cyclamen persicum Mill. Plant Cell Tissue Organ Cult. 2011;107(2):233-242. Doi: https://doi.org/10.1007/s11240-011-9974-y.
Zaidi M, Narayan M, Sardana R, Taga I, Postel S, Johns R, Nulty M, Mao J, Loit E, Altosar I. Optimizing tissue culture media for efficient transformation of different indica rice genotypes. Agron Res. 2006;4(2):563-575.
Zypman S, Applebaum S, Ziv M. Production of desert locust feeding deterrents from in vitro cultured neem (Azadirachta indica). Phytoparasitica, 2001;29(4):1-8. Doi: https://doi.org/10.1007/BF02981844.
Referencias
Allan E, Eeswara J, Johnson S, Mordue A, Morgan D, Stuchbury T. The production of azadirachtin by in vitro tissue cultures of neem Azadirachta indica. Pesticide Sci. 1994;42(1):147-152. Doi:http://dx.doi.org/10.1002/ps.2780420302
Artigas MD, Fernández R. Establecimiento del sistema de regeneración por embriogénesis somática de Azadirachta indica A. Juss. Acta biol Colomb. 2015;20(2):73-83. Doi:http://dx.doi.org/10.15446/abc.v20n2.44200
Chaicharoen S, Jansaengsri S, Umprai T, Kruatrachue M. Utilization of tissue culture technique for propagation of Melia azedaracht. J Sci Soc Thailand. 1996;22(1):217-226. Doi:http://dx.doi.org/10.2306/scienceasia1513-1874.1996.22.217
Chandra S, Bandopadhyay R, Kumar V, Chandra R. Acclimatization of tissue cultured plantlets: from laboratory to land. Biotech Lett. 2010;32(1):1199-1205. Doi:http://dx.doi.org/10.1007/s10529-010-0290-0
Chaturvedi R, Razdan M, Bhojwani S. An efficient protocol for the production of triploid plants from endosperm callus of neem, Azadirachta indica A. Juss. J Plant Physiol. 2003;160(1):557-564. Doi:http://dx.doi.org/10.1078/0176-1617-00884
Chaturvedi R, Razdan M, Bhojwani S. In vitro morphogenesis in zygotic embryo cultures of Neem (Azadirachta indica A. Juss.). Plant Cell Rep. 2004;22(1):801-809. Doi:http://dx.doi.org/10.1007/s00299-004-0768-0
Da Rocha SC. Quoirin M. Calogeneses e rizogenese em explantes do mogno (Swietenia macrophylla King) cultivados in vitro. Cienc Florest. 2004;14(1):91-101.
Daquinta M, Lezcano Y, Cid M, Pina D, Rodríguez R, Escalona M. Callogénesis en meliáceas exóticas (Khaya nyasica stapf y Toona ciliata). Biotecnol Veg. 2003;3(2):123-125.
Daquinta M, Lezcano Y, Cid M, Pina D, Rodríguez R. Morfogénesis in vitro de Toona ciliata a partir de raquis de hojas jóvenes con tidiazuron. Rev Col Biotecnol. 2005;7(2):5-9.
Das P. In Vitro somatic embryogenesis in some oil yielding tropical tree species. Am J Plant Sci. 2011;2(1):217-222. Doi:http://dx.doi.org/10.4236/ajps.2011.22023
De Oliveira LL, Henriques BA, Macedo FA. The effect growth regulators on two different in vitro cultured explants of Carapa guianensis. J Med Plant Res. 2015;96(6):169-178. Doi:https://doi.org/10.5897/JMPR2014.5644
Deb C. Somatic embryogenesis and plantlet regeneration of Melia azedarach L (Ghora Neem) from cotyledonary segments. J Plant Biochem Biotechnol. 2001;10(1):63-65. Doi:http://dx.doi.org/10.1007/BF03263110
Foan C, Othman R. In vitro direct shoot organogenesis and regeneration of planlets from leaf explants of Sentang (Azadirachta excelsa). Biotecnology. 2006;5(3):337-340. Doi:http://dx.doi.org/10.3923/biotech.2006.337.340
Gairi A, Rashid A. Direct differentiation of somatic embryos on cotyledons of Azadirachta indica. Biol Plant. 2005a;49(2):169-173. Doi:http://dx.doi.org/10.1007/s10535-005-0173-8
Gairi A, Rashid A. Direct differentiation of somatic embryos on different regions of intact seedlings of Azadirachta in response to thidiazurón. J Plant Physiol. 2005b;161(1):1073-1077. Doi:10.1016/j.jplph.2004.05.001
Goralski G, Popielarzka M, Slesak H, Siwinska D, Batycka M. Organogénesis in endosperm of Actinidia deliciosa cv. Hayward cultured in vitro. Acta Biol Gracoviensia Ser Bot. 2005;47(2):121-128.
Giagnacovo G, Pasqua G, Monacellis B, Van Der Esch A, CMaccioni O, Vitali F. Organogenesis and embryogenesis from callus cultures of Azadirachta excelsa. Plant Biosyst. 2001;135(1):13-18. Doi:http://dx.doi.org/10.1080/11263500112331350590
Hammer O, David A, Harper T, Ryan P. 2001. PAST: Paquete de programas de estadística paleontológica para enseñanza y análisis de datos. Version. 2.17. Palaeontologia Electronica. 4(1):9.
Karami O, Saidi A. The molecular basis for stress-induced acquisition of somatic embryogenesis. Mol Biol Rep. 2010;37(1):2493-2507. Doi:http://dx.doi.org/10.1007/s11033-009-9764-3
Kintzios S. Territorial plant derived anticancer agents and plant species used in anticancer research. Critic Rev Plant Physiol. 2006;25(2):79-113. Doi:http://dx.doi.org/10.1080 / 07352680500348824
Kota S, Rao R, Chary P. In vitro response of select regions of Azadirachta indica A. Juss (Meliaceae) as elucidated by biochemical and molecular variations. Curr Sci. 2006;91(6):770-776.
Martínez R, Rodríguez J, Vargas J, Azpiroz H. Embriogénesis somática a partir de callos de nim (Azadirachta indica A. Juss). Rev Chapingo Ser Cienc ForAmbient. 2001;7(2):107.114. Doi: http://dx.doi.org/1111
Meisner J, Ascher K, Aly R. Warthen J. Response of Spodoptera littoralis (Boisd.) and Earias insulana (Boisd.) larvae to azadirachtin and salannin. Phytoparasitica. 1981;9(1):27-32. Doi:http://dx.doi.org/10.1007/BF03158326
Mulanda E, Adero M, Wepukhulu D, Amogune N, Akunda E Kinyamario I. Thidiazuron-induced somatic embryogenesis and shoot organogenesis in cotyledon explants of Melia volkensii (Gürke). Propag Ornam Plants. 2014;14(1):40-46.
Mulanda E, Chuhila Y, Awori R, Adero M, Amogune N, Akunda E, Kinyamario I. Morphological and RAPD-marker characterization of Melia volkensii (Gürke) in vitro plants regenerated via direct and indirect somatic embryogenesis. Afr J Biotechnol. 2015;14(15):1261-1274. Doi:http://dx.doi.org/10.5897/AJB2014.14372
Murashige T, Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant. 1962;15(1):473-497. Doi:http://dx.doi.org/10.1111/j.1399-3054.1962.tb08052.x
Nunes E, de Castilho C, Moreno F, Viana A. In vitro culture of Cedrela fissilis Vellozo (Meliaceae). Plant Cell Tissue Organ Cult. 2002;70(3):259–268. Doi:http://dx.doi.org/10.1023/A:1016509415222
Pai MR, Acharya L, Udupa N. Evaluation of antiplague activity of Azadirachta indica leaf extracts gel – a 6 week clinical study. J Ethnopharmacol. 2004;90(1):99-103.
Panda B, Hazea S. In vitro morphogenic response in cotyledon explants of Semecarpus anacardium L. Plant Biotechnol Rep. 2012;6(2):141–148. Doi:http://dx.doi.org/10.1007/s11816-011-0207-y
Parrotta A, Chaturvedi A. Azadirachta indica A. Juss. neem, margosa Meliaceae. Mahogany family. New Orleans: USDA Forest Service, International Institute of Tropical Forestry. 1994;8 p.
Pijut P, Beasley R, Lawson S, Palla K, Stevens M, Wang Y. In vitro propagation of tropical hardwood tree species- A review (2001-2011). Propag Ornam Plants. 2012;12(1):25-51.
Popielarska M, Slesak H, Goralski G. Histological and SEM studies on organogenesis in endosperm-derived callus of kiwifruit (Actinidia deliciosa cv. Hayward). Acta Biol Gracoviensia Ser Bot. 2006;48(2):97-104.
Rafiq M, Dahot M. Callus and azadiractin related limonoids through in vitro culture of Neem (Azadirachta indica A. Juss.). Afr J Biotechnol. 2010;9(4):449-453.
Rai V, McComb J. Direct somatic embryogenesis from mature embryos of sandalwood. Plant Cell Tissue Organ Cult. 2002;69(1):65-70. Doi:http://dx.doi.org/10.1023/A:1015037920529
Ranjan G. In vitro somatic embryogenesis in callus cultures of Azadirachta indica A. Juss. A multipurpose tree. J Forest Res. 2005;10(1):263-267. Doi:http://dx.doi.org/10.1007/s10310-004-0130-y
Rajasekaran C, Meignanam E, Vijayakumar V, Kalaivani T, Ramya S, Premkumar N, Siva R, Jayakumaraj R. Investigations on antibacterial activity of leaf extracts of Azadirachta indica A. Juss. (Meliacea): A traditional Medicinal plant of India. Ethnobot Leafl. 2008;12(1):1213-1217.
Ram B, Rathore TS, Bopanna BD. An efficient protocol for micropropagation and genetic stability analysis of Melia dubia Cav. - an important multipurpose tree. Int J Curr Microb App Sci. 2014;3(7):533-544.
Reyes E, Styles W, Garay D. Estudio preliminar de las propiedades físicas de la especie Azadirachta indica (neem), procedentes del estado Falcón (Venezuela). Rev For Venezuela. 2003;47(2):23-29.
Rodrigues M. Morfogênese in vitro, análise fitoquímica e caracterizaçao anatómica de nim (Azadirachta indica A. Juss) (tesis de maestría). Universidad Federal de Vicoça; 2009. 89 p.
Salvi N, Singh H, Tivarekar1 S, Eapen S. Plant regeneration from different explants of neem. Plant Cell Tissue Organ Cult. 2001;65(1):159-162. Doi:http://dx.doi.org/10.1023/A:1010672809141
Shekhawat G, Mtahur S, Batra A. Role of phytohormones and nitrogen in somatic embryogenesis induction in cell culture derived from leaflets of Azadirachta indica. Biol Plant. 2009;53(4):707-710. Doi:http://dx.doi.org/10.1007/s10535-009-0127-7
Srivastava P, Singh M, Mathur P, Chaturvedi R. In vitro organogenesis and plant regeneration from unpollinated ovary cultures of Azadirachta indica. Biol Plant. 2009;53(2):360-364. Dpi:http://dx.doi.org/10.1007/s10535-009-0067-2
Su W, Hwang W, Se Y, Sagawa Y. Induction of somatic embryogenesis in Azadirachta indica. Plant Cell Tissue Organ Cult. 1997;50(1):91-95. Doi:http://dx.doi.org/10.1023/A:1005891113815
Sunday E, Atawodi J. Azadirachta indica (neem): a plant of multiple biological and pharmacological activities. Phytochem Rev. 2009;8(1):601-620. Doi:http://dx.doi.org/10.1007/s11101-009-9144-6
Te-Chao S, Rungnoi O. Induction of somatic embryogenesis from leaves of Sadao Chang (Azadirachta excelsa (Jack) Jacobs). Sci Hortic. 2000;86(4):311-321. Doi:http://dx.doi.org/10.1016/S0304-4238(00)00153-9
Thomas T, Chaturvedi R. Endosperm culture: a novel method for triploid plant production. Plant Cell Tissue Organ Cult. 2008;93(1):1-14. Doi:http://dx.doi.org/10.1007/s11240-008-9336-6
Trujillo P, Zapata L, Hoyos R, Yepes F, Capataz J, Orozco F. Determinación de la dl50 y tl50 de extractos etanólicos de suspensiones celulares de Azadirachta indica sobre Spodoptera frugiperda. Rev Fac Nac Agron. 2008;61(2):4564-4575.
Urdaneta M. Neem Un Árbol Milagroso. 1st ed. Maracaibo: Universidad del Zulia, Facultad de Agronomía; 2001. p.1-49.
Vila S, González A, Rey H, Mroginsky L. In vitro plant regeneration of Melia azederach L.: shoot organogenesis from leaf explants. Biol Plant. 2003;47(1):13-19. Doi:http://dx.doi.org/10.1023/A:1027364427795
Vila S, Gonzalez A, Rey H, Mroginski L. Effect of morphological heterogeneity of somatic embryos of Melia azedaracht on conversion into plants. Biocell. 2010;34(1):7-13.
Vila S, Rey H, Gonzalez A, Mroginski L. Somatic embryogenesis and plant regeneration in Cedrella fissilis. Biol Plant. 2009;53(2):382-386. Doi:http://dx.doi.org/10.1007/s10535-009-0072-5
Webster S, Mitchell S, Reid W, Ahmad, M. Somatic embryogenesis from leaf and zygotic embryo explants of Blighia sapida ‘cheese’ ackee. In Vitro Cell Devbiol-Plant. 2006;42(1):467-472. Doi:http://dx.doi.org/10.1079/IVP2006795
Yang L, Wang J, Bian L, Li Y, Shen H. Cyclic secondary somatic embryogenesis and efficient plant regeneration in mountain ash (Sorbus pohuashanensis). Plant Cell Tissue Organ Cult. 2012;111(2):173-182. Doi:http://dx.doi.org/10.1007/s11240-012-0181-2
You C, Fan T, Gong X, Bian F, Liang L Qu F. A high-frequency cyclic secondary somatic embryogenesis system for Cyclamen persicum Mill. Plant Cell Tissue Organ Cult. 2011;107(2):233–242. Doi:http://dx.doi.org/10.1007/s11240-011-9974-y
Zaidi M, Narayan M, Sardana R, Taga I, Postel S, Johns R, Nulty M, Mao J, Loit E, Altosar I. Optimizing tissue culture media for efficient transformation of different indica rice genotypes. Agron Res. 2006;4(2):563-575.
Zypman S, Applebaum S, Ziv M. Production of desert locust feeding deterrents from in vitro cultured neem (Azadirachta indica). Phytoparasitica, 2001;29(4):1-8. Doi:http://dx.doi.org/10.1007/BF02981844
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Maria Daniela Artigas Ramirez, Rafael Fernandez Da Silva. (2018). Caracterización morfo-anatómica de la embriogénesis somática secundaria en Azadirachta indica (Meliaceae). Acta Botanica Mexicana, (122), p.7. https://doi.org/10.21829/abm122.2018.1242.
2. Rafael Fernández-Da Silva, Jessica Salomón , Adrián Villarroel, Valeria Montilla. (2021). Evaluación de la producción in vitro de azadiractina en Neem según el tipo de callo y los agentes químicos. Revista Ingeniería UC, 28(2), p.282. https://doi.org/10.54139/revinguc.v28i2.27.
3. Karol Rubio, Santos Leiva, Manuel Oliva, Jorge Diaz-Valderrama, Juan Guerrero-Abad. (2025). Somatic Embryogenesis in Native Peruvian Fine-Flavor Cocoa Genotypes. International Journal of Plant Biology, 16(3), p.84. https://doi.org/10.3390/ijpb16030084.
4. Rafael Fernández Da Silva, Valeria Montilla. (2023). Establecimiento del sistema de embriogénesis somática en Azadirachta indica A. Juss a partir de suspensiones celulares, acoplado a la producción de azadiractina in vitro. Revista Ingeniería UC, 29(2), p.156. https://doi.org/10.54139/revinguc.v29i2.169.
5. Joaquín Teodoro Morán Bajaña, Manuel Oswaldo Santander Villao , Paulo Humberto Centanaro Quiroz , César Antonio Peña Haro. (2022). Obtención de callos embriogénicos a partir de explantes foliares y meristemáticos de pechiche (Vitex gigantea). Pro Sciences: Revista de Producción, Ciencias e Investigación, 6(42), p.146. https://doi.org/10.29018/issn.2588-1000vol6iss42.2022pp146-160.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2016 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).