Propagación in vitro de Phalaenopsis (Orchidaceae) a partir de protocormos, mediante el sistema de inmersión temporal "RITA"
In vitro propagation of Phalaenopsis (Orchidaceae) from protocorms, using the temporary inmersion system "RITA"
Palabras clave:
Phalaenopsis, protocormo, propagación in vitro, inmersión temporal, RITA, protocorm, in vitro propagation, temporary immersion (es)|
_________________________REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VII No. 1 Julio 2005 25-31
Propagación in vitro de Phalaenopsis (Orchidaceae)
a partir de protocormos, mediante el sistema
de inmersión temporal "RITA"
In vitro propagation of Phalaenopsis (Orchidaceae) from protocorms, using the temporary inmersion
system "RITA"
Jorge Mario Tirado*, Esther Julia Naranjo** , Lucía Atehortúa
RESUMEN
Protocormos in vitro de Phalaenopsis de tres meses de edad se transfirieron a contenedores RITA® con el fin de propagarlos masivamente. Los factores evaluados fueron la concentración de sacarosa en el medio y la frecuencia de inmersión. Se dispusieron cinco pares de contenedores RITA® con medio de cultivo líquido a concentraciones de sacarosa de 0, 15, 30, 45 y 60 g/L. El medio utilizado fue el MS a la mitad de la concentración de las sales, suplementado con vitaminas y tidiazuron (5 mg/L). El experimento se realizó en dos etapas, cada una con duración de dos meses. La primera etapa con una frecuencia de inmersión de cuatro horas y la segunda con una frecuencia de inmersión de ocho horas, ambas con un tiempo de inmersión de un minuto. Los resultados mostraron que la mejor respuesta proliferativa, con 8,2 protocormos adventicios por protocormo por mes, se obtuvo en el medio con 15 g/L de sacarosa y un tiempo de inmersión de un minuto cada cuatro horas.
Palabras clave: Phalaenopsis, protocormo, propagación in vitro, inmersión temporal, RITA.
ABSTRACT
In order to massively propagate Phalaenopsis orchids, three months old in vitro protocorms were transferred to RITA® vessels. The evaluation factors were the sucrose concentration in the culture medium and the frequency immersion. There was a set of five pairs of RITA® vessels with liquid culture medium containing sucrose at 0,15, 30, 45, 60 g/L. A half-strength MS medium plus vitamins, supplemented with vitamins and thidiazuron (5 mg/L) was used. The experiment had two stages, each lasting two months. Each stage had a one minute immersion. The first stage had a four hour immersion frequency and the second one had an eight hour immersion frequency. Results showed that the best proliferating response was reached in a 15 g/L of sucrose medium with one minute of immersion time every four hours, resulting in 8,2 adventitious protocorms per protocorm per month. Key words: Phalaenopsis, protocorm, in vitro propagation, temporary immersion, RITA. |
|
* Biólogo, B. Sc. Laboratorio de Biotecnología Vegetal, Instituto de Biología, Universidad de Antioquia, A. A. 1226 Medellín. Correo electrónico: etirado@epm.net.co ** Bióloga, M. Sc. Laboratorio de Biotecnología Vegetal, Instituto de Biología, Universidad de Antioquia. A. A. 1226 Medellín. Correo electrónico: enaranjo@matematicas.udea.edu.co *** Bióloga, M. Sc. y Ph. D. Laboratorio de Biotecnología Vegetal, Instituto de Biología, Universidad de Antioquia. A. A. 1226 Medellín. Correo electrónico: latehor@quimbaya.udea.edu.co Recibido: octubre 13 de 2004 Aceptado: mayo 20 de 2005
|
|
25
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VII No. 1 Julio 2005 25-31______________________________________
|
|
|
|
|
|
INTRODUCCIÓN
Las orquídeas son plantas herbáceas perennes de la familia, clase (Monocotiledóneas). Se calcula que en el mundo existen más de treinta mil especies. Son más abundantes en los trópicos, aunque también hay especies en las zonas templadas, con rangos altitudinales que varían desde el nivel del mar hasta los subpáramos. Algunas viven sobre las ramas de los árboles (epífitas), otras en el suelo, sobre rocas e incluso en ambientes subterráneos o semiacuáticos (Escobar y Múnera, 1990).
Las orquídeas tienen dos tipos básicos de crecimiento: simpodial, en las que el nuevo crecimiento se produce a partir de una yema axilar en sentido horizontal, y monopodial, en las que el nuevo crecimiento se produce a partir de una yema apical en sentido vertical, como es el caso de Phalaenopsis (Escobar y Múnera, 1990).
Phalaenopsis es una orquídea epífita originaria del sureste de Asia, India, Indonesia y parte de Australia (Rittershausen y Rittershausen, 2004). Estas representan uno de los grupos de plantas ornamentales más apreciados a nivel mundial por el colorido, forma y duración de sus flores, pero a diferencia de otros géneros de orquídeas, su sistema de reproducción es difícil ya que su crecimiento monopodial es lento, lo cual ha dificultado su multiplicación vegetativa y la reproducción sexual se ha visto agravada por la presencia de altos índices de esterilidad en algunos de sus híbridos (Jiménez y Guevara, 1996).
Como consecuencia de lo anterior, se han desarrollado varias formas de propagación clonal in vitro de Phalaenopsis, dentro de las cuales podemos citar: la formación de embriones somáticos a partir de callos (Ishii et al., 1998) y la formación de cuerpos similares a protocormos (PLBs, Protocorm Like Bodies) a partir de varios tejidos, como: hojas (Arditti y Ernest, 1993; Park et al., 1996, 2000, 2002), ápices radicales (Kobayashi et al., 1990; Tanaka et al., 1976), ápices de vástagos (Arditti y Ernest, 1993; Tokuhara y Mii, 2001), secciones de ejes florales (Arditti y Ernest, 1993; Jiménez y Guevara, 1996) y callos (Chen et al., 2000; Islam y Ichihashi, 1999), para su posterior regeneración en plántulas.
Los protocormos son cuerpos que se encuentran en un estadio morfológico intermedio entre un
|
embrión cigótico y un vástago. Cuando estos cuerpos se desarrollan sobre el tejido adulto, reciben el nombre de cuerpos protocórmicos o PLBs (Pierik, 1990). Cabe anotar que PLBs de Phalaenopsis han sido multiplicados exitosamente utilizando un biorreactor como sistema de inmersión temporal (Park et al., 2000). Sin embargo, se decidió implementar un nuevo protocolo de propagación, evaluando concentraciones de sacarosa y frecuencias de inmersión diferentes a las utilizadas por Park et al. (2000), empleando el sistema de inmersión temporal "RITA".
Muchas especies vegetales se han propagado con éxito mediante los sistemas de inmersión temporal, como Vitis vinifera (uva), Daucus carota (zanahoria), Musa spp. (banano y plátano), Solanum tuberosum (papa), Hevea brasiliensis (caucho), Coffea arabica (café), Saccharum spp. (caña de azúcar), Ananas comosus (piña) y Potinera spp. (orquídea), entre otras (Etienne y Berthouly, 2002). Estos métodos de cultivo se emplean para propagar masivamente material vegetal en medio líquido, con la ventaja de que son sistemas semiautomatizados que permiten reducir los costos de producción (Etienne y Berthouly, 2002).
MATERIALES Y MÉTODOS
Material vegetal y medios de cultivo. Semillas de Phalaenopsis (Minho princess x 351 rayas) previamente esterilizadas (con etanol al 70% por 15 seg e hipoclorito de sodio al 1% por 15 min) y lavadas con agua destilada estéril fueron sembradas en frascos de vidrio con medio sólido de cultivo (donados por la empresa Orquifollajes Ltda.). Protocormos de tres meses de edad (figura 1a) obtenidos después de la germinación de las semillas fueron transferidos a contenedores RITA® (10 protocormos/RITA®). Estos contenedores fueron previamente autoclavados a 15 psi x 20 minutos. Se dispusieron cinco pares de RITAS con medio de cultivo líquido (175 mL/RITA®), a concentraciones de sacarosa de 0,15, 30, 45 y 60 g/L; se tuvieron así dos repeticiones por cada concentración de sacarosa. El experimento se realizó en dos etapas, cada una con una duración de dos meses. La primera etapa con una frecuencia de inmersión de cuatro horas y la segunda con una frecuencia de inmersión de ocho horas, ambas con un tiempo de inmersión de un minuto. Al mes de cada tratamiento se hizo un cambio del medio líquido por
|
|
26 |
|
|
______________________PROPAGACIÓN IN VITRO DE Phalaenopsis (ORCHIDACEAE) A PARTIR DE PROTOCORMOS
|
|
|
|
|
 |
|
Figura 1. a. Protocormos de Phalaenopsis de 3 meses de edad. b. Contenedores RITA® . c. Protocormos adventicios genererados a partir de protocormos.
|
|
|
|
|
|
la oxidación de este. El medio utilizado fue el MS a la mitad de la concentración de las sales, suplementado con (mg/L): myo-inositol (100), niacina (0,5), piridoxina (0,5), tiamina (0,1), glicina (2,0) y tidiazuron (5), a un pH de 5,5. Los protocormos se desarrollaron a una temperatura promedio de 25 ± 1 °C, bajo lámparas de neón con luz blanca (25 umol/m2s) durante 24 horas/día.
Sistema de inmersión temporal. El sistema RITA® (Recipient for Automated Temporary Inmersion System) (figura 1b) consiste en un contenedor o frasco plástico de un litro de capacidad, dividido en dos compartimientos. En el compartimiento superior, cuya base es perforada, se coloca el material vegetal sobre una espuma de poliuretano, y en el compartimiento inferior, el medio de cultivo líquido. En el centro del compartimiento superior hay un tubo dispuesto longitudinalmente, a través del cual se inyecta aire estéril por medio de un compresor que está conectado al equipo por mangueras, con el fin de desplazar el medio líquido de la parte inferior a la superior. Este proceso es controlado por un temporizador para regular los tiempos y frecuencias de inmersión. Cabe anotar que, en lugar de utilizar la espuma de poliuretano, se adaptó un tamiz o malla metálica (MESH 100) sobre la cual se colocaron los protocormos.
Análisis estadístico. Se estimó la tasa de multiplicación de los protocormos obtenida en cada uno de los contenedores RITA®, en respuesta a las
|
diferentes concentraciones de sacarosa y frecuencias de inmersión. Para esto se procedió a dividir el número de protocormos adventicios (figura 1c) obtenidos en cada RITA® entre el número de protocormos madre, es decir, entre los protocormos que dieron su origen, y este cociente se dividió por el tiempo del tratamiento (dos meses). Cabe anotar que no todos los protocormos transferidos a los RITA® dieron origen a protocormos adventicios, bien sea porque se murieron o porque, a pesar de que permanecieron vivos, no respondieron al tratamiento.
Se utilizó análisis de varianza de dos vías para comparar las respuestas de los protocormos a las diferentes concentraciones de sacarosa y frecuencias de inmersión. Las comparaciones múltiples de medias se analizaron con la prueba de Newman-Keuls. Para la significancia se consideró a = 0,05. Los datos fueron analizados mediante el paquete estadístico Statistica98 (StatSoft, Inc., Tulsa, OK).
RESULTADOS
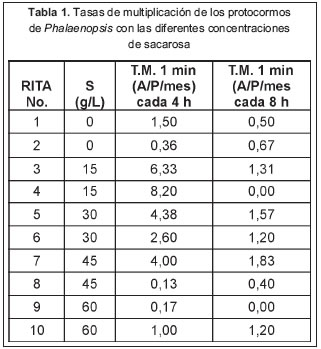
De acuerdo con los resultados obtenidos, el mejor tratamiento fue la concentración de 15 g/L de sacarosa con un tiempo de inmersión de un minuto cada cuatro horas (tabla 1 y figura 2). Sin embargo, a pesar de que en este se observó la mejor respuesta, un tercio de los protocormos obtenidos presentaron signos de vitrificación (datos no publicados). Cabe mencionar que la tasa de supervivencia para este tratamiento fue del 80% (datos no publicados).
|
|
27
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VII No. 1 Julio 2005 25-31_____________________________
|
|
|
|
|
|
|
Los resultados del análisis de varianza indicaron que existen diferencias significativas tanto entre las concentraciones de sacarosa como entre las frecuencias de inmersión. También se encontró interacción significativa entre las concentraciones de sacarosa y las frecuencias de inmersión (tabla 2). La prueba de Newman-Keuls separó el tratamiento de 15 g/L de sacarosa con una frecuencia de inmersión de cuatro horas, como el mejor, y consideró similares entre sí el resto de los tratamientos (figura 2).
DISCUSIÓN
Concentración de sacarosa. En el tratamiento realizado con medio de cultivo líquido sin sacarosa, se observaron bajas tasas de multiplicación de los protocormos (figura 2), a diferencia de los resultados obtenidos por Ishii et al. (1998), quienes indujeron la formación de gran número de PLBs en medio sin sacarosa (a partir de callos previamente cultivados con sacarosa), y por Park et al. (2002), quienes por el contrario no obtuvieron proliferación de PLBs, bajo estas condiciones. Lo anterior puede deberse a que muy pocos cultivos in vitro son autótrofos e incluso cuando se tiene éxito las velocidades de crecimiento son bajas (Roca y Mroginski, 1993).
De igual manera, en los tratamientos realizados con 60 g/L de sacarosa se dieron respuestas similares a las obtenidas sin sacarosa (figura 2), aunque mucho menores que los resultados publicados por Park et al. (2002), quienes obtuvieron mayores cantidades de PLBs por explante foliar. Quizás esto último porque los protocormos, a diferencia de los PLBs, pueden ser más susceptibles a la alta osmolaridad del medio que pudo haber causado un estrés osmótico (aun en células con pared), provocando un
|
 |
|
|
28
|
|
|
_________________________PROPAGACIÓN IN VITRO DE Phalaenopsis (ORCHIDACEAE) A PARTIR DE PROTOCORMOS
|
|
|
|
|
|
desequilibrio de la homeostasia celular y la consecuente disminución de las tasas de proliferación de los protocormos.
A pesar de que con 30 y 45 g/L de sacarosa se obtuvieron mejores respuestas proliferativas que las obtenidas con 0 y 60 g/L, la prueba de Newman-Keuls indicó que no hubo diferencia significativa entre las mismas (figura 2). De forma similar a como se presentó con la concentración de 60 g/L, con 30 y 45 g/L de sacarosa se obtuvieron tasas de multiplicación menores que las registradas por Park et al. (2002). Sin embargo, vale la pena anotar que, a diferencia de los resultados obtenidos con 45 g/L de sacarosa tanto en la presente investigación como en la de Park et al. (2002), Park et al. (2000) reportaron una multiplicación masiva de PLBs a esta concentración, utilizando un biorreactor como sistema de inmersión temporal.
No obstante, de acuerdo con la prueba de Newman-Keuls, solo con 15 g/L de sacarosa se obtuvo una diferencia significativa respecto a las demás (figura 2), a diferencia de los resultados obtenidos por Park et al. (2002), pero que coincide con la mayoría de autores que trabajaron con una concentración similar de sacarosa de 20 g/L (Arditti y Ernest, 1993; Chen et al., 2000; Parket al., 1996; Tokuharay Mii, 2001). Es importante recordar que el resultado obtenido a esta concentración se dio a una frecuencia de inmersión de cuatro horas.
Cabe resaltar que en ensayos previos a esta investigación no se obtuvieron tasas de multiplicación de protocormos de Phalaenopsis, en medios de cultivo sólido con 0, 15, 30, 45 y 60 g/L de sacarosa, bajo las mismas condiciones de cultivo in vitro (datos no publicados).
Tiempo y frecuencia de inmersión. A pesar de que el tiempo y la frecuencia de inmersión reportados para la propagación in vitro de Phalaenopsis fueron de cinco minutos y dos horas respectivamente (Park et al., 2000), Etienne y Berthouly (2002) mencionan que para evitar la vitrificación de varias especies deben usarse tiempos cortos y frecuencias espaciadas de inmersión, ya que el contacto continuo de los tejidos con el medio de cultivo líquido es fuente de hiperhidratación. Además, Phalaenopsis es una orquídea que no debe ser humedecida en exceso (Rittershausen y Rittershausen, 2004). Como se mencionó antes, solamente con un tiempo de
|
inmersión de un minuto cada cuatro horas y con 15 g/L de sacarosa se obtuvo una diferencia significativa respecto a los demás tratamientos.
Interacción entre la concentración de sacarosa y las frecuencias de inmersión. De acuerdo con la tabla 2, las frecuencias de inmersión asociadas a las concentraciones de sacarosa en el medio líquido son factores vitales para obtener altas tasas de multiplicación de Phalaenopsis, utilizando los sistemas de inmersión temporal "RITA". Probablemente con 15 g/L de sacarosa y una frecuencia de inmersión de ocho horas, se dio un lapso de tiempo entre inmersiones demasiado espaciado, que no permitió lograr un contacto efectivo entre el medio líquido y los protocormos, como para darse una respuesta proliferativa similar a la obtenida con la misma concentración de sacarosa, pero a una frecuencia de inmersión de cuatro horas. Incluso a 15 g/L de sacarosa pero con la frecuencia de inmersión de ocho horas, se obtuvo una tasa media de multiplicación aun menor que con las obtenidas a 30 y 45 g/L de sacarosa (con ambas frecuencias de inmersión), pero de igual manera no representa una diferencia significativa comparada con las tasas obtenidas en dichos tratamientos (figura 2).
Vitrificación. Uno de los problemas en los tratamientos fue la vitrificación de algunos de los protocormos adventicios inducidos y de forma similar con ambas frecuencias de inmersión (datos no publicados). Esta condición fisiológica, denominada también hiperhidratación o translucidez, ocurre en los tejidos vegetales que disponen de gran cantidad de agua, como ocurre en los cultivos con medio líquido (Pierik, 1990). De acuerdo con Pierik (1990), el material vegetal joven y tierno es más susceptible a la vitrificación y el grado de translucidez se asocia a muchos factores, como los altos niveles de citoquininas, la deficiencia en el intercambio gaseoso, la baja irradiancia lumínica, las altas temperaturas y la baja concentración de agar o azúcares del medio, entre otros. De hecho, en los tratamientos realizados se encontró que en los medios con menor concentración de sacarosa se dieron los mayores porcentajes de vitrificación (datos no publicados).
Sin embargo, la hiperhidratación que afecta los cultivos en medio líquido puede ser eliminada con los sistemas de inmersión temporal (Etienne y Berthouly, 2002) si el material donde se inoculan los explantes posee una humedad óptima (Park et al.,
|
29
|
|
|
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VII No. 1 Julio 2005 25-31_____________________________
|
|
|
|
|
|
1996) e impide la acumulación de agua por los tejidos (Atehortúa y Valencia, 2002). A pesar de que el tiempo de inmersión fue de un minuto y que los explantes se dispusieron sobre una malla metálica en los RITA® con el fin de evacuar el medio líquido en el menor tiempo posible después de cada inmersión, se observó que en algunos casos, de manera aleatoria, no había una buena evacuación del medio de cultivo alrededor de los protocormos, con lo cual se alteró el tiempo de inmersión real de algunos de ellos; razón por la cual se sugiere el uso de una malla con mayor tamaño de orificios.
Fenolización. Uno de los problemas más comunes que se presentan en el cultivo in vitrode Phalaenopsis es la liberación de compuestos fenólicos por los tejidos y la consecuente oxidación del medio de cultivo (Parket al., 2000), aun con medios líquidos en los cuales es más fácil y rápido diluir los productos tóxicos (Pierik, 1990). Como consecuencia de lo anterior, se debieron realizar cambios de medio al mes de iniciados los tratamientos, pues estos compuestos impiden el crecimiento y desarrollo de los propios tejidos vegetales (Pierik, 1990).
CONCLUSIONES
La multiplicación masiva de protocormos de Phalaenopsis mediante el sistema de inmersión temporal "RITA" involucra una serie de factores que son claves para obtener éxito en su propagación, como la concentración de sacarosa del medio de cultivo y la frecuencia de inmersión. En el presente trabajo se obtuvo que la mejor respuesta proliferativa con 8,2 protocormos adventicios por protocormo por mes, se dio con 15 g/L de sacarosa y un tiempo de inmersión de un minuto cada cuatro horas. De esta manera se concluye que la interacción entre estos factores es fundamental para lograr altas tasas de multiplicación. Es igualmente importante tener en cuenta la porosidad del material sobre el cual se disponen los protocormos, con el fin de evitar la vitrificación y fenolización de los tejidos.
Sin embargo, y a pesar de que el interés de los cultivadores de Phalaenopsis es propagarlas vegetativamente para conservar las características morfológicas deseadas y evitar la alta variabilidad genética al reproducirlas sexualmente, se decidió trabajar con semillas por la posibilidad de adquirirlas en cantidad suficiente y la facilidad de obtener protocormos después de su germinación. De esta manera, lo que
|
se pretendió al trabajar con protocormos fue dar un paso hacia la estandarización de un protocolo para la propagación in vitro de Phalaenopsis vía sistemas de inmersión temporal, para luego desarrollar y estandarizar un protocolo de propagación a partir de meristemos bajo este mismo sistema; objetivo hacia el cual se dirige nuestra investigación.
AGRADECIMIENTOS
Al ingeniero Francisco Villegas, gerente de Orquifo-llajes Ltda., por la donación de las semillas de Phalaenopsis y el medio sólido para su cultivo. Al profesor Carlos Fernández, docente de la Escuela de Ingeniería de Antioquia, por el desarrollo del diseño experimental. Al profesor Abel Díaz, docente de la Universidad de Antioquia, por el análisis estadístico. Al Laboratorio de Biotecnología Vegetal del Instituto de Biología de la Universidad de Antioquia, por el soporte logístico, técnico y financiero.
BIBLIOGRAFÍA
Arditti, J.; Ernest, R. 1993. Micropropagation oforchids. New York: John Wiley & Sons, Inc., p. 682.
Atehortúa, L.; Valencia, C. 2002. Bioconversión de embriones somáticos de Heliconia stricta Huber utilizando los sistemas de inmersión temporal "Rita". Actual Biol. 24 (76): 23-29.
Chen, Y. C.; Chang, C; Chang, W. C. 2000. A reliable protocol for plant regeneration from callus culture of Phalaenopsis. In Vitro Cell Dev Biol-Plant. 36 (5): 420-423.
Escobar, R.; Múnera, J. M. 1990. Orquídeas nativas de Colombia. Medellín: Colina, p. 139.
Etienne, H.; Berthouly, M. 2002. Temporary immersion systems in plant micropropagation. Plant Cell Tissue Organ Cult. 69 (3): 215-231.
Ishii, Y.; Takamura, T.; Goi, M.; Tanaka, M. 1998. Callus in-duction and somatic embriogenesis of Phalaenopsis. Plant Cell Rep. 17 (6-7): 446-450.
Islam, O.; Ichihashi, S. 1999. Effects of sucrose, maltose and sorbitol on callus growth and plantlet regeneration in Phalaenopsis, Doritaenopsis and Neofinetia. J Japan SocHortSci. 68 (6): 1124-1131.
Jiménez, V.; Guevara, E. 1996. Propagación in vitro de Phalaenopsis (Orchidaceae) mediante el cultivo de secciones de ejes florales después de la senescencia de las flores. Agronomía Costarricense. 20 (1): 75-79.
Kobayashi, M.; Komatuda, M.; Yonai, S. 1990. Studies on the vegetative propagation of Phalaenopsis through root-tip culture. En: Islam, O.; Ichihashi, S. 1999. Effects of sucrose, maltose and sorbitol on callus growth and plantlet regeneration in Phalaenopsis, Doritaenopsis and Neofinetia. J Japan Soc Hort Sci. 68 (6): 1124-1131.
|
|
|
|
|
30
|
|
|
____________________PROPAGACIÓN IN VITRO DE Phalaenopsis (ORCHIDACEAE) A PARTIR DE PROTOCORMOS
|
|
|
|
|
|
Park, S. Y.; Kakuta, S.; Kano, A.; Okabe, M. 1996. Efficient propagation of protocorm-like bodies of Phalaenopsis in liquid medium. Plant Cell Tissue Organ Cult. 45 (1): 79-85.
Park, S. Y.; Murthy, H. N.; Paek, K. Y. 2000. Mass multiplica-tion of protocorm-like bodies using bioreactor system and subsequent plant regeneration in Phalaenopsis. Plant Cell Tissue Organ Cult. 63 (1): 67-72.
Park, S. Y.; Murthy, H. N.; Paek, K. Y. 2002. Rapid propagation of Phalaenopsis from floral stalk-derived leaves. In Vitro Cell Dev Biol.-Plant. 38 (2): 168-172.
Pierik, R. L. 1990. Cultivo in vitro de las plantas superiores. Madrid: Mundi-Prensa, p. 301.
|
Rittershausen, B.; Rittershausen, W. 2004. Growing orchids. London: Southwater, p. 256.
Roca, W.; Mroginski, L. 1993. Cultivo de tejidos en la agricultura. Cali: CIAT, p. 969.
Tanaka, M.; Senda, Y.; Hasegawa, A. 1976. Plantletformation by root tip culture in Phalaenopsis. En: Islam, O.; Ichihashi, S. 1999. Effects of sucrose, maltose and sor-bitol on callus growth and plantlet regeneration in Phalaenopsis, Doritaenopsis and Neofinetia. J Japan Soc Hort Sci. 68 (6): 1124-1131.
Tokuhara, K.; Mii, M. 2001. Induction of embriogenic callus and cell suspension culture from shoot tips excised from flower stalk buds of Phalaenopsis (Orchidaceae). In Vitro Cell Dev Biol-Plant. 37 (4): 457-461.
|
31
|
|
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2005 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).