Publicado
ZOOPLANCTON (ROTIFERA Y MICROCRUSTACEA) Y SU RELACIÓN CON LOS CAMBIOS DEL NIVEL DEL AGUA EN LA CIÉNAGA DE AYAPEL, CÓRDOBA, COLOMBIA
Zooplankton (Rotifera and Microcrustacea) and its relationship with the
level water changes in Ayapel floodplain lake (Córdoba) Colombia
LINA JULIANA GALLO-SÁNCHEZ
NÉSTOR JAIME AGUIRRE-RAMÍREZ
JAIME ALBERTO PALACIO-BAENA
JOHN JAIRO RAMÍREZ-RESTREPO
Sede de Investigaciones Universitarias (SIU), Grupo de Investigación
en Gestión y Modelación Ambiental (GAIA), Universidad de Antioquia,
Apartado 1226, Medellín, Colombia. julianaga2003@yahoo.com
Departamento de Ingeniería Sanitaria y Ambiental, Grupo de Investigación en Gestión y Modelación Ambiental (GAIA), Universidad de Antioquia, Apartado 1226, Medellín, Colombia. naguirre@jaibana.udea.edu.co; japalaci@jaibana.udea.edu.co
Instituto de Biología, Grupo de Limnología Básica
y Experimental (LinmoBase), Universidad de Antioquia, Apartado 1226, Medellín,
Colombia. johnra77@yahoo.com
RESUMEN
Entre septiembre de 2004 y junio de 2005 se estudió la relación entre la estructura del zooplancton y los cambios en el nivel del agua en la Ciénaga de Ayapel (Córdoba, Colombia) en once estaciones y seis muestreos. Mientras los rotíferos dominaron la riqueza de especies, los copépodos presentaron mayores abundancias representados principalmente por nauplios y copepoditos. A pesar de que la densidad de zooplancton no presentó diferencias estadísticamente significativas en el espacio ni en el tiempo, se encontró un aumento en la densidad del zooplancton durante la fase de llenado de la ciénaga.
Palabras clave. Zooplancton, Estructura, Ciénaga.
ABSTRACT
The relationship between zooplankton structure and changes in the water level was studied between September 2004 and June 2005 in eleven sampling stations in the Ayapel floodplain lake (Córdoba, Colombia). The rotifers were the zooplankton group with the highest number of species while the copepods, represented principally by nauplii and copepodites, were the most abundant. Zooplankton density did not show statistically significant differences in the space nor in the time; however, it increased during the floodplain lake`s filling up phase.
Key words. Zooplankton, Structure, Floodplain lake.
Recibido: 25/04/2008
Aceptado: 14/02/2009
INTRODUCCIÓN
Las ciénagas son ecosistemas estratégicos ecológica y socialmente, debido a que son ambientes adecuados para el establecimiento de agrupaciones y comunidades biológicas de significado para la pesca y actúan en la regulación hídrica de las aguas superficiales. Los sistemas naturales cenagosos constituyen la base para el sustento de un alto porcentaje de la población humana ubicada en las áreas de influencia directa (Arias 1985). Son consideradas áreas de almacenamiento de sedimentos, materiales orgánicos y nutrientes. Sus planos de inundación son ambientes que soportan actividades pesqueras importantes (Goulding 1980) son sitios de desove y de cría para numerosas especies debido a su gran diversidad de hábitat, a la oferta significativa de alimento como el zooplancton (Goulding 1980, Lowe-McConnel 1987). El zooplancton constituye uno de los primeros eslabones en la cadena alimenticia acuática y participa activamente en la transferencia de energía y en los ciclos de nutrientes (Lehman 1980, Esteves 1988, Chappaz et al. 1999). Consecuentemente, estos organismos se consideran recursos biológicos potenciales ya que son fuente de alimento para larvas de peces y adultos (peces planctófagos) lo que se traduce en un alto valor ecológico.
En Colombia hay más de 7000 km2 en ciénagas permanentes, en especial en los ríos Magdalena, Cauca, Sinú, Arauca y San Jorge, cuyo plano inundable presenta algunos sistemas lagunares asociados, entre los cuales se destaca la Ciénaga de Ayapel que es un subsistema inmerso en el paisaje general de la llanura de inundación del río San Jorge, en interacción con el río y su cuenca vertiente (Márquez 2004). El zooplancton en la Ciénaga de Ayapel ha sido estudiado por Anónimo 2 (1989), Anónimo 3 (1990), Aguirre et al. (2005).
En este estudio se pretende establecer el comportamiento espacial y temporal de la estructura del zooplancton con respecto a las fluctuaciones en el nivel del agua y de algunas variables físicas, químicas y biológicas, en diferentes niveles limnimétricos de la Ciénaga de Ayapel en once estaciones de muestreo.
MATERIALES Y MÉTODOS
Descripción de área. La Ciénaga de Ayapel se localiza en el Municipio de Ayapel, departamento de Córdoba a 8º 2 Norte y 75º 5 Oeste. En época de aguas altas tiene una extensión aproximada de 106.4 Km2, se alimenta de caudales de creciente del río San Jorge y de los caños Grande, Barro y Muñoz, entre otros, y ocasionalmente, del río Cauca. Su principal nexo hidrológico con el río San Jorge es a través de caño Grande, en el cual hay flujos bidireccionales. Este sistema se ubica en una zona de bosque húmedo tropical, con una época de lluvias de abril a noviembre y una época seca de diciembre a marzo. El promedio anual de lluvia fluctúa entre 2000 y 2500 mm. La temperatura ambiente alcanza valores mayores a 25 ºC en época seca (Anónimo 1 1986).
Se eligieron once estaciones de muestreo, cinco en la zona limnética (comprendieron el eje central de la ciénaga) y seis en la boca de los principales caños (Tabla 1 y Fig. 1) en seis momentos diferentes del nivel de agua de la Ciénaga: aguas altas en ascenso, aguas altas, aguas bajas en descenso, aguas bajas, aguas bajas en ascenso y aguas en ascenso. En marzo de 2005 no se muestreo en las estaciones 9 y 10 debido a dificultades en el acceso.


Muestreo de variables físicas y químicas. En cada estación
se tomaron muestras de agua con una botella tipo Kemmerer de 1.5 litros, registrando
in situ la concentración de oxígeno disuelto por medio de un oxímetro
modelo WTW. 300/Set, el pH mediante un medidor de pH modelo WTW. 330/Set-1,
la conductividad eléctrica con un conductímetro WTW 300/Set y
la transparencia del agua con un disco de Secchi. Las concentraciones de nitratos
(NO-3) y ortofosfatos (PO-34) fueron medidas en el laboratorio con un espectrofotómetro
Spectroquant Nova 60 modelo KGaA 62293. Los sólidos totales y suspendidos
se cuantificaron por gravimetría (Anónimo 4 1992).
Muestreo del zooplancton. Con una botella Schindler de cinco litros se tomaron
muestras integradas de zooplancton, filtrando cuidadosamente en un cernidor
de 72 µm el contenido proveniente de la subsuperficie, 50% I0y 1% I0,
mitad de la profundidad total y antes del fondo para un volumen de 25 litros.
De la muestra filtrada se almacenaron 50 ml en envases plásticos, su
contenido fue fijado adicionando 5 ml de formalina al 37% para una dilución
al 4%.
Análisis de laboratorio. La determinación de los zoopláncteres se realizó empleando las referencias de Ruttner-Kolisko (1974), Koste (1978), Sendacz & Kubo (1982), Koste & Shiel (1987), De Paggi & Paggi (1995), Elmoor-Loureiro (1997) y Flößner (2000). La determinación de los estadios larvales de los copépodos (nauplios y copepoditos) no se efectuó más allá del nivel de orden (Calanoida y Cyclopoida). Los conteos se realizaron en una cámara Sedgwick- Rafter de 1 ml y se observaron bajo un microscopio invertido Leica DMIN. La densidad de zooplancton (ind./l) se estimó siguiendo la metodología propuesta por Wetzel & Likens (2000).
Análisis de la información. Para establecer la existencia de diferencias significativas de las variables físicas, químicas y biológicas (densidad) entre ambientes (zona pelágica y boca de los caños) se realizó un análisis de varianza (ANOVA). Los contrastes entre los muestreos y las interacciones de estas variables se efectuaron mediante un análisis multivariado de varianza para medidas repetidas en el tiempo (MANOVA). Para conocer la similitud entre estaciones y muestreos se aplicó un análisis de agrupamiento utilizando la distancia euclidiana y el agrupamiento completo; para ello se trabajó con las abundancias absolutas transformadas con raíz cuadrada. Para determinar la estructura del zooplancton en cada estación y periodo de muestreo se calculó la riqueza numérica de especies, el índice de diversidad de Shannon & Wiener (1949), la Equidad (Pielou 1969) y la Dominancia (Simpson 1949). El número de especies esperado fue estimado con base los estimadores de riqueza Chao 2 y Jack-knife 1.
Para estimar la asociación entre los taxones zooplanctónicos y los descriptores de la comunidad y las variables físicas, químicas y biológicas medidas, se efectuó un análisis de redundancia canónica (RDA) ya que la longitud del gradiente fue inferior a 2.5 (Braak 1985). Previo a este análisis y con el fin de reducir la dimensión de las matrices físicas y químicas (12 filas x 64 columnas) como biológicas (74 filas x 64 columnas) y determinar interdependencia entre variables se realizó un análisis por Componentes Principales (PCA) y se seleccionaron las variables que presentaran coeficiente de correlación mayor a 0.6. En ambos análisis la información de las variables físicas, químicas y biológicas fue estandarizada, centrada (xi-x) y transformada a su forma logarítmica (log xi) para homogenizar varianza. Estos análisis se realizaron con el programa Canoco 4.5 para Windows. Para este análisis las densidades de fitoplancton fueron proporcionadas por Hernández (2006) quien trabajo en el mismo periodo de estudio.
RESULTADOS
Características físicas y químicas. El análisis de varianza no mostró diferencias significativas de las variables físicas y químicas entre las estaciones localizadas en la zona pelágica y las bocas de los caños (Tabla 2). En forma similar, el MANOVA no mostró interacción entre muestreos y ambientes (aguas abiertas y bocas de los caños; Tabla 2), pero si mostró diferencias significativas entre muestreos de variables como la transparencia, la profundidad total, sólidos totales, pH, nitratos y ortofosfatos (Tabla 2).

En la Tabla 3 se presentan las medias aritméticas, el coeficiente de variación y los valores máximos y mínimos de cada variable.
Estructura del zooplancton. En la Tabla 4 se presenta la densidad total (ind./l) de los diferentes morfotipos de zooplancton y la desviación estándar. Los nauplios de copépodos (calanoides y ciclopoides) con una densidad promedio de 32.04 ind./l fueron los más frecuentes y abundante durante el estudio.

También fueron importantes en densidad y frecuencia el cladócero Moina minuta (9.,03 ind./l), el rotífero Brachionus caudatus var. personatus (8.67 ind./l), los copepoditos de Cyclopoida (5.90 ind./l), el rotífero Brachionus calyciflorus (5.42 ind./l) y los copepoditos de Calanoida (4.96 ind./l) (Fig. 2).

Como se deduce de la Fig. 2, el número de los morfotipos más abundantes fue reducido en comparación con los morfotipos de abundancia intermedia en concordancia con el ajuste de las abundancias del zooplancton al modelo de la serie logarítmica (?2= 1.11, g.l= 5, P < 0.05).
Distribución espacial y temporal. De acuerdo al análisis de varianza no se presentaron diferencias significativas en la densidad del zooplancton entre las estaciones de aguas abiertas y las bocas de los caños (a = 0.7195). El análisis de agrupamiento para las estaciones mostró una similitud superior al 87%. La traza de Pillai-Bartlett no mostró diferencias estadísticamente significativas entre muestreos (a = 0.3326). Los resultados del cluster indican un agrupamiento general importante superior al 77% (Fig. 3C). No obstante los muestreos con densidades promedio más altas que corresponden al inicio del ascenso del nivel del agua en abril (112.98 ind./l) y en junio (188.34 ind./l) tendieron a formar grupos diferentes (Fig. 3A). Por el contrario, las densidades promedio más bajas se encontraron en los periodos de aguas altas en ascenso en septiembre (52.98 ind./l) y aguas altas en noviembre (66.08 ind./l).

Descriptores de diversidad. Los estimadores de riqueza Chao 2 y Jack-Knife 1, sugieren que el número de especies esperado para el zooplancton es de 83.30 y 84.20 taxones respectivamente. Estas cifras son cercanas a la riqueza observada (71 taxones) e indican que durante el estudio se obtuvo una muestra representativa del zooplancton de la Ciénaga de Ayapel.
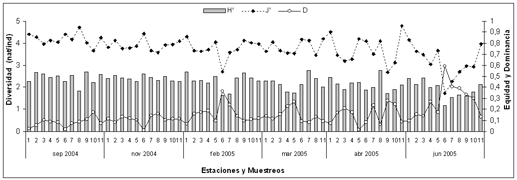
Como se observa en la Fig. 4, la diversidad, la equidad y la riqueza numérica de especies fluctuaron en un rango estrecho en el tiempo, con valores medios de diversidad intermedio (2.22 nat/ind), de Equidad alto (0.75) y dominancia bajo (0.15).
Asociación del zooplancton con las variables físicas, químicas y biológicas. Para el análisis de redundancia se retuvieron los dos primeros ejes, lo que significa que la variabilidad en la distribución de la densidad de algunos taxones zooplanctónicos es explicada por algunas de las variables físicas, químicas y biológicas con un 91.7% de bondad de ajuste.
Como se evidencia en la Fig. 5 el oxígeno disuelto y el fitoplancton presentaron una mayor variabilidad explicada en el eje uno (78.3%). De igual forma, pero en sentido contrario, la variabilidad en el nivel del agua fue explicada en este eje. En el eje dos estuvo explicado el 13.4 % de la variabilidad de los sólidos suspendidos y ortofosfatos. Los rotíferos Polyarthra sp. y Testudinella patina, el cladócero M. minuta y los nauplios y copepoditos de Copépodos presentaron correlaciones muy bajas con los ejes canónicos de ahí que se agruparon muy cerca del centro. Sin embargo, los rotífero B. caudatus y B. calyciflorus se asociaron con altos valores de oxígeno disuelto y fitoplancton, el cual se encuentra dominado en densidad por las especies Cylindrospermopsis raciborskii y Lyngbya cf. limnetica representantes de la división Cianoprocarionta de ahí que conformaron un grupo (Hernández 2006).

DISCUSIÓN
En concordancia con los resultados de estudios previos a esta investigación
realizados por Eco Estudios (1989), CIA (1990) y Aguirre et al. (2005) no se
encontraron diferencias importantes en las variables físicas y químicas
entre las estaciones ubicadas en el eje principal de la ciénaga y las
bocas de los caños en la Ciénaga de Ayapel.
Las concentraciones de los sólidos totales en la ciénaga se mantuvieron
en el rango normal para la mayoría de lagos Neotropicales. El efecto
del viento sobre la columna de agua y el predominio de sedimentos inorgánicos
poco demandantes de oxígeno favorecen altas concentraciones de oxígeno
en la Ciénaga de Ayapel (Aguirre et al. 2005). La reducción en
la concentración de oxígeno disuelto en los planos inundables
en aguas altas ha sido descrita por Welcomme (1992) y Schmidt (1972) para áreas
con amplias zonas de inundación. La concentración de nitratos
se mantuvo en niveles típicos de sistemas con cargas bajas e intermedias
de nutrientes, es decir inferiores a 2 mg/l de nitrato (Bartram & Ballance
1996, Chapman 1996, Volleweider 1968). Para el periodo de estudio la concentración
media de ortofosfatos fue alta y fluctuó entre 0.18 y 0.85 mg/l.
Exceptuando los sólidos suspendidos y la conductividad eléctrica, las variables físicas y químicas presentaron diferencias estadísticamente significativas asociadas al nivel de agua de la ciénaga. Los valores promedios de estas variables sólidos totales, dureza de agua y el oxígeno disuelto y de los nutrientes fueron más bajos durante septiembre y noviembre en parte como consecuencia de la dilución causada por el aumento del nivel del agua. En los muestreos de aguas bajas (febrero, marzo) y de transición (abril, junio) los valores medios de las variables antes mencionadas fueron altos debidos posiblemente a la resuspensión de sedimentos como consecuencia de un efecto de turbulencia del viento sobre la reducida columna de agua favoreciendo el incremento de los valores medios de las variables físicas y químicas. Según Tundisi (1994) las fluctuaciones en el nivel del agua en lagos, ciénagas, pequeños ríos y canales son responsables de los cambios temporales en las concentraciones de nutrientes y materia orgánica, en estos ambientes.
El zooplancton de la Ciénaga de Ayapel presentó una riqueza de especies alta (71 taxones) en relación con el estudio de Gavilán-Díaz (2000) en la Ciénaga de Paredes (48 taxones), en la Ciénaga el Llanito (66 taxones) y en la Ciénaga Chucurí (45 taxones). El 70% de la riqueza numérica de especies estuvo constituido por los rotíferos. Resultados similares han sido reportado para otros ambientes lénticos en Sur América por Robertson & Hardy (1984), Vásquez & Rey (1989, 1992), Paggi & De Paggi (1990), Lansac-Tôha et al. (1993) e Ibañez (2000). Dentro de este grupo, una gran mayoría de los taxones correspondieron a los géneros Brachionus y Lecane, típicos de las asociaciones zooplanctónicas tropicales (Fernando 1980). La preponderancia de género Brachionus en Ayapel, coincide con los resultados de Caravalho (1983) y Gavilán-Díaz (2000). Las especies B. caudatus var. personatus, B. calyciflorus, Conochilus. cf. dossuarius y Brachionus dolobratus fueron los más frecuentes y abundantes. Los rotíferos tienen gran relevancia ecológica, pues son filtradores de detritos, bacterias y algas filamentosas. La alta tasa de renovación poblacional de estos organismos los convierte en elementos importantes en el flujo de energía y en el ciclaje de nutrientes (Esteves 1998).
Otra característica importante de los rotíferos es su alta tolerancia a fluctuaciones en las condiciones ambientales (Allan 1976, Robertson & Hardy 1984) si se considera que el tiempo de residencia del agua en la Ciénaga de Ayapel es bajo, las poblaciones de especies pequeñas, ciclo de vida corto y tolerantes a los cambios ambientales frecuentes, como los rotíferos se podrían favorecer (Neves et al. 2003).
M. minuta se caracteriza por su presencia en sistemas inundables y por su endemismo neotropical (Acosta 2005) y ha sido reportada como organismo dominante en planos de inundación del Neotrópico por Pinto-Coelho (1987), Rey & Vásquez (1988), Sampaio et al. (2002). La dominancia de formas larvales de copépodos ha sido descrita en algunos planos de inundación por Caravalho (1983), Corrales y Frutos (1985), Paggi & De Paggi (1990), Vásquez & Rey (1992), Lima (1996) y Gavilán-Díaz (2000). De acuerdo con Edmondson (1959), la alta proporción de formas inmaduras de copépodos es generalmente el resultado de la reproducción continua de estos organismos con solapamiento de cohortes en regiones tropicales. Un factor que podría estar determinando la proporción de formas jóvenes y adultas, podría ser un mecanismo de conservación poblacional ante las fluctuaciones ambientales que activan eventos reproductivos. En general, la importancia de estos organismos en la ciénaga puede ser el resultado de un proceso adaptativo ante un ambiente fluctuante, con un bajo tiempo de retención hidráulico y variaciones en el nivel del agua.
Al igual que para las variables físicas y químicas, tampoco se encontraron diferencias significativas espaciales en la densidad del zooplancton en la Ciénaga de Ayapel, debido posiblemente a que el bajo tiempo de retención del agua evita la consolidación de diferencias en la composición y densidad del zooplancton. Los altos valores de equidad son el resultado de la codominancia de morfotipos como nauplios, copepoditos, M. minuta, B. caudatus var. personatus, B. calyciflorus y Conochilus. cf. dossuarius, entre otros. La uniformidad especial en las características del zooplancton en la Ciénaga de Ayapel fue reportada también en estudios realizados por el CIA (1990) y por Aguirre et al. (2005).
Aunque no se encontraron cambios temporales estadísticamente significativos en la densidad de zooplancton las más altas densidades se observaron en los períodos de abril y junio durante el aumento de la conectividad entre la ciénaga y su tributario. Esta situación coincidió con un incremento en la frecuencia y densidad de los géneros de hábitos litoral o bentónico Alona, Chydorus, Macrothrix e Ilyocriptus y podría ser el resultado de un fenómeno de "deriva" del zooplancton proveniente del sistema cenagoso periférico. De acuerdo con Hynes (1970) estos géneros son frecuentes en el plancton fluvial y su presencia en la ciénaga indica intercambio de fauna entre los ambientes lóticos y lénticos, así como entre los compartimientos litoral y pelágico (Bonecker & Lansac-Tôha 1996). El aumento en densidad del zooplancton en todas las estaciones de muestreo, especialmente en junio apoya esta hipótesis.
De acuerdo con la teoría de Junk & Wantzen (2004), puede afirmarse que en el periodo de expansión de la Ciénaga de Ayapel y como resultado de los aportes de los caños se generan un conjunto de procesos esenciales en el sistema río-caños-ciénagas como la entrada de sustancias disueltas o suspendidas, orgánicas e inorgánicas acompañados por diferentes tipos de biota. Altas densidades de zooplancton en la fase de inundación en dos lagunas de inundación del río Caura en Venezuela fueron relacionadas por Godoy & Reverol (2005) por la entrada de nutrientes provenientes de la planicie de inundación. Sin embargo, en planicies de inundación se han encontrado las máximas densidades del plancton durante el periodo de aguas bajas con poco o ningún intercambio con el río (Egborge 1974, Rodríguez 1980, Matsumura-Tundisi & Ocano 1983, Vásquez & Sánchez 1984, Twombly & Lewis 1987 y Vásquez & Rey 1992).
Las densidades más bajas de zooplancton en la Ciénaga de Ayapel se presentaron en aguas altas (septiembre y noviembre) posiblemente como consecuencia de un efecto dilución y del bajo tiempo de retención del agua. Resultados similares han sido reportados para planicies de inundación por Egborge (1974), Brandorff & Andrade (1978), Matsumura-Tundisi & Ocano (1983), Vásquez & Sánchez (1984), Twombly & Lewis (1987), Vásquez & Rey (1992) y Godoy & Reverol (2005).
La Ciénaga de Ayapel presentó homogeneidad espacial de las variables
fisicoquímicas y de la estructura del zooplancton. En el tiempo, las
condiciones físicas y químicas del agua de la Ciénaga parecieron
responder a los aportes variables de agua. Durante el periodo de aguas altas
se reducen las concentraciones de sólidos suspendidos y totales y de
nutrientes con el consecuente aumento de la transparencia. En contraste cuando
el nivel del agua es bajo se incrementan los valores de estas variables y disminuye
la transparencia.
Las bajas correlaciones presentadas por M. minuta y por los nauplios y copepoditos
de Copépodos con las variables físicas, químicas y biológicas
pueden indicar que existen otros factores como por ejemplo el tiempo de retención
del agua que pueden estar influyendo en la distribución y estructura
de estos organismos. La alta asociación entre los rotíferos B.
caudatus y B. calyciflorus con el oxígeno disuelto y el fitoplancton
dominado principalmente por la cianofícea C. raciborskii pueden indicar
el pastoreo por parte de los rotíferos en su condición de filtradores
poco selectivos sobre C. raciborskii (Fabbro & Duivenvoorden 1996) ante
la baja oferta trófica por parte del fitoplancton en Ayapel (Hernández
2006).
CONCLUSIONES
Durante el periodo de estudio las variables físicas y químicas no presentaron una variación espacial significativa. En el tiempo respondieron a las fluctuaciones del nivel del agua en la Ciénaga.
Los morfotipos más abundantes y frecuentes del zooplancton en la Ciénaga fueron en su mayoría formas pequeñas como los rotíferos B. caudatus var. personatus, B. calyciflorus, el cladócero M. minuta y los estadios larvales de copépodos (nauplios y copepoditos) que puede ser el resultado de un proceso adaptativo ante un ambiente fluctuante, con un corto tiempo de retención, y fluctuaciones de las condiciones físicas y químicas en respuesta a cambios en el nivel del agua como ocurre en la Ciénaga de Ayapel.
Aunque la densidad del zooplancton no presentó variaciones temporales
significativas se observó un aumento importante de la densidad al inicio
del periodo de lluvias (junio-aguas en ascenso) debido posiblemente al reestablecimiento
de la conexión entre el cuerpo de agua principal, las ciénagas
satélites y los caños afluentes.
Como lo indicó el análisis de redundancia se encontró una
asociación directa entre los rotíferos B. caudatus y B. calyciflorus
con el oxígeno disuelto y el fitoplancton e inversa con el nivel del
agua, el resto del zooplancton pareció no responder directamente a las
fluctuaciones de las variables físicas, químicas y biológicas
estudiadas.
AGRADECIMIENTOS
Los autores manifiestan sus más sinceros agradecimientos a COLCIENCIAS, a CORPOAYAPEL y al grupo de investigación GAIA de la Universidad de Antioquia.
LITERATURA CITADA
1. ACOSTA, F. 2005. Caracterización del zooplancton de lagunas en la
llanura inundable del río Ichilo (Cochabamba-Bolivia). Revista Boliviana
de Ecología 17: 01-14.
2. AGUIRRE, N.J., J. A. PALACIO, M.T. FLÓREZ, A. WILLS, O. CAICEDO, L.F.
JIMÉNEZ, N.E. VILLEGAS, H. GRAJALES & C. PALACIO. 2005. Análisis
de la relación río-ciénaga y su efecto sobre la producción
pesquera en el Sistema Cenagoso de Ayapel, Colombia. Informe final del proyecto
COLCIENCIAS. Grupo de Investigación en Gestión y Modelación
Ambiental GAIA. Facultad de Ingeniería. Universidad de Antioquia, Medellín.
3. ALLAN, J.D. 1976. Life history patterns in zooplankton. The American Naturalist
110: 165-180.
4. ANÓNIMO 1. 1986. Estudio general de suelos de los municipios de Ayapel,
Buenavista, Planeta Rica y Pueblo Nuevo (Departamento de Córdoba). Instituto
geográfico "Agustín Codazzi". Subdirección Agrológica.
Bogotá.
5. ANÓNIMO 2. 1989. Estudio del manejo integral de la Ciénaga
Ayapel. Córdoba. Eco Estudios, CVS (Corporación Autónoma
Regional de los valles del Sinú y del San Jorge), Montería.
6. ANÓNIMO 3. 1990. Estudio de Impacto Ambiental por minería en
la Ciénaga Ayapel. Volumen III. Informe Proyecto. Centro de Investigaciones
(CIA) - Corporación Autónoma regional de los valles del Sinú
y del San Jorge (CVS). Universidad de Antioquia, Medellín.
7. ANÓNIMO 4. 1992. Standard Methods for the Examination of Water and
Wastewater Nº 2540. APHA, Washington, D.C.
8. BARTRAM, J. & R. BALANCE. 1996. Water quality monitoring: a practical
guide to the design and implementation of freshwater quality studies and monitoring
programmes. UNEP y WHO. Londres.
9. BONECKER, C.C. & F.A. LANSAC-TÔHA. 1996. Community structure of
rotifers in two environments of the high River Paraná floodplain (MS),
Brazil. Hydrobiologia 325: 137-150.
10. BRANDORFF, G.O. & E.R. ANDRADE. 1978. The relationship between the water
level of the Amazon River and the fate of the zooplankton population in Lago
Jacaretinga, a varzea lake in the Central Amazon. Stud. Neotrop. Fauna Env.
13: 63-70.
11. CARAVALHO, M.L. 1983. Efeitos da flutuacao do nivel da agua sobre a densidade
e composicao do zooplancton em um Lago de varzea da Amazonia, Brasil. Acta Amazonica
13: 15-724.
12. CHAPMAN, D. 1996. Water quality assessments: a guide to the use of biota,
sediments and water in environmental monitoring, 2nd ed, UNESCO, WHO y UNEP,
Londres.
13. CORRALES, M.A. & S.M. FRUTOS. 1985. Estudio preliminar del zooplancton
de la Laguna Sirena (Corrientes Argentina). Phycis (Buenos Aires), Sec. B 43:
43-48.
14. DE PAGGI, S.J. & J.C. PAGGI. 1995. Determinación de la abundancia
y biomasa zooplanctónica. En: Lopretto, E.C & G. Tell (eds) Ecosistemas
de aguas Continentales. Metodología para su estudio. II .(1995) Ediciones
Sur, La Plata.
15. EDMONDSON, W.T. 1959. Freshwater Biology. 2ª ed. John Wiley, Nueva
York.
16. EGBORGE, A.B.M. 1974. The seasonal variation and distribution of phytoplankton
in the river Oshun, Nigéria, Freshwater Biology 4: 177-191.
17. ELMOOR-LOUREIRO, L. 1997. Manual de identificação de Cladóceros
límnicos do Brasil. Editora Universa. Universidad Católica de
Brasilia, Brasil.
18. FLÖ?NER, D. 2000. Die Haplapoda und Cladocera (ohne Bosminidae) Mitteleuropas.
Backhuys Publishers, Leiden.
19. GAVILÁN-DIAZ, R.A. 2000. Limnologia comparativa de tres lagoas Neotropicais
da bacia do Magdalena Medio Santandereano, (Colombia), com enfase no estudo
da diversidade da comunidade zooplanctónica e sua relacao com a dinámica
hidrológica do sistema regional. Tese (Doutorado).Universidade Federal
de São Carlos, São Carlos.
20. GODOY, A.R. & Y.M. REVEROL. 2005. Variación temporal de los copépodos
de dos lagunas de inundación del río Caura, Estado Bolivar, Venezuela.
Universidad del Zulia, Maracaibo, Venezuela. Boletín del Centro de Investigaciones
Biológicas 39: 262 - 276.
21. HERNÁNDEZ, E. 2006. Estructura del fitoplancton agremiación
fitoplanctónica en la Ciénaga de Ayapel en diferentes periodos
del pulso hidrológico. Tesis de Maestría en Ciencias Ambientales.
Corporación Académica Ambiental. Universidad de Antioquia, Medellín.
22. HYNES, H.B. 1970. The ecology of running water. University Toronto Press,Canadá.
23. JUNK, W. J. & K. M. WANTZEN, 2004. The flood pulse concept: New aspects,
approaches, and applications-an update. In Welcomme, R. & T. Petr (eds),
Proceedings of the 2nd Large River Symposium (LARS), Pnom Penh, Cambodia.Bangkok.
RAP Publication.
24. KOSTE W, SHIEL RJ.1987. Rotifera from Australian Inland. Waters II. Epiphanidae
and Brachionidae (Rotifera: Monogonta). Invertebrates Taxonony 7: 949-1021.
25. KOSTE, W. 1978. Rotatoria: Die Rädertiere Mitteleuropas Überordnung
Monogononta. Vol. II. Gebrüder Borntraeger, Berlín.
26. LANSAC-TÔHA, F.A., A.F. LIMA, S.M. THOMAZ & M.V. ROBERTO. 1993.
Zooplancton de uma planície de inundação do río
Paraná. II. Variação sazonal e influencia dos níveis
fluviometricos sobre a comunidade. Acta Limnologica Brasiliensia. 5: 42-55.
27. LIMA, D. 1996. Community structure of the zooplankton and phytoplankton
of Lake Recreio-Barão de Melgaço Pantanal, Mato Grosso. Masters
Thesis, Federal University of São Carlos, São Carlos.
28. MAGURRAN, A.E. 1989. Diversidad ecológica y su medición. Ediciones
Vedrà. Barcelona.
29. MÁRQUEZ, G. 2004. Sistemas ecológicos y sociedad en Colombia.
Universidad Nacional de Colombia. http://encuentro.virtual.unal.edu.co/cursos/IDEA/201061/index.html.
Fecha de consulta: febrero 12 de 2007.
30. MATSUMURA-TUNDISI T &W.Y OCANO. 1983. Seasonal fluctuation of the copepod
population in Lake D. Helvecio (Parque Fore stall do Río Doce, Minas
Gerais-Brazil). Revista Hydrobiología Tropical 16: 35-40.
31. NEVES, J.F., O. ROCHA, K. ROCHE & A.A. PINTO. 2003. Zooplankton community
structure of two marginal lakes of the river Cuiabá (Mato Grosso, Brazil)
with analysis of Rotifera and Cladocera diversity. Braz. J. Biol. 63: 329-343.
32. PAGGI, J.C. & J. DE PAGGI. 1990. Zooplâncton de ambientes lóticos
e lênticos do río Paraná médio. Acta Limnologica
Brasiliensia 3: 685-789.
33. PIELOU, E.C. 1969. An introduction to mathematical ecology. Willey. Nueva
York.
34. REY. J. & E. VÁSQUEZ. 1988. Notas sobre los avances de las investigaciones
de los cladóceros (Crustacea, Cladocera) de la cuenca baja del Orinoco.
Págs. 155-161. Sociedad de Ciencias Naturales La Salle, XLVIII.
35. ROBERTSON, B.A. & E.R. HARDY. 1984. Zooplankton of Amazonian lakes and
rivers. In: Sioli, H. (ed.): The Amazon: Limnology and Landscape ecology of
a Mighty Tropical River and its Basin: 337-352. -Monogr. Biol. 56. - Junk, Dordrecht.
36. RODRÍGUEZ, E.H. 1980. Composiçao do zooplâncton em cinco
lagos da Amazonía Central. Acta Amazónica 10: 577-609.
37. RUTTNER-KOLISKO, A. 1974. Plankton Rotifers. Biology and Taxonomy. E. Schweizerbatsche
Verlagsbuchhandlung (Nägele u. Obermiller) Stuttgart.
38. SAMPAIO, E., O. ROCHA, T. MATSUMURA-TUNDISI & J. G. TUNDISI. 2002. Composition
and abundance of zooplankton in the limnetic zone of seven reservoirs of the
Paranapanema River, Brazil. Brazilian Journal of Biology 62: 525-545.
39. SAMPAIO, E.V.& C.M. LÓPEZ. 2000. Zooplankton community composition
and some limnological aspects of an oxbow lake of the Paraopeba River, São
Francisco River Basin, Minas Gerais, Brazil. Brazilian Archives of Biology and
Technology 43: 285-293.
40. SCHMIDT, G.W. 1972. Seasonal changes in water chemistry of a tropical lake
(Lago do Castanho, Amazonia, South America). Verh. Int.Ver.Theor.Angew.Limnol
18:613-21.
41. SENDACZ, S. & E. KUBO. 1982. Copepoda ( Calanoida e Cylopoida) de reservatorios
do estado de Sao Paulo. B. Inst. Pesca 9 (único): 51-89.
42. SHANNON, C.E. & W. WIENER. 1949. The mathematical theory of communication.
University Illinois Press, Urbana.
43. SIMPSON, E.H. 1949. Measurement of Diversity. Nature 1163: 688.
44. TUNDISI, J.G. 1994. Tropical South America: present and perspectives. pp.
353-416, En: R. Margalef (ed.) Limnology now: a paradigma of planetary programs,
The Netherlands.
45. TWOMBLY, S. & W.M. LEWIS. 1987. Zooplankton abundance and species composition,
laguna La Osinera, a Venezuela floodplain lake. Archives of Hydrobiology 1:
87-107.
46. VÁSQUEZ, E. & J. REY. 1989. A longitudinal study of zooplankton
along the lower Orinoco River and its delta (Venezuela). Annals of Limnology
25: 107-120.
47. VÁSQUEZ E, J. REY. 1992. Composition, abundance and biomass of zooplankton
in Orinoco floodplain lakes, Venezuela. Annals of Limnology 28: 3-18.
48. VÁSQUEZ, E & L. SANCHEZ. 1984. Variación estacional del
plancton en dos sectores del río Orinoco y una laguna de inundación
adyacente. Memoria de la Sociedad de Ciencias Naturales La Salle 4: 11-31.
49. VOLLEWEIDER, R.A. 1968. Scientific Fundamentals of the Eutrophication of
lakes and Flowing waters, with particular referent to Nitrogen and Phosphorus
as factors in Eutrophication. Pág. 192. Paris RE. Orgazation for Economic
cooperation and development. (DAS/CSI/68.27).
50. WELCOMME, R.L.1992. Pesca fluvial. Documento Técnico de Pesca. No.
262. Pág. 303. FAO Roma.
51. WETZEL, R.G. & G.E. LIKENS 2000. Limnological Analyses. 3ª Edición.
Springer Science.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2009 Caldasia

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cual estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).























