Publicado
TASAS DE RECAMBIO FLORÍSTICO DE GÉNEROS EN BOSQUES MONTANOS DEL NEOTRÓPICO
Beta Diversity in Neotropical Mountain Forests
WILSON LÓPEZ GONZÁLEZ
ÁLVARO J. DUQUE M.
Investigador independiente. Carrera 10 No 65-11 apto 402, Bogotá D.C., Colombia. ewlopez@unal.edu.co
Departamento de Ciencias Forestales, Facultad de Ciencias Agropecuarias,
Universidad Nacional de Colombia, sede Medellín, Colombia. ajduque@unal.edu.co
RESUMEN
Se evaluó la tasa de recambio florístico en bosques de alta montaña (por encima de los 1500 m.s.n.m.) al nivel taxonómico de géneros en dos áreas geográficas y su relación con factores espaciales, climáticos y históricos. Las áreas definidas fueron: 1) Colombia, la cual se define para los sitios en este país localizados alrededor del Ecuador geográfico; y 2) Neotrópico: sitios externos a Colombia más distantes del Ecuador geográfico. Las preguntas a responder fueron: ¿Qué tan comparables son las tasas de recambio florístico de géneros en las diferentes áreas geográficas? y ¿Qué tan similares son los factores que controlan la distribución de géneros? La diversidad beta fue diferente según el área geográfica. La variación climática, representada por la precipitación, fue más relevante a escala del neotrópico, mientras que la variación altitudinal lo fue a escala de Colombia. Los patrones de distribución al nivel de género, fueron poco congruentes con los reportados a nivel de especies en bosques montanos del neotrópico, especialmente cuando se consideraron datos cercanos alrededor del Ecuador geográfico en Colombia.
Palabras clave. Bosques montanos, Andes, Neotrópico, composición florística, diversidad beta.
ABSTRACT
We assessed the rates of genera turnover in two geographic areas in montane forests (over 1500 m.a.s.l), and their relationship with climatic, historical and spatial factors. The chosen areas were: 1) Colombia, which contained all places located within this country, around the geographical Equator; and 2) Neotropics: all areas other than Colombia, further from the geographical Equator. The research questions were: How similar are the genera turnover rates between Colombia and the Neotropics? 2) Which factors are controlling the patterns of distribution of genera? Beta diversity varied between Colombia and the Neotropics. Beta diversity increased with the distance from the geographical Equator. Rainfall was the most important factor in the Neotropics while altitude was the most important in Colombia. The distribution patterns of genera did not follow those reported at the species level in in neotropical mountain forests, especially for those sites near to the geographical Equator.
Key words. Beta-diversity, Mountain Forests, Andes, Neotropics, Colombia, Floristic Turnover.
Recibido: 16/07/2009
Aceptado: 15/04/2010
INTRODUCCIÓN
Los bosques montanos han sido reconocidos por su alto nivel de endemismo y por su alto potencial de especiación, debido al aislamiento geográfico producto de la incidencia de barreras físicas asociadas con la variación topográfica (van der Hammen 1996, Latimer et al. 2005). No obstante, existen claras limitaciones técnicas para develar de forma consistente los patrones de distribución y tasas de recambio florístico a nivel de especies, cuando se realizan estudios que emplean información secundaria o proveniente de diferentes grupos de trabajo. En primer lugar, no se sabe simplemente que se está comparando cuando se usan nombres y no ejemplares botánicos para definir la similitud florística entre dos áreas; es muy bien sabido que entre herbarios existen discrepancias en el nivel de curaduría de grupos, lo cual anudado a los posibles sesgos y experticia de la(s) persona(s) a cargo de la identificación, hacen extremadamente subjetiva la definición de especie dentro de este tipo de estudios. En segundo lugar, la necesidad de eliminar todos aquellos individuos que no obtuvieron una clasificación botánica completa (morfoespecies), promueve que especies con posibles rangos de distribución más restringidos sean excluidas de los análisis (Ruokolainen et al. 2002). Tercero, las diferencias en el esfuerzo de muestreo (Chao et al. 2000, 2005 y 2006), el tipo de organismos incluidos (Duque 2004, Duque et al. en preparación) y las dimensiones mínimas de los individuos medidos (López & Duque 2010), dificultan las comparaciones y los análisis. Cuarto, la ausencia de información cuantitativa también influencia el tipo de índice o métrica que puede ser utilizado para evaluar el grado de recambio florístico (Koleff et al. 2003). Todas estas limitaciones, cuestionan incluso algunas de las conclusiones hasta ahora obtenidas en estudios previos que tratan sobre diversidad beta y patrones biogeográficos en ecosistemas tropicales (Luna-Vega et al. 2001, Condit et al. 2002, Duque et al. 2009).
Comparaciones de los patrones de diversidad con base en niveles taxonómicos superiores como género y familia en bosques tropicales de tierras bajas, han mostrado concordancia con los patrones de diversidad alfa (Francis & Currie 2003) y beta (Terborgh & Andersen 1998, Higgins & Ruokolainen 2004, Ter Steege et al. 2006) reportados a nivel de especies. En ecosistemas de montaña en cambio, el debate parece centrarse más bien en la pregunta de que tanto los patrones de distribución responden a cambios continuos o abruptos en relación con la elevación (Hemp 2005). El uso de categorías taxonómicas superiores permite reducir altamente la incertidumbre taxonómica, presentando menos sesgos debidos a las causas mencionadas anteriormente, aunque afectando sin embargo la resolución y los alcances del estudio. Aún así, una menor incertidumbre taxonómica actúa positivamente como un ponderador adecuado cuando lo que se pretende es evaluar la importancia relativa de la historia climática y los factores ambientales que determinan la composición de la flora local de regiones tan distantes, que poseen un muy bajo o nulo traslape florístico a nivel de especies (Kappelle et al. 1992, Boyle 1996, Ter Steege et al. 2006).
La diversidad beta en ecosistemas naturales ha sido asociada con la variación climática (Condit et al. 2005, Engelbrecht et al. 2007), topográfica o edáfica (Tuomisto et al. 1995, 2003) y la limitación en dispersión (Hubbell 2001). Aún así, no existe consenso acerca de cuál de ellos es el proceso de regulación más importante, ni tampoco de la escala espacial a la cual cada uno se hace más relevante (Duivenvoorden et al. 2002, Soininen et al. 2007, Duque et al. 2009). Bajo el modelo de deriva ecológica (Hubbell 2001), se asume que la limitación en dispersión y procesos estocásticos de especiación y extinción determinan patrones de distribución de especies en parches que se yuxtaponen continuamente en el espacio geográfico. Sin embargo, en condiciones de alta variabilidad climática y topográfica, el efecto de la limitación en dispersión es bastante difícil de evaluar (Bush et al. 2004, Davidar et al. 2007). A su vez, factores climáticos como la estacionalidad y el promedio anual de la precipitación han sido identificados como determinantes de la diversidad y la distribución de especies y géneros de plantas en los trópicos (Gentry 1988; Clinebell et al. 1995; Leigh et al. 2004, Ter Steege et al. 2006). De igual manera, se ha propuesto que existe una relación directa entre la variabilidad edáfica y topográfica y la composición florística (Gentry 1988, Tuomisto et al. 1995). En este sentido, lo que se esperaría es que, dentro de una misma región biogeográfica, zonas ambientalmente similares sean también mucho más parecidas en términos de su composición de especies sin importar la distancia entre sí. Lo que la evidencia actual parece demostrar, es que es mucho más determinante la variación climática que la topográfica cuando se consideran escalas geográficas grandes (Clinebell et al. 1995, Condit et al. 2005, Davidar et al. 2007).
El presente estudio busca analizar los patrones de diversidad beta a nivel de géneros en bosques montanos (por encima de los 1.500 msnm), a dos escalas geográficas: 1) sólo sitios ubicados en Colombia; 2) sitios ubicados en un área geográfica mayor desde los Andes del norte (norte del Perú) hasta Centro América (sur de México) sin incluir los sitios en Colombia. El objetivo central es modelar las tasas de recambio florístico de géneros en las dos áreas geográficas antes descritas, y cuantificar su posible relación con factores espaciales, ambientales y biogeográficos. Con respecto al primer factor, se asume que procesos biológicos espacialmente estructurados como la limitación en dispersión pueden ser modelados por medio de las distancias geográficas (véase Tuomisto et al. 2003). En segundo lugar, los factores ambientales en este caso considerados fueron la precipitación y la altitud, siendo el segundo un factor indirecto relacionado principalmente con la temperatura (Davidar et al. 2007). Por último, el componente biogeográfico, aquel donde convergen procesos históricos comunes dentro de regiones geográficas, que se asume ha tenido un efecto directo sobre los procesos de especiación y por tanto en su composición, fueron considerados según Morrone (2001). Se espera por tanto contribuir al conocimiento de la ecología de los bosques montanos con el fin de promover su manejo y conservación.
ÁREA DE ESTUDIO
Se empleó información florística de 19 sitios de bosques de montaña, considerados todos a partir de 1500 msnm y hasta la línea del límite arbóreo. Los sitios incluidos fueron: cuatro sitios en los bosques húmedos del norte del Perú (P1, P2, P3, P4), tres sitios en la cordillera de Mérida en Venezuela (V1, V2, V4), ocho sitios en la cordillera de los Andes en Colombia (C1 a C8), uno en Ecuador (E) y uno en México (M) y dos en Costa Rica (CR1, CR2). Estos sitios comprenden un gradiente latitudinal entre los 7º24' S (norte del Perú) y 17º31'N (Sierra Juárez, México) (Figura 1, Tabla 1).
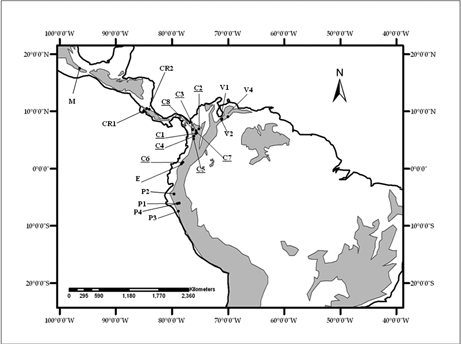
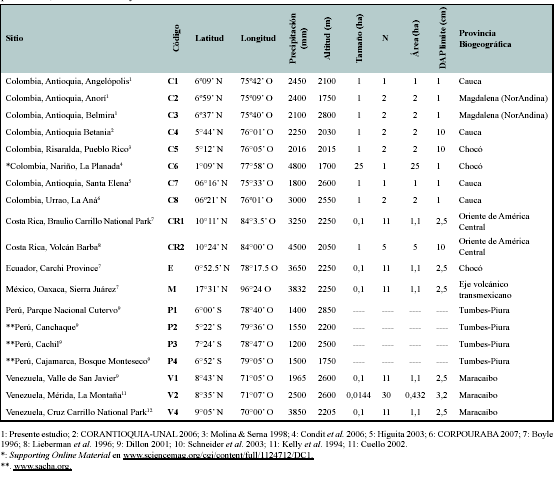
Debido a las diferencias de objetivos entre los estudios considerados, la información florística fue depurada para incluir de los listados los géneros con por lo menos una especie de hábito arbóreo o arbustivo, así como las palmas y helechos arborescentes, excluyendo los demás hábitos de crecimiento.
MÉTODOS
Para estudiar la tasa de recambio florístico de géneros se ajustó un modelo de regresión que relaciona la similitud florística (S) con la distancia geográfica (d) logarítmicamente transformada (S= a + b*LN(d)). Se utilizó el índice de Jaccard como medida de similitud entre todos los pares de sitios. Con este modelo, se cuantificó la dependencia espacial en las tasas de recambio florístico en un gradiente latitudinal en dos áreas geográficas: 1. Sólo considerando los inventarios florísticos dentro de Colombia (C1 a C8) los cuales comprenden un gradiente latitudinal desde los 1º09'N hasta 6º59'N y 2. A escala regional de bosques montanos en el neotrópico para los restantes sitios (México, Costa Rica, Venezuela, Ecuador y Perú) excluyendo los de Colombia. Aunque los dos conjuntos de datos hacen parte de la región neotropical, en adelante nos referiremos a ellos como Colombia y el neotrópico respectivamente, para denotar las diferencias en los rangos geográficos que abarca cada conjunto de datos en los análisis. El modelo espacial, cuando fue significante, fue adicionalmente probado mediante una Prueba de Mantel (Legendre & Legendre 1998).
El efecto sobre la composición florística de factores externos diferentes del espacio geográfico, tales como la precipitación, la posición altitudinal y la posición biogeográfica, fue evaluado de forma independiente mediante una Prueba de Mantel usando 999 permutaciones (Legendre & Legendre 1998). La provincia biogeográfica para cada sitio fue definida de acuerdo con Morrone (2001). El espacio geográfico, la precipitación, la posición altitudinal y la posición biogeográfica, fueron convertidos a matrices de distancia. La primera de ellas se convirtió a distancias en kilómetros, la precipitación y la altitud fueron transformadas mediante una simple distancia Euclidiana, mientras que para la posición biogeográfica las distancias fueron definidas por medio de variables dummy asumiendo un uno (1) cuando distintos sitios pertenecían a la misma provincia biogeográfica y cero (0) cuando pertenecían a diferentes provincias biogeográficas. Los análisis se realizaron con el programa R-Package (Casgrain & Legendre 2000).
Por último, se realizó un análisis de regresión complementario, cuya significancia se evaluó con base en permutaciones de matrices de distancias (Legendre et al. 1994). Para hacer esto se calculó una matriz de distancia de Jaccard mediante la transformación Dij=1-Sij, donde Dij es la distancia florística entre los sitios i y j y Sij es la similitud florística medida con el índice de Jaccard. La regresión múltiple fue computada para expresar una matriz dependiente de distancia florística como una función de matrices de distancia independientes relacionadas con la distancia geográfica, la altitud, la precipitación y la posición biogeográfica. La regresión se realizó usando 999 permutaciones, bajo la opción de eliminación hacia atrás (backward elimination), generando coeficientes de regresión parcial y probabilidades de las variables que fueron significativas en la explicación del modelo. La probabilidad asumida para retener las variables fue de 0.05. Estos análisis se ejecutaron utilizando el programa Permute! 3.4 (disponible en http://www.bio.umontreal.ca/casgrain/en/labo/permute/index.html). Adicionalmente, se realizó un análisis de partición de varianza (Borcard et al. 1992, Duivenvoorden et al. 2002, Legendre 2008) con las variables independientes que fueron significativas, seleccionadas en el paso anterior: para esto se utilizaron los valores de R2 ajustados por los grados de libertad totales y residuales (Legendre 2008), para determinar la contribución de cada una de las variables individuales y en forma combinada.
RESULTADOS
Similitud y distribución de géneros
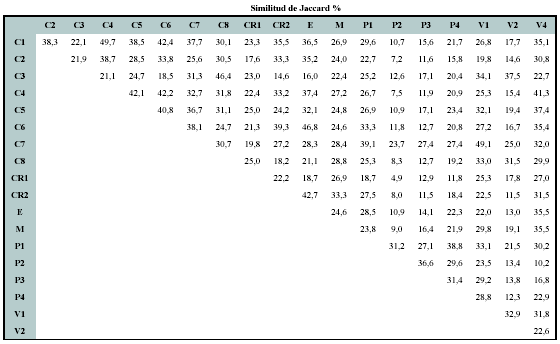
Se registraron en total 427 géneros en los 19 sitios entre Perú y México. Sólo el 1% de los géneros tuvo una distribución en todos los sitios considerados, mientras el 35% de ellos presento una distribución restringida a un sólo sitio (Figura 2). Los géneros de más amplia distribución fueron Clusia, Ilex, Miconia, Piper (19 sitios),Weinmannia (18 sitios), Palicourea, Ocotea y Clethra (17 sitios). La similitud de géneros varió en un orden de magnitud entre 4.9% y 49.7% (media 25.5 ± 9.4).

Variación florística en relación con la distancia geográfica, la altitud, la precipitación y la posición biogeográfica
El porcentaje de explicación de la variación en la composición de géneros con al aumento de la distancia fue relativamente bajo, sólo fue significativo cuando se consideraron los sitios a nivel del neotrópico (R2ajustado 11.6%, p < 0.05), pero no cuando se concentró el análisis únicamente en Colombia (R2ajustado 0%, p > 0.05) (Figura 3).
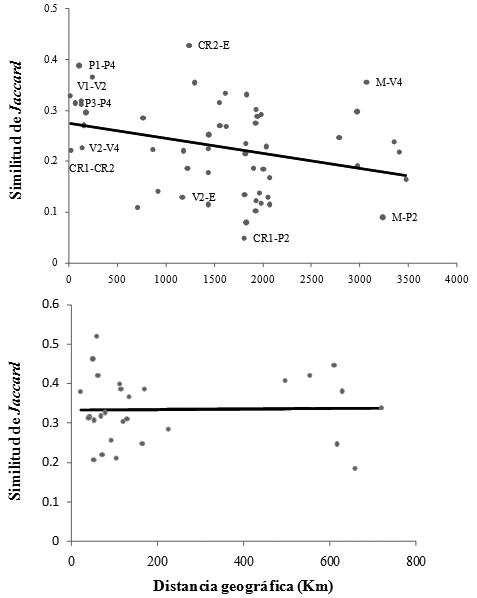
Los resultados anteriores se confirman con los análisis de correlación de Mantel. Cuando se consideraron los sitios en Colombia, sólo la altitud mostró una correlación significativa con la variación florística de géneros (Tabla 2).
Al considerar el neotropico, el cual comprende un área geográfica mayor, la precipitación, la provincia biogeográfica y la distancia geográfica estuvieron correlacionadas significativamente con la variación de géneros (Tabla 3).

En el análisis de regresión de matrices con base en la eliminación de variables, cuando se consideraron los sitios del neotrópico, dejó como variables definitivas la precipitación y la altitud (Tabla 4).

En realidad otras variables también fueron importantes, pero dado que se presenta una alta correlación entre ellas (por ejemplo entre la distancia geográfica con la precipitación y la provincia biogeográfica) durante el proceso de eliminación algunas variables son excluidas del modelo. La correlación significativa entre la distancia y la precipitación confirma que la variación asociada con este factor climático es de hecho un factor importante definiendo los patrones de composición. Como era de esperarse, cuando se analizaron los sitios en Colombia, sólo la variable altitud fue significativa en el modelo (0.685, p = 0.001) (Tabla 4), lo cual significa que los sitios tienden a ser más similares florísticamente en cuanto a géneros por su ubicación altitudinal, independiente de las otras variables incluidas en los análisis.
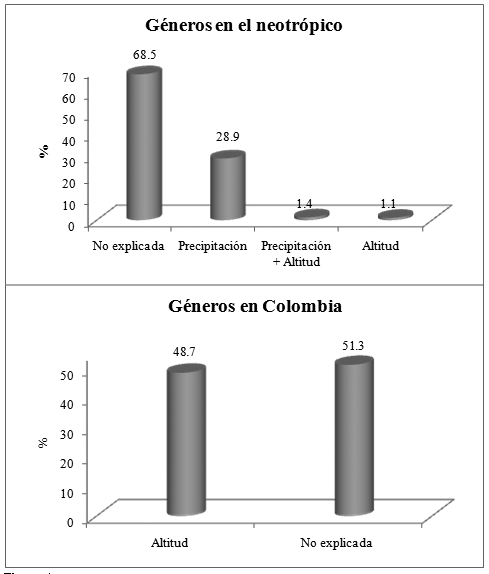
A nivel de Colombia, gran proporción de la variación florística queda sin explicar por las variables consideradas (Figura 4), mientras que los factores ambientales relacionados con la altitud explican el 48.7% de la variación en la composición de géneros. Para el neotrópico, el cual comprende un área geográfica mayor, la precipitación (28.9%) y la altitud (1.1%) y el efecto combinado de éstas (1.4%) explicaron aproximadamente el 31% de la variación florística de géneros, mientras el 68.5% de la variación no es explicada por las variables aquí consideradas (Figura 4).
DISCUSIÓN
Tasa de cambio de géneros en el espacio geográfico
A nivel del neotrópico y por fuera de la franja alrededor del Ecuador geográfico, la tasa de disminución de la similitud florística de géneros a medida que incrementó la distancia fue decreciente. En contraste, a la escala de Colombia, localizada alrededor del Ecuador geográfico, la variación en la similitud florística de géneros fue independiente de la distancia. Sin embargo, y opuesto a lo que se esperaría para los ecosistemas de alta montaña donde la limitación en dispersión por presencia de barreras geográficas debería jugar un papel muy importante en la distribución de los taxones (Nekola & White 1999, Chown & Gaston 2000), la franja tropical de bosques de alta montaña alrededor del Ecuador geográfico parece comportarse de forma similar a su contraparte de tierras bajas y estar dominada (sensu Pitman et al. 1999) por muy pocos géneros de amplia distribución geográfica.
Importancia de factores históricos y climáticos a diferentes escalas geográficas
A la escala del neotrópico por fuera de Colombia y alrededor de la franja tropical, la variación climática e histórica fueron factores importantes definiendo los patrones de cambio de la composición de los géneros. En el modelo, el elemento dominante fue la precipitación, corroborando lo expuesto por otros autores en cuanto a que en gradientes ambientales amplios la variación climática (Clinebell et al. 1995, Davidar et al. 2007) se vuelve más relevante que la variación topográfica o edáfica (Tuomisto et al. 2003). Lo anterior concuerda con lo expuesto por la teoría de los refugios (Haffer 1969, Hooghiemstra & Cleef 1995), donde se propone la cantidad de lluvia, y no la temperatura (Colinvaux et al. 2000), como el elemento más importante definiendo a gran escala (entre provincias biogeográficas) la distribución de familias y géneros en el neotrópico. Sin embargo, desde el punto de vista evolutivo, nuestros resultados a nivel de género no concuerdan con lo expuesto a nivel de especies donde se asume que la mayoría de taxones arbóreos de zonas templadas, los cuales tienen una mayor influencia en las regiones subtropicales que en las tropicales, han tenido menos tiempo para diversificarse (Ricklefs 2004). De esta manera, uno esperaría mayores rangos de distribución para los géneros por fuera de la banda tropical, contrario a lo reportado en este estudio.
A la escala de Colombia, donde la altitud fue el factor preponderante determinando los patrones de distribución de géneros, se sustenta la hipótesis de la heterogeneidad climática propuesta por Boyle (1996). Esta hipótesis establece que las montañas tropicales deben poseer una mayor diversidad beta que su contraparte de tierras bajas, debido a que los cambios en elevación hacen que la estacionalidad de la temperatura (al contrario de la temperatura promedio) disminuya monotónicamente (Kattan & Franco 2004). Sin embargo, es la temperatura promedio, según los resultados de este estudio, el factor primordial dentro de las provincias geográficas la que parece mantener el relativo amplio rango de distribución de los géneros alrededor de la línea ecuatorial, lo cual concuerda a este nivel taxonómico con la hipótesis que considera a los trópicos como un museo que alberga en gran proporción clados ancestrales con orígenes comunes (Bush et al. 2004). Dado que es bien sabida la alta diversidad beta de los bosques de alta montaña a nivel de especies (véase por ejemplo López & Duque, 2010), similar al anterior, nuestros resultados a nivel de género no concuerdan con los obtenidos a nivel de especies. De esta manera, a nivel evolutivo, se confirma que en los bosques de alta montaña de los Andes tropicales las tasas de especiación deben haber sido bastante altas (Hugues & Eastwood 2006) para poder producir estos ecosistemas compuestos por un mosaico de muchos tipos de bosque, a nivel de especies.
Lecciones para la conservación y la adaptación al cambio climático
A lo largo del gradiente altitudinal, similar a como ocurre en las áreas templadas (Wiens & Donoghue 2004), los gradientes de distribución de muchos taxones corresponden con isoclinas climáticas, haciendo que algunas características específicas de las especies tales como la tolerancia al congelamiento se conviertan en una barrera para que desde las tierras bajas éstos puedan llegar a las altas montañas. De ser así, muchas de las familias y géneros de plantas con flores de tierra bajas en los bosques tropicales, deben carecer de representantes en los ecosistemas de alta montaña; por esta razón, los ecosistemas de alta montaña deberían estar dominados por clados más recientes. Esta hipótesis, la cual podría ser probada con base en filogenias y las nuevas técnicas moleculares, aparece como una importante área de investigación para entender mejor los mecanismos que mantienen la diversidad y la distribución de especies en los bosques de montaña.
Dentro de provincias biogeográficas, una línea de diferenciación sustentada en las adaptaciones ecofisiológicas requeridas para sobrevivir a medida que disminuye la temperatura (Mooney & Ehleringer 2003, Hemp 2005), obliga a los taxones a migrar verticalmente, lo cual tendría implicaciones directas ante la posibilidad de persistir de cara al calentamiento global. Sin embargo, la corta distancia geográfica entre elevaciones facilita la dispersión de propágulos dentro de los ecosistemas andinos, lo cual garantizaría que aquellos taxones con un amplio gradiente de distribución en altura se mantuvieran en equilibrio ante un eventual cambio climático (Bush et al. 2004). Por el contrario, para aquellos taxones con gradientes de distribución geográfica restringidos, la sequía o ausencia de lluvias se espera que tenga un mayor impacto (Hooghiestra & van der Hammen 2001), ya que en conjunto con el aumento de temperatura se podría desplazar el límite inferior de formación de nubes afectando sensiblemente la capacidad de sobrevivencia de muchas especies (Bush et al. 2007).
El presente estudio reporta una baja capacidad de explicación de los patrones de distribución de especies cuando se usan géneros en bosques montanos del neotrópico, especialmente cuando se consideran escalas espaciales relativamente pequeñas. Lo que este resultado propone, es que la estructura archipelágica de los ecosistemas de montaña, lo cual se espera se refleje en altas tasas de especiación (Hugues & Eastwood 2006), no permite interpretar de forma apropiada los patrones florísticos de las especies con base en una resolución taxonómica superior, lo cual difiere significativamente de lo reportado para tierras bajas (Terborgh & Andersen 1998, Higgins & Ruokolainen 2004). En los bosques andinos de alta montaña, se debe por tanto, tener una alta precaución a la hora de interpretar y extrapolar los estudios con base en familias o géneros de plantas leñosas, a la hora de definir dónde y cómo priorizar las estrategias de conservación.
AGRADECIMIENTOS
A CORANTIOQUIA y a la Dirección de Investigación de la Universidad Nacional de Colombia, Sede Medellín (DIME) por la financiación que hizo posible la realización de este estudio. El presente estudio ha recibido apoyo logístico de parte del Mountain Research Initiative (MRI) y hace parte de los productos asociados con la red de parcelas Cordillera Forest Dynamics Network (CORFOR -http//www.corfor.com-). Igualmente agradecemos a Juan Lázaro Toro quien contribuyó enormemente al desarrollo logístico. A Jorge Pérez, Álvaro Idárraga, Ricardo Callejas, Heriberto Higuita, Adriana Rivas, Dino Tuberquia y otros, quienes colaboraron con la determinación del material vegetal. A los estudiantes de pregrado de Ingeniería Forestal de la Universidad Nacional de Colombia, Sede Medellín que participaron en la toma de datos de campo. Al personal de los herbarios MEDEL de la Universidad Nacional de Colombia, Sede Medellín y HUA de la Universidad de Antioquia y a sus directores Jorge Pérez y Felipe Cardona respectivamente, por toda su colaboración. Por último queremos agradecer a los tres evaluadores anónimos quienes aportaron importantes elementos de discusión para la consolidación de este manuscrito.
LITERATURA CITADA
1. BORCARD, D., P. LEGENDRE, P. DRAPEAU. 1992. Partialling out the spatial
component of ecological variation Ecology 73: 1045-1055.
2. BOYLE, B.L. 1996. Changes on altitudinal and latitudinal gradients in Neotropical
montane forests. A dissertation Graduate School of Arts and Sciences of Washington
University.
3. BUSH, M.B., M.R. SILMAN & D.H.URREGO. 2004. 48,000 years of climate and
forest change in a biodiversity hot spot. Science 303: 827-829.
4. BUSH, M.B., J.A. HANSELMAN & H. HOOGHIEMSTRA. 2007. Andean montane forests
and climate change. Págs. 33-54 en: BUSH, M.B. & J.R. FLENLEY (eds.),
Tropical Rainforest Responses to Climatic Change. Springer Berlin Heidelberg.
5. CASGRAIN, P. & P. LEGENDRE. 2000. The R Package - Multidimensional analysis,
spatial analysis. Version 4. Département de sciences biologiques, Université
de Montréal, Montreal.
6. CHAO, A., W.H. HWANG, Y.C. CHEN, & C.Y. KUO. 2000. Estimating the number
of shared species in two communities. Statistica Sinica 10: 227-246.
7. CHAO, A., R.L. CHAZDON, R.K. COLWELL & T.J. SHEN. 2005. A new statistical
approach for assessing compositional similarity based on incidence and abundance
data. Ecology Letters 8: 148-159.
8. CHAO, A., R. L. CHAZDON, R. K. COLWELL & T.J. SHEN. 2006. Abundance-based
similarity indices and their estimation when there are unseen species in samples
Biometrics 62: 361-371.
9. CHOWN, S.L. & K.J. GASTON. 2000. Areas, cradles, and museums: the latitudinal
gradient in species richness. Trends in Ecology and Evolution 15: 311-315.
10. CLINEBELL, R.R., O.L. PHILLIPS, A.H. GENTRY, N. STARK & H. ZUURING.
1995. Prediction of neotropical tree and liana species richness from soil and
climatic data. Biodiversity and Conservation 4: 56-90.
11. COLINVAUX, P.A., P.E. DE OLIVEIRA & M.B. BUSH. 2000. Amazonian and neotropical
plant communities on glacial time-scales: The failure of the aridity and refuge
hypotheses. Quaternary Science Reviews 19:141-169.
12. CONDIT, R., P. ASHTON, S. BUNYAVEJCHEWIN, H.DATTARAJA, S. DAVIES, S.ESUFALI,
C. EWANGO, R.FOSTER, I. GUNATILLEKE, C. GUNATILLEKE, P. HALL, K. HARMS, T. HART,
C. HERNANDEZ, S. HUBBELL, A. ITOH, S. KIRATIPRAYOON, J. LAFRANKIE, S. DE LAO,
M. LOO, N. JEAN-REMY, K.MD. NUR SUPARDI, R. ABDUL, S. RUSSO, S. R.UKUMAR, C.
SAMPER, H. SURESH, S. TAN, T.S. HOMAS, R.VALENCIA, M. VALLEJO, G. VILLA, &
T. ZILLIO. 2006. The importance of demographic niches to tree diversity. Science
313: 98-101.
13. CONDIT, R., R. PEREZ, S. LAO, S. AGUILAR, & A. SOMOZA. 2005. Geographic
ranges and ß-diversity: Discovering how many tree species there are where.
Biologiske Skrifter 55: 57-71.
14. CONDIT, R., N. PITMAN, E.G. LEIGH JR, J. CHAVE, J. TERBORGH, R. B. FOSTER,
P. NUÑEZ, S. AGUILAR, R. VALENCIA, R. VILLA, H.C. MULLER-LANDAU, E. LOSOS
& S.P. HUBBELL. 2002. Beta-diversity in tropical forest trees. Science 295:
666-669.
15. CORANTIOQUIA & UNIVERSIDAD NACIONAL. 2006. Mantenimiento y remedición
de las parcelas permanentes de investigación, Reserva Natural Farallones
del Citará, Municipio de Betania Antioquia, vereda Piedra Arriba, Hacienda
Agua Linda.
16. CORPOURABA. 2007. Estructura y composición florística de dos
parcelas permanentes de registro de bosques andinos en las veredas La Aná
-sector Piedras Blancas- y Llanogrande -sector Zarzagueta-, municipio de Urrao
-plan de ordenación forestal-. 41 p.
17. CUELLO, N.L. 2002. Floristic diversity and structure of the montane forests
of Cruz Carrillo National Park in the Venezuelan Andes. A thesis to the Graduate
School at the University of Missouri-St. Louis in Partial Fulfillment of the
Requeriments for the Degree of Master of Science in Biology.
18. DAVIDAR, P., B. RAJAGOPAL, D. MONADAS, J.P. PUYRAVAUD, R. CONDIT, S.J. WRIGHT
& E.G. LEIGH. 2007. The effect of climatic gradients, topographic variation
and species traits on the beta diversity of rain forest trees. Global Ecology
and Biogeography 16: 510-518.
19. DILLON, O.D. 2001. Montane forest. Andean Botanical Information System.
En: www.sacha.org.
20. DUIVENVOORDEN, J. F., J.C. SVENNING & S.J. WRIGHT. 2002. Beta diversity
in tropical forests. Science 295: 636-637.
21. DUQUE, J.A., M. SANCHEZ, J. CAVELIER & J.F. DUIVENVOORDEN. 2004. Different
floristic patterns of woody understory and canopy plants in Colombian Amazonia.
Págs. 23-36, en: Plant diversity scaled by growth forms along spatial
and environmental gradients. A study in the rain forests of NW Amazonia. Amsterdam.
22. DUQUE, A., J.F. PHILLIPS, P. HILDEBRAND, C.A. POSADA, A. PRIETO, A. RUDAS,
M. SUESCÚN & P. STEVENSON. 2009. Distance Decay of Tree Species Similarity
in Protected Areas on Terra Firme Forests in Colombian Amazonia. Biotropica
41: 599-607.
23. ENGELBRECHT, B.M., L.S. COMITA, R. CONDIT, T.A. KURSAR, M.T. TYREE, B.L.
TURNER & S.P. HUBBELL. 2007. Drought sensitivity shapes species distribution
patterns in tropical forests. Nature 447: 80-82.
24. FRANCIS, A. & D.J. CURRIE. 2003. A global consistent richness-climate
relationships for angiosperms. American Naturalist 161: 523-536.
25. GENTRY, A.H. 1988. Changes in plant community diversity and floristic composition
on environmental and geographical gradients. Annals of the Missouri Botanical
Garden 75: 1-34.
26. HAFFER, J. 1969. Speciation in Amazonian Forest Birds. Science 165: 131-137.
27. HEMP, A. 2005. Continuum or zonation? Altitudinal gradients in the forest
vegetation of Mt. Kilimanjaro. Plant Ecology 184: 27-42.
28. HIGGINS, M.A. & K. RUOKOLAINEN. 2004. Rapid tropical forest inventory:
a comparison of techniques based on inventory data from western Amazonia. Conservation
Biology 18: 799- 811.
29. HIGUITA, H. 2003. Conteo de especies de plantas vasculares en un bosque
andino del oriente antioqueño, Colombia. Instituto de Biología,
Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, Medellín.
44 pp.
30. HOOGHIEMSTRA, H. & A.M. CLEEF 1995. Pleistocene climatic change and
environmental and generic dynamics in the north Andean montane forest and paramo.
Págs. 35-49 en: Balslev, H., S.P. Churchill, E. Forero & J.L. Luteyn
(eds.) Biodiversity and conservation of Neotropical montane forests. The New
York Botanical Garden. Nueva York.
31. HOOGHIEMSTRA, H. & T. VAN DER HAMMEN. 2001. Desarrollo del bosque húmedo
neotropical en el Neógeno y Cuaternario: la hipótesis de los refugios.
Págs. 129-136 en: LLORENTE, J. & J. MORRONE (eds.). Introducción
a la biogeografía en Latinoamérica (teorías, conceptos,
métodos y aplicaciones). Facultad de Ciencias UNAM. México D.F.
32. HUBBELL, S.P. 2001. The unified neutral theory of biodiversity and biogeography.
Monographs in Population Biology 32. Princeton University Press, Princeton,
Nueva Jersey.
33. HUGHES, C. & R. EASTWOOD. 2006. Island radiation on a continental scale:
Exceptional rates of plant diversification after uplift of the Andes. PNAS 103:
10334-10339.
34. KAPPELLE, M., A. M. CLEEF & A. CHAVERRI. 1992. Phytogeography of Talamanca
montane Quercus forests, Costa Rica. Journal of Biogeography 19: 299-315.
35. KATTAN, G. H. & P. FRANCO. 2004. Bird diversity along elevational gradients
in the Andes of Colombia: area and mass effects. Global Ecology and Biogeography
13: 451-458.
36. KELLY, D. L., E.V.J. TANNER, E.M. NICLUGHADHA & V. KAPOS. 1994. Floristic
and biogeography of a rainforest in the Venezuelan Andes. Journal of Biogeography
21: 421-440.
37. KOLEFF, P., K.J. GASTON & J.J. LENNON. 2003. Measuring beta diversity
for presence-absence data. Journal of Animal Ecology 72: 367-382.
38. LATIMER, A., J. SILANDER & R. COWLING. 2005. Neutral Ecological Theory
Reveals Isolation and Rapid Speciation in a Biodiversity Hot Spot. Science 309:
1722-1725.
39. LEGENDRE, P. 2008. Studying beta diversity: ecological variation partitioning
by multiple regression and canonical analysis. Journal of Plant Ecology 1: 3-8.
40. LEGENDRE, P., F. LAPOINTE & P. CASGRAIN. 1994. Modeling brain evolution
from behavior: a permutational approach. Evolution 48: 1487-1499.
41. LEGENDRE, P. & L. LEGENDRE. 1998. Numerical Ecology. Elsevier, Amsterdam.
42. LEIGH, E.G., P. JR DAVIDAR, C.W. DICK, J.P. PUYRAVAUD, J. TERBORGH, H. TER
STEEGE & S.J. WRIGHT. 2004. Why do some tropical forests have so many species
of trees? Biotropica 36: 447-473.
43. LIEBERMAN, D., M. LIEBERMAN, R. PERALTA & G. HARTSHORN. 1996. Tropical
forest structure and composition on a large-scale altitudinal gradient in Costa
Rica. Journal of Tropical Ecology 84: 137-152.
44. LÓPEZ, W. & A. DUQUE. 2010. Patrones de diversidad alfa en tres
fragmentos de bosques montanos en la región norte de los Andes, Colombia.
Revista de Biología Tropical 58: 483-498.
45. LUNA-VEGA, I., J. J. MORRONE, O. ALCÁNTARA AYALA & D. ESPINOSA.
2001. Biogeographical affinities among Neotropical cloud forests. Plant Systematics
and Evolutions 228: 229-239.
46. MOLINA, L. & E. SERNA. 1998. Estructura y clasificación de la
vegetación arbórea de un bosque de niebla reserva natural Karagabí
Pueblo Rico -Risaralda-. Tesis Universidad Nacional de Colombia. Facultad de
Ciencias Agropecuarias. Medellín.
47. MOONEY, H. A. & J.R. EHLERINGER. 2003. Photosynthesis. Págs.
1-27 en: Crawley, M.J. (editor). Plant Ecology. Second edition. Blackwell Publishing.
48. MORRONE, J.J. 2001. Biogeografía de América Latina y el Caribe.
M&T-Manuales & Tesis SEA. Vol. 3. Zaragoza.
49. NEKOLA, J.C. & P.S WHITE. 1999. The distance decay in similarity in
biogeography and ecology. Journal of Biogeography 26: 867- 878.
50. PITMAN, N.C.A., J. TERBORGH, M.R. SILMAN & V.P. NUÑEZ. 1999.
Tree species distributions in an upper Amazonian forest. Ecology 80: 2651-2661.
51. RICKLEFS, R. E. 2004. A comprehensive framework for global patterns in biodiversity.
Ecology Letters 7: 1-15.
52. RUOKOLAINEN, K., H. TUOMISTO, J. VORMISTO & N. PITMAN. 2002. Two biases
in estimating range sizes of Amazonian plant species. Journal of Tropical Ecology
18: 935-942.
53. SCHNEIDER, J., J. GAVIRIA & G. ZITKA. 2003. Inventario de un Bosque
altimontano húmedo en el Valle de San Javier, Edo. Mérida, Venezuela.
Plántula 3: 65-81.
54. SOININEN, J., R. MCDONALD & H. HILLEBRAND. 2007. The distance decay
of similarity in ecological communities. Ecography 30: 3-12.
55. TER STEEGE, H., N.C. PITMAN, O.L. PHILLIPS, J. CHAVE, D. SABATIER, A. DUQUE,
J.F. MOLINO, M.F. PRÉVOST, R. SPICHIGER, H. CASTELLANOS, P. VON HILDEBRAND
& R. VÁSQUEZ. 2006. Continental-scale patterns of canopy tree composition
and function across Amazonia. Nature 443: 444-447.
56. TERBORGH, J. & E. ANDERSEN. 1998. The composition of Amazonian forests:
patterns at local and regional scales. Journal of Tropical Ecology 14: 645-664.
57. TUOMISTO, H., K. RUOKOLAINEN, R. KALLIOLA, A. LINNA, W. DANJOY & Z.
RODRÍGUEZ. 1995. Dissecting Amazonian Biodiversity. Science 269: 63-66.
58. TUOMISTO, H., K. RUOKOLAINEN & M. YLI-HALLA. 2003. Dispersal, Environment,
and Floristic Variation of Western Amazonian Forests. Science 299: 241-244.
59. VAN DER HAMMEN, T. 1996. Biodiversidad en el tiempo y en el espacio. Cespedesia
21: 479-485.
60. WIENS, J.J. & M.J. DONOGHUE. 2004. Historical biogeography, ecology,
and species richness. Trends in Ecology and Evolution 19: 639-644.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2010 Caldasia

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cual estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).























