Publicado
COMPOSICIÓN Y PREFERENCIA DE MICROHÁBITAT DE LARVAS DE ODONATA (INSECTA), EN LA CIÉNAGA SAN JUAN DE TOCAGUA (ATLÁNTICO, COLOMBIA)
Composition and microhabitat preference of Odonata larvae (insecta) in the San Juan de Tocagua swamp (Atlántico, Colombia)
MARIANO ALTAMIRANDA-S.
LEÓN ANDRÉS PÉREZ-G.
LUIS CARLOS GUTIÉRREZ-M.
Universidad Nacional de Colombia sede Medellín, Apartado 3840, Medellín,
Colombia. maltamiranda@gmail.com. Autor para correspondencia
Universidad del Atlántico, Km. 7 vía Puerto Colombia, Barranquilla. talysker@hotmail.com,
rotifero1@yahoo.es
RESUMEN
Se evaluó la respuesta del ensamblaje de larvas de odonatos a la disponibilidad de sustratos en la zona litoral de la Ciénaga San Juan de Tocagua (Atlántico, Colombia). Durante los meses de septiembre (2006) a marzo (2007) se realizaron muestreos y se estimaron la diversidad, la riqueza y la abundancia de los estadios larvales de odonatos. Además, se midieron parámetros físico-químicos del cuerpo de agua. Las especies presentaron una amplia ocupación de los sustratos, siendo las macrófitas flotantes y los fondos lodosos los sustratos con mayor cobertura y permanencia. Las especies presentes en el fondo de la ciénaga no mostraron relación con el tipo de textura. Los factores físico-químicos medidos no presentaron relación con la diversidad, la riqueza y la abundancia de larvas en el sistema, sugiriendo que la variación en los valores de estos parámetros no explica la respuesta del ensamblaje a través del estudio.
Palabras clave. Vegetación acuática, riqueza, abundancia, macrófitas.
ABSTRACT
We evaluated the response of the assembly of Odonata larvae to the available substrates on the shoreline of the Swamp San Juan de Tocagua, Atlántico, Colombia. We sampled the habitats from September 2006 to March 2007 to estimate diversity, richness and abundance of larval odonates. We also measured physical and chemical parameters of the water body. The species showed a broad occupancy of the substrate, with greater cover and permanence on the floating macrophytes and the muddy bottom. The species of the bottom of the swamp were not associated with a particular the type of texture. The measured physicochemical factors were not associated with the diversity, richness and abundance of the larvae in the system, suggesting that the variation in the values of these parameters does not explain the response of the assembly during the study.
Key words. Aquatic vegetation, richness, abundance, macrophytes.
Recibido: 19/05/2010
Aceptado: 30/09/2010
INTRODUCCIÓN
Las larvas de los odonatos tienen preferencias al momento de ocupar los sustratos en los hábitats acuáticos (Ward, 1992; Ward & Mill, 2008), incluso esta preferencia se hace notoria desde el momento de la oviposición, dado que con frecuencia las hembras poseen ovipositor y estrategias comportamentales para depositar los huevos en lugares determinados, limitando así el carácter aleatorio de la distribución de las futuras larvas (Corbet, 1999). Esta preferencia es un factor que puede usarse para determinar si la disponibilidad de sustratos influencia la dominancia de una especie.
Por otro lado, es importante esclarecer si son las características bionómicas de las larvas, las que marcan la preferencia por un sustrato determinado (De Marco & Vital, 2008) o si por el contrario, los efectos de la competencia por el espacio o el alimento, surgen como explicación más elocuente (Jhonson et al., 1985; 1987). Algunas especies sincronizan sus periodos de emergencia con la disponibilidad de sustratos, evitando competencia interespecífica (Corbet, 1999). Así mismo las abundancias de las especies en un hábitat, serán controladas conforme a la disponibilidad de sustratos (Steyler y Samways, 1995).
La preferencia de las larvas por ocupar algunos sustratos en los sistemas acuáticos, también se relaciona con las condiciones requeridas para la emergencia del imago (Ward & Mill, 2008). Sin embargo, esta no parece ser la única variable que explica la relación de la diversidad, riqueza y abundancia de larvas en los sustratos. Algunos estudios sugieren que los factores físico- químicos e hidráulicos del hábitat acuático actúan de manera integral, lo que permite la ocupación de los sustratos (Niba & Samways, 2006).
En el neotrópico existen sistemas lénticos de tierras bajas como ciénagas y estuarios que sostienen una variada fauna de insectos y sobresalen elementos de su ecología como la vegetación asociada. Esto hace que sean considerados como ambientes de gran importancia en biología de la conservación. Las ciénagas de la región Caribe colombiana hacen parte de la red de drenaje del río Magdalena y son sistemas fuertemente influenciados por los regímenes de lluvias, tanto de manera local como por la subida de aguas del río Magdalena fruto de las lluvias en las cabeceras ( CEA, 1995)
Algunos estudios sugieren que la competencia intra e interespecífica está mejor asociada a la disponibilidad de espacio que a la de alimento (Jhonson et al., 1985), aunque ciertas especies pueden ser oportunistas cuando hay elevada disponibilidad de sustratos (Ward & Mill, 2008). De igual forma, existe evidencia de que los zigópteros presentan una alta riqueza cuando la disponibilidad de carbono es mayor (Osborn & Samways, 1996), Teniendo en cuenta lo anterior, se analizó la respuesta de las larvas de odonatos a la cobertura y al tipo de sustratos, asumiendo que la disponibilidad de estos determina su composición y estructura, de manera que, si uno de ellos tiene mayor cobertura provocará que la especie que mejor explote el recurso, presente mayor abundancia. Igualmente se evaluó si el estado físico-químico del agua influye en la riqueza, diversidad y abundancias de las poblaciones residentes.
MATERIALES Y MÉTODOS
Área de estudio. El trabajo se desarrolló en la Ciénaga San Juan de Tocagua, durante los meses de septiembre (2006) a marzo (2007), la Ciénaga se encuentra localizada en el corregimiento del mismo nombre, municipio de Luruaco (Departamento del Atlántico-Colombia (10º42´ Norte y 75º14´ Oeste) a unos 15 km al norte de la vía que conduce al municipio de Luruaco. Según el sistema de zonas de vida de Holdridge (1978), la formación vegetal del área de estudio pertenece a bosque seco tropical (Bs-T) con una biotemperatura media de 24ºC y un promedio de lluvias de 1500 mm. La cobertura vegetal predominante es de bosque intervenido, el dosel es discontinuo y alcanza hasta 15 m de altura.
Muestreo e identificación de los individuos inmaduros. Los muestreos se realizaron seleccionando tres estaciones de 500 m de largo, en paralelo al litoral, en donde se utilizó la técnica de transecto y punto adaptada de Ralf et al. (2000). Cada 100 m se instalaron cuadrantes de 1m al margen del cuerpo de agua. De este modo se ubicaron en total cinco puntos en cada una de las estaciones (Fig.1).

Para el muestreo en la vegetación acuática se utilizó una red D-net con área triangular de 20 cm por lado, mientras que para los individuos que se encontraron en el sedimento se utilizó un corazonador de 11.4 cm de diámetro y 40 cm de largo. La separación del material se efectuó en el campo con un tamiz de 0.5 mm de ojo de malla, con la ayuda de pinzas entomológicas. Los tipos de sustrato que se registraron en la Ciénaga San Juan de Tocagua fueron: (macrófitas flotantes libres, macrófitas enraizadas emergentes (Mora-Olivo & Villaseñor, 2007), sedimento franco, limoso, franco-limoso, franco-arcilloso, arcillosos, arcillo-arenoso, y franco-arcillo-arenoso). Las larvas recolectadas se preservaron en frascos con alcohol al 70%. Su identificación se realizó utilizando claves taxonómicas de McCafferty & Provonsha (1981), Arango & Roldán (1983), Roldán (1996) y Westfall & Tennessen (1996). De manera adicional, con la ayuda de una red entomológica, se realizó la captura de ejemplares adultos con la finalidad de establecer la relación náyade-adulto. El esfuerzo de captura por muestreo fue de ocho horas diarias. La recolecta se realizó en la vegetación alrededor y cerca del cuerpo de agua.
Registro de los factores físico-químicos del agua y sedimento. Los registros se realizaron in-situ; y se midieron dentro del perímetro de las estaciones durante los muestreo, en un ciclo nictiomeral cada dos horas. La selección de los puntos de toma de muestra fue aleatoria; se midió el oxigenó disuelto, temperatura del agua, pH, conductividad, salinidad y transparencia (Tabla1), debido a que la variación de estos factores en los sistemas lénticos, puede tener una alta influencia en la dinámica poblacional de las larvas de odonatos (Corbet, 1999).

Para el análisis granulométrico se utilizó el método de Boyoucos (Boul et al., 1973), el cual tiene en cuenta la distribución del tamaño de las partículas del suelo, según la densidad. La materia orgánica fue estimada mediante el método colorimétrico de Walkley & Black (1934).
Análisis estadístico. Para determinar la estructura del ensamblaje de larvas de odonatos, se estimó la riqueza total (S) y la abundancia absoluta como el número total de individuos recolectados por estación y muestreo. Para cuantificar la variación espacial y temporal de la riqueza y la abundancia, se realizó un análisis de varianza de una vía, donde los factores fueron las estaciones y los muestreos y las variables dependientes fueron los índices ecológicos. Debido a que los datos de los índices ecológicos no cumplieron con los supuestos de normalidad (prueba Shapiro-Wilks) y homogeneidad de varianzas (prueba de Barlet) se usó el ANOVA no paramétrico de Kruskal-Wallis, por medio del programa STATGRAPHICS (Statpoint, 2006).
Para evaluar la relación entre los parámetros físico-químicos (oxígeno disuelto, temperatura, pH, salinidad, transparencia), los valores de materia orgánica y la variación de la riqueza y abundancia de larvas, se utilizó el análisis de correlación no paramétrico de Spearman mediante el programa PAST versión 1.34 (Hammer et al., 2001)
RESULTADOS
Distribución espacial de las especies de Odonata y disponibilidad de sustratos. Se registró un total de 14 especies distribuidas en 11 géneros de tres familias (Tabla 2), y se colectaron 1034 larvas de las cuales, Dythemis sterilis (Hagen, 1861) fue la especie que presentó la mayor abundancia con 323 individuos (31,2 %) y mantuvo su dominancia durante seis de los siete meses de muestreo; además de que fue recolectada solo en estado larval.

Otras especies con representación significativa fueron Telebasis filiola (Perty, 1834) con 117 individuos y Coryphaeschna adnexa (Hagen, 1861) con 109 individuos. Estas dos últimas suman 21,8 % de la abundancia general (Fig.2).

El estimador Shapiro-Wilks mostró que no existe una distribución normal de los datos. El análisis de varianza de Kruskal-Wallis arrojó que no existen diferencias significativas entre los muestreos (P= 0,438) entre cuadrantes (P = 0,535) ni por estación (P = 0,828). Sin embargo, a nivel de sustrato se registraron diferencias estadísticas significativas (P= 0,001).
Es notable que las especies de odonatos recolectadas en estado preimaginal presentaron una amplia ocupación de los sustratos disponibles en la Ciénaga San Juan de Tocagua. El 78,5 % de las especies se registraron en todos los coriotopos estudiados. Las especies que no presentan este comportamiento fueron: Telebasis salva (Hagen, 1861), Telebasis sp y Erythrodiplax fervida (Erichson, 1848) que no se encontraron en el fango.
Por otro lado, los resultados muestran una marcada relación con el clima, en donde el sustrato fango incrementa su riqueza durante el período de sequía (Fig.3), el sustrato macrófitas enraizadas también aumenta su abundancia durante este período (Fig.4), mientras que macrófitas flotantes libres, no muestran variaciones en su composición durante los periodos de lluvia o sequía.

Figura 3. Variación temporal de la riqueza de larvas por microhabitat, en la ciénaga San Juan de Tocagua Atlántico-Colombia, septiembre (2006) a marzo (2007). (ME: macrófitas enraizadas, MF: macrófitas flotantes libres, FG: fango).

Figura 4. Variación temporal de la abundancia de náyades por microhábitat, en la ciénaga San Juan de Tocagua Atlántico-Colombia), septiembre (2006) a marzo (2007). ( M.E: macrófitas enraizadas, M.F: macrófitas flotantes libres, FG: fango).
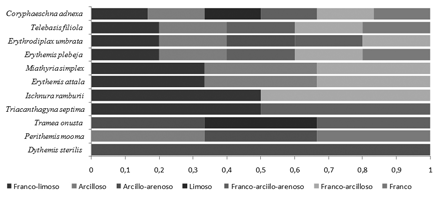
El análisis de la incidencia de la textura del sedimento en la riqueza y la abundancia de larvas mostró que el 36,3 % de las especies ocupan el 71,6 % de los sedimentos, el otro 36,3 % de los odonatos, fueron recolectados en el 42 % de los tipos de textura (Fig.5). No obstante, se registra selectividad de la especie D. sterilis, debido que a pesar de ser la especie de larva más abundante, estuvo restringida al sedimento arcillo-arenoso, siendo uno de los tipos de textura con valores de cobertura relativa más bajos (2,5 %).

Figura 5. Relación entre la abundancia relativa de larvas y
tipos de textura del sedimento, en la Ciénaga San Juan de Tocagua,
Atlántico-Colombia, septiembre (2006) a marzo (2007).
El análisis de las frecuencias de presencias de los individuos inmaduros en los tipos de sedimentos, muestra que sólo C. adnexa ocupa de manera generalizada seis de los siete tipos de textura disponibles. Tres especies adicionales (27,3 %) se registraron en cinco tipos de textura y el resto de las especies presentaron una distribución no homogénea, con ausencia de individuos en varios tipos de texturas (Fig.6).
Respuesta a las características físico-químicas de la ciénaga. Los porcentajes de materia orgánica oscilaron entre 1,4 y 8,5 %, lo que evidencia gran contenido de biomasa en proceso de descomposición.
El 57 % de las especies no mostraron relación con las variables físico-químicas. No obstante, se registró dependencia de seis especies a determinadas variables (Tabla 3), lo cual refleja la posible sensibilidad de éstas, a variaciones de las condiciones limnológicas en la ciénaga. Las especies D. sterilis, Miathyria simplex (Rambur, 1842), Tramea onusta Hagen, 1861 y Erythrodiplax umbrata (Linnaeus, 1758) presentaron relación directa con la temperatura. Erythemis attala (Selys in Sagra 1857) se relacionó de forma directa con el pH e inversa con la salinidad y la transparencia. Por ultimo, Erythemis plebeja (Burmeister, 1839) mostró relación directa con el pH y de manera inversa con la salinidad.

DISCUSIÓN
Las macrófitas representaron el microhábitat de mayor preferencia para la ocupación de larvas de Odonata, dado que éstas proporcionan un lugar más estable espacial y temporalmente (Stewart y Samways, 1998; Ferreira-Perruqueti & De Marco Jr, 2002). Margalef (1983) destaca la importancia de la vegetación acuática como refugio para las comunidades asociadas, y el aumento de su biomasa podría formar nichos más amplios y a su vez incrementar la abundancia de los macroinvertebrados (Fulan & Henry, 2007). Además, el hecho de que las especies del género Telebasis no se colectaran en el sustrato fango, es debido a su hábito escalador, que pudo haber sido determinante para la abundancia de Telebasis filiola. Según Carvalho & Nessimian (1998) Cyanallagma, Enallagma, Homeoura, Ischnura, Oxyagrion y Telebasis presentan hábito escalador y pueden buscar lugares mas protegidos de perturbaciones ambientales como los pulsos de inundación (Fulan y Henry, 2007).
Por otro lado, la presencia de la especie D. sterilis sólo en estado larval puede ser explicada si se tiene en cuenta que algunas náyades de Odonata presentan períodos de emergencia muy específicos (Corbet, 1999; Cordero, 2000). Además, es probable que durante el tiempo de emergencia el adulto no esté utilizando el sistema acuático como zona de actividad y solo utilice éste durante el periodo de cópula y oviposición.
La presencia de lluvias influencia la dinámica temporal de la abundancia de larvas, resultado que se explica si se considera que durante el período de lluvias ocurre una ampliación de las áreas o microhábitats propicios para la oviposición de algunas especies. Adicionalmente, el incremento de éstas se asocia con fuertes perturbaciones en ambientes lénticos (Bass y Potts 2001), como es el caso de la Ciénaga de San Juan de Tocagua, entre las que se destacan las inundaciones de las riberas y el incremento de los sedimentos, entre otros. Estas condiciones diminuyen las probabilidades de supervivencia de algunos macroinvertebrados bentónicos (Domínguez et al.2005). No obstante, el incremento de la riqueza y abundancia de náyades para los sustratos fango y macrófitas flotantes, pueden estar influenciados por la estabilización del sedimento, debido a que durante las lluvias existe una remoción significativa de éste y entrada de material a la ciénaga producto de las escorrentías locales (Brasher 2003). Por otra parte, el sustrato macrófitas flotantes libres se mantiene constante temporalmente, dado que es arrastrado o desplazado con el incremento del pulso de inundación, pero no se ven afectadas sus propiedades físicas. Otra explicación de esto, podría ser la emergencia sincronizada durante las lluvias (Corbet 1999), período durante el cual los imagos se desplazan sin dificultad para realizar su cortejo y reproducción; además, durante las lluvias se presentan charcas temporales en áreas aledañas, dichos microhábitats posibilitan oviposiciones dispersas, mientras que para los períodos de sequía, la única oferta disponible para ovipositar es el espejo de agua de la ciénaga, facilitando una mayor congregación de larvas.
La alta similitud en las poblaciones de larvas que ocupan las macrófitas
enraizadas y flotantes, puede deberse a la mayor disponibilidad de alimento
y refugio, para evitar depredadores activos (Rantala et al., 2004; Stewart y
Samways, 1998). Por el contrario, el sustrato fango se convierte en un microhábitat
más inestable en cuanto a la oferta de alimento e intercambio gaseoso
(Osborn, 2005). Esto es corroborado por la baja abundancia y la riqueza registrada
para este microhábitat, lo que indica que las especies allí presentes,
exhiben una menor sensibilidad a los cambios físicos del microhábitat.
Los porcentajes de materia orgánica, están por encima de los reportados
en la Ciénaga de Malambo (1,65-2,60 %) (Cogollo, 2007) y se encuentran
dentro de los rangos reportados para la Ciénaga de Mallorquín
Franco (2007). Esta materia orgánica se origina de la descomposición
de la vegetación acuática, presenta discontinuidad estando en
forma de parches. El análisis de correlación de Spearman reveló
que el contenido de materia orgánica sólo muestra una leve relación
con la abundancia de E. attala, sin embargo al ser esta relación
baja, puede ser considerada biológicamente irrelevante. Esto no permite
realizar una interpretación adecuada de este comportamiento (Tabla
4). Además, debido a que los odonatos son depredadores activos, la
materia orgánica puede tener influencia directa con la fauna acompañante
que en su mayoría es de hábitos detritívoros (Muzón
& Ellenrieder, 1998).

Varios estudios han demostrado que la calidad de agua de los ecosistemas acuáticos posee un impacto importante en sus componentes biológicos (Delong & Brusven, 1998; Brasher, 2003) De igual manera Corbet (1999) plantea que las características físico-químicas del agua influye directamente en la ecología y el comportamiento de los odonatos. Sin embargo, la acción precisa de estos factores separados es difícil y a menudo inapropiada debido a que estos interactúan entre si y tienen efectos a largo plazo. En nuestro caso, las variables físico-químicas no presentaron relación con la dinámica del ensamblaje de larvas. Un resultado similar fue reportado por Salmah et al. (1998), quienes estudiaron la relación entre algunos de estos factores y la abundancia larval de Neurothemis tullia (Drury, 1773) en cultivos de arroz a exposición de insecticidas. Esto permite suponer que existen otros factores que determinan la dinámica del ensamblaje, como puede ser la presencia de depredadores (Nemjo, 1990). Merrill & Johnson (1984), proponen la hipótesis de que la depredación que otros organismos ejercen sobre la fauna de odonatos, podría ser la causa fundamental de su composición y estructura en sistemas acuáticos. Por lo tanto, las especies posiblemente están adaptadas a los cambios de las condiciones físico-químicas de este tipo de ecosistema altamente impredecible.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a todas aquellas personas que de una u otra forma colaboraron en la realización de este trabajo. A los pobladores del corregimiento San Juan de Tocagua. Al laboratorio de suelos del ICA seccional Atlántico, a Mariela Lobo por su ayuda en la fase de campo, a los doctores Rodolfo Novelo y Adolfo Cordero por sus valiosos comentarios y a los evaluadores anónimos por sus sugerencias que ayudaron a mejorar la calidad del escrito.
LITERATURA CITADA
1. ARANGO, J.C. & G. ROLDAN. 1983. Odonatos inmaduros del departamento de Antioquia
en diferentes pisos altitudinales. Actualidades Biológicas 12 (46): 91-115.
2. BASS, D. & C. POTTS. 2001. Invertebrate comunity composition and physicochemical
conditions of boehler lake, atoka country, Oklahoma. Proc. Okla. Sci. 81: 21-29.
3. BRASHER, A.M.D. 2003. Impacts of human disturbance son biotic communities
in Hawaiian Streams, BioScience 4 (53): 1052-1060.
4. BOUL, S., F. HOLE & R. CRACKEN. 1973. Soil genesis and classification. The
Iowa University Press, Ames, Iowa 9 (14): 360-365.
5. CARVALHO, A.L. & J.L. NESSIMIAN. 1998. Odonata do Estado do Rio de Janeiro,
Brasil: habitats e hábitos das larvas. En: Nessimian, J.L.; Carvalho, A.L. (eds.).
Ecologia de insectos aquáticos. Rio de Janeiro: UFRJ. Programa de Pós-Graduação
em Ecologia, Oecologia Brasiliensis 14 (5): 3-28.
6. CORBET, P.S. 1999. Dragonflies. Behavior and ecology of Odonata. Harley Books.
Nueva York, 829 pp.
7. COGOLLO, B.A. 2007. Determinación de metales pesados ( Pb,Cu,Cd,Zn) en el
bivalvo Polymesoda solida presente en la Ciénaga de Malambo en el Departamento
del Atlántico durante seis meses comprendidos entre los años 2006 y 2007. 48
pp.Tesis de grado- Universidad del Atlántico, Facultad de Ciencias Básicas.
Programa de Biología, Barranquilla
8. CORDERO, A. 2000. Distribution, hábitat requirements and conservation Macromia
splendens (Odonata: Corduliidae) in Galicia. International Journal of Odonatology
3 (1): 73-83
9. CENTRO DE ESTUDIOS AMBIENTALES (CEA). 1995 Universidad Del Magdalena Estudio
Limnológico de las Ciénagas Luruaco, Tocagua y Totumo. Secretaria de Desarrollo
Agropecuario, Universidad del Magdalena, Santa Marta, 50 pp.
10. DE MARCO, P. Jr. & M.V.C. VITAL. 2008. Ecology of Tigriagrion aurantinigrum
Calvert in response to variations in environmental conditions (Zygoptera: Coenagrionidae).
Odonatologica 37 (1): 1-11.
11. DOMINGEZ, G.L., P.L. GOETHALS & N. DE PAUW. 2005. Aspectos del ambiente
físico-químico del Río Chaguana: un primer paso en el uso de los macroinvertebrados
bentónicos en la evaluación de su calidad de agua. Revista Tecnológica ESPOL
48 (1): 127-134.
12. DELONG, M.D. & M.A. BRUSVEN. 1998. Macroinvertebrate community structure
along the longitudinal gradient of an agriculturally impacted streams. Environmental
Management 7 (22): 445-447.
13. FRANCO, A. 2007. Determinación de las concentraciones de Metales pesados
(Pb,Cd,Cu y Zn ) en sedimentos y un organismo de interés comercial (Corbula
caribaea) de la Zona superficial Submareal de la Cienaga de Mallorquín- Atlántico.
124 pp.Tesis de grado. Universidad del Atlántico, Facultad de Ciencias Básicas,
Programa de Biología, Barranquilla.
14. FERREIRA-PERUQUETTI, P.S. & P.J.R. DE MARCO. 2002. Efeito da alteração ambiental
sobre a comunidade de Odonata em riachos de Mata Atlântica de Minas Gerais,
Brasil. Revista Brasileira de Zoologia 19: 317327.
15. FULAN, J.A. & R. HENRY. 2007. Distribuição temporal de imaturos de Odonata
(Insecta) associados a Eichhornia azurea (Kunth) na Lagoa do Camargo, Rio Paranapanema,
São Paulo. Revista Brasileira de Entomologia 21 (2): 224-227.
16. HOLDRIGE, L. 1978. Ecología basada en zonas de vida. Instituto Interamericano
de Ciencias Agrícolas 16 (5) : 124-131.
17. HAMMER, O., D.A.T. HARPER, D.A.T. & P.D. RYAN. 2001. PAST: Paleontological
Statistics Software Package for Education and Data Analysis. Palaeontologia
Electronica 4. Disponible en: http://palaeoelectronica.org/2001_1/past/issue1_01.htm
[Fecha de revisión: 25 junio 2007]
18. JOHNSON, D.M., P.H. CROWLEY, R.E. BOHANAN, C.N. WATSON & T.H. MARTIN. 1985.
Competition among larval dragonflies: A field enclosure experiment. Ecology
66 (1): 119-128.
19. JOHNSON, D.M., C.L. PIERCE, T.H. MARTIN, C.N. WATSON, R.E. BOHANAN & P.H.
CROWLEY. 1987. Prey depletion by odonate larvae: combining evidence from multiple
field experiments. Ecology 68 (5): 1459-1465
20. MARGALEF, R. 1983. Limnología. Ed. Omega, Barcelona, 952 pp.
21. MCCAFFERTY, P.W. & A.V. PROVONSHA. 1981. Aquatic Entomology.Science Books
Ins.448 pp.
22. MERRILL, R.J. & D.M. JOHNSON. 1984. Dietary niche overlap and mutual predation
among coexisting larval Anisoptera. Odonatologica 13: 378-406.
23. MORA-OLIVO, A. & J. VILLASEÑOR. 2007. Diversidad y distribución de la flora
vascular acuática de Tamaulipas, México. J. Bot. Res. Inst. Texas 1(1): 511-527.
24. MUZÓN, J. & N. ELLENRIEDER. 1998. Biodiversidad de artrópodos argentinos.
Ediciones Sur, La Plata, 39 pp.
25. NEMJO, J. 1990. The impact of colonization history and fish predation an
larval odonates (Odonata: Anisoptera) in central new Jersey farm pond. Journal
of Freshwater Ecology 5: 297-305.
26. NIBA, A.S. & M.J. SAMWAYS. 2006. Remarkable elevational tolerance in an
African Odonata larval assemblage. Odonatologica 35 (3): 265-280.
27. OSBORN, R. 2005. Odonata as indicators of habitat quality at lakes in Louisiana,
United States. Odonatologica 34 (3): 259-270.
28. OSBORN, R. & M.J. SAMWAYS. 1996. Determinants of adult assemblage patterns
at new ponds in South Africa. Odonatologica 25: 4958.
29. RALPH, J.C., R. GEUPEL, H. GEOFFREY, P. PYLE, E.T. MARTIN, F. DESANTE &
B. MILA. 2000. Manual de métodos de campo para el monitoreo de aves terrestres.
General technical Report, Albany, C.A: Pacific Southwest Station, Forest Service,
U.S. Department of Agricultura. 73 pp.
30. RANTALA, M.L., J. IILOMEN, J. KOSKIMAKI, J. SUHONEN & K. TYNKKYNEN. 2004.
The macrophyte, Stratiotes aloides, protects larvae of dragonfly Aeshna viridis
against fish predation. Aquatic Ecology 38: 77-82
31. ROLDÁN, G. 1996. Guía para el estudio de los macroinvertebrados acuáticos
del Departamento de Antioquia. Bogota, Colombia: Fondo para la protección del
medio Ambiente José Celestino Mutis : Fondo Colombiano de Investigaciones
Científicas y Proyectos Especiales Francisco José de Caldas. Bogota: Universidad
de Antioquia, 217 pp.
32. SALMAH, M.R., S.T. HASSAN, A.A. HASSAN & A.B. ALI. 1998. Influence of physical
and chemical factors an the larval abundance of Neurothemis tulia (Druty) (Odonata:Libellulidae)
in a rain fed rice field. Hydrobiologia 389: 193-202.
33. STATPOINT. 2006. STATGRAPHICS® Centurion XV. Statistical Exploration and
Modeling Software. Disponible en: www.statgraphics.com. [Fecha de revisión:
17 de julio de 2008]
34. STEYTLER, N. S. & M.J. SAMWAYS. 1995. Biotope selection by adult male dragonflies
(Odonata) at an artificial lake created for insect conservation in South Africa.
Biological Conservation 72: 381-386.
35. STEWART, D.A. & M.J. SAMWAYS. 1998. Conserving dragonfly (Odonata) assemblages
relative to river dynamics in an African savanna game reserve. Conservation
Biology Seattle 12 ( 3): 638-692.
36. WARD, J.V. 1992. Aquatic Insect Ecology: Biology and Habitat. John Wiley
& Sons, Nueva York, 438 pp
37. WARD, L. & P.J. MILL. 2008. Substrate selection in larval Calopteryx splendens
(Harris) (Zygoptera: Calopterygidae). Odonatologica 37(1): 69-77. 38. WALKLEY,
A. & L.A. BLACK. 1934. An examination of the method for determining soil organic
matter, and a proposed modification of the chromic acid titration methods. Soil
Science 37:29-38. 39. WESTFALL, M.J. & K.J. TENNESSEN. 1996. Odonata: 164-211.En:
Merritt, R. y K. Cummins (Eds.). An Introduction to the aquatic insects of North
America. Kendall/Hunt Publishing Company, 3ª edición.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2010 Caldasia

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cual estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).























