Publicado
CLAVE ILUSTRADA DE LOS RENACUAJOS EN LAS TIERRAS BAJAS AL ORIENTE DE LOS ANDES, CON ÉNFASIS EN HYLIDAE
An illustrated key to the tadpoles in the eastern lowlands of Colombia,
with emphasis on the Hylidae
JOHN D. LYNCH
ÁNGELA M. SUÁREZ MAYORGA
Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Apartado 7495, Bogotá D. C., Colombia. johndouglaslynch@gmail.com
Instituto Alexander von Humboldt, Bogotá D. C., Colombia. angela.suarezmayorga@gmail.com
RESUMEN
La fauna de hílidos en las tierras bajas de Colombia al oriente de los
Andes consta de 72-73 especies (una identificada tentativamente), lo que representa
casi el 40% de todas las especies de ranas de la región y un 10% de la
fauna total de anuros del país. La mayoría de estas especies se
reproducen en ambientes lénticos y pocas taxones lo hacen en quebradas
lentas, huecos en troncos de árboles y fitotelmas. En este trabajo
se ilustran los renacuajos de 41 especies, incluyendo ocho especies previamente
desconocidas y tres nunca ilustradas.
Palabras clave. Colombia, Hylidae, Renacuajos, taxonomía, morfología.
ABSTRACT
The hylid frog fauna of the Colombian lowlands east of the Andes consists of
72 or 73 species (one identified only tentatively), comprising about 40% of
all frog species of that region and 10% of the total frog fauna known for the
country. Most lowland hylids reproduce in lentic waters and few species reproduce
in sluggish streams, treeholes, and bromeliads. The tadpoles of 41 species are
illustrated in this study, including eight previously unknown and three others
never before illustrated.
Key words. Colombia, Hylidae, Tadpoles, taxonomy, morphology.
Recibido: 08/09/2009
Aceptado: 20/04/2011
INTRODUCCIÓN
Aunque la fauna anfibia del país está conocida en mucho detalle, existe mucha dificultad para la identificación de renacuajos, aun en las tierras bajas (exceptuando las valles interandinos y la región Caribe). Lynch (2006a) trabajó con los renacuajos de las valles interandinos y la región Caribe pero pocas especies son compartidas con el oriente de los Andes. Las descripciones disponibles en Duellman (1978) y Rodríguez & Duellman (1994) sirven para unas pocas especies y las ilustraciones de Hero (1990) son parcialmente complementarias a las descripciones disponibles.
El enfoque de este artículo es sobre renacuajos de la familia Hylidae por dos razones: (1) esta familia es la segunda más grande de ranas de Colombia y está muy bien representada en las tierras bajas y (2) la variación morfológica entre especies es muy notable, facilitando con mucha frecuencia la identificación a nivel de especie. Sin embargo, tras una inspección cruda del problema continúa siendo muy sencillo confundir un renacuajo con otro y por ello decidimos incluir -sin identificar hasta especie en muchos casos- renacuajos no hílidos en nuestra clave, que le permitan a personas con intereses distintos a los nuestros reconocer su material.
Basándose en las colecciones del ICN, más registros de la bibliografía (pero con nuestras correcciones), la fauna de Hylidae de estas tierras es no menor que 72 ó 73 especies de las cuales solamente nueve (Hypsiboas boans, H. crepitans, H. pugnax, Pseudis paradoxa, "Scarthyla" vigilans, Scinax rostratus, S. ruber, S. x-signatus y Trachycephalus venulosus) se encuentran en la zona trans-Andina. Cuatro géneros albergan 54 especies: Dendropsophus (17), Hypsiboas (16), Osteocephalus (10) y Scinax (11). De la fauna, del oriente de los Andes, pocas especies (Dendropsophus mathiassoni, Hypsiboas crepitans, H. pugnax, Pseudis paradoxa, "Scarthyla" vigilans, Scinax blairi, S. kennedyi, S. rostratus, S. wandae, y S. x-signatus) están restringidas a la zona de Los Llanos Orientales de Colombia. La gran mayoría se encuentra exclusivamente en los bosques amazónicos.
A pesar de nuestros esfuerzos, a la fecha el conocimiento de los renacuajos colombianos sigue estando en un nivel poco aceptable -dos artículos descriptivos de Suárez-Mayorga y Lynch (2001a, b) y una clave ilustrada sobre los renacuajos de la región Caribe y valles interandinos por Lynch (2006a)- con adiciones y apuntes en algunas descripciones de las larvas que, a nuestro juicio, contienen errores gracias a la tendencia tipológica de entonces. Entre éstas podemos mencionar Bokermann (1963a, b); Duellman (1972a, b, c, d); Hero (1990); Kaplan (1991, 1994); Kaplan & Ruiz, (1997); Kluge (1979); McDiarmid & Altig (1990) y Trueb & Duellman (1983). Además, existen en la bibliografía algunas descripciones con identificaciones poco probables, normalmente sin correcciones publicadas.
Lynch (2006b, 2007) publicó listas de especies de ranas conocidas de algunos sectores al oriente de los Andes en Colombia. Estas listas, con algunas correcciones, suman 164 especies (casi el 25% de la fauna colombiana) nombradas (24 brachycephálidos, 12 bufónidos, 8 centrolénidos, 1 ceratóphryido, 12 dendrobátidos, 2 hemiphráctidos, 61 hílidos, 8 leiupéridos, 23 leptodactylidos, 10 microhílidos, 2 pípidos y un ránido). Los brachycephálidos, hemiphráctidos y pípidos de las tierras bajas al oriente de los Andes en Colombia carecen de renacuajos pero las otras 136 especies si tienen.
Esta contribución sigue el patrón establecido por Lynch (2006a) de ofrecer ilustraciones (vista dorsal, vista lateral y detalle del aparato oral) de los renacuajos de la mayoría de las especies. La región extensa de Colombia al oriente de los Andes y por debajo de los 1000 metros es hogar de muchas especies de ranas, la gran mayoría de ellas con renacuajos. Después de ocho años, la colección principal de renacuajos del país (la del Instituto de Ciencias Naturales) ha logrado albergar e identificar renacuajos de la mitad de las especies colombianas que tienen renacuajos; no obstante, para muchas especies amazónicas no contamos con ejemplares de larvas identificados en colección, así que para estas especies tuvimos que asumir que las ilustraciones o descripciones ya publicadas eran correctas y suficientes para ser incluidas en una clave.
En la clave, hemos utilizados caracteres relativamente obvios con la consecuencia de que varios taxones han salidos en mas que un punto. Las razones por una especie saliendo en más que un punto son varios pero principalmente por la variación ontogenética (contrastando renacuajos muy tempranos con renacuajos más avanzados) evidente en estos caracteres obvios.
METODOLOGÍA
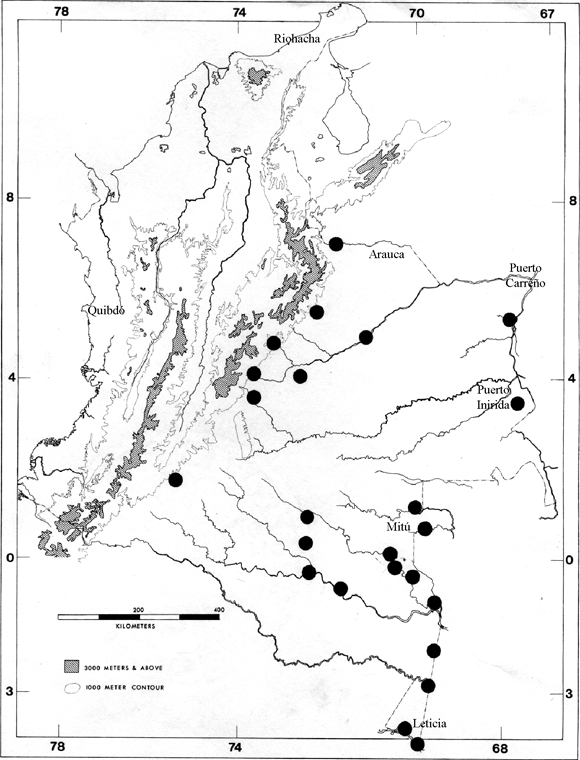
Ésta clave pretende incluir información sobre las larvas de la totalidad de especies de Hylidae registradas para el país en tierras bajas al oriente de la Cordillera Oriental, aunque contamos únicamente con colecciones de 86 localidades en la región (Figura 1). No obstante, las larvas de algunas especies son desconocidas en el mundo y, en varios casos, lo aquí presentado se constituye en la primera información publicada sobre las larvas de la especie en mención, en ausencia de descripciones formales que se encuentran en preparación. La identificación taxonómica y la descripción de caracteres presentes en los géneros y especies aquí considerados están en una amplia proporción soportados por registros de colección depositados en el Museo de Historia Natural del Instituto de Ciencias Naturales -ICN- (véase material examinado Apendice 1), con excepción de aquellos en los que explícitamente se hace referencia a bibliografía consultada (sobre el texto o con comentarios o apuntes sobre la clave).
Figura 1. Localidades al oriente de los Andes para cuales el ICN tiene colecciones
de renacuajos. Cada punto del mapa puede cubrir hasta 25 localidades distintas.
Sobre caracteres
Esta clave ha sido preparada y pensada para personas con poca experiencia en
renacuajos y por eso hemos evitado atención a unos caracteres mas conocidos
por profesionales en herpetología, a favor de caracteres que necesitan
un conocimiento más general. La clave intenta identificar a nivel de
especie renacuajos de la familia Hylidae del oriente de los Andes en Colombia.
Esta clave incluye también otros anuros (identificados hasta familia
o género y en pocos casos a especie) dado que sus renacuajos pueden ser
capturados simultáneamente con renacuajos de hilidos.
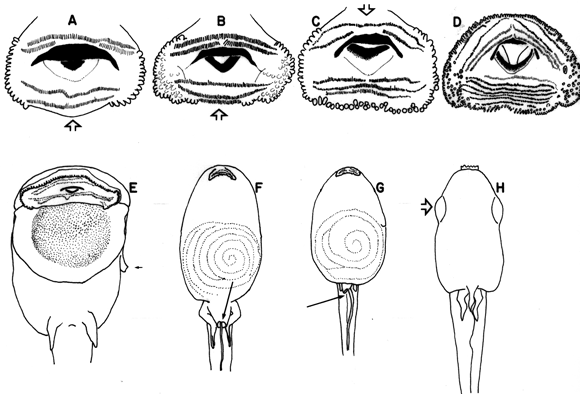
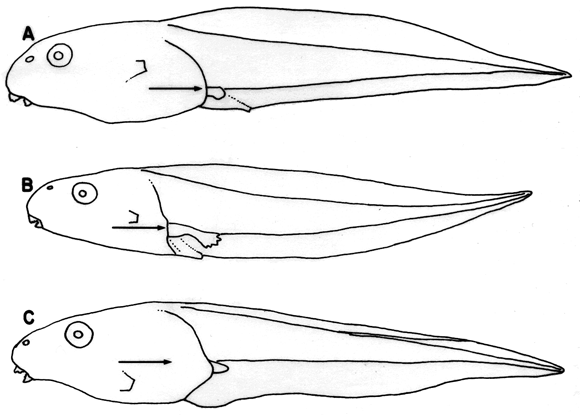
La clave utiliza, en general, caracteres bien conocidos y superficiales. Varios de estos (Fig. 2-Fig. 3) están concentrados en el disco oral (papilas marginales, rostrodontes, hileras de dientes, espacios mediales dentro una hilera de dientes) y otros sobre morfología general (disposición de los ojos, posición del espiráculo, tamaños relativos de aletas y su extensión hacia delante). Una desventaja de estos caracteres es que pocas hipótesis de polarizaciones han sido propuestas o aceptadas.
Figura 2. Arriba: Discos orales de renacuajos seleccionados mostrando los
cuatro patrones de distribución de las papillas marginales. (A) Pseudopaludicola
pusilla, ICN 45519, (B) Physalaemus fischeri, ICN 45992, (C) Leptodactylus
fragilis, ICN 45005, (D) Hypsiboas hutchinsi, ICN 34760. Debajo: vistas ventral
de renacuajos seleccionados: (E) Atelopus ebenoides, ICN 33205, flecha indicando
el espiráculo libre posteriormente, (F) Leptodactylus insularum, ICN
54808, flecha indicando el tubo cloacal medial, (G) Smilisca phaeota, ICN
(no catalogado), flecha indicando el tubo cloacal destral, y (H) Dendropsophus
leucophyllatus, ICN 45669, flecha indicando los ojos visibles en vista ventral.
Figura 3. Renacuajos en vista lateral muestreando la posición del
espiráculo en relación al borde ventral de la musculatura de
la cola (marcado con flecha). (A) Hypsiboas pugnax, ICN 49353, (B) Scinax
garbei, ICN 45608, (C) Phyllomedusa vaillanti, ICN 53173.
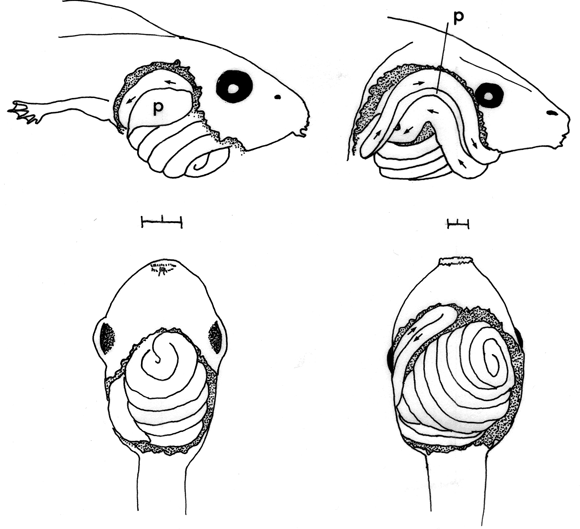
Sin embargo, en el curso de nuestra investigación, hemos detectado un carácter que se puede polarizar aunque no ha sido utilizado en la clave. En la gran mayoría de renacuajos el intestino consta de tres partes: un intestino anterior, medio y posterior ("fore-gut, mid-gut y hind-gut," Viertel & Richter, 1999) y la arquitectura del intestino muestra el intestino anterior ("fore-gut") y el intestino medio ("mid-gut") por encima de espiral del intestino. En renacuajos con tejidos poco pigmentado, se puede observar el espiral mientras el intestino anterior y intestino medio están ocultos. Renacuajos de tres especies de hilidos de la fauna colombiana muestran otra arquitectura, visible en la vista ventral o sobre la superficie del lado derecho (diestra) (Fig. 4). En estos renacuajos, el límite entre el intestino medio e intestino posterior ("hind-gut"), el cual corresponde con la unión del ducto hepático, está desplazada hacia el lado diestro formando una vuelta del intestino que conduce hacia la gula antes de volver y entrar al espiral del intestino. La polarización de este carácter se puede hacer por dos maneras (el mas general versus el menos general de Nelson & Platnick, 1981; o por el grupo externo versus el grupo interno). En ambos casos, el desarrollo de una vuelta gular sale como la condición derivada y la ausencia de esta extensión como primitiva.
Figura 4. Renacuajos de Scinax rostratus (a la izquierda) y Pseudis paradoxa
(a la derecha) en vistas del lado derecha (arriba) y ventral (debajo) con
los tejidos del abdomen sacados muestreando la ruta del intestino. Las flechas
(dentro el intestino) muestran direccionalidad. p = páncreas. Escalas
son de dos milímetros.
Con base en una filogenia molecular, Faivovich et al. (2005) unieron Dendropsophus, Lysapsus, Pseudis, Scarthyla, Scinax, Sphaenorhynchus y Xenohyla dentro de una tribu Dendropsophini (subfamilia Hylinae). En un análisis muy parecido pero con menos taxones de Hylidae, Frost et al. (2006) fraccionaron la tribu agrupando Dendropsophus con Lysapsus, Pseudis y Scarthyla mientras que Scinax y Sphaenorhynchus eran agrupados con Aplastodiscus, Hyloscirtus e Hypsiboas. Aguiar et al. (2007) en otra filogenia molecular (sin sinapomorfias), argumentaron que Lysapsus estaba metido dentro Pseudis; por esto, ellos combinaron los dos géneros.
Nosotros tuvimos acceso a los renacuajos de muchas especies de Dendropsophus, Hyloscirtus, Hypsiboas y Scinax, mas los renacuajos de Sphaenorhynchus (tres especies), Scarthyla (ambas especies) y una especie asignada originalmente (por nosotros) a Lysapsus (L. limellulus) y una a Pseudis (P. paradoxa). Los renacuajos de Dendropsophus, Hyloscirtus, Hypsiboas, Scinaxy y Sphaenorhynchus (igual con renacuajos de Atelopus, Centrolene, Ceratophrys, Chiasmocleis, Colostethus, Dendrobates, Elachistocleis, Gastrotheca, Leptodactylus, Lithobates, Phyllomedusa, Physalaemus, Pipa, Pleurodema, Pseudopaludicola, Rhaebo, Rhinella, Scarthyla goinorum y Trachycephalus) muestran la condición plesiomorfica mientras la condición derivada fue observada en Pseudis limellus, P. paradoxa y Scarthyla vigilans. En una clasificación basada en la evidencia, Scarthyla vigilans debe ser asignada a un grupo que contiene las especies de Pseudis (siguiendo Aguilar et al., 2007). Este carácter muestra que Barrio-Amorós et al. (2006) cometieron un error al asignar "Hyla" vigilans a Scarthyla, basados en sus razones (los adultos fueron imposibles de distinguir para ellos). Scarthyla vigilans no se parece a las demás especies de Pseudis pero en vez de proponer un género nuevo (y monotípico), preferimos asignar la especie a un género reconocido (basada en la evidencia y no en nuestras impresiones). Esto resulta en una combinación nueva, Pseudis vigilans (Solano).
Búsqueda y colecciones de renacuajos
Para incrementar la disponibilidad de material de base en esta colección,
se realizaron inicialmente muestreos selectivos en algunos hábitats reportados
en literatura -bosques inundables amazónicos, charcos estacionales
al interior del bosque, sabanas inundables, entre otros- y posteriormente
se estableció un plan de muestreos estandarizados en áreas estratégicas
enmarcado en los permisos de colecta vigentes. Las técnicas de muestreo
siguieron en principio las utilizadas con anterioridad por ambos autores (similares
a las presentadas por McDiarmid & Altig 1999a) pero para los hábitats
amazónicos fue necesario diseñar técnicas propias que se
describen a continuación. Para el muestreo de raíces de vegetación
flotante (buchón y gramalote) se utilizaron redes circulares planas de
anjeo plástico fino (ojo de malla 1 mm), que se deslizaron manualmente
en sentido horizontal bajo la superficie, de forma que recogieran los residuos
de vegetación y las larvas mientras filtraban el agua. Para el muestreo
en charcos estacionales poco profundos al interior del bosque se utilizaron
redes cortas de acuario y redes rectangulares de fondo. Para arroyos estacionales
y charcos profundos se utilizaron redes rectangulares de fondo con ojo de malla
pequeño, así como mallas de anjeo plástico dispuestas transversalmente
a la corriente. Para muestreos en fitotelmas, se utilizaron la captura
manual con destrucción (en el caso de bromelias y aráceas) y el
vaciado de contenidos en huecos de troncos.
Con el fin de identificar con certeza el material existente, se procuró colectar series de desarrollo que mostraran las secuencias ontogenéticas (para detectar cambios en LTRF), y en adición, se preservó el material secuencialmente en campo, como se sugiere en Cortez-F. et al. (2006). Además, se realizaron visitas a las colecciones de referencia de la Universidad de Kansas (KU) en Lawrence y del Smithsonian Institution (NMNH) en Washington.
CLAVE DE RENACUAJOS
Observaciones sobre la forma y posición de algunas estructuras u órganos se indican en ilustraciones sobre el texto de la clave (ver, especialmente, Fig. 2 y Fig. 3). En algunos casos, hemos hechos comentarios sobre la clave; éstos están numerados y entre paréntesis.
1. Rostrodontes ("picos córneos" en la boca) presentes..................................................2
1'. Rostrodontes ("picos córneos" en la boca) ausentes..........................Microhylidae
(1)
2. Ojos en posición dorsal o dorsolateral, es decir, no visibles o solamente
visibles en su 1/5 inferior cuando la larva se observa en aspecto ventral (Figura
2E-G).................3
2'. Ojos en posición lateral, es decir, visibles en la mayor parte
de su extensión en aspecto ventral de la larva (Figura
2H)..............33
3. Disco abdominal presente (Figura 2E)............................................................Atelopus
3'. Disco abdominal ausente.........................4
4. Disco oral descubierto de papilas anterior y posteriormente: el área
libre de papilas (espacio o gap) anterior ocupa 75-80% de la anchura del disco
oral, mientras que la posterior ocupa 20-60% de la anchura del disco oral (Figura
2A-B).........................5
4'. Disco oral bordeado de papilas marginales en toda su extensión,
o papilas ausentes únicamente del margen anterior del mismo (Figura
2C-D)..........................................8
5. Dos hileras anteriores y dos posteriores de dentículos (fórmula
dental 2/2)..................................................Pseudopaludicola
(2)
5'. Más de dos hileras posteriores de dentículos (fórmula
dental 2/3 ó 2/4)........................6
6. Aleta dorsal aproximadamente tan alta como la ventral en toda su extensión.
Extremo caudal usualmente redondeado. Espacio posterior en las papilas usualmente
excede 40% de la anchura del disco oral................Bufonidae (excepto Atelopus),
Pleurodema, Physalaemus fischeri (3, 4)
6'. Aleta dorsal notoriamente más alta que la ventral, especialmente
hacia la mitad de la cola, y que se inicia en la base de la musculatura caudal.
Extremo caudal usualmente acuminado o alargado. Espacio posterior en las papilas
no excede 30% de la anchura del disco oral.............................7
7. Espiráculo separado del cuerpo en su cuarto posterior, papila en la
narina presente............................................Hypsiboas fasciatus
7'. Espiráculo no separado del cuerpo en su cuarto posterior, aunque
notorio; papila en la narina ausente............................................Hypsiboas
granosus (sensu Hero, 1990)
8. Disco oral bordeado completamente por papilas marginales..................................9
8'. Disco oral desprovisto de papilas en el margen anterior.....................................10
9. Tres a cuatro hileras anteriores de dentículos. Patrón de
coloración con un círculo negro en la mitad de la cola translúcida
en preservativo (café y rosáceo, respectivamente, en vida).........................................Hypsiboas
hutchinsi (Plancha 1a)
9'. Seis a trece hileras anteriores de dentículos...........Ceratophrys
cornuta (5)
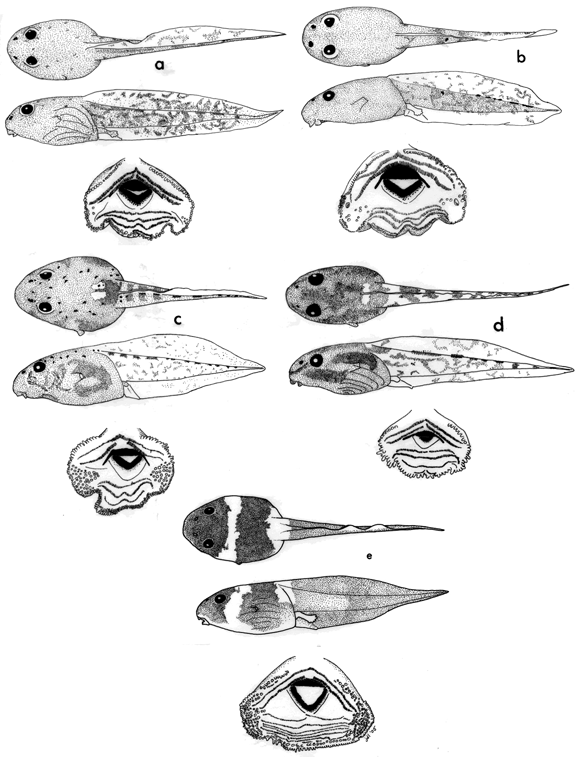
Plancha 1. (a) Hypsiboas hutchinsi en vistas dorsal y lateral; disco oral,
ICN 34760, 33 mm LT; (b) Sphaenorhynchus carneus en vistas dorsal y lateral;
disco oral, ICN 45635, 26 mm LT; (c) Hypsiboas punctatus en vistas dorsal
y lateral; disco oral, ICN 53244, 48 mm LT; (d) Hypsiboas raniceps en vistas
dorsal y lateral; disco oral, ICN 53136, 39 mm LT; (e) Hypsiboas geographicus
en vistas dorsal y lateral; disco oral, ICN 45776, 38 mm LT.
10. Sin hileras de dientes...................Lithodytes lineatus (6),
Ameerega hahneli (7)
10'. Con hileras de dientes........................11
11. Ninguna o una sola hilera anterior de dentículos...............................................12
11'. Más de una hilera anterior de dentículos..................................................................16
12.Una o dos hileras posteriores de dentículos...............................................................13
12'. Tres hileras posteriores de dentículos...15
13. Tamaño de la larva en estadio 35 inferior a 60 mm...................................................14
13'. Tamaño de la larva grande, en estadio 35 superior a 65mm.........................................................Leptodactylus
pentadactylus (8)
14. Renacuajos oscuros....Ameerega hahneli
14'. Renacuajos claros, con aletas usualmente translúcidas a transparentes...............................................Cochranella,
Lithodytes (9)
15. Patrón de coloración en aspecto lateral con una línea
ventrolateral gular y una línea lateral en la mitad de la musculatura
caudal, rojas en vida y púrpura en preservativo....................................Sphaenorhynchus
carneus (10) (Plancha 1b)
15'. Renacuajos prácticamente sin patrón............................................Centrolenidae
16. Igual número de hileras de dentículos queratinizados anteriores
y posteriores, o número de hileras anteriores mayor que número
de hileras posteriores...............17
16'. Número de hileras posteriores de dentículos siempre
mayor al número de hileras anteriores, usualmente 2/3.........18
17. Fórmula dentaria 4/4 ó 5/4............................................................Lithobates
palmipes
17'. Fórmula dentaria 2/2........................[Hypsiboas
granosus sensu Duellman, 1978], [Nyctimantis rugiceps], Lithodytes
18. Aleta dorsal más alta que la aleta ventral, especialmente hacia
la mitad de la cola....19
18'. Aletas dorsal y ventral aproximadamente de la misma altura, o aleta
ventral más alta que la dorsal..........................................27
19. P3 no mas que la mitad de la longitud del P2..........................................................20
19'. P3 por lo menos 2/3 a ¾ la longitud del P2..........................................................21
20. Espacio (gap) anterior en las papilas marginales no superior al 20% de
la anchura del disco oral....................................... Hypsiboas
punctatus (11) (Plancha 1c)
20'. Espacio (gap) anterior en las papilas marginales superior al 30%
de la anchura del disco oral (Fig. 2A-C)..........................................Hypsiboas
raniceps (Plancha 1d)
21. Aletas de cola con patrón de franjas oscuras sobre un fondo translúcido,
claramente visibles en aspectos dorsal y lateral.....................................................22
21'. Aletas de cola sin patrón de franjas oscuras sobre un fondo
más claro, o franjas apenas insinuadas en aspecto dorsal y nunca presentes
en aspecto lateral...................23
22. Última hilera posterior de dentículos notoriamente más
pequeña que las demás, patrón de franjas gruesas completas
verticales en aspecto lateral de larva..................Hypsiboas lanciformis
(Plancha 2a)
22'. Última hilera posterior de dentículos aproximadamente
tan larga como las demás, patrón de franjas delgadas verticales
en aspecto lateral de larva, que no llegan al margen ventral de la aleta ventral...............................................Hypsiboas
calcaratus sensu Duellman, 1978, 2005
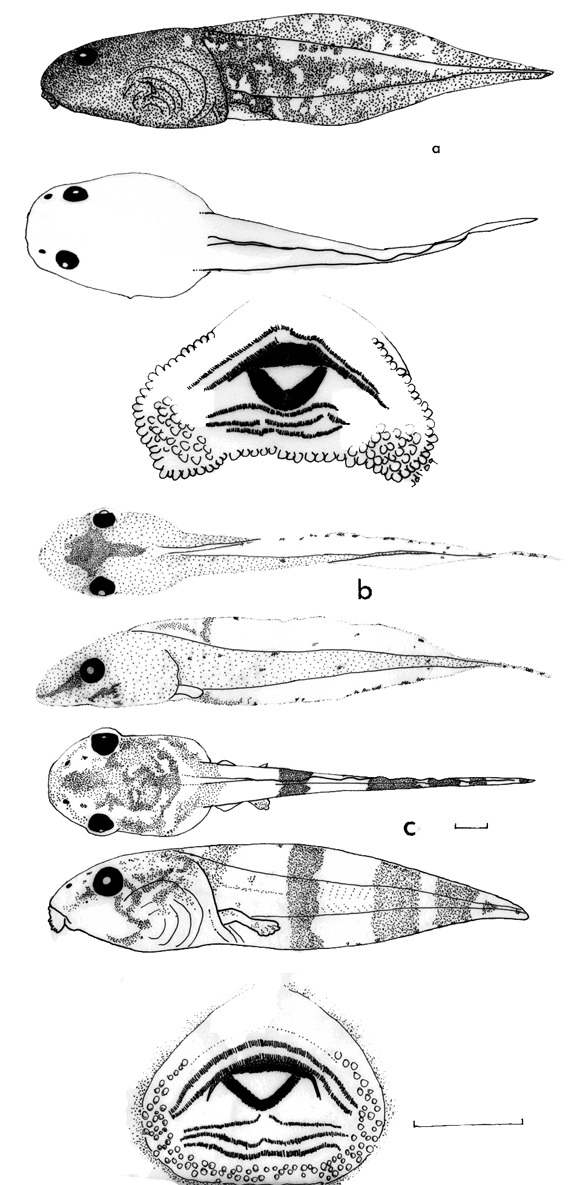
Plancha 2. (a) Hypsiboas lanciformis en vistas dorsal y lateral; disco oral,
ICN 53135, 46 mm LT; (b) Osteocephalus carri en vistas dorsal y lateral, ICN
5694, 47 mm LT.
23. Cuerpo y cola sin patrón; 2/3 a 3/6 hileras de dentículos
queratinizados en la boca. En renacuajos de estadios avanzados es común
una fórmula de 3/4 ó 3/5......................Hypsiboas geographicus
(12) (Plancha 1e)
23'. Cuerpo y cola con patrón............................................24
24. A1 sin espacio medial............................................25
24'. A1 con espacio medial.........................................Hypsiboas
crepitans (Plancha 3a)
Plancha 3. (a) Hypsiboas crepitans en vistas dorsal y lateral; disco oral,
ICN 20710, 45 mm LT; (b) Hypsiboas boans en vistas dorsal y lateral; disco
oral, ICN 45530, 36 mm LT; (c) Hypsiboas wavrini en vistas dorsal y lateral;
disco oral, ICN 54902, 28 mm LT; (d) Hypsiboas pugnax en vistas dorsal y lateral;
disco oral, ICN 49353, 27 mm LT; (e) Osteocephalus cabrerai en vistas dorsal
y lateral; disco oral, ICN 53159, 32 mm LT.
25. Ancho del disco oral aproximadamente 50% ancho máximo del cuerpo.
En estadios tempranos, pueden encontrarse 2/3 hileras de dentículos.
Numerosas papilas submarginales laterales y papilas marginales en el labio posterior
en dos hileras casi continuas.....Hypsiboas boans (Plancha
3b)
25'. Ancho del disco oral 25 a 30% ancho máximo del cuerpo. Papilas
submarginales laterales ausentes o escasos...................26
26. Renacuajos en estadio 25 o superior con 2 hileras anteriores y 3 posteriores
de dentículos queratinizados. Patrón oscuro en las aletas muy
tenue..............................Hypsiboas wavrini (Plancha
3c)
26'. Renacuajos en estadio 28 o superior con 2 hileras anteriores y 4
posteriores de dentículos queratinizados. Cola con diseño o patrón
de reticulaciones oscuras...............................Hypsiboas pugnax
(Plancha 3d)
27. Disco oral con emarginaciones laterales..........................Aromobatidae,
Dendrobatidae, Edalorhina perezi, Lithodytes, Physalaemus petersi, Physalaemus
pustulosus
27'. Disco oral no emarginado..................28
28. 2/3 hileras de dentículos......................29
28'. Más de tres hileras posteriores de dentículos..............................................31
29. Rostrodonte superior completamente liso (no aserrado)....Osteocephalus
oophagus (13)
29'. Rostrodonte superior aserrado............30
30. Tubo cloacal medial (Figura 2F), papilas marginales
normalmente en una hilera................................................Leptodactylus
30'. Tubo cloacal dextral (Figura 2G)........Osteocephalus
planiceps, Plancha 4a), estadios iniciales de Osteocephalus
(14)
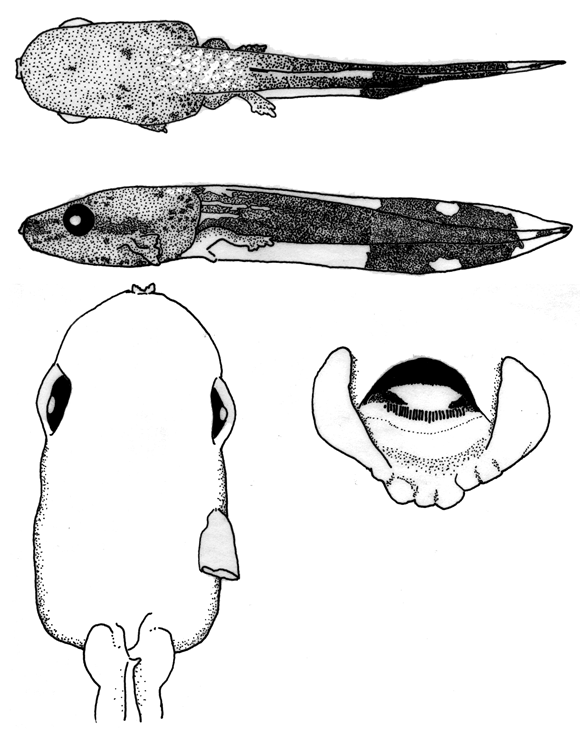
Plancha 4. (a) Osteocephalus planiceps en vistas lateral y dorsal; disco
oral, ICN 54904, 29 mm LT; (b) Dendropsophus sp. (grupo microcephalus) en
vistas dorsal y lateral, ICN 45678, 19 mm LT; (c) Pseudis vigilans en vistas
dorsal y lateral; disco oral, ICN 44541, 33 mm LT.
31. Cuerpo con patrón de dos bandas pálidas transversales, una
detrás de los ojos y la otra, en la base de la cola......................32
31'. Cuerpo sin bandas pálidas...................Otros Osteocephalus
de tierras bajas (15)
32. Banda posterior completa dorsalmente.....Osteocephalus cabrerai
(Plancha 3e)
32'. Banda posterior incompleta dorsalmente...Osteocephalus carri
(Plancha 2b)
33. Espiráculo ventral o medioventral, ubicado por debajo del borde
inferior de la musculatura caudal............34 (Figura 3C)
33'. Espiráculo lateral, ubicado en el costado izquierdo del cuerpo
por encima del borde inferior de la musculatura caudal.....................................................40
(Figura 3A-B)
34. Espiráculo en forma de campana (estadios avanzados) o pequeño,
recto y ligeramente despegado del cuerpo (estadios posteclosionales), pero siempre
ventral. Patrón de coloración en la cola formando una flecha oscura
sobre fondo translúcido, cuyo mango está formado por la musculatura
caudal pigmentada y su vértice apunta hacia en el ápice de la
cola..........Dendropsophus haraldschultzi (Plancha
5)
34'. Espiráculo y/o patrón diferentes.........35
Plancha 5. Dendropsophus haraldschutzi en vistas dorsal, lateral y ventral;
disco oral, ICN 45599, 24 mm LT.
35. Borde anterior del disco oral con papilas..........................Cruziohyla
craspedopus
35'. Borde anterior del disco oral sin papilas...36
36. Una glándula en el margen dorsal de la aleta dorsal, que se extiende
más allá de la mitad de la cola..................37 (Figura
3A)
36'. Margen dorsal de la aleta dorsal sin glándula........................................38
37. Área dorsal del cuerpo uniformemente café en preservativo,
anaranjada o rojiza en vida; tercera hilera posterior de dentículos (P3)
reducida a ½ o menos de la segunda hilera posterior (P2)................................................Phyllomedusa
bicolor (Plancha 6a)
37'. Área dorsal del cuerpo crema con una mancha interocular café
(en preservativo); tercera hilera posterior de dentículos (P3) no considerablemente
más pequeña que la segunda hilera posterior (P2)..............................Phyllomedusa
vaillanti (Plancha 6b)
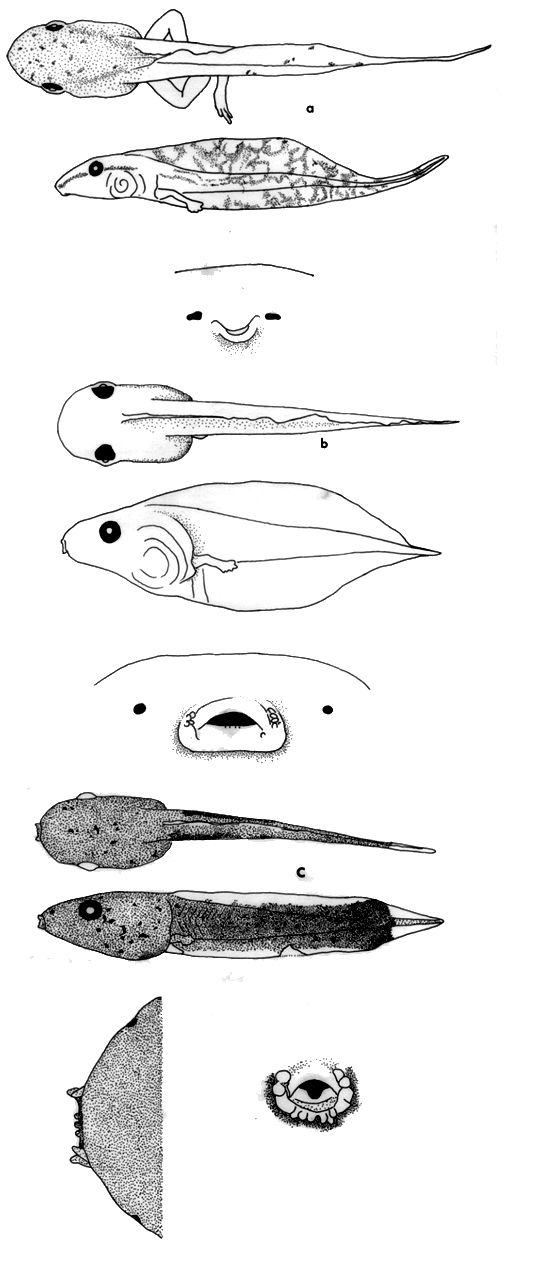
Plancha 6. (a) Phyllomedusa bicolor en vistas dorsal y lateral; disco oral,
ICN 53170, 62 mm LT; (b) Phyllomedusa vaillanti en vistas dorsal y lateral;
disco oral, ICN 53173, 27 mm LT; (c) Phyllomedusa hypocondrialis en vistas
dorsal y lateral; disco oral, ICN 20705, 30 mm LT; (d) Pseudis paradoxa en
vistas dorsal y lateral; disco oral, ICN 48979, 108 mm LT; (e) Scarthyla goinorum
en vistas dorsal y lateral; disco oral, ICN 45603, 29 mm LT.
38. Cuerpo y cola delgados y elongados; el cuerpo se asemeja a una bala. Una
hilera posterior de papilas marginales, aunque irregular. Cuerpo y aletas translúcidos,
naranja o amarillo en vivo, con una mancha naranja difusa en el extremo posterior
de la cola; transparentes en preservativo......................................Phyllomedusa
tomopterna
38'. Cuerpo globular a triangular. Una o dos hileras posteriores de papilas
marginales, al menos en las áreas ventrolaterales del labio posterior.........................39
39. Una única hilera de papilas ventrales en el área medial del
labio posterior, que bien puede estar interrumpida medialmente (ventral gap
de 1 a 7 papilas) o bien puede tener unas pocas papilas medioventrales reducidas
en tamaño respecto a las adyacentes. Hilera P3 reducida a ½ o
menos del espacio medial en la hilera A2...................................................Phyllomedusa
hypocondrialis (Plancha 6c)
39'. Dos hileras ventrales de papilas marginales en el área medial
del labio posterior. Color ventral del cuerpo plateado; blanco o gris claro
translúcido en preservativo.............Phyllomedusa tarsius sensu
Duellman, 1978 (16)
40. Papilas ausentes en el disco oral..........41
40'. Papilas presentes en el disco oral, al menos en una porción
de éste................43
41. Tamaño de la larva (longitud total) en los estadios más avanzados
de desarrollo (35-42) inferior a 10 mm. Cuerpo deprimido (profundidad inferior
a 4 mm), aletas bajas, anaranjadas en vida y transparentes en preservación,
terminadas en un filamento de moderada longitud...............Dendropsophus
sp. A (gr. microcephalus) (Plancha 4b)
41'. Tamaño de la larva (longitud total) en los estadios más
avanzados de desarrollo (35-42) superior a 13 mm. Aletas con algún grado
de pigmentación y musculatura caudal con líneas laterales.....................42
42. Línea oscura (rojiza en vida) entre el extremo rostral y el ojo.
Mancha rojiza en el área interorbital y línea roja longitudinal
en el borde inferior de la musculatura caudal....................Dendropsophus
rhodopeplus (17)
42'. Línea oscura (rojiza en vida) entre el extremo rostral y el
extremo del cuerpo (posterior al ojo). Cola con una fuerte reticulación,
color café pálido en preservativo............Dendropsophus
mathiassoni (Plancha 7a)
Plancha 7. (a) Dendropsophus mathiassoni en vistas dorsal y lateral (ICN
20685, 26 mm LT), disco oral (ICN 45697); (b) Dendropsophus rossalleni en
vistas dorsal y lateral; disco oral, ICN 53093, 32 mm LT; (c) Dendropsophus
brevifrons en vistas dorsal y lateral; detalles del rostro, vista dorsal;
disco oral, ICN 45648, 23 mm LT.
43. Patrón de barras verticales oscuras y claras en la cola, incluso
si solamente hay una banda clara y una oscura, cada una de la mitad de la extensión
de la cola............44
43'. Cola con patrón diferente o sin patrón alguno...................................................50
44. En vista dorsal, la aleta dorsal comienza sobre el cuerpo, posterior al
ojo......45
44'. En aspecto dorsal y lateral, la aleta dorsal está restringida
a la cola............46
45. Patrón de barras gruesas negras interrumpidas ligeramente por barras
transversales blancas.........................................Pseudis paradoxa
(Plancha 6d)
45'. Mitad posterior de la cola (musculatura y aletas) negra en vida o
café oscuro en preservativo, excepto el ápice caudal transparente
a translúcido; mitad anterior de la cola mucho más clara que la
mitad posterior..........................................Dendropsophus riveroi
(Plancha 8a) (18)
Plancha 8. (a) Dendropsophus riveroi en vistas dorsal y lateral; disco oral,
ICN 53141, 21 mm LT; (b) Dendropsophus parviceps en vistas dorsal y lateral;
disco oral, ICN 53070, 22 mm LT.
46. Sin hileras de dentículos......................47
46'. Con hileras de dentículos (2/2-3).......48
47. Cola clara con patrón de barras negras y blancas alternadas, de
anchura similar, y por lo general más de una de cada color..........................Dendropsophus
triangulum (Plancha 9)
47'. Cola oscura con patrón de tres bandas pálidas verticales...................Dendropsophus
koechlini
Plancha 9. Dendropsophus triangulum en vistas dorsal, lateral y ventral;
disco oral, ICN 45618, 33 mm LT.
48. Labio posterior desprovisto de papilas en el área medial.......................................Scarthyla
goinorum (Plancha 6e)
48'. Labio posterior completamente bordeado de papilas en más de
una hilera...........49
49. Barras transversales oscuras distinguibles pero incompletas, larvas restringidas
a los bosques amazónicos. En renacuajos de estadios avanzados, se distingue
membrana interdigital naranja............................Cf Pseudis limellus
(Plancha 10a) (19)
49'. Barras transversales oscuras completas, renacuajos de los Llanos
Orientales......................Pseudis vigilans (Plancha
4c) (20)
Plancha 10. (a) Cf Pseudis limellus en vistas dorsal y lateral; disco oral,
ICN 52150, 26 mm LT; (b) Dendropsophus bokermanni en vistas dorsal y lateral;
disco oral, ICN 23777, 30 mm LT; (c) Sphaenorhynchus lacteus en vistas dorsal
y lateral; disco oral, ICN 45627, 45 mm LT.
50. Cuerpo en aspecto ventral sin un patrón distinguible, uniformemente
blanco o café o gris o sepia....................................51
50'. Cuerpo en aspecto ventral con patrón de líneas o puntos,
claramente diferenciados del fondo..............................67
51. Sin hileras de dentículos........................52
51'. Con hileras de dentículos...................57
52. Cuerpo en aspecto ventral uniformemente blanco o crema (en vivo o en preservativo)................................................................53
52'. Cuerpo en aspecto ventral uniformemente café o sepia............................................54
53. Cola crema con manchitas café..........................Dendropsophus
sarayacuensis (Plancha 11a)
53'. Cola transparente a translúcida, siempre sin patrón..............Dendropsophus
rossalleni/ "Hyla sp. 1" sensu Hero (1990) (Plancha
7b)
Plancha 11. (a) Dendropsophus sarayacuensis en vistas dorsal y lateral; disco
oral, ICN 53078, 28 mm LT; (b) Scinax rostratus en vistas dorsal y lateral;
disco oral, ICN 48967, 34 mm LT; (c) Scinax garbei en vistas dorsal y lateral;
disco oral, ICN 45608, 31 mm LT.
54. Papilas restringidas a los márgenes laterales del disco oral u ocasionalmente
también en el margen posterior, aunque no forman una hilera continua.
Fórmula dental 0/1..............Dendropsophus rossalleni/ "Hyla
sp. 1" sensu Hero (1990) (Plancha 7b)
54'. Papilas laterales y ventrales en el disco oral formando al menos
una hilera. Fórmula dental variable.......................................55
55. Cola principalmente clara (en vida translúcida y beige claro en
preservativo) con esporádicas motas café claro. Coloración
del cuerpo oscura, con dos bandas pálidas dorsales, una preocular y otra
a la altura del inicio de la musculatura caudal..............Dendropsophus
parviceps (Plancha 8b)
55'. Cola principalmente oscura pero el extremo caudal transparente o
translúcido ...............................................................56
56. En aspecto lateral, cuerpo aproximadamente triangular y extremo rostral
acuminado. Aleta dorsal translúcida o blanquecina en sus 5/6 anteriores..........Dendropsophus
brevifrons (Plancha 7c)
56'. En aspecto lateral, cuerpo aproximadamente ovalado y extremo rostral
redondeado. Aleta dorsal completamente pigmentada excepto en su ápice
distal. En aspecto dorsal, una franja clara transversal en la base de la cola
(Wild, 1992) ..............Dendropsophus bokermanni (Plancha
10b)
57. Última hilera posterior de dentículos notoriamente reducida
en comparación con las demás, como máximo 1/3 de la longitud
de las precedentes..................................58
57'. Última hilera posterior de dentículos tan larga como
las demás.............................61
58. Espacio medial en las papilas ventrales al menos tan ancho como la última
hilera posterior de dentículos (P3)..................59
58'. Sin espacio medial en las papilas ventrales..Sphaenorhynchus lacteus
(Plancha 10c)
59. Abundantes papilas submarginales laterales. Aletas caudales tanto o más
altas que la musculatura caudal.......................Scinax rostratus
(Plancha 11b)
59'. Si presentes, menos de diez papilas submarginales........................................60
60. Hilera de dentículos P3 sobre una estructura independiente del margen
del disco oral, denominada brazo labial (21). Patrón de coloración
en la cola de motas dispersas café claro sobre fondo verde translúcido.....Scinax
garbei (Plancha 11c)
60'. Hilera de dentículos P3 dentro del margen de la boca, ligeramente
levantada por un espacio medial sin papilas pero completamente pegada al margen
del disco oral. Patrón de coloración en la cola de marmoleado
púrpura sobre fondo translúcido verdoso......Sphaenorhynchus
dorisae (Plancha 12a)
Plancha 12. (a) Sphaenorhynchus dorisae en vistas dorsal y lateral; disco
oral, ICN 45612, 42 mm LT; (b) Scinax x-signatus en vistas dorsal y lateral;
disco oral, ICN 48977, 30 mm LT; (c) Scinax ruber en vistas dorsal y lateral;
disco oral, ICN 45652, 25 mm LT; (d) Scinax cruentommus en vistas dorsal y
lateral; disco oral, ICN 53190, 23 mm LT; (e) Dendropsophus minutus en vistas
dorsal y lateral; disco oral, ICN 53003, 30 mm LT; (f) Dendropsophus leucophyllatus
en vistas dorsal, lateral y ventral; disco oral, ICN 45669, 28 mm LT.
61. 2/3 hileras de dentículos....................62
61'. Fórmula dental diferente (0/1, 1/2, 2/5, 3/5)........................................................65
62. En aspecto dorsal y lateral la aleta dorsal se inicia sobre la mitad anterior
del cuerpo. Aletas dorsal y ventral de aproximadamente la misma altura......................................63
62'. En aspecto dorsal y lateral la aleta dorsal se inicia sobre el ¼
posterior del cuerpo. Aleta dorsal notoriamente más alta que la aleta
ventral...........................................64
63. En aspecto dorsal la aleta dorsal se inicia al nivel del borde posterior
de los ojos. Altura máxima de la cola casi cuatro veces la altura máxima
de la musculatura caudal. Primera hilera posterior de dentículos (P1)
usualmente continua..............................Scinax x-signatus (Plancha
12b)
63'. En aspecto dorsal la aleta dorsal se inicia hacia la mitad del cuerpo,
nunca inmediatamente tras los ojos. Altura máxima de la cola casi tres
veces la altura máxima de la musculatura caudal. Primera hilera posterior
de dentículos (P1) usualmente dividida. Frecuentemente patrón
de coloración con una línea oscura lateral entre el extremo rostral
y el ojo, y una mancha oscura en el área anterior del cuerpo, sobre el
intestino............................Scinax ruber (Plancha
12c)
64. Poca o ninguna pigmentación en la cola, con un tinte naranja en
vida sobre aletas y musculatura. Distribuida exclusivamente en las sabanas de
la Orinoquia...................Scinax wandae (Plancha
13)
64'. Pigmentación de manchas difusas oscuras sobre fondo claro
en la musculatura caudal, y algunas franjas diagonales sepia insinuadas sobre
las aletas. Línea lateral oscura entre el extremo rostral y el ojo. Distribuida
en la Amazonia..............................Scinax cruentommus (Plancha
12d)
Plancha 13. Scinax wandae en vistas dorsal y lateral; disco oral, ICN 20701, 19 mm LT.
65. Una o dos hileras posteriores de dentículos...............................Dendropsophus
minutus (Plancha 12e) (22)
65'. Tres o mas hileras posteriores de dentículos................................................................66
66. Dos hileras anteriores de dentículos.........................Trachycephalus
resinifictrix
66'. Tres o mas hileras anteriores de dentículos........................Trachycephalus
coriaceus, Trachycephalus venulosus (23)
67. Cuerpo en aspecto ventral con patrón de líneas blancas y
negras..............................Dendropsophus bifurcus, D. leucophyllatus
(Plancha 12f)
67'. Cuerpo en aspecto ventral con patrón de puntos, moteado o
con vetas (marmolizado), con pintas rojizas en vivo..............Dendropsophus
marmoratus (Plancha 14)
Plancha 14. Dendropsophus marmoratus en vistas dorsal, lateral y ventral;
disco oral, ICN 53051, 18 mm LT.
DISCUSIÓN
La clasificación de la Hylidae cambió en manera dramática con la publicación de Faivovich et al. (2005). Estos autores dividieron la familia en tres subfamilias (Hylinae y Phyllomedusinae del Neotrópico) y la subfamilia Hylinae en cuatro tribus. Para la Hylidae, al oriente de los Andes en Colombia, se encuentra dos géneros (Cruziohyla y Phyllomedusa) de Phyllomedusinae y nueve géneros de Hylinae. Los Hylinae está divididos en tres tribus en la Amazonia colombiana (Cophomantini [Hypsiboas], Dendropsophini [Dendropsophus, Pseudis, Scarthyla, Scinax y Sphaenorhynchus], y Lophiohylini [Aparasphenodon, Nyctimantis, Osteocephalus y Trachycephalus]). De las cuatro tribus de Hylinae, Dendropsophini es exclusivamente (o casi exclusivamente con la excepción posible de Sphaenorhynchus carneus) con ojos laterales mientras las otras tres tribus son completamente o predominantemente de renacuajos con ojos dorsales. Especies con ojos laterales ocupan cuerpos de agua léntica (charcos) mientras que especies con ojos dorsales ocupan un gran gama de hábitat (aguas lénticas y lóticas). Al oriente de los Andes en Colombia, muy pocas especies utilizan aguas con corrientes (unas especies de Hypsiboas, Lithobates palmipes, unas Osteocephalus y unos sapos de los géneros Atelopus, Rhaebo y Rhinella) en contraste a la situación en las cordilleras (pocas especies utilizan aguas lénticas). Nuestra estrategia de colección (de renacuajos) ha dependido mucho en las impresiones que hemos tomados basados en los hábitat utilizado para reproducción por parte de los adultos. Como pocas especies de hílidos utilicen quebradas o ríos, hemos invertido poco tiempo en la revisión de ellos. De las 72 ó 73 especies de hílidos conocidas (o esperadas) de estas tierras, la colección del ICN tiene registros de 69 (94%) como adultos y 46 ó 47 (63-64%) como renacuajos.
En el caso de algunas especies, los datos para los renacuajos no concuerdan con la clasificación actual. El renacuajo de Dendropsophus riveroi no se parece a los renacuajos de otras especies de Dendropsophus sino a Scinax, por tener formula labial de 2/3 y labios que sobrelapan parcialmente la parte interna del disco oral. Dendropsophus riveroi es una de las especies pequeñas y los adultos parecen mucho a otras especies asignadas a Dendropsophus. Sin embargo, nuestra determinación del renacuajo de D. riveroi, por la morfología evidente en larvas de los estados 41-42, sugiere que la especie está asignada incorrectamente al género.
El renacuajo de "Scarthyla" vigilans no se parece al renacuajo de Scarthyla goinorum sino a Pseudis. Además, tenemos un renacuajo (Plancha 10a) no identificado pero que parece mucho al renacuajo de un género no conocido para Colombia (Lysapsus, hoy en Pseudis). Los renacuajos de estas tres especies comparten una anatomía de la disposición del intestino (Fig. 4) muy distintiva de lo demás renacuajos y derivada, soportando nuestra decisión de asignar "Hyla" (o "Scarthyla") vigilans al género Pseudis.
AGRADECIMIENTOS
Agradecemos a colegas (Teddy Angarita, Gustavo Ballén, Rances Caicedo, Mario Madrid, César Malambo, Jonh Jairo Mueses, Juan Renjifo, David Sánchez y Adriana Téllez) por su participación en trabajo de campo con nosotros o donación de colecciones y a Sandy Arroyo, Gustavo Ballén, Lucas Barrientos y un evaluador por su revisión critica del manuscrito. David Sánchez ha compartido datos no publicados sobre las disposiciones de las vísceras en renacuajos (una fuente de datos de mucha utilidad en la clasificación e identificación). Nuestro trabajo de campo en Leticia ha beneficiado por la participación de unos indígenas (Gabriel Aricari, Rodolfo Mesa y Walter Morales) y soporte financiara de Conservación Internacional (Colombia) y la Dirección de Investigación sede Bogota (DIB-803649) de la Universidad Nacional de Colombia. Permisos de la colección científica fueron entregados por Corpoamazonia y los caciques de las comunidades de los Kms. 7.5, 10, 11, y 21 de Leticia.
LITERATURA CITADA
1. AGUIAR-JR, O., M. BACCI JR, A.P. LIMA, D.C. ROSSA-FERES, C.F.B. HADDAD &
S.M. RECCO-PIMENTEL. 2007. Phylogenetic relationships of Pseudis and
Lysapsus (Anura, Hylidae, Hylinae) inferred from mitocondrial and nuclear gene
sequences. Cladistics 23: 455-463.
2. BARRIO-AMORÓS, C.L., A. DÍAZ DE PASCUAL, J.J. MUESES-CISNEROS,
E. INFANTE & A. CHACÓN. 2006. Hyla vigilans Solano, 1971, a second
species for the genus Scarthyla, redescription and distribution in Venezuela
and Colombia. Zootaxa 1349: 1-18.
3. BOKERMANN, W.C. 1963a. Girinos de anfíbios brasileiros - 1 (Amphibia
- Salientia). Anais da Academia Brasileira de Ciencias 35(3): 465-474.
4. BOKERMANN, W.C. 1963b. Girinos de anfíbios brasileiros - 2 (Amphibia:
Salientia). Rev. Brasil. Biol. 23(4): 349-353.
5. CORTEZ-F., C., A.M. SUÁREZ-MAYORGA & F.J. LÓPEZ-LÓPEZ.
2006. Preparación y preservación de material científico.
p. 173-200. En: Angulo A., J. V. Rueda-Almonacid, J. V. Rodríguez-Mahecha
& E. La Marca (eds.). 2006. Técnicas de inventario y monitoreo para
los anfibios de la región tropical andina. Conservación Internacional.
Serie Manuales de Campo No. 2. Panamericana Formas e Impresos S. A. Bogotá,
Colombia. 298 p.
6. DUELLMAN, W.E. 1970. The Hylid Frogs of Middle America. Museum of Natural
History, the University of Kansas, Monograph (1): 1-753, pls. 1-72.
7. DUELLMAN, W.E. 1972a. A new species of Hyla from Amazonian Ecuador. Copeia
2: 265-271.
8. DUELLMAN, W.E. 1972b. A review of the Neotropical frogs of the Hyla bogotensis
group. Papers of the Natural Histrory Museum, The University of Kansas 11:1-31.
9. DUELLMAN, W.E. 1972c. South American frogs of the Hyla rostrata group (Amphibia:
Anura: Hylidae). Zoologische Mededelingen 47:177-192.
10. DUELLMAN, W.E. 1972d. The systematic status and life history of Hyla rhodopepla
Gunther. Herpetologica 28(4): 369-375.
11. DUELLMAN, W.E. 1978. The biology of an equatorial herpetofauna in Amazonian
Ecuador. Miscellaneous Publications, Museum of Natural History, University of
Kansas (65): 1-352.
12. DUELLMAN, W.E. 2005. Cusco Amazónico/ The Lives of Amphibians and
Reptiles in an Amazonian Rainforest. Comstock Publishing Associates, Ithica,
New York. xv + 433 pp.
13. FAIVOVICH, J., C.F.B. HADDAD, P.C.A. GARCIA, D.R. FROST, J.A. CAMPBELL,
& W.C. WHEELER. 2005. Systematic review of the frog family Hylidae, with
special reference to Hylinae: phylogenetic analysis and taxonomic revision.
Bulletin of the American Museum of Natural History (294): 1-240.
14. FROST, D.R., T. GRANT, J. FAIVOVICH, R. H. BAIN, A. HAAS, C.F.B. HADDAD,
R.O. DE SÁ, A. CHANNING, M. WILKINSON, S. C. DONNELLAN, C.J. RAXWORTHY,
J.A. CAMPBELL, B.L. BLOTTO, P. MOLER, R.C. DREWES, R.A. NUSSBAUM, J.D. LYNCH,
D.M. GREEN & W.C. WHEELER. 2006. The amphibian tree of life. Bulletin of
the American Museum of Natural History (297): 1-370.
15. GALLARDO, J. M. 1961. On the species of Pseudidae (Amphibia: Anura). Bulletin
of the Museum of Comparative Zoology 125: 111-134.
16. GORZULA, S. & J.C. SEÑARIS. 1999 ("1998"). Contribution
to the herpetofauna of the Venezuelan Guayana I. A data base. Scientia Guaianae
8: 1-269 + xviii.
17. HADDAD, C. & M. MARTINS. 1994. Four species of Brazilian poison frogs
related to Epipedobates pictus (Dendrobatidae): Taxonomy and natural history
observations. Herpetologica 50(3): 282-295.
18. HERO, J.M. 1990. An illustrated key to tadpoles occurring in the central
Amazon Rainforest, Manaus, Amazonas, Brazil. Amazoniana 11: 201-261.
19. JUNGFER, K.H. & L.C. SCHIESARI. 1995. Description of a central Amazonian
and Guianan tree frog, genus Osteocephalus (Anura, Hylidae), with oophagous
tadpoles. Alytes 13: 1-13.
20. KAPLAN, M. 1991. A new species of Hyla from the eastern slope of the Cordillera
Oriental in northern Colombia. Journal of Herpetology 25(3): 313-316.
21. KAPLAN, M. 1994. A new species of frog of the genus Hyla from the Cordillera
Oriental in northern Colombia with comments on the taxonomy of Hyla minuta.
Journal of Herpetology 28(1): 79-87.
22. KAPLAN, M. & P.M. RUIZ. 1997. Two new species of Hyla from the Andes
of central Colombia and their relationships to other small Andean Hyla. Journal
of Herpetology 31(2): 230-244.
23. KLUGE, A.G. 1979. The gladiator frogs of Middle America and Colombia -a
revaluation of their systematics (Anura: Hylidae). Occas. Pap. Mus. Zool. Univ.
Michigan (688): 1-24.
24. LAMAR, W.W. & E.R. WILD. 1995. Comments on the natural history of Lithodytes
lineatus (Anura: Leptodactylidae), with a description of the tadpole. Herpetological
Natural History 3: 135-142.
25. LYNCH, J.D. 2006a. The tadpoles of frogs and toads found in the lowlands
of Northern Colombia. Rev. Acad. Colomb. Cienc. 30(116): 443-457.
26. LYNCH, J.D. 2006b. The amphibian fauna in the Villavicencio region of eastern
Colombia. Caldasia 28: 135-155.
27. LYNCH, J.D. 2007. Anfibios, pp. 163-166, 595-600, En Ruiz, S. L., E. Sánchez,
E. Tabares, A. Prieto, J. C. Arias, R. Gómez, D. Castellanos, P. García,
& L. Rodríguez (eds.). 2007. Diversidad Biológica y Cultural
del sur de la Amazonia Colombiana-Diagnóstico. Corpoamazonia, Instituto
Humboldt, Instituto Sinchi, UAESPNN. Bogotá, Colombia. 636 pp.
28. MCDIARMID, R.W. & R. ALTIG. 1990. Description of a bufonid and two hylid
tadpoles from western Ecuador. Alytes 8: 51-60.
29. MCDIARMID, R.W. & R. ALTIG. 1999a. Research: Materials and Techniques.
P. 7-23. En: McDiarmid R. W. & R. Altig. Tadpoles: The biology of anuran
larvae. The University of Chicago Press, Chicago, US, 444 p.
30. MCDIARMID, R.W. & R. ALTIG. (eds.). 1999b. Tadpoles: The biology of
anuran larvae. The University of Chicago Press, Chicago, US, 444 p.
31. NELSON, G. & N. PLATNICK. 1981. Systematics and Biogeography/ Cladistics
and Vicariance. Columbia University Press, New York.
32. PYBURN, W. F. 1980. An unusual anuran larva from the Vaupés region
of southeastern Colombia. Papeis Avulsos de Zoologia 33: 231-238.
33. RODRÍGUEZ, L.O. & W.E. DUELLMAN. 1994. Guide to the frogs of
the Iquitos Region, Amazonian Peru. Special Publication, Natural History Museum,
University of Kansas (22): 1-80.
34. SAVAGE, J.M. & A.L. CARVALHO. 1953. The family position of neotropical
frogs currently referred to the genus Pseudis. Zoologica 38: 193-200.
35. SCHIESARI, L.C., B. GRILLITSCH & C. VOGL. 1996. Comparative morphology
of phytotelmonous and pond-dwelling larvae of four neotropical treefrog species
(Anura, Hylidae, Osteocephalus oophagus, Osteocephalus taurinus, Phrynohyas
resinifictrix, Phrynohyas venulosa). Alytes 13: 109-139.
36. SCHIESARI, L. C. & G. MOREIRA. 1996. The tadpole of Phrynohyas coriacea
(Hylidae) with comments on the species' reproduction. Journal of Herpetology
30: 404-407.
37. SUÁREZ MAYORGA, A. & J.D. LYNCH. 2001a. Los renacuajos colombianos
de Sphaenorhynchus (Hylidae): descripciones, anotaciones sistemáticas
y ecológicas. Revista de la Academia Colombiana de Ciencias Exactas,
Físicas y Naturales 25: 411-418.
38. SUÁREZ MAYORGA, A. & J.D. LYNCH. 2001b. Redescription of the
tadpole of Hyla vigilans (Anura:Hylidae) and notes about possible taxonomic
relationships. Caribbean Journal of Science 37(1-2): 116-119.
39. TRUEB, L. & W.E. DUELLMAN. 1983. Frogs of the Hyla columbiana group:
Taxonomy and phylogenetic relationships. p.33-51. En: Rhodin A. G. J. &
K. Miyata (eds.). Advances in Herpetology and Evolutionary Biology. Museum of
Comparative Zoology, Cambridge, 725 p.
40. VIERTEL, B. & S. RICHTER. 1999. Anatomy: viscera and endocrines, pp.
92-148, In McDiarmid, R. W. & R. Altig (Eds.), Tadpoles/ The Biology of
Anuran Larvae. The University of Chicago Press, Chicago.
41. WILD, E.R. 1992. The tadpoles of Hyla fasciata and H. allenorum, with a
key to the tadpoles of the Hyla parviceps group (Anura: Hylidae). Herpetologica
48: 439-447.
42. WILD, E.R. 1995. New genus and species of Amazonian microhylid frog with
a phylogenetic analysis of New World genera. Copeia 1995: 837-849.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2011 Caldasia

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cual estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).