Tamaño y viabilidad de semillas: implicancias en la evolución y conservación de Phaius tankervilleae (Orchidaceae)
Seed size and viability: implications on the evolution and conservation of Phaius tankervilleae (Orchidaceae)
DOI:
https://doi.org/10.15446/caldasia.v39n2.62184Palabras clave:
Embrión, orquídea, tetrazolio, testa, volumen (es)Embryo, orchid, tetrazolium, seed Coat, volume (en)
Phaius tankervilleae es una orquídea terrestre altamente apreciada como ornamental y medicinal, razón por la cual se encuentra en peligro de extinción en algunos países como Australia y Japón. Generar información sobre las dimensiones y el vigor de la semilla es importante para entender aspectos de la evolución de la especie y encontrar métodos de conservación. Este estudio tuvo como finalidad poner a prueba la hipótesis, de que el tamaño y viabilidad de las semillas de P. tankervilleae están positivamente relacionados con el tamaño del fruto. Para realizar el estudio se cosecharon frutos de diferentes tamaños, de los cuales se tomaron muestras de 2,5 mg de semillas por frutos. Se realizó la caracterización morfológica de las semillas mediante observaciones en microscopio. Las semillas de cada tamaño de fruto fueron sometidas a un test de Tetrazolio para determinar viabilidad y se les tomaron mediciones del largo, ancho y volumen tanto de la testa como del embrión. Las semillas con embrión son fusiformes y las vanas son filiformes, el embrión es relativamente pequeño y las semillas de fruto mediano son las que presentan menor espacio de aire. Los resultados confirman la hipótesis planteada, cuanto más pequeño es el fruto menor es el tamaño y la cantidad de semillas viables. Por consiguiente, si se desea tener mayor cantidad de semillas de buena calidad es recomendable cosechar frutos de mayor tamaño.
Phaius tankervilleae is a terrestrial orchid highly prized as ornamental and medicinal, which is why it is in danger of extinction in some countries such as Australia and Japan. Generating information on seed size and vigor is important in understanding aspects of the evolution of the species and finding conservation methods. This study aimed to test the hypothesis that the size and viability of P. tankervilleae seeds are positively related to fruit size. In order to carry out the study, fruits of different sizes were harvested, from which samples of 2.5 mg of seeds per fruit were taken. Morphological characterization of the seeds was carried out by means of microscope observations. A Tetrazolium test was carried out to determine the viability of seeds and measurements were taken of the length, width, and volume of both the testa and the embryo. Seeds with embryos are fusiform and the empty one are filiform, the embryo is relatively small and the seeds of medium size fruit are those that have less air space. The results confirm the hypothesis, the smaller the fruit the smaller the size and the number of viable seeds. Therefore, to have more seeds of good quality it is advisable to harvest larger fruits.
Recibido: 16 de febrero de 2017; Aceptado: 28 de agosto de 2017
RESUMEN
Phaius tankervilleae es una orquídea terrestre altamente apreciada como ornamental y medicinal, razón por la cual se encuentra en peligro de extinción en algunos países como Australia y Japón. Generar información sobre las dimensiones y el vigor de la semilla es importante para entender aspectos de la evolución de la especie y encontrar métodos de conservación. Este estudio tuvo como finalidad poner a prueba la hipótesis, de que el tamaño y viabilidad de las semillas de P. tankervilleae están positivamente relacionados con el tamaño del fruto. Para realizar el estudio se cosecharon frutos de diferentes tamaños, de los cuales se tomaron muestras de 2,5 mg de semillas por frutos. Se realizó la caracterización morfológica de las semillas mediante observaciones en microscopio. Las semillas de cada tamaño de fruto fueron sometidas a un test de Tetrazolio para determinar viabilidad y se les tomaron mediciones del largo, ancho y volumen tanto de la testa como del embrión. Las semillas con embrión son fusiformes y las vanas son filiformes, el embrión es relativamente pequeño y las semillas de fruto mediano son las que presentan menor espacio de aire. Los resultados confirman la hipótesis planteada, cuanto más pequeño es el fruto menor es el tamaño y la cantidad de semillas viables. Por consiguiente, si se desea tener mayor cantidad de semillas de buena calidad es recomendable cosechar frutos de mayor tamaño.
Palabras clave:
Embrión, orquídea, tetrazolio, testa, volumen.ABSTRACT
Phaius tankervilleae is a terrestrial orchid highly prized as ornamental and medicinal, which is why it is in danger of extinction in some countries such as Australia and Japan. Generating information on seed size and vigor is important in understanding aspects of the evolution of the species and finding conservation methods. This study aimed to test the hypothesis that the size and viability of P. tankervilleae seeds are positively related to fruit size. In order to carry out the study, fruits of different sizes were harvested, from which samples of 2.5 mg of seeds per fruit were taken. Morphological characterization of the seeds was carried out by means of microscope observations. A Tetrazolium test was carried out to determine the viability of seeds and measurements were taken of the length, width, and volume of both the testa and the embryo. Seeds with embryos are fusiform and the empty one are filiform, the embryo is relatively small and the seeds of medium size fruit are those that have less air space. The results confirm the hypothesis, the smaller the fruit the smaller the size and the number of viable seeds. Therefore, to have more seeds of good quality it is advisable to harvest larger fruits.
Key words:
Embryo, orchid, tetrazolium, seed Coat, volume.INTRODUCCIÓN
En las diferentes especies vegetales del mundo se encuentran una gran variedad de semillas, que van desde las diminutas, que producen las orquídeas, cuyo peso puede ser de 0,0001 mg, hasta semillas que pueden pesar 20 kg como las de Lodoicea maldivica (J.F.Gmel.) Pers. (Moles et al. 2005). Tal variación en el tamaño de las semillas de las angiospermas es debido a que la evolución en las mismas se asoció primordialmente con una mayor reducción en la masa de la semilla (Tiffney 2004).
Las orquídeas se han conocido, apreciado, y utilizado durante siglos en diferentes partes del mundo debido a que muchas poseen alto valor medicinal, ornamental y cultural (Popova et al. 2016). En la familia Orchidaceae se han identificado 880 géneros y más de 25.000 especies, convirtiéndose en la mayor familia de plantas con flores (Givnish et al. 2015), de las cuales, un gran número de especies se encuentran en riesgo de extinción. La conservación de germoplasma de orquídeas, específicamente semillas, representa una forma segura de conservación ex situ (Merritt et al. 2014).
Las orquídeas presentan gran variedad morfológica en la forma de sus hojas, flores, frutos y semillas. Características muy utilizadas para su identificación taxonómica (Cribb et al. 2004, Chemisquy et al. 2009). Si bien los rasgos vegetativos son importantes en la identificación de especies, parte de la taxonomía se asocia con variaciones en el tamaño de las semillas, la relación es tal que los cambios que se pueden encontrar entre las semillas pueden separar claramente taxones (Rodríguez et al. 2008). Sin embargo, la variación del tamaño de las semillas dentro de las especies y los individuos es una característica que se presenta comúnmente (Eriksson 1999, Halpern 2005). La mayor variación del tamaño de la semilla se da dentro de la planta y dentro de la misma infrutescencia que entre plantas e infrutescencias (Vaughton y Ramsey 1998), debido a que las especies vegetales experimentan el dilema de producir más semillas pequeñas o menos semillas más grandes dependiendo de la cantidad de recursos asignados a la reproducción (Leishman et al. 2000). La variación del tamaño de la semilla es un rasgo crítico que determina el tamaño temprano de las plántulas y aumenta las probabilidades de establecimiento bajo condiciones críticas (Galetti et al. 2013).
Tamaño pequeño en las semillas, grandes espacios de aire y una testa fuerte, son características que influyen negativamente en la germinación, debido a que dificultan la humectación de la superficie exterior de la testa, y esto hace que a las semillas floten en el agua por tiempo prolongado, Además, semillas pequeñas no favorecen al desarrollo simbiótico en plantas mico-heterotróficas (Arditti et al. 1980, Arditti y Abdul Ghani 2000, McKendrick et al. 2002, Dalzotto y Lallana 2015).
Entre las orquídeas terrestres más cultivadas y apreciadas como ornamental en la República Argentina está Phaius tankervilleae (Banks) Blume que es una especie nativa de los trópicos, que se distribuye desde el este de Asia a Australia y es clasificada como una especie en peligro de extinción en varios países de su distribución de origen (Hirano et al. 2009, Cheng et al. 2012).
Esta orquídea terrestre está en peligro de extinción en Australia y Japón (Bishop 2000, Hirano et al. 2009, Thokchom et al. 2017). Por la intensa explotación debido a que tiene gran valor ornamental y medicinal, en algunos países los tubérculos secos son comúnmente utilizados como un tónico, pero rara vez se ha propagado sexualmente o mejorado debido a la dificultad de propagación de sus semillas (Hirano et al. 2009, Pant y Shrestha 2011, Pant 2013), ya que la misma presenta muy baja germinación aún en condiciones in vitro (Pant et al. 2011).
Generar información referente a la calidad de las semillas es crucial para la conservación ex situ e in situ de la especie, y un método para evaluar la calidad de las semillas es el test topográfico de Tetrazolio que es una prueba que nos revela aspectos esenciales de un lote y nos permiten conocer e identificar la confiabilidad de las semillas a la hora sembrarlas o almacenarlas (Ruiz 2009). Es un método eficaz, fácil de usar y se obtiene de manera rápida la viabilidad de las semillas por medio de una coloración roja ocasionada por la reducción del tetrazolio a formazán en el proceso de respiración por la actividad deshidrogenasa (Muñoz y Jiménez 2008, Rodríguez et al. 2008, Salazar-M 2012). Además, se complementa de manera precisa con pruebas de germinación in vitro por lo que a partir de este test se podría estimar la germinación (Salazar-M y Cancino 2012). Esta prueba es muy empleada en la actualidad para determinar la viabilidad de semillas de orquídeas y ha sido utilizada con éxito en varias especies como híbridos de Dendrobium (Galdiano et al. 2012), Comparettia falcata Poepp. & Endl. (Chávez et al. 2015), Oncidium bifolium Sims (Billard et al. 2014) y Bipinnulapenicillata (Rchb. f.) Cisternas & Salazar (Dalzotto y Lallana 2015).
Dado que un solo tamaño de semillas no es evolutivamente estable y siempre se presenta alguna variación adaptativa continua dentro de esta característica (Geritz 1995), es que el objetivo de este estudio es poner a prueba la hipótesis de que el tamaño y viabilidad de semillas de P. tankervilleae están relacionadas positivamente con el tamaño del fruto.
MATERIALES Y MÉTODOS
Material vegetal Especie y área de estudio
Phaius tankervilleae es una planta robusta que alcanza una altura de más de 60 cm, con pseudobulbos carnosos ovoide-elípticos, con hojas alternas, elípticas de más de 30 cm de longitud. La vara floral es de 65 cm de longitud, con 10 a 20 flores formando una inflorescencia, el diámetro de la flor es de 8 a 10 cm. Las flores poseen sépalos blancos a blanco amarillento y teñidas de color marrón rojizo en el interior, pétalos de color rojo-marrón o violáceo, de labios de color blanco amarillento, teñidos de rojo y decorados con manchas púrpura oscuro. Florece a finales de invierno y las flores tienen una duración de unos 20 días, pero la inflorescencia en sí dura hasta 45 días (Cribb et al. 2004, Nong et al. 2011, Kumar et al. 2012, Anand et al. 2013).
El análisis de las semillas se llevó a cabo en el Laboratorio de Propagación Vegetativa (LPV) de la Facultad de Ciencias Forestales ubicado en la ciudad de Eldorado, Misiones-Argentina. Los frutos fueron cosechados poco antes de su dehiscencia en el mes de noviembre, en la ciudad de Puerto Rico (Misiones, Argentina).
Estudio de la viabilidad, morfología y tamaño de las semillas
Se seleccionaron cinco plantas de las cuales se cosecharon cuatro frutos pequeños (2 cm de largo), cuatro medianos (4 cm) y cuatro grandes (6 cm). Para determinar la viabilidad, realizar las mediciones lineales de ancho y largo de la testa y del embrión, y para la caracterización morfológica de las semillas, se procedió a la apertura de los frutos con un bisturí, una vez liberadas las semillas se tomaron muestras de 2,5 mg de semillas por fruto, cuatro muestras de cada fruto. Una de las muestras fue utilizada para realizar las observaciones y caracterización morfológica de la testa y el embrión de las semillas, las restantes fueron colocadas en sobres de papel filtro y sumergidas en agua durante 24 horas con el fin de hidratarlas y luego de esta imbibición, se las transfirió a una solución de Tetrazolio (2, 3, 5- cloruro trifenil tetrazolio) al 0,25% durante 24 horas. Transcurrido este tiempo se realizaron preparados para microscopia óptica y posteriormente se tomaron entre 100 y 120 microfotografías hasta alcanzar una muestra de 1600 semillas para determinar viabilidad y 600 para medición de las dimensiones, empleando un microscopio digital modelo NLCD-307. Sobre cada microfotografía se contabilizó la cantidad de semillas viables, no viables y vanas, registrando como semillas viables a aquellas cuyos embriones presentaban coloración del rosado al rojo oscuro, no viable sin tinción, y semillas vanas aquellas sin embrión (Lallana y García 2013). El porcentaje de semillas viables y vanas se estimó de acuerdo con una modificación de la metodología García y Lallana (2014) y Lallana y García (c2016), siguiendo las normas ISTA para evaluar semillas.
Porcentaje de semillas viables = (número de semillas viables / Total de semillas (viables + no viables + vanas))
*100 Porcentaje de semillas vanas = (número de semillas vanas / Total de semillas (viables + no viables + vanas))*100
Cálculo de volumen
Las mediciones lineales se realizaron sobre las microfotografías utilizando el software Motic plus 2.0 (Reyes-L et al. 2015). El volumen de la testa y del embrión se determinó de acuerdo con la metodología descrita por Arditti et al. (1979), suponiendo que las semillas fusiformes son como dos conos unidos por sus bases y el embrión de forma elíptica, se emplearon las siguientes fórmulas.
Fórmula para calcular volumen de la testa
(vT):

Donde
w = ancho
(w/2)2 = r2
l = largo de la semilla
1/2 1= altura de cada cono
1,047 = ∏/3
Fórmula para calcular el volumen del embrión (vE):

Donde
a = 1/2 del largo
b = 1/2 del ancho
∏ = 3,14
Fórmula para calcular el volumen de aire:
Espacio de aire (%) = 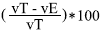
Donde
vT = volumen de la testa
vE = volumen del embrión
Las variables largo, ancho, relación largo/ ancho (L/A), volumen de la testa y del embrión y volumen de aire fueron evaluadas mediante análisis de variancia y las medias fueron comparadas entre sí por la prueba de comparaciones múltiples de Tukey (p ≤ 0,05), por medio del software INFOSTAT (Di Rienzo et al. 2016). Las variables tamaño del fruto y viabilidad de semillas también fueron analizadas por medio de una correlación lineal simple. El supuesto de normalidad se verificó por medio de la prueba de Shapiro-Wilk. Fue necesario transformar los datos de las variables volumen de testa y embrión por medio de la función logarítmica.
RESULTADOS
Tamaño y viabilidad de las semillas
Las semillas de P. tankervilleae son alargadas con extremos agudos y ensanchadas en el centro donde se ubica el embrión, presentando un aspecto fusiforme. La testa es traslúcida y las células que la conforman se presentan en forma de red o reticulada (Fig. 1). El embrión es ovalado de color castaño a amarillo relativamente pequeño con respecto a la testa. Las semillas que poseen embrión son de mayor tamaño hasta 249 цгп más que las semillas vanas. Las longitudes promedio de las semillas viables son de 469 a 597 μm, en tanto que las semillas vanas son de menor tamaño (260-350 μm) y tienden a ser más bien filiformes ya que el ancho de la semilla se mantiene a lo largo de la misma (Fig. 1d y Tabla 1). Tanto las semillas con o sin embrión presentan un extremo truncado de la testa.
Figura 1:
Phaius tankervilleae. a.
Flor, b. Fruto cerrado, c. Fruto abierto con semilla, d. Semillas sin teñir, e. Detalle del embrión de la semilla sin teñir, f. Semillas viables y vanas. La flecha indica la semilla viable. Escala en a, b y c = 1 cm, en d y f = 100 μm, en e = 25 μm.
Letras diferentes dentro de las columnas indican diferencias significativas (p≤0,05, Test de comparaciones múltiples de Tukey). L/A(T)= Relación Largo/ancho de la testaTabla 1: Tamaño y volumen de la testa de la semilla según el tamaño del fruto.

El tiempo de imbibición de las semillas y la concentración de la sal cloruro de 2,3,5-trifeniltetrazolio empleados para realizar el test topográfico de Tetrazolio han permitido lograr una excelente tinción de las células del embrión de color rojo, facilitando la identificación y registro de las semillas viables de aquellas no viables o vanas. Sin embargo, dada la metodología empleada para determinar el porcentaje de semillas viables, no se encontraron semillas no viables con embrión y las semillas viables presentaron mayor tamaño que las semillas vanas (Tabla 1).
El mayor porcentaje de viabilidad se observó en las semillas de frutos grandes (6 cm de longitud) con un 33,30% (DE=7; n=1600) manifestando diferencias significativas. Mientras que la viabilidad de las provenientes de frutos medianos y pequeños fue notablemente menor, alcanzando valores de 19,10% (DE=7; n=1600) y 17,45% (DE=8,6; n=1600) respectivamente.
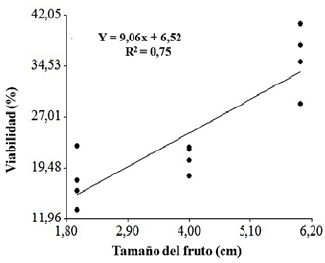
Se observó una correlación positiva (R2=0,75 F=30,31 p=0,0003) entre las variables tamaño del fruto y viabilidad de las semillas (Fig. 2), a mayor tamaño de fruto se incrementa la cantidad de semillas viables, por lo que disminuye el número de semillas vanas, aumentando las posibilidades de obtener una planta.
Figura 2: Correlación de la viabilidad de semillas de P. tankervilleae según el tamaño del fruto.
Volumen de la testa y del embrión
En el análisis de datos de las semillas viables se identificaron diferencias significativas en las variables largo (p=0,0002), ancho (p =0,008), volumen (p =0,0008) y relación L/A (p =0,0024) de la testa. Así mismo se observó que las semillas viables de los frutos grandes son las de mayor tamaño (Tabla 1), debido al largo y el ancho que tienen las testas. Por otro lado, las semillas vanas exhibieron un volumen notablemente inferior al de las semillas viables debido a que poseen una menor longitud en el ancho y largo de las mismas, pero también mostraron diferencias significativas (p =0,0007, 0,024 y 0,0006 respectivamente) en las variables bajo estudio, excepto en la relación L/A de la testa.
Si bien en todas las variables analizadas del embrión se observaron diferencias significativas (Tabla 2), el largo del embrión entre las semillas de frutos pequeños y grandes no manifestaron diferencias significativas, pero si (p =0,008) en el ancho del embrión, debido a que esta dimensión del embrión es menor en las semillas de frutos pequeños. Es decir, que las semillas de frutos pequeños tienen embriones casi tan largos como las semillas de los frutos grandes, pero con un ancho menor, revelando una mayor relación L/A del embrión, el cual determina que la forma del embrión de las semillas de frutos pequeños tiende a ser más ovoide que los embriones de las semillas de los frutos medianos y grandes.
Letras diferentes dentro de las columnas indican diferencias significativas (p≤0,05, Test de comparaciones múltiples de Tukey). L/A (e)= Relación Largo/ancho del embriónTabla 2: Tamaño y volumen del embrión de la semilla según el tamaño del fruto.

En las semillas provenientes de frutos medianos el largo del embrión es menor que el de las semillas de frutos grandes y pequeños, pero es el embrión que en la semilla ocupa mayor espacio, alrededor de un 7,23% (DE=0,26; n=600), del volumen total de la testa, por lo que las semillas de este fruto presentan menor espacio de aire. En las semillas de frutos grandes y pequeños, el tamaño del embrión ocupa solo un 6,97% (DE=0,14; n=600) y 6,70% (DE=0,70; n=600) respectivamente por lo que poseen mayor espacio aire. Sin embargo, no se reflejaron diferencias significativas en el volumen de aire de las semillas (grandes, medianas y pequeñas).
DISCUSIÓN
Las semillas de orquídeas presentan variaciones en su forma que van desde las filiformes, elípticas, ovoides, redondeadas a fusiformes y en algunos casos presentan alas (Menchaca-G y Moreno-M 2011, Verma et al. 2012). Las que son pequeñas tienden a ser redondeadas, en tanto que las grandes mayormente son filiformes (Arditti et al. 1980, Dangat y Gurav 2016). En el presente trabajo se observó que las semillas P. tankervilleae pueden ser desde filiformes a fusiformes dependiendo la presencia del embrión, dado que se identificaron dos formas de semillas, aquellas que tienen embrión son fusiformes, mientras que aquellas que no poseen embrión o vanas, son filiformes. En términos generales se establece que las semillas con embrión de P. tankervilleae son fusiformes y según Verma et al. (2012), las semillas que presentan esta forma tienen embriones pequeños y la mayor parte de la semilla está llena de aire.
En el presente estudio el volumen de aire se estimó entre un 92 y 93% dependiendo del tamaño del fruto. Espacios de aire de estas dimensiones también se han observado en el género Cypripedium (Arditti et al. 1979). En tanto que en especies de Habenaria los espacios de aire pueden variar de 0,86 a 84,91% (Dangat y Gurav 2016). La cantidad de espacio de aire que poseen las semillas puede afectar la dispersión de las semillas debido a su dispersión anemocoria, ya que se espera que las semillas con alto porcentaje de espacio aéreo, es decir una mayor relación volumen de testa/volumen de embrión, tengan una dispersión más amplia, (Menchaca-G y Moreno-M 2011, Verma et al. 2012, Tongbram et al. 2012). En cuanto al tamaño del embrión, este puede ser extremadamente pequeño, formado por unas 8 a 200 células (Menchaca-G y Moreno-M 2011), llegando a ocupar apenas un 4% de la semilla (Arditti 1992, Arditti y Abdul Ghani 2000, Dalzotto y Lallana 2015). En semillas fusiformes la proporción que ocupa el embrión puede variar de 4 a 22,27% (Arditti et al. 1979, Verma et al. 2012), aunque Tongbram et al. (2012) reportaron que el embrión en una semilla fusiforme puede llegar a ocupar hasta un 48,5% del volumen total de la semilla, como ocurre en las semillas de Vanda coerulea Griff. ex Lindl. En este caso se encontró que los embriones de P. tankervilleae ocupan entre un 6,70 a 7,23 % en el volumen de la semilla y es variable de acuerdo al tamaño del fruto.
Basado en los resultados de este trabajo y según la clasificación de Barthlott et al. (2014), la semilla viable, es decir la semilla que dará origen a una nueva planta de P. tankervilleae, puede ser pequeña o mediana, dependiendo del tamaño del fruto. Las semillas provenientes de frutos grandes y medianos son medianas, en tanto que las semillas de frutos pequeños presentan semillas pequeñas y con más espacio de aire en la testa que los frutos medianos y grandes debido a que presenta un embrión relativamente pequeño (Tabla 2), sin embargo, no hubo diferencias significativas en los volúmenes de aire entre los tres tamaños de semillas.
Además del tamaño del fruto, hay otros factores que inducen cambios en el tamaño de las semillas como la variación genética (Meyer 1997, Susko y Lovett-D 2000), disponibilidad de recursos durante el desarrollo del fruto (Vaughton y Ramsey 1998, Ericksson 1999) y cambios ambientales (Pitelka et al. 1983).
El tamaño de la semilla tiene un rol importante en la evolución de la historia de vida de una especie (Leishman y Westoby 1992), y los factores que más afectan en la evolución del tamaño de las semillas son los cambios en la forma de crecimiento (Moles et al. 2005) y la alteración de la disponibilidad de los recursos (Winn 1988, Ericksson 1999). Consecuentemente, el tamaño de la semilla se considera como un indicador de calidad fisiológica dado que se correlaciona positivamente con el vigor de las plantas (Aguiar 1995, Rendón et al. 2002, Aráoz et al. 2004), y mayor capacidad de sobrevivencia, por lo que el tamaño de la semilla puede afectar potencialmente no sólo el éxito inmediato de las plántulas, sino también la generación siguiente (Wulff 1986).
Otro indicador de la calidad de la semilla es el porcentaje de viabilidad, el cual puede determinarse con la prueba de Tetrazolio. Esta prueba ya ha sido utilizada con éxito en P. tankervilleae, en semillas obtenidas de plantas que crecieron en su lugar de origen y se observó un 82,3% de semillas viables (Hirano et al. 2009); sin embargo, en este trabajo los resultados del test mostraron bajos porcentajes de viabilidad y fue variable según el tamaño del fruto; a medida que disminuye el tamaño de este, se incrementa la cantidad de semillas vanas. La baja viabilidad observada en este caso puede deberse a los efectos de la autopolinización o a la ausencia de un polinizador, dado que la auto-polinización reduce la producción de semillas en las orquídeas (Tremblay et al. 2005). Si bien P. tankervilleae es autocompatible, la tasa de polinización abierta es muy baja, debido a que no es autógama, ya que requiere polinizadores específicos los cuales puede ser insectos pertenecientes a los órdenes Hymenoptera, Lepidoptera y Diptera (Buragohain et al. 2016).
El análisis de viabilidad es necesario para evaluar la cantidad real de semillas viables por cápsula y es importante porque la viabilidad puede variar significativamente entre las cápsulas de una misma especie. En Phragmipedium pearcei (Rchb. f.) Rauh & Senghas se observó una variación de un 20 a 80% entre las cápsulas. En tanto que Cypripedium acaule Aitón cuyas semillas son fusiformes la viabilidad varió de 20 a 40% (Lauzer et al. 1994, Muñoz y Jiménez 2008).
El tamaño y la cantidad de semillas viables de P. tankervilleae varían según el tamaño del fruto. La baja viabilidad de las semillas y gran volumen de aire que poseen las semillas de esta orquídea terrestre, podrían dificultar la humectación de la misma y por ende su germinación. Si se desea cultivar o almacenar estas semillas sería conveniente seleccionar frutos de mayor tamaño, aproximadamente de 6 cm de largo. Aunque resulta de vital importancia almacenar semillas de todos los frutos para conservar la variabilidad de la especie. Cuando se considera emplear semillas pequeñas es importante tener en cuenta, que ellas pueden influir negativamente en el crecimiento y establecimiento de las plántulas (Susko y Lovett-D 2000).
PARTICIPACIÓN DE AUTORES
ERD concepción, análisis de datos y escritura del documento, VM obtención de microfotografías y toma de datos, GK análisis de datos y escritura del documento, PR concepción y escritura del documento, FN escritura del documento.
AGRADECIMIENTOS
A la Facultad de Ciencias Forestales por su colaboración para la ejecución de esta investigación y al CONICET y CEDIT por la beca otorgada. Al Dr. Lallana por proveer bibliografía que sirvió para la escritura de este trabajo.
LITERATURA CITADA
Referencias
Aguiar IB. 1995. Conservação de sementes. En: Silva A, Piña-Rodrigues FCM, Figliolia MB, coordinadore. Manual técnico de sementes florestais. São Paulo: Instituto Florestal, IF Série Registros, n. 14. p. 33–44.
Anand M, Sankari A, Arulmozhiyan R. 2013. Performance of orchid species in Shevaroy hills of Eastern Ghats. J. Hortl. Sci. 8(2):210–213.
Aráoz S, Del Longo O, Karlin O. 2004. Germinación de semillas de Zizyphus mistol Grisebach III. Correlaciones paramétricas del tamaño y peso de drupas, endocarpos y semillas con la germinación y el vigor. Mult. 13(2):51–56.
Arditti J, Abdul Ghani AK. 2000. Tansley Review No.110. Numerical and physical properties of orchid seeds and their biological implications. New Phytol. 145(3):367–421. doi:10.1046/j.1469-8137.2000.00587.x.
Arditti J, Michaud JD, Healey PL. 1979. Morphometry of orchid seeds. I. Paphiopedilum and native California and related species of Cypripedium. Am. J. Bot. 66(10):1128–1137.
Arditti J, Michaud JD, Healey PL. 1980. Morphometry of orchid seeds. II. Native California and related species of Calypso, Cephalanthera, Corallorhiza and Epipactis. Am. J. Bot. 67(3):347–360. doi:10.2307/2442345.
Arditti J. 1992. Fundamentals of orchid biology. First edition. New York: John Wiley and Sons.
Barthlott W, Große-Veldmann B, Korotkova N. 2014. Orchid seed diversity. A scanning electron microscopy survey. Turland NJ, Rodewald M, editores. Berlin: Botanic Garden
and Botanical Museum Berlin-Englera.
Billard CE, Dalzotto CA, Lallana VH. 2014. Desinfección y siembra asimbiótica de semillas de dos especies y una variedad de orquídeas del género Oncidium. Polib. (38):145–157.
Bishop T. 2000. Field guide to the orchids of NSW and Victoria. 2th edition. Sydney: University of New South Wales Press.
Buragohain B, Chaturvedi SK, Puro N. 2016. Pollination Biology of Phaius tankervilleae (Banks ex L’Herit) Bl. (Orchidaceae). Int. J. Plant. Reproductive Biol. 8(1):75–81. doi:10.14787/ijprb.2016 8.1.75-81.
Chávez HK, Mosquera A T, Otero-O JT. 2015. Propagación in vitro de semillas de la orquídea Comparettia falcata Poepp. y Endl. (Orchidaceae) mediante técnicas simbióticas y asimbióticas. A. Agro. 64(2):125. doi:10.15446/acag.v64n2.42976.
Chemisquy MA, Prevosti FJ, Morrone O. 2009. Seed morphology in the tribe Chloraeeae (Orchidaceae): combining traditional and geometric morphometrics. Bot. J. Lin. Soc. 160(2):171–183. doi:10.1111/j.1095-8339.2009.00968.x.
Cheng SF, Yeh CH, Jan CH, Chang DCN. 2012. Growth and development of Phaius tankervilleae (Banks) Blume when inoculated with orchid mycorrhizal fungi. Afr. J. Agr. Res. 7(42):5644–5652. doi:10.5897/AJAR12.1182.
Cribb P, Sun M, Barretto G. 2004. Phaius tankervilleae and P. wallichii (Orchidaceae), a pair of confused species. Kew Bulletin 59(4):547–554. doi:10.2307/4110909.
Dalzotto CA, Lallana VH. 2015. Effect of testa in vitro germination of Bipinnula pennicillata (Rchb. F.) Sisternas & Salazar (Orchidaceae). Inv. Agr. 17(2):116–121. doi:10.18004/investig.agrar.2015.diciembre.116-121.
Dangat BT, Gurav RV. 2016. Studies on seed morphometry of Habenaria species from Western Ghats, India. Rich. 13(2):174–188.
Di Rienzo JA, Casanoves F, Balzarini MG, González L, Tablada M, Robledo CW. 2016. InfoStat, versión 2016, Grupo InfoStat, FCA. Argentina: Universidad Nacional de Córdoba.
Eriksson O. 1999. Seed size variation and its effect on germination and seedling performance in the clonal herb Convallaria majalis. A. Oecol. 20(1):61–66. doi:10.1016/S1146-609X(99)80016-2.
Galdiano RF, Lemos EG, Faria RT, Vendrame WA. 2012. Cryopreservation of Dendrobium hybrid seeds and protocorms as affected by phloroglucinol and Supercool X1000. Sci. Hortl. 148:154–160. doi:10.1016/j.scienta.2012.09.036.
Galetti M, Guevara R, Côrtes MC, Fadini R, Von Matter S, Leite AB, Ribeiro T, Carvalho CS, Collevatti RG, Pires MM, Guimarães PR, Brancalion PH, Ribeiro MC, Jordano P. 2013. Functional extinction of birds drives rapid evolutionary changes in seed size. Sci. 340(6136):1086–1090. doi:10.1126/science.1233774.
García LF, Lallana VH. 2014. Protocolo para el análisis de viabilidad de semillas de orquídeas con la prueba topográfica por tetrazolio. Rev. Anal. Sem. 7(28):75–78.
Geritz SA. 1995. Evolutionarily stable seed polymorphism and small-scale spatial variation in seedling density. The Am. Nat. 146(5):685–707. doi:10.1086/285820.
Givnish TJ, Spalink D, Ames M, Lyon SP, Hunter SJ, Zuluaga A, Iles W JD, Clements MA, Arroyo MTK, Leebens-M J, Endara L, Kriebel R, Neubig KM, Whitten WM, Williams NH, Cameron KM. 2015. Orchid phylogenomics and multiple drivers of their extraordinary diversification. Proc. R. Soc. B. The Royal Society. 282(1814):1–10. doi:10.1098/rspb.2015.1553.
Halpern SL. 2005. Sources and consequences of seed size variation in Lupinus perennis (Fabaceae): adaptive and non-adaptive hypotheses. Am. J. Bot. 92(2):205–213. doi:10.3732/ajb.92.2.205.
Hirano T, Godo T, Miyoshi K, Ishikawa K, Ishikawa M, Mii M. 2009. Cryopreservation and low-temperature storage of seeds of Phaius tankervilleae. Plant. Biot. Rep. 3(1):103–109. doi:10.1007/s11816-008-0080-5.
Kumar R, Deka BC, Roy AR. 2012. Evaluation of orchid Species under Sub-Tropical Mid-Hills of Meghalaya. Hortf. Res. Spect. 1(1):24–28.
Lallana VH, García LF. 2013. Efecto de pretratamientos en la prueba de viabilidad de semillas de Trichocentrum jonesianum (Orchidaceae). Inv. Agr. 15(2): 129–132.
Lallana VH, García LF. c2016. Viabilidad de semillas de orquídeas almacenadas en frio. En: Di Leo N, Labria H, Seghesso A, editores. Libro de resúmenes de la I Reunión Transdisciplinaria en Ciencias Agropecuarias. XVII Jornada de Divulgación Técnico-Científicas de la Facultad de Ciencias Veterinarias, UNR. II Jornadas de Ciencia y Tecnología. Argentina: Universidad Nacional de Rosario. p. 143–144. [Revisada en: 14 sep 2016] http://www.fveter.unr.edu.ar/upload/LIBRO_DE_R E S U M E N E S _ I _ R E U N I % D 3 N _TRANSDISCIPLINARIA_EN_CIENCIAS_AGROPECUARIAS_2016.pdf
Lauzer D, St-Arnaud M, Barabé D. 1994. Tetrazolium staining and in vitro germination of mature seeds of Cypripedium acaule (Orchidaceae). Lindl. 9:197–204.
Leishman M R, Westoby M.1992. Classifying plants into groups on the basis of associations of individual traits-evidence from Australian semi-arid woodlands. J. Ecol. 80(3):417–424. doi:10.2307/2260687.
Leishman MR, Wright IJ, Moles AT, Westoby M. 2000. The evolutionary ecology of seed size. New York: CABI Publishing.
Mckendrick SL, Leake JR, Lee-T D, Read DJ. 2002. Symbiotic germination and development of the myco-heterotrophic orchid Neottia nidusavis in nature and its requirement for locally distributed Sebacina spp. New Phytol. 154(1):233–247. doi:10.1046/j.1469-8137.2002.00372.x.
Menchaca-G RA, Moreno-M D. 2011. Manual para la propagación de orquídeas. Primera edición. México: Comisión Nacional Forestal-CONAFOR, Universidad Veracruzana.
Merritt DJ, Hay FR, Swarts ND, Sommerville KD, Dixon KW. 2014. Ex situ Conservation and Cryopreservation of Orchid Germplasm. Int. J. Plant. Sci. 175(1):46–58. doi:10.1086/673370.
Meyer SE. 1997. Ecological correlates of achene mass variation in Chrysothamnus nauseosus (Asteraceae). Am. J. Bot. 84(4): 471–477. doi: doi.org/10.2307/2446023.
Moles AT, Ackerly DD, Webb CO, Tweddle JC, Dickie JB, Westoby M. 2005. A brief history of seed size. Sci. 307(5709):576–580. doi:10.1126/science.1104863.
Muñoz M, Jiménez VM. 2008. Capsule development, in vitro germination and plantlet acclimatization in Phragmipedium humboldtii, P. longifolium and P. pearcei. Lank. Int. J. Orchi. 8(2):23–31.
Nong VD, Chen T, Zhang D. 2011. Phaius baolocensis sp. nov. (Orchidaceae), a new species endemic to the southern highlands of Vietnam. Adan. 34(2):251–255. doi:10.5252/a2012n2a4.
Pant B. 2013. Medicinal orchids and their uses: tissue culture a potential alternative for conservation. Afr. J. Plant. Sci. 7(10):448–467. doi:10.5897/AJPS2013.1031.
Pant B, Shrestha S, Pradhan S. 2011. In vitro seed germination and seedling development of Phaius tankervilleae (L’Her.) Blume. Scietf. World. 9(9):50–52. doi:10.3126/sw.v9i9.5518.
Pant B, Shrestha S. 2011. In vitro mass propagation of a ground orchid-Phaius tancarvilleae (L’Her.) Blume through shoot tip culture. Plant. Tis. Cul. Biot. 21(2):181–188. doi:10.3329/ptcb.v21i2.10241.
Pitelka LF, Thayer ME, Hansen SB. 1983. Variation in achene weight in Aster acuminatus. Can. J. Bot. 61:1415–1420. doi:10.1139/b83-152.
Popova E, Kim HH, Saxena PK, Engelmann F, Pritchard HW. 2016. Frozen beauty: The cryobiotechnology of orchid diversity. Biot. Adv. 34(4):380–403. doi:10.1016/j.biotechadv.2016.01.001.
Rendón JAS, García BM, Cuesta YR, Areas YT. 2002. Correlación entre el tamaño de la semilla, la dormancia, la germinación y el vigor de las plántulas de Calophyllum pinetorum. Rev. Jar. Bot. Nac. 23(1):75–84.
Reyes-L D, Quiroz-V J, Kelso-B HA, Huerta-L M., Avendaño-A CH, Lobato-O R. 2015. Caracterización estomática de cinco especies del género Vanilla. Agr. Meso. 26(2):237–246. doi:10.15517/am.v26i2.19279.
Rodríguez I, Adam G, Durán JM. 2008. Ensayos de germinación y análisis de viabilidad y vigor en semillas. Agricultura: Rev. Agr. 78(912):836–842.
Ruiz MA. 2009. El análisis de tetrazolio en el control de calidad de semillas. Caso de estudio: cebadilla chaqueña. EEA INTA Anguil, Publicación técnica 77:1–19.
Salazar-M SA. 2012. Germinación asimbiótica de semillas y desarrollo in vitro de plántulas de Cattleya mendelii Dombrain (Orchidaceae). A. Agr. 61(1):69–78.
Salazar-M SA, Cancino GO. 2012. Evaluación del efecto de dos suplementos orgánicos en la germinación in vitro de orquídeas nativas de la provincia de Pamplona, Colombia. Rev. Col. Biot. 14(1):53–59.
Susko DJ, Lovett-D L. 2000. Patterns of seed mass variation and their effects on seedling traits in Alliaria petiolata (Brassicaceae). Am. J. Bot. 87(1):56–66. doi:10.2307/2656685.
Thokchom R, Maitra S, Sharma S. 2017. In vitro Mass Propagation of Endangered Terrestrial Orchid Phaius tankervilliae (L’Her.) Blume through Green Seed Pod Culture. Int. J. Curr. Microbiol. App. Sci. 6(5):722–728. doi:10.20546/ijcmas.2017.605.081.
Tiffney BH. 2004. Vertebrate dispersal of seed plants through time. Annu. Rev. Ecol. Evol. Syst. 35:1–29. doi:10.1146/annurev.ecolsys.34.011802.132535.
Tongbram J, Rao AN, Vij SP. 2012. Seed morphometric studies in some orchids from Manipur. J. Orch. Soc. Ind. 26(1-2):25–2.
Tremblay RL, Ackerman JD, Zimmerman JK, Calvo RN. 2005. Variation in sexual reproduction in orchids and its evolutionary consequences: a spasmodic journey to diversification. Biol. J. Lin. Soc. 84(1):1–54. doi:10.1111/j.1095-8312.2004.00400.x.
Vaughton G, Ramsey M. 1998. Sources and consequences of seed mass variation in Banksia marginata (Proteaceae). J. Ecol. 86:563–573. doi:10.1046/j.1365-2745.1998.00279.x.
Verma J, Kusum N, Thakur K, Sembi JK, Vij S P. 2012. Study on seed morphometry of seven threatened Himalayan orchids exhibiting varied life modes. A. Bot. Gal. 159(4):443–449. doi:10.1080/12538078.2012.750582.
Winn AA. 1988. Ecological and evolutionary consequences of seed size in Prunella vulgaris. Ecol. 69(5):1537–1544. doi:10.2307/1941651.
Wulff RD. 1986. Seed size variation in Desmodium paniculatum: I. Factors affecting seed size. The J. Ecol. 74(1):87–97. doi:10.2307/2260350.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Marcela Agustina Báez, Guillermo Küppers, Daily García, Evelyn Raquel Duarte. (2024). Evaluación de viabilidad y factibilidad de germinación de semillas de Dendrobium nobile almacenadas a temperatura ambiente sin secado previo. Revista Colombiana de Biotecnología, 26(1), p.5. https://doi.org/10.15446/rev.colomb.biote.v26n1.107668.
2. Maydelin Torres-Barrios, Alejandro Enrique Pedroso-Reynaldo , Esther Lilian Santacruz Cabrera , Elaine González Hernández , José Lázaro Bocourt Vigit. (2025). Conservación de semillas de orquídeas nativas en banco de germoplasma del Jardín Botánico Orquideario Soroa, Cuba. Avances en Investigación Agropecuaria, 29 https://doi.org/10.53897/RevAIA.25.29.08.
3. Natalia Raquel Dolce, Ricardo Daniel Medina, Graciela Terada, María Teresa González-Arnao, Eduardo Alberto Flachsland. (2020). Orchid Biology: Recent Trends & Challenges. , p.37. https://doi.org/10.1007/978-981-32-9456-1_4.
4. Seir Antonio Salazar Mercado, Edison Alexander Botello Delgado, Jesús David Quintero Caleño. (2020). Efecto de pretatamientos en la prueba de tetrazolio en semillas de Epidendrum barbaricum Hágsater & Dodson. Acta Agronómica, 68(4), p.306. https://doi.org/10.15446/acag.v68n4.79619.
5. Seir Antonio Salazar Mercado, Edinson Alexander Botello Delgado, Jesús David Quintero Caleño. (2020). Optimización de la prueba de tetrazolio para evaluar la viabilidad en semillas de Solanum lycopersicum L.. Ciencia & Tecnología Agropecuaria, 21(3), p.1. https://doi.org/10.21930/rcta.vol21_num3_art:1344.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2017 Caldasia

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cual estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).