Diversidad taxonómica y funcional de arañas (Araneae) epigeas en bosques nativos de las Yungas (Salta, Argentina)
Taxonomic and functional diversity of epigeal spiders (Araneae) in native forest of the Yungas (Salta, Argentina)
DOI:
https://doi.org/10.15446/caldasia.v39n2.63071Palabras clave:
Araneofauna, ecoregión, ensambles de especies, gremios, uso del suelo (es)Araneofauna, eco-region, species assemblages, guilds, land use (en)
El estudio de la araneofauna en las Yungas argentinas es escaso. Sin embargo, es relevante debido a la alta diversidad ambiental y biológica que posee esta ecorregión, principalmente en los sistemas forestales amenazados por el avance de la frontera agropecuaria. El objetivo de este trabajo es comparar la diversidad y la composición de los ensambles de arañas epigeas en la Selva Pedemontana (SP), Selva Montana (SM) y Bosque Montano (BM) de las Yungas de la provincia de Salta. Se tomaron muestras mediante trampas de caída durante el otoño, la primavera 2006 y el verano 2007 en tres sitios de la SP, cinco en la SM, y tres en el BM. Se recolectaron 643 arañas pertenecientes a 75 especies/morfoespecies. Los ensambles de SP reportaron la mayor riqueza de especies sumado a una composición de especies muy disímil en relación con las de SM y BM. Las tejedoras espaciales, otras cazadoras y cazadoras de suelo representaron más del 95 % de la abundancia en cada comunidad. Ellas mostraron patrones semejantes de abundancia en la SM y BM, mientras que en la SP las tejedoras espaciales redujeron marcadamente su abundancia. El cambio en la configuración del paisaje debido al uso del suelo es la principal fuerza que estaría estructurando los ensambles locales de la SP. Este estudio constituye el primero en analizar la diversidad de arañas epigeas y sus gremios en las Yungas del norte argentino siendo un punto de partida para futuros monitoreos de biodiversidad en la región.
The study of the arachnofauna in the argentinean Yungas is scarce. However, it is relevant due to the high environmental and biological diversity, mainly in the forest systems threatened by the advance of the agricultural frontier. The aim of this work is to compare the diversity and composition of epigeal spider assemblages in the Piedmont Forest (SP), Mountain Jungle (SM) and Mountain Forest (BM) of the Yungas in the province of Salta. Three sites of the SP and BM, and five of the SM were considered. Sampling was carried out during autumn, spring (2006) and summer (2007) with pitfall traps. A total of 643 spiders of 75 species/morphospecies were collected. The SP sites showed the highest species richness and species composition very dissimilar compared to the SM and BM. The space web weavers, other hunters and ground hunters accounted for more than 95 % of the abundance in each community considered. They showed similar patterns of abundance in SM and BM, while in SP the space web weavers markedly reduced their abundance. The change in the landscape configuration due to the land use is the main forces that would be structuring the local assemblages of the SP. This study is the first to analyze the epigeal spiders diversity and their guilds in the Yungas of the argentine north, being a starting point for future monitoring of biodiversity in the region.
Recibido: 21 de marzo de 2017; Aceptado: 23 de agosto de 2017
RESUMEN
El estudio de la araneofauna en las Yungas argentinas es escaso. Sin embargo, es relevante debido a la alta diversidad ambiental y biológica que posee esta ecorregión, principalmente en los sistemas forestales amenazados por el avance de la frontera agropecuaria. El objetivo de este trabajo es comparar la diversidad y la composición de los ensambles de arañas epigeas en la Selva Pedemontana (SP), Selva Montana (SM) y Bosque Montano (BM) de las Yungas de la provincia de Salta. Se tomaron muestras mediante trampas de caída durante el otoño, la primavera 2006 y el verano 2007 en tres sitios de la SP, cinco en la SM, y tres en el BM. Se recolectaron 643 arañas pertenecientes a 75 especies/morfoespecies. Los ensambles de SP reportaron la mayor riqueza de especies sumado a una composición de especies muy disímil en relación con las de SM y BM. Las tejedoras espaciales, otras cazadoras y cazadoras de suelo representaron más del 95 % de la abundancia en cada comunidad. Ellas mostraron patrones semejantes de abundancia en la SM y BM, mientras que en la SP las tejedoras espaciales redujeron marcadamente su abundancia. El cambio en la configuración del paisaje debido al uso del suelo es la principal fuerza que estaría estructurando los ensambles locales de la SP. Este estudio constituye el primero en analizar la diversidad de arañas epigeas y sus gremios en las Yungas del norte argentino siendo un punto de partida para futuros monitoreos de biodiversidad en la región.
Palabras clave:
Araneofauna, ecoregión, ensambles de especies, gremios, uso del suelo.ABSTRACT
The study of the arachnofauna in the argentinean Yungas is scarce. However, it is relevant due to the high environmental and biological diversity, mainly in the forest systems threatened by the advance of the agricultural frontier. The aim of this work is to compare the diversity and composition of epigeal spider assemblages in the Piedmont Forest (SP), Mountain Jungle (SM) and Mountain Forest (BM) of the Yungas in the province of Salta. Three sites of the SP and BM, and five of the SM were considered. Sampling was carried out during autumn, spring (2006) and summer (2007) with pitfall traps. A total of 643 spiders of 75 species/morphospecies were collected. The SP sites showed the highest species richness and species composition very dissimilar compared to the SM and BM. The space web weavers, other hunters and ground hunters accounted for more than 95 % of the abundance in each community considered. They showed similar patterns of abundance in SM and BM, while in SP the space web weavers markedly reduced their abundance. The change in the landscape configuration due to the land use is the main forces that would be structuring the local assemblages of the SP. This study is the first to analyze the epigeal spiders diversity and their guilds in the Yungas of the argentine north, being a starting point for future monitoring of biodiversity in the region.
Key words:
Araneofauna, eco-region, species assemblages, guilds, land use.INTRODUCCIÓN
Los bosques subtropicales húmedos de las Yungas argentinas contienen, junto con la Selva Misionera, más del 50 % de la biodiversidad del país presentando un alto grado de endemismo (Bertonatti y Corcuera 2000). Los ambientes boscosos de las Yungas están representados por tres pisos altitudinales de vegetación con diferentes características fisonómicas y florísticas: Selva Pedemontana, Selva Montana y Bosque Montano. De ellos, la Selva Pedemontana es el piso altitudinal más bajo de las Yungas (400-700 m) y es uno de los sistemas forestales más amenazados a nivel nacional (Brown et al. 2006) debido principalmente a la sobre-explotación de especies arbóreas de alto valor maderero (Browny Malizia2004). En la actualidad, casi el 90 % de su superficie ha sido reemplazada por áreas cultivadas (Volante et al. 2012), gracias también a sus condiciones edáficas. Este proceso se ha visto intensificado entre el 2000 y 2007 registrándose las tasas de deforestación y fragmentación del hábitat más altas de la historia (1,15 % anual), duplicando el promedio de deforestación latinoamericano (Grau y Aide 2008, Volante et al. 2012). En la provincia de Salta, la producción agrícola se concentra principalmente en la Selva Pedemontana y en el Chaco Serrano, donde la soja es el mayor cultivo intensivo, sumado al tabaco, poroto, cereales, cítricos, caña de azúcar y la ganadería (Gasparri et al. 2004).
Los ecosistemas de bosque parecen ser homogéneos estructuralmente; sin embargo, existe una alta diversidad de microhábitats sobre el suelo donde las variables ambientales locales como radiación, humedad, vegetación del suelo, profundidad de la hojarasca, entre otras (Niemelä et al. 1996), juegan un papel fundamental en la estructuración de muchas comunidades principalmente de artrópodos (Knapp y Řezáč 2015). El estudio de la diversidad de este grupo en las Yungas argentinas es relativamente escaso, siendo necesario incentivarlos en aquellos ambientes con elevada presión antrópica. Este aspecto adquiere relevancia ya que las actividades humanas van acompañadas, en la mayoría de los casos, por la pérdida global de las especies (Fischer y Lindenmayer 2007). Así, la matriz agrícola circundante a ambientes boscosos influye sobre las comunidades nativas (Blitzer et al. 2012), produciendo cambios en la composición de especies.
Las arañas son sensibles a los cambios en el hábitat debido a la gran cantidad de nichos espaciales y temporales que ocupan (Uetz 1991, Hsieh et al. 2003, Buchholz 2010). Por ello han sido consideradas como indicadoras de cambios ambientales (Scott et al. 2006, Ziesche y Roth 2008, Barriga et al. 2010), pudiendo responder rápidamente a aquellos relacionados con el uso del suelo (Perner y Malt 2003). Estudios recientes han demostrado que la diversidad funcional más que la riqueza de especies puede explicar mejor los efectos de la biodiversidad sobre las funciones de los ecosistemas (Schuldt et al. 2014). En este contexto, el estudio de los gremios de arañas contribuye también al conocimiento sobre el funcionamiento de los ecosistemas y cómo ellas utilizan el hábitat (Cardoso et al. 2011). Las arañas constituyen un grupo muy diverso y abundante de especies depredadoras, convirtiéndolas en organismos claves por su impacto en cualquier ecosistema terrestre (Grismado et al. 2014). A pesar de ello, el estudio ecológico de la araneofauna en los ambientes de las Yungas argentinas, como así también en regiones tropicales y subtropicales del Hemisferio Sur, es escaso (Flórez 1998, Grismado et al. 2014).
El objetivo de este trabajo es contribuir al conocimiento actual de las arañas en las Yungas argentinas comparando la diversidad y la composición de sus ensambles epigeos en los tres pisos de bosques de las Yungas de la provincia de Salta. Se postula que las comunidades de arañas en estos tres ambientes difieren en su composición de especies reflejando las condiciones y recursos particulares de cada piso vegetacional, y que la matriz agropecuaria que rodea a los bosques nativos de la Selva Pedemontana influye sobre la comunidad de arañas nativas de las Yungas, produciendo cambios en su diversidad y composición.
MATERIALES Y MÉTODOS
Área de estudio
Comprendió la porción central de la provincia de Salta entre los 24°28' y 25°38' Sur y entre los 65°37' y 64°51' Oeste donde están representados los tres pisos vegetacionales de las Yungas: Selva Pedemontana (SP), Selva Montana (SM) y Bosque Montano (BM). En general, el clima regional es cálido y húmedo a sub-húmedo con una temperatura media anual de 21,5° C; existiendo una marcada variación estacional de la temperatura debido al fuerte gradiente altitudinal (Rodríguez y Silva 2012).
La SP (400-700 m) presenta un clima templado cálido y húmedo con registros de precipitación anual de 600 a 1000 mm. Este tipo vegetacional presenta una estructura física simple, poco diversa, caracterizada por la selva de palo blanco (Calycophyllum multiflorum Griseb.) y palo amarillo (Phyllostylon rhamnoides (J. Poiss.) Taub.) (Brown et al. 2006). La SP es uno de los sistemas forestales más estacionales de Sudamérica, donde más del 70 % de las especies pierden su follaje durante la estación seca y florecen a principios de la primavera (Prado 1995).
La SM (700-1500 m) representa la franja altitudinal de mayores precipitaciones anuales entre los 1500 y 3000 mm, con un clima templado cálido y húmedo. Es un bosque con predominio de especies perennifolias, con estratos más densos y mayor organización física de la vegetación con lianas, epífitas, musgos con un denso sotobosque y estrato arbóreo (Brown et al. 2006). La selva de laurel, al pie de los cordones montañosos, y la selva de mirtáceas caracterizan a esta unidad ambiental (Brown y Malizia 2004).
Por último, el BM (1500-3000 m) representa el piso ecológico de los bosques nublados, con precipitaciones anuales que varían entre los 900 y 1300 mm. Aquí, son característicos los bosques de pino de cerro (Podocarpus parlatorei Pilg.), los bosques de aliso (Alnus acuminata Kunth) y los bosques de queñoa (Polylepis). Esta unidad muestra el paisaje con mayor heterogeneidad estructural dada por bosques en distintos estadíos sucesionales a partir de la dinámica del fuego (Brown et al. 2006).
Diseño de muestreo
Se establecieron once sitios geo-referenciados y distantes entre sí por al menos 3 km (Fig. 1). Así, tres sitios de la SP estuvieron ubicados en los departamentos Metán (SP1 y SP2) y Capital (SP3), todos ellos rodeados por un mosaico de áreas con diferentes usos de suelo como ganadería, agricultura, espacios urbanos, periurbanos, entre otros. Cinco sitios pertenecieron a la SM localizados en los departamentos Capital (SM1 y SM2) y La Caldera (SM3, SM4 y SM5); mientras que tres correspondieron al BM situados en el departamento La Caldera (BM1, BM2 y BM3). La selección de los sitios de muestreo estuvo limitada por la logística, disponibilidad económica y de accesibilidad fundamentalmente al Bosque Montano y la posibilidad de localizar ambientes nativos de la SP en buen estado de conservación y con una amplia superficie mayor a 2500 ha aproximadamente. Los muestreos se realizaron en abril y noviembre del 2006 que son otoño y primavera, respectivamente, y marzo del 2007 correspondiente al verano. En cada sitio se colocaron al azar diez trampas de caída ampliamente separadas en un área mayor a 1 ha, y con actividad de siete días por fecha de muestreo. Las trampas fueron recipientes plásticos de 7,5 x 12,2 x 5,2 cm (diámetro superior x profundidad x diámetro inferior), con solución sobresaturada de cloruro de sodio (1 kg de NaCl en 8 lts de agua con gotas de detergente). El material recolectado fue preservado en etanol al 70 %. Este método de recolección está estandarizado y es aceptado para muestrear invertebrados epigeos, permitiendo estimar la diversidad de especies y describir cambios temporales y espaciales en la comunidad (Churchill y Arthur 1999).
Figura 1: Localización de los sitios de muestreos en la Selva Pedemontana (SP), Selva Montana (SM) y Bosque Montano (BM) de las Yungas de la provincia de Salta, Argentina.
Las arañas fueron identificadas a nivel de familia utilizando claves taxonómicas (Ubick et al. 2005, Grismado et al. 2014), y se trató de identificar a género o especie teniendo en cuenta las revisiones de géneros y las publicaciones correspondientes a las descripciones de especies, siguiendo la nomenclatura del World Spider Catalog (c2017). Para los análisis de diversidad se usó el concepto de morfoespecie (Samways et al. 2010), el cual denota una unidad taxonómica operativa equivalente a una especie. Ellas se reconocieron sobre la base de caracteres somáticos y de los genitales (Escorcia et al. 2012, Almada y Sarquis 2016). Esta metodología se usó debido a la carencia de revisiones taxonómicas para muchos géneros o familias de arañas y la gran cantidad de especies aun no descritas en Sudamérica. Además, cuando los ejemplares inmaduros fueron recolectados en una misma trampa con ejemplares adultos (excepto primeros estadíos de licósidos) fueron asignados a ellos y reconocidos a su nivel de especie/morfoespecies mediante comparaciones morfológicas, ya que su inclusión es necesaria para obtener estimaciones confiables de la riqueza de especies (Jiménez-Valverde y Lobo 2007, Rubio y Moreno 2010, Castanheira et al. 2016). De esa manera, sólo el 10% de los inmaduros registrados pudieron ser asociados a adultos. Los especímenes fueron depositados en la colección IEBI-MCN (Instituto para el Estudio de la Biodiversidad de Invertebrados-Museo de Ciencias Naturales, Universidad Nacional de Salta).
Análisis de datos
Diversidad y composición de especies/ morfoespecies de arañas epigeas
Con el propósito de considerar sólo la fauna epigea del área de estudio, se eliminaron 118 individuos recolectados pertenecientes a las familias Amaurobiidae, Anapidae, Araneidae, Hahniidae, Micropholcommatidae, Tetragnathidae, Theridiidae, y Titanoecidae. Se calcularon los valores de riqueza de especies/ morfoespecies, abundancia de individuos, número de familias, singletones (especies con un solo individuo) y dobletones (especies con dos individuos) por sitio y unidad de vegetación. Así mismo, la eficiencia del muestreo fue evaluada como el porcentaje de especies observadas con respecto a las esperadas por el estimador no paramétrico Chao1, análisis que se realizó con el programa EstimateS 9.1 (Colwell c2013), estimador recomendado en comunidades con muestras altamente heterogéneas (Chao y Shen c2012). La riqueza de especies de los ambientes fue comparada mediante el análisis de rarefacción-extrapolación basado en individuos a un mismo nivel de cobertura de la muestra, con intervalos de confianza (IC) del 95 % y 100 permutaciones por medio de la librería iNEXT (Chao et al. c2016) utilizando el lenguaje de Programación R (R Core Team c2014). Este método asegura que las muestras sean comparadas con igual completitud, independientemente del tamaño de la muestra, lo cual permite realizar inferencias más robustas acerca del patrón de riqueza de especies de las comunidades (Chao y Jost 2012). Por otro lado, para comparar la diversidad de las comunidades se calculó el Exponencial del índice de Shannon (1D= primer número de Hill) usando el programa PAST versión 3.11 (Hammer et al. 2001).
Se comparó la similitud entre las tres comunidades de las Yungas mediante el índice de Bray-Curtis, y para probar si existieron diferencias entre ellas se utilizó el Procedimiento de Permutación de Respuesta Múltiple (MRPP), por medio del programa PC-ORD versión 6.0 (McCune y Mefford 2011). Se realizó un Análisis de Componentes Principales (PCA) con el programa PC-ORD versión 6.0 (McCune y Mefford 2011), usando la matriz de varianza-covarianza para lograr un ordenamiento entre las unidades muestreales con base en las respuestas múltiples de las especies dominantes. Para evaluar la efectividad del ordenamiento obtenido y el máximo número de ejes a interpretar aplicamos la recomendación de Peres-Neto et al. (2005). Previo al PCA, la matriz de datos fue sometida a una transformación de distancia de Hellinger (Legendre y Gallagher 2001) para superar el problema de distorsión del análisis de ordenamiento y la falta de normalidad multivariada de las abundancias de las especies.
Diversidad y composición de gremios de arañas epigeas
Las arañas fueron agrupadas en gremios siguiendo a Cardoso et al. (2011): especialistas (ESP), cazadoras de suelo (CSU), otras cazadoras (OCA), cazadoras por emboscada (CEM), tejedoras de telas sensibles (TSE) y tejedoras de telas espaciales (TES). Se consideró este último gremio ya que las especies que lo componen fueron reportadas como especies habituales de la fauna epigea en la región (Torres et al. 2015, Torres 2017). Se calculó la proporción de individuos de los gremios en cada unidad de vegetación y se realizó un Análisis de la Varianza Multivariado (MANOVA) usando el programa PAST versión 3.11 (Hammer et al. 2001), para comparar la abundancia y la riqueza de especies por trampa de los gremios dominantes. Los valores de probabilidad del test de Hotelling fueron ajustados mediante la corrección de Bonferroni con el programa antes mencionado.
Para evaluar el efecto de la distancia geográfica sobre el patrón de similitud de las comunidades estudiadas se realizaron pruebas de Mantel, utilizando el programa PAST versión 3.11 (Hammer et al. 2001). Para ello, se consideró la matriz de similitud faunística usando Jaccard como medida de distancia, y otra matriz de distancia geográfica generada mediante las coordenadas de los sitios en formato WGS84 y la distancia geográfica como una medida de la distancia entre pares de sitios.
Para inferir los eventos que podrían explicar la similitud o la diferencia en los ensambles de arañas entre los pares de sitios, se calculó el índice de similitud de Raup-Crick (βRC). Posteriormente estos valores se estandarizaron entre valores de -1 a 1, mediante la fórmula propuesta por Chase et al. (2011) donde se sustrae 0,5 al valor original obtenido y se multiplica por dos. Este índice provee información sobre el grado en que las comunidades son más diferenciadas o similares de lo esperado por azar (Raup y Crick 1979), permitiendo hacer inferencias biológicas acerca de los eventos asociados a la diferencia entre pares de sitios. Así, βRC ≈ 0: Similitudobservada ~ Similitudesperada implica que los eventos estocásticos estructuran las comunidades con una elevada dispersión entre ambientes; βRC ≈ 1: Similitudobservada < Similitudesperada sugiere que las diferencias en los filtros ambientales determinísticos entre los sitios motivan la diferencia en la composición de especies, por lo que fuerzas bióticas conducen a la diferenciación en comunidades adyacentes); y βRC ≈ -1: Similitudobservada > Similitudesperada señala que los filtros ambientales determinísticos compartidos generan mayor similitud entre los sitios, como resultados de los factores abióticos.
RESULTADOS
Diversidad y composición de especies/morfoespecies de arañas epigeas
Se recolectaron 1109 arañas epigeas, incluyendo adultos e inmaduros, de los cuales 643 (591 adultos) pudieron ser asignados a 75 especies/morfoespecies de 16 familias (Tabla 1). El número de individuos recolectado en cada ambiente fue similar (Tabla 2), mientras que el análisis de rarefacción-extrapolación evidenció mayor número de especies en la SP (Riqueza de especies extrapolada (RE) = 48,21, IC: 42,31-54,11) en comparación con la SM (RE = 31, IC: 26,59-35,41) y BM (RE = 33,74, IC: 27,59-39,89), siendo más diversa la comunidad de la SP (considerando 1D), con respecto a los otros ambientes de las Yungas, en el orden del 1,67 y 1,71 veces, respectivamente (Tabla 2). Los inventarios de los tres pisos vegetacionales fueron muy buenos pues alcanzaron valores de completitud superiores al 75 % con SM (83 %) como el más alto (Tabla 2).
Tabla 1: Lista de especies/morfoespecies y abundancia de arañas epigeas de la Selva Pedemontana, Selva Montana y Bosque Montano de las Yungas de la provincia de Salta, Argentina. Abreviatura: TSE = tejedoras de telas sensibles, ESP = especialistas, CEM = cazadoras por emboscada, TES = tejedoras espaciales, OCA = otras cazadoras y CSU = cazadoras de suelo. Torres et al.
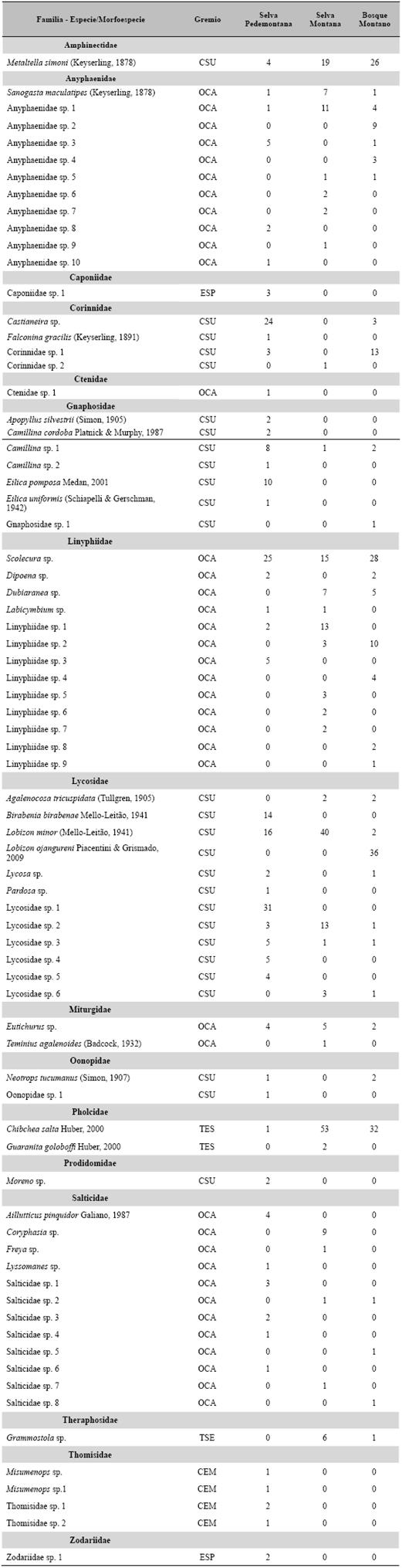
Tabla 2: Riqueza de especies de arañas epigeas, abundancia, número de familias, singletones y dobletones, riqueza de especies estimadas por Chao1, completitud del inventario e exponencial del índice de Shannon (1D) por sitio muestreado y total en la Selva Pedemontana (SP), Selva Montana (SM) y Bosque Montano (BM) de las Yungas de la provincia de Salta, Argentina.

Sólo el 13 % del total de las especies (diez especies) fueron comunes a los tres ambientes de Yungas. Por su lado, la SP reportó el mayor número de especies exclusivas (61 % del total registradas), seguido por la SM (39 %) y el BM (28 %). Así, el índice de Bray-Curtis reportó una alta diferencia del ensamble de la SP con respecto a la SM (77 %) y el BM (75 %), mientras que entre estos dos últimos ambientes la diferencia fue menor (57 %). Estos resultados fueron corroborados mediante el MRPP (ASP-SM = 0,08; p < 0,01, ASP-BM = 0,08; p < 0,01, ASM-BM = 0,03; p < 0,01). Cada ambiente mostró diferentes especies dominantes, así una especie de licósido (Lycosidae sp 1) y de corínnido (Castianeira sp) lo fueron para SP con un 14,49 % y 11,21 %, respectivamente de la abundancia registrada, siendo la primera exclusiva para este ambiente. Lobizon ojangureni (Lycosidae) fue dominante y sólo registrada en BM con una abundancia del 18 %, seguida por Chibchea salta (Pholcidae) (16 %); mientras que esta última fue la especie dominante en la Selva Montana (23,14 %).
El Análisis de Componentes Principales evidenció tres agrupamientos de sitios correspondientes a los pisos altitudinales de vegetación de la Yungas, con una varianza total explicada del 70,95% (Eje 1 = 42,69%, p = 0,021 y Eje 2 = 28,29% p = 0,031). Así, los ensambles nativos de SM y BM se diferencian de los de SP sobre el primer eje, mientras que aquellos lo hacen sobre el segundo eje. Dos especies dominantes, Lycosidae sp. 1 (r = -0,60) y Castianeira sp. (Corinnidae) (r = -0,34) estuvieron correlacionadas negativamente con el primer componente, mostrando preferencias hacia los ambientes de la SP (Fig. 2). Chibchea salta (Pholcidae) fue dominante en los ensambles de la SM (r = 0,53), mientras que las dos especies del género Lobizon (Lycosidae) evidenciaron una respuesta opuestas en sus preferencias ambientales. Así, Lobizon ojangureni (Lycosidae) (r = 0,56) resultó exclusiva de los ambientes del BM, en cambio Lobizon minor (r = -0,54) estuvo más asociada con las selvas altitudinalmente más bajas de la zonación de Yungas. Por último, Scolecura sp (Linyphiidae) (r = 0,48) y Metaltella simoni (Amphinectidae) (r = 0,25) no mostraron preferencia exclusiva hacia algún tipo de vegetación de las Yungas, en particular la primera de las especies.
Figura 2: Proyección de los lugares de muestreo en el Análisis de Componentes Principales de las comunidades de arañas epigeas en los sitios muestreados de la Selva Pedemontana (SP), Selva Montana (SM) y Bosque Montano (BM) de las Yungas de la provincia de Salta, Argentina. Se grafican las especies con mayor inercia sobre los dos primeros ejes.
Diversidad y composición de gremios de arañas
Se registraron seis gremios de arañas de suelo de las Yungas salteñas, cinco de ellos en la SP, donde las cazadoras por emboscada y las especialistas resultaron exclusivas. En la SM y el BM se registraron cuatro gremios, donde las tejedoras de telas sensibles fueron comunes sólo a estos ambientes (Fig. 3). Por su lado, los gremios de las tejedoras espaciales, otras cazadoras y las cazadoras de suelo representaron más del 95 % de la abundancia en cada comunidad considerada. Estos gremios mostraron patrones semejantes de abundancia en la SM y en el BM (Fig. 3). De esa manera, las tejedoras espaciales (Pholcidae) mostraron una riqueza de especies y una abundancia similar en la SM y en el BM, superando significativamente lo reportado para la SP (Tabla 3). En cambio, el gremio otras cazadoras no mostró diferencias de significación estadísticas, en aquellos parámetros, entre los tres pisos vegetacionales (Tabla 3). Por último, el gremio cazadoras de suelo registró mayor abundancia y riqueza de especies en la SP, superando a la SM y al BM (Tabla 3, Fig. 3). La similitud entre los ensambles de todos los sitios estudiados estuvo parcialmente correlacionada con su distancia geográfica (Test de Mantel; R = 0,50, p = 0,02), donde, los valores de PRC indican que los factores principalmente estocásticos (como la dispersión) y bióticos, estarían estructurando las comunidades de arañas en el área de estudio (Tabla 4). Este patrón se repite en los sitios analizados por separado de la SM y el BM, aunque la distancia geográfica (Test de Mantel; RSM = 0,29, p = 0,24; RBM = 0,22, p = 0,65) no parece influir en la estructuración de sus ensambles. En cambio, en los sitios de la SP (Test de Mantel: R = 0,98, p = 0,16) los factores abióticos serían las principales fuerzas que estarían estructurando sus comunidades (Tabla 4).
Figura 3: Proporción de gremios de arañas epigeas en la Selva Pedemontana, Selva Montana y Bosque Montano de las Yungas de la provincia de Salta, Argentina. (TSE = tejedoras de telas sensibles, ESP = especialistas, CEM = cazadoras por emboscada, TES = tejedoras espaciales, OCA = otras cazadoras y CSU = cazadoras de suelo).
Tabla 3: Análisis Multivariado de la Varianza (MANOVA) de la riqueza de especies y abundancia por trampa ± error estándar y de los gremios tejedoras espaciales (TES), otras cazadoras (OCA) y cazadoras de suelo (CSU) en la Selva Pedemontana (SP), Selva Montana (SM) y Bosque Montano (BM) de las Yungas de la provincia de Salta, Argentina.

Tabla 4: Valores de similitud de Raup-Crick (por debajo de la diagonal) y modificados según Chase et al. (2011) (por arriba de la diagonal) de los ensambles de arañas entre pares de sitios de la Selva Pedemontana (SP), Selva Montana (SM) y Bosque Montano (BM) de las Yungas de la provincia de Salta, Argentina.

Cuadros grises = βRC ≈ 0: Similitudobservada≈ Similitudesperada, los eventos estocásticos estructuran las comunidades, elevada dispersión entre los sitios. Cuadros blancos = βRC ≈ 1: Similitudobservada<Similitudesperada, las diferencias en filtros ambientales determinísticos entre sitios motivan la disimilitud en la composición de especies, por lo que fuerzas bióticas conducen a la diferenciación en comunidades adyacentes. Cuadros negros= βRC ≈ −1: Similitudobservada>Similitudesperada los filtros ambientales determinísticos compartidos generan mayor similitud entre los sitios como resultados de factores abióticos.
DISCUSIÓN
En este trabajo, el primero en estudiar la diversidad y composición de la araneofauna epigea en las Yungas del Norte argentino, se evidencia que cada tipo vegetacional de esta ecorregión posee comunidades con estructura particulares de arañas epigeas. Esto puede atribuirse a las diferencias en las características fisonómicas y florísticas que exhibe cada unidad de vegetación, lo que genera cambios en la heterogeneidad del hábitat (Pinzón et al. 2011), ya que la disponibilidad de luz, la composición y el volumen de hojarasca, la humedad y la temperatura del suelo son variables que influyen en la composición de la fauna epigea de arañas (Uetz 1976, Levings y Windsor 1984, Ziesche y Roth 2008). Mientras que por otro lado, también la altura y la composición del dosel influyen sobre las condiciones microclimáticas de los estratos bajos del bosque y la superficie del suelo (Mc Caughey et al. 1997, Lindh y Muir 2004). Eso explicaría que la SM y el BM exhiban un patrón similar en cuanto a la riqueza de especies y en la composición y abundancia de sus gremios, relacionado con sus similitudes vegetacionales (mayor heterogeneidad) y el casi nulo efecto antrópico sobre sus ambientes (del Castillo et al. 2005). Por su parte, la gran destrucción de la SP de las Yungas debido a la sobre-explotación de especies arbóreas (Brown y Malizia 2004) y el reemplazo de casi el 90 % de su superficie por cultivos (Volante et al. 2012) la convierte en un ecosistema altamente modificado (Gasparri et al. 2004) y fragmentado (Grau y Aide 2008). De esa manera, la diferencia marcada observada entre las comunidades de arañas de los otros pisos altitudinales de las Yungas con respecto a las de la SP podría explicarse por la presencia de un bosque más abierto donde la flora se halla empobrecida debido a la presión antrópica (Chebez 2005).
Así, el análisis de Raup-Crick muestra que la suma de diversos factores, entre ellos bióticos y estocásticos, están actuando de manera conjunta sobre la diversidad beta entre las comunidades de arañas epigeas en la SM y en el BM. Bell (2001) y Rodríguez-Artigas et al. (2016), han documentado que esos factores influyen sobre la diversidad beta dentro y entre comunidades nativas de arañas. Por otro lado, el mayor número de especies, familias y gremios de la SP, tan disímil con respecto a la SM y el BM, posiblemente está condicionado por factores abióticos relacionados con la matriz agrícola-urbana circundante. De esa manera, y teniendo en cuenta que la distancia geográfica no muestra ser un factor que esté estructurando las comunidades en los sitios de SP, los cambios en la configuración del paisaje debido al uso del suelo en la región explicarían la similitud de los ensambles locales. Ello es coincidente con otros estudios donde han detectado diferencias en la composición de la fauna epigea tanto en sistemas naturales como en paisajes agrícolas (Knapp y Řezáč 2015, Mazzia et al. 2015, Pedley et al. 2016), donde se demuestra una elevada riqueza de especies en sistemas altamente disturbados en relación a ambientes nativos (Herrmann et al. 2015).
Nuestros resultados muestran que muy pocas especies de arañas epigeas (13 spp.) tienen amplia distribución en los distintos pisos vegetacionales de las Yungas, determinando que los ensambles de la SM y BM comparten más especies de arañas epigeas entre sí, diferenciándose marcadamente de aquellos de la SP. Ello es coincidente con los resultados reportados por Rubio (2015) para los ensambles de arañas sobre el follaje en ambientes similares de las Yungas salteña. Las especies dominantes reportadas para la SP de las Yungas salteñas son comunes en otros ambientes de la provincia. Así, una especie de licósido (Lycosidae sp. 1) ha sido reportada también como una especie típica de ambientes del Chaco de Salta (Cruz et al. en prensa). Los ambientes del Chaco y de la SP en la región central de la provincia experimentan la mayor presión antrópica (Gasparri et al. 2004). La dominancia de aquella especie en ambientes antropizados podría explicarse porque esta familia de arañas tiene una muy buena capacidad de dispersión y de supervivencia en hábitats disturbados (Uetz 1976, Meriste et al. 2016). Ello podría no aplicarse a todos los licósidos, ya que las especies del género Lobizon registradas evidenciaron distintas afinidades ante los ambientes de Yungas. Así, L. minor que es una especie con una amplia distribución en distintos ambientes del Centro Norte del país (Piaccentini y Grismado 2009), está presente con una alta abundancia en la SP y SM pero no en los BM, es decir por encima de los 1500 m, donde su rol ecológico podría estar siendo reemplazado por otra especie (L. ojangureni) que pareciera ser típica de los bosques montanos como queda demostrado en nuestros resultados; estos datos son concordantes con las localidades de colecta reportadas por Piacentini y Grismado (2009).
La fragmentación de la SP producto del uso de suelo circundante a sus bosques nativos podría estar afectando negativamente sobre algunas especies de arañas, mientras que otras se beneficiarían encontrando en ellos las condiciones propicias para su sobrevivencia. Esto último podría ser el caso de Castianeira sp. (Corinnidae), registrada en baja proporción en los hábitats nativos del Chaco (Cruz et al. en prensa), como en la SM y BM, pero es una especie dominante en los sitios de la SP, aspecto que debería evaluarse en futuros estudios. En cambio, Chibchea salta (Pholcidae) abundante en la SM y el BM, se registró con muy baja abundancia en la SP. Si bien, C. salta se distribuye desde Colombia y Venezuela hasta las regiones del norte de Chile y Argentina (Huber 2014); es la única especie del género con registro en el norte de Argentina (World Spider Catalog 2017), y ha sido reportada como una especie característica de la ecorregión Yungas por Rubio y Acosta (2011). Esto estaría en concordancia con lo expresado por Huber (2014) que destaca que las especies de esta familia son vulnerables a la extinción por su sensibilidad a la fragmentación del hábitat, por lo que se requiere serias estrategias para su conservación.
El análisis de los gremios de arañas también pone en evidencia las diferencias observadas entre los tres pisos vegetacionales de las Yungas. Los gremios de las tejedoras de telas espaciales, de otras cazadoras y de las cazadoras de suelo muestran una proporción similar de individuos tanto en la SM como en el BM, en cambio sólo los dos últimos son abundantes en la SP, en particular las cazadoras de suelo. La mayor diferencia radica en este último gremio con un registro significativamente mayor en cuanto a la riqueza de especies y a la abundancia en la SP. Ello se debe principalmente a los integrantes de Corinnidae, Gnaphosidae y Lycosidae que representan un 60 % de especies exclusivas para este tipo vegetacional. Es probable que los campos cultivados sean una fuente importante para la fauna de arañas, las cuales se estarían moviendo desde el cultivo hacia los hábitats nativos con mayor productividad (Rand et al. 2006). Estos últimos contienen posiblemente mayor disponibilidad de presas (Pluess et al. 2008), donde las especies agrobiontes podrían estar mejor adaptadas.
Duelli (1997) postula que los remanentes de hábitat nativos u otros tipos de áreas seminaturales pueden funcionar como refugios, particularmente, para muchas poblaciones de arañas en aquellos períodos donde se ejercen prácticas de manejo agrícola (Sunderland y Samu 2000).
Concluyendo, las unidades de vegetación de las Yungas de la provincia de Salta presentan ensambles de arañas epigeas particulares, donde la SP que es la unidad más afectada por la fragmentación del hábitat debido al uso intensivo del suelo, presenta una composición de especies y gremios muy diferentes a la SM y el BM. Estos dos últimos pisos vegetacionales, poseen especies dominantes que pueden considerarse típicas o restringidas a ellos, lo que se contrapone a lo observado en la SP donde la especie dominante es común, también, en ambientes nativos del Chaco con un paisaje fuertemente antropizado. El incremento en el número de especies de arañas epigeas sumado a un gran porcentaje de especies exclusivas, especialmente cazadoras de suelo, en esta unidad vegetacional puede ser el resultado de factores abióticos que actúan sobre el paisaje disturbado y que estarían estructurando sus comunidades. Sin embargo, nuevos estudios que contemplen variables relacionadas con la cobertura y el uso del suelo, como así también microclimáticas, son necesarios para comprender mejor los factores directos que influyen en la estructuración de las comunidades de arañas epigeas en la región. Los resultados aquí presentados son un punto de partida para futuros estudios en el paisaje salteño que intenten evaluar y monitorear estos ambientes nativos donde el énfasis sea puesto en aquellas especies con distribución restringida o en aquellas afectadas por las actividades humanas.
PARTICIPACIÓN DE AUTORES
VMT identificó el material recolectado, analizó los datos y escribió el manuscrito. AXGR y JAC obtuvieron el apoyo financiero, diseñaron y ejecutaron el muestreo, contribuyeron al análisis de los datos, revisaron los borradores del manuscrito y realizaron las correcciones de los revisores.
AGRADECIMIENTOS
Este trabajo fue financiado por el Consejo de Investigación de la Universidad Nacional de Salta, el Instituto para el Estudio de la Biodiversidad de Invertebrados y el Consejo Nacional de Investigaciones Científicas y Técnicas. Por último, agradecemos a Romina Resuche por su colaboración en el procesamiento de las muestras.
LITERATURA CITADA
Referencias
Almada MS, Sarquis JA. 2016. Araneofauna (Arachnida: Araneae) de suelo en bosques nativos, exóticos y pajonales del Parque General San Martín, Entre Ríos Argentina. Ecol. Austral. 26(3):286–292.
Barriga JC, Lassaletta L, Moreno AG. 2010. Ground-living spider assemblages from Mediterranean habitats under different management conditions. J. Arachnol. 38(2):258–269.
Bell G. 2001. Neutral macroecology. Science 293:2413–2418. doi: 10.1126/science.293.5539.2413.
Bertonatti C, Corcuera J. 2000. Situación Ambiental Argentina 2000. Buenos Aires: Fundación Vida Silvestre.
Blitzer EJ, Dormann CF, Holzschuh A, Klein AM, Rand TA, Tscharntke T. 2012. Spillover of functionally important organisms between managed and natural habitats. Agr. Ecosyst. Environ. 146:34–43. doi:10.1016/j.agee.2011.09.005.
Brown AD, Malizia LR. 2004. Las selvas pedemontanas de las Yungas. Ciencia Hoy 14(83):53–63.
Brown AD, Martínez-Ortíz U, Acerbi M, Corcuera J. 2006. La situación ambiental argentina 2005. Buenos Aires: Fundación Vida Silvestre.
Buchholz S. 2010. Ground spider assemblages as indicators for habitat structure in inland sand ecosystems. Biodivers. Conserv. 19:2565–2595. doi:10.1007/s10531-010-9860-7.
Cardoso P, Pekár S, Jocqué R, Coddington JA. 2011. Global Patterns of Guild Composition and Functional Diversity of Spiders. PLoS ONE 6(6):e21710. doi:10.1371/journal.pone.0021710.
Castanheira P, Pérez-González A, Baptista RL. 2016. Spider diversity (Arachnida: Araneae) in Atlantic Forest areas at Pedra Branca State Park, Rio de Janeiro, Brazil. Biodiver. Data J.
:e7055. doi:10.3897/BDJ.4.e7055.
Chao A, Jost L. 2012. Coverage-based rarefaction and extrapolation: standardizing samples by completeness rather than size. Ecology 93(12):2533–2547. doi:10.1890/11-1952.1.
Chao A, Shen TJ. c2012. User’s Guide for Program SPADE (Species Prediction and Diversity Estimation). [Revisada en: feb 2017]. http:// chao.stat.nthu.edu.tw/
Chao A, Ma KH, Hsieh TC. c2016. iNEXT (iNterpolation and EXTrapolation) Online: Software for Interpolation and Extrapolation of Species Diversity. Program and User’s Guide [Revisada en: feb 2017]. http://chao.stat.nthu.edu.tw/wordpress/software_download/
Chase JM, Kraft NJB, Smith KG, Vallend M, Inouye BD. 2011. Using null models to disentangle variation in community dissimilarity from variation in α-diversity. Ecosphere 2(2):art24. doi:10.1890/ES10-00117.1.
Chebez JC. 2005. Guía de las reservas naturales de la Argentina: Noroeste. Buenos Aires: Albatros.
Churchill TB, Arthur JM. 1999. Measuring spider richness: effects of different sampling methods and spatial and temporal scales. J. Insect Conserv. 3(4):287–295. doi:10.1023/A:1009638706789.
Colwell RK. c2013. EstimateS: Statistical estimation of species richness and shared species from samples. Version 9.1. [Revisada en: 5 Ene 2017]. http://viceroy.eeb.uconn.edu/estimates/
Cruz IG, Torres VM, González-Reyes AX, Corronca JA. en prensa. Eficiencia en el uso de trampas de caída y suficiencia taxonómica en comunidades de arañas (Araneae) epigeas en tres ecorregiones del Noroeste Argentino. Rev. Biol. Trop.
del Castillo EM, Zapater MA, Gil MN, Tarnowski CG. 2005. Selva de Yungas del noroeste argentino (Jujuy, Salta, Tucumán). Recuperación ambiental y productiva lineamientos silvícolas y económicos para un desarrollo forestal sustentable. Jujuy, Argentina: Editorial INTA-EE de cultivos tropicales Yuto.
Duelli P. 1997. Biodiversity evaluation in agricultural landscapes: an approach at two different scales. Agr. Ecosyst. Environ. 62:81–91.
Escorcia RY, Martínez NJ, Silva JP. 2012. Study of spiders’ diversity in a tropical dry forest (bst) in sabanalarga, Atlántico, Colombia. Bol. Cient. Mus. Hist. Nat. 16(1):247–260.
Fischer J, Lindenmayer DB. 2007. Landscape modification and habitat fragmentation: a synthesis. Global Ecol. Biogeogr. 16(3):265–280. doi:10.1111/j.1466-8238.2007.00287.x.
Flórez E. 1998. Estructura de comunidades de arañas (Araneae) en el departamento del Valle, suroccidente de Colombia. Caldasia 20(2):173–192.
Gasparri I, Manghi E, Montenegro C, Strada M, Parmuchi M G, Bono J. 2004. Mapa Forestal de la Provincia de Salta. Actualización año 2002. Salta, Argentina: Secretaria de Ambiente y
Desarrollo Sustentable.
Grau HR, Aide M. 2008. Globalization and landuse transitions in Latin America. Ecol. Soc.
(2):16.
Grismado CJ, Ramírez MJ, Izquierdo MA. 2014. Araneae: Taxonomía, diversidad y clave de identificación de familias de la Argentina. En: Roig-Juñent S, Claps LE, Morrone JJ, editores. Biodiversidad de Artrópodos Argentinos Vol. 3. Tucumán, Argentina: Editorial INSUE-Universidad Nacional de Tucumán. p. 55–94.
Hammer Ø, Harper DAT, Ryan PD. 2001. PAST: Paleontological statistics software package for education and data analysis. Paleontologia Electronica 4(1):9.
Herrmann JD, Opatovsky I, Lubin Y, Pluess T, Gavish-Regev E, Entling MH. 2015. Effects of non-native Eucalyptus plantations on epigeal spider communities in the northern Negev desert, Israel. J. Arachnol. 43(1):101–106. doi: 10.1636/P14-46.1.
Hsieh YL, Lin YS, Tso IM. 2003. Ground spider diversity in the Kenting uplifted coral reef forest, Taiwan: a comparison between habitats receiving various disturbances. Biodivers. Conserv. 12:2173–2194. doi:10.1023/A:1024591311548.
Huber BA. 2014. Pholcidae. En: Roig-Juñent S, Claps LE, Morrone JJ, editores. Biodiversidad de Artrópodos Argentinos Vol. 3. Tucumán, Argentina: Editorial INSUE-Universidad Nacional de Tucumán. p. 131–140.
Jiménez-Valverde A, Lobo JM. 2007. Determinants of local spider (Araneidae and Thomisidae) species richness on a regional scale: climate and altitude vs. habitat structure. Ecol. Entomol. 32:113–122. doi:10.1111/j.1365-2311.2006.00848.x.
Knapp M, Řezáč M. 2015. Even the smallest non-crop habitat islands could be beneficial: distribution of carabid beetles and spiders in agricultural landscape. PLoS ONE 10(4):e0123052. doi:10.1371/journal.pone.0123052.
Legendre P, Gallagher ED. 2001. Ecologically meaningful transformations for ordination of species data. Oecologia 129:271–280. doi:10.1007/s004420100716.
Levings SC, Windsor DM. 1984. Litter moisture content as a determinant of litter arthropod distribution and abundance during the dry season on Barro Colorado Island, Panama. Biotropica 16(2):125–131.
Lindh BC, Muir PS. 2004. Understory vegetation in young Douglas-fir forests: does thinning Ecol. Manag. 192:285–296. doi:10.1016/j.foreco.2004.01.018.
Mazzia C, Pasquet A, Caro G, Thénard J, Cornic JF, Hedde M, Capowiez Y. 2015. The impact of management strategies in apple orchards on the structural and functional diversity of epigeal spiders. Ecotoxicology 24(3):616–625. doi: 10.1007/s10646-014-1409-1.
Mc Caughey JH, Amiro BD, Robertson AW, Spittlehouse DL. 1997. Forest environments. En: Bailey WG, Oke TR, Rouse WR, editors. The Surface Climates of Canada. Montreal: McGill Queen’s University Press. p. 247–276.
McCune B, Mefford MJ. 2011. PC-ORD. Multivariate Analysis of Ecological Data. Version 6.0. Oregon: MjM Software Gleneden Beach.
Meriste M, Helm A, Ivask M. 2016. Ground-Dwelling Spider Fauna of Flooded Meadows in Matsalu, Estonia. Wetlands 36(3):525–537. doi:10.1007/s13157-016-0762-7.
Niemelä J, Haila Y, Punttila P. 1996. The importance of small-scale heterogeneity in boreal forests: variation in diversity in forest-floorinverte-brates across the succession gradient. Ecography 19:352–368. doi:10.1111/j.1600-0587.1996.tb01264.x.
Pedley SM, Oxbrough A, Martin RD, Irwin S, Kelly TC, O’Halloran J. 2016. Can groundbased assessments of forest biodiversity reflect the biological condition of canopy assemblages?. Forest Ecol. Manag. 359:190–198. doi: 10.1016/j.foreco.2015.10.006.
Peres-Neto PR, Jackson DA, Somers KM. 2005. How many principal components? Stopping rules for determining the number of non-trivial axes revisited. Comput. Stat. Data An. 49:974–997. doi:10.1016/j.csda.2004.06.015.
Perner J, Malt S. 2003. Assessment of changing agricultural land use: response of vegetation, ground-dwelling spiders and beetles to the conversion of arable land into grassland. Agr. Ecosyst. Environ. 98:169–181. doi:10.1016/S0167-8809(03)00079-3.
Piacentini LN, Grismado CJ. 2009. Lobizon and Navira, two new genera of wolf spiders from Argentina (Araneae: Lycosidae). Zootaxa 2195:1–33.
Pinzón J, Spence JR, Langor DW. 2011. Spider assemblages in the overstory, understory, and ground layers of managed stands in the western boreal mixedwood forest of Canada. Environ.
Entomol. 40(4):797–808. doi:10.1603/EN11081.
Pluess T, Opatovsky I, Gavish-Regev E, Lubin Y, Schmidt MH. 2008. Spiders in wheat fields and semi-desert in the Negev (Israel). J. Arachnol. 36:368–373. doi:10.1636/CT07-116.1.
Prado D. 1995. Selva Pedemontana: contexto regional y lista florística de un ecosistema en peligro. En: Brown AD, Grau HR, editores. Investigación, conservación y desarrollo en Argentina: Laboratorio de Investigaciones Ecológicas de las Yungas. p. 19–52.
R Core Team. c2014. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. [Revisada en: 15 Ene 2017]. http://www.R-project.org/.
Rand TA, Tylianakis JM, Tscharntke T. 2006. Spillover edge effects: the dispersal of agriculturally subsidized insect natural enemies into adjacent natural habitats. Ecol. Lett. 9:603–614. doi:10.1111/j.1461-0248.2006.00911.x.
Raup DM, Crick RE. 1979. Measurement of faunal similarity in paleontology. J. Paleontol. 53: 1213–1227.
Rodríguez AF, Silva M. 2012. Ecorregión de las selvas de Yungas. En: Morello J, Matteucci SD, Rodríguez AF, Silva ME, editores. Ecorregiones y Complejos Ecosistémicos Argentinos. Buenos Aires: Orientación gráfica Editora. p. 129–148.
Rodriguez-Artigas SM, Ballester R, Corronca JA. 2016. Factors that influence the beta-diversity of spider communities in northwestern Argentinean Grasslands. PeerJ. 4:e1946. doi:10.7717/peerj.1946.
Rubio GD. 2015. Diversidad de arañas (Araneae, Araneomorphae) en la selva de montaña: un caso de estudio en las Yungas Argentinas. Graellsia 71(2):e029. doi:10.3989/graellsia.2015.v71.134 .
Rubio GD, Acosta LE. 2011. Geographical distribution of the space-weaving spider, Chibchea salta, from northwestern Argentina: New records and bioclimatic modeling. J. Insect Sci. 11:54.
Rubio GD, Moreno CE. 2010. Orb-weaving spider diversity in the Iberá Marshlands, Argentina. Neotrop. Entomol. 39(4):496–505.
Samways MJ, Mcgeoch MA, New TR. 2010. Insect Conservation. A Handbook of Approaches and Methods. Oxford: Oxford
University Press.
Schuldt A, Bruelheide H, Durka W, Michalski SG, Purschke O, Assmann T. 2014. Tree diversity promotes functional dissimilarity and maintains functional richness despite species loss in predator assemblages. Oecologia 174(2):533–543. doi:10.1007/s00442-013-2790-9.
Scott AG, Oxford GS, Selden PA. 2006. Epigeic spiders as ecological indicators of conservation value for peat bogs. Biol. Conserv. 127:420–428. doi: 10.1016/j.biocon.2005.09.001.
Sunderland K, Samu F. 2000. Effects of agricultural diversification on the abundance, distribution, and pest control potential of spiders: a review. Entomol. Exp. Appl. 95:1–13. doi:10.1023/A:1003986225443.
Torres VM, Pardo PL, González-Reyes AX, Rodriguez-Artigas SM, Corronca JA. 2015. New records of seven species of pholcid spiders (Araneae, Pholcidae) from the northern Argentina. Check List 11(3):1629. doi:10.15560/11.3.1629.
Torres VM. 2017. Efectos del uso del suelo sobre las comunidades de arañas epigeas en la Región central de la provincia de Salta. [Tesis Doctoral] [Salta]: Universidad Nacional de Salta.
Ubick D, Paquin P, Cushing PE, Roth V. 2005. Spiders of North America: an identification manual. Stockton, California: American Arachnological Society.
Uetz GW. 1976. Gradient analysis of spider communities in a streamside forest. Oecologia 22(4):373–385. doi: 10.1007/BF00345314.
Uetz GW. 1991. Habitat structure and spider foraging. En: Bell SS, McCoy ED, Mushinsky HR, editors. Habitat Structure: The Physical Arrangement of Objects in Space. London: Chapman & Hall. p. 325–348.
Volante JN, Alcaraz-Segura D, Mosciaro MJ, Viglizzo EF, Paruelo JM. 2012. Ecosystem functional changes associated with land clearing in NW Argentina. Agr. Ecosyst. Environ. 154:12–22. doi:10.1016/j.agee.2011.08.012.
World Spider Catalog. c2017. World Spider Catalog, Version 18. Natural History Museum Bern. [Revisada en: 22 Feb 2017]. http://wsc.nmbe.ch
Ziesche TM, Roth M. 2008. Influence of environmental parameters on small-scale distribution of soil-dwelling spiders in forests: What makes the difference, tree species or microhabitat?. Forest Ecol. Manag. 255(3):738-752. doi:10.1016/j.foreco.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Gabriela García Martínez, Claudia Teutli Hernández, Jorge Herrera Silveira, Johnny Omar Valdéz Iuit, Daniel Arceo Carranza. (2024). Estructura y función de la comunidad de artrópodos terrestres en una zona de manglar en proceso de restauración en la costa norte de Yucatán. BIOCYT Biología Ciencia y Tecnología, 17, p.1236. https://doi.org/10.22201/fesi.20072082e.2024.17.87110.
2. Dariana R. Guerrero-Fuentes, Marco Antonio Desales-Lara. (2021). Arañas edáficas del clado RTA (Arachnida: Araneae) del sur de Tonatico, Estado de México, México. ACTA ZOOLÓGICA MEXICANA (N.S.), , p.1. https://doi.org/10.21829/azm.2021.3712306.
3. Wilder Zapata, David Vergara-Moreno, Martín Carrillo-Pallares, Alejandro Segovia-Paccini, Gabriel R. Navas S., Jagoba Malumbres-Olarte. (2023). Seasonal diversity of spider assemblages (Araneae: Arachnida) in the “Guillermo Piñeres” Botanical Garden, Turbaco–Colombia. Neotropical Biodiversity, 9(1), p.17. https://doi.org/10.1080/23766808.2022.2157948.
4. Andrés Moreira-Muñoz, María Virginia Palchetti, Vanezza Morales-Fierro, Valeria Soledad Duval, Rudy Allesch-Villalobos, Carlos E. González-Orozco. (2022). Diversity and Conservation Gap Analysis of the Solanaceae of Southern South America. Frontiers in Plant Science, 13 https://doi.org/10.3389/fpls.2022.854372.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2017 Caldasia

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cual estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).



























