Publicado
Plaguicidas organoclorados en murciélagos (Chiroptera) asociados al bosque húmedo tropical en Córdoba, Colombia
Organoclorated pesticides in bats (Chiroptera) associated with the tropical rainforest in Córdoba, Colombia
DOI:
https://doi.org/10.15446/caldasia.v43n2.84862Palabras clave:
Agroquímicos, contaminantes ambientales, quirópteros, salud de ecosistemas (es)Agrochemicals, Chiroptera, ecosystem health, environmental pollutants (en)
Descargas
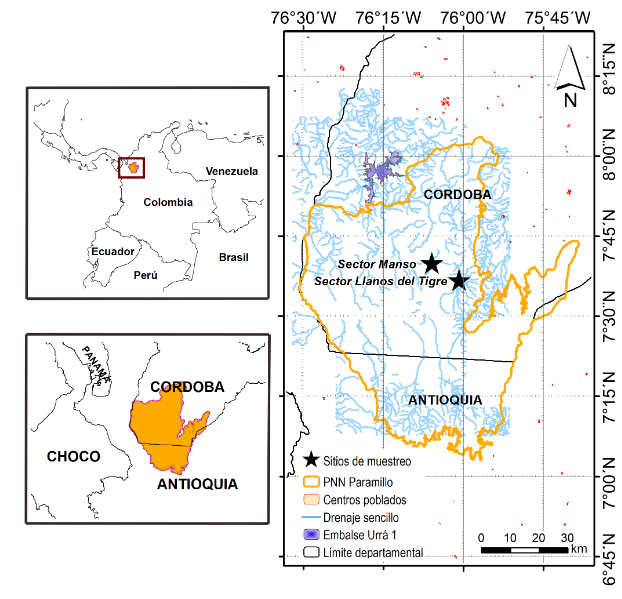
Investigaciones sobre toxicidad ambiental por pesticidas se han realizado principalmente en mamíferos terrestres, pero existe poca información sobre plaguicidas organoclorados en murciélagos. Teniendo en cuenta el papel funcional de este grupo en varios procesos ecosistémicos como insectívoros, frugívoros y polinizadores, su afectación puede estar causando un impacto negativo en la salud de los ecosistemas naturales. En Colombia, no hay estudios que documenten esta problemática; por tanto, el objetivo fue determinar la presencia de plaguicidas organoclorados en el ensamblaje de murciélagos del bosque húmedo tropical (bh-T) en Córdoba, Colombia. Se evaluó la presencia de organoclorados en hígado y músculo de murciélagos del sector Manso-Tigre, un área protegida con ocupación campesina. La concentración de plaguicidas organoclorados como Aldrin, Dieldrin, Endrin, Heptacloro epóxido, α-BCH, βBCH, γ-BCH, 2,4-DDD, 2,4-DDT, 4,4-DDE y 4,4-DDT, se determinó por cromatografía de gases. Niveles de organoclorados en hígado y músculo presentaron diferencias significativas (P<0,05). Se detectó mayor contenido de organoclorados en hígado en las especies Trachops cirrhosus (α–BCH, γ-BCH, Endrin, pp-DDE), Desmodus rotundus (β-BCH), Micronycteris microtis (Aldrin), Platyrrhinus helleri (Heptacloro) y Phyllostomus hastatus (pp-DDT). En tejido muscular, la concentración de organoclorados fue mayor en Trachops cirrhosus (α-BCH, γ-BCH, Endrin, pp-DDE), Artibeus planirostris (β-BCH), Micronycteris microtis (Aldrin, Heptacloro) y Phyllostomus hastatus (pp-DDT). La contaminación por organoclorados en murciélagos posiblemente está relacionada con el uso de agroquímicos, insecticidas y compuestos fosfatados para uso agrícola. Los resultados permiten reconocer a los murciélagos como bioindicadores de contaminación ambiental al indicar procesos de cambios o disturbios en los hábitats.
Researches on environmental toxicity due to the use of pesticides have been carried out mainly in terrestrial mammals but there is little information related to organochlorine in bats, that taking into account the functional role of these animals as insectivores, frugivorous, and pollinators, it may probably be causing a negative impact on the health of natural ecosystems. In Colombia, there are no studies that document this problem. The objective was to determine the presence of organochlorine pesticides in the bat assembly of tropical rainforest in Córdoba, Colombia. The presence of organochlorine pesticides in liver and bat muscle of the Manso-Tigre sector, an area of bh-T with peasant occupation, was evaluated. The concentration of organochlorine pesticides such as Aldrin, Dieldrin, Endrin, Heptachlor epoxide, α-BCH, βBCH, γ-BCH, 2,4-DDD, 2,4-DDT, 4,4-DDE and 4,4-DDT, was determined by gas chromatography. Organochlorine levels in liver and muscle, presented significant statistical differences (P <0.05). Higher organochlorine content in the liver was detected in the species Trachops cirrhosus (α-BCH, γ-BCH, Endrin, pp-DDE), Desmodus rotundus (β-BCH), Micronycteris microtis (Aldrin), Platyrrhinus helleri (Heptachlor) and Phyllostomus hastatus (pp-DDT); and in muscle tissue were Trachops cirrhosus (α-BCH, γ-BCH, Endrin, pp-DDE), Artibeus planirostris (β-BCH), Micronycteris microtis (Aldrin, Heptachlor) and Phyllostomus hastatus (pp-DDT). Organochlorine contamination in bats is possibly related to the use of agrochemicals, insecticides, and phosphate compounds for agricultural use. The results allow us to recognize the importance of bats as a bioindicator of environmental pollution by indicating processes of changes or disturbances in habitats.
Referencias
Alleva E, Francia N, Pandolfi M, De Marinis AM, Chiarotti F, Santucci D. 2006. Organochlorine and heavy-metal contaminants in wild mammals and birds of Urbino-Pesaro Province, Italy: an analytic overview for potential bioindicators. Arch. Environ. Con. Tox. 51(1):123-134. doi: https://doi.org/10.1007/s00244-005-0218-1
Allinson G, Mispagel C, Kajiwara N, Anan Y, Hashimoto J, Laurenson L, Allinson M, Tanabe S. 2006. Organochlorine and trace metal residues in adult southern bent-wing bat (Miniopterus schreibersii bassanii) in southeastern Australia. Chemosphere. 64(9):1464-1471. doi: https://doi.org/10.1016/j.chemosphere.2005.12.067
Bajaj S, Singh DK. 2015. Biodegradation of persistent organic pollutants in soil, water and pristine sites by cold-adapted microorganisms: Mini review. Int. Biodet. & Biodeg. 100: 98–105.
Barhoumi S, Messaoudi I, Gagné F, Kerkeni A. 2012. Spatial and seasonal variability of some biomarkers in Salaria basilisca (Pisces: Blennidae): Implication for bioimonitoring in Tunisian coasts. Ecol. Indic. 14(1):222-228. doi: https://doi.org/10.1016/j.ecolind.2011.06.025
Bayat S, Geiser F, Kristiansen P, Wilson SC. 2014. Organic contaminants in bats: trends and new issues. Environ. Int. 63(1):40-52. doi: https://doi.org/10.1016/j.envint.2013.10.009
Bennett BS, Thies ML. 2007. Organochlorine pesticide residues in guano of Brazilian free tailed bats, Tadarida brasiliensis Saint-Hilaire, from East Texas. Bull. Environ. Contam. Toxicol. 78(1):191-194. doi: https://doi.org/10.1007/s00128-007-9089-7
Buchweitz JP, Carrson K, Rebolloso S, Lehner A. 2018. DDT poisoning of big brown bats, Eptesicus fuscus, in Hamilton, Montana. Chemosphere. 201: 1-5. doi: https://doi.org/10.1016/j.chemosphere.2018.02.152
Castro-Luna A, Sosa VJ, Castillo-Campos G. 2007. Quantifying phyllostomid bats at different taxonomic levels as ecological indicators in a disturbed tropical forest. Acta Chiropterol. 9(1):219-228. doi: https://doi.org/10.3161/1733-5329(2007)9[219:QPBADT]2.0.CO;2
Clark DR Jr. 2001. DDT and the decline of free-tailed bats (Tadarida brasiliensis) at Carlsbad Cavern, New Mexico. Arch. Environ. Contam. Toxicol. 40(1):537-543. doi: https://doi.org/10.1007/s002440010207
Clark Jr DR, Moreno-Valdez A, Mora MA. 1995. Organochlorine residues in bat guano from nine Mexican caves, 1991. Ecotoxicology. 4: 258–265. doi: https://doi.org/10.1007/BF00116344
Clark DR Jr, Krynitsky AJ. 1983. DDT: Recent contamination in New Mexico and Arizona? Environment. 25(1):27-31. doi: https://doi.org/10.1080/00139157.1983.9929859
Clark DR Jr, Shore RF. 2001. Chiroptera. En: Shore RF, Rattner BA, editores. Ecotoxicology of Wild Mammals. Chichester: John Wiley & Sons. p. 159-214.
Clawson RL, Clark DR Jr. 1989. Pesticide contamination of endangered gray bats and their food base in Boone County, Missouri 1982. B. Environ. Contam. Tox. 42(1):431-437. doi: https://doi.org/10.1007/BF01699972
Clawson RL. 1991. Pesticide contamination of endangered gray bats and their prey in Boone, Franklin and Camden Counties, Missouri. Trans. Mo. Acad. Sci. 25(1):13-19.
Cobos VM, Mora MA, Escalona G. 2006. Inhibición de colinesterasa plasmática en el zorzal pardo (Turdus grayi) expuesto al diazinón en cultivos de papaya maradol en Yucatán, México. Rev. Toxicol. 23(1):17-21.
Cobos Gasca VM, Barrientos Medina R, Novelo CC. 2011. Los plaguicidas y su impacto sobre la fauna silvestre de la Península de Yucatán. Bioagrociencias. 4(2):4-9
Díaz MM, Solari S, Aguirre LF, Aguiar LMS, Barquez RM. 2016. Clave de identificación de los murciélagos de Sur América (publicación). Argentina: PCMA (Programa de Conservación de los Murciélagos de Argentina.
Emmons LH. 1990. Neotropical Rainforest Mammals. Chicago: Chicago Press.
[FAO] Food and Agriculture Organization. 1996. Eliminación de Grandes cantidades de Plaguicidas en desuso en los Paises en desarrollo: Directrices Promisorias. Colección FAO: Eliminación de Plaguicidas 4. Roma Italia.
Fernández BR, Guerrero R, Lord R, Ochoa J, Ulloa G. 1988. Mamíferos de Venezuela: lista y claves para su identificación. Maracay: Museo del Instituto de Zoología Agrícola, Facultad de Agronomía, Universidad Central de Venezuela.
Fernández F, Burillo G, Rodríguez M, Alonso E, Ramos I, Hernández MJ. 1997. Intoxicaciones por productos agrícolas: anticolinesterásicos y Paraquat. Emergencias 9(4):18-22.
García-Besné G, Valdespino C, Rendón-von Osten J. 2015. Comparison of organochlorine pesticides and PCB residues among hawksbill (Eretmochelys imbricata) and green (Chelonia mydas) turtles in the Yucatan Peninsula and their maternal transfer. Mar. Pollut. Bull. 91, 139–148. doi: https://doi.org/10.1016/j.marpolbul.2014.12.015
Gardner AL, editor. 2008. Mammals of South America. Volume 1. Marsupials, Xenarthrans, Shrews, and Bats. Chicago: The University of Chicago Press.
Giannini NP, Kalko EKV. 2005. The guild structure of animalivorous leaf-nosed bats of Barro Colorado Island, Panama, revisited. Acta Chiropterol. 7(1): 131-146. doi: https://doi.org/10.3161/1733-5329(2005)7[131:TGSOAL]2.0.CO;2
Gonzalez-Jauregui M, Valdespino C, Salame-Méndez A, Aguirre-León G, Rendón-von Osten J. 2012. Persistent organic contaminants and steroid hormones levels in Morelet’s crocodiles from the Southern Gulf of Mexico. Arch. Environ. Cont. Tox. 62: 445–454. doi: https://doi.org/10.1007/s00244-011-9716-5
Goodwin GG, Greenhall AM. 1961. A Review of the Bats of Trinidad and Tobago: Descriptions, Rabies Infection and Ecology. B. Am. Mus. Nat. Hist. 122(3):187-302 doi: https://doi.org/10.2307/1377397
Guillén A, Ibáñez C, Pérez JL, Hernández LM, González M J, Fernández MA, Fernández R. 1994. Organochlorine residues in Spanish common pipistrelle bats (Pipistrellus pipistrellus). B. Environ. Contam. Tox. 52: 231–237. doi: https://doi.org/10.1007/BF00198493
Handley CO. 1988. Specimen preparation. En: Kunz TH, editor. Ecological and behavioral methods for the study of bats. Washington, DC: Smithsonian Institution Press. p. 437-457.
Hayes JP, Loeb SC. 2007. The influences of forest management on bats in North America. En: Lacki ML, Hayes JP, Kurta A, editores. Bats in forests: conservation and management. Baltimore: Johns Hopkins University Press. p. 207-235.
Hernández-Camacho J, Hurtado A, Ortiz R, Walschburger T. 1992. Unidades biogeográficas de Colombia. En: Halffter IG, editor. La Diversidad Biológica de Iberoamérica. México: Acta Zoológica Mexicana. p. 105-151.
Hernández LM, Ibáñez C, Fernández MA, Guillén A, González MJ, Pérez JL. 1993. Organochlorine insecticide and PCB residues in two bat species from four localities in Spain. Bull. Environ. Contam. Toxicol. 50:871–877. doi: https://doi.org/10.1007/BF00209952
Hill JE, Smith SE. 1988. Bats: a community perspective. Cambridge: Cambridge University Press.
Jones G, Jacobs DS, Kunz TH, Willig MR, Racey PA. 2009. Carpe noctem: the importance of bats as bioindicators. Endanger. Species Res. 8(1):93-115. doi: https://doi.org/10.3354/esr00182
Kalcounis-Rueppell MC, Payne VH, Huff SR, Boyko AL. 2007. Effects of wastewater treatment plant effluent on bat foraging activity in an urban stream system. Biol. Conserv. 138(1-2):120-130. doi: https://doi.org/10.1016/j.biocon.2007.04.009
Kannan K, Hun Yun S, Rudd RJ, Behr M. 2010. High concentrations of persistent organic pollutants including PCBs, DDT, PBDEs and PFOS in little brown bats with white-nose syndrome in New York, USA. Chemosphere. 80, 613–618. doi: https://doi.org/10.1016/j.chemosphere.2010.04.060
LaVal RK, Rodríguez B. 2002. Murciélagos de Costa Rica. Costa Rica: Instituto Nacional de Biodiversidad, Editorial INBio.
Laird BD, Goncharov AB, Man Chan H. 2013. Body burden of metals and persistent organic pollutants among Inuit in the Canadian Arctic. Environ. Int. 59:33-40.
Linares O, editor. 2000. Mamíferos de Venezuela. Caracas: Sociedad Conservacionista Audubon de Venezuela. Murciélagos.
Le DQ, Nguyen DC, Harino H, Kakutani N, Chino N, Arai T. 2010. Distribution of trace metals and methylmercury in soft tissues of the freshwater Eel Anguilla marmorata in Vietnam. Arch. Environ. Con. Tox. 59(2):282-290. doi: https://doi.org/10.1007/s00244-010-9479-4
Luckens MM, Davis WH. 1964. Bats Sensitivity to DDT. Science 146(3646):448. doi: https://doi.org/10.1126/science.146.3646.948
Marrugo-Negrete JL, Benítez LN, Olivero-Verbel J. 2008. Distribution of mercury in several environmental compartments in an aquatic ecosystem impacted by gold mining in northern Colombia. Arch. Environ. Con. Tox. 55(2):305-316. doi: https://doi.org/10.1007/s00244-007-9129-7
Marrugo-Negreta JL, Navarro-Frómeta AE, Urango-Cardenas ID. 2014. Organochlorine Pesticides in Soils from the Middle and Lower Sinú River Basin (Córdoba, Colombia). Water Air Soil Pollut. 225:2053. doi: https://doi.org/10.1007/s11270-014-2053-3
Matthiessen P. 2000. Is Endocrine Disruption a Significant Ecological Issue? Ecotoxicology. 9: 21-24. doi: https://doi.org/10.1023/A:1008907926684
Medellín RA, Equihua M, Amin MA. 2000. Bat diversity and abundance as indicators of disturbance in Neotropical rainforests. Conserv. Biol. 14(6):1666-1675. doi: https://doi.org/10.1111/j.1523-1739.2000.99068.x
Medellín RA, Víquez-R LR. 2014. Los murciélagos como bioindicadores de la perturbación ambiental. En: González C, Vallarino A, Pérez JC, Low AM, editores. Bioindicadores: guardianes de nuestro futuro ambiental. México: Editorial S y G. p. 521-539.
Méndez L, Álvarez-Castañeda ST. 2000. Comparative analysis of heavy metals in two species of Ichthyophagous bats Myotis vivesi and Noctilio leporinus. B. Environ. Contam. Tox. 65(1):51-54. doi: https://doi.org/10.1007/s0012800093
Mispagel C, Allinson M, Allinson G, Iseki N, Grant C, Morita M. 2004. DDT and metabolites residues in the southern bent-wing bat (Miniopterus schreibersii bassanii) of south-eastern Australia. Chemosphere. 55: 997–1003. doi: https://doi.org/10.1016/j.chemosphere.2003.12.008
Nakataa H, Hirakawaa Y, Kawazoea M, Nakabob T, Arizonoc K, Abea S, Kitanoa T, Shimadad H, Watanabee I, Lif W, Ding X. 2005. Concentrations and compositions of organochlorine contaminants in sediments, soils, crustaceans, fishes and birds collected from Lake Tai, Hangzhou Bay and Shanghai city region, China. Environ. Pollut. 133: 415–429.
Newman MC. 2014. Fundamentals of Ecotoxicology: The Science of Pollution. Fourth Edition. New York: CRC Press.
O’Brien D, Lewis S, Davis A, Gallen, C, Smith R, Turner R, Warne M, Turner S, Caswell S, Mueller J, Brodie J. 2016. Spatial and temporal variability in pesticide exposure downstream of a heavily irrigated cropping area: application of different monitoring techniques. J. Agric. Food Chem. 64: 3975−3989. doi: https://doi.org/10.1021/acs.jafc.5b04710.s001
O’Shea TJ, Everette AL, Ellison LE. 2001. Cyclodiene insecticide, DDE, DDT, arsenic and mercury contamination of big brown bats (Eptesicus fuscus) foraging at a Colorado Superfund Site. Arch. Environ. Con. Tox. 40(1):112-120. doi: https://doi.org/10.1007/s002440010153
O’Shea TJ, Johnson JJ. 2009. Environmental contaminants and bats: investigating exposure and effects. En: Kunz TH, Parsons S, editores. Ecological and behavioral methods for the study of bats. Second edition. Baltimore, MD: Johns Hopkins University Press. p. 500-528.
Palencia G, Mercado F, Combatt E. 2006. Estudio agroclimático del departamento de Córdoba. Montería: Facultad de Ciencias Agrícolas, Universidad de Córdoba Colombia.
Parque Nacional Natural Paramillo - DTCA. 2014. Plan de Manejo 2014 - 2019 Parque Nacional Natural Paramillo. Tierralta, Córdoba-Colombia: Parques Nacionales Naturales de Colombia. Ministerio de Ambiente y Desarrollo Sostenible.
Quang Le N, Nguyen D, Harino H, Kakutani N, Chino N, Arai T. 2010. Distribution of trace metals and methylmercury in soft tisús of the freshwater eel Anguilla marmorata in Vietnam. Arch. Env. Cont Tox.59: 282-290. doi: https://doi.org/10.1007/s00244-010-9479-4
Racero-Casarrubia J, Pinedo-Hernández J, Ballesteros-Correa J, Marrugo-Negrete J. 2017. Metales pesados en especies de murciélagos (Quiróptera) asociados a una finca bajo manejo silvopastoril en el departamento de Córdoba, Colombia. Acta Zoo. Mex. 33(1): 45-54. doi: https://doi.org/10.21829/azm.2017.3311012
Ramírez JA, Lacasaña M. 2001. Plaguicidas: clasificación, uso, toxicología y medición de la exposición. Arch. Prev. Riesgos Labor. 4(2):67-75.
Rattner BA. 2009. History of wildlife toxicology. Ecotoxicology. 18: 773–783. doi: https://doi.org/10.1007/s10646-009-0354-x
Sánchez-Palencia Y, Ortiz JE, de Torres T. 2015. Origen y distribución de pesticidas organoclorados (OCPs) en sedimentos actuales de la laguna de El Hito (Cuenca, España Central). Geogaceta. 58(1):119-122.
Senthilkumar K, Kannan K, Subramanian A, Tanabe S. 2001. Accumulation of organochlorine pesticides and polychlorinated biphenyls in sediments, aquatic organisms, birds, bird eggs and bat collected from South India. Environ. Sci. Pollut. Res. 8: 35–47. doi: https://doi.org/10.1007/BF02987293
Simmons NB. 2005. Order Chiroptera. En: Wilson DE, Reeder DM, editores. Mammal species of the world: a taxonomic and geographical reference. Third Edition. Baltimore: John Hopkins University Press. p. 312-529.
Soriano P. 2000. Functional structure of bat communities in tropical rainforest and Andean Cloud Forest. Ecotropicos. 13(1):1-20.
Stechert C, Kolb M, Bahadir M, Djossa BA, Fahr J. 2014. Insecticide residues in bats along a land use-gradient dominated by cotton cultivation in northern Benin, West Africa. Environ. Sci. Pollut. R. 21(14):8812-8821. doi: https://doi.org/10.1007/s11356-014-2817-8
Waliszewski S, Caba M, Gómez-Arroyo S, Villalobos-Pietrini R, Martinez A, Valencia-Quintana R, Lozano M, Torres R. 2013. Niveles de plaguicidas organoclorados en habitantes de México. Rev. Int. Contam. Ambie. 29 (Número especial sobre plaguicidas):121-131.
Swanepoel RE, Racey PA, Shore RF, Speakman JR. 1999. Energetic effects of sublethal exposure to lindane on pipistrelle bats (Pipistrellus pipistrellus). Environ. Pollut. 104, 169–177.
Thies ML, McBee K. 1994. Cross-placental transfer of organochlorine pesticides in Mexican free-tailed bats from Oklahoma and New Mexico. Arch. Environ. Con. Tox. 27(1):239-242. doi: https://doi.org/10.1007/BF00214268
Thies ML, Thies K, McBee K. 1996. Organochlorine pesticide accumulation and genotoxicity in Mexican free-tailed bats from Oklahoma and New Mexico. Arch. Environ. Con. Tox. 30(2):178-187. doi: https://doi.org/10.1007/BF00215796
Timm RM, LaVal RK. 1998. A field key to the bats of Costa Rica. Occasional Publication Series, Center of Latin American Studies. The University of Kansas. 22(1):1-30.
Valdespino C, Sosa VJ. 2017. Effect of landscape tree cover, sex and season on the bioaccumulation of persistent organochlorine pesticides in fruit bats of riparian corridors in eastern Mexico. 175: 373-382. Chemosphere. doi: https://doi.org/10.1016/j.chemosphere.2017.02.071
Weber P, Behr ER, knorr CDL, Vendruscolo DS, Flores EMM, Dressler VL, Baldisserotto B. 2013. Metals in the water, sediment, and tissues of two fish species from different trophic levels in a subtropical Brazilian river. Microchem. J. 106(1):61-66. doi: https://doi.org/10.1016/j.microc.2012.05.004
Wickramasinghe LP, Harris S, Jones G, Vaughan N. 2003. Bat activity and species richness on organic and conventional farms: impact of agricultural intensification. J. Appl. Ecol. 40(6):984-993. doi: https://doi.org/10.1111/j.1365-2664.2003.00856.x
Yates TL, Jones C, Cook JA. 1996. Preservation of voucher specimens. En: Wilson DE, Rusell F, Nichols JD, Rudran R, Foster MS, editores. Measuring and monitoring biological diversity: Standard methods for mammals. Washington: Smithsonian Institution Press. p. 265-273.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. María Camila Portilla-Saldarriaga, Stiven Camilo Dueñas-García, Inés Hernández-Celi, Martha Jhoana Estévez-Gómez. (2025). Gentle remediation options for DDT- and HCH-contaminated soil. Revista Facultad de Ingeniería Universidad de Antioquia, (116) https://doi.org/10.17533/udea.redin.20241143.
2. Cristina Restrepo-Arango, Carlos Eduardo Sarmiento. (2025). Políticas de pesquisa e publicação na Colômbia: o caso da Revista Colombiana de Entomologia através de uma análise de co-word. Encontros Bibli: revista eletrônica de biblioteconomia e ciência da informação, 30, p.1. https://doi.org/10.5007/1518-2924.2025.e103917.
3. Priscila Stéfani Monteiro-Alves, Elizabete Captivo Lourenço, Rodrigo Ornellas Meire, Helena Godoy Bergallo. (2024). Is banning Persistent Organic Pollutants efficient? A quantitative and qualitative systematic review in bats. Perspectives in Ecology and Conservation, 22(3), p.250. https://doi.org/10.1016/j.pecon.2024.07.001.
4. Carolina Ureta, Mercedes Ramírez-Barrón, Felipe Ruán-Soto, Melanie Kolb, Adán L. Martínez-Cruz, Giovanna Gasparello, Víctor Sánchez-Cordero, Raúl Alejandro Alegría-Morán. (2024). Impact of climate change on the distribution of insectivorous bats: Implications for small-scale farming in southern Mexico. PLOS ONE, 19(12), p.e0310623. https://doi.org/10.1371/journal.pone.0310623.
5. Carolina Ureta, Mercedes Ramírez‐Barrón, Edgar Andrés Sánchez‐García, Angela P. Cuervo‐Robayo, Mariana Munguía‐Carrara, Alma Mendoza‐Ponce, Carlos Gay, Víctor Sánchez‐Cordero. (2022). Species, taxonomic, and functional group diversities of terrestrial mammals at risk under climate change and land‐use/cover change scenarios in Mexico. Global Change Biology, 28(23), p.6992. https://doi.org/10.1111/gcb.16411.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2020 Caldasia

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cual estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).























