Published
FENOLOGÍA DE LA FLORACIÓN DE ESPECIES ORNITÓFILAS DE ESTRATOS BAJOS EN DOS HÁBITATS ALTOANDINOS DEL PARQUE NATURAL MUNICIPAL RANCHERÍA (PAIPA-BOYACÁ-COLOMBIA)
Downloads
MARTHA PARADA-QUINTERO
DARÍO ALARCÓN-JIMÉNEZ
LILIANA ROSERO-LASPRILLA
Grupo de Investigación Biología para la Conservación, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Boyacá, Colombia. marticapq@gmail.com, darioa2004@yahoo.com, lilianaroseros@gmail.com
RESUMEN
Se evaluó mensualmente la producción de flores de las especies ornitófilas de estratos bajos de bosque altoandino y área paramizada del Parque Natural Municipal Ranchería. La floración fue medida como el número de flores, individuos y especies en floración, presentes en cinco transectos de 200 m de largo por 5 m de ancho, durante trece meses se registraron 40 especies ornitófilas en floración, pertenecientes a 14 familias. La floración fue continua en el bosque altoandino y en el área paramizada, con un promedio mensual de 305 flores por 0.1 ha para bosque altoandino y 585 por 0.1 ha para el área paramizada. Los hábitats mostraron diferencia en la disponibilidad de flores. La forma de crecimiento arbustiva y las especies de la familia Ericaceae fueron importantes en la oferta de flores, individuos y especies en floración en ambos hábitats durante todo el año. Entre las Ericaceae se destaca a Gaultheria anastomosans, Plutarchia guascensis y Macleania rupestris, las cuales por supatrón de floración de tipo continuo, gran cantidad de individuos y flores producidas a lo largo del año, constituyen recursos importantes para varias de las especies de colibríes residentes del área. La producción continua de flores y la complementariedad temporal en la oferta de flores entre estos hábitats, es importante como fuente de alimento para mantener la comunidad de aves nectarívoras residentes y migratorias en el área.
Palabras clave. Floración, ornitofilia, bosque altoandino, área paramizada, estratos bajos.
ABSTRACT
The flower production of ornithophilous plant species from the lower stratum in two habitats of an Andean forest in the Parque Natural Municipal Rancheria was evaluated during 13 months. Flowering was measured in terms of the number of flowers, individuals, and species that were in bloom along 5 transects of 200 m long by 5 m wide. A total of 40 ornithophilous species of 14 families were recorded. The flowering period was continuous, with a monthly average of 305 flowers per 0.1 ha in the habitat consisting of strictly Andean forest elements while of 585 flowers per 0.1 ha in the habitat consisting of a mixture of Andean forest and Páramo elements. These two habitats showed differences in the flower availability. Shrubs and species of Ericaceae were the most important elements in terms of flower availability, individuals, and flowering species in both habitats throughout the year. Among Ericaceae species, Gautheria anastomosans, Plutarchia guascensis and Macleania rupestris stand out for their pattern of continuous flowering and for the large number of individuals and flowers they produced. All of these characteristics make them an important resource for several species of hummingbirds that inhabit the area. The continuous flower production and the temporal complementarity of available flowers across habitats provide an important food source to maintain the nectarivorous resident and migrant birds in the area.
Key words.Flowering, ornithophilous, high-Andean forest, paramized area, low stratus.
Recibido: 28/09/2010
Aceptado: 21/02/2012
INTRODUCCIÓN
La producción periódica de las estructuras vegetativas y reproductivas (fenología) es resultado de las interacciones entre factores bióticos y abióticos que determinan el tiempo más adecuado para el crecimiento y la reproducción de las plantas (Kearns & Inouye 1993, van Schaik et al. 1993). Entre los eventos fenológicos, la floración es un proceso importante al influir en la formación de los frutos y al afectar a muchos animales que dependen del néctar como recurso energético; esta dependencia se presenta por la variación espacial y temporal del recurso, lo que hace necesario movimientos estacionales de los animales de acuerdo a la oferta de alimento (Stiles 1979, Gutiérrez & Rojas 2001). Igualmente, las plantas desarrollan diferentes estrategias fenológicas para garantizar la atracción de los animales (Fleming 1979) tales como sincronía entre las especies vegetales, que coincide con la presencia o actividad de los vectores animales (e. g. llegada de aves migratorias), floración segregada temporalmente entre las especies que comparten polinizadores para minimizar la polinización inefectiva o la competencia por polinizadores (Stiles 1977, Rathcke & Lacey 1985, van Schaik et al. 1993).
En los bosques tropicales, cerca del diez al quince por ciento de las angiospermas tienen flores adaptadas para la polinización por aves (Feinsinger 1983, Morellato & Sazima 1992), definidas como plantas ornitófilas. El conocimiento y la comprensión de los patrones fenológicos de estas especies vegetales es fundamental para entender la dinámica de las comunidades vegetales y proveer indicios de cómo es la interacción con estos animales.
Estudios sobre cómo es la floración de las especies en bosques tropicales han encontrado que las plantas florecen estacionalmente, principalmente durante el período seco (Hilty 1980, Dulmen 2001, Stevenson 2004); además, en los pocos estudios realizados en ecosistemas andinos que abarquen el seguimiento fenológico por tiempo igual o mayor a un año, concuerdan en que hay mayor floración en períodos secos (Bonilla & Zuloaga 1994, Gutiérrez et al. 2004, Durán & Kattan 2005), donde las plantas deben poseer mecanismos para aprovechar los recursos hídricos de las épocas de mayor precipitación y conformar su estructura reproductiva que finalmente se expresa con la floración en las épocas secas (Bonilla & Zuloaga 1994). La actual necesidad de conocer los procesos autoecológicos de las especies, su papel en el funcionamiento y ensamblaje de los ecosistemas, y la importancia que tienen los ecosistemas altoandinos en el sostenimiento de uno de los principales grupos de animales que interactúan en los procesos de polinización y dispersión de semillas de las especies vegetales tropicales, han generado la realización de esta investigación.
De acuerdo con Stiles (1985) la interpretación de los ritmos estacionales de las aves se facilita si se tiene un mejor conocimiento acerca de los recursos críticos de las aves, incluyendo datos cuantitativos precisos. Por otra parte el desempeño de las actividades estacionales como la reproducción y la muda en los colibríes, han mostrado ser muy influenciadas por los patrones de floración (Skutch 1950, Stiles 1978, 1985, Gutiérrez et al. 2004). Stiles (1985), Gutiérrez et al. 2004 y Gutiérrez (2008) demuestran que cuando se tienen datos cuantitativos de número de flores a lo largo de un año o más es posible responder a preguntas acerca de cómo la cantidad y calidad del recurso afecta eventos como muda, reproducción y movimientos estacionales de los colibríes. Por tanto hacer aportes al conocimiento sobre la fenología de la floración de las especies ornitófilas, con detalles cuantitativos del número de flores producidas a lo largo del año en otros ecosistemas adicionales a los ya estudiados, son importantes para comparar patrones estacionales en diferentes comunidades de colibríes.
En este estudio se presentan datos de la oferta de flores, individuos y especies ornitófilas de los estratos bajos entre el bosque altoandino y el área paramizada del Parque Natural Municipal Ranchería. Las áreas paramizadas en este sitio se formaron por el proceso de intervención antrópica, que ha provocado que en estas zonas se encuentre vegetación principalmente de páramo asociada con relictos de bosque altoandino (Velasco-Linares & Vargas 2008). Nuestros objetivos fueron evaluar la fenología de la floración de la comunidad de plantas ornitófilas en bosque altoandino y área paramizada, y comparar la disponibilidad de flores entre los dos hábitats, los cuales difieren en características de composición florística, estructura y microclima, a pesar de tener una altitud similar en el área de estudio, estas condiciones podrían generar ritmos de floración diferentes y una complementariedad en la oferta de flores entre los dos hábitats, para las aves en estas zonas.
Por otro lado, debido a que una de las principales características de los bosques tropicales es la gran diversidad de formas de crecimiento de la vegetación, en relación con otros ecosistemas terrestres (Oldeman 1990), se evaluó el papel que tienen las diferentes formas de crecimiento de las plantas en la oferta de flores principalmente para la comunidad de aves. Puesto que las formas de crecimiento como lianas, arbustos, epífitas y hierbas son importantes en la composición, la estructura y la dinámica de los bosques tropicales, como ha sido demostrado en numerosas investigaciones (e. g. Gentry & Dodson 1987, Álvarez & Londoño 1996, Galeano et al. 1998, Schnitzer & Bongers 2002) y que su importancia en la producción de flores en los ecosistemas altoandinos no había sido cuantificada se buscaba establecer la importancia de las diferentes formas de crecimiento en la oferta de recursos florales para las aves y determinar su influencia en el ritmo de floración de los dos ecosistemas estudiados.
MATERIALES Y MÉTODOS
Área de estudio. Este estudio se llevó a cabo en el Parque Natural Municipal Ranchería (5°50'29.15"-5°52'29" Norte y 73°07'02.1"-73°07'16" Oeste), localizado en la Reserva Forestal Ranchería (Paipa, Boyacá, Colombia). La Reserva Forestal Ranchería hace parte del corredor de conservación Guantiva-La Rusia-Iguaque o corredor de robles localizado hacia la vertiente occidental de la cordillera oriental colombiana. La vegetación del eje central del corredor está representada por bosques andinos y robledales (Galindo et al. 2006). Según el sistema de zonas de vida de Holdridge et al. (1971) el Parque se encuentra en la zona de vida de bosque muy húmedo montano (bmh-M). La temperatura media anual es 12.2 °C y la precipitación media anual 844 mm (Estación la Sierra IDEAM). Aunque no se presentan marcadas estaciones secas, las lluvias decrecen entre junio-agosto y diciembre-febrero; mientras los niveles altos de precipitación se presentan de marzo a mayo y de septiembre a noviembre. Nosotros evaluamos la fenología de las especies ornitófilas en dos hábitats dentro del Parque (bosque altoandino y área paramizada). El bosque altoandino comprende relictos de vegetación nativa boscosa, con elementos dominantes como Weinmannia tomentosa, Clusia alata y Drimys granadensis, presenta un dosel bajo de 12 m(Sánchez & Cely 2003). El sotobosque es denso, está compuesto principalmente por vegetación herbácea y arbustiva, con presencia de epífitas como bromelias, orquídeas. En el área paramizada se encuentra vegetación de bosque como arbustos pequeños de la familia Ericaceae asociada con especies de páramo como Espeletia muiska, Calamagrostis effusa e Hypericum brathys (Sánchez & Cely 2003). Una descripción completa del área se encuentra en Rosero (2010).
Fase de campo. Este estudio se realizó entre noviembre 2006 y noviembre 2007, en tres veredas del Parque. Para seleccionar las especies ornitófilas, se escogieron las plantas que presentaron en sus flores características del síndrome de ornitofilia como corolas tubulares, de colores llamativos (e.g. rojo, amarillo, naranja; Van Pijl 1961), o que por observaciones personales fueran visitadas por aves nectarívoras y por registros de estudios previos se han reportado como visitadas por aves nectarívoras (Stiles 1978, 1985, Gutiérrez et al. 2004). Para evaluar la floración de las especies ornitófilas, se instalaron al azar cinco transectos lineales de 200 m de largo por 5 m de ancho (Chapman et al. 1994) tres en bosque altoandino y dos en áreas paramizadas, estas últimas debido a que no se encontraron más áreas con la extensión necesaria para establecer los transectos. En cada transecto se marcaron y numeraron todas las plantas ornitófilas con etiquetas de aluminio y una banda de tela; para el caso de las epífitas, se marcó el árbol o arbusto en el cual se encontró la especie. Para el hábitat de bosque altoandino sólo fueron consideradas las plantas con una altura no mayor a 10 m (pertenecientes al sotobosque), con el fin de realizar la comparación con el área paramizada, en el cual se encuentran solo plantas de porte bajo. Las especies encontradas con flores en los transectos fueron clasificadas en una de las cinco formas de crecimiento: árbol, arbusto (incluye subarbustos y arbustos hemiepifitos), trepadora o escandente (incluye lianas o bejucos, enredaderas), hierba terrestre y epifita; esta agrupación fue según la forma de crecimiento que presentaran con base en el porte adulto de la planta y teniendo en cuenta el criterio que está consignado en Font-Quer (2001).
Para evaluar la fenología de la floración, cada quince días se registró el número de individuos en floración (Stevenson 2004, Choo et al. 2007) y se cuantificó el número de flores abiertas presentes en la planta (Stiles 1979, Durán & Kattan 2005). Para las especies con más de 200 flores, se cuantificó en una rama el número total de flores y se extrapoló por el número de ramas. Se recolectaron muestras botánicas de las especies en floración, las cuales se identificaron en el Herbario de la Universidad Pedagógica y Tecnológica de Colombia (UPTC) y en el Herbario Nacional Colombiano (COL), ejemplares testigo de estas especies se entregaron a los herbarios COL y UPTC.
Análisis de la información. Con el fin de comparar los dos tipos de hábitats, los datos de número de especies, individuos y flores registrados a lo largo del período de estudio en ambos hábitats se promediaron y se consideran para 0.1 ha. Con el fin de establecer si se presentaban diferencias en la producción de flores durante los doce meses entre cada hábitat y en cada una de las formas de crecimiento evaluadas, se realizó a través de análisis de varianza de medidas repetidas (variables independientes: hábitat, formas de crecimiento, meses; variables dependientes: número de flores, individuos y especies en floración) y la prueba de comparación múltiple de Tukey, con un valor de significancia de α=0.05. Se probó la normalidad y homogeneidad de varianzas de las variables dependientes usando la prueba de Shapiro-Wilks y la prueba de Bartlet, respectivamente (Sokal & Rohlf 1981). Cuando fue necesario las variables fueron transformadas usando raíz cuadrada para asumir los supuestos de normalidad y homogeneidad de varianza. Las pruebas se aplicaron con el paquete estadístico Statgraphics Plus Versión 5.0. Para comparar la similitud florística cualitativa entre los hábitats de estudio se calculó el índice de similitud de Jaccard (IJ), teniendo en cuenta la presencia/ausencia de las especies (Moreno 2001).
La frecuencia y la duración del patrón de floración para las especies, fue establecida de acuerdo con Newstrom et al. (1994) y Stevenson et al. (2008); se tomaron las especies con más de cinco individuos en floración teniendo en cuenta los estudios realizados por Frankie et al. (1974) y Parrado-Rosselli (2005). La frecuencia se dividió en: continua (floración a lo largo del año > 6 meses), episódica (producción de flores más de una vez por año en eventos discontinuos que en total suman < 6 meses) y anual (únicamente un ciclo grande por año; Newstrom et al. 1994, Stevenson et al. 2008); para las especies con floración anual se estableció su duración en breve (<1 mes), intermedia (1-5 meses) y extendida (>5 meses; Newstrom et al. 1994). Las especies que no presentaron patrones de frecuencia o duración detectables fueron consideradas como irregulares.
RESULTADOS
Se registró el comportamiento fenológico de 721 individuos con síndrome de ornitofilia, pertenecientes a 40 especies de 14 familias, de las cuales, 33 (83%) florecieron durante el año de estudio en el bosque altoandino y 22 en área paramizada (Anexo 1). El número promedio mensual de especies en floración fue igual para ambos hábitats (8 ± 2 especies / 0.1 ha por mes; Tabla 1), mientras que sí se registraron diferencias en la composición de especies entre los hábitats (IJ = 0.375).
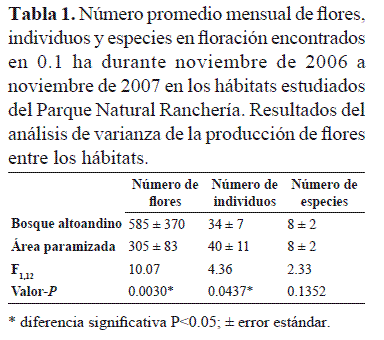
El número de especies en floración no mostró cambios estacionales y fue constante durante el tiempo de estudio (Tabla 1, Figura 1). A lo largo del estudio se observaron siempre individuos en floración en los dos hábitats; sin embargo, el número de individuos en floración fue significativamente mayor en el área paramizada respecto al bosque altoandino, mientras que el número de flores fue mayor en este último (Tabla 1).

El número de individuos en floración en bosque altoandino fue menor en los primeros meses de 2007 e incrementó de junio a agosto, durante el segundo período seco (Figura 1). En el área paramizada el número de individuos en floración incrementó entre noviembre de 2006 y enero de 2007 época en la cual en la zona comienza el período seco y decreció de febrero a mayo durante los más altos niveles de precipitación (Figura 1).
En el área paramizada, la mayor producción de flores se presentó en el primer período seco del año entre diciembre y enero (1814 ± 278 /0.1 ha) y decreció entre febrero y mayo (primer período húmedo); en bosque altoandino incrementó en el segundo período húmedo entre septiembre y noviembre (571 ± 114 flores/0.1 ha;Figura 1). Sin embargo, se encontraron diferencias en el número de flores producidas entre los hábitats y entre los meses (Tabla 1).
La forma de crecimiento arbustiva presentó plantas en floración todo el año, con un total de 5169 ± 558 flores por 0.1 ha para ambos hábitats, 23 ± 6 individuos / 0.1 ha y 13 especies / 0.1 ha en bosque altoandino y 34 ± 9 individuos / 0.1 ha y 5 especies / 0.1 ha en floración en el área paramizada. En el área paramizada se produjo mayor número de flores (3501 ± 127 flores/0.1 ha) respecto al bosque altoandino (1668 ± 23/0.1 ha). Así mismo, el mayor número de individuos y especies en floración en los dos hábitats fueron arbustos. Las formas de crecimiento trepadora y epifita no mostraron picos de floración marcados, debido al bajo número de individuos en floración encontrados. En bosque altoandino la producción de flores por las hierbas fue importante en julio, cuando la producción de flores por los arbustos descendió (Figura 2).

Se encontraron diferencias entre las formas de crecimiento en el número de flores e individuos en floración (ANDEVA Medidas repetidas: número de flores F6,12 = 43.04, P = 0.0000; número de individuos en floración: F6,12= 49.93, P = 0.0000). La producción media de flores e individuos de arbustos en floración fue significativamente mayor que la producción media de las epifitas (q = 371.184 flores, 15.5 individuos, P = 0.0000), los bejucos (q = 361.894 flores, 14.38 individuos, P =0.000) y las hierbas (q = 340.680 flores, 12.69 individuos, P =0.000). La producción de flores no presentó diferencias significativas entre epifitas y bejucos (q = 9.29, P > 0.05), ni epifitas y hierbas (q = 30.504, P > 0.05), ni entre hierbas y bejucos (q = 21.214, P > 0.05).
Composición florística de la disponibilidad de flores. La familia Ericaceae presentó el más alto número de flores, individuos y especies en floración en ambos hábitats (Tabla 2).
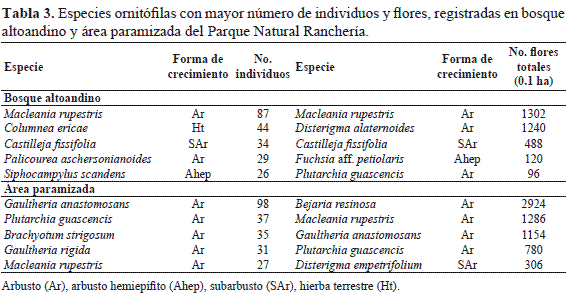
A nivel especie, en bosque altoandino Macleania rupestris (Ericaceae) presentó el mayor número de individuos en floración y la mayor producción de flores todo el año (Tabla 3); mientras, Bejaria resinosa (Ericaceae) presentó la mayor floración en el área paramizada (Tabla 3) y Gaultheria anastomosans el mayor número de individuos en floración. Es importante destacar que para las familias que fueron las más importantes en la oferta de flores, hay una relación aparentemente directa entre el número de especies, individuos y flores.
De las 33 especies vegetales registradas en bosque altoandino, trece especies tuvieron más de cinco individuos en floración, asimismo, todas presentaron continuidad en su producción de flores (Anexo 1). En el área paramizada de las 22 especies evaluadas, doce especies presentaron más de cinco individuos en floración, nueve florecieron continuamente, dos anual y una episódica (Anexo 1). Las especies con floración anual Gaiadendron punctatum y Castilleja fissifolia mostraron duración extendida e intermedia, respectivamente.
DISCUSIÓN
Similar a la mayoría de comunidades de especies de plantas polinizadas por colibríes en los trópicos, la floración en los hábitats de bosque altoandino y área paramizada del Parque Natural Ranchería muestran producción continua de flores ornitófilas (Stiles 1978, Rathcke & Lacey 1985, Newstron et al. 1994). Esta continuidad en los hábitats estudiados es clave porque permitiría sostener de forma permanente la comunidad de aves nectarívoras especialmente las residentes, asegurando una fuente continua de néctar para estas; lo cual es importante en Ranchería donde se reportan once aves nectarívoras como residentes para el Parque (Rosero et al. 2010). Es importante destacar que aunque esta relación no es necesariamente lineal, las plantas presentan variaciones morfológicas, algunas como limitaciones que pueden excluir la visita y alimentación de algunas especies de colibríes, así como también los colibríes con diferentes largos de picos, las 40 especies documentadas en este estudio presentan características que concuerdan en general con el síndrome de ornitofilia (corolas tubulares y colores llamativos atractivos para las aves). Además Toloza-Moreno & León-Camargo (2009) para Ranchería confirman visitas por diferentes especies de colibríes en 34 de las 40 especies analizadas. Para las seis especies en las cuales Toloza-Moreno & León-Camargo (2009) no registraron visitas por colibríes, si se ha documentado visitas (a nivel de especie o género) en los otros dos ecosistemas altoandinos de Colombia en los cuales se ha estudiado la interacción planta-colibrí al nivel de comunidad (Gutiérrez & Rojas 2001, Gutiérrez 2008).
Este estudio muestra que existen diferencias en la composición de especies ornitófilas entre el bosque altoandino y el área paramizada, además, los resultados muestran complementariedad temporal en la oferta del recurso respecto al número de individuos en floración y número de flores entre los hábitats estudiados, lo cual podría estar facilitando que las especies de colibríes puedan realizar movimientos locales entre estos, para suplir sus requerimientos energéticos durante los diferentes meses del año, ya que los animales pueden desplazarse alrededor de los mosaicos de vegetación locales de acuerdo a cambios estacionales en la oferta del recurso (van Schaik et al. 1993).
En este estudio, la forma de crecimiento arbustiva en ambos hábitats provee la mayor cantidad de flores, individuos y especies en floración; del total de especies ornitófilas registradas el 73% son arbustos y durante el período de escasez fue el principal recurso en el área; las familias y especies con mayor número de individuos y flores presentan esta forma de crecimiento. Al respecto, Terborgh (1977) y Stiles (1985) señalan que el número de arbustos polinizados y dispersados por aves aumenta a mayor altitud. A esto se le suma que los arbustos en bosque altoandino y en el área paramizada presentan una floración continua todo el año, por lo cual muchas aves nectarívoras podrían depender de estas plantas para su alimentación en el área y en otros ecosistemas altoandinos. Este aspecto se puede confirmar con lo registrado posteriormente por Toloza-Moreno & León-Camargo (2009) en Ranchería quienes registran que de 76 de las especies vegetales visitadas por colibríes 19 son arbustos, 17 de estas últimas fueron registradas en este estudio. Vale la pena anotar que las dos especies arbustivas registradas en este estudio como ornitófilas (Cavendishia bracteata y Palicourea lineariflora) y en las cuales Toloza-Moreno & Léon-Camargo (2009) no confirman visitas por los colibríes del Parque, Gutiérrez (2008) documenta a C. bracteata como una de las plantas más visitadas por varias especies de colibríes en Torca; igualmente, la predominancia de los arbustos también se ha encontrado en otras comunidades polinizadas por colibríes, principalmente ericáceas (Wolf et al. 1976, Stiles 1985). Las especies herbáceas en bosque altoandino mostraron un incremento en el número de flores a mediados del segundo período seco, cuando se registró un descenso en la temperatura para el área (Estación la Sierra IDEAM, 2007); al respecto, Borchert (1983) señala que para muchas especies herbáceas la floración es inducida principalmente por el fotoperíodo y la baja temperatura. Sin embargo, no se encontró un aporte significativo de flores de las plantas trepadoras y epífitas en la producción total registrada, ni fue clave en meses de escasez de flores de la principal forma de crecimiento (arbustos), lo cual es producto de la baja abundancia de estas formas de crecimiento en los estratos bajos los cuales eran objetivo de esta investigación.
La mayor floración en bosque altoandino se presentó en el período húmedo, similar a lo encontrado en otros tipos de bosques tropicales como húmedo, de galería, montano, litoral y altoandino (Frankie et al. 1974, Funch et al.2002, Gutiérrez et al. 2004, Bollen & Donati 2005). Por otra parte, en el área paramizada la mayor producción de flores se presentó en el primer período seco del año (diciembre de 2006 - enero de 2007), similar a lo encontrado en el páramo el Granizo - Cundinamarca (diciembre a marzo: Bonilla & Zuloaga 1994), y en el páramo del volcán Galeras para las especies ornitófilas (junio-septiembre: Gutiérrez et al. 2004). Sin embargo, la oferta de especies e individuos en floración a lo largo del año en los hábitats del área estudiada, no muestra una marcada estacionalidad; el Parque como en general los ecosistemas altoandinos son áreas cubiertas permanente por nubes y con fluctuaciones en el clima como alta pluviosidad (por lo menos ocho meses húmedos) y alta condensación de agua (Mora-Osejo et al. 1994, González 2000, Brown & Kappelle 2001), presencia de suelos orgánicos de gran espesor (Sturm 1994), numerosas plantas epifitas que actúan como esponjas reteniendo agua (Hamilton 2001 en Brown & Kappelle 2001), lo que causaría que no exista un período seco en estos ecosistemas, que podría explicar la no marcada floración estacional de la comunidad vegetal de los hábitats estudiados en relación con la pluviosidad como si presenta en ecosistemas bajos.
A nivel comunitario, hubo diferencias significativas entre los dos hábitats estudiados. La mayor oferta de flores en promedio anual, se presentó en el bosque altoandino, pero el área paramizada registró en promedio un mayor número de individuos en floración (Tabla 1). La familia más importante por la producción de flores a lo largo del año para los dos hábitats fue Ericaceae, la cual superó en niveles de floración a las siguientes de la lista, Scrophulariaceae y Liliaceae en órdenes de magnitud superior a diez (Tabla 2). Entre las especies importantes por el patrón de floración y el aporte total de flores se destacan Macleania rupestris y Disterigma alaternoides en el hábitat de bosque altoandino, mientras que en el área paramizada Bejaria resinosa, Macleania rupestris yGaultheria anastomosans fueron los recursos florales más abundantes durante el período de estudio. Estas últimas, excepto Bejaria resinosa, también presentaron un patrón de floración continuo. Las especies Macleaniarupestris, Bejaria resinosa y los géneros Disterigma y Gaultheria presentaron órdenes de magnitud en los niveles de floración similares a los registrados en algunas especies de Ericaceae de los mismos géneros estudiadas en Volcán Galeras, uno de los ecosistemas altoandinos de Colombia donde se han hecho este tipo de registros detallados de número de flores para un conjunto de especies ornitófilas (Gutiérrez & Rojas 2001) y a los conteos de flores registrados por Stiles (1985) para algunas especies de Ericaceae ornitófilas en una zona de selva húmeda de menor altitud. De las 20 especies de las cuales se encontró más de cinco individuos en floración, aunque producen flores en cantidades menores a los registrados para las especies de Ericaceae, 17 de ellas presentan patrones de floración de tipo continuo y varias de ellas se registraron en los dos tipos de hábitat (Anexo 1). Este hecho sumado a las características morfológicas de las flores, de colores llamativos, tubulares, rectas o curvas, indica que son recursos florales que pueden ser utilizados por varias de las especies de colibríes residentes registradas en el área de estudio (Rosero et al. 2010).
La oferta de flores en el bosque altoandino y en el área paramizada se encontró que es relativamente alta en el número mensual y total de especies, individuos y flores producidas por 0.1 ha. Por ejemplo, en 1 ha de bosques bajos en el sureste de Puerto Rico (Kodric-Brown et al. 1984) quien muestreó un conjunto de especies ornitófilas, encontró que el mayor número de flores producidas en un mes fue de aproximadamente 1000 flores, mientras en nuestro estudio el mayor número de flores por mes fue 1841 flores por 0.1 ha para el área paramizada y 571 flores por 0.1 ha para el bosque altoandino. En otros estudios realizados en ecosistemas altoandinos en Colombia, Gutiérrez & Rojas (2001) y Rojas (2005) para el Volcán Galeras y Torca, respectivamente, encontraron que el mayor número de flores producidas por especies ornitófilas estuvo entre 5000 y 10000 flores por ha para bosque altoandino y subpáramo. Además, en datos disponibles sobre producción de flores en sitios de Costa Rica, Argentina y en otros bosques de menor altitud de Colombia muestran valores menores de flores (Stiles 1985, Malizia 2001, Durán & Kattan 2005, Stevenson et al. 2008). Esta alta abundancia de flores registrada en los hábitats evaluados en el presente estudio resalta lo clave que podrían ser los ecosistemas altoandinos en el sostenimiento de las diferentes comunidades animales.
Nuestros resultados indican que los hábitats de bosque altoandino y área paramizada tienen una floración continua y relativamente alta; a pesar de ser hábitats contiguos, presentan ritmos de floración diferentes pero complementarios temporalmente, de tal forma que en conjunto generan una oferta continua de flores importante para la comunidad de aves tanto residentes como migratorias, ya que el conjunto de las 40 especies ornitófilas caracterizadas en este estudio son recursos utilizados como fuentes de néctar por los colibríes. La floración de la comunidad de especies ornitófilas evaluadas, no muestra una marcada estacionalidad en relación a los niveles de precipitación, como si se presenta en otros tipos de ecosistemas. A nivel de comunidad la familia más importante en la oferta de especies para ambos hábitats es Ericaceae, la cual es típica de estos ecosistemas resaltando la importancia de esta familia en estos hábitats. Respecto de las formas de crecimiento, la arbustiva fue la más representativa a nivel de especies en floración, individuos y flores, por lo cual la convierte en importante en la oferta floral para mantener a los posibles polinizadores. En general, el Parque Natural Municipal Ranchería como los ecosistemas altoandinos podrían ser importantes áreas en la oferta de flores para uno de los principales grupos de animales de los bosques tropicales como son las aves.
AGRADECIMIENTOS
Agradecemos a la Corporación Autónoma de Boyacá (CORPOBOYACA) y a la Dirección de Investigaciones (DIN) de la Universidad Pedagógica y Tecnológica de Colombia por la financiación de este trabajo. A la Secretaría de Agricultura de Paipa y al CEGAP por su colaboración en la fase de campo. Al Herbario de la Universidad Pedagógica y Tecnológica de Colombia (UPTC) y al Herbario Nacional Colombiano (COL) por permitirnos el acceso a sus colecciones botánicas. Al profesor Julio Betancur y al biólogo Rafael Arévalo por su colaboración en la determinación de algunos ejemplares botánicos. Al profesor Daniel Galindo por su asesoría en el análisis estadístico de esta investigación. A tres evaluadores anónimos quienes revisaron el manuscrito e hicieron importantes sugerencias. A Ángela Parrado-Rosselli por la revisión y las valiosas sugerencias a este manuscrito.
LITERATURA CITADA
1. ÁLVAREZ, E. & A. LONDOÑO. 1996. Importancia ecológica y etnobotánica de las lianas en un bosque inundable de la Amazonia colombiana. Cespedesia 21(67): 373-390.
2. BOLLEN, A. & G. DONATI. 2005. Phenology of the littoral forest of Sainte Luce, southeastern Madagascar. Biotropica 37(1): 32-43.
3. BONILLA, M. & A. ZULOAGA. 1994. Fenología de algunas especies de plantas del páramo "El Granizo", Monserrate (Cundinamarca Colombia). Págs. 485-501 en: L.E. Mora-Osejo & H. Sturm (eds.), Estudios ecológicos del páramo y del bosque altoandino Cordillera Oriental de Colombia. Tomo II. Número 6. Academia Colombiana de Ciencias Exactas, Físicas y Naturales, Colección Jorge Álvarez Lleras, Bogotá D.C.
4. BORCHERT, R. 1983. Phenology and control of flowering in tropical trees. Biotropica 15(2): 81-89.
5. BROWN, A. & M. KAPPELLE. 2001. Introducción a los bosques nublados del neotrópico: una síntesis regional. Págs. 26-40 en: M. Kappelle & A. Brown (eds), Bosques nublados del neotrópico. Primera edición. Instituto Nacional de Biodiversidad, INBio, Santo Domingo de Meredia, Costa Rica.
6. CHAPMAN, C., R. WRANGHAM & L. CHAPMAN. 1994. Indices of habitat-wide fruit abundance in tropical forest. Biotropica 26(2): 160-171.
7. CHOO, J., R. VAZQUEZ & E. STILES. 2007. Diversity and abundance of plants with flowers and fruits from october 2001 to september 2002 in Paucarillo Reserve, northeastern Amazon, Peru. Rev. Peru. Biol. 14(1): 25-31.
8. DULMEN, A. 2001. Pollination and phenology of flowers in the canopy of two contrasting rain forest types in Amazonia, Colombia. Plant Ecology 153: 73-85.
9. DURÁN, S. & G. KATTAN. 2005. A test of the utility of exotic tree plantations for understory birds and food resources in the Colombian Andes. Biotropica 37(1): 129-135.
10. FEINSINGER, P. 1983. Coevolution and pollination. Págs. 282-310 en: D. Futuyma & M. Slatkin (eds), Coevolution. Sinauer Associates, Sunderland, Massachussets.
11. FLEMING, T. 1979. Do tropical frugivores compete for food? American Zoologist 19: 1157-1172.
12. FONT QUER, P. 2001. Diccionario de botánica. Segunda Edición. Ediciones Península, Barcelona.
13. FRANKIE, G., H. BAKER & P. OPLER. 1974. Comparative phenological studies of trees in tropical wet and dry forests in the lowlands of Costa Rica. Journal of Ecology 62: 881–919.
14. FUNCH, L., R. FUNCH & G. BARROSO. 2002. Phenology of gallery and montane forest in the Chapada Diamantina, Bahia, Brazil. Biotropica 34: 40-50.
15. GALEANO, G., S. SUÁREZ & H. BALSLEV. 1998. Vascular plant species count in a wet forest in the Chocó area on the Pacific coast of Colombia. Biodiversity and Conservation 7: 1563-1575.
16. GALINDO, T., J. BETANCUR & H. MENDOZA. 2006. Estructura y composición florística de los bosques de roble en dos parques nacionales naturales en la cordillera Oriental Colombiana. Págs. 95-100 en: C. Solano & N. Vargas (eds), Memorias I Simposio Internacional de Roble y Ecosistemas asociados. Fundación Natura, Pontificia Universidad Javeriana, Bogotá D.C.
17. GENTRY, A. & C. DODSON. 1987. Contribution to non trees to the species richness of a tropical rain forest. Biotropica 19: 149-156.
18. GONZÁLEZ, J. 2000. Monitoring cloud interceptation in a tropical montane cloud forest of the South western Colombian Andes. Advances in Environmental Monitoring and Modelling 1(1): 97-117.
19. GUTIÉRREZ, A. 2008. Las interacciones ecológicas y estructura de una comunidad altoandina de colibríes y flores en la cordillera oriental de Colombia. Ornitología Colombiana 7: 17-42.
20. GUTIÉRREZ, A. & S. ROJAS. 2001. Dinámica anual de la interacción cvolibrí flor en ecosistemas altoandinos del volcán Galeras, sur de Colombia. Tesis de pregrado. Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá D.C.
21. GUTIÉRREZ, A., S. ROJAS & G. STILES. 2004. Dinámica anual de la interacción colibrí-flor en ecosistemas altoandinos. Ornitología Neotropical 15(Suppl): 1-9.
22. HILTY, S. 1980. Flowering and fruiting periodicity in a premontane rain forest in Pacific Colombia. Biotropica 12(4): 292-306.
23. Holdridge, L., W. Grenke, W. Hatheway, T. Liang & J. Tosi. 1971. Forest environments in tropical life zones a pilot study. Pergamon press, Oxford.
24. IDEAM, 1967-2007. Datos meteorológicos de la Estación la Sierra, Colombia.
25. KEARNS, C. & D. INOUYE. 1993. Techniques for pollination biologist. University Press of Colorado. Niwet, Colorado.
26. KODRIC-BROWN, A., J.H. BROWN, G.S. BYERS & D.F. GORI. 1984. Organization of a tropical island community of hummingbirds and flowers. Ecology 65(5): 1358-1368.
27. MALIZIA, L.R. 2001. Seasonal fluctuations of birds, fruits, and flowers in a subtropical forest of Argentina. The Condor 103: 45-61.
28. MORA-OSEJO, L., H. ARENAS, N. BECERRA & B. GUTIÉRREZ. 1994. La regulación de la transpiración momentánea en plantas del páramo por factores endógenos y ambientales. Págs. 89-151 en: L.E. Mora-Osejo & H. Sturm (eds.), Estudios ecológicos del páramo y del bosque altoandino Cordillera Oriental de Colombia. Tomo II. Número 6. Academia Colombiana de Ciencias Exactas, Físicas y Naturales, Colección Jorge Álvarez Lleras, Bogotá D.C.
29. MORELLATO, L. & M. SAZIMA. 1992. Modos de polinizaçâo em uma floresta semidecídua no sudeste do Brasil (Reserva de Santa Genebra, Campinas, SP). Resumos Seminário Mata de Santa Genebra-conservaçâo e pesquisa em uma reserva florestal urbana em Campinas, Campinas. 13pp.
30. MORENO, C.E. 2001. Métodos para medir la biodiversidad. M&T-Manuales y Tesis SEA, col.1. Zaragoza.
31. NEWSTROM, L., G. FRANKIE & H. BAKER. 1994. A new classification for plant phenology based on flowering patterns in lowland tropical rain forest trees at La Selva, Costa Rica. Biotropica 26: 141-159.
32. OLDEMAN, R. 1990. Forests: Elements of silvology. Springer, Berlín.
33. PARRADO-ROSELLI, A. 2005. Fruit Availability and seed dispersal in terra firme rain forest of Colombian Amazonia. Tropenbos Internacional. PhD. Thesis University of Amsterdam. Amsterdam.
34. RATHCKE, B. & E. LACEY. 1985. Phenological Patterns of terrestrial plants. Annual Reviews Ecol. Syst. 16: 179-214.
35. ROJAS, S. 2005. Ecología de la comunidad de pinchaflores (Aves: Diglossa y Diglossopis) en un bosque altoandino. Tesis de maestría. Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá D.C.
36. ROSERO, L (ed.). 2010. Estudios ecológicos en el Parque Natural Municipal Ranchería, un aporte para su conservación. Universidad Pedagógica y Tecnológica de Colombia, CORPOBOYACÁ, Tunja, Colombia.
37. ROSERO, L., D. TOLOZA, D. LEÓN, L. ORTIZ, A. UMBA & A. PRADA. 2010. Evaluación ecológica de las aves de los estratos bajos del Parque. Págs.135-170 en: L. Rosero (ed.), Estudios ecológicos en el Parque Natural Municipal Ranchería, un aporte para su conservación. Universidad Pedagógica y Tecnológica de Colombia, CORPOBOYACÁ, Tunja.
38. SÁNCHEZ, E. & G. CELY 2003. Evaluación del estado de conservación de la vegetación de la Reserva Ranchería, Paipa-Boyacá. Tesis de grado. Escuela de Ciencias Biológicas. Facultad de Ciencias Básicas. Universidad Pedagógica y Tecnológica de Colombia. Tunja.
39. SCHNITZER, S. & F. BONGERS. 2002. The ecology of lianas and their role in forests. Trends in Ecology & Evolution 17(5): 223-230.
40. SKUTCH, A.F. 1950. The nesting seasons of Central American birds in relation to climate and food supply. Ibis 92:182-222.
41. SOKAL, R. & F. ROHLF. 1981. Biometry. Segunda edición. W. H. Freeman, San Francisco.
42. STEVENSON, P. 2004. Phenological patterns of woody vegetation al Tinigua Park, Colombia: Methodological comparisons with emphasis on fruit production. Caldasia 26(1): 125-150.
43. STEVENSON, P.R., M.C. CASTELLANOS, A.I. CORTÉS & A. LINK. 2008. Flowering patterns in a seasonal tropical lowland forest in western Amazonia. Biotropica 40(5): 559-567.
44. STILES, G. 1977. Coadapted competitors: the flowering seasons of hummingbird-pollinated plants in a tropical forest. Science 198: 1170-1178.
45. STILES, G. 1978. Temporal organization of flowering among the hummingbirds food plants of a tropical wet forest. Biotropica 10(3): 194-210.
46. STILES, G. 1979. El ciclo anual en una comunidad coadaptada de colibríes y flores en el bosque tropical muy húmedo de Costa Rica. Rev. Biol. Trop. 27(1): 75-101.
47. STILES, G. 1985. Seasonal patterns and coevolution in the hummingbird-flower community of a Costa Rican subtropical forest. Ornithological Monographs 36: 757-787.
48. STURM, H. 1994. Suelo. Págs. 35-46 en: L.E. Mora-Osejo & H. Sturm (eds.), Estudios ecológicos del páramo y del bosque altoandino Cordillera Oriental de Colombia. Tomo II. Número 6. Academia Colombiana de Ciencias Exactas, Físicas y Naturales, Colección Jorge Álvarez Lleras, Bogotá D.C.
49. TERBORGH, J. 1977. Bird species diversity on an Andean elevational gradient. Ecology 58(5): 1007-1019.
50. TOLOZA-MORENO, D. & D. LEÓN-CAMARGO. 2009. Ciclo anual de los colibríes y su interacción con las plantas ornitófilas en el Parque Natural Municipal Ranchería, Paipa-Boyacá (Colombia). Tesis de grado. Escuela de Ciencias Biológicas. Facultad de Ciencias Básicas. Universidad Pedagógica y Tecnológica de Colombia. Tunja, Colombia.
51. VAN DER PIJL, L. 1961. Ecological aspects of flower evolution. II. Zoophilous flower classes. Evolution 15(1): 44-59.
52. VAN SCHAIK, C., J. TERBORGH & S. WRIGHT. 1993. The phenology of tropical forests: adaptive significance and consequences for primary consumers. Annual Review of Ecology and Systematics 24: 353-377.
53. VELASCO-LINARES, P. & O. VARGAS. 2008. Problemática de los bosques altoandinos. Págs. 41-56 en: J.O. Vargas-Ríos (ed.), Estrategias para la restauración ecológica del bosque altoandino: el caso de la Reserva Forestal Municipal de Cogua, Cundinamarca. Universidad Nacional de Colombia, Bogotá D.C.
54. WOLF, L., F. STILES & F. HAINSWORTH. 1976. Ecological organization of a tropical highland hummingbirds community. Journal of Animal Ecology 32: 349-379.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Article abstract page views
Downloads
License
Copyright (c) 2012 Caldasia

This work is licensed under a Creative Commons Attribution 4.0 International License.
Authors who publish with this journal agree to the following terms:
- Authors retain copyright and grant the journal right of first publication with the work simultaneously licensed under a Creative Commons Attribution License that allows others to share the work with an acknowledgement of the work's authorship and initial publication in this journal.
- Authors are able to enter into separate, additional contractual arrangements for the non-exclusive distribution of the journal's published version of the work (e.g., post it to an institutional repository or publish it in a book), with an acknowledgement of its initial publication in this journal.
- Authors are permitted and encouraged to post their work online (e.g., in institutional repositories or on their website) prior to and during the submission process, as it can lead to productive exchanges, as well as earlier and greater citation of published work (See The Effect of Open Access).





























