EVALUACIÓN DE LA PRODUCCIÓN DE ETANOL UTILIZANDO CEPAS RECOMBINANTES DE Saccharomyces cerevisiae A PARTIR DE MELAZA DE CAÑA DE AZÚCAR
Palabras clave:
Saccharomyces cerevisiae recombinante, gen pdc, gen adhII, Zymomonas mobilis, etanol. (es)EVALUACIÓN DE LA PRODUCCIÓN DE ETANOL UTILIZANDO CEPAS RECOMBINANTES DE Saccharomyces cerevisiae A PARTIR DE MELAZA DE CAÑA DE AZÚCAR
EVALUATION OF ETHANOL PRODUCTION USING RECOMBINANT STRAINS OF Saccharomyces cerevisiae FROM SUGAR CANE MOLASSES
CAROLINA PEÑA
Corporación para
Investigaciones Biológicas-CIB, investigador Unidad Biotecnología Vegetal, cpena@cib.org.co
RAFAEL ARANGO
Médico, PhD, Corporación para Investigaciones Biológicas-CIB, Jefe
Unidad Biotecnología Vegetal, rarango@cib.org.co
Recibido para revisar mayo 29 de 2008, aceptado noviembre 21 de 2008, versión final diciembre 12 de 2008
RESUMEN: Se evaluó la producción de etanol, el crecimiento celular y el consumo de sustrato de tres cepas de Saccharomyces cerevisiae: CBS8066 (control) y dos recombinantes desarrolladas en la Unidad de Biotecnología Vegetal de CIB, GG570-CIBI y GG570-CIBII. Dichas cepas estuvieron bajo el efecto de dos concentraciones de sacarosa (170 y 250g/L) y dos sustratos (industrial con melaza caña azúcar y sintético con sacarosa).
Durante la fermentación en sustrato industrial se obtuvo mayor producción de etanol a concentración de 250g sacarosa/L. Bajo estas condiciones, la cepa GG570-CIBII produjo en promedio 2,34g etanol/L mas con respecto a la cepa control y en adición, a las 10h, produjo 8,02g/L por encima de la cepa control. Por otro lado, la cepa GG570-CIBI produjo 3,46g etanol/L menos que la cepa control.
De esta forma, se encontró que la cepa GG570-CIBII es tolerante a alta concentración de sacarosa, y además, es capaz de producir una concentración mayor de etanol con respecto a la cepa control en melaza caña azúcar con 250g/L sacarosa.
PALABRAS CLAVE: Saccharomyces cerevisiae recombinante, gen pdc, gen adhII, Zymomonas mobilis, etanol.
ABSTRACT: The Ethanol production, cellular growth and substrate consumption of three Saccharomyces cerevisiae strains: CBS8066 (control) and two recombinant CIB, GG570-CIBI and GG570-CIBII were evaluated under the effect of two sucrose concentrations (170 and 250g/L) and two substrates: industrial with sugar cane molasses and synthetic with sucrose.
During the fermentative process on industrial substrate the major ethanol production was obtained at a sucrose concentration of 250g/L. Under these conditions, strain GG570-CIBII produced greater ethanol concentrations than control strain, reaching an average of 2,34 g/L, in addition, at 10h of fermentation, GG570-CIBII strain produced 8,02 g/L ethanol above control strain. On the other hand, strain GG570-CIBI produced 3,46 g/L ethanol less than control strain.
In this way, strain GG570-CIBII cultivated on sugar cane molasses at a sucrose concentration of 250 g/L was tolerant to high sucrose concentration, and besides, this strain was capable of producing greater ethanol concentrations than control strain.
KEYWORDS: recombinant Saccharomyces cerevisiae, pdc gene, adhII gene, Zymomonas mobilis, ethanol.
1. INTRODUCCIÓN
Actualmente, el bioetanol es producido por fermentación alcohólica de los azúcares presentes en materiales renovables [1, 2]. Dicha fermentación está influenciada por factores como la concentración de azúcares del sustrato y el microorganismo fermentador que se emplee.
De acuerdo con reportes previos [3, 4] cuando S. cerevisiae se encuentra cultivada a altas concentraciones de azúcar (menores a 30 – 40%) se incrementa la producción de etanol.
Adicionalmente, cuando S. cerevisiae se encuentra bajo condiciones de alta concentración de oxígeno disuelto [5] y la concentración de azúcares supera 0,16g/L [6] o 9g/L [7], la levadura convierte su metabolismo oxidativo a oxidoreductivo o fermentativo incrementandose la producción de etanol. Dicho fenómeno se conoce como efecto Crabtree.
Las enzimas piruvato descarboxilasa (pdc) y alcohol deshidrogenasa (adh) están presentes en microorganismos etanologénicos como Saccharomyces cerevisiae y Zymomonas mobilis. Dichas enzimas son claves en la producción de etanol [8] y presentan algunas diferencias de acuerdo con el microorganismo. Se ha encontrado que las enzimas de Z. mobilis presentan mayor afinidad por sus respectivos sustratos [9], por lo cual Z. mobilis produce mayor rendimiento de etanol comparado con S. cerevisiae con valores de 0,49 y 0,46g/g respectivamente, en medio de cultivo con 100g/L de glucosa, 200rpm, pH 5 y 30ºC [10].
Aún cuando el rendimiento de etanol de Z. mobilis es mayor, la presencia de sales en medios de uso industrial como la melaza de caña de azúcar inhibe la producción de etanol [8]. Por tal razón, S. cerevisiae continua siendo el microorganismo usado industrialmente pero para mejorar su rendimiento, se ha explorado la posibilidad de crear cepas modificadas genéticamente que permitan incrementar el rendimiento de etanol.
En este trabajo, se evaluó la producción de etanol de dos cepas de S. cerevisiae modificadas genéticamente por inserción de genes optimizados pdc y adhII de Z. mobilis creadas en la Unidad de Biotecnología Vegetal de la CIB, cultivadas bajo el efecto de dos sustratos y dos concentraciones de sacarosa.
En un trabajo previo, la cepa GG570-CIBII mostró un incremento del 40% (con respecto a la cepa control) en la producción de etanol en un sustrato sintético con glucosa como fuente de carbono [11].
2. MATERIALES Y MÉTODOS
2.1 Microorganismo
de estudio
Saccharomyces cerevisiae, cepa CBS8066 (parental) la cual será
nombrada como cepa control, cepa GG570-CIBI (con gen pdc de Z. mobilis) llamada como cepa 4,2 y cepa GG570-CIBII (con genes pdc y adhII de Z. mobilis) denominada como cepa 9,1.
2.2 Medios
de cultivo
Se utilizó como sustrato sintético el medio de
cultivo YPS modificado con: sacarosa 170 ó 250g/L, KH2PO4 (99.3%, Sigma®, Japón) 1 g/L, MgSO4.7H2O (99%, J.T.Baker,
Deventer, Holanda) 0.5 g/L, Bacto TM peptona (Becton, Dickinson and company, Le
Pont de Claix, France) 10 g/L y extracto de levadura (Oxoid, Hampshire,
England) 5 g/L.
Como sustrato industrial se usó melaza de caña de azúcar (35% sacarosa, Ingenio Central Tumaco, Palmira, Colombia) diluida hasta la concentración de sacarosa requerida, filtrada y suplementada con: 1g/L (NH4)2SO4 (99.1%, J.T.Baker, Deventer, Holanda) 0.5g/L MgSO4.7H2O (99%, J.T.Baker, Deventer, Holanda) 1g/L KH2PO4 (99.3%, Sigma®, Japón) [12 – 14].
2.3 Condiciones
de cultivo y preparación de preinóculo
Se realizaron fermentaciones sin
suplementación de oxígeno, por un período de 30h, con toma de muestra cada 5h, en erlenmeyer de 500mL con 300mL de medio de
cultivo, en agitador orbital a
30°C, 150rpm y pH inicial 5.
Se preparó un preinóculo tomando una colonia de la caja petri, se cultivó en 50mL de medio de cultivo YPD 10% glucosa anhidra (99.5%, Sigma®, St. Louis, USA) y se dejó incubando por 24h a 30ºC, 150rpm y pH 5. Posteriormente, se midió DO660 hasta alcanzar 1.6 y se procedió a inocular los erlenmeyers de fermentación con 2% v/v [15, 16]. Las variables estudiadas fueron:
- Cepa de S. cerevisiae: CBS8066, GG570-CIBI y GG570-CIBII.
- Concentración inicial de sacarosa: 170 y 250g/L
- Sustrato: industrial (melaza de caña de azúcar) y sintético (medio YPS).
2.4 Evaluación
del crecimiento celular]
Se hizo seguimiento al
crecimiento celular por el método de peso seco, el cual se desarrollo en la
forma que a continuación se explica.
Se tomó 1mL de suspensión celular de cada erlenmeyer, en un tubo eppendorff de 1,5mL, posteriormente se sometió a centrifugación a 12000rpm a 4ºC durante 6min, luego se descartó el sobrenadante y se procedió a resuspender el pellet en agua destilada para repetir el proceso de centrifugación a las mismas condiciones. La resuspensión del pellet se repitió dos veces. Finalmente, se eliminó el sobrenadante y se sometió el pellet húmedo a secado en horno a 80ºC por 24h o hasta que el peso fuera constante.
2.5 Evaluación del consumo de
sustrato
El contenido de azúcares
reductores se determinó por el método del Ácido Dinitro Salicílico (DNS) [17], el
cual cuantifica de forma indirecta el consumo de sustrato.
La cuantificación de sacarosa se realizó luego de la hidrólisis con HCl al 10% a 95ºC usando DNS [18].
2.6 Evaluación de la concentración de etanol
El seguimiento a la producción de etanol se
llevó a cabo mediante cuantificación por cromatografía de gases [16, 19, 20],
en un equipo marca Agilent modelo 6890 con detector de masas modelo 5973 y
automuestreador.
Las condiciones del equipo fueron establecidas así: volumen de inyección de 1mL, temperatura del inyector: 150ºC y split 50:1, flujo de columna: 1,1mL/min, temperatura de columna: 70ºC/5min, columna DBwax 30m x 0,25mm x 0,25mm, temperatura del detector: 200ºC y gas de arrastre helio.
2.7 Determinación de parámetros cinéticos
Tasa específica de crecimiento (mx) en la fase exponencial de
crecimiento, el cual será aproximadamente igual a mmax [21]:
m es constante cuando se encuentra en la fase de crecimiento exponencial, por tanto, la ecuación se puede integrar.
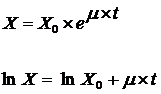
Donde
X=concentración celular en tiempo (t)
X0=concentración celular tiempo (t=0)
m = tasa específica de crecimiento celular, considerada mmax en fase de crecimiento exponencial.
Los rendimientos observados de sustrato en biomasa (Y’x/s) y de sustrato en producto (Y’p/s) se calcularon mediante la gráfica crecimiento celular vs consumo de sustrato y producción de etanol vs consumo de sustrato, cuyas pendientes son Y’x/s y Y’p/s respectivamente [21].
2.8 Análisis estadístico
Se utilizó un diseño tipo
factorial completamente aleatorio 3x22. Cada tratamiento se realizó
por triplicado. Los resultados de los experimentos fueron evaluaron mediante
análisis de varianza (ANOVA) con el paquete estadístico SAS para windows,
versión
8 a
un nivel de confianza del 95%.
3. RESULTADOS
3.1 Evaluación del crecimiento celular
Los valores máximos de crecimiento a 170g/L de
sacarosa se encontraron entre 8,5 – 11,5g/L para melaza
y 10,2 – 11,9g/L para medio YPS. De igual forma a
250g/L los mayores crecimientos fueron 9 – 14,8g/L en melaza y entre 15
– 16,5g/L para el medio YPS (Figura 1).

Figura 1. Evaluación de la
cinética de crecimiento celular. Crecimiento celular a 170g sacarosa/L en
melaza (a), 250g sacarosa/L en melaza (b), 170g sacarosa/L en YPS (c) y 250g
sacarosa/L en YPS (d)
Figure 1. Evaluation of the cellular
growth kinetic. Cellular growth in molasses 170g sucrose/L (a), molasses 250g sucrose/L
(b), YPS 170g sucrose/L (c) and YPS 250g sucrose/L (d)
3.2 Evaluación
del consumo de sustrato
Los resultados obtenidos no
mostraron diferencia significativa en el consumo de azúcar en las tres cepas de S. cerevisiae evaluadas (Figura 2).
Sin embargo, cuando se comparó el consumo a 170 y 250g/L de sacarosa se
determinó mayor consumo bajo la influencia de la primera condición que en la
segunda, ya que a 170g/L la sacarosa residual estuvo alrededor de 30g/L
mientras a 250g/L fue superior a 180g/L.
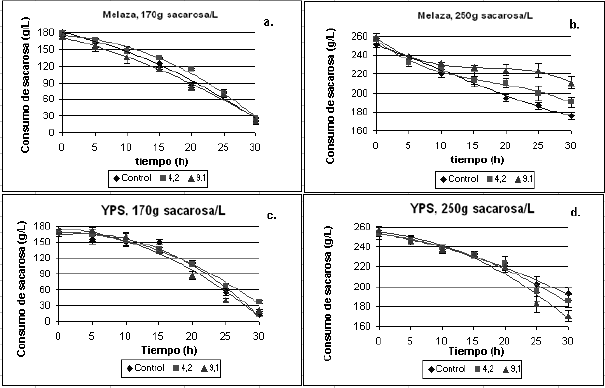
Figura 2. Evaluación de la cinética de consumo de
sustrato. Consumo de sustrato a 170g sacarosa/L en melaza (a), 250g sacarosa/L
en melaza (b), 170g sacarosa/L en YPS (c) y 250g sacarosa/L en YPS (d)
Figure 2.
Evaluation of the substrate consumption kinetic. Substrate consumption in
molasses 170g sucrose/L (a), molasses 250g sucrose/L (b), YPS 170g sucrose/L
(c) and YPS 250g sucrose/L (d)
3.3 Evaluación
de la producción de etanol
En las Gráfica 1 se puede
observar que cuando hay mayor concentración de sacarosa (Figura 3b y 3d) hay
incremento en la producción de etanol para las cepas evaluadas.
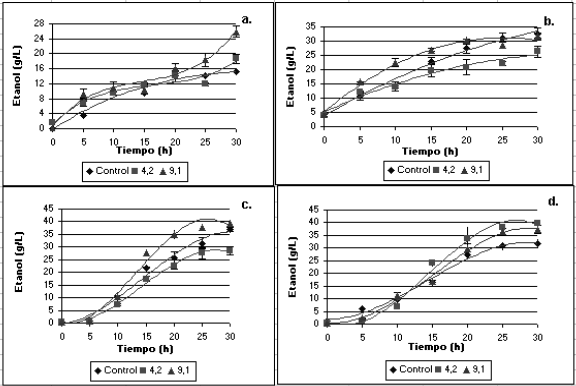
Figura 3. Evaluación de la cinética de producción de
etanol. Producción de etanol a 170g sacarosa/L en melaza (a), 250g sacarosa/L
en melaza (b), 170g sacarosa/L en YPS (c) y 250g sacarosa/L en YPS (d)
Figure 3. Evaluation of the ethanol
production kinetic. Ethanol production in molasses 170g sucrose/L (a), molasses
250g sucrose/L (b), YPS 170g sucrose/L (c) and YPS 250g sucrose/L (d)
Cuando S. cerevisiae estuvo cultivada en melaza, la mayor producción fue de 25g etanol/L a 170g/L de sacarosa con la cepa 9.1 (Figura 3a). En el mismo sustrato a 250g/L de sacarosa (Figura 3b) dicha cepa produjo 31g/L de etanol.
De igual forma, bajo el efecto del sustrato sintético y una concentración de sacarosa de 170g/L (Figura 3c) la cepa 9.1 produjo la mayor concentración de etanol (39,36g/L). En este mismo medio a una concentración de 250g sacarosa/L (Figura 3d) la cepa más productora fue la 4.2 con 39,89g etanol/L.
El análisis de varianza realizado mostró que todos los factores evaluados y sus respectivas interacciones tienen efecto estadísticamente significativo sobre la producción de etanol.
3.4 Parámetros cinéticos
Según los resultados mostrados en
la Tabla 1, se encontraron
mayores mmax cuando las cepas estuvieron cultivadas en medio YPS,
con excepción de la cepa
9.1 a
250g sacarosa/L. Además, a menor concentración inicial de azúcar, mmax fue mayor, exceptuando la cepa 9.1 cultivada en melaza.
Tabla 1. Parámetros cinéticos calculados para S. cerevisiae
Table 1. Calculated kinetic
parameters for S. cerevisiae
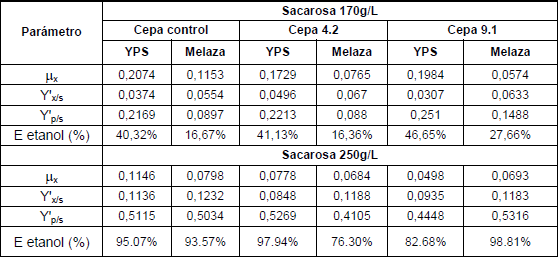
Se determinó mayor rendimiento de azúcar en biomasa en el medio de cultivo melaza y también, cuando la concentración de azúcar fue 250g/L los Y’x/s estuvieron por encima de 0,085g biomasa/g azúcar comparado con los rendimientos inferiores a 0,07g/g obtenidos a 170g/L de sacarosa.
Se encontró que en cualquiera de los dos medios de cultivo utilizados, los rendimientos de etanol fueron superiores a 0,41g etanol/g sacarosa cuando la concentración de azúcar fue mayor, comparado con los Y’p/s por debajo de 0,25g/g a 170g sacarosa/L. También se puede ver que los rendimientos de etanol son mayores cuando se emplea medio YPS independientemente de la concentración inicial de sacarosa. Sin embargo, la cepa recombinante 9.1 presentó mayor rendimiento en melaza con un valor de 0,5316g/g. Se encontró que una concentración de sacarosa mayor hace mucho más eficiente la producción de etanol a partir de las cepas recombinantes de S. cerevisiae con eficiencias superiores a 76% para cualquiera de los sustratos evaluados, mientras a 170g azúcar/L la eficiencia no supera el 47%.
4. DISCUSIÓN
En le presente trabajo, se evaluó la influencia de la concentración de azúcar y el sustrato de fermentación sobre el crecimiento celular, el consumo de sustrato y la producción de etanol de tres cepas de S. cerevisiae, CBS 8066, G570-CIBI y GG570-CIBII.
4.1 Evaluación
de la producción de etanol
Si se comparan los sustratos
utilizados, melaza (Gráfica 1a y 1b) y sacarosa comercial (Gráfica 1c y 1d) se
puede observa que hubo mayor concentración de etanol cuando se utilizó sustrato
sintético. Sin embargo, se podría sugerir que este comportamiento es debido a
la mejor suplementación del medio sintético o como consecuencia de alguna
sustancia inhibitoria presente en la melaza [6] que afecte a S. cerevisiae.
Adicionalmente, con ambos sustratos la producción de etanol incrementa con el aumento en la concentración de azúcar (Gráfica 1b y 1d), por ello se descarta una inhibición en la producción de etanol de las cepas recombinantes por exceso de sustrato y se sugiere, que bajo condiciones de alta concentración de azúcar y en presencia de oxigeno (efecto Crabtree) [4, 22, 23], estas cepas convierten su metabolismo respiratorio a metabolismo fermentativo.
En un estudio previo realizado por [4] con la cepa GR203 de S. cerevisae en medio sintético se encontró que la producción de etanol fue de 31,5g/L (a las 28,5h) y 21,25g/L (a las 25h) a 200 y 300g sacarosa/L respectivamente. Esto muestra una disminución en la producción al incrementar la concentración de azúcar. Las cepas recombinantes evaluadas en este trabajo mostraron un efecto contrario al reportado para la cepa GR203, a las 30h de fermentación en medio de cultivo YPS con 170g/L de sacarosa, en el cual, la cepa 9.1 produjo una concentración de etanol de 39,36g/L, la cual es mayor que la obtenida por la cepa GR203 de 31,5g/L.
De igual forma a 250g/L de sacarosa y 25h de fermentación las cepas 4.2 y 9.1 produjeron etanol en concentraciones de 39,88 y 37,37g/L valores que son mayores al producido por la cepa GR203. Estos datos sugieren que las cepas recombinantes 4.2 y 9.1 son tolerantes a altas concentraciones de sacarosa y además, bajo condiciones similares producen mayores concentraciones de etanol.
[13] reportaron para la cepa ATCC 29191 de Z. mobilis cultivada en melaza de caña de azúcar una concentración de etanol de 2,94 y 12,2g/L a 150 y 250g/L de sacarosa respectivamente, a las 24h de fermentación, 180rpm y 25°C. Por otro lado, cuando la cepa recombinante 4,2 estuvo cultivada en melaza produjo a las 25h 11,86 y 22,18g etanol/L a 170 y 250g sacarosa/L respectivamente, mientras la cepa 9,1 presentó 18,4 y 28,67g etanol/L a 170 y 250g sacarosa/L respectivamente.
Lo anterior demuestra una mayor producción de etanol por parte de S. cerevisiae recombinante que Z. mobilis al estar cultivadas en melaza, sin embargo, ambos microorganismos mostraron incrementar la producción de etanol al aumentar la concentración de sacarosa.
4.2 Evaluación de parámetros cinéticos
Se ha reportado [22] que cuando la cepa NRRL Y132 de S. cerevisiae fue cultivada en medio
sintético con glucosa, los Y’x/s alcanzados fueron
aproximadamente 0,095 y 0,06g biomasa/g glucosa a 170 y 250g glucosa/L
respectivamente, indicando que a mayor concentración inicial de glucosa el
microorganismo disminuye la conversión de sustrato en biomasa. Este
comportamiento es contrario al presentado por las cepas recombinantes 4.2 y 9.1
dado que a mayor concentración de azúcar hubo mayor rendimiento, según lo
reportado en
la Tabla
1.
Los rendimientos de etanol de las cepas recombinantes de S. cerevisiae bajo la influencia de sustrato melaza y 250g/L de sacarosa fueron 0,4105g/g para la cepa 4.2 y 0,5316g/g para la cepa 9.1. Dichos Y’p/s son superiores a los reportados por [13] para Z. mobilis con un valor de 0,29g/g al estar cultivada en melaza y 270g/L de fuente de carbono.
Adicionalmente, se pudo observar que cuando hubo una concentración de 170g sacarosa/L las cepas evaluadas disminuyen la eficiencia en la conversión de sacarosa a etanol cuando están cultivadas en medio melaza. Ésto podría explicarse a través del cambio a metabolismo fermentativo sufrido por S. cerevisiae al incrementar la concentración de azúcar como consecuencia del efecto Crabtree.
De igual forma, bajo una condición de alta concentración de sacarosa (250g/L) la eficiencia alcanzada por las cepas es mayor en YPS, con excepción de la cepa 9.1.
La cepa recombinante 9.1 presentó la mayor eficiencia, bajo todas las condiciones evaluadas (con excepción del tratamiento YPS, 250g sacarosa/L), siendo la máxima eficiencia de 98.81% en melaza, 250g/L sacarosa, que es significativa e indica que la cepa casi logra alcanzar la conversión teórica de sacarosa en etanol.
5. CONCLUSIONES
En sustrato industrial se obtuvo mayor producción de etanol a una concentración de sacarosa de 250g/L. Bajo estas condiciones, la cepa recombinante 9.1 produjo en promedio 2,34 g/L mas con respecto a la cepa control y en adición, a las 10h de fermentación, dicha cepa produjo 8,02 g/L etanol por encima de la cepa control.
Cuando se utilizó sustrato sintético (medio YPS) se encontró que a 250g/L de fuente de carbono hubo mayor producción de etanol con valores máximos de 32 a 40g etanol/L.
Se alcanzaron rendimientos de sustrato en etanol más altos a 250g azúcar/L, obteniéndose mayor rendimiento con la cepa recombinante 9.1 cultivada en melaza, seguida de la cepa recombinante 4.2 en medio YPS. Bajo estas condiciones, las eficiencias alcanzadas por las cepas fueron 98.81% y 97.94%, respectivamente.
REFERENCIAS
[1] FEDERACIÓN NACIONAL DE BIOCOMBUSTIBLES. ABC de los Alcoholes Carburantes. Disponible en: http://www.minminas.gov.co/minminas/sectores.nsf/2a84e89f4d73f130052567be0052c75a/ffdff1b298ac766a052571720071cfad?OpenDocument. [Citado 27 Mayo de 2007]
[2] SOLICLIMA ENERGÍA SOLAR. El etanol como biocombustible. Disponible en: http://news.soliclima.com/modules.php?name=Content&pa=showpage&pid=118. [Citado 20 Mayo de 2007]
[3] HOLCBERG, I. B. AND MARGALITH, P. Alcoholic Fermentation by Immobilized Yeast at High Sugar Concentrations. European J Appl Microbiol Biotechnol, 13, 133 140, 1981.
[4] CONVERTI, A. PEREGO, P. LODI, A. PARISI, F. AND DEL BORGHI, M. A Kinetic Study of Saccharomyces Strains: Performance at High Sugar Concentrations. Biotechnology and Bioengineering, 27, 1108 1114, 1985.
[5] GONZÁLEZ, R. BARCENILLA, J Y TABERA, L. Cepas vínicas de Saccharomyces cerevisiae con bajo rendimiento en etanol. Revista de Enología, 86, 2007.
[6] ERTOLA, R. YANTORNO, O. AND MIGONE, C. Programa Regional de Desarrollo Científico y Tecnológico de la OEA. Disponible en: http://fai.unne.edu.ar/biologia/microind/levaduras.htm. [Citado 20 Mayo de 2007]
[7] HIDALGO, J. Tratado de enología, tomo I. Ediciones Mundi-Prensa, Madrid, 2003.
[8] GUNASEKARAN, P. AND CHANDRA RAJ, K. Ethanol fermentation technology Zymomonas mobilis. Current Science, 77, 56-68, 1999.
[9] BRENDAThe Comprehensive Enzyme Information System. Disponible en: http://www.brenda.uni-koeln.de. [Citado 16 Mayo de 2007]
[10] DAVIS, L. ROGERS, P. PEARCE, J. AND PEIRIS, P. Evaluation of Zymomonas based ethanol production from a hydrolysed waste starch stream. Biomass and Bioenergy, 30, 809-814, 2006.
[11] VÁSQUEZ, J. CASTAÑO, H. MARÍN, P. RODRIGUEZ, E Y ARANGO, R. Ingeniería genética en rutas metabólicas de Saccharomyces cerevisiae para incrementar la productividad de etanol. Memorias 6° Simposio Internacional de Alcoholes y Levaduras, 2007. Bogotá, Colombia, Junio 2007.
[12] NAVARRA, A. SEPULVEDA, M. AND RUBIO, M. Bioconcentration of vinasse from the alcoholic fermentation of sugar cane molasses. Waste Management 20, 581-585, 2000.
[13] CAZETTA, M. CELLIGOI, M. BUZATO, J. AND SCARMINO, J. Fermentation of molasses by Zymomonas mobilis: Effects of temperature and sugar concentration on ethanol production, Bioresource Technology, 98, 2824 2828, 2007.
[14] DE OLIVEIRA, M. DA SILVA, R. BUZATO, J. AND CELLIGOI, M. Study of levan production by Zymomonas mobilis using regional low-cost carbohydrate sources. Biochemical Engineering Journal, 37, 177 183, 2007.
[15] MOJOVIC, L. NIKOLIC, S. RAKIN, M. VUKASINOVIC, M. Production of bioethanol from corn meal hydrolyzates. Fuel, 85, 17501755, 2006.
[16] GOVINDASWAMY, S. AND VANE, L. Kinetics of growth and ethanol production on different carbon substrates using genetically engineered xylose-fermenting yeast. Bioresource Technology, 98, 677-685, 2007.
[17] MILLER, G.L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal. Chem. 1959. 31, 426±428
[18] ERGUN, M AND MUTLU, S.F. Application of a statistical technique to the production of ethanol from sugar beet molasses by Saccharomyces cerevisiae. Bioresource Technology, 73, 251 255, 2000.
[19] ZHU, S. WU, Y. YU, Z. ZHANG, X. WANG, C. YU, F. JIN, S. Production of ethanol from microwave-assisted alkali pretreated wheat straw. Process Biochemistry, 41, 869873, 2006.
[20] PLEASSAS, S. BEKATOROU, A. KOUTINAS, A. SOUPIONI, M. BANAT, I. MARCHANT, R. Use of Saccharomyces cerevisiae cells immobilized on orange peel as biocatalyst for alcoholic fermentation. Bioresource Technology, 98, 860 865, 2007.
[21] DORAN, P. Bioprocess Engineering Principles. Academic Press. Londres, Inglaterra. 1995.
[22] THATIPAMALA, R. ROHANI, S. AND HILL, G.A. Effects of high product and substrate inhibition on the kinetics and biomass and products yields during ethanol batch fermentation. Biotechnology and bioengineering, 40, 289 297, 1992.
[23] LEI, F. ROTBOLL, M. AND JORGENSEN, S. B. A biochemically structured model for Saccharomyces cerevisiae. Journal of Biotechnology 88, 205 221, 2001.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2009 DYNA

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
El autor o autores de un artículo aceptado para publicación en cualquiera de las revistas editadas por la facultad de Minas cederán la totalidad de los derechos patrimoniales a la Universidad Nacional de Colombia de manera gratuita, dentro de los cuáles se incluyen: el derecho a editar, publicar, reproducir y distribuir tanto en medios impresos como digitales, además de incluir en artículo en índices internacionales y/o bases de datos, de igual manera, se faculta a la editorial para utilizar las imágenes, tablas y/o cualquier material gráfico presentado en el artículo para el diseño de carátulas o posters de la misma revista.

















