HIDROGENACIÓN DE FURFURAL SOBRE CATALIZADORES Ir/Nb2O5. ESTUDIO CINÉTICO
Se estudió la cinética de hidrogenación de furfural sobre el catalizador Ir/Nb2O5 que presenta el efecto SMSI (Fuerte interacción metal soporte). Se examinaron el efecto de diferentes parç–¥etros de reacción como concentración inicial en el rango de 0,025 a 0,1 M, presión parcial en el rango de 0,48 MPa a 0,98 Mpa, temperatura de 353 a 393 K y peso del catalizador de 0,1 a 0,4 g. Se encontró una alta selectividad hacía el alcohol insaturado, (alcohol furfuríico), que es el producto más importante de esta reacción. Solventes alcohólicos producen trazas de acetales, especialmente de 2,6 dietil-acetal. Las velocidades iniciales de la hidrogenación de furfural con respecto al estudio de la presión y concentración se incrementaron linealmente con la masa del catalizador, lo que demuestra la ausencia de fenómenos de transporte. La cinética de la reacción se representó con un modelo Langmuir-Hinshelwood (LH) con un solo tipo de sitio activo. La adición de un átomo de hidrógeno sobre la molécula orgánica demostró ser la etapa determinante de la reacción, ajustándose a los datos experimentales.
HIDROGENACIÓN DE FURFURAL SOBRE CATALIZADORES Ir/Nb2O5. ESTUDIO CINÉTICO
HYDROGENATION OF FURFURAL ON Ir/Nb2O5 CATALYST STUDY KINETIC
HUGO ROJAS
Escuela de Ciencias Químicas, Grupo de
Catálisis, Universidad Pedagógica y Tecnológica de Colombia, Tunja Colombia hurojas@udec.cl
GLORIA
BORDA
Escuela de Ciencias Químicas, Grupo de Catálisis,
Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia
DUNIA ROSAS
Escuela de Ciencias Químicas, Grupo de Catálisis, Universidad
Pedagógica y Tecnológica de Colombia, Tunja, Colombia
JOSÉ J. MARTÍNEZ
Escuela de Ciencias Químicas, Grupo de Catálisis, Universidad
Pedagógica y Tecnológica de Colombia, Tunja, Colombia
PATRICIO REYES
Facultad de Ciencias Químicas, Universidad de Concepción,
Chile
Recibido para revisar Agosto 14 de 2007, aceptado Enero 26 de 2008, versión final Febrero 07 de 2008
RESUMEN: Se estudió la cinética de hidrogenación de furfural sobre el catalizador Ir/Nb2O5 que presenta el efecto SMSI (Fuerte interacción metal soporte). Se examinaron el efecto de diferentes parámetros de reacción como concentración inicial en el rango de 0,025 a 0,1 M, presión parcial en el rango de 0,48 MPa a 0,98 Mpa, temperatura de 353 a 393 K y peso del catalizador de 0,1 a 0,4 g. Se encontró una alta selectividad hacía el alcohol insaturado, (alcohol furfurílico), que es el producto más importante de esta reacción. Solventes alcohólicos producen trazas de acetales, especialmente de 2,6 dietil-acetal. Las velocidades iniciales de la hidrogenación de furfural con respecto al estudio de la presión y concentración se incrementaron linealmente con la masa del catalizador, lo que demuestra la ausencia de fenómenos de transporte. La cinética de la reacción se representó con un modelo Langmuir-Hinshelwood (LH) con un solo tipo de sitio activo. La adición de un átomo de hidrógeno sobre la molécula orgánica demostró ser la etapa determinante de la reacción, ajustándose a los datos experimentales.
PALABRAS CLAVE: Hidrogenación, Nb2O5, cinética, furfural, SMSI.
ABSTRACT: Kinetics of furfural hydrogenation over Ir/Nb2O5 catalyst with SMSI effect (Strong Metal Support Interaction) was studied. The effect of different parameters such as initial concentration (0,025 to 0,1 M), H2 pressure partial (0,48 to 0,98 MPa), temperature (353 to 393 K) and catalyst loading (0,1 to 0,4 g) were examined. A high selectivity towards unsaturated alcohol (furfuryl alcohol) using this catalyst was demonstrated. The effect of solvent also was studied. The alcoholic solvents produces acetals traces, especially 2,6-diethyl-acetal. The initial rates of furfural hydrogenation increased linearly with the catalyst loading, indicating absence of mass transfer effects. The reaction kinetics was represented by a LangmuirHinshelwood model (LH). A single site Langmuir-Hinshelwood type model suggesting the addition of a hydrogen atom on the organic molecules as the rate determining step provided the best fit of the experimental data.
KEYWORDS: Hydrogenation, furfural, Nb2O5, kinetics, SMSI.
1. INTRODUCCIÓN
En Catálisis heterogénea, metales y metales soportados son usados para disminuir la energía de activación favoreciendo la rapidez de una reacción química. De acuerdo al tipo de catalizador y a los fenómenos asociados a éste, se puede obtener de manera selectiva productos específicos, por lo general de mayor valor agregado, que son aplicados en la industria química. Un ejemplo lo constituye la hidrogenación de furfural (figura 1). El principal producto de esta reacción es el alcohol furfurílico usado principalmente en la producción de resinas, fibras sintéticas y como intermediario químico en la fabricación de lisina y vitamina C [1,2].
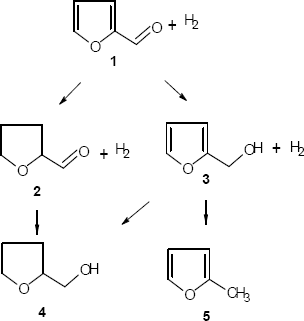
Figura
1. Rutas De Hidrogenación De Furfural. (1) Furfural, (2) Tetrahidrofurfural
,(3) Alcohol Furfurilico, (4) Tetrahidrofurfurilalcohol, (5) 2-Metil Furano
Figure 1. Reaction Pathway For Furfural Hydrogenation. (1) Furfural,
(2) Tetrahydrofurfural ,(3) Furfuryl Alcohol (FA), (4) Tetrahydrofurfuryl Alcohol
(THFA), (5) 2-Methyl-Furane
La obtención convencional de alcohol furfurílico se realiza por reducción del furfural. Por medio de la termodinámica es posible predecir la ocurrencia de la reacción, sin embargo se conoce que es más sencillo la hidrogenación del grupo C=C (Energía de enlace: 147 kcal/mol) que el grupo C=O (Energía de enlace: 170 kcal/mol) y por tanto este tipo de reacciones presentan un reto termodinámico interesante [3].
A partir de estudios cinéticos se correlacionan datos experimentales con una expresión matemática que describe tanto la velocidad como el mecanismo de la reacción. Las expresiones de velocidad se desarrollan siguiendo unos modelos establecidos que representan el comportamiento catalítico convencional en la mayoría de los sistemas catalíticos. Uno de estos modelos es el de Langmuir-Hinshelwood (LH), el cual establece que una de las etapas de la reacción es la etapa limitante, mientras que las demás permanecen en cuasiequilibrio. Las etapas químicas involucradas en catálisis heterogénea implican la adsorción de los reactivos, la reacción en la superficie del catalizador y la desorción de los productos de la reacción hacia el medio reaccionante. Por otro lado, las etapas físicas involucran la difusión de reactivos hacia los poros del catalizador y la salida del producto de los poros del catalizador hacía el medio de reacción.
Las tendencias en actividad y selectividad con variaciones en los parámetros de reacción, tales como: temperatura, presión, uso de diferentes solventes, pueden describir el comportamiento cinético de las reacciones de hidrogenación y permite explicar la adsorción entre reactantes y diferentes productos. En particular, el efecto SMSI puede provocar un gran impacto sobre la cinética de la reacción [4].
Así diferentes autores han reconocido que el uso de catalizadores soportados sobre óxidos parcialmente reducibles (TiO2, Nb2O5, CeO2) que presentan el fenómeno SMSI (del ingles: Fuerte interacción metal-soporte) favorecen la hidrogenación del grupo carbonilo en aldehídos α,β-insaturados [3-5]. Este fenómeno se caracteriza por la disminución de la capacidad de quimisorción de H2 lo cual favorece la polarización del grupo carbonilo y, por ende, la conversión del aldehído α,β-insaturado y selectividad hacia el alcohol insaturado [3-5].
Sin embargo, la reducción convencional del alcohol furfurílico se realiza en fase líquida sobre cromita de cobre (Cu-Cr), con elevadas presiones y temperaturas para obtener una actividad moderada hacía el alcohol insaturado. El gran inconveniente de la cromita de cobre es su toxicidad que causa polución ambiental severa [1]. Por lo anterior diseñar catalizadores convenientes y con gran actividad para la hidrogenación del furfural y que además no contengan cromo es una tarea desafiante para la industria [2]. Estudios previos en el grupo de investigación en catálisis de la Universidad Pedagógica y Tecnológica de Colombia (GC- UPTC), han demostrado que el catalizador Ir/Nb2O5 puede ser una alternativa favorable para la industria. Este catalizador es reconocido por presentar el efecto SMSI, sin embargo, aun no existen aproximaciones al estudio cinético de la hidrogenación de furfural que permitan describir la etapa limitante de la reacción y aproximarse al mecanismo de reacción en este tipo de catalizador.
2. MATERIALES Y MÉTODOS
El catalizador Ir/Nb2O5 se preparó por impregnación acuosa de H2IrCl6 sobre Nb2O5 (Merck, SBET=17 m2g-1) seguido por su calcinación en atmósfera de aire a 673 K y su reducción en atmósfera de hidrógeno a 773 K, con el fin de inducir el efecto SMSI. La superficie específica (SBET) se determinó mediante adsorción de nitrógeno a 77 K en un equipo Micromeritics ASAP 2010. Los estudios de quimisorción de H2 se efectuaron a 298 K en el mismo equipo.
Las reacciones se realizaron en fase líquida en un reactor tipo batch, previa prerreducción del catalizador a 363 K y flujo de hidrógeno a 0.1ml/min. A fin de determinar la selectividad obtenida con el grado de solubilidad del furfural (Aldrich > 98 %) se estudió diferentes solventes: heptano (Aldrich >98%), etanol (Merck >98%) y una mezcla de etanol-heptano (1:1) Se analizó el efecto de las variables de reacción (solvente, presión, concentración, temperatura y masa de catalizador) para lo cual una variable fue modificada mientras las otras se mantenían constantes. El efecto de la presión de H2 se estudio en el rango de 0,48 MPa a 0,98 MPa, la concentración de furfural en el rango de 0,025 a 0,1 M, la masa del catalizador de 0,1 a 0,3 g y la temperatura desde 333 K a 383 K.
La reacción fue seguida en un cromatógrafo de gases Varian 3400, con una columna HP-Wax ( 30 m, 0.53 mm, 1.0 μm de película), helio como gas de arrastre y FID como detector. Los tiempos de retención de los productos detectados fueron: alcohol furfurilico: 17 min, 2-furaldehido dietil acetal 12 min. Todos los productos de reacción fueron confirmados en un equipo GC-masas (CG EM - Varian 3800 - Saturn 2000).
3. RESULTADOS Y DISCUSIÓN
3.1 Caracterización
del catalizador
El catalizador empleado ha sido
previamente caracterizado y reportado en trabajos anteriores por nuestro grupo
de investigación [6]. Se ha determinado que el
sistema Ir/Nb2O5, reducido a alta temperatura (773 K),
presenta un menor valor en la relación H/Ir (H/Ir=0.030) comparado con el sistema
Ir/Nb2O5 reducido a baja temperatura (473 K). Estos resultados
se explican por el efecto SMSI, que permite la decoración o cubrimiento parcial
de la superficie metálica del iridio por especies parcialmente reducidas del
soporte que migran a alta temperatura de reducción, ocasionando un decrecimiento
en la adsorción de H2. Las especies Nb2Ox se
generan por la transferencia de carga del metal hacía el soporte y ocasionan
que el metal quede ligeramente cargado como Irδ+ favoreciendo
así la polarización del grupo carbonilo en aldehídos α,β-insaturados,
cuando éstos están adsorbidos en la superficie del catalizador, como es el
caso del furfural. Por lo tanto, las reacciones efectuadas para el estudio
cinético se llevaron sometiendo el catalizador a reducción a alta temperatura
asegurando la presencia del efecto SMSI.
3.2 Efecto de transferencia de masa
Para las reacciones de hidrogenación en fase líquida, procesos de transferencia
de masa pueden influenciar las velocidades de reacción, y deben estar ausentes
para garantizar que la reacción sea gobernada por parámetros cinéticos y no
de trasferencia de masa [7]. Los fenómenos de transferencia de masa se asocian
con restricciones difusionales: gas-liquido, liquido-sólido, que no permiten
una total interacción de las moléculas del furfural e hidrogeno sobre los sitios
activos del catalizador que están presentes en los poros del sólido.
Las limitaciones de transporte de masa pueden superarse con la mezcla de los reaccionantes y un pequeño tamaño de partícula del catalizador, para lo cual fueron establecidas en 1000 rpm y 100 mallas, respectivamente. La ausencia de limitaciones de transporte de masa se verificó con la tendencia lineal de una gráfica de conversión en función de la masa de catalizador, tal como se destaca en la figura 2.
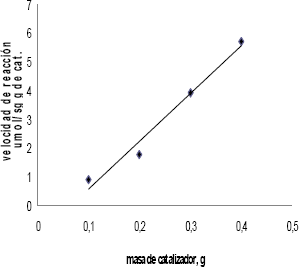
Figura 2. Efecto
De La Masa Del Catalizador En La Conversión En La Hidrogenación De Furfural
A 0,1 M A 363 K Y 0,62 Mpa
Figure 2. Catalyst Loading Effect
Of Ir Catalyst On Hydrogenation Of Furfural At 0.1M, 363 K And 0.62 Mpa
3.3 Efecto del solvente
Diferentes solventes fueron empleados a fin
de estudiar la conversión obtenida
con la polaridad de este. En la figura 3 se observa que la actividad catalítica
aumento con el incremento de la polaridad del solvente, hasta un máximo para
la relación etanol-heptano (1:1) resultando similar a lo obtenido en Aramendía
et al [8] cuando se utiliza etanol como solvente de esta actividad y se presenta
menor inversión hacia el producto de interés, lo cual se explica por la formación
de productos laterales. Así el uso de solventes alcohólicos favorece las reacciones
de acetalización, que ocurren con el grupo OH- del alcohol y el
grupo C=O del furfural, favorecidas por sitios ácidos tipo Bronsted presentes
en la interfase metal-soporte (Ir-Nb). La fragmentación obtenida por espectrometría
de masas en 39, 97, 125 m/z evidenció la presencia de 2-furaldehido dietil
acetal, cuando los solventes usados fueron etanol y etanol-heptano. La selectividad
hacía el alcohol furfurílico sobre este tipo de catalizador con la mezcla de
solventes heptano-etanol (1:1) es mayor al 99 %, por tal razón se escogió esta
mezcla como solvente de reacción para la hidrogenación de furfural a las diversas
condiciones de reacción.
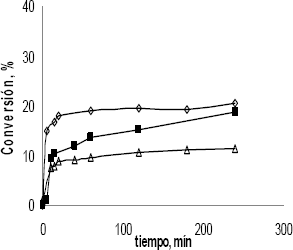
Figura 3. Efecto
Del Solvente En La Hidrogenación De Furfural A 0,1 M, 363 K Y 0,62 Mpa; (∆) Heptano;
(■) Etanol; (◊) Etanol-Heptano (1:1)
Figure 3. Solvent Effect
Of Ir Catalyst On Hydrogenation Of Furfural At 0.1M, 363 K And 0.62 Mpa; (∆)
Heptane; (□) Ethanol; (◊) Ethanol-Heptane (1:1)
3.4 Efecto
de la concentración
inicial
Las concentraciones iniciales
de furfural fueron variadas con el fin de estudiar su efecto sobre la hidrogenación de furfural y la selectividad hacia el producto
deseado. La figura 4 muestra que la conversión aumenta con el consumo del reactante.
Comportamiento convencional del modelo Langmuir-Hinshelwood. El furfural es
una molécula plana tal como la molécula de cinamaldehído siendo posible que
el comportamiento similar de estas dos especies. Una alta concentración de
furfural inhibe la producción de alcohol furfurílico. Esto puede ser explicado
por medio de un efecto estérico del ligando, donde las moléculas de furfural
se adsorben a través de una geometría plana (adsorción preferencial del grupo
C=C) que compite con la adsorción vertical requerida para la hidrogenación
del grupo C=O, como se señala en la figura 5 [9-10].
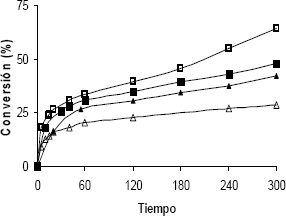
Figura 4. Efecto
De La Concentración
Inicial De Furfural Sobre La Conversión De Furfural; (□) 0,1 M; (■)
0,075 M; (▲) 0,05 M; And (∆) 0,025 M
Figure 4. Effect Of Initial
Concentration Of Furfural On Furfural Conversion; (▲) 0.1 M; (∆)
0.075 M; (■) 0.05 M; And (□) 0.025 M
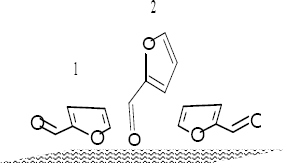
Figura 5. Modos
De Adsorción
De Furfural. 1. Adsorción Plana, 2. Adsorción Vertical
Figure 5. Adsorption Modes Of
Furfural 1. Planar Adsortion, 2. Vertical Adsorption
Un orden cercano a 1/2 fue encontrado con respecto a la concentración inicial de furfural. La metodología para calcular el orden de reacción se baso en el método de actividades iniciales, el cual supone que en los primeros tiempos de reacción no hay formación de productos que compitan con los sitios activos del catalizador.
El orden exhibido para este tipo de catalizador implica que en la ecuación de velocidad que exprese la etapa limitante, el término de la concentración se encuentra tanto en el numerador como en el denominador.
3.5 Efecto
de la presión
El efecto de la presión parcial de hidrógeno sobre la velocidad de la reacción
fue estudiada en el rango de 0,48 MPa a 0,84 MPa, mientras se mantenía constante
la concentración inicial de furfural ( 0,1 M) y temperatura de 363 K. Los resultados
se muestran en la figura 6. Se observa una disminución de la conversión a medida
que la presión incrementa como consecuencia de la desactivación del catalizador
que ocurre en los primeros tiempos de reacción. El orden determinado con respecto
a la presión parcial de hidrógeno asumió un valor de ½, calculado según el
método de velocidades iniciales.
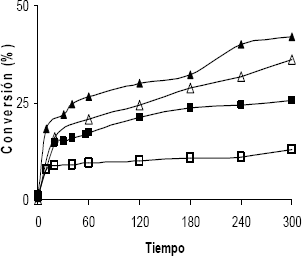
Figura 6. Efecto
De La Presión
Parcial De H2 Sobre La Conversión En La Hidrogenación De Furfural;
Tiempo Vs % Conversión (▲) 0,84 Mpa; (∆) 0,75 Mpa; (■) 0,62
Mpa; And (□) 0,48 Mpa
Figure 6. Effect
Of H2 Partial Pressure On Furfural Hydrogenation ; (▲)
0,84 Mpa; (∆) 0,75 Mpa; (■) 0,62 Mpa; And (□) 0,48 Mpa
3.6 Modelo
Cinético de la hidrogenación
de furfural
El efecto de la
fuerte interacción metal-soporte (SMSI) que presentan el catalizador
de Ir/Nb2O5 altera las propiedades superficiales favoreciendo
la polarización del grupo carbonilo en la hidrogenación de aldehídos α,β-insaturados.
Considerando la alta selectividad obtenida (> 98%) hacía el alcohol furfurílico,
es de suponer que en el catalizador existe una alta densidad de sitios metálicos
SMSI (Irδ+), y por tanto, existen dos modelos tipo Langmuir-Hinshelwood,
de un solo tipo de sitio activo, que fueron desarrollados para explicar el
comportamiento cinético observado hacía la formación del alcohol furfurílico.
3.6.1 Modelo 1
En el primer modelo Langmuir-Hinshelwood (LH) se asume que:
- El hidrógeno muestra adsorción disociativa que compite por los sitios activos con las moléculas orgánicas absorbidas sobre la superficie metálica. Debido a la alta presión de H2 empleada, se considera que las etapas de hidrogenación son irreversibles [11].
- Un solo tipo de sitios activos existe; tipo SMSI (Irδ+).
- La reacción superficial fue considerada como la etapa limitante de la reacción (RDS), mientras que las etapas de adsorción y desorción permanecen en cuasiequilibrio (QE) y se considera que la adición de hidrógeno sobre los grupos funcionales de la molécula tiene lugar sobre los sitios activos de forma simultánea.
- El alcohol furfurílico no participa en la reacción y no produce ningún bloqueo a los sitios activos SMSI.
- Se considera que no existen problemas difusionales en la reacción de hidrogenación de furfural.
Este modelo puede ser descrito como:
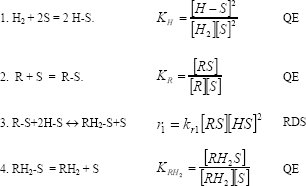
Donde S es el sitio activo, R es el furfural, RH2S es la especie hidrogenada.
Modelo 2. El segundo modelo Langmuir-Hinshelwood Hougen-Watson (LH-HW) considera las observaciones del modelo 1, excepto para la asunción 3 y 4, las cuales fueron modificadas así:
a. La adición de hidrógeno tiene lugar en dos etapas 3ª y 3b, la primera etapa 3ª hace referencia a la adición del primer hidrógeno como la etapa limitante de la reacción.
Este modelo puede ser descrito como:
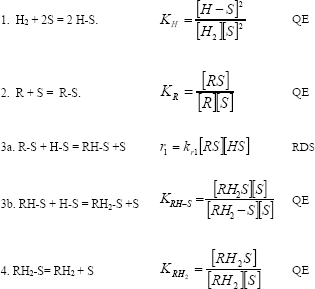
Las ecuaciones fueron resueltas, y los valores de las constantes de velocidad como los parámetros de adsorción de hidrógeno y furfural, fueron calculados a partir de los datos experimentales de concentración versus tiempo, usando un programa de regresión no linear con un método iterativo de Gauss-Newton.
El modelo 2 con la adición de un primer átomo de hidrógeno sobre la molécula orgánica como la etapa limitante de la reacción presentó los mejores parámetros estadísticos.
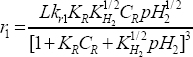
Para la validez de este modelo, se consideró que las constantes estimadas fueron positivas (Lk, KFurfural y KH2) y que el valor de suma residual de cuadrados (SRC) y varianza fuera el menor para las diferentes temperaturas de estudio. Una comparación de las concentraciones de furfural calculadas por el modelo y las experimentales se muestra en la figura 7.
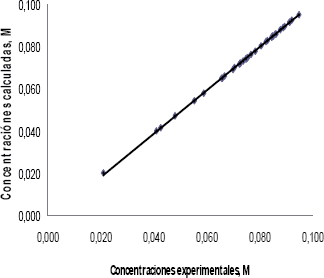
Figura 7. Comparación De Las
Concentraciones De Furfural Experimentales Y Calculadas Según El Modelo 2 A
Diferentes Condiciones De Reacción
Figura 7. Experimental And Calculated
Furfural Concentration According To Model 2 At Different Reaction Conditions
De los parámetros cinéticos obtenidos a diferentes temperaturas a partir del modelo 2, se calcularon tanto la energía de activación para la etapa limitante de la reacción, como la entalpía, y entropía de adsorción del furfural y de H2. Los valores obtenidos se muestran en la tabla 3. La energía de activación de la reacción de hidrogenación (Ea) ~ 9 Kcal mol-1. Las entalpías de adsorción fueron negativas, lo mismo que las entropías de adsorción, lo que demuestra una consistencia termodinámica y satisface las reglas establecidas por Vannice [12].
Tabla 3. Parámetros Termodinámicos
Obtenidos De La Expresión Del Modelo 2}
Table 3. Thermodynamic Parameters
Obtained From Expression Of Model 2

4. CONCLUSIONES
La hidrogenación
de furfural sobre el catalizador de Ir/Nb2O5 no
presenta limitaciones de transferencia de masa que describan un comportamiento
cinético inadecuado. El solvente afecta la selectividad de la reacción debido
a reacciones de acetalización características de alcoholes con grupos carbonilos.
Según el razonamiento matemático de las velocidades iníciales, la velocidad
de reacción puede expresarse como ![]() , que sugiere
que la hidrogenación de furfural sobre Ir/Nb2O5 es de
primer orden global. Al evaluar los modelos propuestos según el mecanismo Langmuir-Hinshelwood
para la etapa limitante de la reacción, la expresión que describe la adición
de un primer átomo de hidrógeno sobre la molécula orgánica fue la que mejor
se ajusto a los datos experimentales (LH).
, que sugiere
que la hidrogenación de furfural sobre Ir/Nb2O5 es de
primer orden global. Al evaluar los modelos propuestos según el mecanismo Langmuir-Hinshelwood
para la etapa limitante de la reacción, la expresión que describe la adición
de un primer átomo de hidrógeno sobre la molécula orgánica fue la que mejor
se ajusto a los datos experimentales (LH).
Según los parámetros termodinámicos, este modelo (LH) demuestra que el mecanismo propuesto coincide en una alto grado con los resultados valores experimentales y describe la alta selectividad hacía el alcohol furfurílico cuando el efecto SMSI está presente en el catalizador.
5. AGRADECIMIENTOS
Los autores agradecen a DIN-UPTC por el apoyo otorgado al proyecto ¨Monocapas de óxidos mixtos de Ti-Si y Nb-Si como soportes de catalizadores de Ir en la hidrogenación selectiva de furfural¨ Cod. SGI 423
REFERENCIAS
[1] NAGARAJA, B.M., SIVA KUMAR, V., SHASIKALA, V., PADMASRI. A.H., SREEDHAR. B. A highly efficient Cu/MgO catalyst for vapour phase hydrogenation of furfural to furfuryl alcohol, Catal. Comm., 4, 287- 293, 2003.
[2] WU. J., SHEN, Y., LIU. C., WANG, H., GENG, C., ZHANG. Z. Vapor phase
hydrogenation of furfural to furfuryl alcohol over environmentally friendly
CuCa/SiO2 catalyst, Catal. Comm., 6, 633637, 2005
[3] REYES, P., ROJAS. H. Hydrogenation of citral over Pt and Pt-Fe catalysts, React. Kinet. Catal., 88, 363-371, 2006.
[4] SINGH. U.K. , VANNICE. M.A. Kinetics of liquid phase hydrogenation reactions over supported metal catalysts-a review. Appl. Catal. A., 213, 1-24, 2006.
[5] M.A. VANNICE. Kinetics of Catalitic Reactions, Springer. 2006.
[6] REYES, P., ROJAS. H., BORDA. G., CASTAÑEDA, J.C., FIERRO. J.L.G.
Synthesis, characterization and catalytic behavior of the Ir/Nb2O5/SiO2 system
in the citronellal hydrogenation. Memorias: ISHHC XIII Internacional symposium
on relations between homogeneous and heterogeneous catalysis, Berkeley, USA
. Julio 2007.
[7] MARTÍNEZ J.J. Hidrogenación de citral sobre catalizadores de Ir/SiO2
dopados con TiO2. [Tesis] Universidad Nacional de Colombia, 2007.
[8] ARAMENDIA. M.A., BORA. V., JIMENEZ, C., MARINAS. J.M., PORRAS. A., URBANO. F.J. Liquid phase hydrogenation of citral over supported palladium. J. Catal., 172, 46-52, 1997.
[9] SILVA. A., JORDAO. E., MENDEZ. M.J., FOUILLOUX. P. Effect of metal-support interaction during selective hydrogenation of cinnamaldehyde to cinnamyl alcohol on platinum based bimetallic catalysts. Appl. Catal. A., 148, 257, 1997.
[10] BREEN. J.P., BURCH. R., GÓMEZ-LÓPEZ J., GRIFFIN. K., HAYES. M.
Steric effects in the selective hydrogenation of cinnamaldehyde to cinnmayl
alcohol using an Ir/C catalyst. Appl. Catal A., 268, 267-273, 2004.
[11] VERGUNST. TH., KAPTEIJN. F., MOULIJN. J.A. Kinetics of cinnamaldehyde hydrogenation concentration dependent selectivity. Catal. Today., 66, 381-387, 2001.
[12] VANNICE. M.A., HYUN. S.H., KALPAKCI. B. LIAUH.W.C. Entropies of adsorption in heterogeneous catalytic reactions. J. Catal., 56, 358-364, 1979.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2008 DYNA

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
El autor o autores de un artículo aceptado para publicación en cualquiera de las revistas editadas por la facultad de Minas cederán la totalidad de los derechos patrimoniales a la Universidad Nacional de Colombia de manera gratuita, dentro de los cuáles se incluyen: el derecho a editar, publicar, reproducir y distribuir tanto en medios impresos como digitales, además de incluir en artículo en índices internacionales y/o bases de datos, de igual manera, se faculta a la editorial para utilizar las imágenes, tablas y/o cualquier material gráfico presentado en el artículo para el diseño de carátulas o posters de la misma revista.

















