Estudo matemático de estabilidade do desempenho do sistema [Fe(CN)6]3–/[Fe(CN)6]4– como mediador na eletrorredução de nitrito, com fins eletroanalíticos
The mathematical stability study for the work of the [Fe(CN)6]3-/[Fe(CN)6]4- system as a mediator in nitrite electroreduction, used for electroanalytical means
DOI:
https://doi.org/10.15446/rcciquifa.v45n1.58017Palabras clave:
nitrito eletrorredução, hexacianoferrato, sensores eletroquímicos, estado estacionário estável (pt)Nitrite, Electroreduction, Hexacyanoferrate, Electrochemical sensors, Stable steady-state (en)
Descargas
O desempenho do sensor de nitrito, baseado no elétrodo, modificado pelo sistema de hexacianoferratos (II) e (III) como mediador, foi descrito matematicamente, sendo o modelo matemático correspondente analisado mediante a teoria de estabilidade lineal e análise de bifurcações. O modelo foi comparado com os análogos e com os sistemas experimentais.
DOI: https://doi.org/10.15446/rcciquifa.v45n1.58017
Estudo matemático de estabilidade do desempenho do sistema [Fe(CN)6]3-/[Fe(CN)6]4- como mediador na eletrorredução de nitrito, com fins eletroanalíticos
The mathematical stability study for the work of the [Fe(CN)6]3-/[Fe(CN)6]4- system as a mediator in nitrite electroreduction, used for electroanalytical means
Volodymyr V. Tkach1*, André Santos2, Reza Ojani3, Petró I. Yagodynets´1
1 Universidade Nacional de Chernivtsi, 58012, Rua de Kotsyubyns'ky., 2, Chernivtsi, Ucrânia.
2 Universidade Federal de Uberlândia, Campus Pontal, 38304-402, Rua 20, 1600, Tupã, Ituiutaba, MG, Brasil
3 Universidade de Mazandarã, 47416-95447, 3o km.Rodovia de Forças Aéreas Iranianas, Babolsar, República Islâmica do Irã
* Correio eletrônico: nightwatcher2401@gmail.com
Recibido para evaluación: 5 de mayo de 2015. Aceptado para publicación: 5 de febrero de 2016.
Resumo
O desempenho do sensor de nitrito, baseado no elétrodo, modificado pelo sistema de hexacianoferratos (II) e (III) como mediador, foi descrito matematicamente, sendo o modelo matemático correspondente analisado mediante a teoria de estabilidade lineal e análise de bifurcações. O modelo foi comparado com os análogos e com os sistemas experimentais
Palavras-chave: nitrito, eletrorredução, hexacianoferrato, sensores eletroquímicos, estado estacionário estável.
Summary
The work of nitrite sensor, based on the electrode, modified by the system of hexacianoferrates (II) and (III) as mediator, was mathematically described, and the corresponding mathematical model was analyzed by means of linear stability theory and bifurcation analysis. The model was compared with its analogues and experimental systems
Keywords: Nitrite, Electroreduction, Hexacyanoferrate, Electrochemical sensors, Stable steady-state.
Introdução
Os íons nitrito (NO2-) são muito comuns na natureza [1] e amplamente utilizados na conservação de alimentos, prevenindo a ação de microorganismos, como Clostridium Botulinum [2] e na síntese orgânica. Também podem ser utilizados como oxidante na síntese e eletrossíntese de polímeros condutores, como polipirrol [3] segundo:

em que Py é molécula de pirrol, sendo que o radical-cátion depois recombina, segundo o mecanismo de Díaz [4–6].
Por outro lado, estes íons são nocivos para a saúde humana [7]. O seu excesso pode causar câncer, haja vista a formação de N-nitrosocompostos [8, 9]. Outrossim, a sua alta concentração no sangue faz com que os íons reajam com o ferro (II) de hemoglobina formando metahemoglobina, que não tem capacidade de transportar oxigênio [10, 11]. Destarte, o desenvolvimento de sensores críveis e sensíveis para a detecção do nitrito tem recebido uma atenção contínua durante os últimos 10 anos.
Foram desenvolvidos vários métodos de determinação de nitrito, como espectrofotometria [12, 13], inclusive o oficialmente aceito no Brasil, baseado na reação de Griess, chemoluminescência [14], cromatografia [15, 16], eletroforese capilar [17] e métodos eletroquímicos [18–24]. Muitos dos procedimentos mencionados incluem fases lentas, requerem procedimentos adicionais, utilizam equipamento caro e impreciso, e assim os métodos eletroquímicos apresentam uma ótima alternativa.
No caso do nitrito, na questão do desenvolvimento de sensores eletroquímicos surge o problema de que aeletrorredução direta de íons nitrito requer a aplicação do grande sobrepotencial nas superfícies dos elétrodos planos. Uma boa maneira de reduzir o potencial é a modificação da superfície de elétrodos. Além disso, alguns elétrodos modificados químicamente foram usados para a catálise de eletrorredução de nitrito [25–28].
Já tem sido detectada a capacidade de ferrocianida [29], poli(o-toluidina) [30], heteropoliânios [31, 32], poli(p-acetanilida) [33] e íons complexos, como hexacianoferrato [34], de promover a eletrorredução de nitrito. Porém, os processos do desempenho de sensores, baseados em elétrodos, modificados por polímeros condutores [35–43], bem como os da eletropolimerização [44–51], podem acompanhar-se pelas instabilidades eletroquímicas (oscilatória e monotônica), que podem influenciar fortemente a resposta dos sensores. Reforçar-se-á, neste aspecto, o fato de o sistema de hexacianoferrato [52] ser um oscilador eletroquímico conhecido.
Anteriormente, tal comportamento só recebia interpretação fenomenológica, que, apesar de lógica, não tinha forte fundamento teórico, geralmente fornecido por um modelo matemático, capaz de descrever adequadamente o comportamento do sistema e por sua análise. Também é preciso mencionar que o modelo é capaz de descrever não só o sistema concreto, mas os que lhe são semelhantes, o que dará a possibilidade de comparação do comportamento.
O objetivo deste trabalho será desenvolver e analisar o modelo matemático do desempenho de sensor eletroquímico de nitrito, baseado em poliacetanilido, descrito em [34], pois a modelagem vai dar uma contribuição forte para a detecção do mecanismo do desempenho.
Nós já temos feito várias tentativas de descrever os sensores eletroquímicos de vários tipos de desempenho, baseados em polímeros condutores (PC) e outros compostos conjugados [53–64] (também foi feita a análise matemática da dependência do seu funcionamento do pH) , ferroceno e derivados [65, 66], oxihidróxido de cobalto [67] e nanopartículas metálicas [68]. Mas em todos os casos foram os sensores, baseados em processos anódicos (por serem maioria). Agora vem descrito o modelo do sensor, baseado no processo catódico. Destarte, este trabalho segue como continuação da pesquisa, descrita nos trabalhos [34, 53–68] e deixa, por meio matemático, comparar o desempenho dos sensores catódico e anódico e a sua dependência do pH.
O sistema e o seu modelo
O desempenho do sensor pode ser esquematicamente representado como:

Como se vê, apesar de o desempenho do mediador não depender do pH, como foi o caso do ferroceno [69, 70], os prótons participam do processo de redução, ou seja, o desempenho do sensor de nitrito depende do pH. Por isso, para a descrição matemática do funcionamento do sensor, introduzir-se-ão as 3 variáveis:
Ν – a concentração da substância que contém nitrito na camada pré-superficial;
θ – o grau do recobrimento do cátodo pelo hexacianoferrato (III);
h – a concentração de prótons na camada pré-superficial.
Para simplificar a modelagem, supõe-se que o líquido esteja agitando-se intensamente (para menosprezar o fluxo de convecção), que o eletrólito de suporte esteja em excesso (para menosprezar o fluxo de migração). A camada de difusão é suposta a ser de espessura constante, igual a δ o perfil concentracional nela é suposto a ser linear.
O analito (neste caso, o ácido nitroso) entra na camada pré-superficial por meio da difusão e sai dela por meio da reação da redução química. Posto assim, a equação de balanço será descrita como:

Sendo Δ o coeficiente de difusão, Ni a concentração do ácido nitroso no interior da solução, r1 a velocidade da etapa química.
A forma oxidada do polímero condutor forma-se aquando da reação (1) e desaparece aquando da (2). Assim sendo, a equação de balanço dela será descrita como:

Sendo Γmax a concentração máxima do polímero condutor oxidado, r2 a velocidade da eletrorredução.
Os prótons entram na camada pré-superficial por meio da sua difusão e deixam-na aquando da eletrorredução (haja vista a equação (1)). Assim sendo (como eles não reagem com o ácido nitroso), a equação de balanço será descrita como:

Sendo D o coeficiente de difusão de prótons, hi a sua concentração no interior da solução.
As velocidades das reações química e eletroquímica podem descrever-se como:

Sendo z a quantidade de elétrons transferidos, F=e*NA, o número de Faraday, φ0 o salto do potencial na dupla camada elétrica (DCE), relativo ao potencial de carga zero.
Comparado aos modelos, descritos em [53–64], o presente modelo é diferente. Como o processo é catódico, o signo da expressão dentro do exponente, é diferente. Outrossim, como os prótons tomam parte da etapa eletroquímica (e não se formam nela, como no caso do polímero condutor, modificado pelo fator pirrolopiridinoquinônico (PQQ)), a sua concentração é inclusa na expressão (8). Além disso, a ordem de reação dos prótons é igual a 2, disso surge a dependência quadrática da velocidade da reação eletroquímica da concentração de prótons.
Resultados e discussão
O comportamento do sistema será descrito por meio da teoria de estabilidade linear. A matriz funcional de Jacobi, cujos elementos são calculados para o estado estacionário, pode ser descrita como:

Em que:
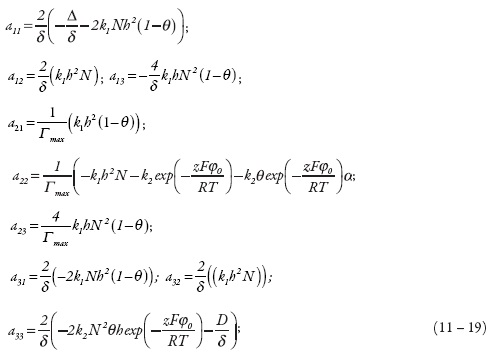
Para simplificar a análise do jacobiano, vamos introduzir as novas variáveis de modo que o determinante da matriz se descreve como:
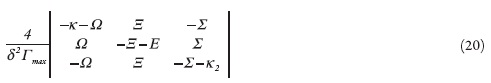
Usando o critério de Routh-Hurwitz e resolvendo a inequação Det J<0, obter-se-á o requisito de estabilidade de estado estacionário como:

A estabilidade do estado estacionário mantém-se pela rapidez da difusão do analito e a sua oxidação (altos valores de κ1 e Ώ. Outrossim, a positividade de E (única variável da equação (20), capaz de ter valores negativos), que descreve a ausência de quaisquer influências do processo de eletrorredução à dupla camada, junto aos altos valores de κ2 (difusão rápida de prótons) e Σ(entrada deles na reação de eletrorredução) faz o estado estacionário mais estável e, em consequência, a resposta mais clara (a região de estabilidade de estado estacionário corresponde à região da dependência linear entre o parâmetro eletroquímico e concentração do analito).
Concluir-se-á também que, como o elemento positivo ΏΞκ2 desaparece, abrindo-se os parênteses, a zona topológica dos parâmetros do sistema, correspondente à estabilidade do estado estacionário vai ser muito vasta, o que confirma o excelente desempenho e sensibilidade do sensor, descrito em [34] e a linearidade da curva analítica na Fig. 7 do mencionado trabalho.
Ao contrário do observado para os sensores com eletro-oxidação, neste caso a diminuição do pH faz o estado estacionário mais estável. Isto vai ao encontro do observado em [34] e em [33] para poliacetanilida. No trabalho [33], o desempenho do sensor foi testado em várias soluções-tampão com pH de 0 a 10 e a melhor resposta foi observada com o pH=0.
Com os valores negativos do pH, a resposta iria ser até melhor que a observada com o pH nulo, por causa da maior velocidade da eletrorredução e, assim, da formação de sítios ativos da eletrooxidação. No entanto, deve-se mencionar que o modelo pode mostrar que o efeito favorável do pH baixo ao desempenho do sensornão deve ser igual ao do efeito favorável do pH baixo no caso do polímero condutor. A Fig. 1 mostra que o estuda cronoamperométrico confirma a estabilidade do estado estacionário no sistema com o pH = 1:
A igualdade de influências da eletrorredução à dupla camada às doutros processos (só com os valores negativos da E) pode causar a instabilidade monotônica, cuja condição para o caso é:

Ela pode ser observada no trecho "N-formado" do voltamperograma, significando que nesta região a um valor da corrente elétrica são correspondentes os 3 valores de potencial, sendo que cada um corresponde a um estado estacionário instável.
Para a aparição do comportamento oscilatório, é necessário (mas não bastante) haver elementos positivos na diagonal principal da matriz funcional de Jacobi, responsáveis pela positiva "conexão de retorno".
A única causa do comportamento oscilatório, na ausência de etapas autocatalíticas, podem ser a influência da eletrorredução à dupla camada, no caso da negatividade de α e do parâmetro E. Isto explica a aparição das tendências ao comportamento oscilatório de amplitude muito pequena, relatadas na curva cronoamperométrica de 0,25 V.
Posto que o valor preciso tenha outro signo, comparado ao dos casos, descritos em [53–64], a causa do comportamento oscilatório segue sendo a mesma.
As oscilações de pequena amplitude foram observadas no trabalho [33] e o modelo matemático mostra que para o caso de [34] tal comportamento também é possível.
Caso da reação de analito com prótons (descrição resumida das alterações no modelo). O modelo apresentado serve para descrever a detecção eletroquímica pH-independente dos analitos que reagem com os prótons ou não são as suas fontes (o exemplo apresentado o do sal de um ácido fraco). No caso de o analito reagir com os prótons, as equações (5) e (6) são alteradas haja vista a reação.
A forma da expressão, descrevendo a reação, depende da sua natureza. Com ela, a influência de prótons à estabilidade do estado estacionário não será uniforme, pois a reação deles com o analito vai apertar o estado estacionário à margem de estabilidade.
No caso de tal reação ser autocatalítica, ela será mais uma causa do comportamento oscilatório no sistema, como também foi observado nos modelos paras os sensores de eletro-oxidação.
Caso da reação de analito, não dependente do pH(descrição resumida das alterações no modelo). No caso de o processo da detecção do analito não ser dependente do pH, a terceira variável exclui-se do sistema de equações diferenciais e este simplifica-se até as (5 – 6). A expressão da velocidade r2 também vem sendo alterada.
O modelo analógico foi descrito matematicamente nos trabalhos anteriores para os sensores de eletro-oxidação [43–56], portanto a sua descrição vem sendo resumida.
Conclusões
- O comportamento do sensor de eletrorredução de nitrito foi descrito matematicamente. Embora semelhante, tem divergências, comparado aos sensores de eletro-oxidação e aos de eletrorredução, na base dos polímeros condutores.
- Ao contrário dos sensores de eletro-oxidação, a diminuição de pH favorece a estabilidade do estado estacionário. O único fator a não favorecer a estabilidade do estado estacionário podem ser as influências da eletrorredução à dupla camada elétrica e, caso haja, as reações entre os prótons e o analito. No entanto, a influência positiva do pH baixo para este caso e para o dos polímeros condutores é desigual.
- Confirmou-se a presença de estrututasdissipativas temporais, os fatores de cujo mantenimento são os mesmos que para os sistemas semelhantes. O comportamento oscilatório é causado pelos fatores eletroquímico e autocatalítico (se o houver).
- As conclusões da modelagem vêm ao encontro das da pesquisa experimental e completam-nas.
Referências
1. http://www.inmoment.ru/beauty/health-body/nitrates.html Acesso aos 7 de abril de 2015.
2. H. Yetim, A. Kayacier, Z. Kesmen, O. Sagdic, The effects of nitrite on the survival of Clostridium sporogenes and the autoxidation properties of the Kavurma, Meat Sci., 72, 206 (2006).
3. Y. Jung, N. Singh, K.-Sh.Choi, Cathodic Deposition of polypyrrole enabling the one-step assembly of metal–polymer hybrid electrodes, Angew. Chem. Int. Ed., 48, 8331 (2009).
4. S. Sadki, P. Schottland, N. Brodie, G. Saboraud, The mechanisms of pyrrole electropolymerization, Chem. Soc. Rev., 29, 283 (2009).
5. N. Alizadeh, M. Babaei, S. Nabavi, Gas sensing ability of a nanostructured conducting polypyrrole film prepared by catalytic electropolymerization on Cu/Au interdigital electrodes, Electroanal., 25, 2181 (2013).
6. M. Gholami, A-M. Ghasemi, M.M. Loghavi et al., Preparation of a miniaturised iodide ion selective sensor using polypyrrole and pencil lead: effect of double coating, electropolymerisation time, and current density, Chem. Papers, 67, 1079 (2013).
7. I.A. Wolff, A.E. Wasserman, Nitrates, nitrites and nitrosamines, Science, 177, 15 (1972).
8. C. Yang, Q. Lu, S. Hu, A novel nitrite amperometric sensor and its application in food analysis, Electroan., 18, 2188 (2006).
9. M.J. Moorcroft, J. Davis, R.G. Compton, Detection and determination of nitrate and nitrite: A review, Talanta, 54, 785 (2001).
10. E. Morcos, N.P. Wiklund, Nitrite and nitrate measurement in human urine by capillary electrophoresis, Electrophoresis, 22, 2763 (2001).
11. V.Y. Titov, Y.M. Petrenko, Proposed mechanism of nitrite-induced methemoglobinemia, Biochemistry, 70, 473 (2005).
12. M. Bru, M.I. Burguete, F. Galindo et al., Cross-linked poly(2-hydroxyethylmethacrylate) films doped with 1,2-diaminoanthraquinone (DAQ) as efficient materials for the colorimetric sensing of nitric oxide and nitrite anion, Tetrahedron Lett., 47, 1787 (2006).
13. Brasil, Ministério da agricultura, Pecuária e Abastecimento, Portaria nº 59 de 19 de março de 2009, Disponível em:< http://www.tuvsud.com.br/uploads/images/1401819075227662290092/ministerio-da-agricultura-fisico-quimicaanimal-e-agua-escopo.pdf>, acesso em outubro, 2014.
14. P. Mikusuka, Z. Vecera, Flow-injection chemiluminescence determination of low concentrations of nitrite in water, Anal. Chim. Acta, 495, 225 (2003).
15. I.M.P.L.V.O. Ferreira, S. Silva, Quantification of residual nitrite and nitrate in ham by reverse-phase high performance liquid chromatography/diode array detector, Talanta, 74, 1598 (2008).
16. M.I.H. Helaleh, T. Korenaga, Ion chromatographic method for simultaneous determination of nitrate and nitrite in human saliva, J. Chromatogr. B, 744, 433 (2000).
17. E. Szoko, T. Tabi, A.S. Halasz et al., High sensitivity analysis of nitrite and nitrate in biological samples by capillary zone electrophoresis with transient isotachophoretic sample stacking, J. Chromatogr. A, 1051, 177 (2004).
18. X. Cai, Z. Zhao, Determination of trace nitrite by catalytic polarography in ferrous iron thiocyanate medium, J. Electroanal. Chem., 252, 361 (1988).
19. J.E. Newbry, M.P.L. Haddad, Amperometric determination of nitrite by oxidation at a glassy carbon electrode, Analyst, 110, 8 (1985).
20. M. Trojanowicz, W. Matuszewski, B. Szostek, Simulataneous determination of nitrite and nitrate in water using flow-injection biamperometry, Anal. Chim. Acta, 261, 391 (1992).
21. Z.H. Wen, T.F. Kang, Determination of nitrite using sensors based on nickel phthalocyanine polymer modified electrodes, Talanta, 62, 351 (2004).
22. M. Thamae, T. Nyokong, Cobalt(II) porphyrazine catalysed reduction of nitrite, J. Electroanal. Chem., 470, 126 (1999).
23. J. Obirai, T. Nyokong, J. Obirai, T. Nyokong, Electrochemical and catalytic properties of chromium tetraaminophthalocyanine, Electroanal. Chem., 573, 77 (2004).
24. J. Davis, M.J. Moorcroft, S.J. Wilkins et al., Electrochemical detection of nitrate and nitrite at a copper modified electrode, Analyst, 125, 737 (2000).
25. L. Ruhlmaann, G. Genet, Wells–Dawson-derived tetrameric complexes {K28H8[P2W15Ti3O60.5]4} electrochemical behaviour and electrocatalytic reduction of nitrite and of nitric oxide, J. Electroanal. Chem., 568, 315 (2004).
26. B. Keita, I. M. Mbomekalle, L. Nadjo, R. Contant, A novel Dawson heteropolyanion and two of its sandwich-type derivatives [Zn4(H2O)2(H4AsW15O56)2]18-, [Cu4(H2O)2(H4AsW15O56)2]18-: Cyclic voltammetry and electrocatalytic properties towards nitrite and nitrate, Electrochem. Comm., 3, 267 (2001).
27. I. Chad, B. Mekki, B.Emek et al., Electrocatalytic reductions of nitrite, nitric oxide, and nitrous oxide by thermophilic cytochrome P450 CYP119 in film-modified electrodes and an analytical comparison of its catalytic activities with myoglobin, J. Am. Chem. Soc., 126, 4934 (2004).
28. L. Liu L. Tian, H. Xu, N. Lu, Electrochemical properties of organo-titanium substituted heteropolytungstate and its electrocatalytic reduction of nitrite, J. Electroanal. Chem., 587, 213 (2006).
29. R. Ojani, J.B. Raoof, E. Zarei, Electrocatalytic reduction of nitrite using ferricyanide: Application for its simple and selective determination, Electrochim. Acta, 52, 753 (2006).
30. R. Ojani, J.B. Raoof, E. Zarei, Poly(ortho-toluidine) modified carbon paste electrode: A sensor for electrocatalytic reduction of nitrite, Electroanal., 20, 79 (2008).
31. R. Ojani, M.A. Rahmanifar, P. Naderi, Electrocatalytic reduction of nitrite by phosphotungstic heteropolyanion. Application for its simple and selective determination, Electroanal., 20, 1092 (2008).
32. J.B. Raoof, R. Ojani, M. Ramine, Voltammetric sensor for nitrite determination based on its electrocatalytic reduction at the surface of p-duroquinone modified carbon paste electrode, J. Solid. State Electrochem., 13, 1311 (2009).
33. R. Ojani, J.B. Raoof, V. Rahemi, A simple and efficient electrochemical sensor for electrocatalytic reduction of nitrite, based on poly(4-aminoacetanilide), J. Chin. Chem. Soc., 58, 247 (2011).
34. L.A.P. Filho, R.M. Takeuchi, M.A.G. Trindade, A.L. Santos, Determinação voltamétrica de nitrito empregando o íon [Fe(CN)6]3- como mediador eletroquímico, Orbital Elec. J. Chem., 7, 10 (2015).
35. Y. Ohnuki, T. Ohsaka, H. Matsuda, N.J. Oyama, Permselectivity of films, prepared by electrochemical oxidation of phenol and amino-aromatic compounds, Electroanal. Chem., 158, 55 (1983).
36. A. Volkov, G. Tourillon, P.C. Lacaze, J.E. Dubois, Electrochemical polymerization of aromatic amines. IR, XPS and PMT study of thin film formation at Pt electrode, J. Electroanal. Chem., 115, 279 (1980).
37. V.M. de Andrade, "Confecção de biossensores através da imobilização de biocomponentes por eletropolimerização de pirrol", Tés. M. Eng. UFRGS, Porto Alegre, 2006.
38. J.P.Tosar-Rovira, "Estudio de la inmovilización de oligonucleótidos a eléctrodos modificados de oro:polipirrol, y detección electroquímica de secuencias complementarias", Tes. Lic. Bioquím., Universidad de la República, Montevideo, 2008.
39. A. Ramanavicius, A. Ramanaviciene, A. Malinauskas, Electrochemical sensors, based on conducting polymer polypyrrole, Electrochim. Acta, 51, 6025 (2006).
40. R. Singh, Prospects of organic conducting polymer modified electrodes: Enzymosensors, Int. J. Electrochem., ID 502707 (2012).
41. D. Zane, G.B. Appetecchi, C. Bianchini et al., An impedimetric glucose biosensor on overoxidized polypyrrole thin film, Electroanal., 23, 1134 (2011).
42. T. McQuade, A. Pullen, T.M. Swager, Conjugated polymer based chemical sensors, Chem. Rev., 100, 2537 (2000).
43. R. Ojani, J.B. Raoof, A. Ahmady, S.R. Hosseini, High improved methanol oxidation onto carbon paste electrode modified by nickel particles dispersed into poly(2,5-dimethylamine) film, Casp. J. Chem., 2, 45 (2013).
44. A.S. Liu, M.A.S. Oliveira, Electrodeposition of polypyrrole films on aluminium from tartrate aqueous solution, J. Braz. Chem. Soc., 18, 143 (2007).
45. D. Sazou, The dynamic behavior of the electrochemical polymerization of indole in acetonitrile - water mixtures, Synth. Met., 130, 45 (2002).
46. I. Das, N. Goel, N.R. Agrawal, S.K. Gupta, Growth patterns of dendrimers and electric potential oscillations during electropolymerization of pyrrole using mono- and mixed surfactants, J. Phys. Chem., 114, 12888 (2010).
47. M. Bazzaoui, E.A. Bazzaoui, L. Martins, J.I. Martins, Electropolymerization of pyrrole on zinc-lead-silver alloys' electrodes in neutral and acid organic media, Synth. Met., 130, 73 (2002).
48. I. Das, N. Goel, S. K. Gupta, N.R. Agrawal, Electropolymerization of pyrrole: Dendrimers, nano-sized patterns and oscillations in potential in presence of aromatic and aliphatic surfactants, J. Electroanal. Chem., 670, 1 (2012).
49. K. Aoki, I. Mukoyama, J. Chen, Competition between polymerization and dissolution of poly(3-methylthiophene) films, Russ. J. Electrochem., 3, 319 (2004).
50. I. Das, N.R. Agrawal, S.A. Ansari, S.K. Gupta, Pattern formation and oscillatory polymerization of thiophene, Ind. J. Chem., 47A, 1798 (2008).
51. M.S. Ba-Shammakh, "Electropolymerization of pyrrole on mild steel for corrosion protection", Ph.D. Thes., King Fahd University of Petroleum and Minerals, Dharan, Saudi Arabia, 2002.
52. A. Olexova, M. Milichercik, L. Treindl, Oscillatory oxidation of Mn(II) ions by hexacyanoferrates(III) and bistability in the reductions of MnO 2 by hexacyanoferrates(II) in a CSTR, Chem. Phys. Lett., 268, 505 (1997).
53. V. Tkach, V. Nechyporuk, P. Yagodynets´, The mathematical stability study of the work of isomerization sensors, based on conduction polymers, Anal. Bioanal. Electrochem., 6, 273 (2014).
54. V. Tkach, R. Ojani, S.C. de Oliveira et al., The mathematical description for the hydrazine detection by Michael reaction with naphtholaminosulphonic acids, Anal. Bioanal. Electrochem., 7, 291 (2015).
55. V. Tkach, R. Ojani, M.O.G. Espínola et al., A descrição matemática do desempenho eletroanalítico e eletrocatalítico de tetracloroortoquinona na oxidação eletroquímica de sulfito no meio ácido, Quím. Ciên. Tecn. Soc., 3, 35 (2014).
56. V. Tkach, V. Nechyporuk, P. Yagodynets´, A descrição matemática do processo da detecção de duas substâncias com um grupo funcional comum pelos sensores e biossensores eletroquímicos baseados nos polímeros condutores, Rev. Colomb. Cienc. Quím. Farm., 42, 215 (2013).
57. V. Tkach, V. Nechyporuk, P. Yagodynets´, I. Rusnak, Los biossensores, basados en los polímeros conductores, y la descripción matemática de su desempeño, Orbital Elec. J. Chem., 4, 136 (2012).
58. V. Tkach, V. Nechyporuk, P. Yagodynets´, Yu. Meslyuk, Mathematical model of the work of the mediated conducting polymer sensors with the use of the polymers of heterocyclic compounds, Rev. Soc. Quím. Perú, 77, 259 (2011).
59. V. Tkach, H. Nascimento, V. Nechyporuk, P. Yagodynets´, A descrição matemática do desempenho de sensores e biossensores eletroquímicos de pH, baseados em polímeros condutores, no processo de medição do pH dos líquidos de cavidade bucal no modo de voltagem constante, Rev. Colomb. Cienc. Quím. Farm., 43, 196 (2014).
60. V. Tkach, B. Kumara-Swamy, R. Ojani, El mecanismo de la oxidación de omeprazol sobre el electrodo de carbono vitroso, modificado por polializarina, y su descripción matemática, Orbital Elec. J. Chem., 7, 1 (2015).
61. V. Tkach, B. Kumara Swamy, R. Ojani et al., O comportamento de paracetamol durante a sua oxidação eletrocatalítica sobre poli(azul da anilina) e a sua descrição matemática, Rev. Colomb. Cienc. Quím. Farm., 44, 148 (2015).
62. V. Tkach, V. Nechyporuk, R. Ojani, P. Yagodynets´, M. Tazyrov, Anales del XXX Congreso Argentino de Química, 22 al 24 de Octubre de 2014, Buenos Aires., URL: http://aqa.org.ar/pdf101/cd/Qca.Analitica/1-001.pdf, acesso aos 7 de Febrero de 2015.
63. V. Tkach, S. Tajik, R. Ojani et al., Mecanismo de desempenho eletroanalítico de 2,7-bis(ferroceniletinil)fluoreno-9-ona para eletrodetecção da hidrazina e sua descrição matemática, Rev. Colomb. Cienc. Quím. Farm., 44, 208 (2015).
64. V. Tkach, V. Nechyporuk, P. Yagodynets´, Proceedings of the 1st CQM Annual Meeting and the 9th Materials' Group Meeting of the University of Madeira, 31st of January – 1st of February 2014, Funchal, Região Autónoma da Madeira, Portugal, p. 37.
65. V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets, Modelagem matemática do desempenho de elétrodos, modificados por camada de ferroceno nos processos da eletrooxidação de compostos orgânicos em meios neutro e ácido, Rev. Colomb. Cienc. Quím. Farm., 43, 35 (2014).
66. V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets´, III Encontro em Técnicas de Caracterização em Análise Química, 6 de junho de 2014, Braga, Portugal, p. 72.
67. V. Tkach, S.C. de Oliveira, G. Maia et al., The mathematical investigation for the oxidation of phenolic compounds over CoO(OH) in alkaline solution, Mor. J. Chem., 4, 112 (2016).
68. V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets´, A descrição matemática do desempenho eletroanalítico de nanopartículas de óxido de cobre (II) na eletrodetecção de hidrazina, Orbital. Elec. J. Chem., 6, 142 (2014).
69. R. Hosseinzadeh, R. Ojani, L. Shabani, Synthesis and electrochemical study of some novel alkynylferrocene derivatives, Curr. Chem. Lett., 3, 37 (2014).
70. J.B. Raoof, R. Ojani, H. Karimi-Maleh et al., Multi-wall carbon nanotubes as a sensor and ferrocene dicarboxylic acid as a mediator for voltammetric determination of glutathione in hemolysed erythrocyte, Anal. Meth., 3, 2637 (2011).
Referencias
(1) http://www.inmoment.ru/beauty/health-body/nitrates.html, Acesso aos 7 de abril de 2015.
(2) H. Yetim, A. Kayacier, Z. Kesmen, O. Sagdic, The effects of nitrite on the survival of Clostridium sporogenes and the autoxidation properties of the Kavurma, Meat Sci., 72, 206 (2006).
(3) Y. Jung, N. Singh, K.-Sh.Choi, Cathodic Deposition of polypyrrole enabling the one-step assembly of metal–polymer hybrid electrodes, Angew. Chem. Int. Ed., 48, 8331 (2009).
(4) S. Sadki, P. Schottland, N. Brodie, G. Saboraud, The mechanisms of pyrrole electropolymerization, Chem. Soc. Rev., 29, 283 (2009).
(5) N. Alizadeh, M. Babaei, S. Nabavi, Gas sensing ability of a nanostructured conducting polypyrrole film prepared by catalytic electropolymerization on Cu/Au interdigital electrodes, Electroanal., 25, 2181 (2013).
(6) M. Gholami, A-M. Ghasemi, M.M. Loghavi et al., Preparation of a miniaturised iodide ion selective sensor using polypyrrole and pencil lead: effect of dou- ble coating , electropolymerisation time, and current density, Chem. Papers, 67, 1079 (2013).
(7) I.A. Wolff, A.E. Wasserman, Nitrates, nitrites and nitrosamines, Science, 177, 15 (1972).
(8) C. Yang, Q. Lu, S. Hu, A novel nitrite amperometric sensor and its application in food analysis, Electroan., 18, 2188 (2006).
(9) M.J. Moorcroft, J. Davis, R.G. Compton, Detection and determination of nitrate and nitrite: A review, Talanta, 54, 785 (2001).
(10) E. Morcos, N.P. Wiklund, Nitrite and nitrate measurement in human urine by capillary electrophoresis, Electrophoresis, 22, 2763 (2001).
(11) V.Y. Titov, Y.M. Petrenko, Proposed mechanism of nitrite-induced methemoglobinemia, Biochemistry, 70, 473 (2005).
(12) M. Bru, M.I. Burguete, F. Galindo et al., Cross-linked poly(2-hydroxyethyl- methacrylate) films doped with 1,2-diaminoanthraquinone (DAQ) as efficient materials for the colorimetric sensing of nitric oxide and nitrite anion, Tetrahedron Lett., 47, 1787 (2006).
(13) Brasil, Ministério da agricultura, Pecuária e Abastecimento, Portaria nº 59 de 19 de março de 2009, Disponível em: http://www.tuvsud.com.br/uploads/images/1401819075227662290092/ministerio-da-agricultura-fisico-quimicaanimal- e-agua-escopo.pdf , acesso em outubro, 2014.
(14) P. Mikusuka, Z. Vecera, Flow-injection chemiluminescence determination of low concentrations of nitrite in water, Anal. Chim. Acta, 495, 225 (2003).
(15) I.M.P.L.V.O. Ferreira, S. Silva, Quantification of residual nitrite and nitrate in ham by reverse-phase high performance liquid chromatography/diode array detector, Talanta, 74, 1598 (2008).
(16) M.I.H. Helaleh, T. Korenaga, Ion chromatographic method for simultaneous determination of nitrate and nitrite in human saliva, J. Chromatogr. B, 744, 433 (2000).
(17) E. Szoko, T. Tabi, A.S. Halasz et al., High sensitivity analysis of nitrite and nitrate in biological samples by capillary zone electrophoresis with transient isotachophoretic sample stacking, J. Chromatogr. A, 1051, 177 (2004).
(18) X. Cai, Z. Zhao, Determination of trace nitrite by catalytic polarography in ferrous iron thiocyanate medium, J. Electroanal. Chem., 252, 361 (1988).
(19) J.E. Newbry, M.P.L. Haddad, Amperometric determination of nitrite by oxidation at a glassy carbon electrode, Analyst, 110, 8 (1985).
(20) M. Trojanowicz, W. Matuszewski, B. Szostek, Simulataneous determination of nitrite and nitrate in water using flow-injection biamperometry, Anal. Chim. Acta, 261, 391 (1992).
(21) Z.H. Wen, T.F. Kang, Determination of nitrite using sensors based on nickel phthalocyanine polymer modified electrodes, Talanta, 62, 351 (2004).
(22) M. Thamae, T. Nyokong, Cobalt(II) porphyrazine catalysed reduction of nitrite, J. Electroanal. Chem., 470, 126 (1999).
(23) J. Obirai, T. Nyokong, J. Obirai, T. Nyokong, Electrochemical and catalytic properties of chromium tetraaminophthalocyanine, Electroanal. Chem., 573, 77 (2004).
(24) J. Davis, M.J. Moorcroft, S.J. Wilkins et al., Electrochemical detection of nitrate and nitrite at a copper modified electrode, Analyst, 125, 737 (2000).
(25) L. Ruhlmaann, G. Genet, Wells–Dawson-derived tetrameric complexes {K28H8[P2W15Ti3O60.5]4} electrochemical behaviour and electrocatalytic reduction of nitrite and of nitric oxide, J. Electroanal. Chem., 568, 315 (2004).
(26) B. Keita, I. M. Mbomekalle, L. Nadjo, R. Contant, A novel Dawson heteropolyanion and two of its sandwich-type derivatives [Zn4(H2O)2(H4AsW15O56)2]18-[Cu4(H2O)2(H4AsW15O56)2]18−: Cyclic voltammetry and electrocatalytic properties towards nitrite and nitrate, Electrochem. Comm., 3, 267 (2001).
(27) I. Chad, B. Mekki, B. Emek et al., Electrocatalytic reductions of nitrite, nitric oxide, and nitrous oxide by thermophilic cytochrome P450 CYP119 in film- modified electrodes and an analytical comparison of its catalytic activities with myoglobin, J. Am. Chem. Soc., 126, 4934 (2004).
(28) L. Liu L. Tian, H. Xu, N. Lu, Electrochemical properties of organo-titanium substituted heteropolytungstate and its electrocatalytic reduction of nitrite, J. Electroanal. Chem., 587, 213 (2006).
(29) R. Ojani, J.B. Raoof, E. Zarei, Electrocatalytic reduction of nitrite using ferricyanide: Application for its simple and selective determination, Electrochim. Acta, 52, 753 (2006).
(30) R. Ojani, J.B. Raoof, E. Zarei, Poly(ortho-toluidine) modified carbon paste electrode: A sensor for electrocatalytic reduction of nitrite, Electroanal., 20, 79 (2008).
(31) R. Ojani, M.A. Rahmanifar, P. Naderi, Electrocatalytic reduction of nitrite by phosphotungstic heteropoly,anion. Application for its simple and selective determination, Electroanal.20, 1092 (2008).
(32) J.B. Raoof, R. Ojani, M. Ramine, Voltammetric sensor for nitrite determination based on its electrocatalytic reduction at the surface of p-duroquinone modified carbon paste electrode, J. Solid. State Electrochem., 13, 1311 (2009).
(33) R. Ojani, J.B. Raoof, V. Rahemi, A simple and efficient electrochemical sensor for electrocatalytic reduction of nitrite, based on poly(4-aminoacetanilide), J. Chin. Chem. Soc., 58, 247 (2011).
(34) L.A.P. Filho, R.M. Takeuchi, M.A.G. Trindade, A.L. Santos, Determinação voltamétrica de nitrito empregando o íon [Fe(CN)6]3– como mediador eletroquí- mico, Orbital Elec. J. Chem., 7, 10 (2015).
(35) Y. Ohnuki, T. Ohsaka, H. Matsuda, N.J. Oyama, Permselectivity of films, prepared by electrochemical oxidation of phenol and amino-aromatic compounds, Electroanal. Chem., 158, 55 (1983).
(36) A. Volkov, G. Tourillon, P.C. Lacaze, J.E. Dubois, Electrochemical polymerization of aromatic amines. IR, XPS and PMT study of thin film formation at Pt electrode, J. Electroanal. Chem., 115, 279 (1980).
(37) V.M. de Andrade, “Confecção de biossensores através da imobilização de biocomponentes por eletropolimerização de pirrol”, Tés. M. Eng. UFRGS, Porto Alegre, 2006.
(38) J.P. Tosar-Rovira, “Estudio de la inmovilización de oligonucleótidos a eléctrodos modificados de oro:polipirrol, y detección electroquímica de secuencias complementarias”, Tes. Lic. Bioquím., Universidad de la República, Montevideo, 2008.
(39) A. Ramanavicius, A. Ramanaviciene, A. Malinauskas, Electrochemical sensors, based on conducting polymer polypyrrole, Electrochim. Acta, 51, 6025 (2006).
(40) R. Singh, Prospects of organic conducting polymer modified electrodes: Enzymosensors, Int. J. Electrochem., ID 502707 (2012).
(41) D. Zane, G.B. Appetecchi, C. Bianchini et al., An impedimetric glucose biosensor on overoxidized polypyrrole thin film, Electroanal., 23, 1134 (2011).
(42) T. McQuade, A. Pullen, T.M. Swager, Conjugated polymer based chemical sensors, Chem. Rev., 100, 2537 (2000).
(43) R. Ojani, J.B. Raoof, A. Ahmady, S.R. Hosseini, High improved metanol oxidation onto carbon paste electrode modified by nickel particles dispersed into poly(2,5-dimethylamine) film, Casp. J. Chem., 2, 45 (2013).
(44) A.S. Liu, M.A.S. Oliveira, Electrodeposition of polypyrrole films on aluminium from tartrate aqueous solution, J. Braz. Chem. Soc., 18, 143 (2007).
(45) D. Sazou, The dynamic behavior of the electrochemical polymerization of indole in acetonitrile–water mixtures, Synth. Met., 130, 45 (2002).
(46) I. Das, N. Goel, N.R. Agrawal, S.K. Gupta, Growth patterns of dendrimers and electric potential oscillations during electropolymerization of pyrrole using mono and mixed surfactants, J. Phys. Chem., 114, 12888 (2010).
(47) M. Bazzaoui, E.A. Bazzaoui, L. Martins, J.I. Martins, Electropolymerization of pyrrole on zinc-lead-silver alloys’ electrodes in neutral and acid organic media, Synth. Met., 130, 73 (2002).
(48) I. Das, N. Goel, S. K. Gupta, N.R. Agrawal, Electropolymerization of pyrrole: Dendrimers, nano-sized patterns and oscillations in potential in presence of aromatic and aliphatic surfactants, J. Electroanal. Chem., 670, 1 (2012).
(49) K. Aoki, I. Mukoyama, J. Chen, Competition between polymerization and dissolution of poly(3-methylthiophene) films, Russ. J. Electrochem., 3, 319 (2004).
(50) I. Das, N.R. Agrawal, S.A. Ansari, S.K. Gupta, Pattern formation and oscillatory polymerization of thiophene, Ind. J. Chem., 47A, 1798 (2008).
(51) M.S. Ba-Shammakh, “Electropolymerization of pyrrole on mild steel for corrosion protection”, Ph.D. Thes., King Fahd University of Petroleum and Minerals, Dharan, Saudi Arabia, 2002.
(52) A. Olexova, M. Milichercik, L. Treindl, Oscillatory oxidation of Mn(II) ions by hexacyanoferrates(III) and bistability in the reductions of MnO 2 by hexacyanoferrates(II) in a CSTR, Chem. Phys. Lett., 268, 505 (1997).
(53) V. Tkach, V. Nechyporuk, P. Yagodynets´, The mathematical stability study of the work of isomerization sensors, based on conduction polymers, Anal. Bioanal. Electrochem., 6, 273 (2014).
(54) V. Tkach, R. Ojani, S.C. de Oliveira et al., The mathematical description for the hydrazine detection by Michael reaction with naphtholaminosulphonic acids, Anal. Bioanal. Electrochem., 7, 291 (2015).
(55) V. Tkach, R. Ojani, M.O.G. Espínola et al., A descrição matemática do desempenho eletroanalítico e eletrocatalítico de tetracloroortoquinona na oxidação eletroquímica de sulfito no meio ácido, Quím. Ciên. Tecn. Soc., 3, 35 (2014).
(56) V. Tkach, V. Nechyporuk, P. Yagodynets´, A descrição matemática do processo da detecção de duas substâncias com um grupo funcional comum pelos sensores e biossensores eletroquímicos baseados nos polímeros condutores, Rev. Colomb. Cienc. Quím. Farm., 42, 215 (2013).
(57) V. Tkach, V. Nechyporuk, P. Yagodynets´, I. Rusnak, Los biossensores, basados en los polímeros conductores, y la descripción matemática de su desempeño, Orbital Elec. J. Chem., 4, 136 (2012).
(58) V. Tkach, V. Nechyporuk, P. Yagodynets´, Yu. Meslyuk, Mathematical model of the work of the mediated conducting polymer sensors with the use of the polymers of heterocyclic compounds, Rev. Soc. Quím. Perú, 77, 259 (2011).
(59) V. Tkach, H. Nascimento, V. Nechyporuk, P. Yagodynets´, A descrição matemática do desempenho de sensores e biossensores eletroquímicos de pH, baseados em polímeros condutores, no processo de medição do pH dos líquidos de cavidade bucal no modo de voltagem constante, Rev. Colomb. Cienc. Quím. Farm., 43, 196 (2014).
(60) V. Tkach, B. Kumara-Swamy, R. Ojani, El mecanismo de la oxidación de omeprazol sobre el electrodo de carbono vitroso, modificado por polializarina, y su descripción matemática, Orbital Elec. J. Chem., 7, 1 (2015).
(61) V. Tkach, B. Kumara Swamy, R. Ojani et al., O comportamento de paracetamol durante a sua oxidação eletrocatalítica sobre poli(azul da anilina) e a sua descrição matemática, Rev. Colomb. Cienc. Quím. Farm., 44, 148 (2015).
(62) V. Tkach, V. Nechyporuk, R. Ojani, P. Yagodynets´, M. Tazyrov, Anales del XXX Congreso Argentino de Química, 22 al 24 de octubre de 2014, Buenos Aires., URL: http://aqa.org.ar/pdf101/cd/Qca.Analitica/1-001.pdf , acesso aos 7 de Febrero de 2015.
(63) V. Tkach, S. Tajik, R. Ojani et al., Mecanismo de desempenho eletroanalítico de 2,7-bis(ferroceniletinil)fluoreno-9-ona para eletrodetecção da hidrazina e sua descrição matemática, Rev. Colomb. Cienc. Quím. Farm., 44, 208 (2015).
(64) V. Tkach, V. Nechyporuk, P. Yagodynets´, Proceedings of the 1st CQM Annual Meeting and the 9th Materials’ Group Meeting of the University of Madeira, 31st of January – 1st of February 2014, Funchal, Região Autónoma da Madeira, Portugal, p. 37.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Licencia
Derechos de autor 2016 Revista Colombiana de Ciencias Químico-Farmacéuticas

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
El Departamento de Farmacia de la Facultad de Ciencias de la Universidad Nacional de Colombia autoriza la fotocopia de artículos y textos para fines de uso académico o interno de las instituciones citando la fuente. Las ideas emitidas por los autores son responsabilidad expresa de estos y no de la revista.
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons de Atribución 4.0 aprobada en Colombia. Consulte la normativa en: http://co.creativecommons.org/?page_id=13



















