Estudio comparativo de la calidad biofarmacéutica de marcas comerciales y multifuente de tabletas de ibuprofeno en el mercado colombiano
Comparative study of the biopharmaceutical quality of commercial brands and multisource of ibuprofen tablets in the Colombian market
DOI:
https://doi.org/10.15446/rcciquifa.v46n1.67291Palabras clave:
Ibuprofeno, AINEs, biofarmacéuticos, disolución, factor de similitud f2, sistema de clasificación biofarmacéutica (es)Ibuprofen, NSAIDs, biopharmaceutical, dissolution, f2 similarity factor, biopharmaceutical classification system (en)
ibuprofeno. Con el fin de evaluar la conformidad de los productos y determinar su equivalencia biofarmacéutica, se adquirieron y evaluaron un total de 10 productos comerciales.
Estos se compraron en establecimientos comerciales de cuatro de las principales ciudades del país: Cartagena, Barranquilla, Bogotá y Cali. Para ello, se evaluaron las características físicas, químicas y biofarmacéuticas de las tabletas, tales como variación
de peso, dureza, desintegración, prueba de disolución, perfil de disolución, eficiencia de la disolución y valoración de principio activo a partir de metodologías validadas. Los ensayos farmacopeicos se evaluaron según lo establecido en la USP 39. Los resultados
permitieron establecer que todos los productos evaluados cumplieron con las especificaciones de la Farmacopea, con respecto a contenido de ingrediente activo y prueba de disolución. En cuanto al comportamiento biofarmacéutico, pese a que todas
las marcas cumplen con las especificaciones farmacopeicas, solo tres de las 10 marcas evaluadas son biofarmacéuticamente equivalentes con el innovador. Los resultados de este trabajo permiten proponer a la comunidad científica la determinación de la equivalencia biofarmacéutica como elemento de apoyo en la toma de decisiones de compra en el servicio farmacéutico.
The mostwidelyuseddrugsintheworldarenon-steroidalanti-inflammatoryanal- analgesics (NSAIDs), because of their ability to relieve pain, a condition common to many pathologies. One of the widely used NSAIDs in Colombia is Ibuprofen. To assess the conformity of products and determine their biopharmaceutical equivalence, a total of 10 commercial products were purchased and evaluated. These were bought in commercial establishments of four of the main cities of the country: Cartagena, Barranquilla, Bogota and Cali. For this purpose, the physical, chemical and biopharmaceutical characteristics of the tablets were evaluated, such as weight variation, hardness, disintegration, dissolution test, dissolution profile, dissolution efficiency and active ingredient titration from validated methodologies. The pharmacopoeial tests were evaluated according to USP 39. The results allowed to establish that all evaluated products met the specifications of the pharmacopoeia with respect to content of active ingredient and test of dissolution. Regarding biopharmaceutical behavior, although all brands comply with pharmacopoeial specifications, only three of the ten brands evaluated are biopharmaceutically equivalent to the innovator. The results of this work allow proposing to the scientific community, the determination of biopharmaceutical equivalence as an element of support in making purchasing decisions in the pharmaceutical service.
Recibido: 8 de marzo de 2017; Aceptado: 25 de mayo de 2017
RESUMEN
Los medicamentos de mayor consumo en el mundo son los analgésicos antiinflamatorios no esteroideos (AINEs), debido a su capacidad para aliviar el dolor, condición común a muchas patologías. Uno de los AINEs de gran utilización en Colombia es el ibuprofeno. Con el fin de evaluar la conformidad de los productos y determinar su equivalencia biofarmacéutica, se adquirieron y evaluaron un total de 10 productos comerciales. Estos se compraron en establecimientos comerciales de cuatro de las principales ciudades del país: Cartagena, Barranquilla, Bogotá y Cali. Para ello, se evaluaron las características físicas, químicas y biofarmacéuticas de las tabletas, tales como variación de peso, dureza, desintegración, prueba de disolución, perfil de disolución, eficiencia de la disolución y valoración de principio activo a partir de metodologías validadas. Los ensayos farmacopeicos se evaluaron según lo establecido en la USP 39. Los resultados permitieron establecer que todos los productos evaluados cumplieron con las especificaciones de la Farmacopea, con respecto a contenido de ingrediente activo y prueba de disolución. En cuanto al comportamiento biofarmacéutico, pese a que todas las marcas cumplen con las especificaciones farmacopeicas, solo tres de las 10 marcas evaluadas son biofarmacéuticamente equivalentes con el innovador. Los resultados de este trabajo permiten proponer a la comunidad científica la determinación de la equivalencia biofarmacéutica como elemento de apoyo en la toma de decisiones de compra en el servicio farmacéutico.
Palabras clave:
Ibuprofeno, AINEs, biofarmacéuticos, disolución, factor de similitud f2, sistema de clasificación biofarmacéutica.SUMMARY
The most widely used drugs in the world are non-steroidal anti-inflammatory analgesics (NSAIDs), because of their ability to relieve pain, a condition common to many pathologies. One of the widely used NSAIDs in Colombia is Ibuprofen. To assess the conformity of products and determine their biopharmaceutical equivalence, a total of 10 commercial products were purchased and evaluated. These were bought in commercial establishments of four of the main cities of the country: Cartagena, Barranquilla, Bogota and Cali. For this purpose, the physical, chemical and biopharmaceutical characteristics of the tablets were evaluated, such as weight variation, hardness, disintegration, dissolution test, dissolution profile, dissolution efficiency and active ingredient titration from validated methodologies. The pharma-copoeial tests were evaluated according to USP 39. The results allowed to establish that all evaluated products met the specifications of the pharmacopoeia with respect to content of active ingredient and test of dissolution. Regarding biopharmaceutical behavior, although all brands comply with pharmacopoeial specifications, only three of the ten brands evaluated are biopharmaceutically equivalent to the innovator. The results of this work allow proposing to the scientific community, the determination of biopharmaceutical equivalence as an element of support in making purchasing decisions in the pharmaceutical service.
Keywords:
Ibuprofen, NSAIDs, biopharmaceuticals, dissolution, f2 similarity factor, biopharmaceutical classification system.INTRODUCCIÓN
En Colombia, el mayor renglón de venta de medicamentos se relaciona con los analgésicos no narcóticos y antipiréticos [1-3], los cuales incluyen a los denominados "analgésicos antiinflamatorios no esteroideos" (AINE's) que, de acuerdo con las Normas Farmacológicas, en conjunto involucran 42 principios activos diferentes [4].
La condición de comercialización (venta libre, con fórmula médica, bajo control especial o para uso hospitalario exclusivamente), determina las circunstancias en las cuales puede ser publicitado y comercializado un medicamento. La venta libre no involucra una consulta al equipo de salud, de manera que se deja al paciente la elección del medicamento según su criterio, sin ningún tipo de seguimiento fármaco-terapéutico, y pre)valece como principio activo de mayor elección el diclofenaco, seguido de ibuprofeno y piroxicam. Esta situación es totalmente acorde con las altas cifras de consumo de estos medicamentos [5].
Los AINEs se encuentran en el listado de medicamentos esenciales del Plan Obligatorio de Salud (POS) [6], y los médicos en Colombia los deben prescribir bajo Denominación Común Internacional (DCI); de hecho, todas las entidades prestadoras de salud (EPS) las suministran como medicamentos multifuente, también conocidos como "genéricos" [7, 8]. Lamentablemente, la fuerte batalla comercial entre medicamentos innovadores y multifuente -que ha existido desde hace ya varias décadas en los mercados farmacéuticos internacional y nacional-, ha creado un ambiente de incertidumbre entre médicos y pacientes, quienes se cuestionan su calidad e intercambiabilidad [9, 10]. El favorecimiento de la legislación nacional para la comercialización de medicamentos multifuente a fin de reducir los costos, tanto para el sistema de salud, como para el paciente, no ha sido suficiente para eliminar el ambiente de desconfianza que permanece en torno a ellos [11, 12], sobre todo por el hecho de encontrarse diferencias muy notables de precios, aun entre productos multifuente.
Una alternativa que permite ofrecer elementos de juicio válidos para abordar este problema con datos experimentales, consiste en desarrollar estudios biofarmacéuticos in vitro, cuya aplicación reúne evidencia importante sobre la calidad de los medicamentos con una mínima inversión. Con el propósito de determinar el nivel de cumplimiento y la equivalencia biofarmacéutica entre tabletas comerciales de ibuprofeno de 400 mg, en este trabajo se describen los estándares de conformidad oficiales (Farmacopea americana-USP 39), tales como uniformidad de peso, dureza, desintegración, prueba de disolución y valoración de principio activo, y no oficiales como perfil de disolución, área bajo la curva, eficiencia de la disolución y factor de similitud f2, evaluados en 10 marcas comerciales disponibles en establecimientos comerciales del país.
MATERIALES Y MÉTODOS
Muestras
Tabletas de ibuprofeno de 400 mg se adquirieron en diferentes droguerías o farmacias de Cartagena, Barranquilla, Bogotá y Cali, sin discriminar entre productos con denominación genérica y con marcas comerciales, incluyendo el innovador. Se procuró la mayor cantidad posible de marcas, de manera que se recolectaron 10 en total (tres de marca comercial, y siete con denominación genérica). Todas, con excepción de la marca F, tenían recubrimiento plano de color naranja. De cada marca se adquirieron dos lotes diferentes, 60 tabletas por lote, para un total de 1200 tabletas que ingresaron al estudio y en las cuales se observó que estuvieran dentro de su periodo de vida útil. Las marcas se codificaron de la A a la J, de forma aleatoria.
Reactivos y materiales
En la preparación y análisis de las muestras, se empleó hidróxido de sodio, fosfato monobásico de potasio y fosfato dibásico de sodio, de grado analítico cada uno ( JT Baker, USA); metanol (MeOH) y acetonitrilo (MeCN) de grado cromatográfico (JT Baker, USA); y un estándar secundario de ibuprofeno (materia prima valorada), titulado contra estándar primario, gentil donación de un laboratorio farmacéutico de la ciudad de Bogotá, de título 99,96%, almacenado bajo rigurosas condiciones de control de temperatura y humedad (20 °C, 40% HR). Aquellas disoluciones empleadas como fase móvil en la cromatografía se filtraron empleando membranas de nylon de 0,45 μπι en el tamaño del poro. Una columna Chromolit® Performance RP-18 (Merck Milli-pore, USA), de dimensiones 100 x 4,6 mm y 2μη1 en tamaño de partícula, se utilizó en la separación cromatográfica.
Instrumentación
Los ensayos físicos se realizaron empleando un durómetro digital Kreamer HC-6.2 (Darmstadt, Alemania); una balanza analítica Ohaus Adventurer (New Jersey, USA); un desintegrador Vankel VK-7, modelo 10-911-71-C (Alemania). En la realización de los ensayos químicos se empleó un equipo de cromatografía líquida Lachrom Elite® (Merck-Hitachi, Tokio, Japón), equipado con bomba cuaternaria, desgasificador en línea, automuestreador, horno para columna y un sistema de detección basado en hilera de diodos (DAD); un disolutor LID-6 (Vanguard Pharmaceutical Spring Inc., Texas, E.U.); un espectrofotómetro UV-Vis S2100 (Cole Parmer, Vernon Hills, IL, E.U.), un sistema purificador de agua Milli-Q (Millipore, Bedford, MA, E.U.), y un baño de ultrasonido (Cole-Parmer 8853, Vernon Hills, IL, E.U.).
Ensayos físicos
Estos ensayos se desarrollaron según se describe en los correspondientes capítulos de la Farmacopea americana 39 [13].
Descripción de las tabletas
De manera aleatoria, se tomaron 10 tabletas de ibuprofeno por lote, examinándolas individualmente y evaluando en cada una sus dimensiones (alto, diámetro mayor y diámetro menor). Se calculó el valor promedio y la desviación estándar (SD) de cada parámetro analizado.
Determinación de la dureza
Se tomaron seis tabletas de ibuprofeno por lote y se midió la fuerza de ruptura (Kg-f) de las tabletas con un durómetro digital.
Uniformidad de peso
Aleatoriamente se seleccionaron 10 tabletas de ibuprofeno por lote, y se registró con exactitud el peso individual obtenido con una balanza analítica. Se calculó el promedio y la SD.
Prueba de desintegración
Se colocaron seis tabletas de un mismo lote en cada una de las celdas de la canastilla del equipo de desintegración, utilizando agua desionizada como medio de inmersión a una temperatura de 37 °C ± 2 °C. Se determinó el tiempo que tardó cada tableta en desintegrarse totalmente.
Ensayos químicos
Validación del método analítico
La validación del método se realizó teniendo en cuenta los lineamientos establecidos en la Conferencia Internacional de Armonización (ICH) [14] y la Farmacopea americana, en términos de los siguientes parámetros:
Selectividad. Para demostrar que la señal obtenida correspondía únicamente a ibuprofeno y no a impurezas o productos de degradación, disoluciones patrón de ibuprofeno (10 mg L-1) se sometieron a cambios de pH y condiciones de oxidación, mediante reflujo con HCl 0,1N; NaOH 0,1 N y H2O2 1%v/v. En todos los casos la condición de exposición fue 60 °C durante 30 minutos, excepto para el agente oxidante, el cual se expuso a 30 °C, tal como lo especifica la guía de la ICH Q1AR en sus prueba de estabilidad para productos farmacéuticos [15].
Linealidad. A fin de evaluar el intervalo de concentraciones dentro del cual existe correlación lineal entre variaciones de la concentración de ibuprofeno y la respuesta instrumental, se prepararon seis disoluciones de trabajo con concentraciones entre 2,5 y 40 ppm. Cada disolución se inyectó por triplicado y se registró el área bajo la curva (ABC) del pico cromatográfico, calculándose el coeficiente de regresión lineal y la ecuación de la recta. Para evaluar la variabilidad de la curva de calibrado, las pendientes de tres curvas preparadas en tres días distintos se compararon utilizando el programa estadístico GraphPad Prism (versión 5.0), lo que permitió constatar correlaciones y comparaciones entre las pendientes por medio de prueba t de Student y F de Fisher de las curvas de calibrado durante los días de análisis, con un intervalo de confianza del 95%.
Robustez. Con el propósito de evaluar la robustez del método optimizado, se realizaron cambios deliberados en parámetros tales como la composición de la fase móvil, el caudal y la longitud de onda de detección [16, 17].
Exactitud. La exactitud se expresó como porcentaje de recuperación, obtenido de com) parar el ABC de tres disoluciones de muestras de medicamento innovador (exactitud del método), contra las ABC de tres disoluciones patrón de ibuprofeno (exactitud del sistema). Las disoluciones se prepararon en el intervalo de 5 a 30 mg L-1, empleándose tres réplicas en cada caso.
Precisión. La precisión se calculó en términos de repetibilidad (intradía) y precisión inter)media (interdías). En el primer caso, se registró el ABC de 10 réplicas de disoluciones patrón y del medicamento innovador, preparadas a una concentración de 10 mg L-1. La precisión se expresó en términos de la desviación estándar relativa (RSD, %). La precisión intermedia se determinó calculando el ABC de tres réplicas de disoluciones patrón y del medicamento innovador, preparadas a una concentración de 10 mg L-1 por analistas diferentes en tres días distintos. Se analizaron los resultados determinándose la desviación estándar relativa (RSD) en cada caso.
Valoración de principio activo
Para la determinación confiable de ibuprofeno, se optimizó y validó el método analítico descrito anteriormente, por cromatografía líquida de alta eficiencia con arreglo de diodos (HPLC-DAD). A partir de un pulverizado obtenido de 10 tabletas, se pesó y disolvió una porción en MeOH, con el fin de obtener una disolución de concentración 100 mg L-1. La disolución, previamente expuesta al baño de ultrasonido (15 min), y filtrada por membrana PVDF de 0,45 μιιι, se diluyó a 10 mg L-1, empleando MeOH como diluyente. Cada lote se preparó individualmente y se analizó por triplicado. Alícuotas de 10 µL de disolución, se inyectaron para su análisis cromatográfico, con base en el empleo de fase estacionaria RP-18 y una fase móvil constituida por una mezcla tampón fosfato (200 mM, pH 6,5)/MeCN, 65:35 %v/v, movida a caudal de 1 mL min1. La longitud de onda de detección fue de 197 nm.
Perfiles de disolución
Para este ensayo se utilizaron las condiciones establecidas en la monografía de ibuprofeno tabletas de la USP 39 [13], a saber: 900 mL de buffer de fosfato a pH 7,2 como medio de disolución, a 50 rpm por 60 minutos, pero tomando alícuotas a los 2, 5, 10, 15, 30, 45, 60 y 75 minutos. Las lecturas se realizaron por espectroscopía UV a 221 nm, empleando curva de calibración del estándar disuelto en el mismo medio. Un total de 12 réplicas por lote se realizaron, empleando el aparato #2 (paletas).
Análisis estadístico
Los datos obtenidos se organizaron utilizando el programa MS Excel 2010. Los análisis se realizaron empleando el programa estadístico GraphPad Prism Vesion 5.0, mediante pruebas t de Student y Anova, seguidas de la prueba de Tukey para comparaciones múltiples, según cada caso. Los perfiles de disolución de los productos de ibuprofeno en estudio se generaron al graficar la cantidad de fármaco disuelta vs. tiempo. A partir de la información proporcionada por las curvas, se evaluaron las áreas bajo la curva (ABC) y la eficiencia de la disolución (ED) para cada una de ellas, y así se realizaron las comparaciones [18]. La eficiencia de disolución (ED) se calculó desde los perfiles de disolución como la razón entre el área bajo la curva de disolución hasta el minuto 75, utilizando la regla trapezoidal y el área total del rectángulo que describe el 100% de la disolución a ese tiempo expresada en porcentaje, empleando la ecuación 1[19].
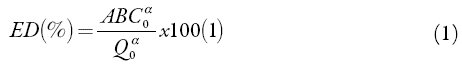
De igual forma, se realizó el análisis independiente de factor de similitud f2, con el fin de determinar la existencia de diferencias estadísticamente significativas entre las marcas analizadas, empleando la ecuación 2 [20, 21].
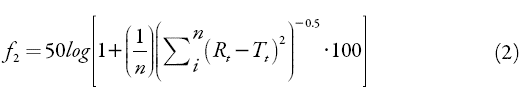
Donde n es el número de puntos de muestreo, y R y T los valores del porcentaje de fármaco disuelto (%Q) en cada punto, del producto de referencia y de otro evaluado, respectivamente.
RESULTADOS Y DISCUSIÓN
Ensayos físicos
Las dimensiones, el peso, la dureza y el tiempo de desintegración de las tabletas de las diferentes marcas evaluadas se presentan en la tabla 1.
*Lotes 1 y 2 son estadísticamente diferentes (p < 0,05). ‡Factor de similitud calculado para cada lote (eficiencias de disolución estadísticamente diferentes). Las medidas corresponden al valor medio ± desviación estándar.Tabla 1: Resultados obtenidos a partir de los ensayos físicos y químicos realizados sobre tabletas de ibuprofeno de 400 mg, disponibles en el comercio colombiano.
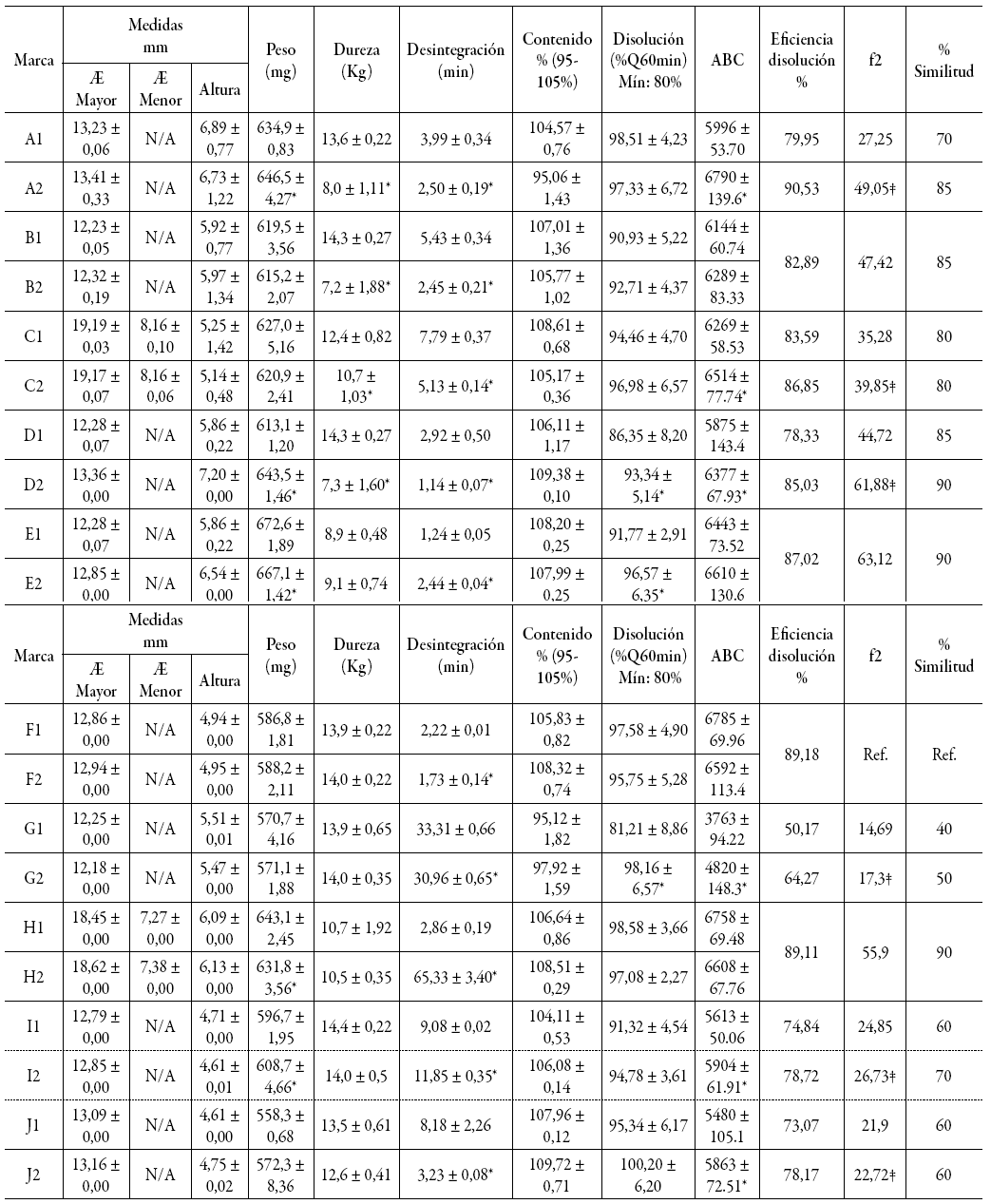
De las 10 marcas bajo estudio, ocho eran de forma circular, y dos de forma alargada u oblonga, observándose homogeneidad en el diámetro de aquellas de forma circular, a pesar de tratarse de marcas distintas. El diámetro de estas osciló entre 12,23 y 13,41mm, observándose poco más de 1mm de diferencia entre el mayor valor y el menor. En contraste, las alturas sí presentaron discrepancias más considerables, llegando a registrarse diferencias de hasta 2,59 mm. Por su parte, las dos marcas de forma alargada mostraron alturas y diámetros mayores y menores próximos entre sí.
Los pesos oscilaron entre 558 y 667 mg, lo que sugiere que los porcentajes de fármaco en la composición de los comprimidos oscilan entre el 60% y el 72% del peso total de las tabletas. En las marcas A, D, E, H e I, se encontraron diferencias estadísticamente significativas entre los pesos promedio de las tabletas de los lotes 1 y 2, diferencias que oscilaron entre los 5 y los 12 mg, aunque para la marca D esta diferencia alcanzó los 30 mg, lo que refleja una diferencia en el contenido de ingrediente activo cercano al 3% entre ambos lotes. La dureza media de las tabletas osciló entre los 8,0 y los 14,4 Kg-F. Las marcas E, F, G, H e I mostraron valores reproducibles entre sus lotes 1 y 2, en tanto que las marcas restantes no lo hicieron. Para la marca A, la diferencia de la dureza entre los lotes 1 y 2 fue del 60%, y para los lotes B y D alcanzó diferencias cercanas al 100%. Con respecto de la desintegración, no se observa una correlación entre esta y la dureza, aunque una observación particular merece la marca H, cuyo lote 1 tuvo un tiempo de desintegración bajo (2,86 min). Sin embargo, para el lote 2 este tiempo medio se prolongó hasta los 65,33 min, observándose que en todas las celdas permanecieron gránulos remanentes hasta ese tiempo, correspondientes a una fracción minoritaria de esas tabletas que no afectó el desempeño de la disolución, ni provocaron diferencias significativas en los valores de área bajo la curva; esto denota que su cinética de disolución fue la misma. Por su parte, la marca G reportó tiempos de desintegración relativamente altos para ambos lotes (poco más de media hora), y unas de las más altas durezas. Aunque ambos superaron la prueba de disolución, fue la marca cuyos lotes presentaron las más bajas eficiencias.
Pruebas de desempeño
Los desempeños corresponden a las pruebas de contenido, disolución y perfiles de disolución. Sus resultados se encuentran en la tabla 1.
Validación del método y valoración del principio activo
Con el fin de establecer las condiciones idóneas del sistema cromatográfico para la determinación de ibuprofeno en tabletas, inicialmente se observó la metodología recomendada por la USP 39, la cual sugiere el empleo de una disolución de ácido cloroacético, pH 3,0 como fase móvil.
Conociendo la elevada reactividad de los ácidos acéticos halogenados, el importante riesgo -que su manipulación representa para el analista, y el compromiso en desarrollar metodologías cada vez más amigables con el medio ambiente, el primer paso abordado en la optimización del método fue evaluar la fuerza elutrópica de otros disolventes que sustituyeran su uso. Se buscó así viabilizar dicho análisis, no solo en términos de calidad de los datos analíticos, sino también de mantener la vida útil de la columna cromatográfica y la protección a las personas.
Con base en la literatura disponible [22, 23], se decide evaluar mezclas de MeOH o MeCN con disoluciones de tampón fosfato (25 mM) ajustadas a pH 3,0 y 6,5. La inclusión de los primeros obedeció a la necesidad de obtener tiempos razonables de retención cromatográfica, mientras que la evaluación de dos valores de pH en la disolución reguladora se llevó a cabo considerando la dependencia de la solubilidad de ibuprofeno al pH.
Así, se ensayaron mezclas de componente orgánico/tampón, en proporciones 35:65 %v/v a caudales entre 0,7 y 1,5 mL min-1. De acuerdo con los resultados obtenidos, el empleo de MeOH y de la disolución reguladora a pH 3,0, aun en combinación con MeCN, condujo a tiempos de retención cromatográficos superiores a 15 minutos. Se desestimó entonces el empleo de MeOH y la optimización de la idoneidad del sistema se enfocó en el empleo de mezclas MeCN/tampón fosfato (25 mM, pH 3,0), incluyendo variaciones del componente orgánico desde 35% hasta 50% en la mezcla. El uso de la relación 50:50, %v/v a un caudal de 1,5 mL min-1 como fase móvil del sistema cromatográfico, proporcionó un factor de asimetría (f) de 1,75 y un número de platos teóricos (N) de 2745 en la separación de ibuprofeno, a un tiempo de cromatografía < 4,0 min. No obstante, se observó que la alta concentración de la disolución para análisis, recomendada por USP, conduce a picos con elevado ancho en la base y a incurrir en incrementos en costos del análisis. Por ello, luego de evaluar otras concentraciones, se decide continuar con disoluciones de concentración 100 mg L-1 en ibuprofeno.
Considerando ahora que la constante de ionización (pKa) de ibuprofeno en agua es de 5,3, y que el uso de disoluciones con valor de pH al menos una unidad superior a este conduce a incrementar la proporción de la especie ionizada, se evalúa la misma mezcla anterior, pero empleando la disolución reguladora de pH 6,5. Los cromatogramas obtenidos mostraron que el tiempo de retención analítico fue inferior a 1,5 minutos, lo cual significa que la transferencia de masa de las moléculas fue superior hacia la fase móvil con respecto a la que se dirige hacia la fase estacionaria, lo que demuestra su alta afinidad por la primera cuando su valor de pH se hace menos ácido. Este comportamiento conllevó a la pérdida de eficiencia en la columna cromatográfica (N = 646), por lo que se reevaluó la proporción de MeCN en la fase móvil.
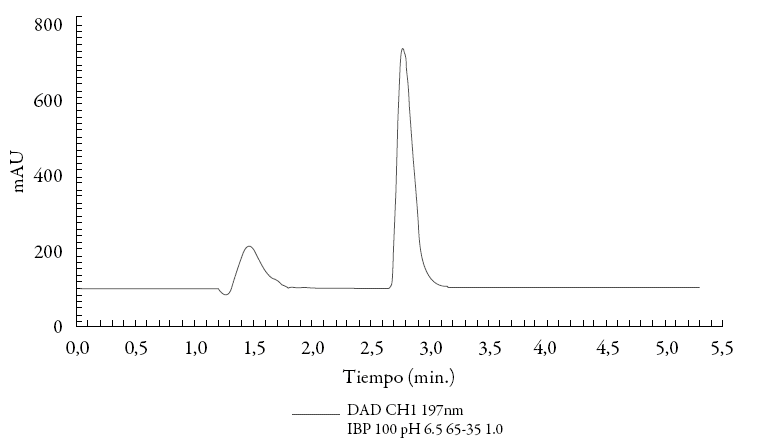
Así, se encontró que el empleo de una fase móvil MeCN/tampón fosfato (25 mM, pH 6,5), 35:65, %v/v movida a caudal de 1 mL min-1 en una columna de fase estacionaria RP-18 (100 x 4,6 mm, 2μm) termostatada a 25 °C, proporcionó las mejores condiciones de análisis al utilizar como longitud de onda de detección 197 nm, en lugar de la sugerida por la USP. La determinación de los parámetros de idoneidad cromatográfica mostró un N= 2153, f = 2,0, y una variabilidad (RSD) = 0,32%, cumpliéndose las exigencias farmacopeicas para idoneidad del sistema cromatográfico (N>1000, f < 2,5 y RSD<2%). La figura 1 muestra un cromatograma típico obtenido bajo las condiciones optimizadas de análisis.
Figura 1: Cromatograma obtenido al inyectar 10/µL de una disolución 100 mg L-1 en ibuprofeno. Condiciones cromatográficas: fase estacionaria RP-18 (25 °C), fase móvil MeCN/tampón fosfato (25 mM, pH 6,5), 35:65, %v/v, elución isocrática (1 mL min-1) y detección a longitud de onda de 197 nm. 72
La validación en términos de selectividad, linealidad, robustez, exactitud y precisión del método optimizado, permitió confirmar que el método implementado es apto para los propósitos perseguidos. Así, se observó que los disolventes empleados en la determinación de ibuprofeno, no proporcionan interferentes que afecten su identificación selectiva, como tampoco lo hace el someter el analito de interés bajo condiciones de estrés, pues no se observaron cambios significativos en el ABC, ni en el tiempo de retención del pico cromatográfico. El análisis de pureza del pico determinó que los espectros de las porciones ascendente, máxima y descendente de este son iguales, confirmándose la selectividad del método optimizado.
En términos de linealidad del método, el análisis de regresión lineal arrojó un valor de R2 > 0,999 (y = 27982x + 56647,7) y RSDs < 2% entre réplicas analíticas de cada punto de la curva, lo que demuestra la existencia de linealidad dentro del intervalo de concentraciones evaluadas (2,5-40 mg L-1). La comparación de las pendientes obtenidas en tres días distintos, a partir de un test de Student y un test de Fisher, demostró, además, que no existen diferencias estadísticamente significativas entre ellas (P>0,05), lo que significa que no se hace necesaria la construcción de una curva de calibrado diaria, dado que no se registra evolución del comportamiento analítico producto del almacenamiento de reactivos. Asimismo, se evidenció que cambios en las condiciones analíticas de separación no comprometen la inequívoca determinación de ibuprofeno.
El promedio de porcentajes de recuperación calculado para el método fue de 107% (RSD 1,6%), encontrándose dentro de las especificaciones de la Farmacopea, la cual establece cuantificaciones en el intervalo de 90-110% con RSD<2%, por lo que se considera que este método es exacto para la cuantificación de ibuprofeno. En cuanto a la precisión del método, los ensayos de repetibilidad realizados, tanto para el sistema, como para el método, arrojan valores de RSD de 1,29 y 1,47%, respectivamente. La Farmacopea permite variaciones inferiores a 2%, de modo que la repetibilidad del método cumple con especificaciones. En el caso de la precisión intermedia, los resultados del análisis de réplicas tratadas en días distintos muestran coeficientes de variación de 0,89% y 0,72% para el sistema y el método, respectivamente. Por tanto, se establece que el método optimizado cumple con el parámetro de precisión.
La aplicación del método validado a la determinación de ibuprofeno en tabletas procedentes de distintos lotes y marcas del mercado nacional, demostró que estos cumplen con las especificaciones farmacopeicas establecidas para ibuprofeno tabletas, al presentar contenidos de ingrediente activo que oscilaron entre el 95,06% + 1,43% y el 109,38% + 0,1% de lo declarado en el empaque. El criterio de aceptación para valoración del principio activo establece un intervalo entre 90 y 110%. Asimismo, se destaca el hecho de que de los 20 lotes analizados, solo en tres (dos pertenecientes a la misma marca), la cuantificación de ibuprofeno se encuentre por debajo del 100% de lo declarado, a diferencia de los lotes restantes, que superan ese valor. Llama la atención el hecho de que los contenidos encontrados en la mayoría de las muestras se acercan al máximo valor aceptado por la Farmacopea, quizás como estrategia válida para garantizar la vida útil del medicamento hasta su fecha de vencimiento. Es importante anotar que todos los lotes adquiridos tenían vidas útiles remanentes de entre uno y dos años al momento de hacer el análisis, con respecto a la fecha de vencimiento declarada. Para la marca A, cuyo lote 2 arrojó un contenido del 95,06%, su fecha de vencimiento era menor en seis meses con respecto al lote 1, cuyo título fue del 104,57%. Por su parte, la marca G mostró los títulos más bajos: 95,12% para el lote 1, y 97,92% para el lote 2, restándole 11 meses de vida útil al primero, y 12 al segundo. Estos resultados parecen sugerir que la estabilidad del ibuprofeno es un desafío para los formuladores, por el hecho de encontrarse los contenidos cercanos al 110%, y por detectarse diferencias importantes en el fármaco entre lotes con fechas de vencimiento relativamente distantes, pero en general, todas dentro del rango de aceptación. Investigaciones adicionales se necesitan a fin de confirmar esta observación.
Con respecto al ensayo de disolución, el criterio de aceptación establecido en la Farmacopea especifica que no menos del 80% de la cantidad declarada en el marbete debe disolverse en los 60 minutos (Q60). Esta prueba, que se realiza a un solo punto, la superaron todos los lotes con relativa holgura (más del 10% de margen de seguridad). Solo el lote 1 de la marca G superó la prueba con un mínimo de ventaja.
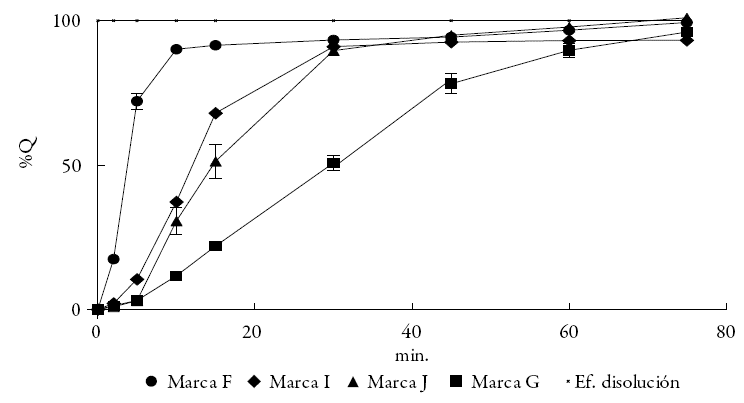
Los perfiles de disolución de las formas farmacéuticas sólidas proveen información valiosa acerca de las características de la disolución de un fármaco, mucho más allá de la que proporciona el ensayo de disolución a un solo punto. La tabla 2 presenta los valores medios de 12 réplicas en cada uno de los ocho tiempos de muestreo, con los que se construyeron los perfiles de disolución de cada marca y lote. Las celdas sombreadas indican el momento en que ya se ha superado el 85% de disolución del fármaco, cantidad de referencia en el sistema de clasificación biofarmacéutica cuando se emplean estos estudios con fines de bioexclusión. Solo cuatro de las 10 marcas se ajustan a este valor (C, E, F y H) antes de los 15 minutos. En dos marcas, un lote cumple y el otro no (A y D). Las restantes quedan por debajo del requisito. Una vez se construyen los perfiles, es necesario realizar comparaciones entre ellos para estar en capacidad de realizar inferencias. Existen modelos basados en Anova (análisis de varianza), modelos dependientes, y modelos independientes. Estos últimos se denominan así, ya que emplean los datos primarios de disolución sin hacer transformaciones. En este trabajo se emplearon los modelos independientes de cálculo de áreas bajo la curva (ABC) [24, 25], el cálculo de la eficiencia de la disolución (ED) [19] y el factor de similitud f2, que compara punto a punto el proceso de disolución [20, 21]. Las AB C se calcularon entre los tiempos 0 y 75 minutos. Un valor alto de este indicador, hace referencia a que en los primeros tiempos del proceso de disolución, hay una liberación y disolución rápida del ingrediente activo. La ED compara las ABC. Si una tableta hipotética se disuelve de manera instantánea al momento de entrar en contacto con el medio de disolución, la curva que describe es una recta paralela a la abscisa que genera un área cuadrada, la cual corresponde al 100% de Q, multiplicada por el tiempo del ensayo (en este caso, 75 minutos), para un área de 7500%/min. Este valor se toma como la disolución ideal. La proporción de las ABC de los perfiles de disolución de las tabletas con respecto a ese valor, es la ED. En la tabla 1 se registran los valores de ED. La marca F corresponde al producto innovador. En la figura 2, se presentan los perfiles de las marcas G, I y J, las cuales tienen los valores más bajos de ABC y ED. La marca F y la ED se grafican como referencia. Se hace evidente en esta figura y en la tabla 2, cómo la marca F se ha disuelto en más de un 85% a los 10 min, lo que se refleja en un ED del 89%, y resulta favorable para su absorción en el medio de pH 7,2; esto es similar al que se puede encontrar en el duodeno.
Figura 2: Perfiles de disolución de las marcas I, J, G y F. La línea superior horizontal, corresponde a una disolución instantánea (ED del 100%).
Cada valor corresponde a la media ± desv. std. (n=12).Tabla 2: Porcentajes promedio de disolución tabletas de ibuprofeno de 400 mg por tiempos de muestreo en el ensayo de perfil de disolución.
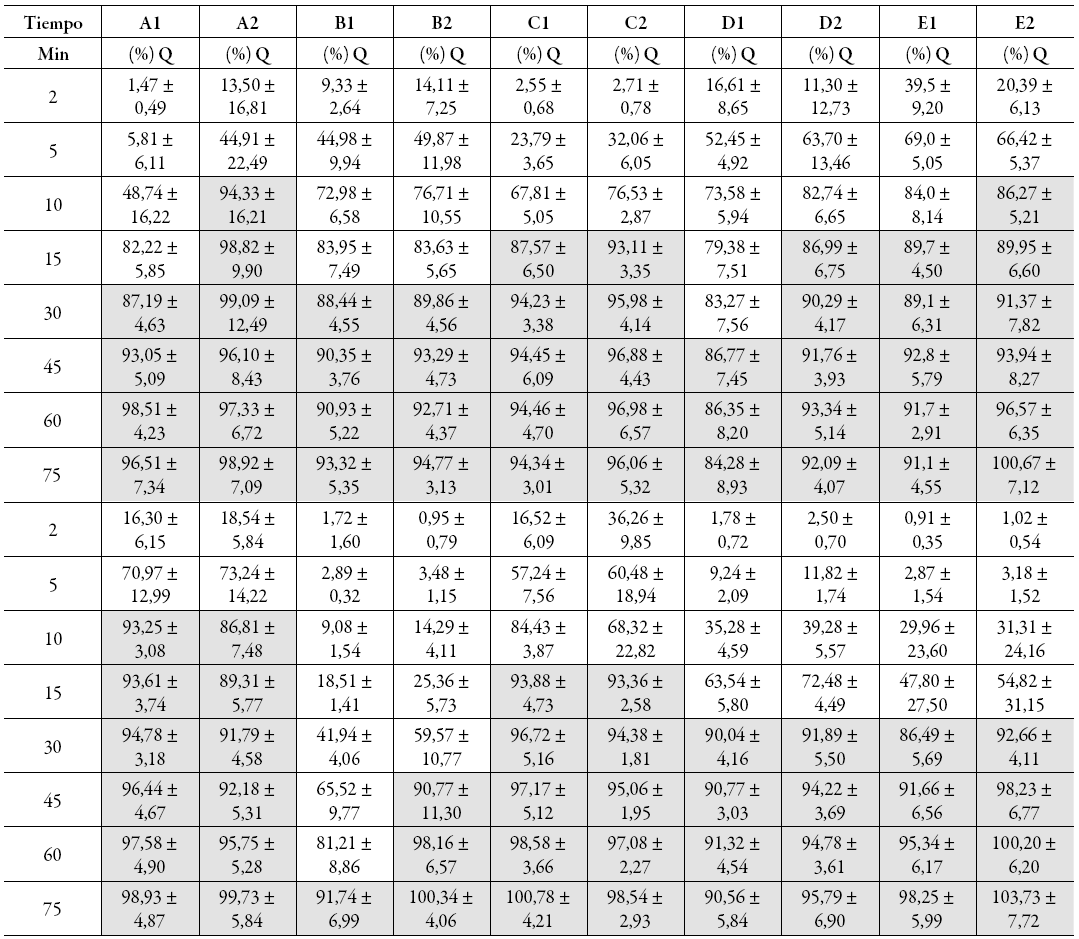
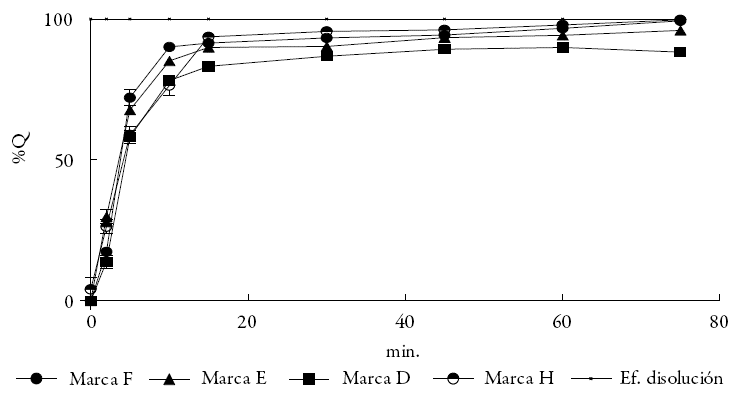
El tercer modelo de comparación de perfiles empleado, corresponde al factor de similitud f2, que es una transformación de la raíz cuadrada recíproca logarítmica de la suma del error al cuadrado, y es una medida de la similitud en el porcentaje disuelto de cada producto comparado. Valores de f2 mayores a 50, corresponden a similitudes superiores al 90%, es decir, se consideran iguales. Las marcas E, H y un lote de D, alcanzaron este desempeño. De acuerdo con lo propuesto por Shah et al. [ 21], estas tres marcas se pue)den considerar biofarmacéuticamente equivalentes con la marca F. La figura 3 presenta sus perfiles, junto con el de la marca F como referencia. El ibuprofeno es un ácido débil que pertenece a la clase II del sistema de clasificación biofarmacéutica [26]; esto significa que se trata de un fármaco de baja solubilidad, pero de alta permeabilidad. La absorción de este tipo de fármacos se puede ver influenciada por los contenidos intestinales, en donde puede permanecer por un tiempo prolongado. Al tratarse de un ácido débil, su solubilidad se incrementa a pH alcalino -como el intestinal-, por la formación de sales más solubles. El ibuprofeno es muy poco soluble a valores de pH bajos (<4) [27], por lo que su mayor absorción ocurre a nivel intestinal, alcanzando las mayores concentraciones plasmáticas en 1-2 horas [28], de lo que se infiere que la mayor absorción ocurre en la regiones más proximales del intestino. Esto indica que una formulación de ibuprofeno en tabletas debe procurar deshacerse en un tiempo corto, así como llegar al duodeno tan liberada como sea posible de los excipientes, y en forma de polvo muy fino. Esto a fin de que la oportunidad que tenga de disolverse y absorberse sea mayor, pues a valores de pH más alcalinos -como los que se encuentran en porciones más distales del tracto gastrointestinal-, pueden ionizar en alta proporción las sales del fármaco, limitando su absorción.
Figura 3: Perfiles de disolución de las marcas E, D y H. El perfil de la marca F se incluye por ser el de referencia.
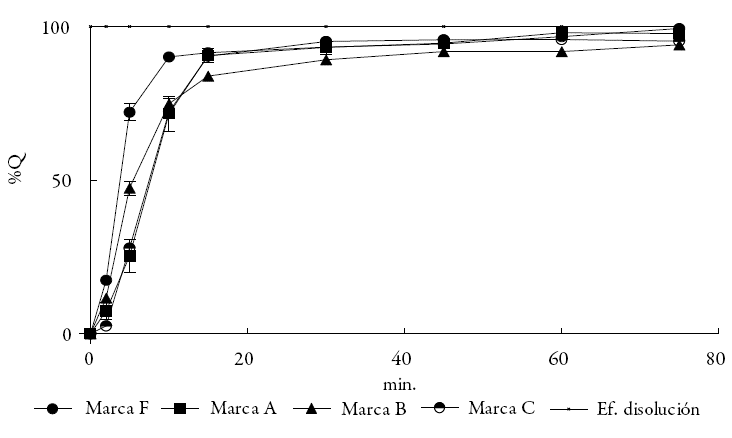
En general, los perfiles de absorción de los fármacos de clase II son altamente dependientes del tipo de formulación [29], por lo que la cinética de disolución de los mismos durante el diseño requiere especial atención. Las marcas A, B, y C mostraron desempeños intermedios, y se representan en la figura 4.
Figura 4: Perfiles de disolución de las marcas A, B y C. El perfil de la marca F se incluye por ser el de referencia.
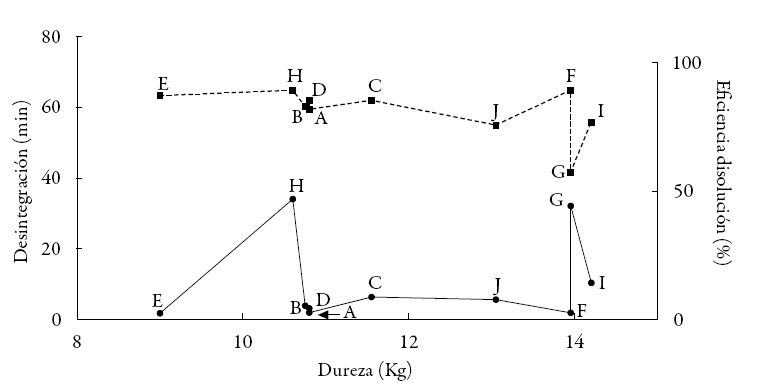
Con el propósito de encontrar visualmente si existe alguna correlación entre la dureza de las tabletas, su tiempo de desintegración y su eficiencia de disolución, se construyó la figura 5. Cada punto corresponde a la media de todos los valores individuales de los dos lotes de cada marca de las mencionadas variables. Al comparar el cambio en los tiempos de desintegración con respecto al incremento en la dureza, si esta última retrasara la desintegración, se observaría una línea con tendencia ascendente de izquierda a derecha, cosa que no ocurre. De la misma manera, si un aumento en los tiempos de desintegración retrasara la velocidad de disolución, debería observarse una línea con pendiente negativa, lo cual tampoco sucede. Únicamente la marca G, que tiene una alta dureza, muestra uno de los mayores tiempos de desintegración, y la más baja ED. Incluso la marca H, que tiene una dureza intermedia y un tiempo de desintegración alto, no ve afectada su disolución, y es equivalente con la marca de referencia, es decir, no se encuentra ninguna correlación entre estas tres variables.
Figura 5: Descripción esquemática de dureza (eje X), desintegración (línea sólida, eje Y izquierda), y eficiencia de la disolución (línea punteada, eje Y derecha) de tabletas de ibuprofeno de 400 mg.
CONCLUSIONES
Los resultados del presente trabajo permiten concluir que todos los productos evaluados cumplieron con las especificaciones de la Farmacopea, con respecto al contenido de ingrediente activo, y con relación a la prueba de disolución. Los análisis realizados a los perfiles de disolución permitieron identificar cómo, pese a que todas las marcas cumplen con las especificaciones farmacopéicas mencionadas, se encuentran unas que tienen un desempeño particularmente destacado (F, E, D y H), y son estas biofarmacéuticamente equivalentes entre sí. También se pudo observar, para las marcas estudiadas, que no existe una relación directa entre la fuerza de compresión, el tiempo de desintegración y la velocidad de disolución, representada en la eficiencia de la disolución.
AGRADECIMIENTOS
Los autores agradecen a la Universidad Nacional de Colombia, sede Bogotá, y a la Universidad de Cartagena, por facilitar los espacios, los recursos y la financiación para llevar a cabo este estudio.
REFERENCIAS
Referencias
(1) Oficina Económica y Comercial de la Embajada de España en Bogotá, Bairexport
Red de Exportadores 2005, El sector de productos farmacéuticos para uso
humano en Colombia, URL: http://www.icex.es, consultado en mayo del 2016.
(2) Asociación Nacional de Industriales de Colombia (ANDI), Cifras de la industria
farmacéutica, URL: http://www.andi.com.co, consultado en mayo del 2016.
(3) C. Miege, J. Choubert, L. Ribeiro, M. Eusèbe, M. Coquery, Fate of pharmaceuticals
and personal care products in wastewater treatment plants–conception of a
database and first results, Env. Poll., 157(5), 1721 (2009).
(4) Ministerio de la Protección Social e Invima, Normas Farmacológicas, URL:
https://www.invima.gov.co/images/pdf/tecnovigilancia/documentos-tecnicos/
Normas_Farmacologicas.pdf, consultado en mayo de 2016.
(5) M.V. Roa, G.G. Cárdenas, Condición de venta de analgésicos antiinflamatorios
no esteroides, legalmente autorizados para su comercialización en Colombia.
Estrategias de uso racional, Rev. Colomb. Cienc. Quím. Farm., 42(2), 145 (2013).
(6) Ministerio de Salud y Protección Social, Resolución 5592 de 2015, Anexo 1., URL:
https://www.minsalud.gov.co/Normatividad_Nuevo/Resoluci%C3%B3n%20
%20de%202015.pdf, consultado en mayo del 2016.
(7) Ministerio de la Protección Social, Decreto 2200 de 2005, URL: https://
www.invima.gov.co/images/pdf/tecnovigilancia/Normatividad%20aplicable/
DECRETO%202200%20DE%202005.pdf, consultado en mayo del 2016.
(8) OPS, “Guía para la implementación de Estrategias de Medicamentos Genéricos
en los países de América Latina y El Caribe como mecanismo para mejorar el
acceso a los medicamentos”, Pan american Health Organization, Washington
D.C., 2010, p. 6, 7.
(9) A. García, C. Hernández, C. Avendaño, Regulación de los medicamentos genéricos:
evidencias y mitos, Inform. Terap. Sist. Nac. Salud, 34(3), 71 (2010).
(10) O. Laosa, P. Guerra, J.L. López, B. Mosquera, J. Frías, Estudios de bioequivalencia:
la necesidad de establecer la fiabilidad de los medicamentos genéricos, Rev.
Per. Med. Exp. Salud Púb., 26(4), 553 (2009).
(11) J.V. Váquez, K.G. Portilla, S.R. Acosta, Regulación en el mercado farmacéutico
colombiano, Rev. Cienc. Soc., 16(2), 197 (2010).
(12) V.J. Wirtz, M.R. Reich, M. Hernández, Investigación para sustentar políticas
farmacéuticas, Salud Púb. Méx., 50, S427 (2008).
(13) Farmacopea de los Estados Unidos de América, Formulario Nacional, USP, USP
-NF 34, The Pharmacopeial Convention, United Book Press, Baltimore, 2016.
(14) International Committee for Harmonization, ICH, Guidance for Industry:
Q2B Validation of Analytical Procedures: Methodology, 1996.
(15) K.K. Hotha, S. Reddy, V. Raju, L. Ravindranath, Forced degradation studies:
Practical approach-overview of regulatory guidance and literature for the drug
products and drug substances, Intern. Res. J. Pharm., 4, 78 (2013).
(16) M. Trinath, S.K. Banerjee, H. Teja, C. Bonde, Development and validation of
spectrophotometric method for simultaneous estimation of sumatriptan and
naproxen sodium in tablet dosage form, Der Pharm. Sin., 1(1), 36 (2010).
(17) Y. Swapna, G.N. Reddy, C.K. Sekhar, A new RP-HPLC method for simultaneous
estimation of Naproxen and Sumatriptan in tablet dosage form, Int. J.
Pharm. Biomed. Sci., 3, 179 (2013).
(18) J. Cook, W. Addicks, Y.H. Wu, Application of the biopharmaceutical classification
system in clinical drug development-an industrial view, AAPS J, 10(2), 306
(2008).
(19) K. Khan, The concept of dissolution efficiency, J. Pharm. Pharmacol., 27(1), 48
(1975).
(20) G. Frutos, J. Ocaña, Técnicas de remuestreo en la comparación de curvas de disolución
de fármacos, An. R. Acad. Farm., 77(2), 1 (2011).
(21) V.P. Shah, Y. Tsong, P. Sathe, J.P. Liu, In vitro dissolution profile comparisonstatistics
and analysis of the similarity factor, f2, Pharm. Res., 15(6), 889 (1998).
(22) S.M. Gómez, J.A. Martínez, F. Martínez, Validación de un método analítico
empleando cromatografía líquida de alta eficiencia para la determinación de ibuprofeno
en medios biorrelevantes, Quim. Nova, 33(8), 1794 (2010). mitos, Inform. Terap. Sist. Nac. Salud, 34(3), 71 (2010).
(23) P. Wang, M. Qi, L. Liu, L. Fang, Determination of ibuprofen in dog plasma by
liquid chromatography and application in pharmacokinetic studies of an ibuprofen
prodrug in dogs, J. Pharm. Biomed. Anal., 38(4), 714 (2005).
(24) T. O'hara, A. Dunne, J. Butler, J. Devane, A review of methods used to compare
dissolution profile data, Pharm. Sci. & Tech. Today, 1(5), 214 (1998).
(25) N. Yuksel, A.E. Kanık y T. Baykara, Comparison of in vitro dissolution profiles
by ANOVA-based, model-dependent and-independent methods, Int. J. Pharm.,
(1), 57 (2000).
(26) H. Potthast, J. Dressman, H. Junginger, K. Midha, H. Oeser, V. Shah, H. Vogelpoel
y D. Barends, Biowaiver monographs for immediate release solid oral dosage
forms: Ibuprofen, J. Pharm. Sci., 94(10), 2121 (2005).
(27) L. Ghosh, N. Ghosh, M. Chatterjee y B. Gupta, Product development studies on
the tablet formulation of ibuprofen to improve bioavailability, Drug Dev. Ind.
Pharm., 24(5), 473 (1998).
(28) N.M. Davies, Clinical pharmacokinetics of ibuprofen, Clin. Pharmacokin., 34(2),
(1998).
(29) Y. Baena, L.F. D’León, Importancia y fundamentación del sistema de clasificación
biofarmacéutico, como base de la exención de estudios de biodisponibilidad y
bioequivalencia in vivo, Rev. Colomb. Cienc. Quím. Farm., 37(1), 18 (2008).
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Juliana María Patiño Medina, Angélica María Candela Soto, Olga Lucía Bayona Ayala, Lizeth J. Alvarado Rueda, Hernando Alberto Camargo García. (2021). Artificial Intelligence, Computer and Software Engineering Advances. Advances in Intelligent Systems and Computing. 1326, p.371. https://doi.org/10.1007/978-3-030-68080-0_28.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2017 Revista Colombiana de Ciencias Químico-Farmacéuticas

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
El Departamento de Farmacia de la Facultad de Ciencias de la Universidad Nacional de Colombia autoriza la fotocopia de artículos y textos para fines de uso académico o interno de las instituciones citando la fuente. Las ideas emitidas por los autores son responsabilidad expresa de estos y no de la revista.
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons de Atribución 4.0 aprobada en Colombia. Consulte la normativa en: http://co.creativecommons.org/?page_id=13