Validación de una metodología analítica por HPLC-DAD para la cuantificación de cafeína en un ensayo de permeación in vitro empleando mucosa oral porcina
Validation of an analytical HPLC-DAD methodology for the quantification of caffeine in an in vitro permeation test using porcine buccal mucosa
DOI:
https://doi.org/10.15446/rcciquifa.v46n2.67956Palabras clave:
validación, cafeína, HPLC, permeabilidad, mucosa bucal, celdas de Franz (es)Validation, caffeine, HPLC, permeability, buccal mucosa, Franz cells (en)
Recibido: 7 de abril de 2017; Aceptado: 3 de agosto de 2017
RESUMEN
En este artículo se presentan los resultados del desarrollo y validación de una metodología analítica por cromatografía líquida de alta eficiencia con detector de arreglo de diodos (HPLC-DAD) para la cuantificación de cafeína; se utilizó una columna C18 con detección UV a 273 nm y una fase móvil compuesta por agua/acetonitrilo (80:20 v/v) de modo isocrático. Las características de desempeño evaluadas permitieron comprobar que existe una adecuada selectividad, una linealidad entre 0,5 y 50 ug/mL, con una precisión expresada como RSD menor a 2%, un porcentaje de recuperación del 99,9% y unos límites de detección y cuantificación para el método de 2,99 y 2,69 ng/mL, respectivamente. El método propuesto es útil para determinar el perfil de permeación bucal de la cafeína mediante un estudio in vitro con celdas de Franz empleando membrana bucal porcina.
Palabras clave:
validación, cafeína, HPLC, permeabilidad, mucosa bucal, celdas de Franz.SUMMARY
This paper presents the results of the development and validation of an analytical methodology through high performance liquid chromatography with a diode array detector (HPLC-DAD) for the quantification of caffeine, using a C18 reverse phase column with UV detection at 273 nm and a mobile phase consisting exclusively of water/acetonitrile (80:20 v/v). The evaluated performance characteristics allowed to verify that there is an adequate selectivity, a linearity between 0.5 and 50 /µg/mL, with precision expressed as RSD in less than 2%, a recovery rate of 99.9%, and limits of detection and quantification for the method of2.99 and 2.69 ng/mL respectively. The proposed method is useful for determining the oral permeation profile of caffeine by an in vitro study with Franz cells using porcine buccal membrane.
Keywords:
Validation, caffeine, HPLC, permeability, buccal mucosa, Franz cells.INTRODUCCIÓN
La ruta más utilizada en la administración de fármacos es la vía peroral, dado que es cómoda, económica y, por lo general, más inocua; sin embargo, presenta varias desventajas significativas dentro de las cuales se destacan: la degradación de algunos principios activos por enzimas digestivas o pH gástrico ácido, anomalías en la absorción en presencia de alimentos, la necesidad de contar con la colaboración del paciente, así como el efecto de primer paso hepático 1. A partir de estos inconvenientes, desde hace varios años ha existido un gran interés en el uso de la mucosa bucal por tener un área de superficie grande, lisa y relativamente inmóvil, con resistencia sustancial a la irritación o daño, además de estar equipada para el suministro sistémico de fármacos 2-6.
El potencial de las moléculas a ser administradas por vía bucal es investigado por metodologías in vivo o in vitro; considerándose las pruebas de permeabilidad con tejido bucal animal aislado en celdas de Franz, el método in vitro más utilizado para determinar la cantidad de fármaco que se difunde a través del tejido en el tiempo, siendo posible evaluar la cinética de transporte a través de la mucosa. Gracias a la semejanza reportada de la mucosa bucal porcina en cuanto a estructura y permeabilidad con la mucosa bucal humana, el cerdo se ha convertido en el modelo animal más utilizado en estas investigaciones 7,8. En este sistema, la mucosa bucal se encuentra separando dos cámaras: una cámara donante donde se dispone el fármaco que entra en contacto con la cara exterior de la mucosa, y una cámara receptora, que simula el medio biológico con el que está en contacto la mucosa. Esta última, es muestreada periódicamente para evaluar la cantidad de compuesto que ha penetrado el tejido con el tiempo y presenta una barra de agitación que mantiene en condiciones homogéneas la solución en el compartimento. La temperatura del sistema se conserva a 37 °C mediante una chaqueta de calentamiento en el compartimento receptor, a través del cual recircula agua con la temperatura controlada 8-10. Considerando las variaciones que existen al utilizar equipos nuevos y las diferencias intrínsecas de la membrana, es importante realizar una adecuada implementación de los ensayos con las celdas de difusión, por lo cual se emplea un fármaco ampliamente conocido y con un perfil de permeación previamente estudiado 11,12. Con este fin, se usa cafeína (figura 1) como un fármaco hidrófilo modelo; un alcaloide del grupo de las xantinas, que aumenta de manera ligera la secreción de noradrenalina y estimula la actividad neural en múltiples regiones del encéfalo 1,12,13.
Figura 1: Estructura molecular de la cafeína.
Los métodos analíticos, empleados para la cuantificación de fármacos en estudios con muestras biológicas, pueden influir en la evaluación e interpretación de los datos obtenidos en este tipo de ensayos, resultando fundamental el empleo de métodos analíticos bien caracterizados y validados para obtener resultados fiables que se pueden interpretar adecuadamente. En la literatura se han reportado diferentes metodologías analíticas para la determinación de cafeína en productos farmacéuticos y muestras biológicas 14,15; sin embargo, a la fecha no existe una metodología específica que permita evaluar el paso de este fármaco a través de la mucosa bucal porcina. Gracias a sus características y a las condiciones de trabajo propuestas, este método permite analizar un alto volumen de muestras en un corto tiempo, evaluando las diferentes condiciones de ensayo en las celdas de difusión. Por tanto, el presente trabajo tiene como objetivo validar un método por cromatografía líquida de alta eficiencia (HPLC) con detector de arreglo de diodos (HPLC-DAD) para cuantificar cafeína y llevar a cabo un estudio de permeación con este activo, empleando mucosa bucal porcina como membrana de estudio
MATERIALES Y MÉTODOS
Reactivos
Cafeína estándar (99%), Sigma-Aldrich (EE. UU., lote: SLB0505V), etanol 98%, reactivo analítico Merck (Alemania, lote: K46066583-445), acetonitrilo grado HPLC Tedia (EE. UU., lote: 905154), solución de Krebs-Ringer-Bicarbonato marca ZenBio (EE. UU., lote: 010416), fosfato de potasio monobásico Merck (Alemania, lote: AM0655773518), cloruro de potasio Chemi (EE. UU., lote: 160331-511), cloruro de sodio J. T. Baker (EE. UU., lote: t10c54), fosfato de sodio dibásico Chemi (EE. UU., lote: 160331-512), agua grado HPLC, filtros 0,45 µm Millipore Corp (EE. UU.).
Equipos y condiciones analíticas
Se empleó un cromatógrafo Shimadzu® (Kioto, Japón), serie Prominence, equipado con una bomba binaria LC-6AD, detector de arreglo de diodos (DAD) SPD-M20A, horno CTO-20A, desgasificador DGU-20As y automuestreador SIL20-A. La columna cromatográfica empleada fue una Kromasil® C18, de 4,6 x 150 mm y 5 µm de tamaño de partícula, a una temperatura isocrática de 30 °C, utilizando como fase móvil agua-acetonitrilo (80:20 v/v), con un flujo 1 mL/min, volumen de inyección 10 µL y longitud de onda 273 nm. Las soluciones que estuvieron en contacto con la mucosa se centrifugaron a una velocidad de 7000 rpm durante 6 min y todas las muestras se filtraron antes de inyectarse a través de filtros Millex (Millipore Corporation, EE. UU.) de 0,45 µm. Los datos se procesaron mediante el software LCsolution® versión 1,25. Para la preparación de las muestras y el ensayo de permeación se utilizó: potenciómetro Hanna® referencia HI 2221 (EE. UU.), ultrasonido Cole-Parmer® modelo 8891 (EE. UU.), sistema de purificación de agua Direct-Q® (EE. UU.), celdas de Franz marca PermeGear® (EE. UU.), equipo de filtración al vacío, balanza analítica (sensibilidad de 0,001 g y 0,0001 g) marca Ohaus® serie Pioneer (EE. UU.), baño termostatado Lauda® (EE. UU.), micropipetas (10-100µL y 100-1.000µL) marca Select BioProducts® (EE. UU.) y plancha de agitación multipunto IKA® modelo RO 10 PS1 Werke (Alemania).
Material biológico
En los diferentes ensayos se empleó mucosa bucal (mejilla), obtenida de cerdos con un peso de 80-100 kg y con una edad promedio de 4-6 meses; los cuales fueron sacrificados con fines comerciales en el frigorífico aprobado por la autoridad sanitaria competente. Las muestras se almacenaron en solución salina amortiguada con fosfato o Krebs-Ringer-Bicarbonato durante un máximo de 24 h y, en algunos casos, se utilizaron luego de ser sometidas a procesos de refrigeración y congelación durante los cuatro días posteriores al sacrificio. Todos los experimentos se realizaron siguiendo las consideraciones éticas en cuanto a la investigación biomédica con animales 16 y con el aval del Comité de Ética de la Facultad de Ciencias de la Universidad Nacional de Colombia (Acta No. 03 de 2016).
Preparación de las muestras
Para la validación del sistema se preparó una solución madre de cafeína (SM-C) por triplicado de 500 µg/mL. A partir de estas soluciones se hicieron las diluciones para trabajar curvas de calibración en el rango de 0,5 µ/mL a 50 µg/mL. En la validación del método se utilizó solución salina amortiguada con fosfato (PBS) de pH 7,4 como medio de disolución; la cual estuvo en contacto con la mucosa durante 4 h a una temperatura de 37 °C, simulando las condiciones del ensayo de permeación. La mucosa empleada estuvo en un período de almacenamiento de cuatro días en condiciones del mercado, sin medio de almacenamiento, con cortes irregulares involucrando epitelio y tejido conectivo.
Validación de la metodología analítica
La validación del método se realizó teniendo en cuenta los lineamientos establecidos por la Conferencia Internacional de Armonización (ICH, por sus siglas en inglés), las normas de la Asociación Española de Farmacéuticos y la guía para la Industria de Validación de Métodos Bioanalíticos de la Administración de Medicamentos y Alimentos (FDA, por su sigla en inglés) 17-19, y se analizaron las siguientes características de desempeño:
Selectividad/Especificidad
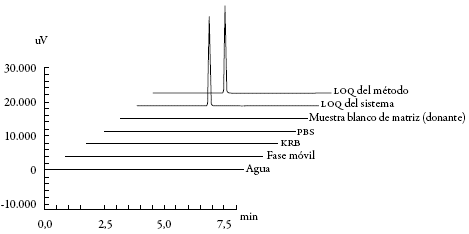
Para establecer la selectividad del método, se analizaron los diferentes componentes de la fase móvil, los medios de almacenamiento utilizados para la mucosa (Krebs-Ringer-Bicarbonato y PBS) y 10 muestras blanco de matriz de 10 mucosas porcinas de procedencia distinta que no estuvieron en contacto con el compuesto modelo obtenidas de diferentes animales. No se observaron interferencias respecto a la solución de cafeína correspondiente a la concentración determinada como límite de cuantificación en la validación del sistema y método (2,99 y 2,69 ng/mL, respectivamente), teniendo como criterios de evaluación el tiempo de retención (tr), la similitud de los espectros de absorción molecular (EAM), los isogramas y los topogramas obtenidos.
Las soluciones blanco de las diferentes matrices recolectadas, se montaron por separado en las celdas de Franz a una temperatura de 37 °C, con PBS a pH de 6,8 en la cámara donante y a pH de 7,4 en la cámara receptora. Dichas mucosas se sometieron a procesos de congelación y refrigeración por cuatro días posteriores al sacrificio; y una vez pasadas las 4 h de duración del ensayo, se tomó una alícuota de 500µL de la cámara receptora y de 400 µL en la cámara donante.
Linealidad
Para evaluar la linealidad del sistema y del método, se establecieron seis niveles de concentración: 0,5, 2,5, 5, 10, 25, 50 µg/mL, cada uno se preparó por triplicado a partir de la dilución de las tres SM-C. La evaluación de la linealidad se hizo por medio del análisis de varianza (ANOVA) para la regresión. El estadístico t de Student se usó para evaluar la pendiente y el intercepto, asumiendo una confianza del 95%.
Precisión
La precisión se determinó mediante la evaluación de la repetibilidad (intradía) y de la precisión intermedia (interdías). El ensayo intradía se estimó mediante análisis por triplicado de tres niveles de concentración (0,5, 10 y 50 µg/mL) en el mismo día, con el mismo analista y con el mismo equipo. Se evaluó a través del coeficiente de variación promedio ponderado (RSDp), obtenido a partir del test de Cochran, y el valor de aceptación para el método en cada nivel debe ser C.V ≤ 15% 18; mientras que el criterio de aceptación, al evaluar la repetibilidad del sistema, es que el coeficiente de variación de las medidas sea máximo del 1% 19. La precisión intermedia se valoró en tres días y con dos analistas, utilizando los tres niveles de concentración del analito (0,5, 10 y 50 µg/mL) y se evaluó mediante un ANOVA empleando una confianza del 95%.
Exactitud
Se calculó mediante comparación de las pendientes de las curvas de calibración del sistema y del método, evaluando de esta manera todo el rango lineal. Como criterio de aceptación para este parámetro, se fijó un porcentaje de recuperación (%R) entre 95% a 105%, considerando la complejidad de la matriz de la muestra 19.
Límite de detección y cuantificación
Para determinar el límite de detección (LOD) y el límite de cuantificación (LOQ), se prepararon curvas de calibración a bajas concentraciones respecto a las utilizadas en el estudio de linealidad, empleando cuatro niveles de concentración (0,1, 0,2, 0,3 y 0,4 µg/mL), con seis réplicas a cada nivel.
El límite de detección (ecuación 1) y el límite de cuantificación (ecuación 2) se calcularon mediante los resultados obtenidos para la linealidad y los resultados de una curva de calibración a bajas concentraciones.
Ecuación 1: límite de detección 19

Ecuación 2: límite de cuantificación 19
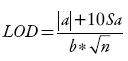
Donde: Sα = desviación estándar del intercepto a bajas concentraciones, α = intercepto a bajas concentraciones y b = pendiente de la curva de calibración a altas concentraciones.
Estabilidad
La estabilidad del analito se evaluó por triplicado a dos niveles de concentración (0,5 y 25 µg/mL), en diferentes tiempos y condiciones de almacenamiento. Se consideró el análisis de las muestras en un período de permanencia en el automuestreador y a la temperatura del mismo (24-25 °C), en tres momentos diferentes: recién preparada, luego de 6 h y, finalmente, a las 24 h. También se corroboró la estabilidad en condiciones de almacenamiento a 4 °C en cuatro ocasiones (semanas 1, 2, 3 y 4); los resultados se compararon con los valores encontrados inicialmente (semana 1). Esto permite valorar la estabilidad del analito con base en el tiempo estimado de permanencia a temperatura de refrigeración y tener en cuenta la estabilidad de la cafeína después de diferentes ciclos de enfriamiento - temperatura ambiente (21 °C). Finalmente, se comprobó la estabilidad del analito en la matriz luego de someterse a las condiciones empleadas con las celdas de Franz (37 °C durante 4 h). Como criterio de aceptación, se tuvo en cuenta que los resultados de las muestras de estabilidad debían estar dentro del 15% de las concentraciones nominales 18.
RESULTADOS Y DISCUSIÓN
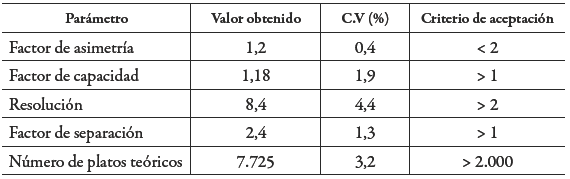
La cafeína presentó un tiempo de retención de 2,99 +/- 0,02 min, haciendo de este un método rápido y económico para la cuantificación del analito. La idoneidad del sistema se evaluó mediante el factor de asimetría, el factor de capacidad, la resolución, el factor de separación y el número de platos teóricos (tabla 1), obtenidos a partir de 10 inyecciones del estándar a una concentración de 10 µg/mL y cumpliendo con las especificaciones en todos los casos 19,20.
Tabla 1: Resultados obtenidos para la idoneidad del sistema.
La longitud de onda de máxima absorción (λmax) de la cafeína en las muestras biológicas fue de 273 nm y se determinó empleando el EAM y el isograma (figura 2) de una muestra a una concentración de 10 µg/mL.
Figura 2: A) Isograma. B) Espectro de absorción molecular (EAM); obtenidos para una solución de cafeína estándar a una concentración de 10 µg/mL.
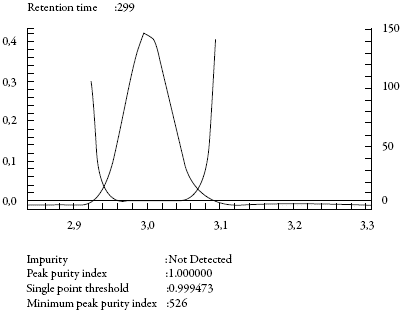
Los cromatogramas obtenidos luego del análisis de los medios de almacenamiento, las matrices blancos con mucosa oral porcina (sin presencia de cafeína) y la fase móvil no mostraron interferentes en el tiempo de retención de la cafeína, ni modificación en el EAM (figura 3), ni en la pureza del pico. Además, se analizó si los diferentes blancos absorbían a la λmax del analito, demostrándose que no tienen incidencia en la cuantificación de la cafeína y verificando la similitud de los EAM y la pureza del pico, entre la lectura del límite de cuantificación correspondiente al sistema y al método. De manera similar, el análisis de la pureza del pico (figura 4) determinó que no se presentan impurezas y, por tanto, a través de la metodología empleada es posible alcanzar una señal que corresponde inequívocamente al analito de interés sin presencia de interferencia por coelución de otros componentes de la matriz.
Figura 3: Cromatogramas de la evaluación de selectividad. Datos procesados con el software LCsolution®.
Figura 4: Pureza del pico de cafeína en el método. Datos procesados con el software LCsolution®.
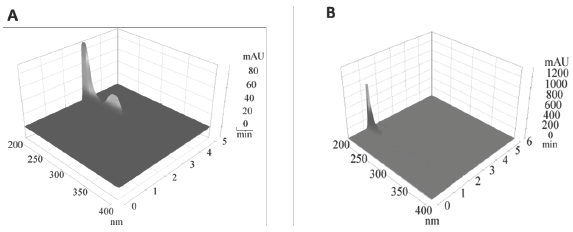
La selectividad de la metodología también puede ser complementada con el estudio de los topogramas obtenidos del DAD (figura 5), en donde gracias a su conformación tridimensional se puede comprobar mediante la corrida cromatografía en un rango de longitudes de onda, que en el tiempo de retención de la cafeína únicamente está presente dicha sustancia sin presencia de ningún interferente que coeluya al tiempo de retención del analito de interés.
Figura 5: Topogramas obtenidos por HPLC-DAD, para A) LOQ método. B) Muestra blanco.
En cuanto a la linealidad, en la figura 6 se presentan las curvas de calibración (relación de áreas vs. concentración) para el sistema y para el método, en las cuales se puede observar un coeficiente de correlación de 0,9999, que indica un alto grado de relación entre la variable x (concentración) y la variable y (respuesta).
Figura 6: Curvas de calibración para el sistema y para el método.
Por otra parte, se hicieron pruebas de hipótesis para el intercepto, la pendiente y el coeficiente de correlación de las curvas de calibración, mediante el estadístico t de Student (tabla 2).
Tabla 2: Prueba t para evaluar la linealidad del sistema y del método.

El test para el intercepto en el sistema y método arrojó un t estimado < t tabla, por tanto, no se rechazó Ho; afirma que la recta presenta un intercepto con el eje Y que no es significativamente diferente de cero y una convergencia al origen. Con respecto a las pendientes, se encontraron valores experimentales de t mayores a los tabulados, por consiguiente, no se rechazó Ho; es decir, las pendientes diferentes de cero son significativas. Además, la prueba de hipótesis para el coeficiente de correlación exhibió un t experimental > t tabla, lo cual llevó a rechazar Ho, asumiendo que hay correlación significativa entre las dos variables, concentración (X) y área bajo la curva (Y) con un nivel de confiabilidad del 95%, mostrando que los datos experimentales se ajustan al modelo de regresión lineal.
Mediante el ANOVA y estadístico de Fisher (tabla 3) para la regresión se encontró en todos los casos que el F experimental fue mayor al F tabulado, quedando demostrada la regresión significativa para el sistema y para el método. El mismo test indicó un desvío de la linealidad no significativo (F experimental > F tabulado), ya que estadísticamente no hay dispersión de los resultados entre réplicas para las distintas concentraciones. Lo anterior permite afirmar que, dentro de los rangos de concentración estudiados, tanto para el sistema como para el método, se obtuvo un comportamiento lineal.
Tabla 3: ANOVA de la regresión lineal para el sistema y para el método, prueba de F.

Para evaluar la precisión intradía, se tomaron muestras preparadas por triplicado a tres niveles de concentración (0,5, 10 y 50 µg/mL), y se empleó el test Cochran. Tal como se evidencia en las tablas 4 y 5, para cada uno de los casos se observó un valor de Gexp menor al Gtab, lo cual indica que las varianzas no son estadísticamente diferentes entre sí; es decir, las varianzas de las concentraciones son homogéneas e indican que el factor concentración no influye en la dispersión de los resultados 19.
X = promedio de las áreas, S = desviación estándar, C.V (%) = porcentaje del coeficiente de variación.Tabla 4: Resultados del test de Cochran para la evaluación de la precisión del sistema.

X = promedio de las áreas, S = desviación estándar, C.V (%) = porcentaje del coeficiente de variación.Tabla 5: Resultados del test de Cochran para la evaluación de la precisión del método.

Además, se obtuvo unos RSDP considerablemente inferiores al valor máximo permitido, que es del 15%, lo que brinda un nivel de precisión confiable sobre las mismas condiciones de operación en un intervalo corto de tiempo. En el caso de la precisión intermedia, el análisis de varianza, mediante un test F, mostró que los valores de F experimentales son menores a los F tabulados (tabla 6), indicando que los resultados no presentan una diferencia estadísticamente significativa por cambio de analista o al realizar el análisis en diferentes días.
Tabla 6: . Precisión intermedia y análisis de varianza del sistema y del método.
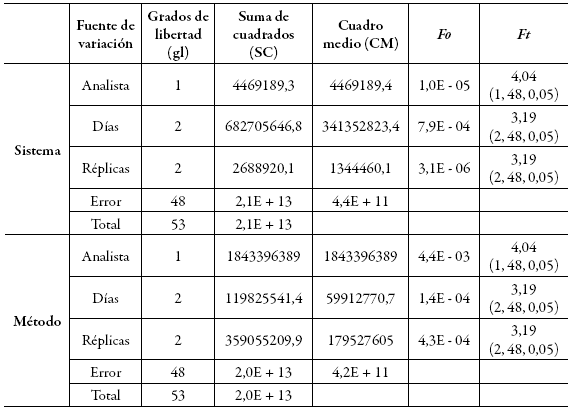
Con base en los lineamientos de la guía de la FDA para la validación de métodos bioanalíticos, se cumple con la repetibilidad y la precisión intermedia, por lo cual se concluye que el método es preciso 18.
Por medio de la comparación de las pendientes de las curvas de calibración del sistema y del método, se evaluó todo el rango lineal, obteniendo 99,9% de porcentaje de recuperación; por lo cual, se estableció que la exactitud del método es correcta.
Los límites de cuantificación y detección se calcularon utilizando las curvas de calibración para sistema y método y unas segundas curvas de concentraciones bajas, a las cuales se les comprobó la linealidad, precisión y exactitud. Los resultados obtenidos se consignan en la tabla 7, y se utilizaron para calcular tanto el límite de detección como el límite de cuantificación, cuyos valores fueron de 0,93 y 0,85 ng/mL para el límite de detección en el sistema y método; y de 2,99 y 2,69 ng/mL para el límite de cuantificación del sistema y método, respectivamente.
Tabla 7: Datos para el cálculo del límite de detección y cuantificación.

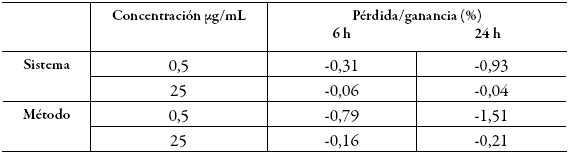
Al evaluar la estabilidad de las muestras a corto plazo en el automuestreador durante 24 h a una temperatura de 24-25 °C (tabla 8) respecto a la lectura de las muestras recién preparadas tomadas como el 100%, se observa una degradación del analito inferior al 2%, la cual se puede considerar despreciable teniendo en cuenta que un estudio similar enfocado al seguimiento de la estabilidad de cafeína en matriz biológica sugiere un límite del 10% 14 y que se tiene como criterio de aceptación que estén dentro del 15% de las concentraciones nominales 18. El porcentaje de variación mayor fue a las 24 h, el cual es un intervalo de tiempo alto, considerando que el tiempo de corrida del método es de 8 min y, por tanto, podrían realizarse hasta 180 inyecciones obteniendo resultados veraces dentro de los límites de desviación permitidos.
Tabla 8: Estabilidad a corto plazo en el automuestreador.
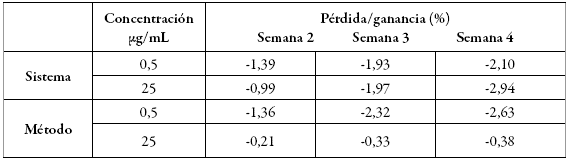
Al determinar la estabilidad a largo plazo como porcentaje de pérdida o ganancia, respecto a la lectura de las muestras recién preparadas tomadas como el 100% (semana 1), se apreció una degradación inferior al 2% en la mayoría de las condiciones, excepto a la semana 4 donde se observó una pérdida mayor del analito (tabla 9). Sin embargo, tal como ocurrió en la estabilidad a corto plazo, se encuentran en un rango aceptado para los criterios establecidos en metodologías bioanalíticas, por tanto se garantiza la estabilidad del analito durante este período de tiempo 18.
Tabla 9: Estabilidad de cafeína a largo plazo (ciclos de enfriamiento - temperatura ambiente).
Finalmente, se comprobó la estabilidad de las muestras al ser sometidas a las condiciones empleadas en el desarrollo de los ensayos de permeación in vitro con celdas de Franz; por lo cual se colocaron a una temperatura de 37 °C durante 4 h. A una concentración de 0,5 µg/mL se observó un porcentaje de ganancia de 0,07% y de 1,17% para una concentración de 25 µg/mL, que se puede atribuir a una posible evaporación del solvente. Sin embargo, la variación es aceptable y se logra inferir que el analito es estable durante los ensayos de permeación in vitro, sin presentar una pérdida significativa del compuesto en cualquiera de las condiciones investigadas.
CONCLUSIONES
Se logró implementar una metodología analítica por cromatografía líquida de alta eficiencia con detector de arreglo de diodos (DAD), para evaluar la permeación in vitro de cafeína a través de la mucosa bucal porcina. Dicha metodología resultó selectiva, precisa, exacta, lineal en el rango de concentraciones de 0,5 a 50 µg/mL, con un límite de detección de 0,93 y 0,85 ng/mL en el sistema y método; y un límite de cuantificación de 2,99 y 2,69 ng/mL en el sistema y método, respectivamente; con una estabilidad de las muestras en las condiciones de almacenamiento (4 °C) durante un mes, por un período de 24 h en el automuestreador y durante la realización del ensayo con celdas de Franz.
AGRADECIMIENTOS
Al Departamento de Farmacia de la Universidad Nacional de Colombia, Sede Bogotá, por facilitar los equipos e instalaciones utilizados en el desarrollo de esta investigación.
REFERENCIAS
Referencias
J. Flórez, J. Armijo, A. Mediavilla, “Farmacología humana”, 5ª edición, Elsevier Masson Eds., Santander, 2008, p. 684.
J. Hao, P.W. Heng, Buccal delivery systems, Drug Dev. Ind. Pharm., 29 (8), 821 (2003).
N.V.S. Madhav, A.K. Shakya, P. Shakya, K. Singh, Orotransmucosal drug delivery systems: A review, J. Control. Rel., 140 (1), 2 (2009).
V. Hearnden, V. Sankar, K. Hull, D.V. Juras, M. Greenberg, A.R. Kerr et al., New developments and opportunities in oral mucosal drug delivery for local and systemic disease, Adv. Drug Del. Rev., 64 (1), 16 (2012).
R.B. Gandhi, J.R. Robinson, Oral cavity as a site for bioadhesive drug delivery, Adv. Drug Del. Rev., 13 (1), 43 (1994).
S. Rossi, G. Sandri, C.M. Caramella, Buccal drug delivery: A challenge already won?, Drug Disc. Today: Technol., 2 (1), 59 (2005).
J. Nicolazzo, In vivo and in vitro models for assessing drug absorption across the buccal mucosa. En “Drug absorption studies”. Ed. Springer, US, 2008, pp. 89-111.
T. Obradovic, In vitro models for investigations of buccal drug permeation and metabolism. En “Drug absorption studies”, Ed. Springer, US, 2008, pp. 167-181.
Y. Sudhakar, K. Kuotsu, A.K. Bandyopadhyay, Buccal bioadhesive drug delivery. A promising option for orally less efficient drugs, J. Control. Rel., 114 (1), 15 (2006).
V.F. Patel, F. Liu, M.B. Brown, Modeling the oral cavity: In vitro and in vivo evaluations of buccal drug delivery systems, J. Control. Rel., 161 (3), 746 (2012).
U. Kulkarni, I. Pather, L. Xiaoling, B. Jasti, Porcine buccal mucosa as in vitro model: Effect of biological and experimental variables, J. Pharm. Sci., 99 (3), 1265 (2010).
U.D. Kulkarni, R. Mahalingam, L. Xiaoling, I. Pather, B. Jasti, Effect of experimental temperature on the permeation of model diffusants across porcine buccal mucosa, AAPS PharmSciTech, 12 (2), 579 (2011).
J.A. Nicolazzo, B.L. Reed, B.C. Finnin, The effect of various in vitro conditions on the permeability characteristics of the buccal mucosa, J. Pharm. Sci., 92 (12), 2399 (2003).
R. Ventura, C. Jiménez, N. Closas, J. Segura, R. de la Torre, Stability studies of selected doping agents in urine: Caffeine, J. Chromatogr. B, 795 (2), 167 (2003).
X.L. Amit Kokate, B. Jasti, Effect of drug lipophilicity and ionization on permeability across the buccal mucosa: A technical note, AAPS PharmSciTech, 9 (2), 501 (2008).
Ministerio de Salud, República de Colombia. Resolución Nº 8430 de 1993. URL: https://www.minsalud.gov.co/Normatividad_Nuevo/RESOLUCION%208430%20DE%201993.pdf, consultado en febrero de 2017.
The International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH). Q2(R1): Validation of analytical procedures: Text and methodology, November 2005. URL: https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q2_R1/Step4/Q2_R1__Guideline.pdf, consultado en febrero de 2017.
US Food and Drug Administration, Guidance for Industry, Bioanalytical Method Validation, Center for Drug Evaluation and Research (CDER), September 2013. URL: https://www.fda.gov/downloads/Drugs/Guidances/ucm368107.pdf, consultado en febrero de 2017.
Asociación Española de Farmacéuticos de la Industria, “Validación de métodos analíticos”. Sección Catalana de AEFI. Comisión de normas de buena fabricación y control de la calidad, 1989, p. 23.
M. Valcárcel, A. Gómez, “Técnicas analíticas de separación”, Reverte Eds., Barcelona, 1988, p. 330.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Roberto Mercado, Silvia Lagos, Ethel Velásquez. (2023). Advances in Dosimetry and New Trends in Radiopharmaceuticals. https://doi.org/10.5772/intechopen.112355.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2017 Revista Colombiana de Ciencias Químico-Farmacéuticas

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
El Departamento de Farmacia de la Facultad de Ciencias de la Universidad Nacional de Colombia autoriza la fotocopia de artículos y textos para fines de uso académico o interno de las instituciones citando la fuente. Las ideas emitidas por los autores son responsabilidad expresa de estos y no de la revista.
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons de Atribución 4.0 aprobada en Colombia. Consulte la normativa en: http://co.creativecommons.org/?page_id=13