Efecto de la fuerza de compresión sobre los atributos críticos de calidad en tabletas de liberación inmediata de furosemida
Effect of compression force on critical quality attributes of immediate release tablets of furosemide
DOI:
https://doi.org/10.15446/rcciquifa.v46n2.67958Palabras clave:
furosemida, tabletas, proceso de compresión, fuerza de compresión, atributos críticos de calidad (es)Furosemide, tablets, compression process, compression force, critical quality attributes (en)
solubilidad y baja permeabilidad, se ubica en la clase IV del Sistema de Clasificación
Biofarmacéutica (BCS, por sus siglas en inglés). Se absorbe rápida pero incompletamente
en el tracto gastrointestinal (GI). Actualmente, este fármaco se comercializa en
tabletas, las que para su obtención deben ser sometidas a un proceso de compresión.
La fuerza aplicada en dicha compresión puede influenciar algunas de las características
de calidad del producto; por ello, la presente investigación estudia el efecto de la
fuerza de compresión sobre los atributos críticos de calidad en el proceso de fabricación
(dureza, friabilidad y desintegración) y en el producto terminado (uniformidad
de dosificación y disolución) de comprimidos de furosemida. El efecto sobre la disolución
se determinó por los factores de diferencia (f1) y de similitud (f2) de los perfiles
de disolución y los parámetros de eficiencia de la disolución (ED) y tiempo medio de
disolución (TMD), los cuales se calcularon con el software académico kinetDS. Los
resultados obtenidos permitieron definir el rango de la fuerza de compresión para el
cual se obtuvo una ED superior al 85% y un TMD inferior a 7,5 min.
and low permeability, it is labeled in class IV of the Biopharmaceutical Classification
System (BCS). It is rapidly but incompletely absorbed from the gastrointestinal
(GI) tract. Currently, this drug is marketed as tablets, which should be subjected to
a compression process. The force applied in this compression can influence some of
the quality characteristics of the product. Therefore, this investigation was carried
out to determine the effect of compression force on the critical quality attributes of
the product in process (hardness, friability and disintegration) and of the finished
product (uniformity of dosage and dissolution). The effect on the dissolution was
determined by the difference factor (f1) and similarity factor (f2) of the dissolution
profiles, the dissolution efficiency (ED) and mean dissolution time (TMD) parameters,
which were calculated by kinetDS academic software. The results obtained
allowed to define the range of compression force for which the ED was higher than
85% and the TMD lower than 7.5 min.
Recibido: 13 de junio de 2016; Aceptado: 14 de agosto de 2017
RESUMEN
La furosemida es un fármaco poco soluble en agua (0,01825 mg/mL). Debido a su baja solubilidad y baja permeabilidad, se ubica en la clase IV del Sistema de Clasificación Biofarmacéutica (BCS, por sus siglas en inglés). Se absorbe rápida pero incompletamente en el tracto gastrointestinal (GI). Actualmente, este fármaco se comercializa en tabletas, las que para su obtención deben ser sometidas a un proceso de compresión. La fuerza aplicada en dicha compresión puede influenciar algunas de las características de calidad del producto; por ello, la presente investigación estudia el efecto de la fuerza de compresión sobre los atributos críticos de calidad en el proceso de fabricación (dureza, friabilidad y desintegración) y en el producto terminado (uniformidad de dosificación y disolución) de comprimidos de furosemida. El efecto sobre la disolución se determinó por los factores de diferencia (f 1) y de similitud (f 2) de los perfiles de disolución y los parámetros de eficiencia de la disolución (ED) y tiempo medio de disolución (TMD), los cuales se calcularon con el software académico kinetDS®. Los resultados obtenidos permitieron definir el rango de la fuerza de compresión para el cual se obtuvo una ED superior al 85% y un TMD inferior a 7,5 min.
Palabras clave:
furosemida, tabletas, proceso de compresión, fuerza de compresión, atributos críticos de calidad.SUMMARY
Furosemide is poorly water soluble drug (0.01825 mg/mL). Due to its low solubility and low permeability, it is labeled in class IV of the Biopharmaceutical Classification System (BCS). It is rapidly but incompletely absorbed from the gastrointestinal (GI) tract. Currently, this drug is marketed as tablets, which should be subjected to a compression process. The force applied in this compression can influence some of the quality characteristics of the product. Therefore, this investigation was carried out to determine the effect of compression force on the critical quality attributes of the product in process (hardness, friability and disintegration) and of the finished product (uniformity of dosage and dissolution). The effect on the dissolution was determined by the difference factor (f 1) and similarity factor f 2 ) of the dissolution profiles, the dissolution efficiency (ED) and mean dissolution time (TMD) parameters, which were calculated by kinetDS® academic software. The results obtained allowed to define the range of compression force for which the ED was higher than 85% and the TMD lower than 7.5 min.
Key words:
Furosemide, tablets, compression process, compression force, critical quality attributes.INTRODUCCIÓN
La furosemida es un diurético ampliamente usado en forma de tabletas por vía oral. Se ha encontrado que durante la manufactura de los comprimidos de furosemida la fuerza de compresión provoca cambios significativos en la disolución del activo 1. Estos inconvenientes se han atribuido principalmente a problemas de aglomeración y baja solubilidad del fármaco, razones por las cuales, evaluar el efecto que el proceso de compresión tiene sobre las características críticas de calidad de las tabletas, son una prioridad en su desarrollo y manufactura 2.
En la compresión, la fuerza y la velocidad de compactación son los parámetros principales del proceso 3. La fuerza de compresión es el factor dominante, de manera tal que a medida que la fuerza incrementa, la resistencia a la tracción o ruptura (dureza) de la tableta aumenta y luego permanece constante o incluso decrece. El incremento de la fuerza de compresión puede causar laminación y "capping", afectando también la friabilidad, el tiempo de desintegración y el perfil de disolución 3.
Por otro lado, en la medida que la velocidad del punzón se incrementa, disminuye su tiempo de permanencia en la matriz y aumenta la porosidad de las tabletas, la tendencia al "capping" y a la laminación. Con un incremento en la porosidad es de esperarse una caída de los tiempos de desintegración y de disolución, pero la interrelación entre la fuerza y la velocidad de compresión confunden el efecto 3,4.
Para estudiar el proceso de compresión, en el modelo propuesto por la Administración de Medicamentos y Alimentos (FDA, por su sigla en inglés) de calidad por diseño QbD, se establece una guía para identificar los riegos de mayor impacto en los atributos críticos de calidad de los comprimidos (tabla 1) 5.
Tabla 1: Ejemplo de la calificación del riesgo para el proceso de compresión de tabletas de liberación inmediata.
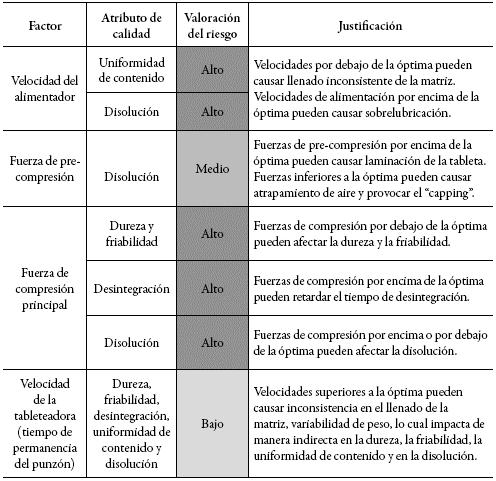
El impacto de estos riesgos identificados se puede evaluar, en gran parte, por las pruebas especificadas en la USP 38 6. Sin embargo, debido a la criticidad de la disolución en el desempeño del producto, la prueba de disolución de punto único establecida en la monografía puede ser adecuada solo para asegurar que no hay cambios de calidad y rendimiento en el producto, pero para evaluar y detectar cambios más importantes, se recomienda una comparación de perfiles de disolución realizada bajo condiciones idénticas para el producto antes y después del cambio 7-9.
Los perfiles de disolución pueden considerarse similares, teniendo en cuenta la similitud global del perfil y la similitud en cada punto temporal de disolución de la muestra. Para establecer dicha similitud, se utilizan los factores de diferencia (f 1 ) y de similitud (f 2) 8. Además, es posible comparar la disolución obtenida a los mismos tiempos con diferentes formulaciones o condiciones de proceso por medio de los parámetros de eficiencia y tiempo medio de disolución 10.
Entendiéndose entonces la eficiencia de la disolución (ED) como el porcentaje del área del rectángulo descrito por el 100% de fármaco disuelto y el tiempo requerido para alcanzar dicha disolución 10, la ED tiene la ventaja de sumar los datos de liberación del principio activo y puede ser relacionada con los datos in vivo 11. Este parámetro está definido por la siguiente ecuación:
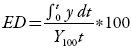
Donde:
ED= área bajo la curva de disolución entre el tiempo cero y el tiempo (t), expresada como un porcentaje de la curva de máxima disolución, Y 100, sobre el mismo período de tiempo.
Y = porcentaje de fármaco disuelto.
t = período de tiempo en el cual se evalúa la disolución.
Por su parte, el tiempo medio de disolución (TMD) se define como el tiempo en el cual se disuelve el 50% del fármaco contenido en la tableta 11. El TMD se calcula de la curva acumulativa de activo disuelto en función del tiempo:
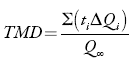
Donde:
T i = tiempo intermedio de los intervalos de tiempo de muestreo.
ΔQ i = incremento de la cantidad de fármaco disuelto en cada intervalo t considerado.
Q ∞ = máxima cantidad de fármaco disuelto.
Los resultados de la ED y del TMD en diferentes formulaciones o condiciones de fabricación pueden ser comparados usando como referencia una prueba t de Student para las dos variables.
Siguiendo lo indicado por la FDA 5 y utilizando estos parámetros como criterio de comparación, el presente trabajo estudia la fuerza de compresión como uno de los factores calificado con alto impacto en los atributos críticos de calidad del producto. Se evaluaron todas las características críticas de calidad de las tabletas en las diferentes condiciones de estudio y se determinaron los factores de diferencia (f 1), similitud (f 2), la ED y el TMD de las tabletas obtenidas 8-10.
Los ensayos se realizaron en una tableteadora instrumentada que permite fijar y controlar la fuerza aplicada en las etapas de pre-compresión y compresión y, de esta forma, establecer un rango de operación que dé viabilidad al proceso por vía seca.
METODOLOGÍA
Elaboración y caracterización de la mezcla
Para el estudio se empleó la forma I (polimorfo) de furosemida, suministrada por la empresa Allianz Group del fabricante IPCA Laboratories. La formulación utilizada se describe en la tabla 2 y se seleccionaron, tomando como referencia, los resultados obtenidos para mejorar la disolución de este activo con coprocesados de lactosa mono-hidrato, polivinil pirrolidona y crospovidona 2,12. Esta formulación evita el empleo de desintegrantes a altas concentraciones (≥ 5%) o la preparación de dispersiones sólidas, que resultan métodos costosos y complejos frente a la compresión directa que es la primera elección a escala industrial 13-16.
Se pesaron las cantidades indicadas de furosemida y de excipientes indicadas en la tabla 2.
Tabla 2: Formulación furosemida en tabletas al 20%.
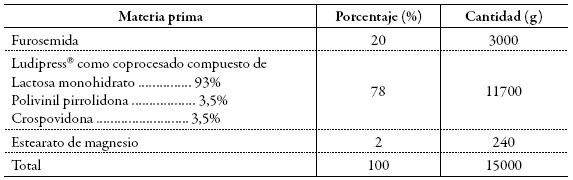
De manera independiente, las cantidades de furosemida y Ludipress® pesadas se pasaron a través de un tamiz No. 20 y se adicionaron a un mezclador de cintas marca Stokes (Ribbon Blender, fabricado en Filadelfia, EE. UU.) con capacidad de 20 kg. Se hizo la mezcla de los ingredientes por un tiempo de 15 min.
Para la lubricación de la mezcla se adicionó al mezclador la cantidad de estearato de magnesio pesada, pasándola previamente por un tamiz de malla No. 20. El lubricante se incorporó mezclando durante 5 min.
Uniformidad de mezcla
La distribución homogénea de la furosemida se determinó tomando una muestra de 5 g en 5 puntos del mezclador. La cuantificación del activo se realizó por cromatografía líquida de alta eficiencia según USP 38 6 en un cromatógrafo marca Waters, modelo Alliance 2695 con detector UV.
Para la corrida se utilizó como fase móvil una mezcla de 600 mL de agua, 400 mL de tetrahidrofurano y 1 mL de ácido acético glacial y como diluente una solución en partes iguales de agua-acetonitrilo. Se empleó una columna RP18 5,0 µm LiChrospher 100 (250-4), a un flujo de 1,00 µL/min, con una temperatura en la columna de 17 ± 5 °C. El volumen de inyección de la muestra fue de 50 µL para un tiempo de retención del analito de 6,8 min ± 10% a una longitud de onda de 254 nm.
La técnica analítica fue validada para las condiciones cromatográficas mencionadas anteriormente en cuanto a especificidad, exactitud (promedio recuperación: 99,28%), precisión (RSD: 0,55%) y linealidad (y = 61077,64x - 49337,58; r2 = 0,99982).
Compresión de la mezcla
La mezcla de furosemida con los excipientes se dividió en tres porciones iguales de 4,5 kg, siendo esta la cantidad de mezcla requerida en las tolvas de la tableteadora para hacer la compresión.
Para realizar la compresión de cada fracción de la mezcla, se programó el equipo para trabajar a una velocidad de 50 rpm en la torreta, a diferentes fuerzas de compresión. Se empleó una tableteadora Sejong Pharmatech, MRC-S instrumentada que controla, mide y registra la distancia entre los punzones. La cantidad de polvo comprimido se sometió a la misma fuerza de compresión fijando la distancia entre los rodillos de compresión y garantizando el peso uniforme de los comprimidos 17-19. El controlador lógico programable (PLC) del equipo permitió ajustar la fuerza de compresión en el rango de 0,9 a 25,5 kN. La compresión se hizo con punzones de acero inoxidable, circulares, con cara plana, de 6,0 mm de diámetro.
Se tomaron muestras representativas de las tabletas (500 en cada caso) obtenidas al inicio, mitad y final de la compresión a diferente fuerza de compresión (8 niveles), se mantuvieron en condiciones controladas de humedad (50-60%HR) y temperatura (entre 15 y 20 °C) en el cubículo de compresión y se realizaron las pruebas físicas de dureza, friabilidad y desintegración 20. Con estas variables se hizo la selección de los niveles de compresión en los cuales las tabletas cumplieron satisfactoria y simultáneamente los criterios en las tres pruebas 21. Estos comprimidos se analizaron con respecto al contenido de principio activo y uniformidad del mismo y se compararon por medio del comportamiento de disolución 22.
Pruebas físicas
Determinación de la dureza
Se colocó cada comprimido entre las dos mordazas de un durómetro Vanderkamp VK200 y se aumentó la presión hasta la ruptura de la tableta. La medición se realizó sobre diez comprimidos obtenidos en cada condición de compresión y el resultado se reportó como el valor promedio obtenido en cada caso. La prueba se hizo en comprimidos recién fabricados y se realizó seguimiento a la dureza en un período de 48 h. En el período de seguimiento, las tabletas se almacenaron en condiciones controladas (humedad 50-60%HR).
Friabilidad
Se tomó una muestra de 10 comprimidos previamente pesados, y se colocó en el tambor de un friabilizador Vankel FRIABI4. Se programó para rotar el tambor 100 veces. Una vez el friabilizador finalizó los ciclos, se observó la integridad de las tabletas y se procedió a pesarlas. La prueba se realizó por triplicado en cada condición de compresión y si se observaban partículas de polvo, estas se eliminaban con ayuda del aire comprimido antes de pesar. Se considera aceptable una pérdida de peso inferior al 1% 6.
Prueba de desintegración
Se depositó una tableta en cada uno de los 6 tubos de la canastilla de un desintegrador Hanson Research QC 21. Se colocó un disco sobre cada comprimido y se sumergió la canastilla en agua a 37 ± 2 °C. Una vez puesto el equipo en operación, se registró el tiempo necesario para la completa desintegración de las 6 tabletas. La prueba se hizo por triplicado en cada condición de compresión.
Pruebas químicas
Se determinó el contenido de furosemida en los comprimidos con la técnica validada, se calculó la uniformidad de dosis de acuerdo con lo indicado en la USP 38 y se verificó que las tabletas cumplan con los criterios de valoración establecidos en dicha farmacopea, previo a realizar la prueba de disolución 6.
Pruebas de desempeño
Evaluación del comportamiento de la disolución in vitro
Se tomaron muestras de 6 tabletas obtenidas en cada una de las condiciones de compresión y se procedió a evaluar la disolución en un disolutor con paletas, automuestrador y celda para la lectura directa de las muestras al ultravioleta (Vankel VK700).
Como medio de disolución, se empleó solución amortiguadora de fosfato de pH 5,8, a 50 rpm por 60 min a una temperatura de 37 ± 0,5 °C; condiciones definidas en la USP 38 6. Se tomó una alícuota del medio de disolución a intervalos de 5 min durante 1 h (12 en total); la toma de la muestra y filtración de esta se trabajó en modo automático. Se utilizaron filtros de cánula de 35µm marca Varían. El método analítico para la cuantificación de furosemida por espectrofotometría al UV en este medio de disolución se validó previamente, demostrando el cumplimiento de los criterios de especificidad, linealidad (y = 0,01x + 0,0012; r 2 = 0,9978), precisión (RSD: 0,45%) y exactitud (promedio de recuperación: 101,7%).
Con los datos de concentración de activo liberado en función del tiempo se elaboraron los perfiles de disolución para cada una de las tabletas evaluadas.
Comparación de los perfiles de disolución
Los perfiles de disolución de las tabletas obtenidas a diferentes condiciones de fuerza de compresión se compararon mediante el método del modelo independiente, calculando el factor de diferencia (f 1 ) y el factor de similitud f 2) 8. Igualmente, se realizaron comparaciones de la ED y del TMD para cada perfil mediante la prueba t utilizando un nivel de confianza del 95%.
RESULTADOS Y DISCUSIÓN
Uniformidad de la mezcla
La uniformidad de la mezcla entre los puntos muestreados se calculó por medio de la desviación estándar relativa (RSD) y se encontró un valor del 2,5%. El contenido (promedio) de activo en la mezcla se encontró entre 90%-110% y todos los resultados individuales en el rango del 75% al 125% de la cantidad esperada (tabla 3). Lo anterior indica una adecuada distribución del activo en la mezcla y la posibilidad de continuar con la compresión.
Tabla 3: Uniformidad de la mezcla.
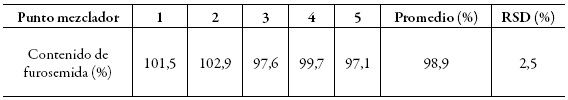
Compresión de la mezcla
Fuerza de compresión
Utilizando el PLC de la tableteadora, se fijó la fuerza en las etapas de pre-compresión y de compresión en cada caso, para obtener los valores reportados (tabla 4). De manera independiente, se determinó la dureza promedio de 10 comprimidos en cada condición (tabla 4).
Tabla 4: Ajuste de fuerza en pre-compresión y compresión.
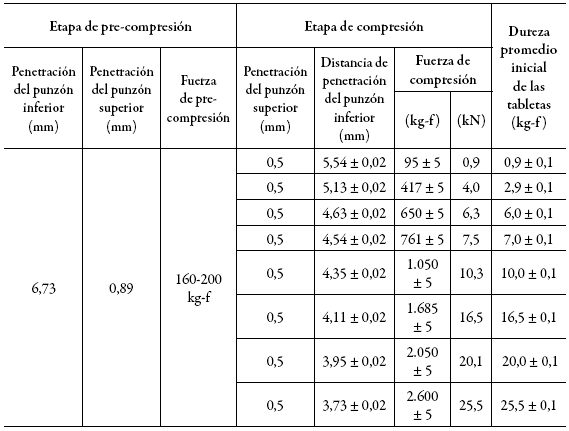
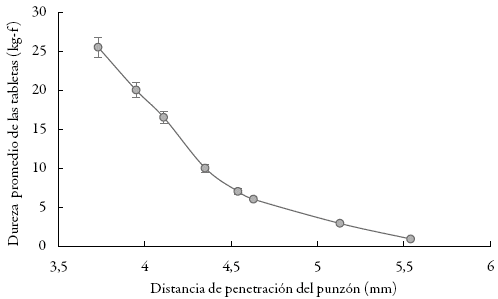
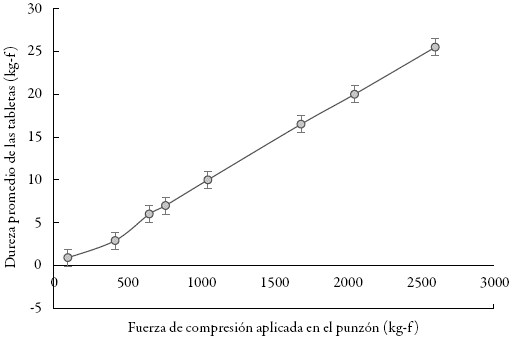
Con estos datos se obtuvieron las gráficas de la dureza promedio de las tabletas en función de la distancia de penetración del punzón (figura 1) y de la dureza promedio de las tabletas en función de la fuerza de compresión principal (figura 2).
Figura 1: Dureza de las tabletas en función de la distancia de penetración del punzón.
Figura 2: Dureza de las tabletas en función de la fuerza de compresión aplicada por el punzón en la etapa de compresión.
Se encontró una relación directa entre la fuerza de compresión aplicada en el punzón y la dureza promedio obtenida en las tabletas (figura 2). Este comportamiento facilita el control del proceso, ya que, al existir dicha proporcionalidad entre fuerza y dureza, la tableteadora puede garantizar la reproducibilidad de los resultados en el proceso de compresión 12,17.
Se obtuvieron los siguientes resultados en las pruebas realizadas a las tabletas obtenidas a diferentes fuerzas de compresión:
Pruebas físicas
Dureza
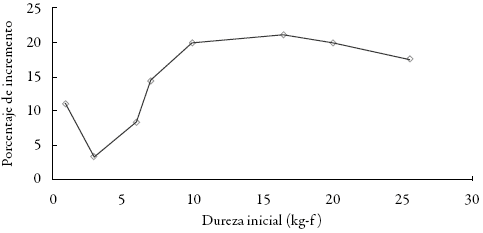
Se realizó la medición de la dureza de las tabletas recién comprimidas y a las 48 h se observó un incremento en el valor obtenido inicialmente. Transcurridos 2 días la dureza de las tabletas se estabilizó. El incremento (%) en la dureza de los comprimidos se presenta en la figura 3. Para el rango de estudio, dicha variación está en el orden del 3% al 22% de la dureza inicial. Este fenómeno se observa con relativa frecuencia y se sabe que está influenciado por factores como la pérdida o ganancia de humedad, la deformación plástica y el reordenamiento de las partículas al interior del comprimido luego de la consolidación 23.
Figura 3: Incremento en la dureza de las tabletas (48 h después).
Las variaciones en la dureza de las tabletas en las etapas pos-compresión pueden atribuirse a atracciones entre las partículas o cambios en estas al interior del comprimido 24. Se han propuesto tres principales explicaciones mecanicistas: reorganización del material sólido en la superficie de las partículas dentro de la tableta, deformación continua de las partículas después de la compactación y cristalización del material disuelto entre partículas vecinas debido al movimiento del agua dentro de la tableta 25,26.
En el presente estudio, los resultados muestran que el incremento en la dureza fue mayor en la medida que aumentó la fuerza de compresión en tabletas con durezas entre 3 y 10 kg-f, se estabiliza en tabletas con durezas entre 10 y 20 kg-f y es menor en comprimidos con durezas superiores a dicho valor.
A medida que el contenido de humedad en la tableta se incrementa, la dureza de las tabletas también aumenta (de manera especial a bajos contenidos de humedad), alcanza un máximo, y luego decrece (específicamente con altos contenidos de humedad) 24. Debido a que el efecto de la humedad del ambiente es mayor cuando las tabletas se obtienen por compresión directa, fue necesario controlar estrictamente las condiciones de almacenamiento de los comprimidos a granel hasta el envasado hermético de los mismos 26.
Friabilidad
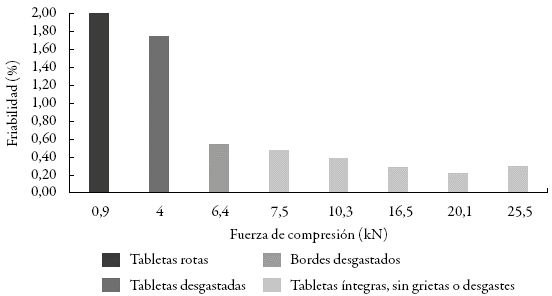
En la figura 4 se reportan los resultados obtenidos al evaluar la friabilidad de las tabletas obtenidas a los diferentes niveles de fuerza de compresión investigados.
Figura 4: Relación de la friabilidad con la fuerza de compresión aplicada.
Para garantizar la integridad de las tabletas en el proceso de envase, empaque, transporte y almacenamiento y de acuerdo con los resultados obtenidos, se decide que la dureza de los comprimidos debe ser igual o superior a los 8 kg-f, ya que las tabletas con durezas inferiores presentarán problemas de friabilidad como desgaste y ruptura. Este valor de dureza se alcanza con fuerzas de compresión iguales o superiores a 7,5 kN.
Desintegración
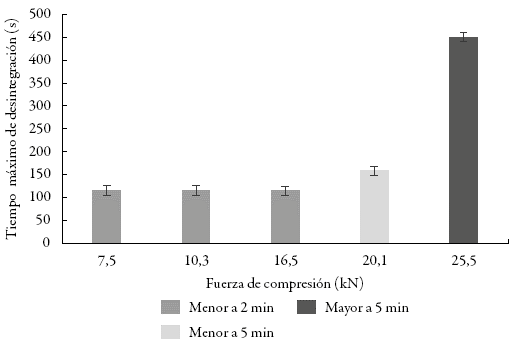
Se realizó la prueba de desintegración a las tabletas obtenidas con fuerzas de compresión en el rango de 7,5 a 25,5 kN. Los resultados se presentan en la figura 5.
Figura 5: Relación de la dureza y el tiempo máximo de desintegración de las tabletas.
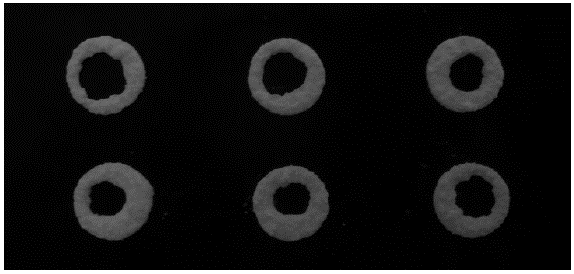
Para comprimidos obtenidos a fuerzas de compresión iguales o superiores a los 20,1 kN, se observó que la presión aplicada por el punzón retarda el efecto desintegrante de la crospovidona. A mayor fuerza de compresión, el punzón penetra más en la matriz, desplaza mayor cantidad de aire y reduce la porosidad de la tableta, dificultando la penetración del agua y el hinchamiento del comprimido 13,27. De esta forma, las tabletas no se desintegran como tal, sino que se erosionan lentamente formando aros, tal como se presenta en la figura 6. La formación de dichos aros está relacionada con la distribución de la fuerza aplicada al interior de la matriz y la densificación del polvo en el comprimido 28.
Figura 6: Formación de aros en la prueba de desintegración
Teniendo en cuenta que las tabletas obtenidas a fuerzas de compresión iguales o superiores a los 20,1 kN presentaron tiempos de desintegración mayores a 2 min, se considera conveniente acotar el parámetro de fuerza de compresión a 16,5 kN, con objeto de favorecer una rápida desintegración de la tableta y asegurar la menor variabilidad en los resultados. De esta forma, se establece como criterio para la dureza de las tabletas un rango entre 8 y 20 kg-f.
Pruebas químicas
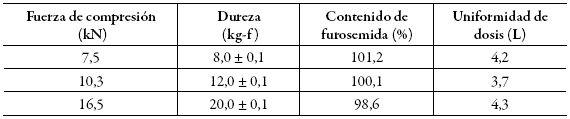
Los resultados del contenido y la uniformidad de dosis de los comprimidos de furosemida se presentan en la tabla 5 y evidencian el cumplimiento de los criterios establecidos en la USP 38 6. Los resultados se consideran satisfactorios para continuar con las pruebas de disolución.
Tabla 5: Contenido de furosemida en comprimidos obtenidos, según la fuerza de compresión.
Pruebas de desempeño
Para evaluar el efecto de la fuerza de compresión en la disolución in vitro del principio activo, se tomaron muestras de las tabletas obtenidas con fuerzas de compresión de 7,5 kN, 10,3 kN y 16,5 kN y se realizaron los correspondientes perfiles de disolución. La tabla 6 resume los resultados obtenidos en cada tiempo de muestreo y el coeficiente de variación asociado a la medición realizada en los 6 vasos del disolutor.
* % F: porcentaje de furosemida disuelta, CV: coeficiente de variación.Tabla 6: Furosemida liberada (%) en tabletas obtenidas a diferentes fuerzas de compresión.
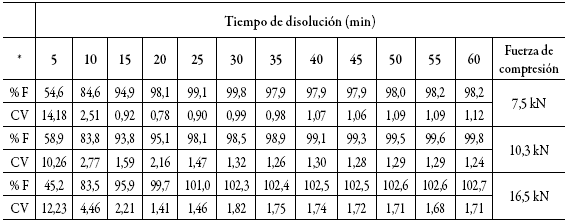
La cantidad de fármaco disuelto es superior a 80% en los primeros 10 min de la disolución (tabla 6). Además, se observa que la mayor dispersión de los datos se presenta en los primeros minutos, donde el proceso de desintegración se lleva a cabo, es decir, la velocidad de disolución está influenciada por el desintegrante (crospovidona) de la formulación 13,15.
Comparación de los perfiles de disolución a diferentes fuerzas de compresión
Para el análisis se utilizaron como referencia los datos de disolución de las tabletas obtenidas en el nivel intermedio de fuerza de compresión (10,3 kN) y se compararon con el nivel inferior (7,5 kN) y el superior (16,5 kN), calculando los factores de diferencia (f 1) y de similitud (f 2). Así, se determinó la significancia del efecto de la fuerza de compresión en cada una de las condiciones de estudio. En la tabla 7 se presentan los resultados.
Tabla 7: Comparación de los perfiles de disolución para tabletas de furosemida obtenidas con diferente fuerza de compresión.
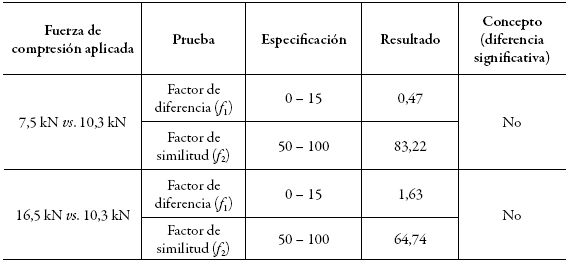
El factor de diferencia es menor a 2,0 cuando se comparan las tabletas obtenidas a 7,5 kN y 16,5 kN frente a las de 10,3 kN, lo que confirma que no se detecta diferencia significativa entre las tabletas obtenidas a fuerzas de compresión entre los 7,5 kN y 16,5 kN. Asimismo, al comparar los factores de similitud (83,22 y 64,74), es posible afirmar que los perfiles de liberación para las tabletas obtenidas en los tres niveles de fuerza de compresión son equivalentes. Por lo anterior, dicho rango de compresión se fija como parámetro para controlar el proceso.
Se considera que el buen desempeño de las tabletas en las condiciones de operación definidas, se logró por las propiedades de compresibilidad y desintegración de la formulación utilizada. Gracias a la compresibilidad de la mezcla, se presentó un incremento lineal en la dureza de las tabletas con la fuerza de compresión aplicada (7,5 kN a 16,5 kN). En estas condiciones se obtuvieron comprimidos con baja friabilidad que tendrían la porosidad suficiente para permitir la permeación del agua y la desintegración. El rápido efecto desintegrante se atribuye a la capacidad de hinchamiento de la crospovidona al entrar en contacto con el agua 15.
El análisis de los perfiles de disolución con el software KinetDS® permitió determinar la eficiencia y el tiempo medio de disolución de la furosemida en los comprimidos obtenidos.
La ED se calculó a las diferentes fuerzas de compresión y los resultados se presentan en la tabla 8. La ED fue superior al 85% en todos los casos con un TMD comprendido en el rango entre 5,0 y 7,0 min.
Tabla 8: Comparación de las medias de las ED y los TMD a diferentes fuerzas de compresión.
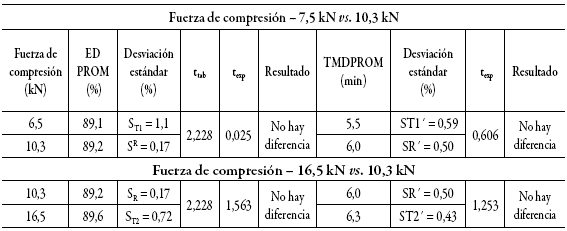
Al realizar la comparación de las medias de las ED y los TMD por medio de la prueba de hipótesis, se pudo demostrar que no se detecta diferencia estadísticamente significativa entre estos parámetros.
De acuerdo con los resultados obtenidos en las pruebas de desintegración y disolución, se puede inferir que controlando la fuerza de compresión y la dureza de las tabletas durante el proceso, se pueden obtener comprimidos que satisfagan los criterios de aceptación y así alcanzar con seguridad la liberación del activo.
De la misma forma, con la formulación utilizada se logró que la disolución de las tabletas de furosemida no resultara afectada de manera significativa por la fuerza de compresión y fue posible definir un espacio de diseño para el proceso que asegura la liberación del fármaco dentro de los criterios de aceptación establecidos por la USP 38 6.
Diseño del proceso de compresión - Establecimiento de los parámetros de proceso
Con el estudio realizado se definió el rango de la fuerza de compresión principal con el cual se pueden obtener comprimidos de furosemida por vía seca y a escala industrial. En la tabla 9 se presentan el rango de operación y los criterios de aceptación de las tabletas para controlar el proceso.
Tabla 9: Definición de la fuerza de compresión y de las características de calidad del producto en el proceso.

Los resultados obtenidos sirven como punto de partida para ajustar el proceso si se quiere realizar la compresión en otras tableteadoras rotativas 18. Sin embargo, se debe tener en cuenta que todo cambio de equipo requiere que se haga la evaluación de su impacto sobre los atributos críticos de calidad del producto, como lo indican las guías SUPAC 29,30.
CONCLUSIONES
Se evaluó el efecto de la fuerza de compresión sobre los atributos críticos de calidad de tabletas de furosemida obtenidas por compresión directa y se definieron las condiciones de operación en las cuales se puede llevar a cabo el proceso de compresión (7,5 kN a 16,5 kN) para obtener tabletas con una rápida (TMD < 7,5 min) y total liberación del fármaco (ED > 85%). Por medio de las pruebas de desempeño y utilizando como estadísticos de prueba los factores f 1 yf 2 y los parámetros ED y TMD, se demostró la equivalencia de las tabletas obtenidas en el rango de compresión establecido.
REFERENCIAS
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Licencia
Derechos de autor 2017 Revista Colombiana de Ciencias Químico-Farmacéuticas

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
El Departamento de Farmacia de la Facultad de Ciencias de la Universidad Nacional de Colombia autoriza la fotocopia de artículos y textos para fines de uso académico o interno de las instituciones citando la fuente. Las ideas emitidas por los autores son responsabilidad expresa de estos y no de la revista.
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons de Atribución 4.0 aprobada en Colombia. Consulte la normativa en: http://co.creativecommons.org/?page_id=13