Capacidad antioxidante y calidad post-descongelación de semen equino criopreservado con quercetina y ergotioneina
DOI:
https://doi.org/10.15446/rfmvz.v63n3.62747Keywords:
antioxidantes, criopreservación de semen, estrés oxidativo (es)Downloads
Doi: 10.15446/rfmvz.v63n3.62747
CAPACIDAD ANTIOXIDANTE Y CALIDAD POST-DESCONGELACIÓN DEL SEMEN EQUINO CRIOPRESERVADO CON QUERCETINA Y ERGOTIONEINA
ANTIOXIDANT CAPACITY AND POST-THAW QUALITY OF STALLION SEMEN CRYOPRESERVED WITH QUERCETIN AND ERGOTHIONEINE
G. Restrepo1*, J. D Montoya2, B. Rojano1
1 Universidad Nacional de Colombia Sede Medellin, Calle 59A
no 63-20, Medellin (Colombia).
2 Politécnico Colombiano Jaime Isaza Cadavid, Cra. 48 no.
7-151, Medellin (Colombia).
* Autor para correspondencia: grestre0@unal.edu.co
Artículo recibido: 9 de noviembre de 2015 Aprobado: 28 de abril de 2016
RESUMEN
Se evaluó la capacidad antioxidante y la calidad post-descongelación del semen equino criopreservado con quercetina y ergotioneina. Nueve eyaculados provenientes de tres caballos criollos colombianos se criopreservaron bajo tres tratamientos: ergotioneina (100 pM), quercetina (100 pM) y control (sin antioxidante). Posteriormente a la descongelación se evaluaron los siguientes parámetros: la capacidad antioxidante total (CAT) del semen mediante el ensayo del ácido 2,2'-azino-bis-[3-etilbenzotiazolina]-6-sulfónico (ABTS•+); la movilid ad total (MT); la movilidad progresiva (MP); la hiperactividad (HA) y las velocidades curvilínea (VCL), lineal (VSL) y media (VAP) mediante el sistema computarizado SCA ; además, la integridad estructural de la membrana y la integridad acrosómica por microscopia de fluorescencia mediante las sondas SYBR/IP y FITC/ PNA, respectivamente; la morfología mediante la tinción eosina-nigrosina y la integridad funcional de membrana a través de la prueba hipoosmótica (HOS). Se realizó el ajuste de modelos lineales generalizados (GLM) y la comparación de medias por Tukey. La CAT (pmol trolox/ml) del semen descongelado fue superior para la ergotioneina (4,0 ± 0,3) y la quercetina (3,9 ± 0,4), respecto del control (2,6 ± 1,5). Para la MT se encontró una media superior para la ergotioneina (70,3 ± 11,2 %), respecto a la quercetina (63 ± 10,5 %) y al control (66,1 ± 11,2 %) (P < 0,05). Para MP, HA, VCL, VSL y VAP, el tratamiento control presentó valores superiores a los tratamientos con antioxidantes (P < 0,05). Se concluye que la ergotioneina y la quercetina incrementan la CAT e influyen sobre la movilidad y la cinética post-descongelación del semen equino.
Palabras clave: antioxidantes, criopreservación de semen, estrés oxidativo.
ABSTRACT
The aim of this study was to evaluate the antioxidant capacity and post-thaw quality of stallion semen cryopreserved with quercetin and ergothioneine. Nine ejaculates from three Colombian Creole horses were cryopreserved under three treatments: ergothioneine (100 pM), quercetin (100 pM) and control (no antioxidant). Post-thaw were evaluated the parameters: total antioxidant capacity (TAC) of semen through the acid test of azino 2,2'-bis[3-ethylbenzothiazoline]-6-sulfonic acid (ABTS•+); total motility (MT), progressive motility (MP), hyperactivity (HA) and curvilinear (VCL), linear (VSL) and average path (VAP) velocities by the computerized system SCA ; structural membrane integrity and acrosome integrity by fluorescence microscopy using SYBR / IP and FITC / PNA probes, respectively; morphology by eosinnigrosin staining and functional membrane integrity by hypoosmotic swelling test (HOS). The adjustment of generalized linear models (GLM) and comparison of means by Tukey was performed. The TAC (pmol trolox/ml) of thawed semen was higher for ergothioneine (4.0 ± 0.3) and quercetin (3.9 ± 0.4), compared to control (2.6 ± 1.5). For MT a higher average for ergothioneine (70.3 ± 11.2%) compared to quercetin (63 ± 10.5%) and control (66.1 ± 11.2%) was found (P < 0.05). For MP, HA, VCL, VSL and VAP, the control showed higher values compared to the antioxidant treatments (P < 0.05). It is concluded that ergothioneine and quercetin increased the TAC and have influence on post-thawed motility and kinetics of stallion semen.
Keywords: antioxidants, semen cryopreservation, oxidative stress.
INTRODUCCIÓN
Pese a los avances en la criopreservación de células espermáticas, el desarrollo de esta biotecnología para la especie equina, ha avanzado lentamente (Kirk et al. 2005). Es evidente la variación en la congelabilidad del semen entre los diferentes reproductores (Neira et al. 2007), de tal forma que solo entre el 30% y el 40% de los caballos producen semen que puede criopreservarse (Ángel y Bran 2010).
La criopreservación de las células reproductivas produce un incremento en la producción de especies reactivas de oxígeno (EROs) y la reducción de su capacidad antioxidante, lo cual origina una condición denominada 'estrés oxidativo' (Tatone et al. 2010). Las EROs son responsables de causar daño a las membranas de los espermatozoides y de la fragmentación de su ADN, entre otros factores que influyen en la fertilidad (Lanqoni et al. 2015). El semen equino es conocido por su susceptibilidad a la peroxidación lipídica, a causa de su alto contenido de ácidos grasos poliinsaturados (Macías-García et al. 2011). Sin embargo, otros componentes celulares como proteínas, ácidos nucleicos y azúcares, son blancos potenciales del estrés oxidativo (Agarwal et al. 2008).
Las alteraciones estructurales de los espermatozoides equinos durante la criopreservación se han relacionado con la peroxidación de los lípidos y la oxidación de las proteínas. Incluso se ha propuesto la evaluación de estos procesos como un método útil para la identificación de machos con problemas de fertilidad (Morte et al. 2008). De otro lado, el plasma seminal equino contiene diversas moléculas antioxidantes (Ortega-Ferrusola et al. 2009); sin embargo, este fluido biológico es comúnmente removido durante los procesos de criopreservación seminal (Moore et al. 2005), haciendo necesaria la suplementación de los diluyentes con antioxidantes (Barros et al. 2012; Lisboa et al. 2012).
Dos moléculas antioxidantes, la ergotioneina y la quercetina, han generado interés por sus efectos favorables durante la congelación de espermatozoides (Gibb et al. 2013; Najafi et al. 2014). La ergotioneina puede formarse por microorganismos, como un tiol de bajo peso molecular, que se encuentra presente en fluidos como el plasma seminal, en células como los eritrocitos y en órganos como el riñón y el hígado, e incluso está presente en hongos comestibles (Kaneko et al. 1980; Hartman 1990; Tepwong 2012). El plasma seminal equino contiene una alta concentración de ergotioneina (Metcalf et al. 2008). Esta molécula es considerada como altamente antioxidante, tiene la capacidad de neutralizar moléculas de oxígeno (Dahl et al. 1988), radicales hidroxilo (Akanmu et al. 1991) y radicales peroxilo (Asmus et al. 1996). En semen de carnero, la ergotioneina ha mejorado la movilidad de los espermatozoides sometidos a períodos cortos de almacenamiento a 5°C (Yildiz y Daşkin 2004). Su adición en el diluyente de congelación para el semen equino, ha permitido mejorar la calidad espermática post-descongelación (Metcalf et al. 2008).
Por su parte, la quercetina es un flavonoide antioxidante que suprime la formación del ion superóxido y los quelatos de hierro, además de inhibir la formación de radicales peroxilipídicos (Afanas'ev et al. 1989). En el semen equino, reduce la peroxidación lipídica de los espermatozoides durante la congelación y evita su capacitación prematura antes de la inseminación artificial (McNiven y Richardson 2006). Gibb et al. (2013) encontraron que la quercetina mejora la movilidad y la habilidad de unión a la zona pelúcida de los espermatozoides equinos congelados, además de ser útil en la reducción de la fragmentación del ADN en el semen sexado.
A pesar de las investigaciones realizadas, poco se conoce sobre la influencia que la ergotioneina y la quercetina ejercen sobre la capacidad antioxidante total (CAT) del semen criopreservado, lo cual ha limitado los diferentes estudios respecto de la evaluación de las alteraciones espermáticas y su impacto sobre la fertilidad. El objetivo de esta investigación fue evaluar la capacidad antioxidante y la calidad post-descongelación del semen equino criopreservado con quercetina y ergotioneina.
MATERIALES Y MÉTODOS
Recolección y evaluación seminal
Se utilizaron tres caballos criollos colombianos (Equus caballus) procedentes del Valle del Aburrá (Antioquia, Colombia) para la recolección de nueve eyaculados mediante el método de vagina artificial. Los animales, entre 4 y 8 años de edad, fueron sometidos a un régimen de mínimo una colecta semanal, con fertilidad comprobada por crías nacidas vivas y con una condición corporal de 6 a 7 (escala 1-9). El semen colectado se diluyó en proporción 1:1 en un diluyente comercial (Equiplus®, Minitube) a 37°C y luego se transportó en un dispositivo de refrigeración (Equitai-ner®, Hamilton Research Inc). Se evaluó la concentración espermática mediante espectrofotometría (Spermacue®, Minitube) y la movilidad por microscopía de contraste de fase (Eclipse E200®, Nikon Inc.). Solo se procesaron los eyaculados con un mínimo de 100 x 106 espermatozoides/ ml y 60% de movilidad total.
Tratamientos de criopreservación
La criopreservación del semen se realizó mediante un protocolo modificado de congelación (Bustamante et al. 2009). El semen se centrifugó a 1.200 g por 12 minutos y el precipitado se resuspendió para conseguir una concentración final de 100 x 106 espermatozoides/ml, en el mismo diluyente empleado para el transporte (EquiPlus®, Minitube), suplementado con 5% de A(A-dimetilformamida (Sigma-Aldrich) y 5% de yema de huevo centrifugada. La yema centrifugada se preparó de acuerdo con lo descrito por Nouri et al. (2013), para lo cual se diluyó en una proporción de 3:1 en agua ultra pura y se centrifugó a 1.600 g durante 99 minutos.
Luego, cada eyaculado se separó en tres alícuotas y se suplementó con los tratamientos: L(+)ergodoneina (100 pM, Sigma-Aldrich®), quercetina (100 pM, Sigma-Aldrich®) y control (sin antioxidante). El semen de cada tratamiento se mantuvo en refrigeración a 5°C por 30 minutos y luego se empacó en pajillas de 0,5 ml (MRS1 Dual V2®, IMV Technologies). Las pajillas se sometieron a vapores de nitrógeno líquido por 15 minutos y se almacenaron durante un mes en un tanque para nitrógeno líquido (IMV Technologies).
Evaluación seminal post-descongelación
Evaluación de la capacidad antioxidante total (CAT)
Se empleó el ensayo de decoloración del radical catiónico ABTS•+ (ácido 2,2'-azi-no-bis-[3-etilbenzotiazolina]-6-sulfónico), el cual mide la habilidad relativa de un antioxidante para atrapar el radical ABTS•+ generado en una solución acuosa. Este ensayo se realizó de acuerdo con lo descrito por Arts et al. (2004) y Rojano et al. (2010). Para cada eyaculado se evaluaron tres pajillas con semen descongelado por tratamiento. El radical ABTS•+ se generó por la oxidación de 3,5 mM de ABTS con 1,25 mM de persulfato de potasio. Se emplearon 10 pl de semen y 990 pl de la solución del radical ABTS•+ Luego de 30 minutos de reacción a temperatura ambiente y en la oscuridad, se midió en un espectrofotómetro (6405 UV/Vis, Jenway) el cambio en la absorbancia respecto a una solución de referencia compuesta por 10 pl de solución buffer y 990 pl de la solución del radical ABTS•+ Después de 24 horas de reacción, se ajustó la absorbancia con PBS a pH 7,4 hasta 0,70 unidades, a una longitud de onda de 732 nm y se comparó frente a una curva patrón con Trolox® Como interpretación del ensayo, la disminución de la coloración de la solución con el radical ABTS•+ se atribuye a la reducción de dicho radical por efecto de los antioxidantes de la muestra.
Movilidad espermática
Se evaluó mediante el sistema Sperm Class Analizer (SCA®, Microptic S.L.) de acuerdo a lo descrito por Res trepo et al. (2013). Se utilizó un microscopio de contraste de fase (Eclipse E200 ®, Nikon, Inc) con una cámara digital (Scout SCA780®, Basler). Se evaluaron los parámetros: movilidad total (MT), movilidad progresiva (MP), velocidad rectilínea (VSL), velocidad curvilínea (VCL), velocidad media (VAP) e hiperactividad (HA).
Integridad estructural de la membrana plasmática (IEM)
Se evaluó utilizando el procedimiento descrito por Gamboa et al. (2010), con el kit Live/Dead * (Molecular Probes Inc). Se suspendieron 200 pl de la muestra espermática en solución Hanks Heppes (HH) con 1% de albúmina sérica bovina (BSA), para una concentración aproximada de 20 x 106 espermatozoides/ml. Luego, la mezcla se incubó a 37°C por 8 minutos, con 6 mM de SYBR-14. Seguidamente se incubó de la misma manera, con 0,48 mM de yoduro de propidio (IP). A continuación, a partir de una muestra de 5 pl, se realizó el conteo de 200 espermatozoides mediante un filtro UV-2A de un microscopio E200 ® con fluorescencia HBO (Nikon Inc.).
Integridad acrosómica (IA)
Se evaluó mediante el uso de la sonda fluorescente FITC-PNA * (Sigma-Aldrich), de acuerdo con lo descrito por Rathi et al. (2001). Se realizó un extendido de cada muestra, el cual se fijó por 10 minutos con etanol al 95%. Luego se dejó secar a temperatura ambiente y se agregaron 25 pl de FITC-PNA® (5 pg/ml) en solución buffer fosfato (PBS). Cada extendido se guardó en la oscuridad por 30 minutos y posteriormente se lavó con agua destilada. Se evaluaron 200 espermatozoides usando un filtro G-2A, de un microscopio E200 ® con fluorescencia HBO (Nikon Inc.).
Integridad funcional de la membrana plasmática (HOS)
Se determinó mediante la prueba hipoosmótica (HOS) (Neild et al. 1999). Se tomaron 100 pl de semen y se adicionaron a un tubo con 500 pl de una solución hipoosmótica de sacarosa 5,4% (100 mOsmol/l). Esta mezcla se incubó a 38,5°C por 30 minutos y luego se evaluó mediante microscopia de contraste de fase (Eclipse E200®, Nikon Inc.), la reacción de 200 espermatozoides.
Morfología espermática (MN)
Se evaluó mediante la tinción con eosina-nigrosina (Barth y Oko 1989). Sobre un portaobjetos se depositó una gota de muestra y una gota de eosina-nigrosina (Sigma-Aldrich). Ambas gotas se mezclaron y se realizó un extendido, el cual se fijó sobre una platina térmica a 37°C. Se realizó la evaluación de la morfología de 200 espermatozoides en un microscopio de contraste de fase (Eclipse E200®, Nikon Inc.).
Análisis estadístico
se realizó el ajuste de modelos lineales generalizados (GLM) para cada variable. Se incluyó el efecto fijo del tratamiento y el efecto fijo del eyaculado anidado dentro del equino. Mediante un análisis de correlación de Pearson, se realizó la definición de covariables, así como la evaluación de la relación entre la CAT y los parámetros espermáticos. Se comprobó la normalidad de los datos a través de la prueba de Shapiro-Wilk. Se realizó la comparación de las medias mediante la prueba de Tukey. Todos los análisis se estimaron usando el programa SAS 9.2® (SAS Inst. Inc., Cary, NC).
RESULTADOS
La evaluación de la capacidad antioxidante total (CAT) del semen descongelado mediante la metodología ABTS•+ arrojó como resultado valores de 2,6 ± 1,5 pmol trolox/ml, 3,9 ± 0,4 pmol trolox/ml y 4,0 ± 0,3 pmol trolox/ml, para los tratamientos control, quercetina y ergotioneina, respectivamente. Se observó diferencia en los niveles de CAT, siendo superiores para las muestras suplementadas con los antioxidantes respecto del control (P < 0,05). Los resultados del control presentaron un mayor nivel de variabilidad frente a los de la quercetina y la ergotioneina, con coeficientes de variación (CV) de 59,1%, 10,7% y 7,1%, respectivamente. Para el modelo estadístico ajustado para esta variable dependiente, se encontró un coeficiente de determinación (R2) de 0,60. El efecto fijo del tratamiento, así como el efecto fijo del eyaculado anidado dentro del equino fueron significativos (P < 0,05). Se encontró una media para la variable de 3,50 ± 1,1 pmol trolox/ml de semen y un coeficiente de variación (CV) del 22,3%.
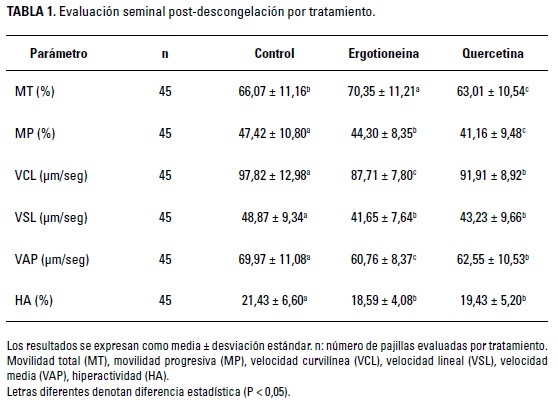
La Tabla 1 presenta los resultados de la evaluación seminal post-descongelación para cada tratamiento. El efecto fijo del tratamiento, así como el efecto anidado del eyaculado dentro del equino, fueron significativos para todas las variables (P < 0,05), a excepción de la integridad acrosómica (P > 0,05). Se hallaron coeficientes de correlación negativos y significativos (P < 0,05) entre la CAT y los parámetros MP (r = -0,53), VCL (r = -0,49), VAP (r = -0,38) y HA (r = -0,51). Para los parámetros de movilidad espermática solo se observó un efecto significativo y superior de ambos antioxidantes para la MT (P < 0,05), mientras para la MP, en los parámetros cinéticos (VCL, VSL y VAP) y la hiperactivación espermática (HA), se encontró superioridad del tratamiento control (P < 0,05).
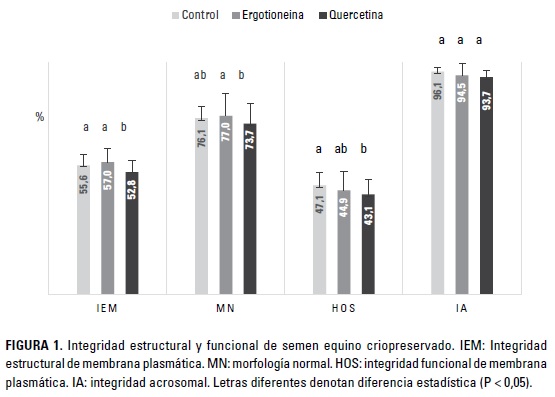
La Figura 1 presenta los resultados de integridad estructural y funcional de los espermatozoides criopreservados bajo los diferentes tratamientos. Para la integridad estructural (IEM) y funcional (HOS) de la membrana plasmática, la quercetina mostró resultados inferiores al control y a la ergotioneina (P < 0,05). Sin embargo, entre estos últimos antioxidantes no se encontraron diferencias para ambos parámetros (P < 0,05). Para la MN y la IA no se encontraron diferencias entre el control y los antioxidantes evaluados (P < 0,05), sin embargo, la MN del semen suplementado con ergotioneina fue superior a la encontrada para el tratamiento con quercetina (P < 0,05).
DISCUSIÓN
La criopreservadón de células reproductivas produce un incremento en la producción de EROs (Tatone et al. 2010). Cuando los mecanismos antioxidantes son incapaces de contrarrestar el exceso de EROs se produce estrés oxidativo (Aitken 2006). Esta condición induce en las células espermáticas cambios en la fluidez de la membrana y alteración de la actividad enzimática, lo cual genera la reducción de la movilidad, la viabilidad y la capacidad fecundante de los espermatozoides (Najafi et al. 2014).
La remoción del plasma seminal durante la criopreservación del semen equino, produce la pérdida de antioxidantes enzimáticos y no enzimáticos, que protegen a los espermatozoides de los efectos nocivos de las EROs (Waheed et al. 2013). Debido a esto la principal alternativa para proteger los espermatozoides del estrés oxidativo es la adición de moléculas antioxidantes exógenas (Cocchia et al. 2011; Barros et al. 2012), aunque poco se conoce del aporte que dichas moléculas a la capacidad antioxidante total (CAT) del semen criopreservado. Esto ha limitado la evaluación de las alteraciones espermáticas y su impacto sobre la fertilidad. La evaluación de la CAT puede dar más información biológicamente relevante, que la obtenida a partir de la medición de concentraciones de antioxidantes individuales, dado que la cooperación entre los diferentes antioxidantes proporciona una mayor protección contra el ataque de las EROs (Ghiselli et al. 2000). Durante la criopreservación del semen equino, componentes de los diluyentes, como la yema de huevo y el plasma seminal residual, así como otros antioxidantes endógenos, podrían aportar a la CAT del semen en dilución, por lo cual la evaluación de esta propiedad podría adquirir mayor relevancia. En plasma seminal equino la evaluación de la CAT, mediante la metodología ABTS, evidenció una correlación negativa con el daño del ADN de los espermatozoides (Wnuk et al. 2010).
En esta investigación fue evidente el aporte de la quercetina y la ergotioneina a la CAT del semen equino. Para ambas moléculas se encontró un valor de CAT superior, respecto al control sin antioxidante (P < 0,05). Así mismo, se observó una menor variabilidad en los resultados para ambos antioxidantes (CV < 20%). El incremento de la CAT del semen por efecto de la ergotioneina se observó en un estudio reciente en semen criopreservado de carneros, con resultados de 155,1 ± 2,7 mM/l, 173,9 ± 5,1 mM/l y 250 ± 28 mM/l, para control, ergotioneina al 5 mM y ergotioneina al 10 mM, respectivamente; sin embargo, los autores no encontraron diferencias estadísticas entre los tratamientos para diferentes parámetros de calidad seminal (P < 0,01) (Yildiz et al. 2015).
La ergotioneina tiene la capacidad de proteger los espermatozoides de sustancias químicas oxidadas y peroxidadas (Mann y Lutwak-Mann 1981), posiblemente por su capacidad de neutralizar moléculas de oxígeno (Dahl et al. 1988), radicales hidroxilo (Akanmu et al. 1991) y radicales peroxilo (Asmus et al. 1996). El semen de carnero congelado con 6 mM de ergotioneina reduce la peroxidación lipídica (Najafi et al. 2014). De otro lado, el aporte antioxidante de la quercetina se relaciona con su capacidad para suprimir la formación del ion superóxido, los quelatos de hierro y la formación de radicales peroxi-lipídicos (Afanas'ev et al. 1989), lo cual explicaría su capacidad para reducir la peroxidación lipídica y evitar la capacitación prematura de los espermatozoides equinos durante la congelación (McNiven y Richardson 2006).
Los resultados de calidad seminal en este estudio muestran un efecto favorable de la ergotioneina sobre la movilidad total, con una media superior respecto a los demás tratamientos (P < 0,05) (Tabla 1), lo cual concuerda con Metcalf et al. (2008) quienes encontraron una mejora de la movilidad espermática post-descongelación usando una suplementación al medio de congelación con 18 pM de ergotioneina. Sin embargo, todos los demás parámetros de movilidad y cinética espermática evaluados en la presente investigación (MP, VCL, VSL, VAP y HA) presentaron valores superiores para el tratamiento control (P < 0,05) (Tabla 1). Lo anterior coincide con Coutinho et al. (2008) quienes encontraron que el uso de ergotioneina (0,7, 2,0, 6,0 y 18 mM) en medios de congelación de semen equino, no mejora la movilidad total y progresiva de los espermatozoides. De igual forma, en otro estudio no se encontró efecto de la ergotioneina (5 y 10 mM) sobre los parámetros seminales post-descongelación de semen de carneros (Yildiz et al. 2015).
Aún son pocas las investigaciones donde se reporta el uso de ergotioneina en semen equino, razón por la cual, los resultados pueden ser contradictorios. Sin embargo, a modo de análisis de los resultados obtenidos en este estudio, es importante considerar que las EROs están involucradas en los procesos de capacitación espermática (Chi et al. 2008), por lo cual sería posible que la disminución de las EROs, por acción de moléculas antioxidantes, modifique los patrones de movilidad y cinética espermática, incluso mediante la reducción de procesos como la criocapacitación (Thomas et al. 2006). Un indicador importante en este sentido, estaría dado por la tasa de hiperactivación espermática, la cual se vio reducida por la suplementación con ergotioneina y quercetina (Tabla 1).
La suplementación con ergotioneina de 2 y 4 mM durante la criopreservación de semen de carneros presenta resultados benéficos en los patrones de movilidad espermática, con un incremento en los porcentajes de movilidad total y progresiva, así como en los parámetros cinéticos (vsL, vCL y YAP) de los espermatozoides (Çoyan et al. 2011). De igual forma, la suplementación con 10 mM de ergotioneina puede mejorar la movilidad progresiva y la integridad de membrana de muestras seminales de carnero con pobre congelabilidad (Ari et al. 2012). Ambos estudios difieren en gran medida con lo encontrado en esta investigación, donde aunque se observó un incremento en la MT, hubo una reducción tanto en la MP, como en los parámetros cinéticos de los espermatozoides (Tabla 1).
En otro estudio con semen de carnero se demostró un efecto favorable de niveles de inclusión entre 2 y 6 mM de ergotioneina, sobre la movilidad total, la vitalidad y la funcionalidad de la membrana (HOS). Sin embargo, no se encontró efecto sobre la MP, los parámetros cinéticos, la capacitación y reacción acrosómica, la actividad de la glutatión peroxidasa (GPx) y las anormalidades espermáticas (Najafi et al. 2014). En coincidencia con la presente investigación, se halló un mejoramiento de la MT (Tabla 1); sin embargo, en el presente estudio no se encontró efecto alguno sobre la integridad funcional (HOs) o la integridad estructural (IEM) de la membrana plasmática; este último parámetro se asocia con la vitalidad de los espermatozoides (Figura 1). Adicionalmente, se encontró una mayor proporción de espermatozoides móviles respecto a aquellos con membrana plasmática integra (IEM), lo cual podría atribuirse a la detección de alteraciones tempranas de la membrana que no comprometen necesariamente la viabilidad espermática. En un estudio de Yeste et al. (2014) se observó este mismo fenómeno para eyaculados de equinos de pobre y buena congelabilidad, en los cuales también se evaluó la integridad estructural de la membrana plasmática mediante las sondas SYBR-14 / IP
Son escasos los estudios de suplementación con quercetina en el semen equino. La evaluación de quercetina (0,15 mM) en la criopreservación y el sexaje de semen equino, sobre diferentes parámetros de calidad seminal, demostró un incremento cercano al 5% en la movilidad espermática post-descongelación, al igual que efectos favorables sobre la integridad del ADN y la habilidad de unión de los espermatozoides a la zona pelúcida (Gibb et al. 2013). Otros trabajos con el uso de quercetina en semen de especies como carneros y humanos, han encontrado efectos como la reducción del potencial de membrana mitocondrial, la movilidad y la vitalidad (Khanduja et al. 2001; Silva et al. 2012). En la presente investigación, la quercetina generó una reducción sobre todos los parámetros de movilidad evaluados (Tabla 1) e incluso sobre aquellos relacionados con la integridad de los espermatozoides, a excepción de la morfología normal y la integridad del acrosoma (Figura 1). Esto podría ser generado por un efecto pro-oxidante observado cuando se utiliza la quercetina y otros flavonoides en diferentes sistemas biológicos e incluso para otros antioxidantes como la vitamina C y la vitamina E en condiciones in vitro. Dicha actividad pro-oxidante es dependiente de la concentración y de las condiciones de reacción que, para el caso de los flavonoides, corresponden a sistemas de reacción Fenton que involucran radicales superóxido o peróxido de hidrógeno (Johnson y Loo 2000; Kessler y Ubeaud 2003). Adicionalmente en semen humano, la inhibición de la movilidad y la vitalidad por efecto de la quercetina, se ha vinculado al descenso de la actividad Ca2+-ATPasa (Khanduja et al. 2001). Los coeficientes de correlación negativos hallados para la CAT con MP, VCL, VAP y HA, de igual forma indicarían una relación inversa entre dichos parámetros, como producto de la suplementación con ergotioneina y quercetina.
Una diferencia importante entre los estudios de suplementación de semen con quercetina y ergotioneina, reside en la amplia variación en las concentraciones utilizadas. Ello muestra la necesidad de implementar investigaciones en las que se aborde el análisis del efecto de diferentes concentraciones de estas moléculas sobre el estado redox y la capacidad antioxidante del semen equino.
CONCLUSIONES
La ergotioneina y la quercetina incrementan la capacidad antioxidante total del semen equino sometido a criopreservación. La ergotioneina genera un incremento postdescongelación en la movilidad total de los espermatozoides equinos; sin embargo, a las concentraciones utilizadas en el estudio, ambos antioxidantes producen una reducción en la movilidad progresiva y la cinética espermática. De otro lado, la quercetina tiene un efecto deletéreo post-descongelación sobre la integridad estructural y funcional de la membrana plasmática de los espermatozoides equinos.
REFERENCIAS
Afanas'ev I, Dcrozhko A, Brodskii A, Kostyuk V, Potapovitch A. 1989. Chelating and free radical scavenging mechanisms of inhibitory action of rutin and quercetin in lipid peroxidation. Biochem Pharmacol. 38:1763-1769.
Agarwal A, Makker K, Sharma R. 2008. Clinical relevance of oxidative stress in male factor infertility: an update. Am J Reprod Immunol. 59:2-11.
Aitken R. 2006. sperm function test and fertility. Int J Androl, 9:69-75.
Akanmu D, Cecchini R, Aruoma O, Halliwell B. 1991. The antioxidant action of ergothioneine. Arch Biochem Biophys. 288:10-16.
Ángel D, Bran J. 2010. Reproducción asistida en equinos: nuevos aportes desde la teoría. Rev Ces Med Vet Zootec. 5:56-69.
Ari U, Kulaksiz R, Ozturcler Y, Yidiz S, Lehim-cioglu N. 2012. Effect of L (+) ergothioneine on freezability of ram semen. Int J Anim Vet Adv. 4:378-383.
Arts M, Dallinga S, Voss H, Haenen G, Bast A. 2004. A new approach to assess the total antioxidant capacity using the TEAC assay. Food Chem. 88:567-570.
Asmus K, Bensasson R, Bernier J, Houssin R, Land E. 1996. One-electron oxidation of ergothioneine and analogues investigated by pulse radiolysis: redox reaction involving ergothioneine and vitamin. Biochem J. 315: 625-629.
Barros L, Silva S, Almeida F, Silva E, Carneiro G, Guerra M. 2012. Effect of addition of acetyl-cysteine and glutathione peroxidase in freezing extender of stallion semen. J Equine Vet Sci. 32:475-518.
Barth A, Oko R. 1989. Anormal morfology of bovine spermatozoa. 1 ed. Iowa: Iowa state University Press. 285p.
Bustamante I, Pederzolli C, Sgaravatti A, Gregory R, Dutra C, Jobim M. 2009. Skim milk-egg yolk based semen extender compensates for non-enzymatic antioxidant activity loss during equine semen cryopreservation. Anim Reprod. 6(2):392-399.
Chi H, Kim J, Ryu C, Lee J, Park J, Chung D, Choi S, Kim M, Chun E, Roh S. 2008. Protective effect of antioxidant supplementation in sperm-preparation medium against oxidative stress in human spermatozoa. Hum Reprod. 23(5):1023-1028.
Cocchia N, Pasolinia M, Mancini R, Petrazzuolo O, Cristofaro I, Rospane I, Sica A, Tortora G, Lorizio R, Paraggio G, Mancini A. 2011. Effect of sod (superoxide dismutase) protein supplementation in semen extenders on motility, viability, acrosome status and ERK (extracellular signal-regulated kinase) protein phosphorylation of chilled stallion spermatozoa. Theriogenology. 75:1201-1210.
Coutinho M, Ferreira H, Johnson A. 2008. Effects of Tempol and L-Ergothioneine on motility parameters of cryopreserved stallion sperm. Anim Reprod Sci. 107:317-318.
Çoyan K, Baspinar N, Numan MB, Peker PA. 2011. Effects of cysteine and ergothioneine on post-thawed merino ram sperm and biochemical parameters. Cryobiology. 63:1-6.
Dahl T, Midden W, Hartman P 1988. Some prevalent biomolecules as defenses against singlet oxygen damage. Photochem Photobiol. 47: 357-362.
Gamboa S, Rodrigues A, Henriques L, Batista C, Ramalho-Santos J. 2010. Seasonal functional relevance of sperm characteristics in equine spermatozoa. Theriogenology. 73:950-958.
Gibb Z, Butler T, Morris L, Maxwell W, Grupen C. 2013. Quercetin improves the postthaw characteristics of cryopreserved sex-sorted and nonsorted stallion sperm. Theriogenology. 79 :1001-1009.
Ghiselli A, Serafini M, Natella F, Scaccini C. 2000. Total antioxidant capacity as a tool to assess redox status: critical view and experimental data. Free Rad Biol Med. 29:1106-1114.
Hartman P. 1990. Ergothioneine as antioxidant. Methods Enzymol. 186:310-318.
Johnson M, Loo G. 2000. Effects of epigallocatechin gallate and quercetin on oxidative damage to cellular DNA. Mutat Res. 459:211-218.
Kaneko I, Takeuchi Y, Yamaoka Y, Tanaka Y, Fukuda T, Fukumori Y, Mayumi T, Hama T. 1980. Quantitative determination of ergothioneine in plasma and tissues by TLC-densitometry. Chem Pharm Bull. 28:3093-3097.
Kessler M, Ubeaud G. 2003. Anti- and pro-oxidant activity of rutin and quercetin derivatives. J Pharm Pharmacol. 55:131-142.
Khanduja K, Verma A, Bhardwa A. 2001. Impairment of human sperm motility and viability by quercetin is independent of lipid peroxidation. Andrologia. 33: 277-281.
Kirk E, Squires E, Graham J. 2005. Comparison of in vitro laboratory analyses with the fertility of cryopreserved stallion spermatozoa. Therio-genology. 64:1422-1439.
Lançoni R, Celeghini E, Bianchi-Alves M, Santos G, Florez-Rodriguez S, Leite T, Arruda R. 2015. Use of melatonin and ferulic acid as promoters of cryopreserved equine sperm. Anim Reprod. 12:559.
Lisboa F, Hartwig F, Maziero R, Monteiro G, Papa F, Dell'aqua J. 2012. Use of L-carnitine and acetyl-L-carnitine in cooled-stored stallion semen. J Equine Vet Sci. 32:475-518.
Macías-García B, González L, Ortega-Ferrusola C, Salazar-Sandoval C, Morillo-Rodríguez A, Rodríguez-Martinez H. 2011. Membrane lipids of the stallion spermatozoon in relation to sperm quality and susceptibility to lipid peroxidation. Reprod Domest Anim. 46:141-8.
Mann T, Lutwak-Mann C. 1981. Male reproductive function and semen. En: Physiology of Mammals and Other Vertebrates. Berlin: Springer-Verlag. 495p.
McNiven M, Richardson G. 2006. Effect of quercetin on capacitation status and lipid peroxidation of stallion spermatozoa. Cell Preservation Technology. 4:169-177.
Metcalf E, Dideon B, Blehr R, Schlimgen T, Bertrand W, Varner D, Teague S, Hausman M. 2008. Effects of DMSO and L-Ergothioneine on post-thaw semen parameters in stallions: preliminary results. Anim Reprod Sci. 107:332-333.
Moore A, Squires E, Graham J. 2005. Effect of seminal plasma on the cryopreservation of equine spermatozoa. Theriogenology. 63:2372-2381.
Morte M, Rodrigues A, Soares D, Rodrigues A, Gamboa S, Ramalho-Santos J. 2008. The quantification of lipid and protein oxidation in stallion spermatozoa and seminal plasma: Seasonal distinctions and correlations with DNA strand breaks, classical seminal parameters and stallion fertility. Anim Reprod Sci. 106: 36-47.
Najafi A, Daghigh H, Mohammadi H, Najafib H, Zanganehb Z, Sharafib M, Martinez F, Adeldust H. 2014. Different concentrations of cysteamine and ergothioneine improve microscopic and oxidative parameters in ram semen frozen with a soybean lecithin extender. Cryobiology. 69:68-73.
Neild D, Chaves G, Flores M, Mora N, Beconi M, Agiiero A. 1999. Hypoosmotic test in equine spermatozoa. Theriogenology. 51:721-727.
Neira J, Ramirez G, Leon-Garcia S, Moreno Garcia D. 2007. Efecto de la asociación de la L-Glutamina -Etilenglicol en criopreservación de semen equino. Revista de Medicina Veterinaria. 14:93-105.
Nouri H, Armin T, Zhandi M, Sadegui R. 2013. The effects of centrifuged egg yolk used with INRA plus soybean lecithin extender on semen quality to freeze miniature caspian horse semen. J Equine Vet Sci. 33:1050-1053.
Ortega-Ferrusola C, González-Fernández L, Morrell J, Salazar-Sandoval C, Macías-García B, Rodríguez-Martinez H. 2009. Lipid peroxidation, assessed with BODIPY-C11, increases after cryopreservation of stallion spermatozoa, is stallion-dependent and is related to apoptotic-like changes. Reproduction. 138:55-63.
Rathi R, Colembrander B, Bevers M, Gadella B. 2001. Evaluation of in vitro capacitation of stallion spermatozoa. Biol Reprod. 65:462-470.
Restrepo G, Ocampo D, Velásquez A. 2013. Evaluación de la movilidad del semen criopreservado de caballos criollo colombiano por un Sistema analizador de clase. Revista UDCA Actualidad & Divulgación Científica. 16:445-450.
Rojano B, Mesa-Vanegas A, Gaviria C, Cardona F, Sáez-Veja J, Blair-Trujillo S. 2010. Actividad antioxidante y contenido de fenoles totales de algunas especies del género Calophyllum. Revista Cubana de Plantas Medicinales. 15:13-26.
Silva E, Cajueiro J, Silva S, Soares P, Guerra M. 2012. Effect of antioxidants resveratrol and quercetin on in vitro evaluation of frozen ram sperm. Theriogenology. 77:1722-1726.
Tatone C, Di Emidio G, Vento M, Ciriminna R, Artini P. 2010. Cryopreservation and oxidative stress in reproductive cells. Gynecol Endocrinol. 26:563-567.
Tepwong P, Giri A, Sasaki F, Fukui R, Ohshima T. 2012. Mycobial enhancement of ergothioneine by submerged cultivation of edible mushroom mycelia and its application as an antioxidative compound. 131: 247-258.
Thomas A, Meyers S, Ball B. 2006. Capacitation-like changes in equine spermatozoa following cryopreservation. Theriogenology. 65:1531-1550.
Waheed M, El-Bahr S, Al-haider A. 2013. Influence of seminal plasma antioxidants and osteopontin on fertility of the Arabian horse. J Equine Vet Sci. 33:705-709.
Wnuk M, Lewinska B, Oklejewicz G, Bartosz M, Tischner M, Bugno-Poniewierska M. 2010. Redox status of equine seminal plasma reflects the pattern and magnitude of DNA damage in sperm cells. Theriogenology. 74:1677-1684.
Yeste M, Estrada E, Rocha L, Marín H, Rodríguez-Gil J, Miró J. 2014. Cryotolerance of stallion spermatozoa is related to ROS production and mitochondrial membrane potential rather than to the integrity of sperm nucleus. Andrology 3:395-407.
Yildiz S, Daşkin A. 2004. Koç spermasinin farkli antioksidanlar iteren sulandiricilarla kisa süreli saklanmasi. Kafkas Univ Vet Fak. 10:155-159.
Yildiz S, Öztürkler Y, Ari U, Lehimcioğlu N, Atakişi E, Kulaksiz R. 2015. The effects of L-ergothioneine, N-acetylcystein and cystein on freezing of ram semen. Kafkas Univ Vet Fak Derg. 21:81-86.
Article citation:
Restrepo G, Montoya JD, Rojano B. Capacidad antioxidante y calidad post-descongelacion del semen equino criopreservado con quercetina y ergotioneina. [Antioxidant capacity and post-thaw quality of stallion semen cryopreserved with quercetin and ergothioneine]. Rev Med Vet Zoot. 63(3): 167-178. Doi: 10.15446/rfmvz.v63n3.62747.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
CrossRef Cited-by
1. Fernanda Pilaquinga, Jeroni Morey, Lenys Fernandez, Patricio Espinoza-Montero, Mauricio Moncada-Basualto, Josue Pozo-Martinez, Claudio Olea-Azar, Rafael Bosch, Lorena Meneses, Alexis Debut, María de las Nieves Piña. (2021). Determination of Antioxidant Activity by Oxygen Radical Absorbance Capacity (ORAC-FL), Cellular Antioxidant Activity (CAA), Electrochemical and Microbiological Analyses of Silver Nanoparticles Using the Aqueous Leaf Extract of Solanum mammosum L.. International Journal of Nanomedicine, Volume 16, p.5879. https://doi.org/10.2147/IJN.S302935.
Dimensions
PlumX
Article abstract page views
Downloads
License
Copyright (c) 2016 Giovanni Restrepo, Juan David Montoya, Benjamín Rojano

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
This article is published under the terms of the Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
The authors retain copyright of their work and grant the journal the right of first publication.
Readers are free to copy and redistribute the material in any medium or format under the license terms, provided proper attribution is given, the work is not used for commercial purposes, and no modifications or derivatives are made.