Costos e impacto económico del síndrome de apnea-hipopnea obstructiva del sueño (SAHOS) para la salud pública
Cost and economic impact of obstructive sleep apnea-hypopnea syndrome (OSAHS) on public health
DOI:
https://doi.org/10.15446/revfacmed.v65n1Sup.59570Palabras clave:
Apnea obstructiva del sueño, Economía, Costo de enfermedad, Sistemas de salud, Accidentes. (es)Sleep Apnea, Obstructive, Economics, Cost of Illness, Health Care Systems, Accidents. (en)
El síndrome de apnea-hipopnea obstructiva del sueño (SAHOS) no tratado se asocia con costos directos e indirectos significativos. Este trastorno también tiene un impacto negativo sobre el desempeño y la seguridad laboral y está implicado en una proporción considerable de accidentes automovilísticos. El diagnóstico oportuno y la terapia óptima han mostrado disminución en la utilización de los sistemas de salud y en los costos, al tiempo que atenúan los riesgos adversos. Del mismo modo, el SAHOS no tratado se asocia con incremento en las tasas de desempleo. Para los profesionales de la salud, tener un paciente con SAHOS involucrado en una colisión automovilística es de crucial importancia debido al daño personal y público, así como la potencial discapacidad física por el accidente. En Latinoamérica se requiere de la medición de los costos directos e indirectos dado el problema de salud pública que tiene asociado el SAHOS y las implicaciones mencionadas.
Untreated obstructive sleep apnea-hypopnea syndrome (OSAHS) is associated with significant direct and indirect medical costs. This disorder also has a significant negative impact on work performance and safety, and is implicated in a substantial proportion of motor vehicular crashes. Timely diagnosis and optimal therapy have shown a lower utilization rate related to health care systems and reduced costs, while adverse risks are mitigated at the same time.
Prompt diagnosis and optimal therapy have shown to decrease heath care utilizaton and costs, as well as mitigating these adverse risks.
Similarly, untreated OSAHS is associated with higher unemployment rates. For health care professionals, having a patient with OSAHS involved in a MVC is of paramount importance for a several reasons, including personal and public damage, as well as the potential physical disability that may be caused by the accident. In Latin America, measuring direct and indirect costs is necessary considering the public health problem associated with OSAHS and the implications mentioned above.
artículo de reflexión
DOI: https://doi.org/10.15446/revfacmed.v65n1Sup.59570
Costos e impacto económico del síndrome de apnea-hipopnea obstructiva del sueño (SAHOS) para la salud pública
Cost and economic impact of obstructive sleep apnea-hypopnea syndrome (OSAHS) on public health
Recibido: 19/09/2016. Aceptado: 12/05/2017.
David Ingram1 • Teofilo Lee-Chiong1 • Darío Londoño2
1 University of Colorado - School of Medicine and National Jewish Health - Denver - Colorado - USA.
2 Fundación Santa Fe de Bogotá - Departamento de Medicina Interna - Sección de Neumología - Bogotá D.C. - Colombia.
Correspondencia: Dario Londoño. Fundación Santafé de Bogotá. Carrera 7B No. 123-90. Bogota D.C. Colombia.
Correo electrónico: dario.londono@fsfb.org.co.
| Resumen |
El síndrome de apnea-hipopnea obstructiva del sueño (SAHOS) no tratado se asocia con costos directos e indirectos significativos. Este trastorno también tiene un impacto negativo sobre el desempeño y la seguridad laboral y está implicado en una proporción considerable de accidentes automovilísticos. El diagnóstico oportuno y la terapia óptima han mostrado disminución en la utilización de los sistemas de salud y en los costos, al tiempo que atenúan los riesgos adversos. Del mismo modo, el SAHOS no tratado se asocia con incremento en las tasas de desempleo. Para los profesionales de la salud, tener un paciente con SAHOS involucrado en una colisión automovilística es de crucial importancia debido al daño personal y público, así como la potencial discapacidad física por el accidente. En Latinoamérica se requiere de la medición de los costos directos e indirectos dado el problema de salud pública que tiene asociado el SAHOS y las implicaciones mencionadas.
Palabras clave: Apnea obstructiva del sueño; Economía; Costo de enfermedad; Sistemas de salud; Accidentes (DeCS).
Ingram D, Lee-Chiong T, Londoño D. Costos e impacto económico del síndrome de apnea-hipopnea obstructiva del sueño (SAHOS) para la salud pública. Rev. Fac. Med. 2017;65:S141-7. Spanish. doi:
https://doi.org/10.15446/revfacmed.v65n1Sup.59570.
| Abstract |
Untreated obstructive sleep apnea-hypopnea syndrome (OSAHS) is associated with significant direct and indirect medical costs. This disorder also has a significant negative impact on work performance and safety, and is implicated in a substantial proportion of motor vehicular crashes. Timely diagnosis and optimal therapy have shown a lower utilization rate related to health care systems and reduced costs, while adverse risks are mitigated at the same time.
Prompt diagnosis and optimal therapy have shown to decrease heath care utilizaton and costs, as well as mitigating these adverse risks.
Similarly, untreated OSAHS is associated with higher unemployment rates. For health care professionals, having a patient with OSAHS involved in a MVC is of paramount importance for a several reasons, including personal and public damage, as well as the potential physical disability that may be caused by the accident. In Latin America, measuring direct and indirect costs is necessary considering the public health problem associated with OSAHS and the implications mentioned above.
Keywords: Sleep Apnea, Obstructive; Economics; Cost of Illness; Health Care Systems; Accidents (MeSH).
Ingram D, Lee-Chiong T, Londoño D. [Cost and economic impact of obstructive sleep apnea-hypopnea syndrome (OSAHS) on public health]. Rev. Fac. Med. 2017;65:S141-7. Spanish. doi:
https://doi.org/10.15446/revfacmed.v65n1Sup.59570.
Introducción
El síndrome de apnea-hipopnea obstructiva del sueño (SAHOS) es un trastorno común asociado con efectos deletéreos en la salud. Los estimados de la prevalencia de este síndrome varían dependiendo de la población evaluada y la definición escogida, p. ej., si se utiliza la definición rigurosa de SAHOS moderado y severo, se encuentra una prevalencia estimada en adultos cercana al 13% en hombres y al 6% en mujeres (1). Además, el SAHOS no tratado puede contribuir de forma significativa a la morbimortalidad al incluir hipertensión arterial, evento cerebrovascular, depresión, deterioro cognitivo y muerte de cualquier causa (2-5).
Mientras las consecuencias del SAHOS en la salud son de gran importancia, el trastorno también está asociado con incremento en la carga socioeconómica y mayores costos en el sistema de salud. Asimismo, la somnolencia diurna y el déficit neurocognitivo presentes en las personas con SAHOS pueden, de manera secundaria, llevar a un riesgo incrementado de accidentes automovilísticos. El objetivo de esta revisión es destacar los costos directos en el sistema de salud, así como los costos indirectos relacionados a la productividad laboral y a los accidentes y colisiones vehiculares asociadas con el SAHOS no tratado.
Desarrollo
Costos en el sistema de salud
Costos de SAHOS no tratado
Debido a los efectos adversos sobre la salud, parece razonable plantear la hipótesis de que el SAHOS no tratado podría incrementar de forma sustancial los costos en el sistema de salud. Kryger et al. (6) encontraron que los pacientes obesos con SAHOS, en comparación con aquellos sin SAHOS, tenían tasas más altas de hospitalización (251 vs. 91 noches) y de utilización del sistema de salud. Estos hallazgos fueron confirmados y suplementados por Kapur et al. (7), quienes compararon los costos médicos de pacientes con y sin SAHOS.
En el año previo al diagnóstico, en los pacientes con SAHOS se encontró que presentaban costos médicos cercanos al doble comparados con los controles apareados por edad y sexo (USD 2 720 vs. USD 1 384), dando como estimado un costo anual de USD 1 336 para el SAHOS no tratado. El estudio de Kapur et al. (7) demostró un efecto independiente de la carga de enfermedad crónica y la obesidad; además, estos investigadores demostraron una relación curvilinear entre el índice de apnea hipopnea (IAH) y los costos médicos, con un efecto linear en severidad baja a moderada y un efecto techo evidente en los casos más severos. Estudios posteriores han confirmado el incremento en la utilización de los servicios de salud y los costos asociados con el SAHOS no tratado (8-11), lo cual parece, en gran parte, relacionado con la hipertensión asociada y otras enfermedades cardiovasculares (9).
Adicional a los costos directos discutidos con anterioridad, también existe evidencia de costos indirectos substanciales asociados con el SAHOS no tratado. Los costos indirectos se refieren a las pérdidas estimadas en productividad debidas a la enfermedad. Jennum & Kjellberg (12) evaluaron los costos totales e indirectos asociados con el ronquido, el SAHOS y el síndrome de hipoventilación y obesidad y los compararon con una muestra aleatoria poblacional controlada por estatus socioeconómico en Dinamarca. Así como en estudios previos, estos autores encontraron que el SAHOS no tratado estaba asociado con costos médicos directos incrementados y con tasas de desempleo incrementado. Entre los empleados, el ingreso laboral fue de solo dos tercios respecto al de los controles. Estos hallazgos fueron confirmados en un estudio más reciente, que también demostró incremento en los costos indirectos para las parejas de los pacientes con SAHOS (13).
Costo de las estrategias diagnósticas en SAHOS
Mientras la historia clínica y el examen físico pueden identificar pacientes con riesgo de SAHOS, solo un estudio de sueño formal puede confirmar el diagnóstico definitivo. En la actualidad, el estudio de sueño para SAHOS puede ser realizado en el laboratorio de sueño con un polisomnograma (PSG) o en el domicilio con un estudio ambulatorio. Por lo general, se realiza un PSG de noche dividida en el laboratorio, en el cual en la segunda mitad del estudio se utiliza titulación de presión positiva en vía aérea (PAP) si se identifica SAHOS durante la primera mitad del estudio.
Debido a que el estudio domiciliario no monitoriza las etapas de sueño, este puede subestimar la frecuencia de eventos respiratorios durante el sueño, lo cual lleva a resultados falsos negativos. Por esta razón, los estudios domiciliarios son, por lo general, reservados para pacientes con una probabilidad elevada pretest de SAHOS moderado a severo. De igual forma, los estudios domiciliarios no son apropiados para pacientes con comorbilidades médicas significativas —pulmonar, cardíaca o neurológica— o para aquellos con sospecha de trastornos del sueño diferentes a SAHOS (14).
El New England Comparative Effectiveness Public Advisory Council comparó los costos directos para las diferentes estrategias diagnósticas para SAHOS basados en 1 000 pacientes hipotéticos del Medicaid. Los autores compararon: a) PSG en laboratorio de sueño, b) pacientes tamizados positivos con el Cuestionario de Berlín que van a PSG, c) evaluación antropométrica positiva que va a PSG y d) estudio domiciliario. Se reportaron los siguientes costos para el estudio de sueño: PSG: USD 652.83, cuestionario+PSG USD 518.06, antropométrico+PSG USD 674.62 y domiciliario USD 200.70 (15). El estudio domiciliario con terapia de presión positiva sobre la vía aérea autoajustable (APAP) cuesta menos (USD 811.12) que el PSG en laboratorio con titulación posterior de PAP (USD 1 244.9) o domiciliario con titulación posterior (USD 1 112.73).
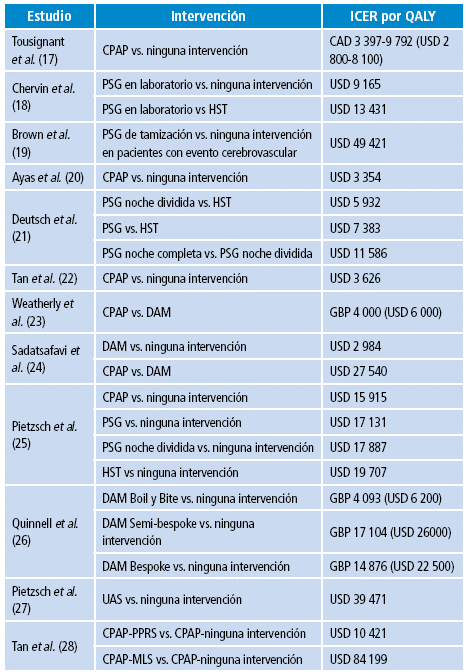
El costo-efectividad relativo de las diferentes estrategias diagnósticas y terapéuticas es más importante que los costos absolutos. Una forma de medición utilizada para calcular directa y objetivamente el costo-efectividad de las estrategias clínicas es la tasa incremental de costo efectividad (ICER), el cual es el costo por el QALY (años de vida ajustados por calidad, por su sigla en inglés) ganado. El uso del ICER puede cuantificar mejor el verdadero valor adicionado de las intervenciones y permite realizar comparaciones entre las modalidades terapéuticas. Como referencia, en EE. UU., un umbral arbitrario relativo de ICER de USD 50 000 por QALY ganado es mandatorio, así que tratamientos que cuestan menos que esta cantidad se consideran costo-efectivos (16). En la Tabla 1 se muestra el costo-efectividad del diagnóstico y tratamiento del SAHOS.
Tabla 1. Estudios que evalúan el costo por años de vida ajustados por calidad para el diagnóstico y tratamiento del síndrome de apnea-hipopnea obstructiva del sueño.
|
Estudio |
Intervención |
ICER por QALY |
|
Tousignant |
CPAP vs. ninguna intervención |
CAD 3 397-9 792 (USD 2 800-8 100) |
|
Chervin et al. (18) |
PSG en laboratorio vs. ninguna intervención |
USD 9 165 |
|
PSG en laboratorio vs HST |
USD 13 431 |
|
|
Brown et al. (19) |
PSG de tamización vs. ninguna intervención en pacientes con evento cerebrovascular |
USD 49 421 |
|
Ayas et al. (20) |
CPAP vs. ninguna intervención |
USD 3 354 |
|
Deutsch et al. (21) |
PSG noche dividida vs. HST |
USD 5 932 |
|
PSG vs. HST |
USD 7 383 |
|
|
PSG noche completa vs. PSG noche dividida |
USD 11 586 |
|
|
Tan et al. (22) |
CPAP vs. ninguna intervención |
USD 3 626 |
|
Weatherly et al. (23) |
CPAP vs. DAM |
GBP 4 000 (USD 6 000) |
|
Sadatsafavi et al. (24) |
DAM vs. ninguna intervención |
USD 2 984 |
|
CPAP vs. DAM |
USD 27 540 |
|
|
Pietzsch et al. (25) |
CPAP vs. ninguna intervención |
USD 15 915 |
|
PSG vs. ninguna intervención |
USD 17 131 |
|
|
PSG noche dividida vs. ninguna intervención |
USD 17 887 |
|
|
HST vs ninguna intervención |
USD 19 707 |
|
|
Quinnell et al. (26) |
DAM Boil y Bite vs. ninguna intervención |
GBP 4 093 (USD 6 200) |
|
DAM Semi-bespoke vs. ninguna intervención |
GBP 17 104 (USD 26000) |
|
|
DAM Bespoke vs. ninguna intervención |
GBP 14 876 (USD 22 500) |
|
|
Pietzsch et al. (27) |
UAS vs. ninguna intervención |
USD 39 471 |
|
Tan et al. (28) |
CPAP-PPRS vs. CPAP-ninguna intervención |
USD 10 421 |
|
CPAP-MLS vs. CPAP-ninguna intervención |
USD 84 199 |
Nota: las figuras arriba de ICER/QALY comparan la intervención listada inicialmente versus la intervención listada al final.
ICER: tasa incremental de costo-efectividad; QALY: años de vida ajustados por calidad; CPAP: presión positiva continua en la vía aérea; DAM: dispositivo de avance mandibular; PSG: polisomnograma; HST: estudio de sueño en casa; UAS: estimulación de la vía aérea superior; cpap-pprs/mls: cpap seguido por cirugía reconstructiva palatofaríngea o cirugía multinivel para aquellos pacientes intolerantes de CPAP.
Fuente: Elaboración propia.
Deutsch et al. (21) examinaron el costo-efectividad del estudio domiciliario, el PSG de noche dividida y el de noche completa y encontraron un costo-efectividad ligeramente mayor para el domiciliario, aunque mayores tasas de abandonos de uso del PAP. Sin embargo, los autores notaron que el ahorro a largo plazo de la alternativa del domiciliario se debía en su mayoría a menos pacientes con SAHOS que recibían terapia PAP; el costo de esta última durante un periodo de cinco años es mayor que el del diagnóstico inicial.
Pietzsch et al. (25) realizaron un análisis similar de las mismas tres estrategias diagnósticas en pacientes con sospecha de SAHOS moderado a severo y encontraron que el PSG de noche completa seguido de titulación de PAP fue la estrategia más costo-efectiva a largo plazo; principalmente, debido a la precisión diagnóstica, comparada con los otros dos métodos (25). En contraste, el ensayo aleatorizado controlado homePAP encontró que los pacientes llevados a estudio domiciliario con APAP tenían menores costos diagnósticos iniciales y mayor adherencia comparada con aquellos que se llevaban a estudio diagnóstico y de titulación en el laboratorio (29).
Teniendo en cuenta estos dos últimos estudios, la evidencia disponible es algo contradictoria acerca de cuál estrategia es la más costo-efectiva para diagnosticar SAHOS. Los resultados sugieren que en el PSG de laboratorio ciertos costos son más altos en principio, pero que su precisión diagnóstica puede resultar en un significativo ahorro de costos a largo plazo, comparado con el domiciliario. Es probable que la estrategia diagnóstica óptima dependa de la población específica a ser tratada y de los recursos médicos disponibles (30).
Costo de las terapias para SAHOS
Por lo general, el tratamiento de primera línea para SAHOS es la PAP. Varios estudios han demostrado el costo-efectividad del CPAP, comparado con dejar al paciente sin tratamiento, entre los pacientes con SAHOS moderado a severo (22,31), enfermedad cardiovascular (32) y diabetes tipo 2 (33). El costo por QALY ganado ha mostrado ser favorable y ser costo-efectivo después de dos años de tratamiento (20,24,31).
Los dispositivos orales son más utilizados en el tratamiento para el SAHOS, en especial en aquellos pacientes que no toleran la terapia PAP. Comparados con dejar al paciente sin tratamiento, los dispositivos orales han mostrado ser costo-efectivos; no obstante, la terapia PAP provee beneficio adicional en costo-efectividad cuando se comparan directamente con los dispositivos orales (24). Weatherly et al. (23) compararon los dispositivos orales, la terapia PAP y las recomendaciones en el estilo de vida y encontraron que la segunda fue la más costo-efectiva.
Varios abordajes quirúrgicos también se encuentran entre las opciones terapéuticas para el SAHOS. La estimulación de la vía aérea superior (VAS) es una nueva modalidad en el arsenal terapéutico para el SAHOS (34). Pietzsch et al. (27) analizan los datos de un ensayo clínico aleatorizado y encuentran que la estimulación de la VAS fue la alternativa más costo-efectiva. Tan et al. (28) encontraron que la cirugía palatofaríngea es más costo-efectiva que la cirugía multinivel en pacientes intolerantes a la terapia PAP.
Accidentes y errores laborales
La somnolencia diurna excesiva (SDE) es una de las quejas más comunes de los pacientes con SAHOS que no solo afecta a la persona y su funcionamiento social, sino que también impacta de forma negativa su desempeño laboral. Ulfberg et al. (35) demostraron, hace casi dos décadas, que el ronquido primario y el SAHOS franco están asociados con SDE y problemas subjetivos de desempeño laboral. La magnitud del efecto era sustancial en los roncadores primarios con 20 veces más riesgo y en los pacientes con SAHOS 40 veces más riesgo de SDE en el sitio de trabajo. Los pacientes con SAHOS también tenían 20 veces más riesgo de dificultades en el desarrollo de habilidades laborales.
Mulgrew et al. (36) examinaron con más detalle el impacto del SAHOS en la función laboral. Al evaluar una muestra de más de 400 pacientes remitidos por sospecha de SAHOS, los autores no encontraron relación entre la severidad de este y las múltiples dimensiones de la limitación laboral. Sin embargo, entre los trabajadores industriales hubo efectos deletéreos significativos del SAHOS sobre el manejo del tiempo y las interacciones personales. La SDE estuvo fuertemente relacionada con dominios múltiples de funcionamiento laboral.
En un seguimiento de pacientes tratados con terapia PAP, se demostraron mejoras significativas en el manejo del tiempo, relaciones interpersonales y el desenlace laboral. Los efectos negativos del SAHOS y de la SDE sobre la función laboral y la discapacidad laboral fueron replicados por Omachi et al. (37); en contraste con los hallazgos de Mulgrew et al. (36), ellos demostraron una asociación independiente entre SAHOS y discapacidad laboral independiente de la SDE.
La posible asociación entre SAHOS y accidentes laborales ha sido estudiada y se ha demostrado una relación entre el ronquido con somnolencia diurna y los accidentes laborales, aunque no hubo un diagnóstico formal de SAHOS con PSG (38). Estos hallazgos también fueron evidentes en un estudio de granjeros en Kentucky, en quienes los síntomas de SAHOS fueron relacionados con riesgo incrementado de lesión (39). Así, la evidencia disponible demuestra una asociación entre el ronquido y otros síntomas autoreportados de SAHOS y los accidentes laborales.
Los investigadores también han examinado la relación entre el SAHOS definido por PSG y los accidentes laborales. Jurado-Gamez et al. (40) realizaron un estudio de casos y controles comparando pacientes con SAHOS versus pacientes sin SAHOS y demostraron más incapacidades y menor productividad laboral en el primer grupo. No obstante, no encontraron relación entre las medidas de severidad del SAHOS y los accidentes laborales: 27% en SAHOS vs. 25% en el grupo control. Los autores concluyeron que mientras el SAHOS parece estar asociado con limitaciones en la productividad laboral y más incapacidades, este no se asoció con accidentes laborales. Este hallazgo negativo también fue reportado por Hägg et al. (41) en población femenina escandinava.
Accidentes automovilísticos
Las colisiones automovilísticas (CAM) tienen una morbimortalidad considerable (42). Para los profesionales de la salud, tener un paciente con SAHOS involucrado en una CAM es de crucial importancia, debido a varias razones que incluyen el daño personal y público, así como la potencial discapacidad física. Entender la incidencia y los factores de riesgo para una CAM en el escenario del SAHOS es fundamental.
La evidencia que apoya la asociación entre el SAHOS y las CAM es robusta y fue revisada hace poco por Ellen et al. (43), quienes identificaron 30 estudios que examinaron el riesgo de CAM en los pacientes con SAHOS. Así, se muestra un riesgo incrementado de CAM entre los conductores no comerciales, los estudios de los registros de las aseguradoras, las CAM autoreportadas y el desempeño en el simulador de conducción. Para ponerlo en perspectiva, la tasa de colisiones en pacientes con SAHOS es comparable con aquella de las personas con demencia moderada-severa o con niveles sanguíneos de alcohol entre 0.05 y 0.70 mg/dL.
Los estudios que incluyen conductores comerciales también soportan ampliamente una asociación significativa, aunque la magnitud del efecto es menor. Datos sobre la relación entre la severidad del SAHOS y el riesgo de accidentes son inconsistentes. De este modo, 11 estudios evaluaron el efecto de la terapia PAP sobre las CAM y encontraron una reducción en la tasa de accidentes con el tratamiento. Hallazgos similares fueron demostrados con la cirugía palatofaríngea como tratamiento.
Dado el riesgo incrementado de las CAM asociado con el SAHOS, varios investigadores han intentado identificar los factores de riesgo para los accidentes. Arita et al. (44) realizaron un análisis multivariado de medidas objetivas y subjetivas de la severidad del SAHOS y encontraron que ambas puntuaciones en la Escala de Somnolencia de Epworth y la frecuencia reportada por el paciente de sentirse somnoliento mientras conduce o trabaja estaban relacionadas con las CAM. Medidas polisomnográficas de la severidad del SAHOS no permanecieron como predictores significativos en el modelo multivariado (44).
Teniendo en cuenta estos hallazgos, Karimi et al. (45) trataron de identificar marcadores de función cognitiva en los pacientes con SAHOS que predijeran las CAM y encontraron que la atención sostenida —determinada por una evaluación neurocognitiva— estaba asociada con CAM. Con las pruebas en los simuladores de conducción, el buen desempeño parece estar asociado con menor riesgo de CAM; sin embargo, el pobre desempeño no predice estos accidentes (46).
Dado su uso amplio en la medicina del sueño, la utilidad de la prueba de latencia múltiple del sueño y la prueba de mantenimiento de la vigilia en predecir el riesgo de CAM merecen atención especial. Los parámetros actuales de la American Academy of Sleep Medicine (AASM) sugieren que la prueba de mantenimiento de la vigilia tiene mayor validez de apariencia que la prueba de latencia múltiple del sueño en la evaluación de la habilidad individual de permanecer despierto en el contexto de la seguridad (47). Además, las guías sugieren que, en el escenario de datos empíricos limitados, el permanecer despierto durante una prueba de mantenimiento de la vigilia de 40 minutos indica la evidencia objetiva más fuerte de la habilidad de permanecer despierto. Valores entre 8 y 40 minutos son ambiguos y valores <8 minutos son anormales.
A propósito del estudio más informativo a la fecha en este tópico, Philip et al. (48) examinaron la relación entre las medidas objetivas y subjetivas de somnolencia y el desempeño en la conducción en la vida real en los pacientes con SAHOS. Los autores reportaron que ambas escalas —la de somnolencia y la puntuación en la prueba de mantenimiento de la vigilia— estaban relacionadas con el desempeño en la conducción. Latencias de sueño <34 minutos estuvieron asociadas con peor desempeño en la conducción con déficit igual entre los grupos de somnolientos (20-33 minutos) y muy somnolientos (0-19 minutos).
En un entorno simulado de conducción, la prueba de mantenimiento de la vigilia ha sido asociada con más fuerza al desempeño en la conducción que a la latencia de sueño en una prueba de latencia múltiple del sueño (49,50). Un protocolo más prolongado de 40 minutos de la prueba de mantenimiento de la vigilia ha mostrado ser más sensible en la detección de dificultades en la conducción, comparado con protocolos <20 minutos (51). En un estudio más reciente, que utiliza un simulador de conducción, los pacientes con SAHOS con una prueba anormal de mantenimiento de la vigilia tienen peor desempeño en la conducción (52) y este es peor con latencias <19 minutos. Reuniendo toda la información, la evidencia disponible apoya la utilización de la prueba de mantenimiento de la vigilia como una medida objetiva relacionada con el desempeño en la conducción y deterioro observado con latencias promedio de sueño <34 minutos.
En relación con el daño potencial, debido a las CAM asociadas con el SAHOS, está la posibilidad de responsabilidad del somnólogo. Hasta donde se sabe, Svider et al. (53) han realizado el único análisis de litigio de mala práctica relacionada con SAHOS y no reportan algún caso relacionado con conducción. La American Thoracic Society (ATS) ha publicado las guías de práctica clínica para conducción en los pacientes con SAHOS; sus recomendaciones incluyen: todos los pacientes con sospecha de SAHOS o confirmado deben ser evaluados por somnolencia diurna y advertidos del riesgo de conducir hasta que tengan terapia efectiva; el riesgo de conducir somnoliento debe ser reevaluado en los pacientes de alto riesgo; para pacientes de alto riesgo de conducir de forma somnolienta, la terapia debe ser iniciada en el mes siguiente a la evaluación inicial, pero no de forma empírica antes de un estudio polisomnográfico; y los medicamentos estimulantes no deben utilizarse con el objetivo de disminuir el riesgo al conducir.
Los requerimientos legales para los médicos, en cuanto al reporte de pacientes individuales con SAHOS, varía entre los países y entre los estados. Las guías ATS recomiendan que al menos los médicos deben notificar al departamento de vehículos motorizados si un paciente de muy alto riesgo —con somnolencia diurna severa y una CAM o casi una— continúa conduciendo, aun si el tratamiento no ha sido iniciado o es exitoso. Una investigación de la posición al respecto fue publicada hace poco por la Canadian Thoracic Society (54). Bonnie & George (55) han argumentado que una vez un clínico ha informado al paciente del riesgo asociado con su trastorno del sueño y sus opciones terapéuticas, los primeros ya no tienen mayor responsabilidad por la falla del paciente en reducir su riesgo.
Los conductores de vehículos motorizados comerciales (VMC) representan un caso especial con respecto a la tamización del SAHOS y el tratamiento, dada la mayor tasa de mortalidad ocupacional, el mayor tamaño de sus vehículos y la posibilidad de transportar materiales tóxicos o un gran número de pasajeros. Las guías para tamización de SAHOS en los operadores de VMC fueron diseñadas en un consenso del American College of Chest Physicians, el American College of Occupational and Environmental Medicine y la National Sleep Foundation (56). Otros países también han establecido las guías.
Las recomendaciones incluyen tamizar a los operadores de VMC utilizando la historia clínica y la evaluación física y realizar un estudio polisomnográfico cuando esté indicado. Los conductores son descalificados de forma temporal para conducir vehículos motorizados hasta que sea descartado el SAHOS por medio de PSG o sean tratados de manera adecuada. La adherencia a la terapia PAP —al menos cuatro horas/día— debe ser demostrada y los conductores pueden retornar a su trabajo una semana después de tratamiento si el IAH residual es menor a 5/hora mientras está con la terapia PAP.
Costos en Latinoamérica
En la medicina respiratoria, hace muchos años se inició el estudio de los sujetos en condiciones de reposo y en condiciones ideales, en los cuales se evalúa la función respiratoria mediante diferentes técnicas. En los últimos 25 años se consideró que era muy importante observar qué ocurría con estas condiciones respiratorias durante la actividad, el ejercicio y la aplicación de ciertos retos. A su vez, esto llevó a un desarrollo grande en la observación de las alteraciones del sujeto expuesto al estrés, como el ejercicio y otras pruebas, o en el caso de la exposición a la metacolina para detectar obstrucción bronquial.
En los últimos años se ha notado que los seres humanos pasan alrededor de 25 años durmiendo y que se pueden presentar algunas alteraciones ligadas al hecho de dormir, como, p. ej., el ronquido simple, el síndrome de resistencia aumentada de la vía aérea, la apnea obstructiva posicional y la dependiente del sueño REM (rapid eye movement), el SAHOS, la apnea central, la apnea mixta y la recientemente denominada apnea compleja. Esto muestra un espectro muy amplio de patología que ha llevado al desarrollo de la medicina del sueño y al estudio de todas las entidades descritas.
En Colombia, la prevalencia de los trastornos del sueño es del 27%, lo cual hace que se constituya en un problema de salud pública. Sin embargo, no se cuenta con datos exactos de la frecuencia de las enfermedades en el país (57). Si se extrapolan datos, es probable que se tengan cifras de SAHOS de entre el 4% y el 6% de la población. Es importante recordar que muchos pacientes que han padecido de enfermedades cardíacas o cerebrovasculares requieren de estudios en búsqueda de la presencia de SAHOS y, al mismo tiempo, la presencia del SAHOS favorece el desarrollo de enfermedad cardiovascular —hipertensión, arritmias, falla cardíaca, entre otras—.
Según los datos del Banco Mundial (58), en el 2014 la población de Latinoamérica y el caribe corresponde a cerca de 521 900 000 sujetos; una prevalencia del 5% de SAHOS correspondería a tener cerca de 26 millones de sujetos con esta enfermedad. Si se compara con la frecuencia de VIH en esta misma región, las cifras son cercanas al 0.494%, de acuerdo con las cifras de Health, Nutrition and Population Statistics del Banco Mundial (59), lo cual muestra la magnitud del problema del SAHOS y las implicaciones que puede tener en la génesis de algunas patologías cardiovasculares que, como se sabe, están afectando un número importante de personas en la región.
Para determinar el impacto económico del SAHOS en Latinoamérica, se decidió realizar una búsqueda de la literatura en las siguientes bases de datos: LILACS, CidSAUDE, PAHO, REPIDISCA, BBO, BDENF, HomeoIndex, MedCarib, Wholis, IBECAS. Las publicaciones encontradas correspondieron a todas aquellas realizadas en la región y se usaron como términos de búsqueda “sueño” y “costos”, sin ningún límite. Se obtuvo un número muy escaso de publicaciones sobre el tema y la mayoría de ellas relacionadas con estudios de costo efectividad del uso de alguna de las alternativas de tratamiento.
Basado en las publicaciones disponibles de otras regiones y reflexiones personales, es necesario tener en cuenta los siguientes aspectos al momento de hablar de costos de una entidad como el SAHOS. El primer aspecto a mencionar es la búsqueda de sujetos que padecen la enfermedad; para definir esta situación es importante recordar que el número de sujetos que se requiere tamizar corresponde a (1/prevalencia)*100, que —para el caso de SAHOS, con una prevalencia cercana al 5%— sería de 20 sujetos para encontrar un caso de SAHOS —leve, moderado o severo— en la población general.
De acuerdo a los hallazgos de Gutiérrez et al. (60), en el 2006, en Colombia, el costo del diagnóstico puede estar cercano a 2.2 salarios mínimos mensuales legales vigentes (SMLMV), pero puede llegar a ser hasta de 6.5 SMLMV. Al realizar el diagnóstico correcto, se puede evitar una serie de complicaciones cardiovasculares; tal sería el caso de un infarto agudo de miocardio, el cual, de acuerdo a la guía de práctica clínica basada en la evidencia de Colombia (61), podría alcanzar un costo de 13 SMLMV. Para el manejo de la hipertensión arterial, solo considerando el tratamiento médico, el costo promedio al año va desde 0.027 hasta 17 SMLMV, de acuerdo a la guía de práctica clínica basada en la evidencia de Colombia para el manejo de la hipertensión arterial (62).
Un segundo aspecto a considerar en la evaluación de costos es conocer las implicaciones económicas que tienen los pacientes sin diagnóstico confirmado y sin manejo adecuado del SAHOS, los cuales presentan más complicaciones cardiovasculares —no control de la presión arterial, más eventos coronarios agudos, etc.— y metabólicas, así como una frecuencia más alta de consultas programadas y no programadas por diferentes síntomas (63) que, luego del diagnóstico y del manejo, disminuyen de manera significativa.
Un tercer aspecto corresponde al uso de una terapia adecuada en el manejo del SAHOS. Sin lugar a dudas, el CPAP es un método muy efectivo para el tratamiento comparado con el manejo conservador en sujetos con enfermedad moderada o severa, y no se debe usar en la mayoría de los casos leves. Al mismo tiempo, el uso de los elementos mandibulares es recomendado en casos leves y algunos moderados. El alto costo de estas terapias —CPAP y sistemas mandibulares— tiene un alto beneficio y, en la mayoría de los estudios de costo/efectividad, tienen una relación que se considera como buena inversión del dinero para la mayoría de los países (64).
Un cuarto elemento está dado por algunas consecuencias menos medidas, pero de gran impacto social, que se relacionan con la presencia del SAHOS: la accidentalidad —de tránsito, laboral e intrafamiliares—. De igual forma, se ha reconocido que los microsueños son una de las causas más frecuentes de accidentes automovilísticos y estos están relacionados con la presencia de SAHOS (65). Esto hace necesario que, al menos en los grupos de alto riesgo —como conductores de vehículos públicos o de carga—, se realicen estudios de tamizado para encontrar aquellos con este trastorno y, así, disminuir el riesgo de los accidentes y los costos que estos tienen en términos económicos o de vidas humanas.
A manera de resumen, si se decide medir la carga económica del SAHOS en Latinoamérica, sería necesario incluir diferentes aspectos de costos directos, tales como búsqueda de sujetos enfermos con sus pruebas diagnósticas correspondientes; entrenamiento de personal para realizar un diagnóstico clínico adecuado usando cuestionarios estructurados para determinar grupos de mayor riesgo; métodos diagnósticos más efectivos y menos costosos, de acuerdo al grupo que se esté evaluando, y definición de costo de las terapias disponibles, teniendo en consideración la efectividad de las mismas, de acuerdo a la severidad de la alteración y el impacto por las enfermedades concomitantes evitadas o la mejoría de las mismas. Sin lugar a dudas, Latinoamérica requiere de estas mediciones dado el problema de salud pública que tiene asociado el SAHOS.
Conclusiones
El SAHOS no tratado se asocia con costos directos e indirectos significativos. El trastorno también tiene un impacto negativo sobre el desempeño y seguridad laborales y está implicado en una proporción considerable de accidentes automovilísticos. El diagnóstico oportuno y la terapia óptima han mostrado disminución en la utilización de los sistemas de salud y costos y atenúan los riesgos adversos.
Contribución de los autores
Los autores DI y TLC se encargaron de la elaboración de la sección de costos internacionales, mientras que DL se encargó de los costos en Latinoamérica.
Conflicto de intereses
Ninguno declarado por los autores.
Financiación
Ninguna declarada por los autores.
Agradecimientos
A la Asociación Colombiana de Medicina Interna (ACMI® - Médicos para adultos), la Asociación Colombiana de Neurología (ACN), la Asociación Colombiana de Sociedades Científicas (ACSC) por permitir a los autores usar sus instalaciones como lugar de reunión de trabajo y a la Dra. Patricia Hidalgo Martínez (HUSI-PUJ) por la traducción de la sección de costos internacionales.
Referencias
1.Peppard PE, Young T, Barnet JH, Palta M, Hagen EW, Hla KM. Increased prevalence of sleep-disordered breathing in adults. Am J Epidemiol. 2013;177(9):1006-14. http://doi.org/bnjg.
2.Olaithe M, Bucks RS. Executive dysfunction in OSA before and after treatment: a meta-analysis. Sleep. 2013;36(9):1297-305. http://doi.org/bnxz.
3.Yaffe K, Laffan AM, Harrison SL, Redline S, Spira AP, Ensrud KE, et al. Sleep-disordered breathing, hypoxia, and risk of mild cognitive impairment and dementia in older women. JAMA. 2011;306(6):613-9. http://doi.org/bhj879.
4.Young T, Palta M, Dempsey J, Peppard PE, Nieto FJ, Hla KM. Burden of sleep apnea: rationale, design, and major findings of the Wisconsin Sleep Cohort study. WMJ. 2009;108(5):246-9.
5.Yaggi HK, Concato J, Kernan WN, Lichtman JH, Brass LM, Mohsenin V. Obstructive sleep apnea as a risk factor for stroke and death. N Engl J Med. 2005;353(19):2034-41. http://doi.org/bvsxsj.
6.Kryger MH, Roos L, Delaive K, Walld R, Horrocks J. Utilization of health care services in patients with severe obstructive sleep apnea. Sleep. 1996;19(Suppl 9):S111-6.
7.Kapur V, Blough Dk, Sandblom RE, Hert R, de Maine JB, Sullivan SD, et al. the medical cost of undiagnosed sleep apnea. Sleep. 1999;22(6):749-55.
8.Albarrak M, Banno K, Sabbagh AA, Delaive K, Walld R, Manfreda J, et al. Utilization of healthcare resources in obstructive sleep apnea syndrome: a 5-year follow-up study in men using CPAP. Sleep. 2005;28(10):1306-11.
9.Smith R, Ronald J, Delaive K, Walld R, Manfreda J, Kryger MH. What are obstructive sleep apnea patients being treated for prior to this diagnosis? Chest. 2002;121(1):164-72. http://doi.org/d884nc.
10.Ronald J, Delaive K, Roos L, Manfreda J, Bahammam A, Kryger MH. Health care utilization in the 10 years prior to diagnosis in obstructive sleep apnea syndrome patients. Sleep. 1999;22(2):225-9.
11.Berg G, Delaive K, Manfreda J, Walld R, Kryger MH. The use of health-care resources in obesity-hypoventilation syndrome. Chest. 2001;120(2):377-83. http://doi.org/ctcqj7.
12.Jennum P, Kjellberg J. Health, social and economical consequences of sleep-disordered breathing: a controlled national study. Thorax. 2011;66(7):560-6. http://doi.org/bft4jz.
13.Jennum P, Ibsen R, Kjellberg J. Social consequences of sleep disordered breathing on patients and their partners: a controlled national study. Eur Respir J. 2014;43(1):134-44. http://doi.org/bnx2.
14.Collop NA, Anderson WM, Boehlecke B, Claman D, Goldberg R, Gottlieb DJ, et al. Clinical guidelines for the use of unattended portable monitors in the diagnosis of obstructive sleep apnea in adult patients. Portable Monitoring Task Force of the American Academy of Sleep Medicine. J Clin Sleep Med. 2007;3(7):737-47.
15.The New England Comparative Effectiveness Public Advisory Council. Diagnosis and Treatment of Obstructive Sleep Apnea in Adults. Rockville, MD: Institute for Clinical & Economic Review; 2012 [cited 2015 May 3]. Available from: http://goo.gl/532tv9.
16.Simoens S. How to assess the value of medicines? Front Pharmacol. 2010;1:115. http://doi.org/fw4957.
17.Tousignant P, Cosio MG, Levy RD, Groome PA. Quality adjusted life years added by treatment of obstructive sleep apnea. Sleep. 1994;17(1):52-60.
18.Chervin RD, Murman DL, Malow BA, Totten V. Cost-utility of three approaches to the diagnosis of sleep apnea: polysomnography, home testing, and empirical therapy. Ann Intern Med. 1999;130(6):496-505. http://doi.org/bn2b.
19.Brown DL, Chervin RD, Hickenbottom SL, Langa KM, Morgenstern LB. Screening for obstructive sleep apnea in stroke patients: a cost-effectiveness analysis. Stroke. 2005;36(6):1291-3. http://doi.org/cffcfk.
20.Ayas NT, FitzGerald JM, Fleetham JA, White DP, Schulzer M, Ryan CF, et al. Cost-effectiveness of continuous positive airway pressure therapy for moderate to severe obstructive sleep apnea/hypopnea. Arch Intern Med. 2006;166(9):977-84. http://doi.org/fjggbv.
21.Deutsch PA, Simmons MS, Wallace JM. Cost-effectiveness of split-night polysomnography and home studies in the evaluation of obstructive sleep apnea syndrome. J Clin Sleep Med. 2006;2(2):145-53.
22.Tan MCY, Ayas NT, Mulgrew A, Cortes L, FitzGerald JM, Fleetham JA, et al. Cost-effectiveness of continuous positive airway pressure therapy in patients with obstructive sleep apnea-hypopnea in British Columbia. Can Respir J. 2008;15(3):159-65. http://doi.org/bnx5.
23.Weatherly HLA, Griffin SC, Mc Daid C, Durée KH, Davies RJO, Stradling JR, et al. An economic analysis of continuous positive airway pressure for the treatment of obstructive sleep apnea-hypopnea syndrome. Int J Technol Assess Health Care. 2009;25(1):26-34. http://doi.org/c3kjfj.
24.Sadatsafavi M, Marra CA, Ayas NT, Stradling J, Fleetham J. Cost-effectiveness of oral appliances in the treatment of obstructive sleep apnoea-hypopnoea. Sleep Breath. 2009;13(3):241-52. http://doi.org/cmf9dg.
25.Pietzsch JB, Garner A, Cipriano LE, Linehan JH. An integrated health-economic analysis of diagnostic and therapeutic strategies in the treatment of moderate-to-severe obstructive sleep apnea. Sleep. 2011;34(6):695-709. http://doi.org/b9sn4r.
26.Quinnell TG, Bennett M, Jordan J, Clutterbuck-James AL, Davies MG, Smith IE, et al. A crossover randomised controlled trial of oral mandibular advancement devices for obstructive sleep apnoea-hypopnoea (TOMADO). Thorax. 2014;69(10):938-45. http://doi.org/bn2c.
27.Pietzsch JB, Liu S, Garner AM, Kezirian EJ, Strollo PJ. Long-Term Cost-Effectiveness of Upper Airway Stimulation for the Treatment of Obstructive Sleep Apnea: A Model-Based Projection Based on the STAR Trial. Sleep. 2015;38(5):735-44. http://doi.org/bnx9.
28.Tan KB, Toh ST, Guilleminault C, Holty J-EC. A Cost-Effectiveness Analysis of Surgery for Middle-aged Men with Severe Obstructive Sleep Apnea Intolerant of CPAP. J Clin Sleep Med. 2014;11(5):525-35. http://doi.org/bnzb.
29.Rosen CL, Auckley D, Benca R, Foldvary-Schaefer N, Iber C, Kapur V, et al. A multisite randomized trial of portable sleep studies and positive airway pressure autotitration versus laboratory-based polysomnography for the diagnosis and treatment of obstructive sleep apnea: the HomePAP study. Sleep. 2012;35(6):757-67. http://doi.org/bnx3.
30.Ayas NT, Pack A, Marra C. The demise of portable monitoring to diagnose OSA? Not so fast! Sleep. 2011;34(6):691-2. http://doi.org/d6kh9k.
31.Guest JF, Helter MT, Morga A, Stradling JR. Cost-effectiveness of using continuous positive airway pressure in the treatment of severe obstructive sleep apnoea/hypopnoea syndrome in the UK. Thorax. 2008;63(10):860-5. http://doi.org/b6d6t3.
32.Trakada G, Economou N-T, Nena E, Trakada A, Zarogoulidis P, Steiropoulos P. A health-economic analysis of diagnosis and treatment of obstructive sleep apnea with continuous positive airway pressure in relation to cardiovascular disease. The Greek experience. Sleep Breath. 2015;19(2):467-72. http://doi.org/bnx6.
33.Guest JF, Panca M, Sladkevicius E, Taheri S, Stradling J. Clinical outcomes and cost-effectiveness of continuous positive airway pressure to manage obstructive sleep apnea in patients with type 2 diabetes in the U.K. Diabetes Care. 2014;37(5):1263-71. http://doi.org/bnx7.
34.Strollo PJ Jr, Soose RJ, Maurer JT, de Vries N, Cornelius J, Froymovich O, et al. Upper-airway stimulation for obstructive sleep apnea. N Engl J Med. 2014;370(2):139-49. http://doi.org/b7x8.
35.Ulfberg J, Carter N, Talbäck M, Edling C. Excessive daytime sleepiness at work and subjective work performance in the general population and among heavy snorers and patients with obstructive sleep apnea. Chest. 1996;110(3):659-63. http://doi.org/b8m46w.
36.Mulgrew AT, Ryan CF, Fleetham JA, Cheema R, Fox N, Koehoorn M, et al. The impact of obstructive sleep apnea and daytime sleepiness on work limitation. Sleep Med. 2007;9(1):42-53. http://doi.org/c4md6k.
37.Omachi TA, Claman DM, Blanc PD, Eisner MD. Obstructive sleep apnea: a risk factor for work disability. Sleep. 2009;32(6):791-8.
38.Lindberg E, Carter N, Gislason T, Janson C. Role of snoring and daytime sleepiness in occupational accidents. Am J Respir Crit Care Med. 2001;164(11):2031-5. http://doi.org/bnzc.
39.Spengler SE, Browning SR, Reed DB. Sleep deprivation and injuries in part-time Kentucky farmers: impact of self reported sleep habits and sleep problems on injury risk. AAOHN J. 2004;52(9):373-82.
40.Jurado-Gámez B, Guglielmi O, Gude F, Buela-Casal G. Workplace Accidents, Absenteeism and Productivity in Patients with Sleep Apnea. Arch Bronconeumol. 2015;51(5):213-8. http://doi.org/f2x9hw.
41.Hägg SA, Torén K, Lindberg E. Role of sleep disturbances in occupational accidents among women. Scand J Work Environ Health. 2015;41(4):368-76. http://doi.org/f3nntb.
42.Centers for Disease Control and Prevention (CDC). Motor vehicle crash deaths in metropolitan areas--United States, 2009. MMWR Morb Mortal Wkly Rep. 2012;61(28):523-8.
43.Ellen RLB, Marshall SC, Palayew M, Molnar FJ, Wilson KG, Man-Son-Hing M. Systematic review of motor vehicle crash risk in persons with sleep apnea. J Clin Sleep Med. 2006;2(2):193-200.
44.Arita A, Sasanabe R, Hasegawa R, Nomura A, Hori R, Mano M, et al. Risk factors for automobile accidents caused by falling asleep while driving in obstructive sleep apnea syndrome. Sleep Breath. 2015;19(4):1229-34. http://doi.org/bnzd.
45.Karimi M, Hedner J, Zou D, Eskandari D, Lundquist A-C, Grote L. Attention deficits detected in cognitive tests differentiate between sleep apnea patients with or without a motor vehicle accident. Sleep Med. 2015;16(4):528-33. http://doi.org/f3nj92.
46.Turkington PM, Sircar M, Allgar V, Elliott MW. Relationship between obstructive sleep apnoea, driving simulator performance, and risk of road traffic accidents. Thorax. 2001;56(10):800-5. http://doi.org/chmdm9.
47.Littner MR, Kushida C, Wise M, Davila DG, Morgenthaler T, Lee-Chiong T, et al. Practice parameters for clinical use of the multiple sleep latency test and the maintenance of wakefulness test. Sleep. 2005;28(1):113-21.
48.Philip P, Sagaspe P, Taillard J, Chaumet G, Bayon V, Coste O, et al. Maintenance of Wakefulness Test, obstructive sleep apnea syndrome, and driving risk. Ann Neurol. 2008;64(4):410-6. http://doi.org/bbzck7.
49.Pizza F, Contardi S, Mondini S, Trentin L, Cirignotta F. Daytime sleepiness and driving performance in patients with obstructive sleep apnea: comparison of the MSLT, the MWT, and a simulated driving task. Sleep. 2009;32(3):382-91.
50.Sagaspe P, Taillard J, Chaumet G, Guilleminault C, Coste O, Moore N, et al. Maintenance of wakefulness test as a predictor of driving performance in patients with untreated obstructive sleep apnea. Sleep. 2007;30(3):327-30.
51.Arzi L, Shreter R, El-Ad B, Peled R, Pillar G. Forty- versus 20-minute trials of the maintenance of wakefulness test regimen for licensing of drivers. J Clin Sleep Med. 2009;5(1):57-62.
52.Philip P, Chaufton C, Taillard J, Sagaspe P, Léger D, Raimondi M, et al. Maintenance of Wakefulness Test scores and driving performance in sleep disorder patients and controls. Int J Psychophysiol. 2013;89(2):195-202. http://doi.org/f5fj5p.
53.Svider PF, Pashkova AA, Folbe AJ, Eloy JD, Setzen M, Baredes S, et al. Obstructive sleep apnea: strategies for minimizing liability and enhancing patient safety. Otolaryngol Head Neck Surg. 2013;149(6):947-53. http://doi.org/bnzf.
54.Ayas N, Skomro R, Blackman A, Curren K, Fitzpatrick M, Fleetham J, et al. Obstructive sleep apnea and driving: A Canadian Thoracic Society and Canadian Sleep Society position paper. Can Respir J. 2014;21(2):114-23. http://doi.org/bnzg.
55.Bonnie RJ, George CF. Liabilities of sleep deprivation and sleep disorders. UpToDate. [Cited 2015 May 6]. Available from: http://goo.gl/vqSDht.
56.Hartenbaum N, Collop N, Rosen IM, Phillips B, George CFP, Rowley JA, et al. Sleep apnea and commercial motor vehicle operators: Statement from the joint task force of the American College of Chest Physicians, the American College of Occupational and Environmental Medicine, and the National Sleep Foundation. Chest. 2006;130(3):902-5. http://doi.org/bq6q64.
57.Escobar-Córdoba F, Liendo C. Trastornos respiratorios del sueño y alteraciones cardiovasculares. Rev Fac Med. 2012;60(1):1-3.
58.Banco Mundial. América Latina y el Caribe. [Cited 2015 Jun]. Available from: http://goo.gl/RjGlmN.
59.The World Bank. HNP Data Dashboards. [Cited 2015 Jun]. Available from: http://goo.gl/XnOl24.
60.Gutiérrez-Álvarez AM, Vélez-van Meerbeke A, Venegas-Mariño MA. Proceso clínico-administrativo para el diagnóstico de los pacientes con SAHOS: duración y costos. Acta Neurol Colomb. 2006;22:12-24.
61.Ministerio de Salud y Protección Social, Colciencias. Guía de práctica clínica para el Síndrome Coronario Agudo. 2nd ed. Bogotá D.C.: MinSalud; 2013.
62.Ministerio de Salud y Protección Social, Colciencias. Guía de práctica clínica para Hipertensión arterial primaria (HTA). Bogotá D.C. MinSalud; 2013.
63.Pagel JF. Obstructive Sleep Apnea (OSA) in Primary Care: Evidence-based Practice. J Am Board Fam Med. 2007;20(4):392-8. http://doi.org/fjkjrn.
64.McDaid C, Griffin S, Weatherly H, Durée K, van der Burgt M, van Hout S, et al. Continuous positive airway pressure devices for the treatment of obstructive sleep apnoea–hypopnea syndrome: a systematic review and economic analysis. Health Technol Assess. 2009;3(4):iii-iv, xi-xiv. http://doi.org/bmqb.
65.Torre-Bouscoulet L, Castorena-Maldonado A, Meza-Vargas MS. Otras consecuencias de los trastornos del dormir. A propósito de los accidentes vehiculares. Rev. Inst. Nal. Enf. Resp. Méx. 2005;18(2):162-9.

Jeison Malagón
“Paradisomnia”
Universidad Nacional de Colombia
Recibido: 19 de septiembre de 2016; Aceptado: 12 de mayo de 2017
Resumen
El síndrome de apnea-hipopnea obstructiva del sueño (SAHOS) no tratado se asocia con costos directos e indirectos significativos. Este trastorno también tiene un impacto negativo sobre el desempeño y la seguridad laboral y está implicado en una proporción considerable de accidentes automovilísticos. El diagnóstico oportuno y la terapia óptima han mostrado disminución en la utilización de los sistemas de salud y en los costos, al tiempo que atenúan los riesgos adversos. Del mismo modo, el SAHOS no tratado se asocia con incremento en las tasas de desempleo. Para los profesionales de la salud, tener un paciente con SAHOS involucrado en una colisión automovilística es de crucial importancia debido al daño personal y público, así como la potencial discapacidad física por el accidente. En Latinoamérica se requiere de la medición de los costos directos e indirectos dado el problema de salud pública que tiene asociado el SAHOS y las implicaciones mencionadas.
Palabras clave:
Apnea obstructiva del sueño, Economía, Costo de enfermedad, Sistemas de salud, Accidentes (DeCS).Abstract
Untreated obstructive sleep apnea-hypopnea syndrome (OSAHS) is associated with significant direct and indirect medical costs. This disorder also has a significant negative impact on work performance and safety, and is implicated in a substantial proportion of motor vehicular crashes. Timely diagnosis and optimal therapy have shown a lower utilization rate related to health care systems and reduced costs, while adverse risks are mitigated at the same time.
Prompt diagnosis and optimal therapy have shown to decrease heath care utilizaton and costs, as well as mitigating these adverse risks.
Similarly, untreated OSAHS is associated with higher unemployment rates. Forhealthcareprofessionals,having apatientwithOSAHS involved in a MVC is of paramount importance for a several reasons, including personal and public damage, as well as the potential physical disability that may be caused by the accident. In Latin America, measuring direct and indirect costs is necessary considering the public health problem associated with OSAHS and the implications mentioned above.
Keywords:
Sleep Apnea, Obstructive, Economics, Cost of Illness, Health Care Systems, Accidents (MeSH).Introducción
El síndrome de apnea-hipopnea obstructiva del sueño (SAHOS) es un trastorno común asociado con efectos deletéreos en la salud. Los estimados de la prevalencia de este síndrome varían dependiendo de la población evaluada y la definición escogida, p. ej., si se utiliza la definición rigurosa de SAHOS moderado y severo, se encuentra una prevalencia estimada en adultos cercana al 13% en hombres y al 6% en mujeres 1. Además, el SAHOS no tratado puede contribuir de forma significativa a la morbimortalidad al incluir hipertensión arterial, evento cerebrovascular, depresión, deterioro cognitivo y muerte de cualquier causa 2-5.
Mientras las consecuencias del SAHOS en la salud son de gran importancia, el trastorno también está asociado con incremento en la carga socioeconómica y mayores costos en el sistema de salud. Asimismo, la somnolencia diurna y el déficit neurocognitivo presentes en las personas con SAHOS pueden, de manera secundaria, llevar a un riesgo incrementado de accidentes automovilísticos. El objetivo de esta revisión es destacar los costos directos en el sistema de salud, así como los costos indirectos relacionados a la productividad laboral y a los accidentes y colisiones vehiculares asociadas con el SAHOS no tratado.
Desarrollo
Costos en el sistema de salud
Costos de SAHOS no tratado
Debido a los efectos adversos sobre la salud, parece razonable plantear la hipótesis de que el SAHOS no tratado podría incrementar de forma sustancial los costos en el sistema de salud. Kryger et al. 6 encontraron que los pacientes obesos con SAHOS, en comparación con aquellos sin SAHOS, tenían tasas más altas de hospitalización (251 vs. 91 noches) y de utilización del sistema de salud. Estos hallazgos fueron confirmados y suplementados por Kapur et al. 7, quienes compararon los costos médicos de pacientes con y sin SAHOS.
En el año previo al diagnóstico, en los pacientes con SAHOS se encontró que presentaban costos médicos cercanos al doble comparados con los controles apareados por edad y sexo (USD 2 720 vs. USD 1 384), dando como estimado un costo anual de USD 1 336 para el SAHOS no tratado. El estudio de Kapur et al. 7 demostró un efecto independiente de la carga de enfermedad crónica y la obesidad; además, estos investigadores demostraron una relación curvilinear entre el índice de apnea hipopnea (IAH) y los costos médicos, con un efecto linear en severidad baja a moderada y un efecto techo evidente en los casos más severos. Estudios posteriores han confirmado el incremento en la utilización de los servicios de salud y los costos asociados con el SAHOS no tratado 8-11, lo cual parece, en gran parte, relacionado con la hipertensión asociada y otras enfermedades cardiovasculares 9.
Adicional a los costos directos discutidos con anterioridad, también existe evidencia de costos indirectos substanciales asociados con el SAHOS no tratado. Los costos indirectos se refieren a las pérdidas estimadas en productividad debidas a la enfermedad. Jennum & Kjellberg 12 evaluaron los costos totales e indirectos asociados con el ronquido, el SAHOS y el síndrome de hipoventilación y obesidad y los compararon con una muestra aleatoria poblacional controlada por estatus socioeconómico en Dinamarca. Así como en estudios previos, estos autores encontraron que el SAHOS no tratado estaba asociado con costos médicos directos incrementados y con tasas de desempleo incrementado. Entre los empleados, el ingreso laboral fue de solo dos tercios respecto al de los controles. Estos hallazgos fueron confirmados en un estudio más reciente, que también demostró incremento en los costos indirectos para las parejas de los pacientes con SAHOS 13.
Costo de las estrategias diagnósticas en SAHOS
Mientras la historia clínica y el examen físico pueden identificar pacientes con riesgo de SAHOS, solo un estudio de sueño formal puede confirmar el diagnóstico definitivo. En la actualidad, el estudio de sueño para SAHOS puede ser realizado en el laboratorio de sueño con un polisomnograma (PSG) o en el domicilio con un estudio ambulatorio. Por lo general, se realiza un PSG de noche dividida en el laboratorio, en el cual en la segunda mitad del estudio se utiliza titulación de presión positiva en vía aérea (PAP) si se identifica SAHOS durante la primera mitad del estudio.
Debido a que el estudio domiciliario no monitoriza las etapas de sueño, este puede subestimar la frecuencia de eventos respiratorios durante el sueño, lo cual lleva a resultados falsos negativos. Por esta razón, los estudios domiciliarios son, por lo general, reservados para pacientes con una probabilidad elevada pretest de SAHOS moderado a severo. De igual forma, los estudios domiciliarios no son apropiados para pacientes con comorbilidades médicas significativas -pulmonar, cardíaca o neurológica- o para aquellos con sospecha de trastornos del sueño diferentes a SAHOS 14.
El New England Comparative Effectiveness Public Advisory Council comparó los costos directos para las diferentes estrategias diagnósticas para SAHOS basados en 1 000 pacientes hipotéticos del Medicaid. Los autores compararon: a) PSG en laboratorio de sueño, b) pacientes tamizados positivos con el Cuestionario de Berlín que van a PSG, c) evaluación antropométrica positiva que va a PSG y d) estudio domiciliario. Se reportaron los siguientes costos para el estudio de sueño: PSG: USD 652.83, cuestionario+PSG USD 518.06, antropométrico+PSG USD 674.62 y domiciliario USD 200.70 15.
El estudio domiciliario con terapia de presión positiva sobre la vía aérea autoajustable (APAP) cuesta menos (USD 811.12) que el PSG en laboratorio con titulación posterior de PAP (USD 1 244.9) o domiciliario con titulación posterior (USD 1 112.73).
El costo-efectividad relativo de las diferentes estrategias diagnósticas y terapéuticas es más importante que los costos absolutos. Una forma de medición utilizada para calcular directa y objetivamente el costo-efectividad de las estrategias clínicas es la tasa incremental de costo efectividad (ICER), el cual es el costo por el QALY (años de vida ajustados por calidad, por su sigla en inglés) ganado. El uso del ICER puede cuantificar mejor el verdadero valor adicionado de las intervenciones y permite realizar comparaciones entre las modalidades terapéuticas. Como referencia, en EE. UU., un umbral arbitrario relativo de ICER de USD 50 000 por QALY ganado es mandatorio, así que tratamientos que cuestan menos que esta cantidad se consideran costo-efectivos (16). En la Tabla 1 se muestra el costo-efectividad del diagnóstico y tratamiento del SAHOS.
Nota: las figuras arriba de ICER/QALY comparan la intervención listada inicialmente versus la intervención listada al final. ICER: tasa incremental de costo-efectividad; QALY: años de vida ajustados por calidad; CPAP: presión positiva continua en la vía aérea; DAM: dispositivo de avance mandibular; PSG: polisomnograma; HST: estudio de sueño en casa; UAS: estimulación de la vía aérea superior; cpap-pprs/mls: cpap seguido por cirugía reconstructiva palatofaríngea o cirugía multinivel para aquellos pacientes intolerantes de CPAP. Fuente: Elaboración propia.Tabla 1: Estudios que evalúan el costo por años de vida ajustados por calidad para el diagnóstico y tratamiento del síndrome de apnea-hipopnea obstructiva del sueño.
Deutsch et al. 21 examinaron el costo-efectividad del estudio domiciliario, el PSG de noche dividida y el de noche completa y encontraron un costo-efectividad ligeramente mayor para el domiciliario, aunque mayores tasas de abandonos de uso del PAP. Sin embargo, los autores notaron que el ahorro a largo plazo de la alternativa del domiciliario se debía en su mayoría a menos pacientes con SAHOS que recibían terapia PAP; el costo de esta última durante un periodo de cinco años es mayor que el del diagnóstico inicial.
Pietzsch et al. 25 realizaron un análisis similar de las mismas tres estrategias diagnósticas en pacientes con sospecha de SAHOS moderado a severo y encontraron que el PSG de noche completa seguido de titulación de PAP fue la estrategia más costo-efectiva a largo plazo; principalmente, debido a la precisión diagnóstica, comparada con los otros dos métodos 25. En contraste, el ensayo aleatorizado controlado homePAP encontró que los pacientes llevados a estudio domiciliario con APAP tenían menores costos diagnósticos iniciales y mayor adherencia comparada con aquellos que se llevaban a estudio diagnóstico y de titulación en el laboratorio 29.
Teniendo en cuenta estos dos últimos estudios, la evidencia disponible es algo contradictoria acerca de cuál estrategia es la más costo-efectiva para diagnosticar SAHOS. Los resultados sugieren que en el PSG de laboratorio ciertos costos son más altos en principio, pero que su precisión diagnóstica puede resultar en un significativo ahorro de costos a largo plazo, comparado con el domiciliario. Es probable que la estrategia diagnóstica óptima dependa de la población específica a ser tratada y de los recursos médicos disponibles 30.
Costo de las terapias para SAHOS
Por lo general, el tratamiento de primera línea para SAHOS es la PAP. Varios estudios han demostrado el costo-efectividad del CPAP, comparado con dejar al paciente sin tratamiento, entre los pacientes con SAHOS moderado a severo 22,31, enfermedad cardiovascular 32 y diabetes tipo 2 33. El costo por QALY ganado ha mostrado ser favorable y ser costo-efectivo después de dos años de tratamiento 20,24,31.
Los dispositivos orales son más utilizados en el tratamiento para el SAHOS, en especial en aquellos pacientes que no toleran la terapia PAP. Comparados con dejar al paciente sin tratamiento, los dispositivos orales han mostrado ser costo-efectivos; no obstante, la terapia PAP provee beneficio adicional en costo-efectividad cuando se comparan directamente con los dispositivos orales 24. Weatherly et al. 23 compararon los dispositivos orales, la terapia PAP y las recomendaciones en el estilo de vida y encontraron que la segunda fue la más costo-efectiva.
Varios abordajes quirúrgicos también se encuentran entre las opciones terapéuticas para el SAHOS. La estimulación de la vía aérea superior (VAS) es una nueva modalidad en el arsenal terapéutico para el SAHOS 34. Pietzsch et al. 27 analizan los datos de un ensayo clínico aleatorizado y encuentran que la estimulación de la VAS fue la alternativa más costo-efectiva. Tan et al. 28 encontraron que la cirugía palatofaríngea es más costo-efectiva que la cirugía multinivel en pacientes intolerantes a la terapia PAP.
Accidentes y errores laborales
La somnolencia diurna excesiva (SDE) es una de las quejas más comunes de los pacientes con SAHOS que no solo afecta a la persona y su funcionamiento social, sino que también impacta de forma negativa su desempeño laboral. Ulfberg et al. 35 demostraron, hace casi dos décadas, que el ronquido primario y el SAHOS franco están asociados con SDE y problemas subjetivos de desempeño laboral.
La magnitud del efecto era sustancial en los roncadores primarios con 20 veces más riesgo y en los pacientes con SAHOS 40 veces más riesgo de SDE en el sitio de trabajo. Los pacientes con SAHOS también tenían 20 veces más riesgo de dificultades en el desarrollo de habilidades laborales.
Mulgrew et al. 36 examinaron con más detalle el impacto del SAHOS en la función laboral. Al evaluar una muestra de más de 400 pacientes remitidos por sospecha de SAHOS, los autores no encontraron relación entre la severidad de este y las múltiples dimensiones de la limitación laboral. Sin embargo, entre los trabajadores industriales hubo efectos deletéreos significativos del SAHOS sobre el manejo del tiempo y las interacciones personales. La SDE estuvo fuertemente relacionada con dominios múltiples de funcionamiento laboral.
En un seguimiento de pacientes tratados con terapia PAP, se demostraron mejoras significativas en el manejo del tiempo, relaciones interpersonales y el desenlace laboral. Los efectos negativos del SAHOS y de la SDE sobre la función laboral y la discapacidad laboral fueron replicados por Omachi et al. 37; en contraste con los hallazgos de Mulgrew et al. 36, ellos demostraron una asociación independiente entre SAHOS y discapacidad laboral independiente de la SDE.
La posible asociación entre SAHOS y accidentes laborales ha sido estudiada y se ha demostrado una relación entre el ronquido con somnolencia diurna y los accidentes laborales, aunque no hubo un diagnóstico formal de SAHOS con PSG 38. Estos hallazgos también fueron evidentes en un estudio de granjeros en Kentucky, en quienes los síntomas de SAHOS fueron relacionados con riesgo incrementado de lesión 39. Así, la evidencia disponible demuestra una asociación entre el ronquido y otros síntomas autoreportados de SAHOS y los accidentes laborales.
Los investigadores también han examinado la relación entre el SAHOS definido por PSG y los accidentes laborales. Jurado-Gamez et al. 40 realizaron un estudio de casos y controles comparando pacientes con SAHOS versus pacientes sin SAHOS y demostraron más incapacidades y menor productividad laboral en el primer grupo. No obstante, no encontraron relación entre las medidas de severidad del SAHOS y los accidentes laborales: 27% en SAHOS vs. 25% en el grupo control. Los autores concluyeron que mientras el SAHOS parece estar asociado con limitaciones en la productividad laboral y más incapacidades, este no se asoció con accidentes laborales. Este hallazgo negativo también fue reportado por Hagg et al. 41 en población femenina escandinava.
Accidentes automovilísticos
Las colisiones automovilísticas (CAM) tienen una morbimortalidad considerable 42. Para los profesionales de la salud, tener un paciente con SAHOS involucrado en una CAM es de crucial importancia, debido a varias razones que incluyen el daño personal y público, así como la potencial discapacidad física. Entender la incidencia y los factores de riesgo para una CAM en el escenario del SAHOS es fundamental.
La evidencia que apoya la asociación entre el SAHOS y las CAM es robusta y fue revisada hace poco por Ellen et al. 43, quienes identificaron 30 estudios que examinaron el riesgo de CAM en los pacientes con SAHOS. Así, se muestra un riesgo incrementado de CAM entre los conductores no comerciales, los estudios de los registros de las aseguradoras, las CAM autoreportadas y el desempeño en el simulador de conducción. Para ponerlo en perspectiva, la tasa de colisiones en pacientes con SAHOS es comparable con aquella de las personas con demencia moderada-severa o con niveles sanguíneos de alcohol entre 0.05 y 0.70 mg/dL.
Los estudios que incluyen conductores comerciales también soportan ampliamente una asociación significativa, aunque la magnitud del efecto es menor. Datos sobre la relación entre la severidad del SAHOS y el riesgo de accidentes son inconsistentes. De este modo, 11 estudios evaluaron el efecto de la terapia PAP sobre las CAM y encontraron una reducción en la tasa de accidentes con el tratamiento. Hallazgos similares fueron demostrados con la cirugía palatofaríngea como tratamiento.
Dado el riesgo incrementado de las CAM asociado con el SAHOS, varios investigadores han intentado identificar los factores de riesgo para los accidentes. Arita et al. 44 realizaron un análisis multivariado de medidas objetivas y subjetivas de la severidad del SAHOS y encontraron que ambas puntuaciones en la Escala de Somnolencia de Epworth y la frecuencia reportada por el paciente de sentirse somnoliento mientras conduce o trabaja estaban relacionadas con las CAM. Medidas polisomnográficas de la severidad del SAHOS no permanecieron como predictores significativos en el modelo multivariado 44.
Teniendo en cuenta estos hallazgos, Karimi et al. 45 trataron de identificar marcadores de función cognitiva en los pacientes con SAHOS que predijeran las CAM y encontraron que la atención sostenida -determinada por una evaluación neurocognitiva- estaba asociada con CAM. Con las pruebas en los simuladores de conducción, el buen desempeño parece estar asociado con menor riesgo de CAM; sin embargo, el pobre desempeño no predice estos accidentes 46.
Dado su uso amplio en la medicina del sueño, la utilidad de la prueba de latencia múltiple del sueño y la prueba de mantenimiento de la vigilia en predecir el riesgo de CAM merecen atención especial. Los parámetros actuales de la American Academy of Sleep Medicine (AASM) sugieren que la prueba de mantenimiento de la vigilia tiene mayor validez de apariencia que la prueba de latencia múltiple del sueño en la evaluación de la habilidad individual de permanecer despierto en el contexto de la seguridad 47. Además, las guías sugieren que, en el escenario de datos empíricos limitados, el permanecer despierto durante una prueba de mantenimiento de la vigilia de 40 minutos indica la evidencia objetiva más fuerte de la habilidad de permanecer despierto. Valores entre 8 y 40 minutos son ambiguos y valores <8 minutos son anormales.
A propósito del estudio más informativo a la fecha en este tópico, Philip et al. 48 examinaron la relación entre las medidas objetivas y subjetivas de somnolencia y el desempeño en la conducción en la vida real en los pacientes con SAHOS. Los autores reportaron que ambas escalas -la de somnolencia y la puntuación en la prueba de mantenimiento de la vigilia- estaban relacionadas con el desempeño en la conducción. Latencias de sueño <34 minutos estuvieron asociadas con peor desempeño en la conducción con déficit igual entre los grupos de somnolientos (20-33 minutos) y muy somnolientos (0-19 minutos).
En un entorno simulado de conducción, la prueba de mantenimiento de la vigilia ha sido asociada con más fuerza al desempeño en la conducción que a la latencia de sueño en una prueba de latencia múltiple del sueño 49,50. Un protocolo más prolongado de 40 minutos de la prueba de mantenimiento de la vigilia ha mostrado ser más sensible en la detección de dificultades en la conducción, comparado con protocolos <20 minutos 51. En un estudio más reciente, que utiliza un simulador de conducción, los pacientes con SAHOS con una prueba anormal de mantenimiento de la vigilia tienen peor desempeño en la conducción 52 y este es peor con latencias <19 minutos. Reuniendo toda la información, la evidencia disponible apoya la utilización de la prueba de mantenimiento de la vigilia como una medida objetiva relacionada con el desempeño en la conducción y deterioro observado con latencias promedio de sueño <34 minutos.
En relación con el daño potencial, debido a las CAM asociadas con el SAHOS, está la posibilidad de responsabilidad del somnólogo. Hasta donde se sabe, Svider et al. 53 han realizado el único análisis de litigio de mala práctica relacionada con SAHOS y no reportan algún caso relacionado con conducción. La American Thoracic Society (ATS) ha publicado las guías de práctica clínica para conducción en los pacientes con SAHOS; sus recomendaciones incluyen: todos los pacientes con sospecha de SAHOS o confirmado deben ser evaluados por somnolencia diurna y advertidos del riesgo de conducir hasta que tengan terapia efectiva; el riesgo de conducir somnoliento debe ser reevaluado en los pacientes de alto riesgo; para pacientes de alto riesgo de conducir de forma somnolienta, la terapia debe ser iniciada en el mes siguiente a la evaluación inicial, pero no de forma empírica antes de un estudio polisomnográfico; y los medicamentos estimulantes no deben utilizarse con el objetivo de disminuir el riesgo al conducir.
Los requerimientos legales para los médicos, en cuanto al reporte de pacientes individuales con SAHOS, varía entre los países y entre los estados. Las guías ATS recomiendan que al menos los médicos deben notificar al departamento de vehículos motorizados si un paciente de muy alto riesgo -con somnolencia diurna severa y una CAM o casi una- continúa conduciendo, aun si el tratamiento no ha sido iniciado o es exitoso. Una investigación de la posición al respecto fue publicada hace poco por la Canadian Thoracic Society 54. Bonnie & George 55 han argumentado que una vez un clínico ha informado al paciente del riesgo asociado con su trastorno del sueño y sus opciones terapéuticas, los primeros ya no tienen mayor responsabilidad por la falla del paciente en reducir su riesgo.
Los conductores de vehículos motorizados comerciales (VMC) representan un caso especial con respecto a la tamización del SAHOS y el tratamiento, dada la mayor tasa de mortalidad ocupacional, el mayor tamaño de sus vehículos y la posibilidad de transportar materiales tóxicos o un gran número de pasajeros. Las guías para tamización de SAHOS en los operadores de VMC fueron diseñadas en un consenso del American College of Chest Physicians, el American College of Occupational and Environmental Medicine y la National Sleep Foundation 56. Otros países también han establecido las guías.
Las recomendaciones incluyen tamizar a los operadores de VMC utilizando la historia clínica y la evaluación física y realizar un estudio polisomnográfico cuando esté indicado. Los conductores son descalificados de forma temporal para conducir vehículos motorizados hasta que sea descartado el SAHOS por medio de PSG o sean tratados de manera adecuada. La adherencia a la terapia PAP -al menos cuatro horas/día- debe ser demostrada y los conductores pueden retornar a su trabajo una semana después de tratamiento si el IAH residual es menor a 5/hora mientras está con la terapia PAP.
Costos en Latinoamérica
En la medicina respiratoria, hace muchos años se inició el estudio de los sujetos en condiciones de reposo y en condiciones ideales, en los cuales se evalúa la función respiratoria mediante diferentes técnicas. En los últimos 25 años se consideró que era muy importante observar qué ocurría con estas condiciones respiratorias durante la actividad, el ejercicio y la aplicación de ciertos retos. A su vez, esto llevó a un desarrollo grande en la observación de las alteraciones del sujeto expuesto al estrés, como el ejercicio y otras pruebas, o en el caso de la exposición a la metacolina para detectar obstrucción bronquial.
En los últimos años se ha notado que los seres humanos pasan alrededor de 25 años durmiendo y que se pueden presentar algunas alteraciones ligadas al hecho de dormir, como, p. ej., el ronquido simple, el síndrome de resistencia aumentada de la vía aérea, la apnea obstructiva posicional y la dependiente del sueño REM (rapid eye movement), el SAHOS, la apnea central, la apnea mixta y la recientemente denominada apnea compleja. Esto muestra un espectro muy amplio de patología que ha llevado al desarrollo de la medicina del sueño y al estudio de todas las entidades descritas.
En Colombia, la prevalencia de los trastornos del sueño es del 27%, lo cual hace que se constituya en un problema de salud pública. Sin embargo, no se cuenta con datos exactos de la frecuencia de las enfermedades en el país 57. Si se extrapolan datos, es probable que se tengan cifras de SAHOS de entre el 4% y el 6% de la población. Es importante recordar que muchos pacientes que han padecido de enfermedades cardíacas o cerebrovasculares requieren de estudios en búsqueda de la presencia de SAHOS y, al mismo tiempo, la presencia del SAHOS favorece el desarrollo de enfermedad cardiovascular - hipertensión, arritmias, falla cardíaca, entre otras-.
Según los datos del Banco Mundial 58, en el 2014 la población de Latinoamérica y el caribe corresponde a cerca de 521 900 000 sujetos; una prevalencia del 5% de SAHOS correspondería a tener cerca de 26 millones de sujetos con esta enfermedad. Si se compara con la frecuencia de VIH en esta misma región, las cifras son cercanas al 0.494%, de acuerdo con las cifras de Health, Nutrition and Population Statistics del Banco Mundial 59, lo cual muestra la magnitud del problema del SAHOS y las implicaciones que puede tener en la génesis de algunas patologías cardiovasculares que, como se sabe, están afectando un número importante de personas en la región.
Para determinar el impacto económico del SAHOS en Latinoamérica, se decidió realizar una búsqueda de la literatura en las siguientes bases de datos: LILACS, CidSAUDE, PAHO, REPIDISCA, BBO, BDENF, HomeoIndex, MedCarib, Wholis, IBECAS. Las publicaciones encontradas correspondieron a todas aquellas realizadas en la región y se usaron como términos de búsqueda "sueño" y "costos", sin ningún límite. Se obtuvo un número muy escaso de publicaciones sobre el tema y la mayoría de ellas relacionadas con estudios de costo efectividad del uso de alguna de las alternativas de tratamiento.
Basado en las publicaciones disponibles de otras regiones y reflexiones personales, es necesario tener en cuenta los siguientes aspectos al momento de hablar de costos de una entidad como el SAHOS. El primer aspecto a mencionar es la búsqueda de sujetos que padecen la enfermedad; para definir esta situación es importante recordar que el número de sujetos que se requiere tamizar corresponde a (1/prevalencia)*100, que -para el caso de SAHOS, con una prevalencia cercana al 5%- sería de 20 sujetos para encontrar un caso de SAHOS -leve, moderado o severo- en la población general.
De acuerdo a los hallazgos de Gutiérrez et al. 60, en el 2006, en Colombia, el costo del diagnóstico puede estar cercano a 2.2 salarios mínimos mensuales legales vigentes (SMLMV), pero puede llegar a ser hasta de 6.5 SMLMV. Al realizar el diagnóstico correcto, se puede evitar una serie de complicaciones cardiovasculares; tal sería el caso de un infarto agudo de miocardio, el cual, de acuerdo a la guía de práctica clínica basada en la evidencia de Colombia 61, podría alcanzar un costo de 13 SMLMV. Para el manejo de la hipertensión arterial, solo considerando el tratamiento médico, el costo promedio al año va desde 0.027 hasta 17 SMLMV, de acuerdo a la guía de práctica clínica basada en la evidencia de Colombia para el manejo de la hipertensión arterial 62.
Un segundo aspecto a considerar en la evaluación de costos es conocer las implicaciones económicas que tienen los pacientes sin diagnóstico confirmado y sin manejo adecuado del SAHOS, los cuales presentan más complicaciones cardiovasculares -no control de la presión arterial, más eventos coronarios agudos, etc.-y metabólicas, así como una frecuencia más alta de consultas programadas y no programadas por diferentes síntomas 63 que, luego del diagnóstico y del manejo, disminuyen de manera significativa.
Un tercer aspecto corresponde al uso de una terapia adecuada en el manejo del SAHOS. Sin lugar a dudas, el CPAP es un método muy efectivo para el tratamiento comparado con el manejo conservador en sujetos con enfermedad moderada o severa, y no se debe usar en la mayoría de los casos leves. Al mismo tiempo, el uso de los elementos mandibulares es recomendado en casos leves y algunos moderados. El alto costo de estas terapias -CPAP y sistemas mandibulares- tiene un alto beneficio y, en la mayoría de los estudios de costo/efectividad, tienen una relación que se considera como buena inversión del dinero para la mayoría de los países 64.
Un cuarto elemento está dado por algunas consecuencias menos medidas, pero de gran impacto social, que se relacionan con la presencia del SAHOS: la accidentalidad -de tránsito, laboral e intrafamiliares-. De igual forma, se ha reconocido que los microsueños son una de las causas más frecuentes de accidentes automovilísticos y estos están relacionados con la presencia de SAHOS 65. Esto hace necesario que, al menos en los grupos de alto riesgo -como conductores de vehículos públicos o de carga-, se realicen estudios de tamizado para encontrar aquellos con este trastorno y, así, disminuir el riesgo de los accidentes y los costos que estos tienen en términos económicos o de vidas humanas.
A manera de resumen, si se decide medir la carga económica del SAHOS en Latinoamérica, sería necesario incluir diferentes aspectos de costos directos, tales como búsqueda de sujetos enfermos con sus pruebas diagnósticas correspondientes; entrenamiento de personal para realizar un diagnóstico clínico adecuado usando cuestionarios estructurados para determinar grupos de mayor riesgo; métodos diagnósticos más efectivos y menos costosos, de acuerdo al grupo que se esté evaluando, y definición de costo de las terapias disponibles, teniendo en consideración la efectividad de las mismas, de acuerdo a la severidad de la alteración y el impacto por las enfermedades concomitantes evitadas o la mejoría de las mismas. Sin lugar a dudas, Latinoamérica requiere de estas mediciones dado el problema de salud pública que tiene asociado el SAHOS.
Conclusiónes
El SAHOS no tratado se asocia con costos directos e indirectos significativos. El trastorno también tiene un impacto negativo sobre el desempeño y seguridad laborales y está implicado en una proporción considerable de accidentes automovilísticos. El diagnóstico oportuno y la terapia óptima han mostrado disminución en la utilización de los sistemas de salud y costos y atenúan los riesgos adversos.
Contribución de los autores
Los autores DI y TLC se encargaron de la elaboración de la sección de costos internacionales, mientras que DL se encargó de los costos en Latinoamérica.
Conflicto de intereses
Ninguno declarado por los autores.
Financiación
Ninguna declarada por los autores.
Agradecimientos
A la Asociación Colombiana de Medicina Interna (ACMI® -Médicos para adultos), la Asociación Colombiana de Neurología (ACN), la Asociación Colombiana de Sociedades Científicas (ACSC) por permitir a los autores usar sus instalaciones como lugar de reunión de trabajo y a la Dra. Patricia Hidalgo Martínez (HUSI-PUJ) por la traducción de la sección de costos internacionales.
Referencias
Referencias
Peppard PE, Young T, Barnet JH, Palta M, Hagen EW, Hla KM. Increased prevalence of sleep-disordered breathing in adults. Am J Epidemiol. 2013;177(9):1006-14. http://doi.org/bnjg.
Olaithe M, Bucks RS. Executive dysfunction in OSA before and after treatment: a meta-analysis. Sleep. 2013;36(9):1297-305. http://doi.org/bnxz.
Yaffe K, Laffan AM, Harrison SL, Redline S, Spira AP, Ensrud KE, et al. Sleep-disordered breathing, hypoxia, and risk of mild cognitive impairment and dementia in older women. JAMA. 2011;306(6):613-9. http://doi.org/bhj879.
Young T, Palta M, Dempsey J, Peppard PE, Nieto FJ, Hla KM. Burden of sleep apnea: rationale, design, and major findings of the Wisconsin Sleep Cohort study. WMJ. 2009;108(5):246-9.
Yaggi HK, Concato J, Kernan WN, Lichtman JH, Brass LM, Mohsenin V. Obstructive sleep apnea as a risk factor for stroke and death. N Engl J Med. 2005;353(19):2034-41. http://doi.org/bvsxsj.
Kryger MH, Roos L, Delaive K, Walld R, Horrocks J. Utilization of health care services in patients with severe obstructive sleep apnea. Sleep. 1996;19(Suppl 9):S111-6.
Kapur V, Blough Dk, Sandblom RE, Hert R, de Maine JB, Sullivan SD, et al. the medical cost of undiagnosed sleep apnea. Sleep. 1999;22(6):749-55.
Albarrak M, Banno K, Sabbagh AA, Delaive K, Walld R, Manfreda J, et al. Utilization of healthcare resources in obstructive sleep apnea syndrome: a 5-year follow-up study in men using CPAP. Sleep. 2005;28(10):1306-11.
Smith R, Ronald J, Delaive K, Walld R, Manfreda J, Kryger MH. What are obstructive sleep apnea patients being treated for prior to this diagnosis? Chest. 2002;121(1):164-72. http://doi.org/d884nc.
Ronald J, Delaive K, Roos L, Manfreda J, Bahammam A, Kryger MH. Health care utilization in the 10 years prior to diagnosis in obstructive sleep apnea syndrome patients. Sleep. 1999;22(2):225-9.
Berg G, Delaive K, Manfreda J, Walld R, Kryger MH. The use of health-care resources in obesity-hypoventilation syndrome. Chest. 2001;120(2):377-83. http://doi.org/ctcqj7.
Jennum P, Kjellberg J. Health, social and economical consequences of sleep-disordered breathing: a controlled national study. Thorax. 2011;66(7):560-6. http://doi.org/bft4jz.
Jennum P, Ibsen R, Kjellberg J. Social consequences of sleep disordered breathing on patients and their partners: a controlled national study. Eur Respir J. 2014;43(1):134-44. http://doi.org/bnx2.
Collop NA, Anderson WM, Boehlecke B, Claman D, Goldberg R, Gottlieb DJ, et al. Clinical guidelines for the use of unattended portable monitors in the diagnosis of obstructive sleep apnea in adult patients. Portable Monitoring Task Force of the American Academy of Sleep Medicine. J Clin Sleep Med. 2007;3(7):737-47.
The New England Comparative Effectiveness Public Advisory Council. Diagnosis and Treatment of Obstructive Sleep Apnea in Adults. Rockville, MD: Institute for Clinical & Economic Review; 2012 [cited 2015 May 3]. Available from: http://goo.gl/532tv9.
Simoens S. How to assess the value of medicines? Front Pharmacol. 2010;1:115. http://doi.org/fw4957.
Tousignant P, Cosio MG, Levy RD, Groome PA. Quality adjusted life years added by treatment of obstructive sleep apnea. Sleep. 1994;17(1):52-60.
Chervin RD, Murman DL, Malow BA, Totten V. Cost-utility of three approaches to the diagnosis of sleep apnea: polysomnography, home testing, and empirical therapy. Ann Intern Med. 1999;130(6):496-505. http://doi.org/bn2b.
Brown DL, Chervin RD, Hickenbottom SL, Langa KM, Morgenstern LB. Screening for obstructive sleep apnea in stroke patients: a cost-effectiveness analysis. Stroke. 2005;36(6):1291-3. http://doi.org/cffcfk.
Ayas NT, FitzGerald JM, Fleetham JA, White DP, Schulzer M, Ryan CF, et al. Cost-effectiveness of continuous positive airway pressure therapy for moderate to severe obstructive sleep apnea/hypopnea. Arch Intern Med. 2006;166(9):977-84. http://doi.org/fjggbv.
Deutsch PA, Simmons MS, Wallace JM. Cost-effectiveness of split-night polysomnography and home studies in the evaluation of obstructive sleep apnea syndrome. J Clin Sleep Med. 2006;2(2):145-53.
Tan MCY, Ayas NT, Mulgrew A, Cortes L, FitzGerald JM, Fleetham JA, et al. Cost-effectiveness of continuous positive airway pressure therapy in patients with obstructive sleep apnea-hypopnea in British Columbia. Can Respir J. 2008;15(3):159-65. http://doi.org/bnx5.
Weatherly HLA, Griffin SC, Mc Daid C, Durée KH, Davies RJO, Stradling JR, et al. An economic analysis of continuous positive airway pressure for the treatment of obstructive sleep apnea-hypopnea syndrome. Int J Technol Assess Health Care. 2009;25(1):26-34. http://doi.org/c3kjfj.
Sadatsafavi M, Marra CA, Ayas NT, Stradling J, Fleetham J. Cost-effectiveness of oral appliances in the treatment of obstructive sleep apnoea-hypopnoea. Sleep Breath. 2009;13(3):241-52. http://doi.org/cmf9dg.
Pietzsch JB, Garner A, Cipriano LE, Linehan JH. An integrated health-economic analysis of diagnostic and therapeutic strategies in the treatment of moderate-to-severe obstructive sleep apnea. Sleep. 2011;34(6):695-709. http://doi.org/b9sn4r.
Quinnell TG, Bennett M, Jordan J, Clutterbuck-James AL, Davies MG, Smith IE, et al. A crossover randomised controlled trial of oral mandibular advancement devices for obstructive sleep apnoea-hypopnoea (TOMADO). Thorax. 2014;69(10):938-45. http://doi.org/bn2c.
Pietzsch JB, Liu S, Garner AM, Kezirian EJ, Strollo PJ. Long-Term Cost-Effectiveness of Upper Airway Stimulation for the Treatment of Obstructive Sleep Apnea: A Model-Based Projection Based on the STAR Trial. Sleep. 2015;38(5):735-44. http://doi.org/bnx9.
Tan KB, Toh ST, Guilleminault C, Holty J-EC. A Cost-Effectiveness Analysis of Surgery for Middle-aged Men with Severe Obstructive Sleep Apnea Intolerant of CPAP. J Clin Sleep Med. 2014;11(5):525-35. http://doi.org/bnzb.
Rosen CL, Auckley D, Benca R, Foldvary-Schaefer N, Iber C, Kapur V, et al. A multisite randomized trial of portable sleep studies and positive airway pressure autotitration versus laboratory-based polysomnography for the diagnosis and treatment of obstructive sleep apnea: the HomePAP study. Sleep. 2012;35(6):757-67. http://doi.org/bnx3.
Ayas NT, Pack A, Marra C. The demise of portable monitoring to diagnose OSA? Not so fast! Sleep. 2011;34(6):691-2. http://doi.org/d6kh9k.
Guest JF, Helter MT, Morga A, Stradling JR. Cost-effectiveness of using continuous positive airway pressure in the treatment of severe obstructive sleep apnoea/hypopnoea syndrome in the UK. Thorax. 2008;63(10):860-5. http://doi.org/b6d6t3.
Trakada G, Economou N-T, Nena E, Trakada A, Zarogoulidis P, Steiropoulos P. A health-economic analysis of diagnosis and treatment of obstructive sleep apnea with continuous positive airway pressure in relation to cardiovascular disease. The Greek experience. Sleep Breath. 2015;19(2):467-72. http://doi.org/bnx6.
Guest JF, Panca M, Sladkevicius E, Taheri S, Stradling J. Clinical outcomes and cost-effectiveness of continuous positive airway pressure to manage obstructive sleep apnea in patients with type 2 diabetes in the U.K. Diabetes Care. 2014;37(5):1263-71. http://doi.org/bnx7.
Strollo PJ Jr, Soose RJ, Maurer JT, de Vries N, Cornelius J, Froymovich O, et al. Upper-airway stimulation for obstructive sleep apnea. N Engl J Med. 2014;370(2):139-49. http://doi.org/b7x8.
Ulfberg J, Carter N, Talbäck M, Edling C. Excessive daytime sleepiness at work and subjective work performance in the general population and among heavy snorers and patients with obstructive sleep apnea. Chest. 1996;110(3):659-63. http://doi.org/b8m46w.
Mulgrew AT, Ryan CF, Fleetham JA, Cheema R, Fox N, Koehoorn M, et al. The impact of obstructive sleep apnea and daytime sleepiness on work limitation. Sleep Med. 2007;9(1):42-53. http://doi.org/c4md6k.
Omachi TA, Claman DM, Blanc PD, Eisner MD. Obstructive sleep apnea: a risk factor for work disability. Sleep. 2009;32(6):791-8.
Lindberg E, Carter N, Gislason T, Janson C. Role of snoring and daytime sleepiness in occupational accidents. Am J Respir Crit Care Med. 2001;164(11):2031-5. http://doi.org/bnzc.
Spengler SE, Browning SR, Reed DB. Sleep deprivation and injuries in part-time Kentucky farmers: impact of self reported sleep habits and sleep problems on injury risk. AAOHN J. 2004;52(9):373-82.
Jurado-Gámez B, Guglielmi O, Gude F, Buela-Casal G. Workplace Accidents, Absenteeism and Productivity in Patients with Sleep Apnea. Arch Bronconeumol. 2015;51(5):213-8. http://doi.org/f2x9hw.
Hägg SA, Torén K, Lindberg E. Role of sleep disturbances in occupational accidents among women. Scand J Work Environ Health. 2015;41(4):368-76. http://doi.org/f3nntb.
Centers for Disease Control and Prevention (CDC). Motor vehicle crash deaths in metropolitan areas--United States, 2009. MMWR Morb Mortal Wkly Rep. 2012;61(28):523-8.
Ellen RLB, Marshall SC, Palayew M, Molnar FJ, Wilson KG, Man-Son-Hing M. Systematic review of motor vehicle crash risk in persons with sleep apnea. J Clin Sleep Med. 2006;2(2):193-200.
Arita A, Sasanabe R, Hasegawa R, Nomura A, Hori R, Mano M, et al. Risk factors for automobile accidents caused by falling asleep while driving in obstructive sleep apnea syndrome. Sleep Breath. 2015;19(4):1229-34. http://doi.org/bnzd.
Karimi M, Hedner J, Zou D, Eskandari D, Lundquist A-C, Grote L. Attention deficits detected in cognitive tests differentiate between sleep apnea patients with or without a motor vehicle accident. Sleep Med. 2015;16(4):528-33. http://doi.org/f3nj92.
Turkington PM, Sircar M, Allgar V, Elliott MW. Relationship between obstructive sleep apnoea, driving simulator performance, and risk of road traffic accidents. Thorax. 2001;56(10):800-5. http://doi.org/chmdm9.
Littner MR, Kushida C, Wise M, Davila DG, Morgenthaler T, Lee-Chiong T, et al. Practice parameters for clinical use of the multiple sleep latency test and the maintenance of wakefulness test. Sleep. 2005;28(1):113-21.
Philip P, Sagaspe P, Taillard J, Chaumet G, Bayon V, Coste O, et al. Maintenance of Wakefulness Test, obstructive sleep apnea syndrome, and driving risk. Ann Neurol. 2008;64(4):410-6. http://doi.org/bbzck7.
Pizza F, Contardi S, Mondini S, Trentin L, Cirignotta F. Daytime sleepiness and driving performance in patients with obstructive sleep apnea: comparison of the MSLT, the MWT, and a simulated driving task. Sleep. 2009;32(3):382-91.
Sagaspe P, Taillard J, Chaumet G, Guilleminault C, Coste O, Moore N, et al. Maintenance of wakefulness test as a predictor of driving performance in patients with untreated obstructive sleep apnea. Sleep. 2007;30(3):327-30.
Arzi L, Shreter R, El-Ad B, Peled R, Pillar G. Forty- versus 20-minute trials of the maintenance of wakefulness test regimen for licensing of drivers. J Clin Sleep Med. 2009;5(1):57-62.
Philip P, Chaufton C, Taillard J, Sagaspe P, Léger D, Raimondi M, et al. Maintenance of Wakefulness Test scores and driving performance in sleep disorder patients and controls. Int J Psychophysiol. 2013;89(2):195-202. http://doi.org/f5fj5p.
Svider PF, Pashkova AA, Folbe AJ, Eloy JD, Setzen M, Baredes S, et al. Obstructive sleep apnea: strategies for minimizing liability and enhancing patient safety. Otolaryngol Head Neck Surg. 2013;149(6):947-53. http://doi.org/bnzf.
Ayas N, Skomro R, Blackman A, Curren K, Fitzpatrick M, Fleetham J, et al. Obstructive sleep apnea and driving: A Canadian Thoracic Society and Canadian Sleep Society position paper. Can Respir J. 2014;21(2):114-23. http://doi.org/bnzg.
Bonnie RJ, George CF. Liabilities of sleep deprivation and sleep disorders. UpToDate. [Cited 2015 May 6]. Available from: http://goo.gl/vqSDht.
Hartenbaum N, Collop N, Rosen IM, Phillips B, George CFP, Rowley JA, et al. Sleep apnea and commercial motor vehicle operators: Statement from the joint task force of the American College of Chest Physicians, the American College of Occupational and Environmental Medicine, and the National Sleep Foundation. Chest. 2006;130(3):902-5. http://doi.org/bq6q64.
Escobar-Córdoba F, Liendo C. Trastornos respiratorios del sueño y alteraciones cardiovasculares. Rev Fac Med. 2012;60(1):1-3.
Banco Mundial. América Latina y el Caribe. [Cited 2015 Jun]. Available from: http://goo.gl/RjGlmN.
The World Bank. HNP Data Dashboards. [Cited 2015 Jun]. Available from: http://goo.gl/XnOl24.
Gutiérrez-Álvarez AM, Vélez-van Meerbeke A, Venegas-Mariño MA. Proceso clínico-administrativo para el diagnóstico de los pacientes con SAHOS: duración y costos. Acta Neurol Colomb. 2006;22:12-24.
Ministerio de Salud y Protección Social, Colciencias. Guía de práctica clínica para el Síndrome Coronario Agudo. 2nd ed. Bogotá D.C.: MinSalud; 2013.
Ministerio de Salud y Protección Social, Colciencias. Guía de práctica clínica para Hipertensión arterial primaria (HTA). Bogotá D.C. MinSalud; 2013.
Pagel JF. Obstructive Sleep Apnea (OSA) in Primary Care: Evidence-based Practice. J Am Board Fam Med. 2007;20(4):392-8. http://doi.org/fjkjrn.
McDaid C, Griffin S, Weatherly H, Durée K, van der Burgt M, van Hout S, et al. Continuous positive airway pressure devices for the treatment of obstructive sleep apnoea–hypopnea syndrome: a systematic review and economic analysis. Health Technol Assess. 2009;3(4):iii-iv, xi-xiv. http://doi.org/bmqb.
Torre-Bouscoulet L, Castorena-Maldonado A, Meza-Vargas MS. Otras consecuencias de los trastornos del dormir. A propósito de los accidentes vehiculares. Rev. Inst. Nal. Enf. Resp. Méx. 2005;18(2):162-9.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Natalia Londoño-Palacio. (2017). Primer consenso colombiano del síndrome de apnea hipopnea obstructiva del sueño (SAHOS). Revista de la Facultad de Medicina, 65(1Sup), p.7. https://doi.org/10.15446/revfacmed.v65n1Sup.60334.
2. Oscar Bedoya, Santiago Rodríguez, Jenny Patricia Muñoz, Jared Agudelo. (2024). Application of Machine Learning Techniques for the Diagnosis of Obstructive Sleep Apnea/Hypopnea Syndrome. Life, 14(5), p.587. https://doi.org/10.3390/life14050587.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2017 Revista de la Facultad de Medicina

Esta obra está bajo una licencia Creative Commons Reconocimiento 3.0 Unported.
-





















