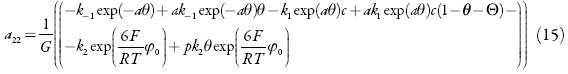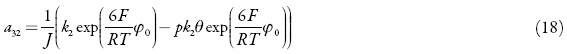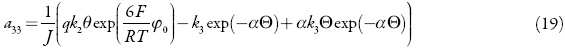Eletrossíntese de anestesina. Uma descrição matemática
Eletrossíntese de anestesina. Uma descrição matemática
DOI:
https://doi.org/10.15446/rcciquifa.v45n2.59937Palabras clave:
Anestesina, eletrossíntese catódica, eletrossíntese anódica, oscilações eletroquímicas, estado estacionário estável (pt)
Uma rota eletroquímica de eletrossíntese de anestesina (benzocaína), incluindo
uma etapa anódica e uma catódica, foi avaliada, do ponto de vista mecanístico. Para
tal, dois modelos matemáticos para cada passo foram desenvolvidos e analisados,
mediante a teoria de estabilidade linear e a análise de bifurcações. Foram demonstradas
as diferenças na pH-dependência da cinética de cada passo, bem como as diferenças nas
condições de estabilidade do estado estacionário para ambas as etapas.
A possibilidade do comportamento oscilatórioe do monotônico também foi avaliada.
uma etapa anódica e uma catódica, foi avaliada, do ponto de vista mecanístico. Para
tal, dois modelos matemáticos para cada passo foram desenvolvidos e analisados,
mediante a teoria de estabilidade linear e a análise de bifurcações. Foram demonstradas
as diferenças na pH-dependência da cinética de cada passo, bem como as diferenças
nas condições de estabilidade do estado estacionário para ambas as etapas. A
possibilidade do comportamento oscilatório e do monotônico também foi avaliada.
https://doi.org/10.15446/rcciquifa.v45n2.59937
Eletrossíntese de anestesina. Uma descrição matemática
Anesthesyne electrosynthesis. A mathematical description
Volodymyr V. Tkach1,2*, Sílvio C. de Oliveira2, Reza Ojani3, Olena I. Aksimentyeva4 Olga Yelenich1, Petró I. Yagodynets'1
1 Universidade Nacional de Chernivtsi, 58012, Rua de Kotsyubyns'ky., 2, Chernivtsi, Ucrânia
2 Universidade Federal de Mato Grosso do Sul, Av. Sem. Felinto. Müller, 1555, C/P. 549, 79074-460, Campo Grande, MS, Brasil
3 Universidade de Mazandarã, 47416-95447, 3o km. Rodovia de Forças Aéreas Iranianas, Babolsar, República Islâmica do Irã
4 Universidade Nacional de L'viv, 79005, Rua de Kyryl e Mefodiy., 6, L'viv, Ucrânia
* Correio eletrônico: nightwatcher2401@gmail.com
Recebido em: 01 de novembro de 2015 Aceito em: 02 de maio de 2016
Resumo
Uma rota eletroquímica de eletrossíntese de anestesina (benzocaína), incluindo uma etapa anódica e uma catódica, foi avaliada, do ponto de vista mecanístico. Para tal, dois modelos matemáticos para cada passo foram desenvolvidos e analisados, mediante a teoria de estabilidade linear e a análise de bifurcações. Foram demonstradas as diferenças na pH-dependência da cinética de cada passo, bem como as diferenças nas condições de estabilidade do estado estacionário para ambas as etapas. A possibilidade do comportamento oscilatório e do monotônico também foi avaliada.
Palavras-chave: Anestesina, eletrossíntese catódica, eletrossíntese anódica, oscilações.
Summary
An electrochemical route for anesthesyne (benzocaine) electrosynthesis, including one anodic and one cathodic step was mechanistically evaluated. For that purpose, two mathematical models for each step were developed and analyzed, by means of linear stability theory and bifurcation analysis. The differences of pH-dependences of the kinetics of each step, like also in steady-state stability conditions, were investigated for both stages. The possibility for the oscillatory and monotonic behavior was also evaluated.
Keywords: Anesthesyne, cathodical electrosynthesis, anodic electrosynthesis, electrochemical oscillations, stable steady-state.
Introdução
Anestesina, ou benzocaína [1, 2], isto é, etil-p-aminobenzoato, é um fármaco, amplamente usado como analgético.
A anastesina é um composto derivado de compostos eletroativos (anilina e p-nitrotolueno). Destarte, além de várias metodologias de síntese química [3], a eletrossíntese, frequentemente usada para a obtenção, controle de produção e análise de vários fármacos e outras substâncias biologicamente ativas [4–10], também pode ser aplicada para a sua obtenção [11]. Em alguns casos, [12, 13] a eletrossíntese pode não ter analogias químicas.
Apesar de ter adquirido uma significância, o desenvolvimento da eletrossíntese de fármacos ainda enfrenta vários problemas como:
-a indecisão acerca do mecanismo mais provável da sua realização, inclusive a diferença de mecanismo;
-a possibilidade de ocorrência das instabilidades eletroquímicas (oscilatória e monotônica) durante a eletrooxidação (eletrorredução) de pequenas moléculas orgânicas ([14–22], inclusive a eletropolimerização de compostos heterocíclicos) e hidrogênio;
-a necessidade de escolha e adaptação de certas metodologias para cada meio (por exemplo, no caso da eletropolimerização anódica, os meios neutro e alcalino são mais convenientes e no caso da eletrodeposição catódica, o mais conveniente é o meio ácido).
Para a resolução dos mencionados problemas, o desenvolvimento de um modelo matemático, capaz de descrever adequadamente o comportamento do sistema, é indispensável como parte da investigação mecanística, haja vista que dá um fundamento rígido teórico, de que carecem as investigações semiempíricas experimentais. Isto lhe permite dar explicações, teoricamente fundamentadas, às instabilidades eletroquímicas, cuja ocorrência é provável [14–22]. Outrossim, a modelagem permite comparar o comportamento do sistema concreto com o dos análogos, sem ensaios experimentais e ainda prever o comportamento dos sistemas, ainda não observados experimentalmente.
Destarte, o objetivo geral do nosso trabalho será a investigação mecanística teórica da eletrossíntese de anestesina, partindo de p-nitrotolueno. A realização deste objetivo geral inclui a realização dos seguintes objetivos específicos: desenvolvimento e análise de modelos matemáticos, correspondentes aos passos anódico e catódico da eletrossíntese [11] do fármaco, comparação do comportamento do sistema com o dos análogos, descritos em [23–35].
Seção i. de p-nitrotolueno ao p-nitrobenzoato de etila. o seistema e o seu modelo
Conforme o trabalho [11], na primeira etapa da eletrossíntese, ocorre um processo anódico da eletrooxidação de p-nitrotolueno para formar o ácido p-nitrobenzênico, seguida pela formação do éster do ácido, conforme:
Haja vista a presença do grupo nitrila, que é aceptor de elétrons, o potencial da eletrossíntese é muito alto (+1,6 V) [11] e o processo inclui a formação de dois compostos preliminares -o álcool p-nitrobenzílico e p-nitrobenzaldeído, cuja formação foi confirmada por dados dos espectros RMN e IV [11].
Como a reação é realizada em solução alcoólica e, também, haja vista a alta velocidade de adsorção de compostos aromáticos (carbo e heterocíclicos), o processo inclui a etapa de adsorção de p-nitrotolueno sobre o ânodo e, destarte, no modelo matemático, introduzir-se-ão as três variáveis:
c – a concentração de p-nitrotolueno na camada pré-superficial;
θ – o grau de recobrimento de p-nitrotolueno na supefície do ânodo;
Θ – o grau de recobrimento do ácido não esterificado.
A fim de simplificar o modelo, evitando a aparição de equações diferenciais em derivadas parciais de segunda ordem, supomos que o eletrólito esteja agitando-se intensamente (destarte é possível menosprezar a influência do fluxo de convecção), que o eletrólito de suporte esteja em excesso (o que possibilita o menosprezo das influências do fluxo de migração). Também é suposto que o perfil concentracional das substâncias seja lineal e a espessura da camada constante e igual a δ.
O p-nitrotolueno entra na camada pré-superficial por meio da sua difusão e, também por meio da dessorção, deixando a camada durante a adsorção. Nesta ordem de idéias, a equação de balanço da sua concentração descrever-se-á como:
em que D é coeficiente de difusão, c0, a concentração de p-nitrotolueno no interior da solução, r1 e r-1 são velocidades de adsorção e dessorção, correspondentemente.
O p-nitrotolueno entra na superfície do ânodo por meio da adsorção e desaparece, mediante a sua dessorção. Ele também é oxidado, formando o ácido p-nitrobenzênico. Por conseguinte, a equação de balanço da sua concentração superficial, obter-se-á sob a forma de:
em que G é a concentração máxima superficial do nitrocomposto e r2, a velocidade da sua concentração.
O ácido p-nitrobenzênico é formado como produto final da eletrooxidação de p-nitrotolueno e reage com o etanol (solvente), formando o éster. Como o ácido p-nitrobenzênico é mais forte que o benzênico, a esterificação, no caso daquele, ocorre de maneira mais rápida que no caso deste. Por outro lado, no trabalho [11] se utilizam os elétrodos de platina e cobre e, destarte, a salinização (com a dissolução anódica) não é possível. Posto assim, a equação de balanço da concentração superficial do ácido, ver-se-á como:
Sendo J a concentração superficial máxima do ácido e r3, a velocidade de esterificação.
As velocidades dos respectivos processos podem ser calculadas como:
em que os parâmetros k são constantes de velocidades de respectivos processos, o parâmetro a descreve a interação entre as partículas na superfície, F é o número de Faraday, R, a constante universal de gases e T, a temperatura absoluta do vaso.
Como se vê, é um sistema clássico de eletrooxidação de um composto orgânico, cujo produto é transformado num composto solúvel, com o comportamento, parecido ao descrito em [23–35]. As características especiais deste sistema e as diferenças do seu comportamento, quando comparado com o dos análogos, discutir-se-ão abaixo:
Resultados e discussão (seção I)
Para investigar o comportamento do sistema com a primeira etapa da eletrossíntese da anestesina, vamos analisar o conjunto de equações diferenciais (3–5), mediante a teoria de estabilidade linear. A matriz funcional de Jacobi, cujos elementos são calculados para o estado estacionário, descrever-se-á como:
em que:
Pode-se ver que o comportamento oscilatório, neste sistema, é possível, porque se podem satisfazer as condições da bifurcação de Hopf. Estas condições requerem a presença de elementos positivos na diagonal principal do Jacobiano.
Como se pode ver, há elementos positivos ak-1exp( –αθ)θ e ak1exp(aθ)c(1-θ-Θ), que descrevem o (característico para outros sistemas análogos [23–35]) comportamento oscilatório, causado pela atração de partículas do nitrocomposto. Mas, contrariamente aos trabalhos [23–35], não é o único tipo de atração entre as partículas adsorvidas que pode levar à aparição das oscilações em corrente (no modo potenciostático). O elemento αk3Θexp(−αΘ), que descreve a interação entre as partículas do ácido durante a esterificação, também é positivo e, destarte, responsável pelo comportamento oscilatório.
Também, há, neste sistema, elementos positivos, correspondentes ao comportamento oscilatório, causado pelas influências do processo eletroquímico na dupla camada elétrica (DCE). São  em que p e q são parâmetros que descrevem as influências dos processos eletroquímicos na estrutura da DCE. Tais influências também são características para os sistemas análogos [23–35].
em que p e q são parâmetros que descrevem as influências dos processos eletroquímicos na estrutura da DCE. Tais influências também são características para os sistemas análogos [23–35].
Conclui-se, assim, que o comportamento oscilatório, neste sistema, é possível, sendo mais provável que no caso de uma eletrooxidação comum de um composto orgânico, haja vista a solubilização do éster.
Aplicando ao conjunto de equações diferenciais (3–5) o critério de Routh e Hurwitz, obter-se-á o requisito de estabilidade do estado estacionário. Para evitar a aparição de expressões grandes, introduzimos as novas variáveis, de modo que o determinante de Jacobiano se descreve como:
Abrindo os parênteses e resolvendo a inequação Det J<0, obter-se-á a condição de estabilidade sob a forma:
A condição (21) satisfar-se-á com certeza, se as variáveis Λ, Υ tiverem valor negativo e Ω e Π, valor positivo, o que acontece, quando os parâmetros α, p e q têm valores negativos, ou nulos o que descreve a repulsão de partículas adsorvidas e a fraqueza das influências do processo eletroquímico na DEL, o que, diga-se a verdade, já foi observado na maioria dos sistemas análogos [23–35]. Satisfeita a condição (21), tratar-se-á de um sistema, cujo comportamento se definirá por difusão do nitrocomposto.
Quando as influências estabilizadoras são iguais às estabilizadoras, a inequação (21) transforma-se em equação e se realiza a instabilidade monotônica, que define a margem entre os estados estacionários estáveis e instáveis. Tal instabilidade se revela na aparição de um trecho N-formado no voltamperograma.
Em tal ponto, coexistem vários estados estacionários, cada um instável. Eles se destroem, quando as condições do comportamento do sistema se alteram.
No caso de o ânodo ser ativo na reação com ácidos, alterar-se-á o comportamento do sistema e adicionar-se-lhe-á mais um fator do comportamento oscilatório, que é a interação das partículas durante a salinização do ácido. Outrossim, como esta reação corre mais rápido que a esterificação, a estabilidade de estado estacionário perderá a sua eficiência para a eletrossíntese do fármaco, o que justifica a escolha de um ânodo inerte (platina).
Um sistema, análogo a este, pode se observar durante a eletrossíntese de polímeros condutores em seguintes condições:
-eletrossíntese de polímeros condutores ácidos em meio neutro sobre metais ativos (salinificação é responsável pela dissolução);
-eletrossíntese de polímeros condutores autodopados (que se solubilizam);
-eletrossíntese de polímeros condutores, modificados por grupos dos éteres de coroa, na presença dos compostos de metais de transição (em cuja presença se formará um complexo).
Conclusões (seção I)
Da análise da etapa anódica da eletrossíntese do fármaco, pode-se concluir que:
-nela, trata-se de um sistema de eletrooxidação de um composto orgânico, cujo produto é, posteriormente, modificado por uma reação química;
-sendo satisfeitas as condições principais do estado estacionário (repulsão de partículas adsorvidas e fraqueza das influências da reação eletroquímica na DCE), o processo reger-se-á pela difusão do nitrocomposto;
-o comportamento oscilatório, como num sistema comum de eletrooxidação de um composto orgânico, é possível por causa da atração de partículas adsorvidas, bem como por conta das influências da reação eletroquímica na DCE. Sem embargo, a atração de partículas pode acontecer, além do processo de adsorção e dessorção, também durante a esterificação.
Seção II. do éster ao fármaco. análogo eletroquímico da reação de zínin. o sistema e o modelo
A famosa redução de nitrobenzeno em anilina foi descoberta em 1842, pelo químico russo N.N. Zínin [36]. Posteriormente se realizou o análogo eletroquímico desta reação [37].
A segunda etapa da eletrossíntese do fármaco anestesina é catódica e se dá no cátodo de cobre (que impede a "evolução" de hidrogênio), conforme a equação:
A eletrorredução mais profunda (até o álcool p-aminobenzílico e etanol) se dá em potenciais catódicos mais baixos e em soluções mais ácidas.
Para fazer uma análise de estabilidade durante a transformação do éster em fármaco, introduzimos as três variáveis:
Assim, o sistema com a eletrossíntese descrever-se-á com um conjunto de três equações diferenciais, apresentado como:ε – a concentração do éster na camada pré-superficial;
η – o grau de recobrimento da superfície do cátodo pelo éster inicial;
H – a concentração dos prótons na camada pré-superficial, supondo o suposto acima.
em que as velocidades dos respectivos processos obterão os valores de:
Trata-se, neste caso, de mais um sistema que tem análogos – a eletropolimerização catódica direta de um composto orgânico [38], a eletrodeposição catódica de polímero condutor, após a in situ geração de partículas oxidantes no cátodo [39], e processos eletroquímicos que se empregam na determinação da concentração de nitrito [40–42]. Os detalhes comuns e diferentes deste processo com os mencionados discutir-se-ão abaixo.
Resultados e discussão (seção II)
Analisamos o conjunto de equações diferenciais (23) mediante a teoria de estabilidade linear. A matriz funcional de Jacobi, cujos elementos são calculados para o estado esta cionário, ver-se-á como:
em que:
Como se pode ver, neste caso o comportamento oscilatório pode acontecer e, ainda por cima, ele é mais provável neste sistema que nos processos catódicos análogos [38–42], haja vista a interação atrativa das partículas durante a solubilização do fármaco (amina) na solução ácida. É porque, além dos elementos positivos, relativos à interação das partículas adsorvidas durante a adsorção e dessorção, bem como dos relativos às influências da eletrorredução na DCE, existe mais um elemento  , relativo à interação de partículas adsorvidas durante a solubilização do fármaco.
, relativo à interação de partículas adsorvidas durante a solubilização do fármaco.
A análise de estabilidade do estado estacionário, feita conforme foi descrito na seção I, pode mostrar que o processo se regerá por difusão: tanto do éster, como dos prótons. O decrescimento do pH, como nos casos dos processos [38–42], favorecerá a estabilidade do estado estacionário, contrariamente aos sistemas com a eletrooxidação anódica [23–35].
No caso da evolução de hidrogênio, a eletrorredução de prótons terá a sua própria influência (negativa) no processo da eletrorredução do éster. Como a difusão dos prótons é mais rápida que a do éster, ocupar-se-ão os sítios ativos de adsorção do éster, o que prejudicará a eficiência da eletrossíntese, pois então a eletrorredução irá ao segundo plano. Destarte, o uso do cátodo de cobre é justificado.
Conclusões (seção II)
A análise de modelo da eletrorredução do éster, rendendo o fármaco anestesina mostra que:
-neste caso, o comportamento oscilatório é mais provável que nos processos catódicos análogos, haja vista a solubilização do fármaco em soluções ácidas;
-o decrescimento do pH é favorável à eletrossíntese de fármaco, pois os prótons participam da reação;
-no caso da evolução de hidrogênio, prejudicar-se-á a eletrossíntese, haja vista a ocupação dos sítios ativos da reação.
Conflito de interesses
Os autores declaram que não há conflito de interesses.
Referências
1. http://www.cedrosa.com.mx/info/a910.htm, página com informações técnicas, acesso aos 20 de dezembro de 2015.
2. http://www.drugs.com/sfx/benzocaine-topical-side-effects.html, base de dados de fármacos; acesso aos 20 de dezembro de 2015.
3. http://academic.regis.edu/kahrendt/000%202015%20CH%20421/04%20Lab/S2015_CH421_Lab%2004_Synthesis%20of%20Benzocaine_Lab.pdf, Metodologia de síntese; acesso aos 20 de dezembro de 2015.
4. K.R. Mahantesha, B.E. Kumara Swamy, K. Vasantakumar Pai, Poly (alizarin) modified glassy carbon electrode for the electrochemical investigation of omeprazole: A voltammetric study, Anal. Bioanal. Electrochem., 6, 234 (2014).
5. Md.M. Rahman, X.-B. Li, N.S. Lopa et al., Electrochemical DNA hybridization sensors based on conducting polymers, Sensors, 15, 3801 (2015).
6. H. Beitollahi, H. Karimi-Maleh, I. Sheikhoae, Simultaneous voltammetric determination of ascorbic acid and uric acid using a modified multiwalled carbon nanotube paste electrode, Casp. J. Chem., 1, 17 (2012).
7. L.H. de Oliveira, A.C. Dias Souza, L. Pizzuti et al., Determinação voltamétrica do antioxidante galato de propila em biodiesel empregando eletrodos de pasta de carbono modificados com líquido iônico, Orbital. Elec. J. Chem., 6, 255 (2014).
8. J.B. Raoof, A. Kiani, R. Ojani, R. Valliolahi, Electrochemical determination of dopamine using banana-MWCNTs modified carbon paste electrode, Anal. Bioanal. Electrochem., 3, 59 (2011).
9. S.C.B. Oliveira, C.H.S. Mendes, F.F.S. Filho et al., Electrochemical oxidation mechanism of procarbazine at glassy carbon electrode, J. Electroanal. Chem., 746, 51 (2015).
10. J.I. Gowda, S.T. Nandibewoor, Carbon paste sensor for the determination of an anticancer drug paclitaxel in pharmaceuticals and biological fluids, Anal. Bioanal. Electrochem., 7, 539 (2015).
11. Ш.Ш. Хидиров, З.М. Магомедова, М.А. Ахмедов, Кр.Н. Ашурбекова, Идентификация продуктов анодных и катодных реакций процесса электросинтеза анестезина Вестн. ДГУ. Химия., 30, 60 (2015), publicação em russo.
12. L.K. Sharma, S. Kumar, S. Singh, R.K.P. Singh, Electrochemical synthesis of 5-substituted-2-amino (substituted amino)-1,3,4-oxadiazoles at the platinum electrode, Russian J. Electrochem., 46, 37 (2010).
13. S. Singh, S. Kumar, L.K. Sharma, R.P.K. Singh, A novel electroorganic synthesis of some 2-amino -5-substituted-1,3,4-oxadiazoles at the platinum electrode, J. Indian Chem. Soc., 86, 734 (2009).
14. L. Hudson, M.R. Bassett, Oscillatory electrodissolution of metals, Rev. Chem. Eng., 7, 108 (1991).
15. M. Pagitsas, S. Dimitra, The improved Franck-FitzHugh model for the electrodissolution of iron in sulphuric acid solutions: linear stability and bifurcation analysis. Derivation of the kinetic equations for the forced Franck-FitzHugh model, Electrochimica Acta, 36, 1301 (1991).
16. A.J. Pearlstein, J.A. Johnson, Global and conditional stability of the steady and periodic solutions of the Franck-FitzHugh model of electrodissolution of Fe in H2 SO4, J. Electrochem. Soc., 136, 1290 (1991).
17. I. Das, N.R. Agrawal, S.A. Ansari, S.K. Gupta, Pattern formation and oscillatory polymerization of thiophene, Ind. J. Chem., 47, 1798 (2008).
18. S.U. Rahman, M.S. Ba-Shammakh, Thermal effects on the process of electropolymerization of pyrrole on mild steel, Synth. Met., 140, 207 (2004).
19. A.S. Liu, M.A.S. Oliveira, Electrodeposition of polypyrrole films on aluminium from tartrate aqueous solution, J. Braz. Chem Soc., 18, 143 (2007).
20. D. Sazou, The dynamic behavior of the electrochemical polymerization of indole in acetonitrile - water mixtures, Synth. Met., 130, 45 (2002).
21. M. Bazzaoui, E.A. Bazzaoui, L. Martins, J.I. Martins, Electropolymerization of pyrrole on zinc-lead-silver alloys' electrodes in neutral and acid organic media, Synth. Met., 130, 73 (2002).
22. I. Das, N. Goel, S.K. Gupta, N.R. Agrawal, Electropolymerization of pyrrole: Dendrimers, nano-sized patterns and oscillations in potential in presence of aromatic and aliphatic surfactants, J. Electroanal. Chem., 670, 1 (2012).
23. V.V. Tkach, V.V. Nechyporuk, P.I. Yagodynets', Descripción matemática de la síntesis electroquímica de polímeros conductores en la presencia de surfactantes, Avanc. Quím., 8, 9 (2013).
24. V.V. Tkach, V.V. Nechyporuk, P.I. Yagodynets', The "Polythiophene Paradox". The phenomenon and its mathematical description, Quím. Bras., 7, 59 (2013).
25. V. Tkach, V. Nechyporuk, P. Yagodynets', Eletropolimerização dos compostos heterocíclicos. Modelos matemáticos, Cienc. Tecn. Mat., 24, 54 (2012).
26. V. Tkach, V. Nechyporuk, P. Yagodynets', O estudo de estabilidade do processo da eletropolimerização de pirróis N-substituídos, Proc. Quím., 8, 49 (2014).
27. B. Ткач, В. Нечипорук, П. Ягодинец и др., Математическое описание электрополимеризации электрохимически модифицированных мономеров в гальваностатическом режиме, Журн. Сиб. Фед. Унив. Хим., 7, 403 (2014), em russo.
28. V. Tkach, V. Nechyporuk, P. Yagodynets, Estudio matemático de las condiciones de estabilidad en la polimerización electroquímica de compuestos heterocíclicos en presencia de oxidantes, Afinidad, 70, 73 (2013).
29. V. Tkach, R. Ojani, V. Nechyporuk et al., Cathodic and anodic potentiostatic polypyrrole electrodeposition in strongly acid media. Theoretical and experimental comparison, Bulg. Chem. Comm., 48, 126 (2016).
30. V. Tkach, V. Nechyporuk, P. Yagodynets', The mathematical description for the electropolymerization of furan, pyrrole and thiophene derivatives in alkaline media, Med. J. Chem., 3, 1122 (2015).
31. V. Tkach, V. Nechyporuk, P. Yagodynets', As eletropolimerizações galvanostática e potenciodinâmica dos compostos heterocíclicos e a sua descrição matemática, Tecn. Met. Mat. Min., 10, 249 (2013).
32. V. Tkach, V. Nechyporuk, As causas do comportamento oscilatório de sistemas eletroquímicos devido de imobilização de substâncias diferentes através da polimerização eletroquímica de combinações heterocíclicas, Eclet. Quím., 37, 68 (2012).
33. V. Tkach, S.C. de Oliveira, O.I. Aksimentyeva et al., The mathematical modeling for the electropolymerization of acid derivatives of heterocyclic compounds over active metals, Mor. J. Chem., 3, 550 (2015).
34. V. Tkach, B. Kumara Swamy, R. Ojani et al., O comportamento de paracetamol durante a sua oxidação eletrocatalítica sobre poli(azul da anilina) e a sua descrição matemática, Rev. Colomb. Cienc. Quím. Farm., 44, 148 (2015).
35. V. Tkach, B. Kumara Swamy, R. Ojani et al., El Mecanismo de la oxidación de omeprazol sobre el electrodo de carbono vitroso, modificado por polializarina, y su descripción matemática, Orbital Elec. J. Chem., 7, 1 (2015).
36. http://202.127.145.151/ReferenceBook/OrganicReaction/V20.PDF - Base de dados das reações nominais de química orgânica.
37. S.G. Mayranovskiy, "Electrosynthesis of monomers", Nauka, Moscow, 1980, 330 p.
38. V. Tkach, V. Nechyporuk, P. Yagodynets', M. Hryhoryak, A investigação do comportamento eletroquímico durante a síntese eletroredutiva de polímeros condutores na presença de catiões dos metais, Cienc. Tecn. Mat., 24, 50 (2012).
39. Y. Jung, N. Singh, K. Sh. Choi, Cathodic deposition of polypyrrole enabling the one-step assembly of metal-polymer hybrid electrodes, Angew. Chem. Int. Ed., 48, 8331 (2009).
40. R. Ojani, J.B. Raoof, V. Rahemi, A simple and efficient electrochemical sensor for electrocatalytic reduction of nitrite, based on poly(4-aminoacetanilide), J. Chin. Chem. Soc., 58, 247 (2011).
41. L.A.P. Filho, R.M. Takeuchi, M.A.G. Trindade, A.L. Santos, Determinação voltamétrica de nitrito empregando o íon [Fe(CN)6]3-como mediador eletroquímico, Orbital Elec. J. Chem., 7, 10 (2015).
42. V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets', O estudo matemático do desempenho do sensor eletroquímico de nitrito, baseado em poli(p-aminoacetanilida, Rev. Fac. Ing. UCV, 30, 65 (2015).
Como citar este artigo
V.V. Tkach, S.C. de Oliveira, R. Ojani, O. I. Aksimentyeva, O. Yelenich, P.I. Yagodynets', Eletrossíntese de anestesina. Uma descrição matemática, Rev. Colomb. Cienc. Quím. Farm., 45(2), 219-233 (2016).
Referencias
(1) http://www.cedrosa.com.mx/info/a910.html acesso aos 20 de dezembro de 2015.
(2) http://www.drugs.com/sfx/benzocaine-topical-side-effects.html/ , base de dados de farmacos; acesso aos 20 de dezembro de 2015.
(3) http://academic.regis.edu/kahrendt/000%202015%20CH%20421/04%20
Lab/S2015_CH421_Lab%2004_Synthesis%20of%20Benzocaine_Lab.pdf ,
Metodologia de sintese; acesso aos 20 de dezembro de 2015.
(4) K.R. Mahantesha, B.E. Kumara Swamy, K. Vasantakumar Pai, Poly (alizarin)
modified glassy carbon electrode for the electrochemical investigation of omeprazole:
A voltammetric study, Anal. Bioanal. Electrochem., 6, 234 (2014).
(5) Md.M. Rahman, X.-B. Li, N.S. Lopa et al., Electrochemical DNA hybridization
sensors based on conducting polymers, Sensors, 15, 3801 (2015).
(6) H. Beitollahi, H. Karimi-Maleh, I. Sheikhoae, Simultaneous voltammetric determination
of ascorbic acid and uric acid using a modified multiwalled carbon nanotube paste electrode, Casp. J. Chem., 1, 17 (2012).
(7) L.H. de Oliveira, A.C. Dias Souza, L. Pizzuti et al., Determinacao voltametrica
do antioxidante galato de propila em biodiesel empregando eletrodos de pasta de
carbono modificados com liquido ionico, Orbital. Elec. J. Chem., 6, 255 (2014).
(8) J.B. Raoof, A. Kiani, R. Ojani, R. Valliolahi, Electrochemical determination of
dopamine using banana-MWCNTs modified carbon paste electrode, Anal. Bioanal.
Electrochem., 3, 59 (2011).
(9) S.C.B. Oliveira, C.H.S. Mendes, F.F.S. Filho et al., Electrochemical oxidation
mechanism of procarbazine at glassy carbon electrode, J. Electroanal. Chem., 746,
(2015).
(10) J.I. Gowda, S.T. Nandibewoor, Carbon paste sensor for the determination of an
anticancer drug paclitaxel in pharmaceuticals and biological fluids, Anal. Bioanal.
Electrochem., 7, 539 (2015).
(11) Ш.Ш. Хидиров, З.М. Магомедова, М.А. Ахмедов, Кр.Н. Ашурбекова, Идентификация продуктов анодных и катодных реакций процесса электросинтеза анестезина Вестн. ДГУ. Химия., 30, 60 (2015), publicacao em russo.
(12) L.K. Sharma, S. Kumar, S. Singh, R.K.P. Singh, Electrochemical synthesis of 5-substituted-2-amino (substituted amino)-1,3,4-oxadiazoles at the platinum electrode, Russian J. Electrochem., 46, 37 (2010).
(13) S. Singh, S. Kumar, L.K. Sharma, R.P.K. Singh, A novel electroorganic synthesis of some 2-amino -5-substituted-1,3,4-oxadiazoles at the platinum electrode, J. Indian Chem. Soc., 86, 734 (2009).
(14) L. Hudson, M.R. Bassett, Oscillatory electrodissolution of metals, Rev. Chem. Eng., 7, 108 (1991).
(15) M. Pagitsas, S. Dimitra, The improved Franck—FitzHugh model for the electrodissolution of iron in sulphuric acid solutions: linear stability and bifurcation analysis. Derivation of the kinetic equations for the forced Franck—FitzHugh model, Electrochimica Acta, 36, 1301 (1991).
(16) A.J. Pearlstein, J.A. Johnson, Global and conditional stability of the steady and periodic solutions of the Franck–FitzHugh model of electrodissolution of Fe in H2 SO4, J. Electrochem. Soc., 136, 1290 (1991).
(17) I. Das, N.R. Agrawal, S.A. Ansari, S.K. Gupta, Pattern formation and oscillatory polymerization of thiophene, Ind. J. Chem., 47, 1798 (2008).
(18) S.U. Rahman, M.S. Ba-Shammakh, Thermal effects on the process of electropolymerization of pyrrole on mild steel, Synth. Met., 140, 207 (2004).
(19) A.S. Liu, M.A.S. Oliveira, Electrodeposition of polypyrrole films on aluminium from tartrate aqueous solution, J. Braz. Chem Soc., 18, 143 (2007).
(20) D. Sazou, The dynamic behavior of the electrochemical polymerization of indole in acetonitrile – water mixtures, Synth. Met., 130, 45 (2002).
(21) M. Bazzaoui, E.A. Bazzaoui, L. Martins, J.I. Martins, Electropolymerization of pyrrole on zinc-lead-silver alloys’ electrodes in neutral and acid organic media, Synth. Met., 130, 73 (2002).
(22) I. Das, N. Goel, S.K. Gupta, N.R. Agrawal, Electropolymerization of pyrrole: Dendrimers, nano-sized patterns and oscillations in potential in presence of aromatic and aliphatic surfactants, J. Electroanal. Chem., 670, 1 (2012).
(23) V.V. Tkach, V.V. Nechyporuk, P.I. Yagodynets’, Descripcion matematica de la
sintesis electroquimica de polimeros conductores en la presencia de surfactantes,
Avanc. Quim., 8, 9 (2013).
(24) V.V. Tkach, V.V. Nechyporuk, P.I. Yagodynets’, The “Polythiophene Paradox”.
The phenomenon and its mathematical description, Quim. Bras., 7, 59 (2013).
(25) V. Tkach, V. Nechyporuk, P. Yagodynets´, Eletropolimerizacao dos compostos heterociclicos. Modelos matematicos, Cienc. Tecn. Mat., 24, 54 (2012).
(26) V. Tkach, V. Nechyporuk, P. Yagodynets´, O estudo de estabilidade do processo da eletropolimerizacao de pirrois N-substituidos, Proc. Quim., 8, 49 (2014).
(27) В. Ткач, В. Нечипорук, П. Ягодинец и др., Математическое описание
электрополимеризации электрохимически модифицированных мономеров
в гальваностатическом режиме, Журн. Сиб. Фед. Унив. Хим., 7, 403 (2014),
em ruso.
(28) V. Tkach, V. Nechyporuk, P. Yagodynets, Estudio matematico de las condiciones de estabilidad en la polimerizacion electroquimica de compuestos heterocíclicos en presencia de oxidantes, Afinidad, 70, 73 (2013).
(29) V. Tkach, R. Ojani, V. Nechyporuk et al., Cathodic and anodic potentiostatic
polypyrrole electrodeposition in strongly acid media. Theoretical and experimental
comparison, Bulg. Chem. Comm., 48, 126 (2016).
(30) V. Tkach, V. Nechyporuk, P. Yagodynets´, The mathematical description for the
electropolymerization of furan, pyrrole and thiophene derivatives in alkaline
media, Med. J. Chem., 3, 1122 (2015).
(31) V. Tkach, V. Nechyporuk, P. Yagodynets´, As eletropolimerizacoes galvanostatica e potenciodinamica dos compostos heterociclicos e a sua descricao matematica, Tecn. Met. Mat. Min., 10, 249 (2013).
(32) V. Tkach, V. Nechyporuk, As causas do comportamento oscilatorio de sistemas
eletroquimicos devido de imobilizacao de substancias diferentes atraves da polimerização eletroquimica de combinacoes heterociclicas, Eclet. Quim., 37, 68 (2012).
(33) V. Tkach, S.C. de Oliveira, O.I. Aksimentyeva et al., The mathematical modeling
for the electropolymerization of acid derivatives of heterocyclic compounds over
active metals, Mor. J. Chem., 3, 550 (2015).
(34) V. Tkach, B. Kumara Swamy, R. Ojani et al., O comportamento de paracetamol durante a sua oxidacao eletrocatalitica sobre poli(azul da anilina) e a sua descrição matematica, Rev. Colomb. Cienc. Quim. Farm., 44, 148 (2015).
(35) V. Tkach, B. Kumara Swamy, R. Ojani et al., El Mecanismo de la oxidacion de
omeprazol sobre el electrodo de carbono vitroso, modificado por polializarina, y
su descripcion matematica, Orbital Elec. J. Chem., 7, 1 (2015).
(36) http://202.127.145.151/ReferenceBook/OrganicReaction/V20.PDF Base de
dados das reacoes nominais de quimica organica.
(37) S.G. Mayranovskiy, “Electrosynthesis of monomers”, Nauka, Moscow, 1980, 330 p.
(38) V. Tkach, V. Nechyporuk, P. Yagodynets´, M. Hryhoryak, A investigacao do comportamento eletroquimico durante a sintese eletroredutiva de polímeros condutores na presenca de catioes dos metais, Cienc. Tecn. Mat., 24, 50 (2012).
(39) Y. Jung, N. Singh, K.-Sh. Choi, Cathodic deposition of polypyrrole enabling the one-step assembly of metal–polymer hybrid electrodes, Angew. Chem. Int. Ed.,
, 8331 (2009).
(40) R. Ojani, J.B. Raoof, V. Rahemi, A simple and efficient electrochemical sensor
for electrocatalytic reduction of nitrite, based on poly(4-aminoacetanilide), J. Chin. Chem. Soc., 58, 247 (2011).
(41) L.A.P. Filho, R.M. Takeuchi, M.A.G. Trindade, A.L. Santos, Determinacao voltametrica de nitrito empregando o ion [Fe(CN)6]3- como mediador eletroquimico, Orbital Elec. J. Chem., 7, 10 (2015).
(42) V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets´, O estudo matematico do
desempenho do sensor eletroquimico de nitrito, baseado em poli(p-aminoacetanilida, Rev. Fac. Ing. UCV, 30, 65 (2015).
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Licencia
Derechos de autor 2016 Revista Colombiana de Ciencias Químico-Farmacéuticas

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
El Departamento de Farmacia de la Facultad de Ciencias de la Universidad Nacional de Colombia autoriza la fotocopia de artículos y textos para fines de uso académico o interno de las instituciones citando la fuente. Las ideas emitidas por los autores son responsabilidad expresa de estos y no de la revista.
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons de Atribución 4.0 aprobada en Colombia. Consulte la normativa en: http://co.creativecommons.org/?page_id=13