Efecto del aceite esencial de Rosmarinus officinalis sobre Porphyromonas gingivalis cultivada in vitro
Effect of essential oil of Rosmarinus officinalis on Porphyromonas gingivalis cultivated in vitro
DOI:
https://doi.org/10.15446/rcciquifa.v45n2.59942Palabras clave:
Rosmarinus officinalis, aceite esencial, Porphyromonas gingivalis (es)Rosmarinus officinalis, essential oil, Porphyromonas gingivalis (en)
El interés por los productos naturales como fuente de agentes antimicrobianos ha
ido en aumento. Estudios previos han demostrado que extractos de plantas pueden
inhibir la proliferación bacteriana en la cavidad oral. El objetivo de este estudio fue
determinar la susceptibilidad in vitro de Porphyromonas gingivalis ATCC 33277
frente al aceite esencial de Rosmarinus officinalis. Para la evaluación de la actividad
antimicrobiana del aceite esencial se utilizó el método cuantitativo de dilución en
agar, descrito por Clinical and Laboratory Standards Institute (CLSI) para bacterias
anaerobias. El aceite esencial de R. officinalis demostró una concentración mínima
inhibitoria (CMI) contra Porphyromonas gingivalis ATCC 33277 de 1000 μg/ml.
Estos resultados sugieren que el aceite esencial podría ser útil como un agente antibacteriano en preparaciones de uso oral.
https://doi.org/10.15446/rcciquifa.v45n2.59942
Efecto del aceite esencial de Rosmarinus officinalis sobre Porphyromonas gingivalis cultivada in vitro
Effect of essential oil of Rosmarinus officinalis on Porphyromonas gingivalis cultivated in vitro
Diego M. Bonilla1, Yulitza Mendoza1, Campo E. Moncada1, Ozkarina Murcia1, Ángela P. Rojas2*, Jairo Calle2†, Roberto Pinzón2**, Lina Nerio2
1 Facultad de Odontología, Universidad Nacional de Colombia, Sede Bogotá, Cra. 30 N. ° 45-03, Bogotá D. C., Colombia.
2 Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá, Cra. 30 N. ° 45-03, Bogotá D. C., Colombia.
* Correo electrónico: aprojasr@unal.edu.co
** Correo electrónico: rpinzons@unal.edu.co
Recibido para evaluación: 23 de diciembre de 2014 Aceptado para publicación: 28 de junio de 2016
Resumen
El interés por los productos naturales como fuente de agentes antimicrobianos ha ido en aumento. Estudios previos han demostrado que extractos de plantas pueden inhibir la proliferación bacteriana en la cavidad oral. El objetivo de este estudio fue determinar la susceptibilidad in vitro de Porphyromonas gingivalis ATCC 33277 frente al aceite esencial de Rosmarinus officinalis. Para la evaluación de la actividad antimicrobiana del aceite esencial se utilizó el método cuantitativo de dilución en agar, descrito por Clinical and Laboratory Standards Institute (CLSI) para bacterias anaerobias. El aceite esencial de R. officinalis demostró una concentración mínima inhibitoria (CMI) contra Porphyromonas gingivalis ATCC 33277 de 1000 μg/ml. Estos resultados sugieren que el aceite esencial podría ser útil como un agente antibacteriano en preparaciones de uso oral.
Palabras clave: Rosmarinus officinalis, aceite esencial, Porphyromonas gingivalis.
Summary
The interest in natural products as a source of antimicrobial agents has been increasing. Previous studies have shown that plant extract may inhibit bacterial growth in the oral cavity. The aim of this study was to determine the in vitro susceptibility of Porphyromonas gingivalis ATCC 33277 against the essential oil of Rosmarinus officinalis. To evaluate the antimicrobial activity of the essential oil, quantitative agar dilution method described by the Clinical and Laboratory Standards Institute (CLSI) for anaerobic bacteria was used. The essential oil of R. officinalis showed a minimum inhibitory concentration (MIC) of 1000 µg/ml against Porphyromonas gingivalis ATCC 33277. These results suggest that essential oil of R. officinalis may be useful as an antibacterial agent in oral preparations.
Keywords: Rosmarinus officinalis, essential oil, Porphyromonas gingivalis.
Introducción
La enfermedad periodontal comprende un grupo de patologías causadas por la acumulación de bacterias, que pueden llegar a comprometer los tejidos que rodean el diente. Existen factores de riesgo que incrementan la enfermedad periodontal como: diabetes mellitus, enfermedades cardiovasculares, embarazo, poca higiene oral y el estrés [1].
Se estima que la diversidad microbiana de la cavidad oral comprende cerca de 500 especies [2]. Los microorganismos más frecuentemente identificados como agentes patógenos periodontales incluyen siete especies anaeróbicas: Porphyromonas gingivalis, Bacteroides forsythus, Treponema denticola, Prevotella intermedia, Fusobacterium nucleatum, Eubacterium, y espiroquetas, y tres especies microaerofílicas: Actinobacillus ctinomycetemcomitans, Campylobacter rectus, y Eikenella corrodens [3]. Se han identificado tres microorganismos: T. forsythia, P. gingivalis y T. denticola, como los patógenos más fuertemente asociados con la enfermedad periodontal severa, por causar sangrado y daño en tejidos [4]. Además de la enfermedad periodontal, P. gingivalis ha demostrado estar relacionada con otras patologías de alta prevalencia como la artritis reumatoidea [5-6] y la aterosclerosis [7].
El tratamiento de la enfermedad periodontal puede ser de tipo quirúrgico o no quirúrgico, conforme a la severidad de la patología. En el segundo caso se opta por un plan de limpieza, tratamiento farmacológico con antibióticos (doxiciclina, metronidazol, amoxicilina–clavulanato de potasio, ciprofloxacina, tetraciclinas o azitromicina) [8] y el uso de enjuagues bucales antisépticos. Los agentes antibacterianos más utilizados en formulaciones antisépticas incluyen: triclosan, peróxido de hidrógeno y aceites esenciales [9].
En la actualidad se ha incrementado el interés por los productos naturales como fuente de agentes antimicrobianos. Estudios anteriores han demostrado el efecto antibacteriano de extractos de plantas y aceites esenciales contra bacterias orales, entre los más utilizados se encuentra el aceite esencial del té verde (Melaleuca alternifolia), el cual ha demostrado actividad antibacteriana contra Streptococcus mutans y Porphyromonas gingivalis, así como el aceite esencial de Artemisia lavandulaefolia que inhibe especialmente, microorganismos anaerobios orales [10]. Una de las plantas más utilizadas de forma empírica es el romero (Rosmarinus officinalis), el cual se usa en el tratamiento de inflamaciones de la boca en forma tópica y como enjuague bucal para la higiene oral; este se utiliza en forma de infusión partiendo de las partes aéreas de la planta.
Varios estudios realizados con el aceite esencial del romero han comprobado su efecto contra microorganismos Gram-negativos, Gram-positivos y microorganismos resistentes. Jiang y colaboradores demostraron la actividad antimicrobiana del aceite esencial de R. officinalis sobre tres bacterias Gram-positivas: Staphylococcus epidermidis, Staphylococcus aureus y Bacillus subtilis; tres bacterias Gram-negativas: Proteus vulgaris, Pseudomonas aeruginosa y Escherichia coli y dos hongos: Candida albicans y Aspergillus niger [11]. Bernardes y colaboradores [12] también demostraron la actividad antibacteriana del aceite contra Streptococcus mutans, S. salivarius, S. sobrinus, S. mitis, S. sanguinis, y Enterococcus faecalis, microorganismos presentes en la cavidad oral.
A pesar de la amplia disponibilidad de antibióticos de uso clínico, aún es indispensable continuar con la búsqueda de nuevos agentes antimicrobianos que permitan el tratamiento contra microorganismos patógenos resistentes. Ardila y colaboradores observaron resistencias a amoxicilina, clindamicina y metronidazol de cepas aisladas de P. gingivalis en pacientes con enfermedad periodontal [13] y Jacinto, al estudiar la sensibilidad de algunos microorganismos anaeróbicos orales encontró que Prevotella intermedia/nigrescens es resistente a la Penicilina G [14]; ambas especies son de importancia en la enfermedad periodontal.
En este estudio se analiza la susceptibilidad in vitro de Porphyromonas gingivalis ATCC 33277 frente al aceite esencial de Rosmarinus officinalis empleando el método cuantitativo de dilución en agar descrito por el Clinical and Laboratory Standards Institute (CLSI) para bacterias anaerobias.
Metodología
Extracción del aceite
El material vegetal fue recolectado de los cultivos existentes en la Facultad de Agronomía de la Universidad Nacional de Colombia para el proyecto Plantas aromáticas. La extracción del aceite esencial de Rosmarinus officinalis se realizó mediante el método de destilación por arrastre con vapor a partir de las hojas de la planta.
Caracterización fisicoquímica
La determinación del índice de refracción se realizó por medio del refractómetro de Abbe AusJENA, la densidad del aceite esencial se obtuvo utilizando un picnómetro de 5 ml y la determinación de la rotación óptica a través de un polarímetro de Laurent. Todas las mediciones fueron realizadas a 22 °C.
Perfíl cromatográfico
Se realizó el perfil cromatográfico del aceite esencial de R. officinalis utilizando cromatografía en capa delgada (CCD) con el fin de identificar qué tipo de compuestos se encuentran en el aceite. Las placas fueron preparadas usando Silicagel 60 (Merck) como fase estacionaria. Se utilizaron dos tipos de fase móvil, tolueno-acetato de etilo 93:7 y cloruro de metileno. La muestra se aplicó a 0,5 cm del solvente en varios puntos de origen y se utilizaron dos tipos de reveladores: vainillina-ácido sulfúrico y anisaldehído-ácido sulfúrico. Para las placas reveladas con vainillina-ácido sulfúrico, se asperjó sobre la placa vainillina al 1% en etanol (solución I) seguida inmediatamente de ácido sulfúrico al 10% en etanol (solución II). Después de calentar a 110 °C por 5 minutos se calculó el factor de retención (Rf ) de las manchas reveladas.
El reactivo anisaldehído-ácido sulfúrico fue preparado con 0,5 ml de anisaldehído mezclado con 10 ml de ácido acético glacial, seguido por 85 ml de metanol y 5 ml de ácido sulfúrico concentrado, en ese orden. Las placas que se revelaron con este reactivo fueron calentadas a 100 °C por 5 minutos después de esparcir el reactivo sobre la placa [15]. Finalmente, se calculó el factor de retención (Rf ) para las manchas de las sustancias separadas.
Actividad antimicrobiana
Cepa bacteriana y condiciones de cultivo
La cepa bacteriana usada fue Porphyromonas gingivalis ATCC 33277, partiendo de un cultivo en fase exponencial de crecimiento. Se utilizó una concentración de microorganismos de 108 UFC/ml que corresponde al tubo N.° 0,5 de la escala de Mc. Farland, adicionando 100 μl del inóculo sin esparcir en el agar Brucella enriquecido. Después de 10 minutos las cajas se incubaron en un medio anaeróbico durante 7 días a una temperatura de 36 ºC empleando una campana hermética y sobres de AnaeroGen (Oxoid®).
Evaluación de la actividad antimicrobiana
La susceptibilidad de Porphyromonas gingivalis se determinó por el método de dilución en agar descrito por el Clinical and Laboratory Standards Institute (CLSI) para bacterias anaerobias [16]. Se realizaron diluciones de aceite esencial de R. officinalis y de metronidazol en etanol 96%, en concentraciones de 12,5 μg /ml a 12000 μg/ml de aceite esencial y de 0,015 μg/ml a 256 μg/ml de metronidazol.
Las diluciones obtenidas fueron inoculadas por triplicado en agar Brucella enriquecido con 5% de sangre, 0,0005 % de Hemina y 0,00005% de Menadiona. Para la determinación de la CMI se tuvo en cuenta la dilución causada por el medio tras agregar el inóculo. Se emplearon controles negativos para descartar posible contaminación del medio y se evaluó el diluyente como blanco.
Determinación de la concentración mínima inhibitoria
La concentración mínima inhibitoria (CMI) fue determinada después del séptimo día de incubación. Para ello se evaluó la concentración de aceite esencial y de metronidazol a la cual no hubo crecimiento aparente del microorganismo en el agar. Una vez determinada la CMI, se realizó una resiembra en medio agar Brucella enriquecido tomando dos concentraciones; una por encima y otra por debajo de la CMI para evaluar el efecto bacteriostático o bactericida del aceite esencial de R. officinalis y del metronidazol sobre P. gingivalis.
Las concentraciones utilizadas para hallar la CMI del metronidazol fueron tomadas de acuerdo al método para la evaluación de la susceptibilidad antimicrobiana de bacterias anaerobias del CLSI [16].
Análisis estadístico
Se utilizó el método de la t-Student para determinar diferencias significativas entre los promedios extremos de las concentraciones de aceite esencial de romero y metronidazol.
Resultados y discusión
Tras la extracción del aceite esencial de Rosmarinus officinalis se obtuvo un rendimiento de 0,67% que se encuentra dentro del rango 0,48 y 1,75% reportado en la literatura para esta especie por Angioni y colaboradores quienes utilizaron el mismo método de extracción [17].
Propiedad Valor
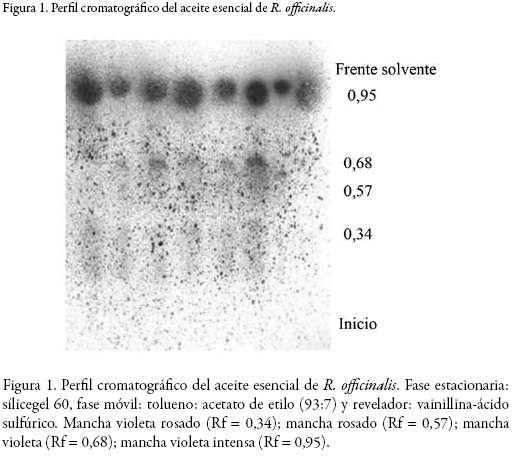
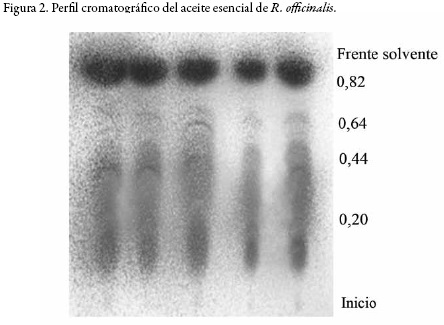
Los resultados de la caracterización se encuentran en la tabla 1, donde se observan propiedades fisicoquímicas útiles en la identificación del aceite esencial de R. officinalis. Con el fin de detectar que tipo de compuestos se encuentran en el aceite esencial, se realizó un perfil cromatográfico utilizando cromatografía en capa delgada (CCD). En la figura 1 se observan las manchas obtenidas utilizando vainillina-ácido sulfúrico como revelador universal para la detección de flavonoides, terpenoides y esteroles [18]; y en la figura 2 se observan las manchas obtenidas utilizando anisaldehido-ácido sulfúrico como revelador, también útil para la detección de terpenoides [19].
Las placas cromatográficas reveladas muestran manchas violetas relacionadas con la presencia de terpenoides en el extracto, los cuales se han reportado en la literatura como los principales componentes del aceite esencial, en especial del tipo monoterpenos. W. Wang y colaboradores evaluaron la composición del aceite esencial de R. officinalis encontrando que entre los 19 compuestos identificados, los principales corresponden los moterpenos 1,8-cineol, alcanfor, canfeno, α-pineno y β-pineno [20].
En otro estudio realizado por S. Santoyo y colaboradores se identificaron 33 compuestos del aceite esencial extraído con fluídos supercríticos de los cuales el 80% del aceite lo constituían los monoterpenos α-pineno, 1,8-cineol, alcanfor, verbenona y borneol [21]. Los resultados de las placas cromatográficas muestran la presencia de terpenoides a los cuales se le atribuye las manchas violetas indicando la predominancia de este tipo de compuestos en el aceite esencial [15].
Figura 2. Perfil cromatográfico del aceite esencial de R. officinalis. Fase estacionaria: sílicegel 60, fase móvil cloruro de metileno y revelador anisaldehido-ácido sulfúrico. Mancha azul verde (Rf = 0,20); mancha azul violeta (Rf = 0,44); mancha lila (Rf = 0,64); mancha violeta intensa (Rf = 0,82).
Adicionalmente, se ha reportado en la literatura la actividad antimicrobiana del aceite esencial de R. officinalis del cual gran parte de su actividad se ha atribuido a la presencia de monoterpenos en su composición. S. Santoyo y colaboradores evaluaron la actividad antimicrobiana del aceite esencial y de estándares de estos compuestos, encontrando que todos presentaron actividad antimicrobiana sobre Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Bacillus subtilis, Aspergillus niger y Candida albicans, de los cuales borneol, verbenona y alcanfor presentaron la mayor actividad antimicrobiana sobre las cepas estudiadas [21].
En el presente estudio se evalúa la actividad antimicrobiana del aceite esencial de R. officinalis sobre Porphyromonas gingivalis, bacteria anaerobia altamente relacionada con la enfermedad periodontal. Para el desarrollo del estudio se utilizó metronidazol como control teniendo en cuenta la metodología para el análisis de la actividad antimicrobiana sobre bacterias anaerobias del CLSI [16]. El metronidazol es un antibiótico nitroimidazol cuya actividad antimicrobiana se debe a que se difunde de manera pasiva dentro del citoplasma de las bacterias anaerobias donde proteínas de transporte le transfieren electrones al grupo nitro, de esa forma se genera un radical libre nitroso que interactúa con el ADN de manera irreversible resultando en la inhibición de la síntesis de ADN y finalmente, en la muerte de la bacteria [22]. Los resultados de la evaluación de la actividad antimicrobiana sobre Porphyromonas gingivalis frente al aceite esencial de R. officinalis y el metronidazol se muestran en las tablas 2 y 3, respectivamente; donde se observa que la CMI obtenida para metronidazol y el aceite esencial fue de 0,071 μg/ml y 1000 μg/ml, respectivamente; con un coeficiente de variación de 7% y un p ≤ 0,0001 que rechaza la hipótesis nula de que todos los tratamientos eran semejantes. Los resultados indican que aunque el aceite esencial presenta actividad antimicrobiana, la CMI es inferior al control. La diferencia entre los resultados se debe a que se están evaluando compuestos con posible actividad antimicrobiana, a concentraciones desconocidas y embebidas en la matriz compleja del aceite esencial, frente a un fármaco con un mecanismo de acción conocido y actividad antimicrobiana ampliamente estudiada.
Aun así, se han reportado estudios donde se demuestra la actividad antimicrobiana del aceite esencial de R. officinalis contra microorganismos aerobios y anaerobios [23-25]. Entre los microorganismos estudiados se encuentran Streptococcus mutans, Streptococcus pyogenes [26], Actinobacillus actinomyceetemcomitans, Fusobacterium nucleatum, Streptococcus sobrinus [27], los cuales también se ha relacionado con la enfermedad periodontal. Adicionalmente, Takarada y colaboradores en 2004 [27], evaluaron la actividad del aceite esencial de R. officinalis sobre P. gingivalis utilizando el método de dilución en medio líquido para diferentes cepas y encontraron que para P. gingivalis, la CMI del aceite es del 1%.
Las diferencias en los resultados pueden verse influenciadas por las diferencias en el diseño experimental, las diferencias propias de las cepas y el perfil químico del aceite el cual varía con la época del año en la que se recolecta el material vegetal, los fertilizantes utilizados, la posición geográfica, el genotipo, el método de extracción, entre otros factores que influyen en la expresión de metabolitos secundarios [28]. Finalmente, se evaluó el efecto inhibitorio del diluyente del aceite esencial, alcohol al 96%, tablas 2 y 3 comprobándose que este no tiene ningún efecto inhibitorio sobre P. gingivalis. Los resultados obtenidos en la evaluación de la actividad antimicrobiana del aceite esencial sobre Porphyromonas gingivalis sugieren su utilidad en el tratamiento de la patología periodontal en preparaciones orales.
Conclusión
Los resultados obtenidos contribuyen a la caracterización química y al conocimiento de la actividad antimicrobiana del aceite esencial de Rosmarinus officinalis contra Porphyromonas gingivalis. El perfil cromatográfico indica la predominancia de compuestos terpénicos en el aceite esencial. La CMI que se encontró para el extracto frente a Porphyromonas gingivalis ATCC 33277 fue de 1000 μg/ml con un efecto bacteriostático a la concentración de 1000 μg/ml y un efecto bactericida a la concentración de 1200 μg/ml. Para el metronidazol empleado como control se obtuvo una CMI de 0,071 µg/ ml. Al ser éste el primer estudio en Colombia que evalúa la actividad del aceite esencial de Rosmarinus officinalis sobre Porphyromonas gingivalis se considera que es un aporte importante en la búsqueda de nuevos principios activos que lleven a posteriores estudios en los cuales se evalué la efectividad del aceite esencial sobre la patología periodontotal como una alternativa en el tratamiento de la enfermedad asociada a P. gingivalis.
Conflicto de intereses
Los autores no declaran conflicto de intereses.
Agradecimientos
Los autores agradecen al Departamento de Farmacia y a la Facultad de Agronomía de la Universidad Nacional de Colombia por facilitar el desarrollo de este trabajo.
Referencias
1. E. Koshi, S. Rajesh, P. Koshi, P. Arunima, Risk assessment for periodontal disease, Journal of Indian Society of Periodontology, 16(3), 324 (2012).
2. B. Paster, S. Boches, J. Galvin, R. Ericson, C. Lau, V. Levanos, A. Sahasrabudhe, F. Dewhirst, Bacterial diversity in human subgingival plaque, Journal of bacteriology, 183(12), 3770 (2001).
3. J. Kim, S. Amar, Periodontal disease and systemic condition: A bidirectional relationship, Odontology, 94, 11 (2006).
4. A. Buonavoglia, F. Latronico, C. Pirani, M. Greco, M. Corrente, C. Prati, Symptomatic and asymptomatic apical periodontitis associated with red complex bacteria: clinical and microbiological evaluation, Odontology, 101, 84 (2013).
5. T.R. Mikuls, J.B. Payne, F. Yu, G.M. Thiele, R.J. Reynolds, G.W. Cannon et al., Periodontitis and Porphyromonas gingivalis in patients with rheumatoid arthritis, Arthritis & Rheumatology, 66(5),1090 (2014).
6. J. Koziel, P. Mydel, J. Potempa, The link between periodontal disease and rheumatoid arthritis: An updated review, Current Rheumatology Reports, 16(3), 5 (2014).
7. T. Kurita-Ochiai, M. Yamamoto, Periodontal pathogens and atherosclerosis: implications of inflammation and oxidative modification of LDL, BioMed Research International, 2014, 4 (2014).
8. A. Prakasam, S. Elavarasu, R. Natarajan, Antibiotics in the management of aggressive periodontitis, Journal of Pharmacy & Bioallied Sciences, Supplement, S253- S254, (2012).
9. K. Shinada, M. Ueno, Y. Kawaguchi, C. Konishi, S. Takehara, S. Yokoyama, T. Zaitsu, M. Ohnuki, F. Clive, Effect of a mouthwash with chlorine dioxide on oral malodor and salivary bacteria: A randomized placebo-controlled 7-day trial, Trials, 11, 15 (2010).
10. E. Palombo, Traditional medicinal plant extracts and natural products with activity against oral bacteria: potential application in the prevention and treatment of oral diseases, Evidence Based Complementary and Alternative Medicine, 2011, 2 (2011).
11. Y. Jiang, N. Wu, Y. Jie Fu, W. Wang, M. Luo, C. Zhao, Y. Gang Zu, X. Liu, Chemical composition and antimicrobial activity of the essential oil of Rosemary, Enviromental toxicology and pharmacology, 32(1), 63 (2011).
12. W. Bernardes, R. Lucarini, M. Tozatti, M. Souza, M. Andrade, A. da Silva, C. Gomes, A. Miller, P. Pauletti, M. Groppo, W. Cunha, Antimicrobial Activity of Rosmarinus officinalis against oral pathogens: Relevance of carnosic acid and carnosol, Chemistry & Biodiversity, 7, 1838 (2010).
13. C. Ardila, M. Granada, I. Guzmán, Antibiotic resistance of subgingival species in chronic periodontitis patients, Journal of Periodontal Research, 45, 559 (2010).
14. R. Jacinto, B. Gomes, C. Ferraz, A. Zaia, F. Souza, Microbiological analysis of infected root canals from symptomatic and asymptomatic teeth with periapical periodontitis and the antimicrobial susceptibility of some isolated anaerobic bacteria, Oral Microbiology Immunology, 18, 290 (2003).
15. H. Wagner, "Drug Analysis Thin Layer Chromatography Atlas", Springer-Verlag, Berlín, 1984, p. 22-23, 30-31.
16. Clinical and Laboratory Standards Institute, "Methods for antimicrobial susceptibility testing of anaerobic bacteria", approved standard-8th ed., CLSI document M11-A8, Clinical and Laboratory Standards Institute, Wayne, PA, 2012.
17. A. Angioni, A. Barra, E. Cereti, D. Barile, J.D. Coïsson, M. Arlorio, S. Dessi, V. Coroneo, P. Cabras, Chemical composition, plant genetic differences, antimicrobial and antifungal activity investigation of the essential oil of Rosmarinus officinalis L., Journal of Agricultural and Food Chemistry, 52, 3531 (2004).
18. J. Sánchez, "Estudio de hojas de Chelonanthus alatus (Gentianaceae)", tesis de grado, Universidad Nacional de Colombia, 2011, pp. 11.
19. M. Mastrogiovanni,"Extracción,purificaciónycaracterizacióndesaponinasdeQuillaja brasiliensis", tesis de grado, Universidad de la República, Uruguay, 2012, pp. 17.
20. W. Wang, N. Wu, Y.G. Zu, Antioxidative activity of Rosmarinus officinalis L. essential oil compared to its main components, Food Chemistry, 108(3), 10191022 (2008).
21. S. Santoyo, J. Cavero, L. Jaime, E. Ibañez, F.J. Señoráns, G. Reglero, Chemical composition and antimicrobial activity of Rosmarinus officinalis L. essential oil obtained via supercritical fluid extraction, Journal of Food Protection, 4, 790-795 (2005).
22. Micromedex® Solutions. "Metronidazole", Greenwood Village, Colo: Thomson Micromedex, URL: http://www.micromedexsolutions.com, consultado en junio de 2015.
23. A.I. Hussain, F. Anwar, S.A. Shahid, A. Jabbar, S. Mahboob, P.S. Nigam, Rosmarinus officinalis essential oil: Antiproliferative, antioxidant and antibacterial activities, Brazilian Journal of Microbiology, 41, 1076 (2010).
24. J. Smullen, M. Finney, G.M. Storey, H.A. Foster, Prevention of artificial dental plaque formation in vitro by plant extracts, Journal of Applied Microbiology, 113, 970- 971 (2012).
25. B. Bozin, N. Mimica-Dukic, I. Samojlik, E. Jovin, Antimicrobial and antioxidant properties of rosemary and sage (Rosmarinus officinalis L. and Salvia officinalis L., Lamiaceae) essential oils, Journal of Agricultural and Food Chemistry, 55(19), 7879 (2007).
26. A. Ait-Ouazzou, S. Lorán, M. Bakkali, A. Laglaoui, C. Rota, A. Herrera, R. Pagán, P. Conchello, Chemical composition and antimicrobial activity of essential oils of Thymus algeriensis, Eucalyptus globulus and Rosmarinus officinalis from Morrocco, Journal of the Science of Food and Agriculture, 91, 2646-2648 (2011).
27. K. Takarada, R, Kimizuka, N. Takahashi, K. Honma, K. Okuda, T. Kato, A comparison of the antibacterial efficacies of essential oils against oral pathogens, Oral Microbiology and Immunology 19, 61 (2004).
28. A. R. Bilia, F. Santomauro, C. Sacco, M. C. Sesto, R. Donato, Essential oil or Artemisia annua L.: An extraordinary component with numerous antimicrobial properties, Evidence-Based Complementary and Alternative Medicine, 2014¸ 159819 (2014).
Cómo citar este artículo
D.M. Bonilla, Y. Mendoza, C.E. Moncada, O. Murcia, Á.P. Rojas, J. Calle, R. Pinzón, L. Nerio, Efecto del aceite esencial de Rosmarinus officinalis sobre Porphyromonas gingivalis cultivada in vitro, Rev. Colomb. Cienc. Quím. Farm., 45(2), 275-287 (2016).
Referencias
(1) E. Koshi, S. Rajesh, P. Koshi, P. Arunima, Risk assessment for periodontal disease, Journal of Indian Society of Periodontology, 16(3), 324 (2012).
(2) B. Paster, S. Boches, J. Galvin, R. Ericson, C. Lau, V. Levanos, A. Sahasrabudhe, F. Dewhirst, Bacterial diversity in human subgingival plaque, Journal of bacteriology, 183(12), 3770 (2001).
(3) J. Kim, S. Amar, Periodontal disease and systemic condition: A bidirectional relationship, Odontology, 94, 11 (2006).
(4) A. Buonavoglia, F. Latronico, C. Pirani, M. Greco, M. Corrente, C. Prati, Symptomatic and asymptomatic apical periodontitis associated with red complex bacteria: clinical and microbiological evaluation, Odontology, 101, 84 (2013).
(5) T.R. Mikuls, J.B. Payne, F. Yu, G.M. Thiele, R.J. Reynolds, G.W. Cannon et al., Periodontitis and Porphyromonas gingivalis in patients with rheumatoid arthritis, Arthritis & Rheumatology,66(5),1090 (2014).
(6) J. Koziel, P. Mydel, J. Potempa, The link between periodontal disease and rheumatoid arthritis:an updated review, Current Rheumatology Reports, 16(3), 5 (2014).
(7) T. Kurita-Ochiai, M. Yamamoto, Periodontal pathogens and atherosclerosis: implications of inflammation and oxidative modification of LDL, BioMed Research International, 2014, 4 (2014).
(8) A. Prakasam, S. Elavarasu, R. Natarajan, Antibiotics in the management of aggressive periodontitis, Journal of Pharmacy & Bioallied Sciences, Supplement, S253- S254, (2012).
(9) K. Shinada, M. Ueno, Y. Kawaguchi, C. Konishi, S. Takehara, S. Yokoyama, T. Zaitsu, M. Ohnuki, F. Clive, Effect of a mouthwash with chlorine dioxide on oral malodor and salivary bacteria: A randomized placebo-controlled 7-day trial, Trials, 11, 15 (2010).
(10) E. Palombo, Traditional medicinal plant extracts and natural products with activity against oral bacteria: potential application in the prevention and treatment of oral diseases, Evidence Based Complementary and Alternative Medicine, 2011, 2 (2011).
(11) Y. Jiang, N. Wu, Y. Jie Fu, W. Wang, M. Luo, C. Zhao, Y. Gang Zu, X. Liu, Chemical composition and antimicrobial activity of the essential oil of Rosemary, Enviromental toxicology and pharmacology, 32(1), 63 (2011).
(12) W. Bernardes, R. Lucarini, M. Tozatti, M. Souza, M. Andrade, A. da Silva, C. Gomes, A. Miller, P. Pauletti, M. Groppo, W. Cunha, Antimicrobial Activity of Rosmarinus officinalis against oral pathogens: Relevance of carnosic acid and carnosol, Chemistry & Biodiversity, 7, 1838 (2010).
(13) C. Ardila, M. Granada, I. Guzmán, Antibiotic resistance of subgingival species in chronic periodontitis patients, Journal of Periodontal Research, 45, 559 (2010).
(14) R. Jacinto, B. Gomes, C. Ferraz, A. Zaia, F. Souza, Microbiological analysis of infected root canals from symptomatic and asymptomatic teeth with periapical periodontitis and
The antimicrobial susceptibility of some isolated anaerobic, bacteria, Oral Microbiology Immunology, 18, 290 (2003).
(15) H. Wagner, “Drug Analysis Thin Layer Chromatography Atlas”, Springer-Verlag,
Berlín, 1984, p. 22-23, 30-31.
(16) Clinical and Laboratory Standards Institute, “Methods for antimicrobial susceptibility testing
Of anaerobic bacteria”, approved standard-8 ed., CLSI document M11-A8, Clinical and Laboratory Standards Institute, Wayne, PA, 2012.
(17) A. Angioni, A. Barra, E. Cereti, D. Barile, J.D. Coïsson, M. Arlorio, S. Dessi, V. Coroneo, P. Cabras, Chemical composition, plant genetic differences, antimicrobial and antifungal activity investigation of the essential oil of Rosmarinus officinalis L., Journal of Agricultural and Food Chemistry, 52, 3531 (2004).
(18) J. Sánchez, “Estudio de hojas de Chelonanthus alatus (Gentianaceae)”, tesis de grado, Universidad Nacional de Colombia, 2011, pp. 11.
(19) M. Mastrogiovanni, “Extracción, purificación y caracterización de saponinas de Quillaja brasiliensis”, tesis de grado, Universidad de la República, Uruguay, 2012, pp. 17.
(20) W. Wang, N. Wu, Y.G. Zu, Antioxidative activity of Rosmarinus officinalis L. essential oil compared to its main components, Food Chemistry, 108(3), 10191022 (2008).
(21) S. Santoyo, J. Cavero, L. Jaime, E. Ibañez, F.J. Señoráns, G. Reglero, Chemical composition And antimicrobial activity of Rosmarinus Officinalis L. Essential oil obtained via supercritical fluid extraction, Journal of Food Protection, 4, 790-795 (2005).
(22) Micromedex® Solutions. “Metronidazole”, Greenwood Village, Colo: Thomson Micromedex, URL: http://www.micromedexsolutions.com ,
Consultado en junio de 2015.
(23) A.I. Hussain, F. Anwar, S.A. Shahid, A. Jabbar, S. Mahboob, P.S. Nigam, Rosmarinus Officinalis essential oil: Antiproliferative, antioxidant and antibacterial activities, Brazilian Journal of Microbiology, 41, 1076 (2010).
(24) J. Smullen, M. Finney, G.M. Storey, H.A. Foster, Prevention of artificial dental plaque formation in vitro by plant extracts, Journal of Applied Microbiology, 113, 970- 971 (2012).
(25) B. Bozin, N. Mimica-Dukic, I. Samojlik, E. Jovin, Antimicrobial and antioxidant properties of rosemary and sage (Rosmarinus officinalis L. and Salvia officinalis L., Lamiaceae) essential oils, Journal of Agricultural and Food Chemistry, 55(19), 7879 (2007).
(26) A. Ait-Ouazzou, S. Lorán, M. Bakkali, A. Laglaoui, C. Rota, A. Herrera, R. Pagán, P. Conchello, Chemical composition and antimicrobial activity of essential oils
of Thymus algeriensis, Eucalyptus Globulus and Rosmarinus Officinalis from Morrocco, Journal of the Science of Food and Agriculture, 91, 2646-2648 (2011).
(27) K. Takarada, R, Kimizuka, N. Takahashi, K. Honma, K. Okuda, T. Kato, A comparison of the antibacterial efficacies of essential oils against oral pathogens, Oral Microbiology and Immunology 19, 61 (2004).
(28) A. R. Bilia, F. Santomauro, C. Sacco, M. C. Sesto, R. Donato, Essential oil or Artemisia annua L.: An extraordinary component with numerous antimicrobial properties, Evidence-Based Complementary and Alternative Medicine,159819 (2014).
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Rosario Castro, Dinorah Vargas, Sheila I. Peña, Laura O. Arvizu, Juan R. Ayala, Orbelin Soberanis, Gerardo Leyva, Jocelin Ledesma, Esperanza García, Sara C. Caballero, Ivan Juárez. (2025). Susceptibility testing of Escherichia coli and Salmonella enterica to plant essential oils and commercial antibiotics. Letters in Drug Design & Discovery, 22(6), p.100080. https://doi.org/10.1016/j.lddd.2025.100080.
2. Yina Pájaro-González, Andrés Felipe Oliveros-Díaz, Julián Cabrera-Barraza, José Cerra-Dominguez, Fredyc Díaz-Castillo. (2022). Medicinal Plants as Anti-Infectives. , p.3. https://doi.org/10.1016/B978-0-323-90999-0.00005-7.
3. Luis Sequeda-Castañeda, Camila Muñoz-Realpe, Crispín Celis-Zambrano, Sandra Gutiérrez-Prieto, Pilar Luengas-Caicedo, Fredy Gamboa. (2019). Preliminary Phytochemical Analysis of Berberis goudotii Triana & Planch. ex Wedd. (Berberidaceae) with Anticariogenic and Antiperiodontal Activities. Scientia Pharmaceutica, 87(1), p.2. https://doi.org/10.3390/scipharm87010002.
4. Roxana González-Ball, Tania Bermúdez-Rojas, Marilyn Romero-Vargas, Melissa Ceuterick. (2022). Medicinal plants cultivated in urban home gardens in Heredia, Costa Rica. Journal of Ethnobiology and Ethnomedicine, 18(1) https://doi.org/10.1186/s13002-022-00505-z.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2016 Revista Colombiana de Ciencias Químico-Farmacéuticas

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
El Departamento de Farmacia de la Facultad de Ciencias de la Universidad Nacional de Colombia autoriza la fotocopia de artículos y textos para fines de uso académico o interno de las instituciones citando la fuente. Las ideas emitidas por los autores son responsabilidad expresa de estos y no de la revista.
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons de Atribución 4.0 aprobada en Colombia. Consulte la normativa en: http://co.creativecommons.org/?page_id=13