Actividad antibacteriana in vitro de aceites esenciales de diferentes especies del género Citrus
Antibacterial activity in vitro of essential oils from different species of the genus Citrus
DOI:
https://doi.org/10.15446/rcciquifa.v46n2.67934Palabras clave:
actividad antibacterial, Citrus, aceite esencial (es)Antibacterial activity, Citrus, essential oil (en)
Recibido: 28 de febrero de 2017; Aceptado: 24 de julio de 2017
RESUMEN
Se evaluó la actividad antibacteriana in vitro de aceites esenciales de diferentes especies del género Citrus frente a cepas ATCC de Staphylococcus aureus, Staphylococcus epidermidis, Klebsiellapneumoniae, Pseudomonas aeruginosa y Escherichia coli, determinando la concentración mínima inhibitoria (CMI) y la concentración mínima bactericida (CMB). Las bacterias se replicaron en medios de agar y caldos específicos. Se determinó el momento de máxima densidad óptica (DO620) para emplearlo como tiempo de incubación; luego se hicieron pruebas de evaluación de sensibilidad con la exposición de las cepas a concentraciones a 1000µg/mL del extracto en caldo. Para solubilizar se empleó dimetilsulfóxido (DMSO) al 1%. Posteriormente, se le determinó la concentración mínima inhibitoria mediante metodologías de microdilución en caldo y la concentración mínima bactericida. Encontrándose una actividad de los aceites esenciales del género Citrus, con valores de CMI ≥ 600 mg/mL frente a S. aureus, S. epidermidis, K. pneumoniae, P. aeruginosa y E. coli. En función a los resultados obtenidos, se concluye que las diferentes especies del género Citrus son consideradas como promisorias para el control del componente bacteriano.
Palabras clave:
actividad antibacterial, Citrus, aceite esencial.SUMMARY
The in vitro antibacterial activity of essential oils of different species of the Citrus genus was evaluated against ATCC strains of Staphylococcus aureus, Staphylococcus epidermidis, Klebsiella pneumoniae, Pseudomonas aeruginosa and Escherichia coli, determining the minimum inhibitory concentration (MIC) and minimum bactericidal concentration (MBC). The bacteria were replicated in specific agar media and broths. The maximum optical density moment (OD620) was determined to be used as the incubation time; sensitivity tests were then performed with exposure of the strains at concentrations to 1000 µg/mL broth extract. 1% dimethylsulfoxide (DMSO) was used to solubilize. Subsequently, the minimum inhibitory concentration was determined using microdilution methodologies in broth and the minimum bactericidal concentration. We found strong activity of the essential oils of the genus Citrus, with values of CMI ≥ 600 mg/mL against S. aureus, S. epidermidis, K. pneumoniae, P. aeruginosa and E. coli. Based on the results obtained, it is concluded that the different species of Citrus genus are considered as promising for the control of the bacterial component.
Keywords:
Antibacterial activity, Citrus, essential oil.INTRODUCCIÓN
Colombia es un país que posee una gran diversidad de ecosistemas y microclimas, lo cual hace que su vegetación sea muy variada, enriquecida con especies endémicas y diversidad genética muy alta. Algunas de las plantas que se pueden encontrar poseen aceites esenciales con principios activos que han demostrado actividad biológica o industrial, con amplias perspectivas para llevar a cabo la investigación y el desarrollo de nuevos productos 1-4.
El término "aceite esencial" (AE) es utilizado para referirse a sustancias líquidas, volátiles, de carácter lipofílico y con propiedades aromáticas. Estas sustancias son sintetizadas por las plantas como metabolitos secundarios y pueden ser extraídas mediante métodos físicos como la destilación a vapor o hidrodestilación 5-7. Los AE tienen un papel importante en la protección de las plantas, pues actúan como agentes antibacterianos, antivirales, antifúngicos e insecticidas 8-17. Poseen una composición química compleja que consiste en una mezcla de sustancias orgánicas como hidrocarburos, alcoholes, aldehídos, cetonas, ésteres, etc. 12,18. Algunos aceites esenciales se extraen de las células localizadas en el flavedo (parte externa coloreada de la cáscara) de los frutos cítricos 3,12,13,19-24.
Los cítricos pertenecen a la clase Angiospermae, a la subclase dicotiledónea, a la orden rutae, a la familia rutaceae, cuyos frutos o frutas poseen un alto contenido en vitamina C y ácido cítrico y al género Citrus, y dentro de ellos se conocen las siguientes especies: naranja (Citrus sinensis), mandarina (Citrus reticulata), limón (Citrus aurantifolia), pomelo (Citrusparadisi) 12,13,14-19. El origen del género Citrus se sitúa en el sureste de Asia y el centro de China, Filipinas y el archipiélago indomalayo hasta Nueva Guinea. Las primeras variedades e híbridos de cítricos son el resultado de un largo proceso de identificación, colecta y reproducción de plantas silvestres 19-24.
Los cítricos son cultivos permanentes y, en general, tienen alta adaptabilidad a diversas condiciones climáticas, facilitando su cultivo en un gran número de países, aunque las regiones productoras por excelencia han sido localizadas en el continente americano y en el occidente del continente europeo 3,12,13. En especial, la naranja es la fruta más común del género Citrus spp., y la más conocida en el ámbito mundial 19-23.
El género Citrus, cuyo término común es cítrico, designa las especies de grandes arbustos o arbolillos perennes (entre 5 m y 15 m) de la familia de las rutáceas cuyos frutos poseen un alto contenido en vitamina C y ácido cítrico, el cual les proporciona ese sabor ácido tan característico 18,25.
En este trabajo, se obtuvieron AE, mediante hidrodestilación (HD) e hidrodestilación asistida por la radiación con microondas (MWHD), de las especies vegetales naranja (Citrus sinensis), limón (Citrus aurantifolia), mandarina (Citrus reticulata), pomelo (Citrusparadisi), cultivadas en el norte del departamento de Bolívar (Colombia); y se determinó la composición química, la sensibilidad antibacteriana y la concentración mínima inhibitoria (CMI) in vitro de los AE frente a cepas ATCC de Staphylococcus aureus, Staphylococcus epidermidis, Klebsiella pneumoniae, Pseudomonas aeruginosa y Escherichia coli.
MATERIALES Y MÉTODOS
Los reactivos y otros materiales se adquirieron a entidades reconocidas. El dimetilsulfóxido (DMSO) se adquirió de JT Baker (Phillipsburg, EEUU). El Caldo Müeller Hinton (caldo MH) y el agar Müeller Hinton (agar MH), se obtuvieron de Merck KGaA (Darmstadt, Alemania). La gentamicina sulfato de Biopex SAC (Estándar Secundario Lote: 10C256). Las cepas bacterianas provinieron de la American Type Culture Collection (ATCC): Staphylococcus aureus (ATCC 25923), Staphylococcus epidermidis (ATCC 12228), Klebsiella pneumoniae (ATCC 13883), Pseudomonasaeruginosa (ATCC 27853) y Escherichia coli (ATCC 25922).
Recolección del material vegetal
El pericarpio de las frutas de naranja (C. sinensis), limón (C. aurantifolia), mandarina (C. reticulata), pomelo (C. paradisi) se recolectó en la ciudad de Cartagena, ubicada en el norte del departamento de Bolívar (10°25'25"N 75°31'31"O), Colombia.
Se tomaron 1000 g de pericarpio por semana, en el período comprendido de abril a mayo del 2016 bajo la supervisión del ingeniero agrónomo Antonio Carlos Bustillo, quien realizó la identificación taxonómica de la especie.
Procesamiento del material vegetal
El pericarpio de las frutas colectadas se lavó con agua desionizada, y se seleccionó las que se encontraban frescas, enteras, sin señales de deterioro. En seguida se trocearon, pesaron y procesaron inmediatamente 6.
Procedimientos de extracción del AE
La obtención del AE por HD, se efectuó en un equipo de hidrodestilación del tipo Clevenger 500 g del material vegetal, se introdujeron en el balón de extracción, el cual contenía 500 mL de agua destilada. El tiempo de extracción fue de 3 h.
Por el método MWHD, la obtención se llevó a cabo en un equipo de destilación tipo Clevenger con un reservorio de destilación Dean Stark adaptado a un sistema de calentamiento por radiación de microondas, un horno microondas convencional marca (Samsumg, Estados Unidos), con una potencia del 70%, dentro del cual se colocó un balón de extracción de 4 L con 500 mL de agua destilada y 500 g del material vegetal. El tiempo de extracción fue de 3 h 4,5.
En ambos casos, los aceites esenciales obtenidos se separaron por decantación e inmediatamente se almacenaron en viales ámbar a 4 °C hasta la realización de los respectivos análisis. Los rendimientos en la extracción se evaluaron por triplicado a tiempos de 20, 30, 40, 50, 60, 90, 120 y 180 min, operando siempre bajo las mismas condiciones 4,5,26,27, según la ecuación (1):
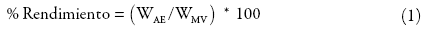
Donde, WAE es el peso (g) obtenido del aceite esencial y WMV corresponde al peso en gramos (g) del material vegetal fresco.
Análisis del AE por cromatografía de gases/espectrometría de masas (CG/EM)
Se empleó un equipo CG/EM 7890A/5975C Agilent (Estados Unidos) en interfase con un detector selectivo de masas HP5973 Network conectado en línea con un sistema HP-MS ChemStation y la base de datos NIST-2008. Las condiciones de operación fueron las siguientes: columna capilar HP-5MS (5% phenyl methyl silox, 30 m x 250 µm x 0,25 µm), temperatura inicial 45 °C, temperatura de la línea de transferencia de 280 °C y volumen de inyección 1,0 µL en modo split (20:1), con temperatura del inyector de 250 °C 5. La detección de los compuestos se realizó por comparación del espectro de masas, en cada tiempo de retención, con los reportados en la base de datos NIST-2008 4,6.
Actividad antibacteriana in vitro
Los inóculos bacterianos se prepararon de acuerdo con las indicaciones establecidas por el Instituto de Estándares Clínicos y de Laboratorio (CLSI, por sus siglas en inglés) 28, se tomaron entre 3 y 4 colonias bien diferenciadas y morfológicamente similares de las bacterias previamente sembradas en placas de Petri con agar MH, luego aquellas se suspendieron en tubos de ensayo con caldo MH estéril, se incubaron a 35 ± 2 °C y se verificó constantemente la densidad óptica (DO) a 620 nm en lector de microplacas (Multiscan EX Thermo®), hasta que la suspensión bacteriana alcanzó una DO620 entre 0,08 - 0,1 unidades, lo que equivale a 0,5 en la escala de McFarland (1 x 108 UFC/mL), la cual fue diluida a in de obtener una suspensión de trabajo de 5 x 105 UFC/mL en los ensayos biológicos 29-33. A fin de determinar la fase de crecimiento exponencial de las bacterias y, de manera consecuente, el tiempo de incubación de estas, se realizaron curvas de crecimiento de las cepas en estudio. Para ello, 0,1 mL del inóculo diluido se adicionó a 9,9 mL de caldo MH e incubado a 35 ± 2 °C y se verificó la DO620 de la suspensión bacteriana en un lector de microplacas 33. Se utilizó dimetilsulfóxido al 1% (DMSO) para disolver el extracto obtenido; este se emplea con frecuencia en estudios microbiológicos 9,34,35. Posteriormente, el DMSO al 1% y el extracto disuelto se incubaron en placas de 96 pocillos a 35 ± 2 °C por el tiempo definido para cada bacteria en las curvas de crecimiento; transcurrido este tiempo, se determinó los porcentajes de viabilidad frente al blanco de máximo crecimiento (caldo con inóculo). Para la evaluación de la actividad antibacteriana, se prepararon soluciones concentradas de 1000 µg/mL de los aceites esenciales, según el criterio de autores que consideran como promisorios aquellos extractos vegetales que presenten valores de concentración mínima inhibitoria (CMI) inferior a 1000 µg/mL 10. Esta solución se incubó con las suspensiones bacterianas durante el tiempo definido para cada bacteria en las curvas de crecimiento, a 35 ± 2 °C, utilizando gentamicina sulfato (0,016 mg/mL) como control positivo de actividad antibacteriana. Transcurrido este tiempo, las placas se agitaron durante 5 min a 100 rpm, se determinó la DO620 en lector de microplacas y se estimó la viabilidad por comparación frente al blanco de máximo crecimiento.
Concentración mínima inhibitoria (CMI)
Se determinó la CMI de aquellos aceites esenciales que presentaron porcentajes de inhibición superiores al 90%, siguiendo lo establecido por el CLSI con algunas modificaciones. Brevemente, 50 µL de las suspensiones de las cepas bacterianas en estudio se incubaron, por el período de tiempo definido para cada bacteria en las curvas de crecimiento bacteriano, a 35 ± 2 °C, en placas de 96 pocillos, con 50 µL de concentraciones seriadas entre 50 y 1000 µg/mL del extracto evaluado. Las placas se sellaron durante el período de incubación para reducir la evaporación; al finalizar este tiempo, se agitaron a 100 rpm durante 5 min y se determinó la DO620 en lector de microplacas. La CMI se calculó como la mínima concentración del extracto o fracción que inhibe completamente el crecimiento bacteriano y se expresó en µg/mL 29-32.
Concentración mínima bactericida (CMB)
Para determinar la concentración del aceite esencial que mostró completa inhibición del crecimiento bacteriano, en el ensayo de determinación de la CMI, se tomó un inóculo con un asa estéril y se hizo un subcultivo en placas de Petri con agar MH. Las placas inoculadas se incubaron a 35 ± 2 °C durante el tiempo adecuado para cada bacteria, luego del cual se evaluó si había crecimiento de colonias bacterianas. La CMB se calculó como la mínima concentración del compuesto que no permite el crecimiento visible de colonias en la placa de Petri. En caso de observarse crecimiento, se concluye que esa concentración del extracto o fracción produce un efecto bacteriostático 11.
Análisis estadístico
Los resultados correspondientes a tres ensayos independientes se expresaron como el promedio ± el error estándar de la media (ESM). Para la organización de los datos se empleó la hoja de cálculo MS Excel 2010, y para los análisis estadísticos el paquete GraphPad Prism V5.00 para Windows.
RESULTADOS
La eficiencia de la extracción de los aceites esenciales de C. sinensis, C. aurantifolia, C. reticulata, C. paradisi se presenta en la figura 1.
Figura 1: Cinética de extracción de los a) AE de C. sinensis y C. paradisi; b) C. aurantifolia, C. reticulata, obtenidos por el método de hidrodestilación por arrastre de vapor (HD) e hidrodestilación asistida por microondas (MWHD).
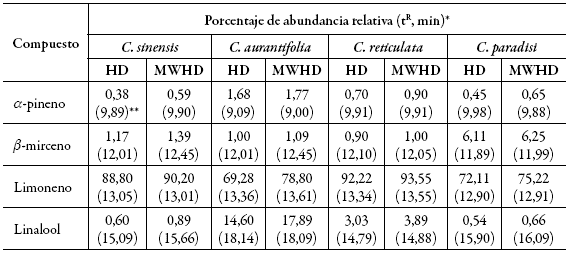
La identificación de los componentes, los tiempos de retención y los porcentajes de abundancia son reportados en la tabla 1. Los monoterpenos son los metabolitos volátiles con mayor abundancia en los AE. El compuesto mayoritario encontrado es el limoneno para ambos métodos "HD y MWHD" en todas las muestras evaluadas.
* Tiempo de retención (tR) y abundancia relativa (%) de los aceites esenciales, identificados por comparación con espectro de masas de referencia de la base de datos NIST - 2008. ** Todos los resultados presentaron diferencias estadísticas significativas a un nivel de confianza (P < 0,05).Tabla 1: Componentes mayoritarios detectados en los AE obtenidos por el método de hidrodestilación por arrastre de vapor (HD) e hidrodestilación asistida por microondas (MWHD).
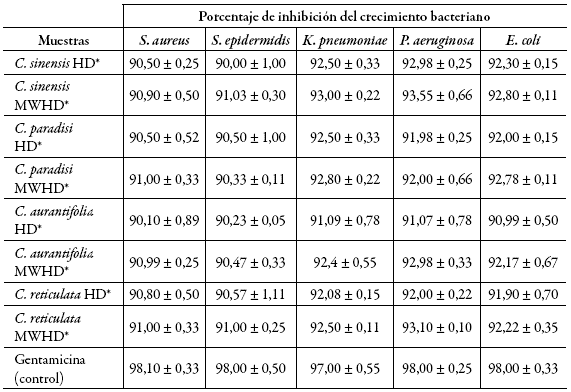
Los ensayos de crecimiento revelaron que las cepas de S. aureus, S. epidermidis, K. pneumoniae, P. aeruginosa y E. coli alcanzaron la mayor DO620 a las 20 h; por tanto, estos fueron los tiempos de punto final de incubación en los bioensayos de actividad antibacteriana. Para disolver los aceites esenciales evaluados en DMSO al 1%, primero se evaluó el crecimiento bacteriano y se demostró que este disolvente no inhibió la viabilidad de ninguna de las cepas; por consiguiente, se eligió utilizar un sistema caldo: DMSO en proporción 99:1. Los resultados de la evaluación de la sensibilidad antibacteriana de los aceites esenciales de C. sinensis, C. paradisi, C. aurantifolia y C. reticulata obtenidos por el método de hidrodestilación por arrastre de vapor (HD) e hidrodestilación asistida por microondas (MWHD) (tabla 1), permitieron identificar los extractos capaces de inhibir el crecimiento de las cepas bacterianas, tomando como criterio de selección, aquellos que fueron capaces de inhibir en más de 90% a las tres cepas (tabla 2). Por tanto, se le determinó la CMI y CMB.
*Aceites esenciales que inhibieron más de 90% a las cinco cepas. Los valores corresponden a la media de tres ensayos independientes ± desviación estándar.Tabla 2: Sensibilidad antibacteriana de los aceites esenciales de C. sinensis, C. paradisi, C. aurantifolia y C. reticulata obtenidos por el método de hidrodestilación por arrastre de vapor (HD) e hidrodestilación asistida por microondas (MWHD).
La CMI se determina con la utilización de caldo inoculado y estandarizado, al que se le adicionan soluciones del aceite esencial a diferentes concentraciones, provocando una dilución. Los valores se presentan en la tabla 3.
Tabla 3: Concentración mínima inhibitoria (CMI) y concentración mínima bactericida (CMB) de aceites esenciales frente a S. aureus, S. epidermidis, K. pneumoniae, P. aeruginosa y E. coli.

Por su parte, los resultados de la CMB para los aceites esenciales sugieren que a esas concentraciones su actividad se debe a efectos de tipo bacteriostático y no bactericida (tabla 3).
DISCUSIÓN
Las plantas aromáticas son fuente de aceites esenciales, productos de alto valor agregado, empleados diariamente como aditivos alimenticios y fragancias, entre otros 2-5. El uso de estas plantas, a lo largo de la historia, ha conducido a la búsqueda de métodos de extracción de aceites esenciales que ofrezcan ventajas tanto en la eficiencia de extracción como en la calidad del aceite obtenido 6,8-11. Teniendo en cuenta que la composición química está influenciada por diversos factores, como la temperatura, altitud, condiciones de cultivo, suelo origen y edad de la planta, así como por cambios de tipo genético 6.
Los rendimientos de AE más altos se alcanzaron en las especies de pomelo y mandarina caracterizado por el alto contenido de limoneno. Se encontraron diferencias estadísticas significativas para el rendimiento según el método de extracción empleado. Estos resultados indican que la técnica MWHD mostró ser el método más efectivo en la extracción de los aceites esenciales 36,37. Esto es debido a la acción de las microondas sobre las paredes glandulares que contiene el aceite esencial, lo cual hace que el material vegetal se rompa más rápido y eficientemente 26. La hidrodestilación asistida por microondas utiliza tres formas de transferencia de calor dentro de la muestra: la irradiación, conducción y convección. Como resultado, produce calor con mayor rapidez dentro y fuera de las glándulas. Con la HD esta transferencia de calor solo puede ocurrir por conducción y convección, lo que la hace menos efectiva 6,37.
De igual manera, la técnica de MWHD presenta ventajas destacables en comparación con HD en cuanto a disminución de tiempo y uso de solvente (agua), calentamiento efectivo y tamaño de equipo reducido. Sin embargo, la HD es un método sencillo, reproducible, económico y, sobre todo, ampliamente utilizado en la industria 6,26,27,36,37.
En los aceites estudiados, la fracción monoterpénica es la más abundante. El limoneno es el monoterpeno presente en mayor proporción (72,11% y 93,55%, abundancia relativa, tabla 1). El AE de C. reticulata mostró un mayor porcentaje, seguido de C. sinensis y C. paradisi; estos resultados son comparables con los reportados entre 76% y 96% para los AE cítricos 19-24. Entre los monoterpenos detectados en mayor proporción que le siguen al limoneno son el /β-mirceno y el linalool, los cuales se encuentran dentro de lo reportado por la literatura para aceites esenciales de cítricos 22.
Cabe resaltar que los aceites esenciales mostraron un mayor efecto inhibitorio frente a cepas Gram-negativas. Este comportamiento particular frente a un grupo de cepas, probablemente se debe a que la pared celular de las bacterias Gram-positivas estudiadas está compuesta básicamente por peptidoglicano que representa hasta el 90% de la pared, ácidos teicoicos que también suelen estar presentes en pequeñas cantidades y polisacáridos; mientras que la pared celular de las Gram-negativas está constituida solo por el 10% del peptidoglicano, además posee tres polímeros que se encuentran fuera de su envoltura: lipoproteína, membrana externa y lipopolisacáridos, este último con un contenido de lípido A que pudiera favorecer la entrada, por disolución de los aceites esenciales debido a su carácter hidrofóbico y provocar la muerte celular por desestabilización de la membrana externa y la membrana plasmática. Este lípido A no está presente en las bacterias Gram-positivas y esta sería una causa probable del efecto del aceite en los diferentes grupos bacterianos, donde las bacterias Gram-negativas son relativamente más sensibles 22. El carácter hidrofóbico de los AE le permite atravesar la pared celular de bacterias Gram-negativas a través de canales compuestos por unas proteínas llamadas porinas, las cuales se encuentran en la membrana externa y facilitan el transporte de nutrientes y sustancias de bajo peso molecular dentro de la célula, incluyendo agentes antimicrobianos 12,19,22.
Los componentes de los aceites esenciales podrían ejercer actividad antibacteriana por interferir en la bicapa de fosfolípidos de la membrana celular causando el incremento de su permeabilidad y pérdida de los constituyentes celulares, dado que destruye el sistema de enzimas incluyendo las que implican la producción de energía celular (fuerza motriz de protones) y de respiración bacteriana, cuando se trata de concentraciones bajas de los aceites esenciales; mientras que a altas concentraciones provocarían daños severos de los componentes estructurales de la célula bacteriana, como la pérdida de homeóstasis o inactivando o destruyendo el material genético, dando lugar a la muerte celular. En el mecanismo de acción de los aceites esenciales como agentes antibacterianos, se debe considerar el gran número de compuestos químicos que se encuentran presentes en estos, cuyas actividades antibacterianas no presentan un mecanismo específico 12,19,22.
En función a los resultados obtenidos, concluimos que las diferentes especies del género Citrus son consideradas como promisorias para el control del componente bacteriano. El rendimiento de los aceites esenciales es dependiente del método de extracción utilizado para su obtención. Desde el punto de vista de la química, los aceites esenciales contienen mayoritariamente monoterpenos, siendo el limoneno el que se encuentra con un mayor porcentaje de abundancia relativa. Se destaca que el proceso de hidrodestilación asistida por radiación con microondas es considerado un método rápido, eficiente, verde y relativamente económico en comparación con la hidrodestilación convencional.
AGRADECIMIENTOS
Los autores agradecen a la Universidad de Cartagena y al Centro de Comercio y Servicios, Sena, por facilitar el espacio, los recursos y el tiempo; asimismo, al ingeniero agrónomo Antonio Carlos Bustillo por su colaboración.
REFERENCIAS
Referencias
M. Andrade, Estado del conocimiento de la biodiversidad en Colombia y sus amenazas. Consideraciones para fortalecer la interacción ciencia-política, Rev. Acad. Colomb. Cienc, 35 (137), 491-507 (2011).
C. Granados, Y. Yáñez, G. Santafé, Evaluación de la actividad antioxidante del aceite esencial foliar de Calycolpus moritzianus y Minthostachys mollis de Norte de Santander, Bistua, Rev. Fac. Cienc. Bás ., 10 (1), 12-23 (2012).
G. Matiz, M.R. Osorio, F. Camacho, M. Atencia, J. Herazo, Diseño y evaluación in vivo de fórmulas para acné basadas en aceites esenciales de naranja (Citrus sinensis), albahaca (Ocimum basilicum L.) y ácido acético, Biomédica, Rev. Inst. Nac. Salud, 32 (1), 125-133 (2012).
G. León, M. Torrenegra, M. Osorio, J. Gil, Extracción, caracterización y actividad antioxidante del aceite esencial de Plectranthus amboinicus L., Rev. Cubana Farm., 49 (4), 708-718 (2015).
M. Torrenegra, C. Granados, M. Osorio, G. León, Method comparison of hydrodistillation microwave radiation-assisted (MWHD) front hydrodistillation (HD) in the extraction of essential oil of Minthostachys mollis, Inf. Tecnol ., 26 (1), 117-122 (2015).
G. León, M.R. Osorio, S.R. Martínez, Comparación de dos métodos de extracción del aceite esencial de Citrus Sinensis L., Rev. Cubana Farm ., 49 (4), 742-750 (2015).
G. Mohammad-Taghi, R. Karamatollah, Comparison of microwave-assisted hydrodistillation withthe traditional hydrodistillation method in the extraction of essential oils from Thymus vulgaris L., Food Chem ., 109 (4), 925-930 (2008).
L. Hernández, M. Rodríguez, Actividad antimicrobiana de plantas que crecen en Cuba, Rev. Cubana Plant. Med, 6 (2), 44-47 (2001).
A. Ramírez, L. Stella, D. Marín, Metodologías para evaluar in vitro la actividad antibacteriana de compuestos de origen vegetal, Scientia et Technica, 15 (42), 263-268 (2009).
S. Gibbons, Plants as a source of bacterial resistance modulators and anti-infective agents, Phytochem. Rev ., 4 (1), 63-78 (2005).
L. Franco, G. Matiz, I. Pájaro, H. Gómez, Actividad antibacteriana in vitro de extractos y fracciones de Physalis peruviana L. y Caesalpinia pulcherrima (L.) Swartz, Boletín Latinoamer. Caribe Plant. Med. AromAt, 12 (3), 230-237 (2013).
J. Martínez, B. Sulbarán, G. Ojeda, A. Ferrer, R. Nava, Actividad antibacteriana del aceite esencial de mandarina, Rev. Fac. Agronom. Univ. Zulia, 20, 502-512 (2003).
M. Torrenegra-Alarcón, C. Granados-Conde, M. Durán-Lengua, G. León-Méndez, X. Yáñez-Rueda, N. Pájaro-Castro, Composición química y actividad antibacteriana del aceite esencial de Minthostachys mollis, ORINOQUIA - Universidad de los Llanos, 20 (1), 69-74 (2016).
F. Bakkali, S. Averbeck, D. Averbeck, M. Idaomar, Biological effects of essential oils - A review, Food Chem. Toxicol, 42 (2), 446-475 (2008).
K. Chaieb, H. Hajlaoui, T. Zmantar, A. Kahla-Nakbi, M. Rouabhia, K. Mahdouani, A. Bakhrouf, The chemical composition and biological activity of clove essential oil, Eugenia caryophyllata (Syzigium aromaticum L. Myrtaceae): A short review, Phytother. Res ., 21 (6), 501-506 (2007).
K. Saban, C. Ahmet, O. Hakan, C. Ramazan, K. Memis, M. Ebru, Antifungal, phytotoxic and insecticidal properties of essential oil isolated from Turkish and its three components, carvacrol, thymol and cymene, Bioresource Technol ., 99 (18), 8788-8795 (2008).
M. Ramy, S. Romeilah, I. Ghada, Chemical compositions, antiviral and antioxidant activities of seven essential oils, J. Appl. Sci. Res ., 6 (1), 50-62 (2010).
B. Sulbarán, G. Ojeda, F. Ysambertt, L. Cabrera, Volatile fraction composition of Venezuelan sweet orange essential oil (Citrussinensis), Ciencia, 11 (1), 55-60 (2003).
J.R. Juárez, A.J. Castro, J.F. Jáuregui, J.V. Lizano, M. Carhuapoma, F.F. Choquesillo et al ., Composición química, actividad antibacteriana del aceite esencial de Citrus sinensis L. (naranja dulce) y formulación de una forma farmacéutica, Cienc. Inv, 13 (1), 9-13 (2010).
M.L. Lota, D. de Rocca-Serra, C. Jacquemond, F. Tomi, J. Casanova, Chemical variability of peel and leaf essential oils of sour orange, Flav. Frag. J., 16, 89-96. (2001).
X. Yáñez, L.L. Lugo, D.Y. Parada, Estudio del aceite esencial de la cáscara de la naranja dulce (Citrussinensis, variedad valenciana) cultivada en Labateca (Norte de Santander, Colombia), Bistua, Rev. Fac. Cienc. Bás ., 5 (1), 3-8 (2007).
L. Guerra, L. Soto, Z. Medina, G. Ojeda de R., J. Peña. Actividad antibacteriana del aceite esencial de cortezas de naranja (Citrus sinensis) var. Valencia frente a microorganismos Gram-positivos y Gram-negativos, Rev. Fac. Agronom. Univ. Zulia, 31, 215-232 (2014).
J.P. Rojas, A. Perea, E.E. Stashenko, Obtención de aceites esenciales y pectinas a partir de subproductos de jugos cítricos, Vitae, Rev. Fac. Quím. Farm., U. de A., 16 (1), 110-115 (2009).
L. Soto, G. Ojeda de Rodríguez, L. Rojas, B. Sulbarán, J. Peña, M. Berradre, V. Fernández, Caracterización química del aceite esencial de toronja (Citrus paradisi L.), Rev. Fac. Agronom. Univ. Zulia, 30, 266-283 (2013).
M. Viuda, Y. Ruiz, J. Fernández, J. Pérez, Antibacterial activity of lemon (Citrus lemon L.), mandarin (Citrus reticulate L.), grapefruit (Citrusparadise L.) and orange (Citrus sinensis L.) essential oils, J. Food Safety, 28 (4), 567-576 (2008).
M. Golmakani, K. Rezaei, Comparison of microwave-assisted hydrodistillation with the traditional hydrodistillation method in the extraction of essential oils from Thymus vulgaris L., Food Chem, 109 (4), 925-930 (2008).
H.W. Wang, Y.Q. Liu, S.L. Wei, Z.J. Yan, K. Lu, Comparison of microwave-assisted and conventional hydrodistillation in the extraction of essential oils from mango (Mangifera indica L.) Flowers, Molecules, 15, 7715-7723 (2010).
Clinical and Laboratory Standards Institute (CLSI), "Performance standards for antimicrobial susceptibility testing", 21st international supplements, CLSI Document M100-S21, Wayne, Pennsylvania, 2011.
G. Matiz, M. Osorio, G. León, Actividad antibacteriana in vitro de diecinueve aceites esenciales frente a bacterias asociadas al acné, Rev. Cubana Farm ., 49 (1), 103-116 (2015).
M. Torrenegra, G. Matiz, G. León, J. Gil, Actividad antibacteriana in vitro de aceites esenciales frente a microorganismos implicados en el acné, Rev. Cubana Farm., 49 (3), 512-523 (2015).
G. Matiz, M. Osorio, Actividad antibacterial de extractos de hormigas de los géneros Crematogaster y Solenopsis, Rev. Colomb. Cienc. Quím. Farm ., 42 (1), 42-55 (2013).
G.E. Matiz-Melo, K.F. Fuentes-López, G. León-Méndez, Microencapsulación de aceite esencial de tomillo (Thymus vulgaris) en matrices poliméricas de almidón de ñame (Dioscorea rotundata) modificado, Rev. Colomb. Cienc. Quím. Farm ., 44 (2), 189-207 (2015).
J.E. Pérez, G. Isaza, S. Acosta, Actividad antibacteriana de extractos de Phenax rugosus y Tabebuia chrysantha, Biosalud, 6, 59-68 (2007).
S. Sutton, Measurement of cell concentration in suspension by optical density, Pharm. Microbiol. Forum Newsletter, 12 (8), 3-13 (2006).
A. López, A. García, J. Rojas, Evaluación de dos metodologías para determinar la actividad antimicrobiana de plantas medicinales, Boletín Latinoamer. Caribe Plant. Med. AromAt, 4 (2), 28-32 (2005).
H.W. Wang, Y.Q. Liu, S.L. Wei, Z.J. Yan, X. Jin, Comparative chemical composition of the essential oils obtained by microwave-assisted hydrodistillation and hydrodistillation from Agrimonia pilosa Ledeb. Collected in three different regions of China, Chem. Biodivers ., 9 (3), 662-668 (2012).
C.A. Rincón, J.C. Castaño, E. Ríos, Actividad biológica de los aceites esenciales de Acmella ciliata (Kunth) Cass., Rev. Cubana Plant. Med ., 17 (2), 160 (2012)
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Santanu Chakraborty, Manami Dhibar, Aliviya Das, Kalpana Swain, Satyanarayan Pattnaik. (2023). Essential Oils. , p.521. https://doi.org/10.1002/9781119829614.ch23.
2. Rosa Aparicio zambrano, Judith Velasco Carrillo, Rafael Paredes Uzcategui, Luis Rojas Fermín. (2019). Caracterización química y actividad antibacteriana del aceite esencial de Mangifera indica L. de tres regiones de Venezuela. Revista Colombiana de Química, 48(3), p.13. https://doi.org/10.15446/rev.colomb.quim.v48n3.79292.
3. Glicerio León-Méndez, Nerlis Pájaro-Castro, Enilson Pájaro-Castro, Miladys Torrenegra- Alarcón, Adriana Herrera-Barros. (2019). Essential oils as a source of bioactive molecules. Revista Colombiana de Ciencias Químico-Farmacéuticas, 48(1), p.80. https://doi.org/10.15446/rcciquifa.v48n1.80067.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2017 Revista Colombiana de Ciencias Químico-Farmacéuticas

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
El Departamento de Farmacia de la Facultad de Ciencias de la Universidad Nacional de Colombia autoriza la fotocopia de artículos y textos para fines de uso académico o interno de las instituciones citando la fuente. Las ideas emitidas por los autores son responsabilidad expresa de estos y no de la revista.
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons de Atribución 4.0 aprobada en Colombia. Consulte la normativa en: http://co.creativecommons.org/?page_id=13



















