Evaluación de anticuerpos anti-Trichinella spiralis obtenidos por inmunizaciones sublinguales y convencionales con la proteína 45kDa
Evaluation of Anti-Trichinella spiralis Obtained by Sublingual and Conventional Immunizations with the 45kDa Protein
DOI:
https://doi.org/10.15446/abc.v22n2.56809Palabras clave:
diagnóstico, inmunología, parasitología. (es)diagnosis, immunology, parasitology. (en)
Descargas
La trichinellosis es una enfermedad parasitaria zoonótica y cosmopolita, se debe al consumo de carne deficientemente cocida, principalmente proveniente del cerdo, diversos estudios avalan la eficacia de la administración de inmunoterapia. Se ha caracterizado un antígeno inmunodominante de 45 kDa y se plantea como objetivo evaluar la presencia de anticuerpos IgA, IgM e IgG anti-Trichinella spiralis a lo largo de la infección, así como el comportamiento en la administración de la inmunización de 45 kDa de Trichinella spiralis (T. spiralis) administrado por vía sublingual y vía parenteral. Se utilizaron 36 murinos (Long Evans), seis para la infección y purificación del antígeno de 45 kDa, 30 para formar los grupos de trabajo, control sano (cinco murinos), control infectado (cinco murinos), y 20 para los grupos experimentales, se inmunizaron dos grupos con cuatro dosis (0, 7, 14 y 21 días) del inmunógeno de 45 KDa de T. spiralis, uno por vía sublingual y otro por vía parenteral y se retaron con 500 larvas infectantes (LI) de T. spiralis siete días después de la ultima inmunización y dos grupos más se infectaron con 500 LI y se inmunizaron a las cuatro semanas postinfección por ambas vías. La respuesta se evaluó por inmunofluorescencia indirecta (IFI) por microscopia confocal para determinar la respuesta humoral con anticuerpos de clase IgG, IgM e IgA.
Trichinellosis is a cosmopolitan zoonotic disease produced mainly by the consumption of poorly cooked swine meat. Several studies have probed the efficiency of immunotherapy as a method for the treatment of trichinellosis. In this work, a 45 kDa immunodominant antigen was characterized, and the presence of IgA, IgM and IgG anti-Trichinella spiralis antibodies was evaluated during the course of the infection. In addition, the differences between sublingual and parenteral administration of the 45 kDa T. spiralis antigen were determined. Long Evans rats were used both to purify the 45 kDa antigen and to evaluate the immune response produced in six different groups: healthy and infected controls; two groups of immunized murines (sublingually and parenterally) with 4 doses of the 45 kDa T. spiralis immunogen administered at days 0, 7, 14 and 21 and challenged with 500 T. spiralis infective larvae (IL) 7 days after the last immunization; and finally, two groups of murines infected with 500 IL of T. spiralis, immunized at week 4 post infection by the same two routes. The humoral response was evaluated by indirect immunofluorescence by confocal microscopyin order to determine the presence of IgA, IgM and IgG antibodies.
DOI: https://doi.org/10.15446/abc.v22n2.56809
EVALUACIÓN DE ANTICUERPOS ANTI-Trichinella spiralis OBTENIDOS POR INMUNIZACIONES SUBLINGUALES Y CONVENCIONALES CON LA PROTEÍNA 45kDa
Evaluation of Anti-Trichinella spiralis Obtained by Sublingual and Conventional Immunizations with the 45kDa Protein
Francisca CHÁVEZ RUVALCABA1, María Isabel CHÁVEZ RUVALCABA2, Carlos Eduardo HERNÁNDEZ LUNA1, José Jesús MUÑOZ ESCOBEDO3, José Luis MUÑOZ CARRILLO1, María Alejandra MORENO GARCÍA2.
1 Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León, Pedro de Alba S/N, Ciudad Universitaria, San Nicolás de los Garza, N.L., México.
2 Unidad Académica de Ciencias Biológicas de la Universidad Autónoma de Zacatecas. Zacatecas, México.
3 Facultad de Odontología de la Universidad Autónoma de Zacatecas, Jardín Juárez 147, Centro Historico, Zacatecas Centro, 98000 Zacatecas, México.
For correspondence. charuva@hotmail.com
Received: 4th April 2016, Returned for revision: 5th May 2016, Accepted: 3rd October 2016.
Associate Editor: Juan F. Gonzalez.
Citation/Citar este artículo como: Chávez Ruvalcaba F, Chávez Ruvalcaba MI, Hernández Luna CE, Muñoz Escobedo JJ, Muñoz Carrillo JL, Moreno García MA. Evaluación de anticuerpos anti-Trichinellaspiralis obtenidos por inmunizaciones sublinguales y convencionales con la proteína 45kDa. Acta biol. Colomb. 2017;22(2):149-156. DOI: https://doi.org/10.15446/abc.v22n2.56809
RESUMEN
La trichinellosis es una enfermedad parasitaria zoonótica y cosmopolita, se debe al consumo de carne deficientemente cocida, principalmente proveniente del cerdo, diversos estudios avalan la eficacia de la administración de inmunoterapia. Se ha caracterizado un antígeno inmunodominante de 45 kDa y se plantea como objetivo evaluar la presencia de anticuerpos IgA, IgM e IgG antti-Trichinella spiralis a lo largo de la infección, así como el comportamiento en la administración de la inmunización de 45 kDa de Trichinella spiralis (T. spiralis) administrado por vía sublingual y vía parenteral. Se utilizaron 36 murinos (Long Evans), seis para la infección y purificación del antígeno de 45 kDa, 30 para formar los grupos de trabajo, control sano (cinco murinos), control infectado (cinco murinos), y 20 para los grupos experimentales, se inmunizaron dos grupos con cuatro dosis (0, 7, 14 y 21 días) del inmunógeno de 45 KDa de T. spiralis, uno por vía sublingual y otro por vía parenteral y se retaron con 500 larvas infectantes (LI) de T. spiralis siete días después de la ultima inmunización y dos grupos más se infectaron con 500 LI y se inmunizaron a las cuatro semanas postinfección por ambas vías. La respuesta se evaluó por inmunofluorescencia indirecta (IFI) por microscopia confocal para determinar la respuesta humoral con anticuerpos de clase IgG, IgM e IgA.
Palabras clave: diagnóstico, inmunología, parasitología.
ABSTRACT
Trichinellosis is a cosmopolitan zoonotic disease produced mainly by the consumption of poorly cooked swine meat. Several studies have probed the efficiency of immunotherapy as a method for the treatment of trichinellosis. In this work, a 45 kDa immunodominant antigen was characterized, and the presence of IgA, IgM and IgG antti-Trichinella spiralis antibodies was evaluated during the course of the infection. In addition, the differences between sublingual and parenteral administration of the 45 kDa T. spiralis antigen were determined. Long Evans rats were used both to purify the 45 kDa antigen and to evaluate the immune response produced in six different groups: healthy and infected controls; two groups of immunized murines (sublingually and parenterally) with four doses of the 45 kDa T. spiralis immunogen administered at days 0, 7, 14 and 21 and challenged with 500 T. spiralis infective larvae (IL) 7 days after the last immunization; and finally, two groups of murines infected with 500 IL ofT. spiralis, immunized at week 4 post infection by the same two routes. The humoral response was evaluated by indirect immunofluorescence by confocal microscopyin order to determine the presence of IgA, IgM and IgG antibodies.
Keywords: diagnosis, immunology, parasitology.
INTRODUCCIÓN
La trichinellosis es una enfermedad parasitaria zoonótica que afecta a mamíferos silvestres y domésticos, se trasmite de modo accidental al hombre por ingestión de carne o productos cárnicos insuficientemente cocidos, procedentes de animales infectados (Ilic et al., 2012; Gu et al., 2013; Bruschi y Dupouy-Camet, 2014; Chu et al., 2014; Cui et al., 2014; Ilic et al., 2014; Wang et al., 2014; Wei et al., 2015). No sólo afecta la salud pública, si no también representa un problema económico en la producción animal porcina y la seguridad alimentaria (Cui et al., 2014; Gao et al., 2014; Lia et al., 2014; Wang et al., 2014). La OMS la clasifica como la séptima enfermedad parasitaria de transmisión alimentaria de mayor impacto mundial (OMS, 2014).
Debido a la importancia zoonótica, los principales esfuerzos en muchos países se han centrado en el control y eliminación del parásito en la cadena alimentaria (Gajadhar et al., 2009; Molina et al., 2012). Trichinella spiralis (T. spiralis) se encuentra entre los patógenos con mayor complejidad antigénica, esta enfermedad tiene problemas al diagnóstico en los humanos y animales, pero la técnica de Western Blot (WB) detecta el patrón característico del triplete inmunodominante de la enfermedad de 43, 45 y 48 kDa característico de la enfermedad (Maldonado et al., 2007; Salinas et al., 2007), mientras otros autores manejan que el triplete característico es 45, 49 y 53 kDa (Ilic et al., 2014). Las vacunas son la tecnología sanitaria más eficaz, junto con los programas de inmunización, son intervenciones de mayor rentabilidad en salud pública, se logran mayores beneficios (Solórzano et al., 2004). El predominio global de la enfermedad es difícil de evaluar, se calcula que 11 millones de personas pueden estar infectados (Wei et al., 2011; Lia et al., 2014; Yang et al., 2015), mientras que Ilic et al. (2014), estiman que el número de casos nuevos en el mundo es de 2500 personas por año.
A lo largo del tiempo se ha estudiado la biología de T. spiralis, así como el comportamiento inmunológico que presenta el hospedero, para buscar métodos de control, erradicación y tratamiento de la trichinellosis, por lo cual el objetivo principal observar el comportamiento de inmunoglobulinas IgA, IgG e IgM y in policlonal, la modificación de estas con la administración del inmunógeno así como la disminución de la carga parasitaria, debido a los trabajos realizados para el dignóstico de la enfermedad, podemos asumir como hipótesis que la inmunoglobulina que tiene un efecto mayor es la IgG, y que la proteína de 45kDa disminuye la carga parasitaria respecto al control infectado.
MATERIALES Y MÉTODOS
Se utilizaron 42 murinos (ratas) hembras de la cepa Long Evans de aproximadamente dos meses y medio de edad, seis para la elaboración del inmunógeno de 45 kDa de T. spiralis y cinco para cada uno de los grupos controles sanos e infectados y grupos experimentales: control sano (CS): al cual no se le dio ningún tratamiento, seis semanas después se sacrificaron; control infectado (CI): los murinos de dos meses y medios, se infectaron con 500 LI de T. spiralis y se sacrificaron a las seis semanas; el tercer grupo, se inmunizó a cinco murinos de dos meses y medio por el método parenteral con el inmunógeno de 45kDa de T. spiralis a los cero (vía muscular), siete (vía subcutánea), 14 (vía muscular) y 21 (vía peritoneal) días, a la cuarta semana se retaron con 500 LI de T. spiralis y se sacrificaron a las seis semanas; el cuarto grupo, se infectaron cinco murinos con aproximadamente 500 LI, después de cuatro semanas postinfección se aplicó por el método parenteral el inmunógeno de 45 kDa de T. spiralis a los cero (vía muscular), siete (vía subcutánea), 14 (vía muscular) y 21 (vía peritoneal) días y se sacrificaron a las seis semanas; quinto grupo, se inmunizaron a cinco murinos por vía sublingual con el inmunógeno de 45 kDa de T. spiralis a los 0, 7, 14 y 21 días, a las cuarta semanas se retaron con 500 LI de T. spiralis y se sacrificaron a las seis semanas; sexto grupo, se infectaron cinco murinos con aproximadamente 500 LI, después de cuatro semanas postinfección se aplicó vía sublingual el inmunógeno de 45 kDa de T. spiralis a los 0, 7, 14 y 21 días y se sacrificaron a las seis semanas. Para la inmunización se tomó como día cero la cuarta semana de post infección, cada uno de los murinos se le realizaron cinco sangrados (preinfección o preinmunización y antemortem), por medio de seno venoso orbital con tubo capilar por presión con un volumen medio de 0,1-0,5 ml al animal anestesiado en cámara de gas con halotano (C2HBrClF3) los primeros dos sangrados y por punción cardiaca con un volumen mayor a 0,5 ml con animal anestesiado antes del sacrificio, obteniendo suero sanguíneo para realizar una técnica inmunoquímica como lo es la inmunofluorescencia indirecta. Los modelos animales utilizados para el trabajo experimental fueron manejados y sacrificados bajo los lineamientos de la Norma Oficial Mexicana (NOM) NOM-062-ZOO-1999 que contempla las especificaciones técnicas para la reproducción, cuidado y uso de animales de laboratorio.
Del músculo infectado con LI de T. spiralis se obtuvo el Antígeno soluble total (AST) al cual se le realizó electroforesis en geles de poliacrilamida SDS (SDS-PÁGE), reducido en condiciones del 10 % geles de poliacrilamida. En la porción del gel que contenía el triplete característico de 42, 43 y 45 kDa se separó por elución, con solución de Tris 10 mM, a un pH de 8,13, adicionándole inhibidores de proteasa, posteriormente se homogenizo mediante centrifugación a 12100 x gravedades a 4° C durante 30 min. La proteína que se obtuvo del sobrenadante, se le realizó la determinación de concentración de proteína por el método de Bradford. Posteriormente se filtró mediante las membranas que permitió el paso del péptido de 45 kDa, el sobre nadante se tomó para ser analizado por el SDS-EPPA reducido a 10 %, en el gel para confirmar la presencia de este inmunógeno. Posteriormente estas fracciones se utilizaron como inmunógeno (Chapa et al., 1992; Chávez, 2013).
Se obtuvo secuenciación de la proteína por medio de una base de datos general del software ProteinLinx Global Server (PLGS), para después hacerlo con un método de proceso donde se usó la base de datos especifica de T. spiralis, está fue obtenida de la Universal Uniprot-SwissProt donde se afirmó que los péptidos identificados tienen más del 95 % de confiabilidad y masas exactas menores a 10 ppm (Chávez, 2013).
Se utilizaron muestras de 30 g de tejido (masetero, lengua, intercostal, diafragma y pierna), se incubaron a 37 °C, en un tamíz de tul en forma de saco, suspendido en una solución al 0,3 % de pepsina (10000 U) y HCl al 37 % (0,2 M) en 500 ml de agua destilada, dentro de un embudo de separación, se esperó 24 horas para separar el paquete larvario con las LI, que se depositarán en el fondo de cada embudo y se observaron en una cámara de newbawer al microscopio óptico con lente 10 X y se cuantifico el número de LI (Del Río y Herrera, 1986; García et al., 2012; Lia et al., 2014). Se realizó a todos los grupos experimentales determinación de características de célula nodriza.
Por medio de la técnica de inmunofluorescencia se detectan complejos antígeno-anticuerpo, se usan anticuerpos Anti-inmunoglobulinas de ratas marcado con isotiocianato de fluoresceína. Esta técnica cuenta con una mayor sensibilidad en comparación con técnicas como ELISA y Western blot para la determinación de inmunoglobulinas, lo que nos permite definir la localización en la LI de T. spiralis.
La técnica se implementó en fase líquida, en un microtubo se colocaron 15 μl de LI de T. spiralis obtenidas por digestión artificial, lavadas anteriormente en una solución de PBS-Twen al 5 %, con 1000 μl de PBS, se realizan tres lavados por cinco minutos, se extraen 900 μl de PBS en el último lavado y se incuba por 45 min con 20 μl del primer anticuerpo (suero problema), se hacen tres lavados más por cinco minutos con PBS y se incuba 45 min más con 40 μl del segundo anticuerpo (anti IgG, IgA e IgM) en una dilución de 1-1000, se hacen tres lavados, se colocó en un portaobjetos aproximadamente 1 μl, se cubrió con portaobjetos y se examinó en el microscopio de fluorescencia. Si la reacción es positiva, se producirá la formación del complejo antígeno-anticuerpo (Venturiello et al., 1998).
RESULTADOS
En el presente estudió se analizaron un total de 36 murinos hembras de la cepa Long Evans de los cuales 30 se dividieron en seis grupos: control sano, control infectado, inmunizado vía parenteral y retados, infectados e inmunizados vía parenteral, inmunizados vía sublingual y retados e infectados e inmunizados vía sublingual, y seis para la elaboración del inmunógeno de 45 kDa.
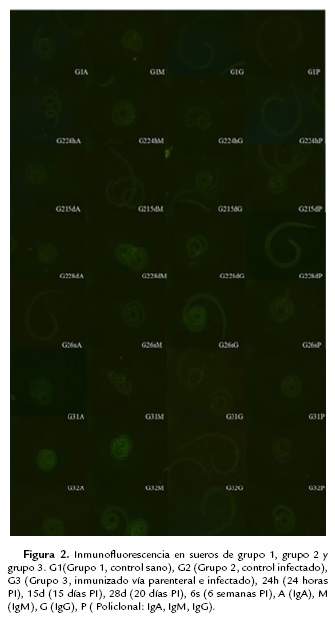
Los sueros de murinos obtenidos en los diferentes tiempos de las inmunizaciones y grupos fueron analizados por medio de inmunoflourescencia indirecta en microcopio confocal con anticuerpos monoclonales IgA, IgM, IgG y policlonal (IgA, IgM, e IgG), donde se pudo observar la interacción de los anticuerpos presentes, en base a los controles negativos y positivos, y como se ha llevado a cabo en cortes histológicos por otros autores, los sueros que marcaban una fluorescencia en la cutícula y esticosoma son determinados como positivos y en los que no había fluorescencia o solo se presentaba en el esticosito se clasificaron como negativas (Fig. 1).
Como se puede observar en la figura 2, no se presenta fluorescencia en ninguna de las muestras con ningún anticuerpo (G1A, G1M, G1G y G1P), con respecto al control infectado, mientras que el control infectado a las 24 h postinfección solo se identificó por medio de IgM (G224hM), a partir de los 15 días postinfección la IgG y con el anticuerpo policlonal dieron positivos por inmunofluorescencia y se mantuvo a los 28 días y las seis semanas, mientras que por el anticuerpo IgA no se presentó interacción antígeno-anticuerpo.
En el grupo tres (inmunizado vía parenteral y retado con 500 LI), por medio del anticuerpo policlonal (IgA, IgG e IgM) se identificó desde la primera inmunización, el anticuerpo IgA durante la primera y segunda inmunización descendiendo en la tercera y cuarta inmunización y volviéndose a presentar al momento del reto, mientras que la IgM hizo interacción a partir de la segunda inmunización presentándose hasta el reto, con el anticuerpo IgG este al igual como se menciona en la literatura presentó positividad hasta la tercera inmunización manteniéndose hasta el reto.
Los sueros analizados del grupo 4, fueron principalmente positivos desde la primera inmunización hasta el sacrificio, con cada una de las inmunoglobulinas, con excepción de la 1ra inmunización después de la infección con la inmunoglubilina IgA, manteniéndose la respuesta inmunitaria después de la infección debido a la estimulación de las inmunizaciones subsecuentes (Fig. 1 y 2).
A diferencia con la inmunización parenteral, en la sublingual se pudo observar la interacción con la IgA, desde la tercera inmunización manteniéndose hasta el reto, por lo cual ocurre la estimulación de la respuesta inmune humoral a nivel de mucosas y permite que el parásito adulto que se encuentra en estómago (etapa entérica), pueda ser eliminado con mayor éxito, al analizarse con IgM se observó en inmunización sublingual una interacción en la cuarta inmunización, mientras que en la parenteral desde la tercera, las muestras analizadas con IgG y policlonal se presentan igual tanto por vía sublingual como en la parenteral (Fig. 1 y 5).
A diferencia del grupo cuatro (infección e inmunización parenteral), en el grupo seis (infección inmunización sublingual) no se identificó la interacción antígeno anticuerpo con IgA en la primera inmunización, siguiendo el mismo patrón con IgM, IgG y policlonal en los diferentes tiempos de inmunización (Fig. 1 y 5), dando positivos en cada uno.
Se realizó un análisis de varianza de los datos obtenidos con el programa Stargraphics Centurion. En el ANOVA simple teniendo como variable dependiente larvas y como factor, los grupos de tratamiento se realizaron 180 observaciones, presentando un p<0.05 mostrando que es estadísticamente significativo, con un nivel de confianza del 95 %, mostrando que el diagnóstico con inmunoflourescencia para Trichinella spiralis es altamente significativo y puede utilizarse como diferencial de otros tipos de parasitosis.
DISCUSIÓN
La inmunoterapia activa para combatir la Trichinellosis se ha utilizado a través del tiempo con gran éxito. Reveles etal. (2000) utilizó antígeno soluble total para modificar el implante de LI enquistadas de T. spiralis en músculo estriado de cerdo, obteniendo como resultado que los animales que recibieron inmunoterapia subieron de peso 10 kg como promedio, su pelo se hizo brillante y menos erizo, en la compresión inicial, al observarla al microscopio de luz, se encontraron LI de T. spiralis calcificadas. Posterior a la inmunoterapia, hubo un aumento de vascularización, aumento de acúmulos de grasa, aumento de polimorfonucleares y disminución del número de LI calcificadas, lo cual llevo a utilizar otro modelo experimental, Moreno (2000) realizó un estudió donde se utilizaron antígenos solubles totales de T. spiralis en rata, lo que permitió una reducción en la carga parasitaria y daño a la célula nodriza y la larva infectante, concordando con Laredo et al., (2012), que inmunizaron ratas Long Evans con AST de T. spiralis y sacrificadas a diferentes tiempos, encontrando una disminución en la carga parasitaria, mostrando un efecto protector contra la parasitosis, observándose la perdida de espiral y modificación del quiste del parásito, debido a los resultados obtenidos en estos dos modelos y detectándose tanto en los grupos experimentales como en los controles infectados, un triplete característico de T. spiralis, Maldonado et al. (2007), utilizaron Ag de T. spiralis de 45 kDa en rata, con lo que pudo obtener una disminución en la carga parasitaria, inhibición en la implantación del parásito, y daño a la célula nodriza, lo cual condujo a probar el antígeno inmunoprotector por dos diferentes vías: la parenteral y la sublingual, encontrando una disminución del 50 % en la sublingual con respecto al control infectado, Bautista (2004), realizó un experimento donde se aplicó Ag de T. spiralis con Lactobacillus casei en ratón BALB/c, para lograr la protección contra la infección y la disminución de carga parasitaria. Dea (2006), logró la disminución de la carga parasitaria por medio de la utilización de Ag TSL1 en copolímeros de ratón y Gamble (1985), utilizó Ag purificados con Ac monoclonales de ratón, con lo que pudo observar una disminución en la cantidad de parásitos intestinales, menos fecundación de la hembra adulta y menos carga parasitaria. Chávez (2013) comparó el AST de T. spiralis con el inmunógeno de 45kDa observando una mejor respuesta inmunólogica con el inmunógeno, por lo cual en el presente estudio se opto por utilizarlo por diferentes vías de inmunización para evaluar la presencia de IgA, IgM e IgG anti-T. spiralis a diferentes tiempos de inmunización.
Wei et al. (2011) presentaron un antígeno protector que induce inmunidad parcial contra la infección por T. spiralis en ratones BALB/c, mientras tanto Cui et al. (2014) caracterizaron 12 Ac monoclonales, de los cuales diez reconocieron por medio de Western blot bandas entre 19,3-119,8 kDa (principalmente 28,7-68,4 kDa), con la generación y caracterización de estos, proporcionan bases para el desarrollo de técnicas de diagnóstico serológico especificas para trichinellosis, Yang et al. (2014) purificaron y evaluaron una proteína recombinante TsDAF-21 como potencial antígeno por Western blot el cual fue reconocido en suero de ratones a los 14, 21 y 28 días PI no así en la etapa temprana de la infección (siete días). Wei et al. 2015) clonaron e identificaron un gen Tspst en un sistema de expresión de E. coli, que codifica una proteína de 29 kDa la cual tiene una buena inmunogenicidad en ratones y se puede utilizar como un inmunógeno para producir anticuerpos. Ilic et al. (2014) consideran que la prueba estándar de oro por serología para el diagnóstico de Trichinella es Western blot para distinguir los antígenos de reacción cruzada diferencia de técnicas comúnmente utilizadas como lo son inmunofluorescencia indirecta y ELISA.
La técnica de Western blot ha sido utilizada de forma industrial para el diagnóstico de T. spiralis, Yera et al. (2013) utilizaron la técnica para evitar reacciones cruzadas observadas con imnufluorescencia indirecta y ensayos de inmunoabsorción ligados a enzimas, utilizaron antígenos de extractos crudos de T. spiralis para analizar 60 sueros de pacientes con T. spiralis, 11 sueros de pacientes sanos y 51 sueros de pacientes con otras enfermedades parasitarias (cisticercosis, esquistosomiasis, strongyloidosis, fascioliasis, toxocariasis, amebiasis hígado, anisakiasis, filariasis, la toxoplasmosis, la hidatidosis, malaria), bandas de 43, 44 y 64 se encontraron en 51 sueros con T. spiralis y cuatro de nueve sueros de pacientes en etapas tempranas de la enfermedad.
En el estudio realizado en el Laboratorio Nacional de Referencia de Serbia para la detección de Trichinellosis en sueros de diferentes hospederos (humano, caballo, cerdo y perro) por la técnica de western blot, se pudo apreciar la presencia de una triada de bandas con masas moleculares de 45, 49 y 53 kDa, esta misma triada reconocida por un anticuerpo monoclonal especifico 7C2C5 (Ilic et al., 2014) e identificada en nuestro estudio en los sueros controles a partir de los 21d PI hasta las seis semanas, en los grupos 3 y 5 al reto con LI y en los grupos 4 y 6 desde la infección y durante las cuatro inmunizaciones con la proteína de 45kDa y la inmunoflourescencia con el anticuerpo policlonal (IgA, IgM e IgG) al igual que con el anticuerpo de IgG. Radovic et al. (2012) realizaron transferencias por western de antígenos de ES de T. spiralis para determinar qué componentes parasitarios fueron responsables de la reactividad cruzada observada por IFI, de sueros con autoanticuerpos y sueros infectados con T. spiralis, para determinar que antígenos podían estar conservados evolutivamente en el parásito y en hospedero, se pudo observar que el suero positivo control, que contenía anticuerpos específicos anti-Trichinella reconocía bandas de 45, 49 y 53 kDa (la tríada-Trichinella específica) que contiene el epítopo inmunodominante para la etapa de larvas musculares del género Trichinella, mientras que el realizado en suero con autoanticuerpos reacciono con uno o dos de las bandas en esta tríada, por lo cual el patrón de bandas observado en transferencias de Western blot realizadas con los sueros que contienen autoanticuerpos difería del patrón obtenido usando los sueros positivos de T. spiralis.
En inmunizaciones con AST de T. spiralis se detectó por medio de western Blot el 60 % de sueros inmunizados y posteriormente se reto con LI de T. spiralis los cuales fueron todos positivos, al igual que en nuestro trabajo por medio del western blot con el anticuerpo policlonal (IgA, IgM e IgG), (Moreno et al., 2012).
Sun et al., (2015) analizaron por medio de ELISA la sensibilidad y especificidad de tres diferentes antígenos de T. spiralis (antígenos crudos de parásitos adultos, antígenos de ES de parásitos adultos y antígenos de ES de larvas musculares) para detectar IgG anti-Trichinella en sueros de ratones experimentalmente infectados y en sueros de pacientes con trichinellosis, en sueros de los ocho a los diez días PI infectados con 500 LI se detectaron anticuerpos anti-T.spiralis con cada una de los antígenos, sin embargo a los 12 d PI con el antígeno de larvas musculares no hubo presencia de anticuerpos, así como en los sueros de pacientes infectados a los 19 d PI (75 %), concordando con este estudio que los mejores antígenos para el diagnóstico de anticuerpos anti-T spiralis son los de ES de larvas adultas.
Cui et al. (2014) en el estudio realizado con la purificación de la proteína de 31 kDa reveló que la inmunotinción fue ampliamente distribuido en la totalidad del cuerpo de los parásitos (larva muscular, gusanos adultos, larva preencapsulada y larva recién nacida), en el mismo año Cui et al. (2014), caracterizaron anticuerpos monoclonales que al realizar esta técnica, mostró que nueve de los 12 anticuerpos reaccionaron en cutícula y órganos internos de T. spiralis.
Yang et al. (2014), purificaron y evaluaron la proteína recombinante TsDAF-21 para ser utilizada como un antígeno para el diagnóstico de T. spiralis y realizaron un ensaño de inmunolocalización el cual arrojó que esta proteína se expresa en las diferentes etapas de T. spiralis (larvas recién nacidas, larvas musculares y gusanos adultos).
En la necesidad de encontrar nuevos métodos para el control de la enfermedad, se han implementado el uso de bacterias inmunoestimulantes, ácido lácticos (Lactobacillus casei), ya que son parte de las bacterias comensales que contribuyen al mantenimiento de la homeostasis inmunológica en el intestino y se ha comprobado que con una solo aplicación induce protección inespecífica contra este nematodo (Martínez et al., 2009).
La exclusión inmune representa la primera línea de defensa contra helmintos intestinales y se refiere a la protección de la superficie de la mucosa por medio de anticuerpos (IgA e IgM de secreción) y otros factores innatos (Contreras, 2001), por lo cual en el presente trabajo la vía de administración sublingual presentó una mayor protección contra la infección por T. spiralis y por medio de inmunofluorescencia se puede apreciar que a partir de la tercera inmunización vía sublingual hay una presencia de IgA anti-T. spiralis, ya que en trichinellosis la respuesta humoral y celular especifica del hospedero se desarrolla así los diversos estadios del ciclo de vida del parásito. Este se manifiesta a nivel intestinal como una respuesta inflamatoria que causa la expulsión del parásito, y a nivel muscular como la formación de infiltrados celulares (Alcantara y Correa, 1996), por lo cual podemos referir que la disminución de la carga parasitaria fue debida al aumento de inmunoglobulinas en mucosas. Takashashi et al. (1995) menciona que en el humano está comprobado que los antígenos de respuesta lenta, son detectados por anticuerpos de la clase IgM, mientras que antígenos de respuesta rápida por la clase IgG, aumentándose ambas en el presente trabajo.
CONCLUSIÓN
La técnica de inmunofluoresecencia indirecta es especifica y sensible a la detección de anticuerpos de clase IgA, IgG e IgM en el diagnóstico de Trichinella spiralis, así mismo permite detectar la evolución de la enfermedad y la cinética de las inmunoglobulinas a la aplicación de inmunógenos.
AGRADECIMIENTOS
Al laboratorio de Biología Celular y Microbiología de la Unidad Académica de Ciencias Biológicas de la Universidad Autónoma de Zacatecas y al Consejo Nacional de Ciencia y Tecnología.
CONFLICT OF INTEREST
The authors declare that they have no conflict of interest.
REFERENCIAS
Alcantara P, Correa P. Human humoral immune response agains Trichinella spiralis. J Parasitol. 1993;23:657-660. Doi:10.1007/s00436-003-0931-5.
Bruschi F, Dupouy-Camet J. Helmint Infections and their Impacto on Global Public Health. Springer; Vienna. 2014. p. 229-279.
Chapa RMR, Salinas T, Aguilar A, Martínez M. Recognition of Trichinella spiralis muscle larvae antigens by sera from human infected with this parasite and its potential use in diagnosis. Rev Latin Microbiol. 1992;34:95-99.
Chávez EG. Caracterización de la respuesta inmune generada por la inmunización e inmunoterapia de la proteína de 45 kDa y del antígeno soluble total (AST) de Trichinella spiralis. Tesis de Doctorado en Ciencias con Acentuación en Microbiología. UANL. 2013:65.
Chu KB, Kim S, Lee SH, Joo KH, Lee K, Lee Y, Zheng S, Quan F. Enhanced protection agains Clonorchis sinensis induced by co-infection with Trichinella spiralis in rats. Parasite Immunol. 2014;36:522-530. Doi:10.1111/pim.12125.
Contreras A. Trichinellosis humana: análisis longitudinal de la respuesta de anticuerpos IgM e IgG sericos dirigidos contra el estadio adulto de Trichinella spiralis y de su utilidad en el diagnóstico de la trichinellosis humana. Dirección General UNAM: México. 2001. p.
CuiJ, Wang L, Sun G, Liu LN, Zhang SB, Liu RD, Zhang X, Jiand P, Wang ZQ. Characterization of Trichinellaspiralis 31 kDa protein and its potential application for the serodiagnosis of Trichinellosis. Acta Tropica. 2014;142:52-63.
Cui J, Jing FJ, Fu GY, Ren HJ, Liu LN, Wang ZQ. Preparation and characterization of monoclonal antibodies agains ES antigens of Trichinella spiralis. Helminthologia. 2014;51:253-261.
Del Rio A, Herrera DR. Triquinosis experimental: Extracción de antígenos y procedimientos para detectar anticuerpos. Archivos de Investigación Médica. 1986;359-367.
Gajardhar AA, Pozio E, Gamble HR. Trichinella diagnostics and control: mandatory and best practices for ensuring food safety. Vet Parasitol. 2009;23:197-205.
Gamble HR, Rapic D, Marmculic A, Murrell KD. Evaluation of excretion-secretory antigens for the serodiagnosis of swine trichinellosis. Vet Parasitol. 1988;30:131-136.
García MJ, Reveles G, Muñoz J, Moreno M. Utilidad del albendazol/quinfamida en el tratamiento de la fase intestinal de la infección por Trichinella spiralis en modelo murino. Archivos Venezolanos de Farmacología y Terapéutica. 2012;31:51-61.
Gao F, Wang R, Liu M. Trichinella spiralis, potential model nematode for epigenetics and its implication in metazoan parasitism. Front Physiol. 2014;4:1-5. Doi:10.3389/fphys.2013.00410.
Gu Y, Wei J, Yang J, Huang J, Yang X, Zhu X. Protective Immunity against Trichinella spiralis infectiom induced by a Multi-epitope Vaccine in a Murine Model. 2013;8(19): e77238. Doi:10.1371/journal.pone.0077238.
Ilic N, Gruden-Movsesijan A, Sofronic-Milosavljevic L. Trichinella spiralis: shaping the immune response. Immunol Serbia. 2012;82:111-119.
Ilic N, Gruden-Movsesijan A, Zivojinovic M, Sofronic-Milosavjevic L. Characteristic band pattern in western blots for especific detection of anti-Trichinella spiralis antibodies in different host species. Acta Veterinaria-Beograd Versitia. 2014;64:33-43.
Laverde L, Builes L, Masso C. Detección de Trichinella spiralis en cerdos faneados en dos plantas de beneficio en el municipio de Bello. Ces. Med. Vet. Zootec. 2012; 4:47-56.
Lia C, Liu M, Bai X, Liu P, Wang X, Li T. Characterisation of a plancitoxi-1-like DNase II gene in Trichinella spiralis. PLoS Negl Trop Dis. 2014;8:8. Doi:10.1371/journal.pntd.
Martínez G, Santiago R, Bautista G. Effect of Lactobacillus caseishirota strain intraperitoneal adminstration in CD1 mice on the establishment of Trichinella spiralis adult worms and on IgA anti-T. spiralis production. Vet Parasitol. 2009;162:171-175.
Maldonado TC, Reveles RG, Saldivar ES, Muñoz JJ, Morales MV, Moreno MA. Evaluación del efecto protector de 2 inmunógenos de Trichinella spiralis en ratas long Evans con modificación nutricional e infectado con Trichinella spiralis. Archivos Venezolanos de Farmacología y Terapéutica. 2007: 26(2):110-114.
Molina V, Albarracín S, Krivokapich S, Chiosso C, Mancini S, Bigatti R, Arbusti P, Avila A, Larrieu E. Seroepidemiología y control de Trichinellosis en credos en Sierra Grande, Argentina. In Vet. 2012;14:33-40.
Moreno A, García A, Saldivar S, Reveles R, Muñoz J. Evaluación del Efecto Protector de 3 inmunógenos en modelo experimental murino y cerdo e infectado con Trichinella spiralis. Redvet. 2012:13(2):1-12.
NORMA Oficial Mexicana NOM-062-ZOO-1999, Especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio. Secretaría de Agricultura, Ganadería y Desarrollo sural. Diario Oficial de la Federación. Available at: http://www.ibt.unam.mx/computo/pdfs/bioterio.NOM-062.pdf.
Radovic I, Gruden-Movsesijan A, Ilic N, Mostarica-Stojkovic M, Sofronic-Milisavljevic L. Trichinellaspiralis shares epitopes with human autoantigens. Mem Inst Oswaldo Cruz. 2012;107:503-509.
Reveles G, Muñoz J, Saldivar SJ, Moreno MA. Efectos de la inmunoterapia sobre larvas infectadas (LI) de Trichinella spiralis implantadas en músculo estriado en modelo experimental. Bioline International. 2000:17(2):126.
Salinas TM, Navarrete LA, Mendez LB, Esquivel AD, Martínez A, Hernandez S. Trichinella spiralis: strong antibody response to a 49kDa newborn larva antigen in infected rats. Exp Parasitol. 2007;2:160-167. Doi:10.1016/j. exppara.2006.07.007.
Solórzano CC, Anchus J, Periago MR. El desarrollo de nuevas vacunas: generación de información para la toma de decisiones. Rev Panam Salud Pública. 2004.
Sun G, Wang Z, Liu C, Jiang P, Liu R, Wen H, Qi X, Wang L, Cui J. Early serodiagnosis of trichinellosis by ELISA using excretory-secretory antigens of Trichinella spiralis adult worms. Parasit Vectors. 2015;484:1-8 Doi:10.1186/s13071-015-1094-9.
Takahashi Y, Goto C, Kita K. Ultraestructural study of Trichinella spiralis with emphasis on adult female reproductive organs. J Helminthol. 1995;69:247-252. Doi:10.1017/S0022149X00001632.
Venturiello SM, Malmassari SN, Costantino SN, Nuñez G. Cytotoxicity-blocking antibodies in human chronic trichinelosis. Parasitol Res. 1998;86:762-767.
Venturiello S, Constantino SN, Nuñez GG. Alteraciones fisiopatológicas y relación inmunológica hospedador-parásito en trichinellosis. Rev Mex Cienc Farm. 2011;149:35.
Wang L, Cui J, Hu D, Lui R and Wang Z. Identificación of early diagnostic antigens from major excretory-secretory proteins of Trichinella spiralis muscle larvae using inmmunoproteomics. Parasit Vectors. 2014;7:40. Doi:10.1186/1756-3305-7-40.
Wei J, Gu Y, Yang J, Yang Y, Wang S, Cui S, Zhu X. Identification and characterization of protective epitope of Trichinella spiralis paramyosin. Vaccine. 2011;29:3162-3168. Doi:10.1371/journal.pone.0077238.
Wei Y, Ling GL, Ruo DL, Ge GS, Chun YL, Shuai BZ. Molecular identification and characterization of Trichinella spiralis proteosome subunit beta type-7. Parasit Vectors. 2015;8:18. Doi:10.1186/s13071-014-0626-z.
Yang J, Pan W, Sun X, Zhao X, Yuan G, Sun Q. Inmunoproteomic profile of Trichinella spiralis adult worm proteins recognized by early infection sera. Parasit Vectors. 2015;8:20. Doi:10.1186/s13071-015-0641-8 Yera H, Andiva S, Perret C, Limonne D, Boireau P, Dupouy-Camet J. Development and Evaluation of a Western blot kit for Diagnosis of Human Trichinellosis. Clin Diagn Lab Immunol. 2013;10:793-796.
Referencias
Alcantara P, Correa P. Human humoral immune response agains Trichinella spiralis. J Parasitol. 1993;23:657-660. Doi:10.1007/s00436-003-0931-5
Bruschi F, Dupouy-Camet J. Helmint Infections and their Impacto on Global Public Health. Springer;Vienna. 2014. p. 229-279.
Chapa RMR, Salinas T, Aguilar A, Martínez M. Recognition of Trichinella spiralis muscle larvae antigens by sera from human infected with this parasite and its potential use in diagnosis. Rev Latin Microbiol. 1992;34:95-99.
Chávez EG. Caracterización de la respuesta inmune generada por la inmunización e inmunoterapia de la proteína de 45 kDa y del antígeno soluble total (AST) de Trichinella spiralis. Tesis de Doctorado en Ciencias con Acentuación en Microbiología. UANL. 2013:65
Chu KB, Kim S, Lee SH, Joo KH, Lee K, Lee Y, Zheng S, Quan F. Enhanced protection agains Clonorchis sinensis induced by co-infection with Trichinella spiralis in rats. Parasite Immunol. 2014;36:522-530. Doi:10.1111/pim.12125.
Contreras A. Trichinellosis humana: análisis longitudinal de la respuesta de anticuerpos IgM e IgG sericos dirigidos contra el estadio adulto de Trichinella spiralis y de su utilidad en el diagnóstico de la trichinellosis humana. Dirección General UNAM: México. 2001. p.
Cui J, Wang L, Sun G, Liu LN, Zhang SB, Liu RD, Zhang X, Jiand P, Wang ZQ. Characterization of Trichinellaspiralis 31 kDa protein and its potential application for the serodiagnosis of Trichinellosis. Acta Tropica. 2014;142:52-63.
Cui J, Jing FJ, Fu GY, Ren HJ, Liu LN, Wang ZQ. Preparation and characterization of monoclonal antibodies agains ES antigens of Trichinella spiralis. Helminthologia. 2014;51:253-261.
Del Rio A, Herrera DR. Triquinosis experimental: Extracción de antígenos y procedimientos para detectar anticuerpos. Archivos de Investigación Médica. 1986;359-367.
Gajardhar AA, Pozio E, Gamble HR. Trichinella diagnostics and control: mandatory and best practices for ensuring food safety. Vet Parasitol. 2009;23:197-205.
Gamble HR, Rapic D, Marmculic A, Murrell KD. Evaluation of excretion-secretory antigens for the serodiagnosis of swine trichinellosis. Vet Parasitol. 1988;30:131-136.
García MJ, Reveles G, Muñoz J, Moreno M. Utilidad del albendazol/quinfamida en el tratamiento de la fase intestinal de la infección por Trichinella spiralis en modelo murino. Archivos Venezolanos de Farmacología y Terapéutica. 2012;31:51-61.
Gao F, Wang R, Liu M. Trichinella spiralis, potential model nematode for epigenetics and its implication in metazoan parasitism. Front Physiol. 2014;4:1-5. Doi:10.3389/fphys.2013.00410
Gu Y, Wei J, Yang J, Huang J, Yang X, Zhu X. Protective Immunity against Trichinella spiralis infectiom induced by a Multi-epitope Vaccine in a Murine Model. 2013;8(19): e77238. Doi:10.1371/journal.pone.0077238
Ilic N, Gruden-Movsesijan A, Sofronic-Milosavljevic L. Trichinella spiralis: shaping the immune response. Immunol Serbia. 2012;82:111-119.
Ilic N, Gruden-Movsesijan A, Zivojinovic M, Sofronic-Milosavjevic L. Characteristic band pattern in western blots for especific detection of anti-Trichinella spiralis antibodies in different host species. Acta Veterinaria-Beograd Versitia. 2014;64:33-43.
Laverde L, Builes L, Masso C. Detección de Trichinella spiralis en cerdos faneados en dos plantas de beneficio en el municipio de Bello. Ces. Med. Vet. Zootec. 2012; 4:47-56.
Lia C, Liu M, Bai X, Liu P, Wang X, Li T. Characterisation of a plancitoxi-1-like DNase II gene in Trichinella spiralis. PLoS Negl Trop Dis. 2014;8:8. Doi:10.1371/journal.pntd
Martínez G, Santiago R, Bautista G. Effect of Lactobacillus caseishirota strain intraperitoneal adminstration in CD1 mice on the establishment of Trichinella spiralis adult worms and on IgA anti-T. spiralis production. Vet Parasitol. 2009;162:171-175.
Maldonado TC, Reveles RG, Saldivar ES, Muñoz JJ, Morales MV, Moreno MA. Evaluación del efecto protector de 2 inmunógenos de Trichinella spiralis en ratas long Evans con modificación nutricional e infectado con Trichinella spiralis. Archivos Venezolanos de Farmacología y Terapéutica. 2007: 26(2):110-114.
Molina V, Albarracín S, Krivokapich S, Chiosso C, Mancini S, Bigatti R, Arbusti P, Avila A, Larrieu E. Seroepidemiología y control de Trichinellosis en credos en Sierra Grande, Argentina. In Vet. 2012;14:33-40.
Moreno A, García A, Saldivar S, Reveles R, Muñoz J. Evaluación del Efecto Protector de 3 inmunógenos en modelo experimental murino y cerdo e infectado con Trichinella spiralis. Redvet. 2012:13(2):1-12
NORMA Oficial Mexicana NOM-062-ZOO-1999, Especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio. Secretaría de Agricultura, Ganadería y Desarrollo sural. Diario Oficial de la Federación. Available at: http://www.ibt.unam.mx/computo/pdfs/bioterio.NOM-062.pdf
Radovic I, Gruden-Movsesijan A, Ilic N, Mostarica-Stojkovic M, Sofronic-Milisavljevic L. Trichinellaspiralis shares epitopes with human autoantigens. Mem Inst Oswaldo Cruz. 2012;107:503-509.
Reveles G, Muñoz J, Saldivar SJ, Moreno MA. Efectos de la inmunoterapia sobre larvas infectadas (LI) de Trichinella spiralis implantadas en músculo estriado en modelo experimental. Bioline International. 2000:17(2):126.
Salinas TM, Navarrete LA, Mendez LB, Esquivel AD, Martínez A, Hernandez S. Trichinella spiralis: strong antibody response to a 49kDa newborn larva antigen in infected rats. Exp Parasitol. 2007;2:160-167. Doi:10.1016/j.exppara.2006.07.007
Solórzano CC, Anchus J, Periago MR. El desarrollo de nuevas vacunas: generación de información para la toma de decisiones. Rev Panam Salud Pública. 2004.
Sun G, Wang Z, Liu C, Jiang P, Liu R, Wen H, Qi X, Wang L, Cui J. Early serodiagnosis of trichinellosis by ELISA using excretory-secretory antigens of Trichinella spiralis adult worms. Parasit Vectors. 2015;484:1-8 Doi:10.1186/s13071-015-1094-9
Takahashi Y, Goto C, Kita K. Ultraestructural study of Trichinella spiralis with emphasis on adult female reproductive organs. J Helminthol. 1995;69:247-252. Doi:10.1017/S0022149X00001632
Venturiello SM, Malmassari SN, Costantino SN, Nuñez G. Cytotoxicity-blocking antibodies in human chronic trichinelosis. Parasitol Res. 1998;86:762-767.
Venturiello S, Constantino SN, Nuñez GG. Alteraciones fisiopatológicas y relación inmunológica hospedador-parásito en trichinellosis. Rev Mex Cienc Farm. 2011;149:35.
Wang L, Cui J, Hu D, Lui R and Wang Z. Identificación of early diagnostic antigens from major excretory-secretory proteins of Trichinella spiralis muscle larvae using inmmunoproteomics. Parasit Vectors. 2014;7:40. Doi:10.1186/1756-3305-7-40
Wei J, Gu Y, Yang J, Yang Y, Wang S, Cui S, Zhu X. Identification and characterization of protective epitope of Trichinella spiralis paramyosin. Vaccine. 2011;29:3162-3168. Doi:10.1371/journal.pone.0077238
Wei Y, Ling GL, Ruo DL, Ge GS, Chun YL, Shuai BZ. Molecular identification and characterization of Trichinella spiralis proteosome subunit beta type-7. Parasit Vectors. 2015;8:18. Doi:10.1186/s13071-014-0626-z
Yang J, Pan W, Sun X, Zhao X, Yuan G, Sun Q. Inmunoproteomic profile of Trichinella spiralis adult worm proteins recognized by early infection sera. Parasit Vectors. 2015;8:20. Doi:10.1186/s13071-015-0641-8
Yera H, Andiva S, Perret C, Limonne D, Boireau P, Dupouy-Camet J. Development and Evaluation of a Western blot kit for Diagnosis of Human Trichinellosis. Clin Diagn Lab Immunol. 2013;10:793-796.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Iván Darío Ocampo-Ibáñez, Yamil Liscano, Sandra Patricia Rivera-Sánchez, José Oñate-Garzón, Ashley Dayan Lugo-Guevara, Liliana Janeth Flórez-Elvira, Maria Cristina Lesmes. (2020). A Novel Cecropin D-Derived Short Cationic Antimicrobial Peptide Exhibits Antibacterial Activity Against Wild-Type and Multidrug-Resistant Strains of Klebsiella pneumoniae and Pseudomonas aeruginosa. Evolutionary Bioinformatics, 16 https://doi.org/10.1177/1176934320936266.
2. José Luis Muñoz-Carrillo, Claudia Maldonado-Tapia, Argelia López- Luna, José Jesús Muñoz-Escobedo, Juan Armando Flores-De La Torre, Alejandra Moreno-García. (2019). Parasites and Parasitic Diseases. https://doi.org/10.5772/intechopen.80372.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2017 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).