Crioconservación de semen de dorada Brycon moorei con dimetilsulfóxido
Cryopreservation of dorada Brycon moorei sperm with dimethyl sulfoxide
DOI:
https://doi.org/10.15446/rev.colomb.biote.v19n2.59987Palabras clave:
Concentración espermática, crioprotector, glucosa, Movilidad, velocidad (es)Cryoprotectant, glucose, motility, sperm concentration, velocity (en)
El objetivo fue evaluar la calidad del semen descongelado de dorada Brycon moorei crioconservado con dimetilsulfóxido (DMSO) a tres porcentajes de inclusión. El semen se obtuvo de nueve machos mantenidos en cautiverio en la Estación Piscícola Repelón (Atlántico, Col), inducidos con extracto pituitario de carpa (4,5 mg/kg). El semen fue diluido en proporción 1:3 con un diluyente compuesto de DMSO a tres porcentajes 5%, 10% y 15%; glucosa al 6% y yema de huevo al 12%; empacado en macrotubos de 2,5 ml, congelados en vapores de nitrógeno y después de tres meses descongelados a 35°C durante 90 s. Semen fresco fue considerando como tratamiento control. En semen descongelado se evaluó movilidad total, tipos de movilidades, progresividad, velocidades y concentración espermática con el programa Sperm Class Analyzer SCA®; adicionalmente en semen fresco se determinó volumen, color y tiempo de activación. El semen fresco presentó movilidad mayor a 80% y tiempo de activación entre 28,5 y 41 s; mientras que, la concentración espermática osciló entre 10188,1 y 14590,2 millones/ml. La movilidad total del semen descongelado fue mayor cuando DMSO se incluyó a 5% (40,1±5,0%) o 10% (43,3±8,7%) (p>0,05); pero a 15% registró la menor movilidad (30,6±7,9%) y el mayor porcentaje de espermatozoides inmóviles (69.4±7.9%) (p<0,05); lo cual sugiere que inclusiones de DMSO por encima de 10% ocasionan mayores daños al espermatozoide de dorada. Los resultados permiten concluir que DMSO debe ser incluido entre 5 y 10%, junto con glucosa al 6% y yema de huevo al 12% para crioconservar semen de dorada.
The aim was assess thawed sperm quality of dorada Brycon moorei, cryopreserved with dimethylsulfoxide (DMSO) to three inclusion rate. The sperm was obtained from nine males, kept in captivity in the Repelón Fish Farming Station (Atlántico, Col), were induced with carp pituitary extract (4.5 mg/kg). The semen was diluted with an extender composed of DMSO to three inclusion rates (5%, 10% and 15%); 6% glucose and 12% egg yolk. The sperm was diluted in 1:3, packed in macrotubes of 2.5 mL and freeze with vapors of nitrogen and after three months were thawed at 35°C for 90 s. The fresh sperm was considered as control treatment. The thawed semen was analyzed total motility, types of motility, progressivity, velocities and sperm concentration with the Sperm Class Analyzer SCA® software; further, volume, color and activation time were measured in fresh semen. The fresh sperm showed motility greater than 80% and activation time between 28.5 and 41 s; whereas that sperm concentration ranged between 10188.1 and 14590.2 million/ml. The total motility of thawed sperm was higher when DMSO was included at 5% (40.1±5.0%) or DMSO 10% (43.3±8.7%) (p> 0.05); but with 15% DMSO, were registered the low motility (30.6±7.9%) and the highest percentage of immotile sperm (69.4±7.9%) (p<0.05); which suggests inclusions of DMSO above 10% cause greater damage to dorada spermatozoa. The results showed that DMSO should be included between 5 and 10%, along with 6% glucose and 12% egg yolk for cryopreservation of dorada sperm.
Recibido: 16 de febrero de 2017; Aceptado: 15 de diciembre de 2017
RESUMEN
El objetivo fue evaluar la calidad del semen descongelado de dorada Brycon moorei crioconservado con dimetilsulfóxido (DMSO) a tres porcentajes de inclusión. El semen se obtuvo de nueve machos mantenidos en cautiverio en la Estación Piscícola Repelón (Atlántico, Col), inducidos con extracto pituitario de carpa (4,5 mg/kg). El semen fue diluido en proporción 1:3 con un diluyente compuesto de DMSO a tres porcentajes 5%, 10% y 15%; glucosa al 6% y yema de huevo al 12%; empacado en macrotubos de 2,5 ml, congelados en vapores de nitrógeno y después de tres meses descongelados a 35°C durante 90 s. Semen fresco fue considerando como tratamiento control. En semen descongelado se evaluó movilidad total, tipos de movilidades, progresividad, velocidades y concentración espermática con el programa Sperm Class Analyzer SCA®; adicionalmente en semen fresco se determinó volumen, color y tiempo de activación. El semen fresco presentó movilidad mayor a 80% y tiempo de activación entre 28,5 y 41 s; mientras que, la concentración espermática osciló entre 10188,1 y 14590,2 millones/ml. La movilidad total del semen descongelado fue mayor cuando DMSO se incluyó a 5% (40,1±5,0%) o 10% (43,3±8,7%) (p>0,05); pero a 15% registró la menor movilidad (30,6±7,9%) y el mayor porcentaje de espermatozoides inmóviles (69.4±7.9%) (p<0,05); lo cual sugiere que inclusiones de DMSO por encima de 10% ocasionan mayores daños al espermatozoide de dorada. Los resultados permiten concluir que DMSO debe ser incluido entre 5 y 10%, junto con glucosa al 6% y yema de huevo al 12% para crioconservar semen de dorada.
Palabras claves:
Concentración espermática, crioprotector, glucosa, Movilidad, velocidad.ABSTRACT
The aim was assess thawed sperm quality of dorada Brycon moorei, cryopreserved with dimethylsulfoxide (DMSO) to three inclusion rate. The sperm was obtained from nine males, kept in captivity in the Repelón Fish Farming Station (Atlántico, Col), were induced with carp pituitary extract (4.5 mg/kg). The semen was diluted with an extender composed of DMSO to three inclusion rates (5%, 10% and 15%); 6% glucose and 12% egg yolk. The sperm was diluted in 1:3, packed in macrotubes of 2.5 mL and freeze with vapors of nitrogen and after three months were thawed at 35°C for 90 s. The fresh sperm was considered as control treatment. The thawed semen was analyzed total motility, types of motility, progressivity, velocities and sperm concentration with the Sperm Class Analyzer SCA® software; further, volume, color and activation time were measured in fresh semen. The fresh sperm showed motility greater than 80% and activation time between 28.5 and 41 s; whereas that sperm concentration ranged between 10188.1 and 14590.2 million/ml. The total motility of thawed sperm was higher when DMSO was included at 5% (40.1±5.0%) or DMSO 10% (43.3±8.7%) (p> 0.05); but with 15% DMSO, were registered the low motility (30.6±7.9%) and the highest percentage of immotile sperm (69.4±7.9%) (p<0.05); which suggests inclusions of DMSO above 10% cause greater damage to dorada spermatozoa. The results showed that DMSO should be included between 5 and 10%, along with 6% glucose and 12% egg yolk for cryopreservation of dorada sperm.
Key words:
Cryoprotectant, glucose, motility, sperm concentration, velocity.INTRODUCCIÓN
La dorada Brycon moorei, es un pez endémico de Colombia, distribuido en las cuencas del Magdalena y el Caribe (Maldonado-Ocampo et al., 2008). En el Magdalena se distribuye en las sub-cuencas de los ríos Cauca, San Jorge, Cesar, La Miel y Manso; mientras que en el Caribe se ha reportado en el Ranchería, desde el Cercado hasta Cuestecita (Mojica et al., 2012). Conocida comúnmente como Dorada, mueluda, sardinata (Magdalena) o lisa (Ranchería) (Mojica et al., 2012); es considerada una especie de gran importancia comercial con potencialidad piscícola debido a su tamaño, rápido crecimiento, alimentación omnívora y aceptación de alimento artificiales (Rodríguez-Franco et al., 2014).
En la cuenca del Magdalena la dorada es considerada vulnerable a la extinción, debido a la alta presión pesquera a que es sometida y la fuerte alteración antrópica que experimenta la cuenca; mientras que en el río Ranchería su situación es considerada crítica (Mojica et al., 2012). Ante esta situación se requiere de acciones de conservación, entre las que se destaca la crioconservación de semen, la cual ha sido considerada una herramienta para la conservación de especies amenazadas o en peligro de extinción mediante el establecimiento de bancos genéticos (Bobe y Labbé, 2009).
La crioconservación ofrece ventajas como optimización de los procesos reproductivos en cautiverio de especies con maduración gonadal asincrónica y ciclos reproductivos estacionales (Atencio-García et al., 2014); así como un uso eficiente del semen durante los procesos de reproducción artificial (Lahnsteiner et al., 2004). Según Medina-Robles et al. (2005) la crioconservación beneficia las actividades de reproducción en acuicultura, porque incrementa la posibilidad de reproducción por fuera de la temporada reproductiva, facilita el movimiento e intercambio de material genético, mejora la eficiencia en la utilización de los parentales y contribuye a disminuir la presión sobre las poblaciones silvestres ejercida por los piscicultores en procura de nuevos sementales.
Existe reportes de crioconservación de semen de más de 200 especies de organismos acuáticos en el mundo (Tiersch, 2011). Sin embargo en Colombia, los estudios de crioconservación de semen de peces nativos son recientes, destacándose los avances en el desarrollo de protocolos de crioconservación de cachama blanca Piaractus brachypomus (Navarro et al., 2004, Ramírez-Merlano et al., 2005), yamú Brycon amazonicus (Cruz-Casallas et al., 2004; Velasco-Santamaría et al., 2006), bagre rayado Pseudoplatystoma metaense (Ramírez-Merlano et al., 2011), bocachico Prochilodus magdalenae (Atencio et al., 2013) y bagre blanco Sorubim cuspicaudus (Atencio-García et al., 2014); con resultados satisfactorios del semen crioconservado en la reproducción artificial de estas especies.
Sin embargo, al tratar de utilizar estos protocolos en otras especies los resultados no han sido los mejores, debido a que se considera un proceso especie-específico (Lim y Le, 2013). Para que un protocolo de crioconservación de semen de una especie de pez sea exitoso es necesario ajustar cada uno de los factores considerados críticos en la realización de este proceso, entre los cuales se destacan la recolección del semen, la composición del diluyente, la concentración del crioprotector, y las curvas de congelación y descongelación (Tiersch, 2011, Irawan et al., 2010).
Los diluyentes o agentes crioprotectores son soluciones que tienen como función proteger la integridad del espermatozoide de la acción tóxica de los productos generados por su propio metabolismo durante el proceso de crioconservación, y reducir la temperatura de congelación del medio en el que se encuentran suspendidas las células para disminuir o contrarrestar la formación de cristales de hielo (Woods et al., 2004). La determinación del porcentaje de inclusión del crioprotector es importante porque define la capacidad de protección a la célula espermática y reduce la toxicidad sobre la misma. Por tanto, el objetivo de presente estudio fue evaluar el uso de dimetilsulfóxido (DMSO) a tres porcentajes de inclusión (5, 10, 15%) como crioprotector en la crioconservación de semen de dorada Brycon moorei evaluando la calidad seminal post-descongelación.
MÉTODOS
Material biológico
La investigación se realizó en Instituto de Investigaciones Piscícola de la Universidad de Córdoba - CINPIC (Monteria, Córdoba). Se seleccionaron nueve machos de dorada de dos años de edad, en fase de espermiación, mantenidos bajo condiciones de cautiverio en la Estación Piscícola de Repelón (EPR) de la Autoridad Nacional de Acuicultura y Pesca - AUNAP (Repelón, Atlántico); los cuales fueron transportados al CINPIC vía terrestre en tanques de 1000 l con aireación permanente. Luego fueron mantenidos durante 48 h en tanques circulares de 3m3 de volumen útil, con flujo de agua constante (5 L/min) para habituarlos a las condiciones experimentales, reducir la intensidad del estrés generado por la manipulación y el cambio de ambiente. Los machos seleccionados, con peso promedio de 1000±200 g estaban en fase de espermiación; es decir a leve presión en la cavidad celómica en sentido cráneo-caudal liberaron líquido seminal (Atencio et al., 2013). Los machos fueron inducidos con una dosis única de extracto hipofisario de carpa (EPC) a razón de 4,5 mg/Kg de peso vivo para incrementar el volumen seminal (Atencio, 2001). Todos los procedimientos que implicaron la manipulación de los animales fueron realizados de conformidad con las normas y procedimientos para el uso de animales de laboratorio, descritos por el Committee on Care and Use of Laboratory Animal Resources National Research - Council of the National Academies (USA).
Obtención del semen
El semen se obtuvo entre las 6-7 horas post-inducción y para su extracción los machos fueron previamente tranquilizados por inmersión directa en una solución de Eugenol (Proquident, Colombia) a razón de 0,5 ml/10 l de agua (Perez Ribeiro et al., 2010). El semen fresco fue medido volumen, color, tiempo de activación, movilidad total, tipos de movilidad, progresividad, velocidades y concentración espermática; mientras que en el semen descongelado solo se analizó movilidad total, tipos de movilidad, progresividad y velocidades espermáticas.
Tratamientos y crioconservación de semen
Para el proceso de crioconservación solo se utilizó semen con movilidad total mayor a 80%. El diluyente fue preparado con dimetilsulfóxido (DMSO) (Sigma Chemical Co., St. Louis, MO, USA) a tres porcentajes (5, 10, 15% v/v), glucosa 6% (p/v) y yema de huevo 12% (v/v). El semen fresco fue considerando como tratamiento control. El semen fue diluido en proporción 1:3 (Velasco-Santamaría et al., 2006) y luego depositadas en macrotubos de 2,5 ml.
Congelación y descongelación. La congelación se realizó en vapores de nitrógeno en un dry shipper de 4L (MVE, SC 4/2v, USA) durante 30 minutos. La tasa de enfriamiento del vapor de nitrógeno fue descrita por Cruz-Casallas et al. (2006a) asi: de 28 a -20ºC desciende a 27,3ºC/min, de -20 a -100ºC baja a 29,9ºC/min y de -100 a -196ºC el descenso es de 5,5ºC/min. Al alcanzar la temperatura de crioconservación (≈196ºC), los macrotubos fueron trasladados a un termo de almacenamiento de 34L (MVE, XC 34/18, USA) y sumergidos en nitrógeno líquido. Los macrotubos fueron descongelados, después de tres meses, en baño serológico (Memmert, WNB 7-45, Alemania) a 35°C durante 90 segundos.
Evaluación de la calidad seminal
Volumen y color seminal. La recolección del semen se realizó en tubos Falcón graduados y estériles, se midió el volumen y se reportó el color. En la recolección se evitó la contaminación por orina y otros fluidos (sangre, bilis y heces) como lo sugiere Cruz-Casallas et al. (2006a).
Tiempo de activación de los espermatozoides. Una muestra de 0,25 µl de semen se colocó en una cámara Makler (Sefi Medical Instruments Ltd, Israel) y se activó con 75 µl de agua destilada (dilución 1:300). La medición del tiempo se realizó desde el instante en que se adicionó la solución activadora hasta que alrededor del 90% de los espermatozoides dejó de moverse (Martínez, 2010).
Movilidad total. En una cámara de conteo Makler (Sefi Medical Instruments Ltd, Israel) se colocó una muestra de 0,25 µl de semen y 75 µl de agua destilada (dilución 1:300); con ayuda de un microscopio óptico de contraste de fase (Nikon, E50i, Japón) y el programa Sperm Class Analyzer SCA (Microptic SL, SCA VET 01, España) se midió la movilidad total (Atencio et al., 2013).
Velocidad espermática. Las muestras fueron analizadas en un periodo de cuatro segundos por el programa SCA®, obteniéndose los porcentajes de espermatozoides con velocidad rápida (tipo a, velocidades mayores a 100 µm/s), media (tipo b, velocidades entre 45 y 100 µm/s), lenta (tipo c, velocidades entre 10 y 45 µm/s), así como el porcentaje de células estáticas (tipo d o sin movimiento) (Atencio et al., 2013). El SCA® también estimó las velocidades curvilínea (VCL) y lineal (VSL).
Concentración espermática. Se utilizó 1 µl de semen mezclado con 699 µl de glucosa al 6% en un Eppendorf de 2 mL (dilución 1:700), la mezcla se homogenizó durante cinco segundos en un vortex a 1200 rpm (Velp Scientific, Zxclasic, China). Luego se tomaron 10 µl y se colocaron en una cámara Makler (Sefi Medical Instruments Ltd, Israel) (Atencio et al., 2013). La concentración fue estimada mediante el programa SCA®. De cada macho se obtuvo una repetición para cada tratamiento (n=9) y cada repetición fue evaluada por triplicado para obtener un valor promedio de la característica seminal analizada.
Diseño experimental y análisis estadístico
Se utilizó un diseño completamente al azar y todas las variables estudiadas fueron sometidas a pruebas de normalidad y homogeneidad de varianza. Para las variables que cumplieron estos supuestos se aplicó ANOVA de una sola vía, cuando se encontraron diferencias significativas se realizó la prueba de Rango Múltiple de Tukey. En todos los casos p<0,05 fue utilizado como criterio estadístico para establecer diferencia significativa. Los análisis se realizaron con ayuda del programa Statgraphic Centurion,
RESULTADOS
El color del semen de dorada estuvo en el rango de amarillo pardo a amarillo, con volumen seminal promedio de 3,5±1,8 ml y movilidad total previa al proceso de congelación mayor a 80%, de acuerdo a lo propuesto por Martínez et al. (2011) para Prochilodus magdalenae. El tiempo de activación osciló entre 28,5 y 41 s; mientras que la concentración espermática osciló entre 10188,1 y 14590,2 millones/ml (tabla 1).
Tabla 1: Características del semen fresco de dorada Brycon moorei obtenidos por inducción hormonal (n=9).
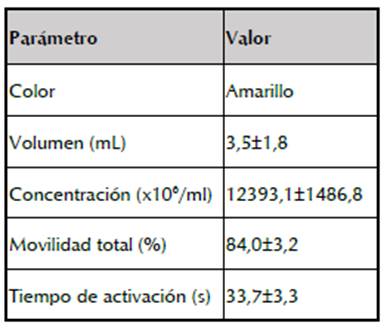
Los valores de movilidad total (84,0±3,2%), progresividad total (52,4±8,8%), velocidad curvilínea (118,7±23,1 µm/s) y velocidad lineal (65,9±15,7 µm/s) de semen fresco fueron mayores con respecto a los registrados en semen descongelado (p<0,05). El semen fresco también registró el mayor porcentaje de espermatozoides con movilidad rápida (44,0±9,6%) y media (16,6±4,7%) y el menor porcentaje de espermatozoides estáticos (17,0±3,7%), se observó diferencia significativa con relación a los registros del semen descongelado (p<0,05) (tabla 2).
Tabla 2: Características seminales de semen fresco y descongelado de dorada Brycon moorei. Letras diferentes en la misma fila indica diferencia significativa (p<0,05).

La movilidad total del semen descongelado fue mayor cuando fue tratado con DMSO 5% (40,1±5,0%) y DMSO 10% (43,3±8,7%) sin observarse diferencia significativa entre estos tratamientos (p>0,05); mientras que DMSO 15% (30,6±7,9%) registró el menor valor (p<0,05). Sin embargo el porcentaje de espermatozoides rápidos en el semen descongelado osciló entre 6,2±4,3% (DMSO 5%) y 1,8±1,3% (DMSO 15%), sin observarse diferencia significativa entre estos tratamientos (p>0,05); así mismo el porcentaje de espermatozoide con movilidad media osciló entre 7,3±5,5% (DMSO 5%) y 5,8±3,3% (DMSO 15%) (p>0,05); mientras que el semen tratado con DMSO 15% registró el mayor porcentaje de espermatozoides estáticos, observándose diferencia significativa con el resto de tratamientos evaluados (p>0,05). Cuando el semen fue crioconservado con DMSO 5%, el porcentaje de espermatozoides con movilidad lenta fue de 26,7±6,4%; valor que no mostró diferencia significativa (p>0,05) con los resultados obtenidos para semen fresco (21,9±5,0%) ni con el semen crioconservado con DMSO 15% (23,0±5,1%) (tabla 2).
La progresividad total del semen descongelado osciló entre 9,9±5,9% (DMSO 5%) y 4,4±2,7% (DMSO 15%) sin observarse diferencia entre estos valores (p>0,05). La velocidad curvilínea del semen descongelado osciló entre 48,3±17,8 µm/s (DMSO 5%) y 35,3±9,2 µm/s (DMSO 15%) (p>0,05). Una tendencia similar fue observada en la velocidad lineal, la cual osciló 25,7±9,3 µm/s (DMSO 5%) y 15,9±5,7 µm/s (DMSO 15%) (tabla 2).
DISCUSIÓN
Los resultados de las características seminales de B. moorei del presente estudio son los primeros registros para machos mantenidos en cautiverio, cuyo semen fue obtenido mediante inducción hormonal. Sin embargo, existen reportes de las características seminales de otros co-específicos del género Brycon en cautiverio, con semen obtenido mediante hipofización como B. sinuensis (Montes y Salgado 2014), B. amazonicus (Cruz-Casallas et al., 2006a) y sin inducción hormonal como B. henni (Montoya-Lopez et al., 2006; Pineda-Santis et al., 2015).
En semen de brycónidos migratorios, obtenido mediante inducción hormonal por hipofización, Montes y Salgado (2014) en B. sinuensis reportaron una concentración espermática de 10058±5493 millones/ml y tiempo de activación entre 27 y 46 seg y Cruz-Casallas et al. (2005) en B. amazonicus registraron concentración de 13900±4000 millones/ml y tiempo de activación de 41±7 s; mientras que Pineda-Santis et al. (2015) en B. henni, un brycónido no migratorio, en semen fresco obtenido sin inducción hormonal, obtuvieron una concentración de 14554±5138 millones/ml, valores que podrían considerarse similares o cercanos a los obtenidos en el presente estudio.
La movilidad total del semen crioconservado es considerada un criterio de calidad espermática, que permite medir el éxito o fracaso del proceso de crioconservación. Padilla (2014) señaló que desde el mismo momento en que el semen entra en contacto con la solución crioprotectora se produce daños en las mitocondrias, membrana espermática y fragmentación del DNA como consecuencia del choque hiperosmótico y la toxicidad del crioprotector y que estos daños se incrementan durante los procesos de congelación y descongelación. La magnitud de los daños criogénicos puede resultar en disminución de la movilidad y velocidad espermáticas; lo cual termina afectando la capacidad fertilizante del semen descongelado (Ramírez-Merlano et al., 2010).
En los resultados del presente estudio, se encontró que en todos los casos el proceso de crioconservación y descongelación causó una reducción de la movilidad total, de las velocidades espermáticas, progresividad total e incrementó el porcentaje de espermatozoides inmóviles en el semen descongelado. La movilidad total del semen descongelado se redujo entre 48-52% con relación a la del semen fresco (84,0%) cuando fue tratado con DMSO 5% (40,1±5,0%) o DMSO 10% (43,3±8,7%) y cayó a alrededor de la tercera parte cuando fue tratado con DMSO 15% (30,6±7,9%). Pineda-Santis et al. (2015) obtuvo una reducción aproximada de 38% de la movilidad total del semen fresco de B henni cuando lo criopreservó con DMSO 5%.
El porcentaje de espermatozoides rápidos en el semen descongelado no mostró diferencia estadística a los diferentes porcentajes de inclusión del DMSO; pero mostró una drástica reducción con relación al semen fresco (44,0±9,6%) cuando fue tratado tanto con DMSO 5% (6,2±4,3%) como con DMSO 15% (1,8±1,3%) (p>0.05). El porcentaje de espermatozoides estáticos (sin movimiento) se triplicó con DMSO 5% (59,0±5,0%) y DMSO 10% (56,7±8,7%) con relación a semen fresco (17,0±3,7%); pero se incrementó a cuatro veces cuando DMSO se utilizó a 15% (69,4±7,9%) (tabla 2).
Las velocidades espermáticas (curvilínea y lineal) del semen descongelado se redujeron en más del 60%; mientras que la progresividad total disminuyó en más del 80% con relación a los registros de semen fresco (tabla 2). A pesar que en estas variables, en el semen descongelado, no hubo diferencia estadística entre las tres inclusiones de DMSO probadas (5, 10 y 15%), se observa una tendencia de menores velocidades y progresividad a medida que aumenta la inclusión del crioprotector. Según Lahnsteiner et al. (2000) la reducción de la velocidad espermática reduce la probabilidad que el espermatozoide alcance el micrópilo.
La movilidad total del semen crioconservado con DMSO 5% o 10%, fueron mayores a las obtenidas con DMSO 15% (p<0,05), lo cual sugiere que porcentajes de inclusión por encima de 10% ocasionan mayores daños a los espermatozoides de dorada; que cuando DMSO se incluye entre 5% y 10%. En otros brycónidos, la crioconservación de semen con DMSO entre 5 y 10%, también ha mostrado resultados adecuados como los reportados por Cruz-Casallas et al. (2006b) para B. amazonicus, quienes encontraron que DMSO a niveles de inclusión entre 5% (76±2%) y 10% (33±4%) permitieron buenos porcentajes de movilidad del semen descongelado. Murgas et al. (2001) reportaron valores de movilidad espermática de 53% en piracanjuba Brycon orbygnyanus utilizando DMSO al 10%, valores muy cercanos a los obtenidos en el presente estudio. Martínez (2010) recomendó crioconservar semen de Prochilodus magdalenae con DMSO a 10% para obtener una alta movilidad total (71±9.02%).
Los daños que sufren las mitocondrias y la membrana citoplasmática en el proceso de crioconservación se consideran como las principales causas de la pérdida de movilidad, tipos de movilidad y velocidades espermáticas (Cabrita et al., 2010; Padilla, 2014). Varios estudios han encontrado alta correlación entre el daño mitocondrial y la movilidad total (Fraser y Strzezek, 2007; Martínez et al, 2012; Padilla, 2014). La funcionalidad de la mitocondria juega un papel importante en la activación espermática, ya que suministra la energía en forma de ATP necesaria el movimiento del espermatozoide y la duración del mismo (Medina-Robles et al., 2005).
Los daños que sufren las mitocondrias se explican como consecuencia de la producción de especies reactivas de oxígeno (EROS); lo cual disminuye la movilidad por el descenso en la fosforilación de proteínas del axonema (O'Connell et al., 2002; Paasch et al., 2004; Martin et al., 2004). Se ha sugerido que el incremento del estrés oxidativo es causado por un desbalance entre la producción y remoción de las EROS que conduce al aumento en la concentración de los radicales libres y en consecuencia un aumento en el daño celular (Gallardo, 2007).
Martínez y Pardo (2010) sugieren que es probable que los crioprotectores interactúan directamente con las reservas de ATP, lo que disminuye su concentración en la célula espermática, como consecuencia del estrés osmótico por la adición del crioprotector y/o por la congelación del agua externa.
He y Woods (2004) crioconservaron semen de Morone saxatilis y encontraron que el nivel de ATP de semen precongelado disminuyó considerablemente cuando el crioprotector entró en contacto con los espermatozoides, y su pérdida fue mayor después de la congelación, lo cual les permitió sugerir que el proceso de crioconservación ocasiona daño en las mitocondrias.
CONCLUSIÓN
Los resultados del presente estudio permiten concluir que DMSO debe ser incluido entre 5 y 10%, junto con glucosa al 6% y yema de huevo al 12% para crioconservar semen de dorada Brycon moorei; ya que concentraciones mayores ocasionan altas pérdidas de calidad del semen crioconservado.
AGRADECIMIENTOS
A la Autoridad Nacional de Acuicultura y Pesca - AUNAP por la financiación del presente estudio mediante convenio 00070/2014 y al apoyo de la vice-rectoría de Investigación y Extensión de la Universidad de Córdoba.
REFERENCIAS BIBLIOGRÁFICAS
Referencias
Aboagla EM., Terada T. 2004. Effects of egg yolk during the freezing step of cryopreservation on the viability of goat spermatozoa. Theriogenology. 62:1160–1172.
Andersson G., Karlberg O., Canback B., Kurland C. 2003. On The Origin Of Mitochondria: A Genomics Perspective. Philos T Roy Soc B. 358:165-179.
Atencio-García V., Pardo-Carrasco S., Espinosa-Araujo J., Pérez-Almanza E. 2013. Evaluación de dimetilacetamida como crioprotector para la crioconservación de semen de bocachico Prochilodus magdalenae. Arch Med Vet. 45:151-158.
Atencio-García VJ., Dorado M., Navarro E., Pérez F., Herrera B., Movilla J., Espinosa-Araujo JA. 2014. Evaluación de etilenglicol como crioprotector en la crioconservación de semen de bagre blanco Sorubim cuspicaudus, Pimelodidae. Acta biol Colomb. 19(2):271-280.
Babiak IJ., Glogowski E., Brzuska J., Szumiec JA. 1997. Cryopreservation of sperm of common carp Cyprinus carpio. Aquac Res. 7:567-571.
Bathgat R., Maxwell WM., Evans G. 2006. Studies on the effect of supplementing boar semen cryopreservation media with different egg yolk types on in vitro post-thaw sperm quality. Reprod Domest Anim. 41:68–73.
Bart AN., Wolfe DF., Dunhan RA. 1998. Cryopreservation of blue catfish spermatozoa and subsequent fertilization of channel catfish eggs. T Am Fish Soc. 127:819-570.
Bobe J., Labbé C. 2009. Egg and sperm quality in fish. Gen Comp Endocrinol. 165(3):535-548.
Brown GG., Mims SD. 1999. Cryopreservation of padllefish Polyodon spathula milt. J World Aquacult Soc. 30:245-249.
Cruz-Casallas PE., Pardo-Carrasco SC., Arias-Castellanos JA., Lombo-Castellanos PE., Lombo-Rodríguez DA., Pardo-Mariño JE. 2004. Cryopreservation of yamú Brycon siebenthalae Milt. J World Aquacult Soc. 35(4):529-535.
Cruz-Casallas P., Medina-Robles V., Velasco Santamaría Y. 2006. Evaluación de diferentes crioprotectores para la crioconservación de espermatozoides de yamú Brycon amazonicus. Rev Col Cienc Pec. 19(2): 152-159.
Figueroa E., Risopatrón J., Sánchez R., Isachenko E., Merino O., Isachenko V., Valdebenito I. 2013. Spermatozoa vitrification of sex-reversed rainbow trout Oncorhynchus mykiss: Effect of seminal plasma on physiological parameters. Aquaculture. 372(375):119– 126.
Fraser L., Strzezek J. 2007. Effect of different procedures of ejaculate collection, extenders and packages on DNA integrity of boar spermatozoa following freezing thawing. Anim Reprod Sci. 99: 317- 329.
Gallardo JM. 2007. Evaluación del sistema antioxidante en el semen normal. Rev Invest Clin. 42:47.
Grassiotto Q., Negräu JN., Carvalho ED., Foresti F. 2001. Ultraestructure of spermatogenic cells and spermatozoa in Hoplias malabaricus (Teleostei, Characiformes, Erythrinidae). J Fish Biol. 59:1494-1502.
He S., Woods L. 2004.Effects of dimethyl sulfoxide and glycine on cryopreservation induced damage of plasma membranes and mitochondria to striped bass Morone saxatilis sperm. Cryobiology. 48: 254–262.
Holt WV. 2000. Basic aspects of frozen storage of semen. Anim Reprod Sci. 62: 3-22.
Horváth A., Urbányi B. 2000. The effect of cryoprotectants on the motility and fertilizing capacity of cryopreserved African catfish Clarias gariepinus (Burchell 1822) sperm. Aquac Res. 31:317-24.
Irawan H., Vuthiphandchai V., Nimrat S. 2010.The effect of extenders, cryoprotectants and cryopreservation methods on common carp Cyprinus carpio sperm. Anim Reprod Sci.; 122: 236-243.
Jiang Z., Li Q., Li W., Hu J., Zhao H., Zhang S. 2007. Effect of low density lipoprotein on DNA integrity of freezing–thawing boar sperm by neutral comet assay. Anim Reprod Sci. 99:401-407.
Kerby J. 1983. Cryogenic preservation of sperm from striped bass. Trans. T Am Fish Soc. 112: 86– 94.
Lahnsteiner F., Berger B., Horvath A., Urbányi B. 2004. Studies on the semen biology and sperm cryopreservation in the starlet, Acipenser ruthenus. Aquac Res. 35:519-528.
Lahnsteiner F., Berger B., Horvath A., Urbányi B., Weismann T. 2000. Cryopresevation of spermatozoa in cyprindid fishes. Theriogenology. 54:1477-1496.
Li Z., Lin Q., Liu R., Xie W., Xiao W. 2007. Reducing oxidative DNA damage by adding antioxidants in human semen samples undergoing cryopreservation procedure. Zhonghua Yi Xue Za Zhi. 87:3174 –7.
Linhart O., Rodina M., Cosson J. 2000. Cryopreservation of sperm in common carp Cyprinus carpio: sperm motility and hatching success of embryos. Cryobiology. 41:241-250.
Maldonado-Ocampo J., Vari R., Usma J. 2008. Checklist of the freshwater fishes of Colombia. Biota Colombiana 9(2):143-237.
Martin G., Sabido O., Durand P., Levy R. 2004. Cryopreservation induces and apoptosis-like mechanism in bull sperm. Biol Reprod. 71: 28-37.
Martínez, G. 2010. Efecto del crioprotector y osmolaridad del diluyente sobre la calidad espermática y el material genético en semen crioconservado de bocachico Prochilodus magdalenae (tesis de maestría). Medellín: Facultad de Ciencias, Universidad Nacional de Colombia sede Medellín; p. 44-45.
Martínez JG., Pardo-Carrasco S. 2010. Crioconservación de semen en peces: efectos sobre la movilidad espermática y la fertilidad. Acta biol Colomb. 15(2):3-24.
Martínez J., Atencio-García V., Pardo-Carrasco S. 2011. Efectos de la concentración de glucosa sobre la activación de la movilidad espermática en bocachico Prochilodus magdalenae (Pisces, Characiformes). Rev MVZ Cordoba. 16(2):2554-2563.
Medina-Robles VM., Velasco-Santamaría YM., Cruz-Casallas PE. 2005. Aspectos generales de la crioconservación espermática en peces teleósteos. Rev Colomb Cienc Pec. 18:34-48.
Mojica, J. Castellanos, C. Usma, S. Álvarez, R. Lasso, A. 2012. Libro rojo de peces dulceacuícolas de Colombia 2012. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, WWF Colombia y Universidad de Manizales p. 99.
Mongkonpunya, K. Pupipat, T. Tiersch, TR. 2000. Cryopreservation of sperm of Asian catfishes, including the endangered Mekong giant catfish. In: Tiersch TR, Mazik PM (eds). Cryopreservation in Aquatic species. The World Aquaculture Society. Louisiana, USA, Baton Rouge; p. 108-116.
Montes, C. Salgado, S. 2014. Efecto de la concentración de glucosa sobre la movilidad espermática de la dorada Brycon sinuensis (Trabajo de pregrado). Córdoba: Departamento ciencias acuícolas, facultad de medicina veterinaria y zootecnia, Universidad de Córdoba.
Montoya-López A., Olivera-Ángel M., Carrillo L. 2006. Algunos aspectos biológicos y del manejo en cautiverio de la sabaleta Brycon henni Eigenmann, 1913 (Pisces: Characidae). Rev Colomb Cienc Pec. 19(2):180-186.
Moussa M., Marinet V., Tainturier D., Anton M. 2002. Low density lipoproteins extracted from the hen egg yolk by an easy method: cryoprotective effect on frozen-thawed bull semen. Theriogenology. 57:1695–1706.
Murgas L., Gualhanone A., Silva M., Mello C., Freitas R., Zangeronimo G. 2001. Calidad seminal del pez piracanjuba Brycon orbignyanus post-descongelación. An Vet. 17: 3-10.
Navarro O., Velasco-Santamaría Y., Cruz-Casallas P. 2004. Evaluación de cinco crioprotectores para la crioconservación de semen de cachama blanca (Piaractus brachypomus). Rev Colomb Cienc Pec. 17:53-59.
O'Connell M., McClure N., Lewis S. 2002. The effects of cryopreservation on sperm morphology, motility and mitochondrial function. Hum Reprod. 1: 704–709.
Ogier-De Baulny B., Le Vern Y., Kerboeuf D., Maisse G. 1997. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved rainbow trout Oncorhynchus mykiss spermatozoa. Cryobiology. 34: 141-149.
Ogier- De Baulny B., Labbe C., Maisse G. 1999. Membrane integrity, mitocondrial activity, ATP content, and motility of the european catfish Silurus glanis testicular spermatozoa after freezing with different cryoprotectans. Cryobiology. 39:177-184.
Paasch U., Sharma R., Gupta A., Grunewald S., Mascha E., Thomas A., et al. 2004. Cryopreservation and thawing is associated with varying extent of activation of apoptotic machinery in subsets of ejaculated human spermatozoa. Biol Reprod. 71:1828-1837.
Padilla, D. 2014. Evaluación de daños en el espermatozoide de bagre blanco Sorubim cuspicaudus durante la crioconservación con etilenglicol (tesis de maestría). Córdoba: Departamento de Química, Facultad de Ciencias Básicas, Universidad de Córdoba.
Pan J., Ding S., Ge J., Yan W., Hao C., Chen J., et al. 2008. Development of cryopreservation for maintaining yellow catfish Pelteobagrus fulvidraco sperm. Aquaculture. 279:173-176.
Pace MM., Graham EF. 1974. Components in egg yolk which protect bovine spermatozoa during freezing. J Anim Sci. 39:1144–1149.
Pérez, E. 2010. Evaluación de dimetilacetamida como crioprotector para la crioconservación de semen de bocachico Prochilodus magdalenae (Trabajo de pregrado). Córdoba: Departamento ciencias acuícolas, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba.
Pinzón-Arciniegas S., Mojica Rodríguez J., Cruz Casallas P. 2005. Ensayos preliminares sobre crioconservación de semen de bagre rayado Pseudoplatystoma fasciatum Linnaeus, 1766. Orinoquia. 9(2): 28- 37.
Ramírez-Merlano J., Velasco-Santamaría Y., Medina-Robles V., Cruz-Casallas P. 2005. Crioconservación de semen de cachama blanca (Piaractus brachypomus Cuvier, 1818): efectos del volumen de empaque y de la sustancia crioprotectora sobre la calidad seminal. Rev Colomb Cienc Pecu. 18:331.
Ramírez- Merlano J., Medina-Robles V., Cruz-Casallas P. 2010. Crioconservación espermática en peces, un acercamiento en Siluriformes. Orinoquia 14(1): 59- 71.
Ramírez-Merlano J., V Medina-Robles., P Cruz-Casallas. 2011. Crioconservación seminal de bagre rayado Pseudoplatystoma metaense (Teleostei, Pimelodidae), bajo diferentes protocolos de congelación. Arch Med Vet. 43:135-144.
Richardson GF., Wilson CE., Crim LW., Yao XZ. 1999. Cryopreservation of yellowtail flounder Pleuronectes ferrugineus semen in large straws. Aquaculture. 174, 89-94.
Taddei AR., Barbato F., Abelli L., Canese S., Moretti F., Rana KJ., Fausto AM., Mazzini M. 2001. Is cryopreservation a homogeneous process? Ultrastructure and motility of untreated, prefreezing, and postthawed spermatozoa of Diplodus puntazzo (Cetti). Cryobiology. 244-255.
Tiersch, TR. 2011. Introduction to the second edition. In: Tiersch TH, Grenn CC (eds). Cryopreservation in aquatic species. 2nd ed. World Aquaculture Society, Baton Rouge, Loussiana, USA, p 1-17.
Tiersch, R. Green C. 2011. Cryopreservation in Aquatic Species, 2nd ed. World Aquaculture Society. Baton Rouge, Louisiana. USA. p 423.
Velasco-Santamaría YM., Medina-Robles VM., Cruz-Casallas PE. 2006. Cryopreservation of yamú Brycon amazonicus sperm for large scale fertilization. Aquaculture. 256:264-271.
Viveiros AT. 2001. Influence of cooling rates and plunging temperatures in an interrupted slow-freezing procedure for semen of the african catfish Clarias gariepinus. Cryobiology. 43:276-287.
Wamecke D., Pluta H. 2003. Motility and fertilizing capacity of frezen/thawed common carp Cyprinus carpio sperm using dimetil-acetamida as the mam cryoprotectant. Aquaculture. 187:361- 375.
Woods E., Benson J., Agca Y., Critser J. 2004. Fundamental cryobiology of reproductive cells and tissues. Cryobiology. 48(2):146-156.
Yao Z., Crim LW., Richardson GF., Emerson CJ. 2000. Motility, fertility and ultrastructural changes of ocean pout Macrozoarces americanus sperm after cryopreservation. Aquaculture. 181: 361-375.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Cesar Montes-Petro, Juan Yepes-Escobar, Carlos Tapia-Pacheco, Diana Madariaga Mendoza, José Espinosa Araujo, Victor Julio Atencio-García. (2024). MADUREZ TESTICULAR Y CALIDAD SEMINAL DE Ichthyoelephas longirostris (Prochilodontidae) DEL MEDIO RÍO CAUCA. Acta Biológica Colombiana, 29(3) https://doi.org/10.15446/abc.v29n3.112600.
2. Víctor M. Medina-Robles, Astrid S. Duarte-Trujillo, Pablo E. Cruz-Casallas. (2020). Crioconservación seminal en peces de agua dulce: aspectos biotecnológicos, celulares y bioquímicos. Orinoquia, 24(2), p.51. https://doi.org/10.22579/20112629.630.
3. Edwin Enrique Herrera-Cruz, Jorge Luis Aristizabal-Regino, Jonny Andrés Yepes-Blandón, Ana Lucía Estrada-Posada, José Alonso Espinosa-Araujo, Víctor Julio Atencio-García. (2019). Criopreservación de semen de bagre rayado Pseudoplatystoma magdaleniatum con tres diferentes crioprotectores. Revista Colombiana de Biotecnología, 21(2), p.55. https://doi.org/10.15446/rev.colomb.biote.v21n2.77847.
4. Paula Graziela Lassen, Maria Eugênia Andrighetto Canozzi, Bruna Bitencourt da Costa, Júlio Otávio Jardim Barcellos, Danilo Pedro Streit. (2022). Cryopreserved Semen Motility of South American Neotropical Fish: A Meta-Analysis. Reviews in Fisheries Science & Aquaculture, 30(1), p.19. https://doi.org/10.1080/23308249.2021.1884643.
5. César Montes-Petro, Víctor Atencio-García, Ana Estrada-Posada, Jonny Yepes-Blandón. (2019). Reproducción en cautiverio de vizcaína Curimata mivartii con extracto pituitario de carpa. Orinoquia, 23(2) https://doi.org/10.22579/20112629.570.
6. A.S. Mamonova, A.A. Belous. (2025). Features of gametogenesis and modern methods of hormonal stimulation of fish in aquaculture: review. Rybovodstvo i rybnoe hozjajstvo (Fish Breeding and Fisheries), (10), p.706. https://doi.org/10.33920/sel-09-2510-02.
7. Priscila Cotta Palhares, Isadora de Lima Assis, José Gilmar da Silva Souza, Thales de Souza França, Renata Catão Egger, Daniella Aparecida de Jesus Paula, Luis David Solis Murgas. (2020). Effect of melatonin supplementation to a cytoprotective medium on post-thawed Brycon orbignyanus sperm quality preserved during different freezing times. Cryobiology, 96, p.159. https://doi.org/10.1016/j.cryobiol.2020.07.002.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2017 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















