EFECTO DE ALCOHOLES Y POLIOLES SOBRE LA ESTABILIDAD ESTRUCTURAL DE LA beta-LACTOGLOBULINA EN SOLUCIÓN ACUOSA
EFECTO DE ALCOHOLES Y POLIOLES SOBRE LA ESTABILIDAD ESTRUCTURAL DE LA β-LACTOGLOBULLNA EN SOLUCIÓN ACUOSA
EFFECT OF ALCOHOLS AND POLYOLS ON THE STRUCTURAL STABILITY OF β-LACTOGLOBULLN IN AQUEOUS SOLUTION
EFEITO DE ALCOÓIS E POLIOLES SOB A ESTABILIDADE ESTRUTURAL DA β-LACTOGLOBULLNA EM SOLUÇÃO AQUOSA
Gloria I. Giraldo1,2, José M. Lozano3, Carmen M. Romero4
1 Departamento de Física y Química, Universidad Nacional de Colombia, sede Manizales, Manizales, Colombia.
3 Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia.
4 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia.
Recibido: 18/12/09 - Aceptado: 07/04/10
RESUMEN
En este trabajo se presenta un estudio sistemático sobre el efecto del incremento en el número de grupos OH de alcoholes y polioles de cuatro carbonos sobre las propiedades conformacionales de la β-lactoglobulina. Los cambios en el comportamiento de las soluciones acuosas de la proteína por la adición de 1-butanol, 1,2-butanodiol, 1,2,4-butano-triol y 1,2,3,4-butanotetrol fueron determinados por espectroscopia UV, de fluorescencia y DC en el UV lejano, y en el UV cercano a 298,15 K. Los resultados muestran que el butanol ejerce una mayor modificación en la estructura de la proteína y el efecto va disminuyendo a medida que se incrementa el número de grupos OH.
Palabras clave: β-lactoglobulina, propiedades conformacionales, estabilidad estructural, alcoholes, polioles.
ABSTRACT
In this work we present a systematic study of the effect of the increase of OH groups in alcohols and polyols of four carbon atoms on the conformational properties of β-lactoglobulin. The changes in the behavior of the aqueous solution of the protein by the addition of 1-butanol, 1,2-butanediol, 1,2,4-butanetriol y 1,2,3,4-butano-tetrol were determined by UV, far and near UV CD spectra and fluorescence spectroscopy at 298.15K. The results show that the largest modification ofprotein structure is due to butanol and the effect decreases as the number of OH groups increase.
Key words: β-lactoglobulin, conformational properties, structural stability, alcohols, polyols.
RESUMO
Neste trabalho apresenta-se um estudo sistemático sob o efeito do acréscimo do número de grupos OH de alcoóis e polióis de quatro carbonos nas propriedades conformacionais da β-lactoglobulina. As mudanças no comportamento das soluções aquosas da proteína, pela adição de 1-butanol, 1,2 butanodiol, 1,2,4 e 1,2,3,4 butanotetrol butanotriol, foram determinados por espectroscopia UV, fluorescência e DC no UV distante, e no UV próximo a 298,15 K. Os resultados mostraram que o butanol tem uma maior influencia na estrutura da proteína, e o seu efeito diminui com o aumento do número de grupos OH.
Palavras-chave: β-lactoglobulina, propriedades conformacionais, estabilidade estrutural, álcool, polióis.
INTRODUCCIÓN
La conformación nativa de las proteínas es controlada por interacciones intramoleculares entre los grupos funcionales de las proteínas y las moléculas de solvente, las cuales son dominantes a baja concentración de proteína. Varios factores -tales como pH, temperatura, presión, o la adición de cosolutos-, afectan la conformación nativa de las proteínas produciendo cambios que pueden causar el desdoblamiento de la proteína.
A pesar de la existencia de numerosos estudios sobre el efecto de distintos cosolutos, el mecanismo por el cual la adición de compuestos de bajo peso molecular contribuye a la estabilidad o al desdoblamiento de las proteínas no ha sido dilucidado, aunque hay evidencia de la influencia que ejerce el agua y la forma como la presencia de otras sustancias cambia las interacciones agua-agua. El efecto de la adición de compuestos de bajo peso molecular, como los alcoholes, sobre las propiedades conformacionales de péptidos y proteínas ha sido estudiado ampliamente, y se ha concluido que el efecto desnaturalizante observado aumenta con la longitud de la cadena hidrocarburo y disminuye con su ramificación (1, 2). Las técnicas espectroscópicas son las más utilizadas para estudiar el efecto del solvente sobre la estructura de proteínas; estas técnicas incluyen dicroísmo circular (DC) en la región ultravioleta (UV) lejano y cercano, espectroscopia UV en el lejano y cercano y espectroscopia de fluorescencia (3).
La β-lactoglobulina es una proteína globular con un PM de 18400 Da que se halla en abundancia en el suero de la leche de muchos mamíferos, pero no se encuentra en la leche humana. Su estructura primaria se conoce completamente y está formada por una sola cadena peptídica de 162 residuos de aminoácidos. La cadena está plegada sobre sí misma, y la estructura terciaria está restringida por dos puentes S-S, quedando un grupo tiol libre. En el estado nativo, la β-lactoglobulina es una proteína predominantemente β, consistente de un barril β, con ocho hebras ¡ antiparalelas (βA - βH), una hebra-β adicional (βI) y una hélice principal (4-8).
Se han realizado varios estudios para analizar el efecto de alcoholes sobre β-lactoglobulina, e igualmente los cambios conformacionales y la influencia sobre sus propiedades funcionales; aunque no está claro el mecanismo por el cual ejercen un efecto desnaturalizante, se ha encontrado que puede ser parcialmente explicado por la disminución de la polaridad de los solventes. Los resultados sugieren que en solventes de baja polaridad, las interacciones hidrofóbicas proteína-agua se debilitan mientras que los enlaces de hidrógenos intramoleculares se fortalecen, teniendo como resultado la desnaturalización de la proteína nativa y la estabilización de estructuras α-hélices extendidas (9, 10).
Con el fin de evaluar el efecto del incremento en el número de grupos OH de alcoholes y polioles de cuatro carbonos sobre las propiedades conformacionales de la β-lactoglobulina, en este trabajo se analizaron los cambios de los espectros de la proteína por espectroscopia UV y de fluorescencia y DC en el UV lejano y UV cercano, así como los cambios en el área superficial accesible de la proteína en presencia de soluciones acuosas de 1-butanol, 1,2-butanodiol, 1,2,4-butanotriol y 1,2,3,4-butanotetrol a 298,15K.
MATERIALES Y MÉTODOS
β -lactoglobulina obtenida a partir de suero de leche bovino siguiendo la metodología descrita en un trabajo previo (11), 1-butanol 99,9% (J. T. Baker); 1,2-butanodiol 99% (Aldrich); 1,2,4-butanotriol 95% (Fluka) y 1,2,3,4-butanotetrol 99% (Sigma). Los reactivos líquidos fueron desgasificados antes de su uso. A los alcoholes se les determinó el contenido de humedad por el método de Karl Fischer. El agua requerida para la preparación de las soluciones fue tratada con KMnO4 y doblemente destilada, de acuerdo con los procedimientos reportados en la literatura (12) obteniendo agua con una conductividad inferior a 2 µS-cm-1. Todas las soluciones fueron preparadas por el método de pesada, en una balanza Precisa, serie XR de doble rango, con una precisión de ± 0,01 mg en el rango inferior.
Los espectros de absorbancia UV/VIS a 298,15K se obtuvieron registrando la absorbancia en un rango de longitudes de onda λ entre 250 y 500 nm, en un espectrofotómetro de doble haz Lambda 20 PERKIN ELMER con una celda de 1 cm de paso y una concentración de proteína de 1 mg-cm-3 en buffer acetato de sodio 10 mM a pH 5,5.
Los espectros de fluorescencia fueron obtenidos entre 300 y 400 nm usando espectrofotómetro Aminco-Browman Serie 2 con una excitación de 280 nm a 298,15 K.
Para evaluar el efecto de los alcoholes y polioles de cuatro carbonos sobre la estabilidad conformacional de β-lactoglobulina se determinaron los espectros UV y de fluorescencia. Para tal efecto la proteína se disolvió en buffer acetato de sodio 10 mM a pH 5,5 y en cada uno de los solventes a una concentración XOH = 0,02 para todos los alcoholes, excepto para el 1-butanol que por su solubilidad se trabajó a XOH de 0,015. Las muestras se dejaron en reposo durante dos horas antes de registrar los espectros.
El análisis de las propiedades estructurales se hizo por espectroscopia de dicroísmo circular (DC) a 298,15 K, en un espectropolarímetro JASCO J-810. Los espectros fueron registrados en un intervalo de longitud de onda entre 190 y 250 nm empleando una celda con un paso de luz de 0,5 cm. El espectro registrado es el promedio de 3 barridos tomados a 20 nm-min-1 y corregidos por línea base empleando el software Jasco. Los resultados se expresan como elipticidad molar residual [Θ]. La determinación de los elementos de estructura secundaria se realiza a partir de la desconvolución de los espectros utilizando el programa CDPro, que emplea tres algoritmos de desconvolución: CONTINLL, SELCON3 y CDSSTR (13).
Para determinar el área superficial expuesta se empleó la prueba de fluorescencia ANS (ácido 1-anilino, 8-naftalensulfónico). Se toman 5 µL de solución de ANS 8 mM, preparada en buffer de acetato 0,01 M pH 5,5, se diluyen con buffer, o con las soluciones alcohólicas según el caso hasta 1 mL y se hacen adiciones de proteína 6,2 µM en volúmenes de 10 µL; la solución se deja en reposo durante un minuto después de cada adición y se determina la intensidad de la señal de fluorescencia a 298,15 K en el espectrofluorímetro con una excitación de 370 nm y una emisión de 480 nm. La pendiente de la gráfica de intensidad de la señal de fluorescencia en función de la concentración de proteína en µM-1 se usa como índice de hidrofobicidad superficial So (14-16). Los resultados corresponden al promedio de dos mediciones.
RESULTADOS Y DISCUSIÓN
La fluorescencia intrínseca es una técnica muy sensible para monitorear los cambios conformacionales de las proteínas, dado que los espectros reflejan cambios en el ambiente y su influencia sobre los residuos de triptófano. La β-lactoglobulina tiene dos residuos triptófano (Trp) en las posiciones 19 y 61. El residuo 19 se encuentra dentro del núcleo hidrofóbico y el 61 forma parte de un "loop" externo; por tanto, los cambios en la señal de fluorescencia se atribuyen al residuo 19, que es expuesto a la superficie del solvente por efecto del desdoblamiento de la molécula (17, 18).
La Figura 1 muestra los espectros de fluorescencia de β-lactoglobulina determinados para la proteína en buffer de acetato y en los alcoholes. Se observa un máximo alrededor de 336 nm para la proteína en buffer acetato 10 mM a pH 5,5. Este valor máximo está de acuerdo con la longitud de onda de máxima emisión para la proteína, registrada en varios trabajos (19, 20). La presencia de 1-butanol produce un pequeño desplazamiento del máximo hacia longitudes de onda más altas, mientras que el 1,2,4-butanotriol produce un desplazamiento hacia longitudes de onda mas bajas.
La absorción que registran las proteínas en el UV cercano puede atribuirse a las transiciones electrónicas (principalmente tipo π -— π*) de los aminoácidos aromáticos, triptófano, tirosina y fenilalanina, porque aunque la histidina posee un anillo de cinco miembros en su cadena lateral, tipo imidazol, su absorción no se extiende en esta región.
La Figura 2 muestra los espectros UV para la proteína en buffer y en presencia de los alcoholes.
El espectro de β-lactoglobulina en el UV cercano presenta el comportamiento típico de una proteína que contiene los aminoácidos aromáticos mencionados anteriormente (3). En general se observa una disminución de la intensidad de la señal de absorbancia de la proteína en presencia de los alcoholes. La disminución es mayor en 1-butanol, lo cual indica que a las concentraciones utilizadas en este estudio, y a la temperatura de 298,15 K, el 1-butanol tiene un efecto marcado sobre la estructura de β-lactoglobulina. Entre 250 y 370 nm, todos los espectros presentan una línea con pendiente nula, que se traduce en que, a las condiciones del ensayo, no hay agregación de la proteína (21).
Al comparar los espectros de absorción de la proteína en las soluciones acuosas de alcoholes y polioles con el registrado en buffer acetato 10 mM pH 5,5, no se observa un desplazamiento significativo de la longitud de onda de máxima intensidad por la adición de los solventes.
La Figura 3 muestra los espectros de DC para β-lactoglobulina en buffer pH de acetato 10 mM pH 5,5 y en cada uno de los solventes.
Los espectros de β-lactoglobulina registrados entre 190 y 260 nm, a pH 5,5 y concentración de 0,1 mg mL-1, exhiben el comportamiento típico de un patrón de hebra β, con un mínimo alrededor de los 215 nm y una banda positiva alrededor de los 198 nm (22).
La adición de los solventes no produce modificaciones significativas en la tendencia estructural de los espectros, pero sí en la intensidad de la señal, indicando que, aunque hay variaciones en el contenido de elementos estructurales tipo hebra β, ésta sigue siendo la forma predominante.
El cálculo de estructura secundaria a partir de los espectros de DC utilizando el programa CD Pro mostró que el algoritmo CONTINLL fue el que presentó menor desviación (RSD); por tanto todos los resultados reportados corresponden a los obtenidos con este método. Esta situación coincide con la evaluación que hace Miles (23) de los diferentes algoritmos y concluye que el CONTINLL, basado en la metodología de Provencher y Glöckner (13), da resultados más precisos.
En la Tabla 1 se resumen los elementos de estructura calculados para β-lactoglobulina en buffer acetato 10 mM pH 5,5 y en las soluciones acuosas de los alcoholes entre 190 y 260 nm para todos los espectros. El rango de valores para la desviación estándar normalizada (NMRSD) que se obtuvo en los resultados de la desconvolución está entre 0,02 y 0,09.
Se aprecia que la β-lactoglobulina disuelta en buffer tiene un contenido de hebra-β del 36%, elementos estructurales tipo hélice-α del 19% tipo giro (turns) del 22% y de regiones no estructuradas u organizadas aleatoriamente en el espacio, de aproximadamente un 23%. Al comparar estos datos con las estructuras dilucidadas a partir de las coordenadas en el espacio consignadas en el banco de datos de proteínas (protein data bank PDB Id: 1BEB) (24) para la proteína, se encuentra que el contenido de elementos tipo hebra-β es de un 41%, de hélices-α del 16,7%, de giros (turns) del 21,6% y de regiones no estructuradas del 20,7%. De acuerdo con esto, se puede argumentar que los datos obtenidos en este estudio tienen un alto grado de semejanza con los obtenidos a partir de la difracción de rayos X sobre cristales de β-lactoglobulina, y que en consecuencia la estructura de la proteína en solución es similar a su estructura cristalina.
La adición de pequeñas cantidades de 1-butanol causa inicialmente un incremento en el contenido de elementos de estructura tipo hebra β y disminución de los elementos de estructuras α-helicoidales. Este comportamiento cambia al aumentar la fracción molar de butanol de 0,015, observándose un incremento del contenido de hélice y a la vez una disminución en el contenido de estructura tipo hebra.
El 1,2-butanodiol tiene un comportamiento diferente al 1-butanol. En todos los casos disminuye el contenido de hélice, y la estructura tipo hebras β sufre ligeros cambios en el rango de concentración evaluado, que no presentan una tendencia definida. En este caso se exhibe un incremento en los elementos no estructurados.
El 1,2,4-butanotriol estabiliza inicialmente los elementos tipo hebra-β, y este efecto disminuye al aumentar la fracción molar del triol.
El comportamiento de los elementos estructurales de la β-lactoglobulina en presencia de 1,2,3,4-butanotetrol muestra una tendencia opuesta a la que presenta cuando se adiciona 1-butanol. Se observa una disminución en el contenido de estructura tipo β que aumenta con la fracción molar del poliol, y a fracción molar de 0,020 la proteína alcanza una estructura similar a la que se tiene en solución buffer acetato 10 mM pH 5,5. Al incrementar la concentración hasta 0,015 se produce un aumento en el contenido de elementos tipo hélice α, resultado que confirma la hipótesis de varios investigadores acerca de la formación de hélices no nativas en la β-lactoglobulina, por efecto de los alcoholes (9, 10, 25).
Cuando se comparan las propiedades estructurales de la proteína en buffer y en presencia de los diferentes alcoholes, no se observan cambios significativos en los elementos estructurales tipo giro (turns)y en las regiones no estructuradas; la variación al aumentar la concentración no sigue una tendencia definida.
Para esta proteína se han hecho estudios previos con metanol, y estos han concluido que en presencia de soluciones de metanol al 30%, la β-lactoglobulina presenta conformaciones compactas desnaturalizadas, pero que conservan parte de su estructura nativa (26). En la literatura no hay datos sobre el efecto del 1-butanol sobre esta proteína. Kientz y Bigelow (27) estudiaron el efecto del dietilenglicol sobre su estructura, encontrando resultados similares en el comportamiento de la estructura de la proteína por adición del diol a baja concentración.
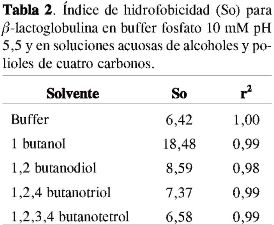
La β-lactoglobulina contiene una alta proporción de aminoácidos hidrofóbicos, que se ubican preferencialmente en el interior de la molécula. Cuando ésta desdobla, se produce un incremento en la superficie hidrofóbica que puede ser evaluada con la prueba de ANS, la cual brinda información acerca de los cambios estructurales de la molécula (15). El cambio en el área superficial accesible por efecto de solventes, determinado como So, se presenta en la Tabla 2.
Los datos muestran un incremento del área superficial accesible al solvente, So, por la presencia de los alcoholes. Este incremento es más marcado para el 1-buta-nol y puede atribuirse al desdoblamiento que tiene la molécula permitiendo una exposición de los grupos apolares a la superficie de la proteína por efecto del solvente. El área superficial accesible disminuye a medida que se incrementa el número de grupos OH, encontrándose que para el 1,2,3,4-butanotetrol este valor puede considerarse igual al obtenido para la proteína en buffer fosfato 10 mM pH 5,5. Los resultados coinciden con los obtenidos por comportamiento DC de los parámetros de desnaturalización alcanzados a partir de las curvas de estabilidad térmica (28).
CONCLUSIONES
Se encontró que la estructura de la proteína en solución es similar a su estructura cristalina.
La adición de los alcoholes estudiados no produce modificaciones significativas en la tendencia estructural de los espectros, y se mantiene el predominio de elementos estructurales tipo hebra β en presencia de los alcoholes considerados.
Los resultados obtenidos al analizar los cambios en el área superficial accesible de la proteína por efecto del solvente ratifican la información obtenida por DC. Se observa una mayor modificación en la estructura de la β-lactoglobulina en presenciade1-butanolquees elcosolutomás hidrofóbico y que tiene un reconocido efecto desnaturalizante; la modificación estructural disminuye a medida que se incrementa el número de grupos OH y, en consecuencia, el carácter hidrofilico del alcohol.
AGRADECIMIENTOS
Los autores agradecen a la Universidad Nacional de Colombia, sedes Bogotá y Manizales, por su apoyo para la realización de este trabajo, y a la Fundación Instituto de Inmunología de Colombia (Fidic), por facilitar el equipo donde se realizaron las determinaciones.
REFERENCIAS BIBLIOGRÁFICAS
1. Brandts, J. F.; Hunt, L. The Thermodynamics of Protein Denaturation. III. The Denaturation of Ribo-nuclease in Water and in Aqueous Urea and Aqueous Ethanol Mixtures. J. Am. Chem. Soc. 1967. 89 (19): 4826-4838.
2. Herskovits, T. T.; Gadegbeku, B.; Jaillet, H. On the Structural Stability and Solvent Denaturation of Proteins I. Denaturation by the Alcohols and Glycols. J. of Biol. Chem. 1970. 245 (10): 2588-2598.
3. Havel, A. H. Spectroscopic Methods for Determining Protein Structure in Solution. New York: VCH Publisher. 1996. pp. 1-67.
4. Sakurai, K.; Oobatake, M.; Yuji, G. Salt-dependent monomer-dimer equilibrium of bovine ß-lactoglobulinat pH3. Prot. Sci. 2001. 10(11): 2325-2335.
5. Forge, V.; Hoshino, M.; Kuwata, K.; Arai, M.; Kuwajima, K.; Batt, C. A.; Goto, Y. Is Folding of ß-Lactoglobulin Non-hierarchic? Intermediate with Native-like ß-Sheet and Non-native a-Helix. J. Mol. Biol. 2000. 296(4): 1039-1051.
6. Uhrínová, S.; Smith, M. H.; Jameson, G. B.; Uhrín, D.; Sawyer, L.; Barlow, P. N. Structural Changes Accompanying pH-Induced Dissociation of the ß-Lactoglobulin Dimer. Biochem. 2000. 39 (13): 3565-3574.
7. Sawyer, L.; Barlow, P. N.; Boland, M. J.; Creamer, L. K.; Denton, H.; Edwards, P. J. B.; Holt, C. J.; Geoffrey, B.; Kontopidis, G.; Norris, G. E.; Uhrínová, S.; Wu, S.-Y. Review: Milk protein structure-what can it tell the dairy industry? Int. Dairy J. 2002. 12 (4): 299-310.
8. Kontopidis, G.; Holt, C., and Sawyer, L. Invited Review: ß-Lactoglo-bulin: Binding Properties. J. Dairy Sci. 2004. 87 (4): 785-796. "
9. Hirota-Nakaoka, N.; Goto, Y. Alcohol-induced Denaturation of ß-Lactoglobulin: A Close Correlation to the Alcohol-induced a-Helix Formation of Melittin. Bioorg. Med. Chem. 1999. 7(1): 67-73.
10. Kumar, S.; Modig, K.; Halle, B. Trifluoroethanol-Induced b-a Transition in ß-Lactoglobulin: Hydration and Cosolvent Binding Studied by 2H, 17O, and 19F Magnetic Relaxation Dispersion. Biochem. 2003. 42 (46): 13708-13716.
11. Lozano, J. M.; Giraldo, G. I.; Romero, C. M. An improved method for isolation of ß-Lactoglobulin. Int. Dairy J. 2008. 18 (1): 55-63.
12. Weissberger, A.; Rossiter, B. Techniques of Chemistry. Physical Methods of Chemistry, Vol. 4, New York: Wiley-Interscience. 1972.
13. Provencher, S. W.; Glöckner, J. Estimation of Globular Protein Secondary Structure from Circular Dichroism. Biochem. 1981. 20 (1): 33-37.
14. Kim, D.; Cornec, M.; Narsimhan, G. Effect of thermal treatment on interfacial properties of beta-lactoglobulin. J. ColloidInterfaceSci. 2005. 285 (1): 100-109.
15. Sava, N.; van der Plancken, I.; Claeys, W.; Hendrickx, M. The Kinetics of Heat-Induced Structural Changes of ß-Lactoglobulin J. Dairy Sci. 2005. 88 (5): 1646-1656.
16. Tubio, G.; Nerli, B.; Pico, G. Relationship between the protein surface hydrophobicity and its partitioning behaviour in aqueous two-phase systems of polyethyleneglycol-dextran. J. Chromatogr. B. 2004 . 799 (2): 293-301.
17. Vetri, V.; Militello, V. Thermal induced conformational changes involved in the aggregation pathways of beta-lactoglobulin. Biophys. Chem. 2005. 113 (1): 83-91.
18. Lee, B. K.; Shimanouchi, T.; Umakoshi, H.; Kuboi, R. Evaluation of carboxylic acid-induced conformational transitions of ß-lactoglobulin: Comparison of the alcohol effects on a-lactoglobulin. Biochem.l Eng. J. 2006. 28 (1): 79-86.
19. Futterman, S.; Joram, H. The Enhancement of Fluorescence and the Decreased Susceptibility to Enzymatic Oxidation of Retinol Complexed with Bovine Serum Albumin, ß-Lactoglobulin, and the Retinol-binding Protein of Human Plasma. J. Biol. Chem. 1972. 247 (16): 5168-5172.
20. Busti, P.; Scarpeci, S.; Gatti, C.; Delorenzi, N. Use of fluorescence methods to monitor unfolding transitions in ß-Lactoglobulin. Food Res. Int. 2002. 35 (9): 871-877.
21. Gómez-Moreno, C., and Sancho Sanz, J. Estructura de proteínas. Barcelona: Ariel Ciencia. 2003.
22. Fasman, G. Circular Dichroism and the Conformational Analysis of Biomolecules. New York: Plenum Press. 1996.
23. Miles, A. J.; Whitmore, L.; Wallace, B. A. Spectral magnitude effects on the analyses of secondary structure from circular dichroism spectroscopic data. Prot. Sci. 2005. 14 (2): 368-374.
24. Brownlow, S.; Morais Cabral, J. H.; Cooper, R.; Flower, D. R.; Yewdall, S. J.; Yewdall, S. J.; Polikarpov, I.; North, A. C.; Sawyer, L. Bovine ß-lactoglobulin at 1.8 Å resolution - still an enigmatic lipocalin. Structure 1997. 5 (4): 481-495.
25. Dong, A.; Matsuura, J.; Manning, M. C.; Carpenter, J. F. Intermolecular beta-Sheet Results from Trifluo-roethanol-Induced Nonnative alpha-Helical Structure in beta-Sheet Predominant Proteins: Infrared and Circular Dichroism Spectroscopic Study. Arch. Biochem. Biophy. 1998. 355(2): 275-281.
26. Babu, K. R.; Moradian, A.; Douglas, D. J. The Methanol-Induced Conformational Transitions of ß-Lactoglobulin, Cytocromo c, and Ubiquitin at Low pH: A study by Electrospray Ionization Mass Spectrometry. J. Am. Soc. Mass Spectrom. 2001. 12 (3): 317-328.
27. Kientz, M. L.; Bigelow, C. C. The Effect of Ethylene Glycol on the Structure of beta-Lactoglobulin. Biochem. 1966. 5(11): 3494-3500.
28. Romero, C. M.; Lozano, J. M.; Giraldo, G. I. and Sancho J. (2007) Thermal Stability of ß-Lactoglobulin en Presence of Aqueous Solutions of Alcohols and Polyols. International Journal of Biological Macromolecules (40): 423-428.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).