DETERMINACIÓN DE ISOTERMAS DE ADSORCIÓN Y ENTALPÍAS DE INMERSIÓN DE CARBON ACTIVADO EN SOLUCIONES ACUOSAS DE 3-CLORO FENOL A DIFERENTE pH
DETERMINACIÓN DE ISOTERMAS DE ADSORCIÓN Y ENTALPIAS DE INMERSIÓN DE CARBON ACTIVADO EN SOLUCIONES ACUOSAS DE 3-CLORO FENOL A DIFERENTE pH
DETERMINATION OF ADSORPTION ISOTHERMS AND IMMERSION ENTHALPIES OF ACTIVATED CARBON IN 3-CLORO PHENOL AQUEOUS SOLUTIONS AT DIFFERENT pH
DETERMINAÇÃO DE ISOTERMAS DE ADSORÇÃO E ENTALPÍAS DE IMERSÃO DE CARVÃO ATIVADO EM SOLUÇÕES ACUOSAS DE 3-CLORO FENOL A DIFERENTE pH
Diana P. Vargas1, Liliana Girado1'2 y Juan Carlos Moreno3
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia.
3 Departamento de Química, Facultad de Ciencias, Universidad de los Andes, Bogotá, Colombia.
Recibido: 19/01/10 - Aceptado: 30/04/10
RESUMEN
Se estudia el efecto que produce el pH de la solución en la adsorción y la entalpia de inmersión de un carbón activado en soluciones acuosas de 3-cloro fenol. El carbón activado presenta un área superficial de 685 m2g-1, mayor contenido de grupos ácidos totales y un pH en el punto de carga cero, ligeramente ácido. Los valores de pH a los que se realizan las isotermas son 3, 5, 7,9y11.
Se obtienen valores de la cantidad máxima adsorbida entre 96,2 y 46,4 mgg-1, para cada uno de los valores de pH, y valores entre 0,422 y 0,965 Lmg-1, para la constante de Langmuir. La cantidad máxima adsorbida disminuye con el pH, y el máximo valor para esta se encuentra en el pH de 5.
Se determinan las entalpías de inmersión del carbón activado en una solución de concentración constante de 3-cloro fenol a los diferentes pH, con un valor máximo de 37,6 Jg-1 para el pH de 5.
Se determinan entalpías de inmersión del carbón activado en función de la concentración de la solución de 3-cloro fenol a pH 5, de máxima adsorción, y se calcula la entalpía de inmersión máxima, con un valor de 41,67 Jg-1.
Palabras clave: adsorción en solución, carbón activado, 3-cloro fenol, en-talpía de inmersión.
ABSTRACT
The effect that produces the solution pH in the adsorption and the immersion enthalpy of an activated carbon in 3-chloro phenol aqueous solutions are studied. The activated carbon presents a surface area of 685 m2g-1, major acid total groups content and a pH in the point of zero charge, lightly acid. The pH values at which the adsorption isotherms and immersion enthalpies were realized are 3, 5, 7, 9 and 11.
The results of the adsorption are fitted to the Langmuir model and the values of the maximum quantity adsorbed that are between 96.2 and 46.4 mgg-1 were obtained for each pH value and values between 0.422 and 0.965 Lmg-1 for the Langmuir constant. The maximum quantity adsorbed diminishes with pH, a similar behavior is obtained with regard to the immersion enthalpies; the maximum value for these properties is for pH 5.
The immersion enthalpies of the activated carbon in a 3-chloro phenol solution of constant concentration are determined for the different pH values, with a maximum value of 37.6 Jg-1 for pH 5. Immersion enthalpies of the activated carbon in function of 3-chloro phenol solution concentration are determined at pH 5, of maximum adsorption, and the maximum immersion enthalpy is calculated, with a value of 41.67 Jg-1.
Key words: adsorption in solution, activated carbon, 3-chloro phenol, immersion enthalpy.
RESUMO
Se estuda o efeito que produz o pH da solução na adsorção e a entalpía de imersão de um carvão ativado em soluções acuosas de 3-cloro fenol. O carvão ativado apresenta um área superficial de 685 m2g-1, maior conteúdo de grupos ácidos totais e um pH no ponto de ônus zero, ligeiramente ácido. Os valores de pH aos que se realizam as isotermas são 3, 5, 7, 9 e 11.
Obtêm-se valores da quantidade máxima adsorbida entre 96,2 e 46,4 mgg-1, para cada um dos valores de pH e valores entre 0,422 e 0,965 Lmg-1, para a constante de Langmuir. A quantidade máxima adsorbida diminui com o pH e o máximo valor para esta se encontra ao pH de 5.
Determinam-se as entalpias de imersão do carvão ativado numa solução de concentração constante de 3-cloro fenol aos diferentes pH, com um valor máximo de 37,6 Jg-1 para o pH de 5. Determinam-se entalpias de imersão do carvão ativado em função da concentração da solução de 3-cloro fenol a pH 5, de máxima adsorção, e se calcula a entalpia de imersão máxima, com um valor de 41,67 Jg-1.
Palavras-chave: adsorção em solução, carvão ativado, 3-cloro fenol, entalpia de imersão.
INTRODUCCIÓN
La interfase sólido-liquido desempeña un papel importante en muchos de los procesos naturales e industriales, en los que las interacciones tienen lugar en la interfase sólido-liquido (1). Una de las aplicaciones que se ha estudiado de forma amplia es la que se relaciona con los procesos de adsorción, dado que la purificación de agua y distintos solventes se realiza con materiales adsorbentes con una determinada porosidad en su superficie.
Entre las aplicaciones de los materiales porosos en fase liquida, la que más destaca es el tratamiento de aguas, tanto potables como residuales; de hecho, esta aplicación constituye más del 40% del consumo de adsorbentes en fase liquida. Las aguas naturales están contaminadas con compuestos orgánicos naturales y artificiales, que son fuertemente adsorbidos en carbón activado, especificamente, y esta es la principal razón por la que en las plantas de agua potable se use carbón activado en la última etapa de purificación del agua antes de pasar al consumidor (2).
El estudio termodinámico de los procesos de adsorción permite obtener un mayor conocimiento de las interacciones que se presentan entre un sólido y un liquido, en muchos casos soluciones, y además de obtener caracteristicas estructurales del sólido, lleva a que se puedan predecir comportamientos en los sistemas (3). Entre las aplicaciones de los carbones activados está la de remover compuestos orgánicos de aguas, y para esta aplicación particular uno de los aspectos que tiene mayor influencia en la adsorción es la quimica de la superficie (4), que depende del contenido de heteroátomos, principalmente grupos con oxigeno, que determinan en los carbones activados la carga de la superficie, la hidrofobicidad y la densidad electrónica de las capas grafénicas. La carga superficial depende del pH del medio y de las caracteristicas de la superficie del carbón; la carga superficial negativa proviene de la disociación de los grupos superficiales de carácter ácido.
Los estudios acerca del proceso de adsorción sobre carbón activado de fenol y sus compuestos derivados presentes en soluciones acuosas se han realizado desde hace tiempo (5-8), dado que representan un serio peligro para el medio ambiente y, en particular, para la salud humana (9-11). La intensidad de la interacción entre la solución y el carbón activado se puede determinar por medio de la entalpía de inmersión del sólido en soluciones que contengan sustancias activas con la superficie y que permiten relacionar las propiedades fisicoquímicas del carbón activado con la capacidad de adsorción de los compuestos que están en solución (12, 13).
En este trabajo se estudia la adsorción de 3-cloro fenol desde soluciones acuosas sobre un carbón activado preparado de cuesco de palma africana, a partir de isotermas de adsorción y entalpías de inmersión a diferentes valores de pH, que varían entre 3 y 11. Se determinan entalpías de inmersión del carbón activado en soluciones de 3-cloro fenol en función de la concentración para el pH de máxima adsorción y se establecen relaciones entre las cantidades adsorbidas y los valores entálpicos de la interacción sólido-líquido.
MATERIALES Y MÉTODOS
El carbón activado que se emplea en este trabajo se obtiene por activación física de cuesco de palma africana. Inicialmente se lleva a cabo una carbonización del material particulado a 723 K en atmósfera de N2, y posteriormente se realiza la activación con CO2 a 1.073 K durante 2 horas.
Determinación de la isoterma de adsorción de N2
Las características texturales se establecen determinando la isoterma de adsorción de N2 a 77 K en un equipo convencional volumétrico, Autosorb 3B, Quantachrome.
Determinación de la química superficial del carbón activado
Se determinan la acidez y la basicidad total del carbón activado por el método de Boehm (14). Se pesa aproximadamente 1,000 g del sólido para cada determinación, y se coloca, en un frasco de vidrio con tapa esmerilada con 50 mL de solución de hidróxido de sodio, NaOH, 0,1 M y otra cantidad en un recipiente con 50 mL solución de ácido clorhídrico, HCl, 0,1 M. Las soluciones se agitan mecánicamente y se mantienen a 298 K, durante 5 dias. Alicuotas de 10 mL de las soluciones se titulan con la solución estándar de hidróxido de sodio o ácido clorhidrico según sea el caso; el pH de la solución se mide con un pH meter CG 840B Schott. Se determina el pH en el punto de carga cero, por el método de titulación de masas (15).
Determinación de la cantidad de 3-cloro fenol adsorbido
Para determinar la cantidad que adsorbe el carbón activado de 3-cloro fenol, se colocan 0,5 g de éste en frascos de vidrio y 250 mL de las respectivas soluciones acuosas de 3-cloro fenol en un rango de concentración entre 20 a 120 mgL-1. Las muestras se agitan mecánicamente y se mantienen a una temperatura de 298 K por un periodo de 72 horas, que asegura el equilibrio del sistema; durante este tiempo el pH de la solución se mantiene en un valor fijo, en un rango entre 3 y 11, mediante la adición de soluciones diluidas de HCl o de NaOH. La concentración de equilibrio del compuesto fenólico en las soluciones después de la adsorción se determina, previa calibración, a cada valor de pH a la longitud de onda de máxima absorción, con un equipo espectrofoto-métrico UV-Vis Milton Roy Co. Spectronic Genesys SN.
Determinación de la entalpia de inmersión
Se determinan las entalpías de inmersión del carbón activado en soluciones de 3-cloro fenol de diferente concentración en un rango de 20 a 120 mgL-1, para el pH de máxima adsorción, y también se determinan para soluciones de 100 mgL-1 a los valores de pH escogidos. Para dicha determinación se usa un microcalorímetro de conducción de calor con una celda calorimétrica en acero inoxidable (16). Se colocan en la celda 30 mL de la solución por utilizar, que se ha mantenido en un termostato a 298 K; se pesa una muestra de carbón activado del orden de 0,500 g y se coloca dentro de la celda calorimétrica en una ampolleta de vidrio; se ensambla el microcalorímetro. Cuando el equipo alcanza una temperatura de alrededor de 298 K, se inicia el registro de potencial de salida por un periodo de aproximadamente 15 minutos tomando lecturas de potencial cada 20 segundos; se procede a realizar el rompimiento de la ampolleta de vidrio, se registra el efecto térmico generado y se continúa con las lecturas de potencial por aproximadamente 15 minutos más; al final de la experiencia se calibra eléctricamente.
RESULTADOS Y DISCUSIÓN
En la Tabla 1 se presentan los resultados de la caracterización del carbón activado obtenido a partir de cuesco de palma africana. Se observa que el carbón activado presenta un valor de área superficial de 685 m2g-1, que está de acuerdo con valores obtenidos en otros trabajos (17), en los que se presentan condiciones similares en su preparación. Los resultados obtenidos para el volumen total de poros, 0,42 cm3g-1, concuerda con el porcentaje de quemado del precursor, burn-off de 49,7%, que se obtiene para una activación con CO2 durante un tiempo de 2 horas.
El contenido de grupos ácidos totales es mayor que el contenido de grupos básicos, lo que hace que el pH en el punto de carga cero, pHPZC, sea ligeramente ácido, con un valor de 6,8, que se debe tener en cuenta para la adsorción del 3-cloro fenol a los diferentes valores de pH, dado que éste modifica la carga superficial del carbón activado. En la Figura 1 se muestra la isoterma de adsorción de N2 a 77 K obtenida para el carbón activado, la cual es típica para un sólido microporoso con una escasa distribución de poro, que se observa en el codo cerrado a presiones relativas bajas, y la presencia de una incipiente mesoporosidad que se observa a presiones relativas mayores.
Se determinan las isotermas a 298 K para diferentes valores de pH, 3 a 11, y se verifica el cambio en las cantidades adsorbidas del soluto en función del pH. Las isotermas son del tipo Langmuir. En la Figura 2 se muestran las isotermas obtenidas para el pH de 5 (que es el pH de máxima adsorción del 3-cloro fenol) y para el pH 11 (en el que se obtiene la menor adsorción del adsorbato); este comportamiento se presenta en los electrolitos débiles que se hallan en agua, y se relaciona con el pKa del 3-cloro fenol de 8,8, con el pH de la solución y con el pHPZC del carbón activado de 6,8. De esta forma, para el caso del pH 5, el soluto se encuentra protonado y el carbón activado cargado positivamente; la adsorción tiene lugar debido a las fuerzas dispersivas y a las características físicas del carbón activado. A pH 11 de la solución, tanto el carbón activado como el 3-cloro fenol se encuentran cargados negativamente, y por tanto se produce una repulsión electrostática que tiene como resultado una disminución en la adsorción.
Como se observa en la Figura 2, hay una marcada influencia del pH en la adsorción del 3-cloro fenol, que de igual forma se manifiesta en la capacidad máxima, entre 96,2 y 46,4 mgg-1, y constante de adsorción, con valores entre 0,422 y 0,965 Lmg-1. Al linealizar los datos experimentales de acuerdo con el modelo de Langmuir, para los valores de pH del ensayo, se obtienen coeficientes de correlación que se encuentran entre 0,9947 y 0,9984, lo cual sugiere un buen ajuste del proceso de adsorción de 3-cloro fenol a dicho modelo. Las líneas para los datos que corresponden a la adsorción del 3-cloro fenol a los pH de 3, 5 y 7 son cercanas y marcan valores de pendientes similares, donde se favorece la adsorción dado que el carbón activado presenta un pHPZC de 6,8; las líneas para las isotermas que se determinan a valores de pH de 9 y 11 tienen un comportamiento distinto y valores de pendientes mayores y, por tanto, cantidades adsorbidas de 3-cloro fenol menores en aproximadamente 50% con respecto a la adsorción máxima que se obtiene de un pH de la solución de 5.
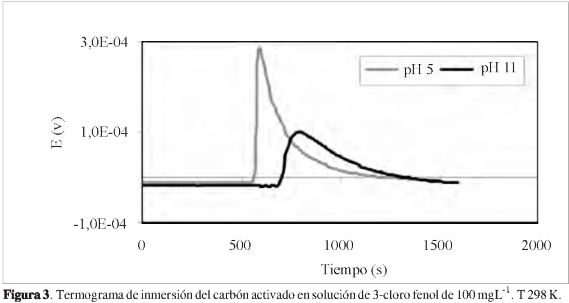
La entalpía de inmersión del carbón activado en soluciones acuosas de 3-cloro fenol indica la energía que se involucra en la interacción entre el sólido y la solución (18); por tanto esta propiedad permite establecer cómo influye el pH en el proceso de adsorción y se constituye en una característica del sistema. En la Figura 3 se presenta un termograma que muestra la interacción sólido-solución, de carácter exotérmico, para la determinación de la entalpía de inmersión del carbón activado en solución de 100 mgL-1 de 3-cloro fenol nuevamente para los pH de5y11.
En la Tabla 2 aparecen los resultados logrados para la capacidad máxima de adsorción obtenida por el modelo de Langmuir, la constante del proceso de adsorción KL y la entalpía de inmersión del carbón activado en soluciones de 3-cloro fenol, de concentración constante, a diferentes valores de pH. Se observa que para el pH 5 se obtiene el valor mayor para la capacidad de adsorción y para la entalpía de inmersión, aunque cabe señalar que los valores de esta para los pH 3y5son similares, y no se establece una diferencia notable en las interacciones energéticas que dominan el proceso de adsorción.
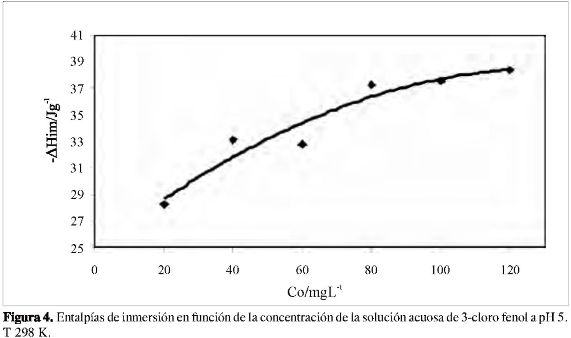
Una vez que se establece el pH de máxima adsorción, que se escoge de acuerdo con los resultados de las isotermas, se determina la entalpía de inmersión del carbón activado en soluciones de 3-cloro fenol a distintas concentraciones, y se observa un incremento en los valores de la entalpía de inmersión a medida que aumenta la concentración de la solución hasta alcanzar un valor límite, tal como ocurre en la gráfica de la isoterma, de 38,4 Jg-1 para una concentración de 120 mgL1. En la Figura 4 se muestra la relación entre la entalpia de inmersión y la concentración de las soluciones de 3-cloro fenol. La forma de la gráfica sugiere que a concentraciones bajas se presentan variaciones entálpicas que se van amortiguando a medida que la concentración de la solución es mayor, de manera que la diferencia entre los valores de la entalpia de inmersión para las soluciones de 120 y 100 mgg-1 es de 0,4 Jg-1.
Al realizar una linealización, del tipo Langmuir, de las entalpias de inmersión en función de la concentración de equilibrio, se obtiene la entalpia máxima de inmersión con un valor de 41,67 Jg-1, que está acorde con los valores experimentales obtenidos a partir de la Figura 4. De esta forma la experimentación calorimétrica complementa la información con respecto al proceso de adsorción de 3-cloro fenol desde solución acuosa sobre el carbón activado obtenido a partir de cuesco de palma africana, establece que el proceso es exotérmico y permite el cálculo de la capacidad y la entalpia de inmersión máximas como parámetros de caracterización.
CONCLUSIONES
La adsorción de 3-cloro fenol desde solución acuosa sobre un carbón activado preparado a partir de cuesco de palma africana, con un valor de área superficial de 685 m2g-1 y con un pH en el punto de carga cero de 6,8, en función del pH de la solución, muestra que la capacidad de adsorción disminuye con el aumento del pH.
Las isotermas obtenidas a los diferentes valores de pH, de 3 a 11, se ajustan al modelo de Langmuir, y se determinan para cada una los valores de cantidad máxima adsorbida que se encuentra entre 96,2 y 46,4 mgg-1 y la constante KL con valores entre 0,422 y 0,965 Lmg-1.Seestablece el pH de 5 como el de máxima adsorción.
Las entalpias de inmersión en función de la concentración de 3-cloro fenol en la solución muestran una tendencia similar a la de la curva isoterma, y el ajuste de los datos a una linealización tipo Langmuir permite calcular la entalpia de inmersión máxima con un valor de 41,67 Jg-1.
AGRADECIMIENTOS
Los autores agradecen al Convenio Marco entre la Universidad de los Andes y la Universidad Nacional de Colombia y al Acta de Acuerdo entre los departamentos de Química de las dos universidades.
REFERENCIAS BIBLIOGRÁFICAS
1. Denoyel, R.; Rouquerol, F. Adsorption from the liquid phase. En: Handbook of Porous Solids. Eds. Schüth F, Sing KSW, Weitkamp J. Wiley-VCH 2002.
2. Rodriguez-Reinoso, F. Production and applications of activated carbons. En: Handbook of Porous Solids. Eds. Schüth F, Sing KSW, Weitkamp J. Wiley-VCH 2002.
3. Matsui, Y.; Fukuda, Y.; Inoue, T. Effect of organic matter on powdered activated carbon adsorption of trace contaminants: characteristics and mechanism of competitive adsorption. Water Res. 2003. 37: 4413-4424.
4. McGuire, M. J.; Suffet, I. H. Treatment of water by granular activated carbon. Washington, D. C.: American Chemical Society. 1983.
5. Mattson, J. S.; Mark, H. B. Jr. Activated carbon: surface chemistry and adsorption from solution. New York; Marcel Dekker. 1971.
6. Wang, S. L.; Tzou, Y. M.; Lu, Y. H.; Sheng, G. Removal 3-chlorophenol from water using rice-strawbased carbon. J. Hazard. Mater. 2007. 147: 313-318.
7. Hamdaoui, O.; Naffrechoux, E. Modeling of adsorption isotherms of phenol and chlorophenols onto granular activated carbon. Part I. Two parameter models and equations allowing determination of thermodynamics parameters. J. Hazard. Mater. 2007, 147: 381-394.
8. Merzougui, Z.; Addoun, F. Effect of oxidant treatment of date pit activated carbons application to the treatment of waters. Desalination. 2008. 222: 394-403.
9. Mohamed, F. Sh.; Khater, W. A.; Mostafa, M. R. Characterization of phenols sorptive properties of carbons activated by sulphuric acid. Chemical Engineering Journal. 2006, 116: 47-52.
10. Dabrowski, A.; Podkoscielny, P.; Hubicki, Z.; Barczak, M. Adsorption of phenolic compounds by activated carbon - a Critical Review. Chemosphere. 2005.58: 1049-1070.
11. Ahmaruzzaman, M.; Sharma, D. K. Adsorption of phenols from waste-water. J. Colloid and Interface Sci. 2005. 287: 14-24.
12. Giraldo, L.; Moreno, J. C. Determinación de la entalpia de inmersión de carbón activado en soluciones acuosas de fenol y su relación con la capacidad de adsorción. Rev. Colomb. Quím. 2003. 32 (1): 45-54.
13. Giraldo, L.; Moreno, J. C. Calorimetric determination of activated carbons in aqueous solutions. J. Therm. Anal. Cal. 2007 . 89 (2): 589-594.
14. Boehm, H. P. Advances in Catalysis. Eley, D.D.H. Pines, P. B.Weisz, Eds. New York: Academic Press. 1966. p. 192.
15. Kosmulski, M. pH dependent surfacecharging and point of zero change. J. Colloid. Inter. Sci. 2004. 275 (1): 214-224.
16. Giraldo, L.; Moreno, J. C.; Huertas, J.I. Heats Conduction micro-calorimeter with metallic reaction Cells. Instrumentation Science & Technology. 2002. 30 (2): 177-186.
17. Turmuzi, M.; Daud, W. R.; Tasirin, S. M.; Takriff, M. S.; Iyeke, S. E. Production of activated carbon from candlenut shell by CO2 activation. Carbon. 2004. 42: 453-455.
18. Finnin, B. A.; O'Neill, M. A. A.; Gaisford, M.; Beezer, S.; Hadgraft, A.; Sears, J. Performance validation of step isothermal calorimeters. J. Therm. Anal. Cal. 2006. 83: 331-334.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).