INTERACCIÓN DE LA GLUTAMINA SINTETASA (GS) Y EL PÉPTIDO β -AMILOIDE COMO UNA ESTRATEGIA DE PURIFICACIÓN
INTERACCIÓN DE LA GLUTAMINA SINTETASA (GS) Y EL PÉPTIDO β -AMILOIDE COMO UNA ESTRATEGIA DE PURIFICACIÓN
INTERACTION OF GLUTAMINE SYNTHETASE (GS) AND AMYLOID β-PEPTIDE AS A PURIFICATION STRATEGY
INTERAÇÃO DA GLUTAMINA SINTETASE (GS) E PÉPTIDO β AMILÓIDE COMO UMA ESTRATÉGIA DE PURIFICAÇÃO
Sonia Luz Albarracín C.1, 2, 3, Edwin A. Rodríguez L.4, Gerardo Pérez G.2†, Edgar Antonio Reyes2
1Departamento de Nutrición y Bioquímica, Grupo de Terapia Celular y Molecular, Facultad de Ciencias, Pontificia Universidad Javeriana, Carrera 7 N.° 43-82, Bogotá, Colombia.
2Departamento de Química, Grupo de Investigación en Proteínas, Facultad de Ciencias, Universidad Nacional de Colombia, carrera 30 N.° 45-03, Bogotá, Colombia.
4Instituto de Errores Innatos del Metabolismo, Laboratorio de Expresión y Purificación de Proteínas, Facultad de Ciencias, Pontificia Universidad Javeriana, carrera 7 N.° 43-82, Bogotá, Colombia.
† In memorian
Recibido: 11/04/2012 – Aceptado: 25/06/2012
RESUMEN
La enfermedad de Alzheimer (EA) es la forma de demencia más común en la edad adulta. Se manifiesta con la pérdida progresiva de la memoria a medida que las neuronas en la corteza cerebral y el hipocampo mueren. En todas las formas de EA se evidencia aumento de la expresión de diferentes proteínas, así como la presencia de agregados insolubles de péptido-β-amiloide (PBA). La glutamina sintetasa (GS) es una enzima clave en el metabolismo del glutamato y en la detoxificación de amonio (NH4+). Previamente se ha reportado una posible interacción GS-PBA que puede estar asociada con EA. En este trabajo se realizó la purificación de la enzima cerebral de rata a partir de un extracto sometido a precipitación fraccionada con (NH4)2SO4 del 20-60 % de saturación y posteriormente a través de cromatografías sucesivas de filtración en gel, intercambio iónico y afinidad. El peso molecular del complejo fue calculado en 137 kDa por el orden de elución en la columna de filtración. Se identificó interacción de la enzima con PBA 1-40, lográndose la purificación de una sola banda de 45 kDa, correspondiente a la forma monomérica de la GS. En este trabajo se presenta un nuevo método de purificación de la enzima y se demuestra la interacción de GS con el PBA. Se propone que esta interacción GS-PBA puede ser uno de los procesos que se presentan en la enfermedad al explicar la reducción de la actividad de la enzima en paciente con EA, ya que podría alterar el ciclo glutamato-glutamina y generar cambios en el entorno celular que favorecen excitotoxicidad por glutamato típica de los procesos de neurodegeneración.
Palabras clave: glutamina sintetasa, purificación de proteínas, péptido beta amiloide.
ABSTRACT
Alzheimer‘s disease (AD) is the most common form of dementia in adulthood; it is manifested by the progressive loss of memory since neurons in both cerebral cortex and hippocampus die. In all the forms of AD is observed the increased expression of different proteins, as well as the presence of insoluble aggregates of β-amyloid peptide (BAP). Glutamine synthetase (GS) is a key enzyme in the metabolism of glutamate and in the detoxification of ammonium (NH4+). A possible interaction GS-PBA has been previously reported and it can be associated with AD. In this work we performed the purification of the enzyme from rat brain extract subjected to fractional precipitation 20-60 % saturation with (NH4)2SO4, and thereafter through successive chromatographies of gel filtration, ion exchange and affinity. The molecular weight of the complex was calculated at 137 kDa by the order of elution in the column filtration. The interaction of the enzyme with 1-40 PBA was identified, achieving the purification of a single band of 45 kDa corresponding to the monomeric form of the GS. In this paper we present a new method of the enzyme purification and we demonstrated the interaction of GS with the PBA. We propose this interaction GS-PBA can be one of the processes that occur in the disease and it could explain the reduction in enzyme activity in patients with AD, since it might alter the glutamate-glutamine cycle and generate changes in the cellular environment which favor glutamate excitotoxicity typical of neurodegeneration processes.Key words: Glutamine synthetase; protein purification; beta amyloid peptide.
RESUMO
A doença do Alzhéimer (DA) é a forma mais comum de demência na idade adulta, que se manifesta pela perda progressiva da memória, já que os neurónios em córtex cerebral e hipocampo morrem. Em todas as formas de AD é observado o aumento da expressão de proteínas diferentes, bem como a presença de agregados insolúveis de β-amilóide péptido (BAP). Glutamina sintetase (GS) é uma enzima chave no metabolismo do glutamato e na desintoxicação de amónio (NH4+). Uma possível interacção GS-PBA foi relatada anteriormente e pode ser associada com o AD. Neste trabalho, foi realizada a purificação da enzima a partir do extrato do cérebro de rato e foi submetido a precipitação fraccionada com (NH4)2SO4 de 20- 60 % de saturação e, subsequentemente, através de cromatografias sucessivas de filtração em em gel, permuta iónica e de afinidade. O peso molecular do complexo foi calculado em 137 kDa por ordem de eluição na filtração de coluna. A interacção da enzima com 1-40 PBA foi identificada, alcançando a purificação de uma única banda de 45 kDa correspondente à forma monomérica do GS. Neste artigo, apresentamos um novo método de purificação da enzima e demonstramos a interação da GS com o PBA. Propomos que esta interacção GS-PBA pode ser um dos processos que ocorrem na doença e pode explicar a redução na actividade da enzima nos pacientes com o AD, uma vez que poderia alterar o ciclo de glutamatoglutamina e gerar alterações no ambiente celular que favorecem a excitotoxicidade típica do glutamato nos processos de neurodegeneração.
Palavras-chave: Glutamina sintetase; purificação de proteína; peptídeo beta-amilóide.
INTRODUCCIÓN
Las enfermedades neurodegenerativas, y en especial las demencias, afectan a miles de personas de forma creciente debido al aumento de la esperanza de vida de la población, lo que hará que la prevalencia de estas patologías sea mayor en los próximos años. La enfermedad de Alzheimer (EA) se caracteriza por una pérdida progresiva de la memoria y de otras capacidades mentales a medida que las neuronas en la corteza cerebral y el hipocampo se atrofian y mueren (1). Las lesiones típicas extracelulares son las placas seniles (PS) o amiloides, cuyo principal constituyente es el péptido β-amiloide (PBA). La secuencia DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVV del péptido de 40 residuos (PBA 1-40) corresponde a una parte de la región hidrofóbica de la proteína precursora amiliode (PPA 672-712) (2). También se pueden encontrar intracelularmente otras lesiones denominadas ovillos neurofibrilares, que están compuestas por la proteína tau hiperfosforilada (3). Los depósitos de PBA y las alteraciones en su procesamiento son reconocidas en todas las formas de EA (4). El mecanismo de autoagregación, la cinética y la formación de complejos moleculares insolubles se conocen como la “ hipótesis amiloide” (2, 5). Aunque la mayoría de grupos han enfocado sus investigaciones a entender las interacciones del PBA con proteínas neuronales, otros han reportado interacciones con proteínas astrocíticas, que en condiciones patológicas pueden ser liberadas al espacio extracelular (6). La glutamina sintetasa (GS) (E.C. 6.3.1.2) es una enzima astrocítica clave en el metabolismo de los monómeros nitrogenados, y está involucrada en el balance metabólico y el reciclaje de aminoácidos para el normal funcionamiento del cerebro (7). Los astrocitos cumplen diferentes funciones en el cerebro, como el mantenimiento de la homeostasis iónica, la compartimentación metabólica, el mantenimiento del reservorio de neurotransmisores y la protección de las neuronas contra la neurotoxicidad del glutamato (8). La GS cataliza la reacción entre el glutamato procedente de las neuronas y el amonio (NH4+) para la formación de la glutamina con gasto de una molécula de ATP. La glutamina es liberada por los astrocitos de nuevo a las neuronas, que la emplean como precursor de glutamato en un proceso metabólico que se conoce como el ciclo glutamato-glutamina (9, 10). En condiciones patológicas como EA se produce la activación de los astrocitos, pero sus funciones en la enfermedad aún no son bien entendidas. Sin embargo, parece que este proceso se encuentra íntimamente asociado con las vecindades de las PS, en donde se deposita PBA. Adicionalmente, los astrocitos reactivos contienen diferentes formas de PBA, y se reporta que estas células pueden degradar formas extracelulares del péptido (11, 12). Lo anterior sugiere un papel importante de estas células en la progresión de la enfermedad, ya que podrían intervenir en la acumulación y limpieza de PBA. Usando modelos celulares se ha evidenciado la interacción de GS con el PBA, resultando en la inactivación oxidativa de la GS y en el incremento de la formación de radicales libres y el aumento de la neurotoxicidad del péptido (13). Estas observaciones sugieren que existe una relación entre la interacción de la enzima con PBA y la formación de la placa amiloide que podría evidenciarse con el compromiso en la toxicidad por NH4+ (13).En este trabajo se utilizó como estrategia de purificación de la enzima la interacción de la GS y el PBA, proponiéndose un nuevo protocolo de extracción y purificación de la GS de cerebro de rata en el que se utilizaron, de forma secuencial, precipitación fraccionada con sulfato de amonio, filtración en gel, intercambio iónico y cromatografía de afinidad. En este último paso se inmovilizó el PBA 1-40 en un soporte de Sepharosa- NHS y se purificó la enzima de una mezcla de proteínas, obteniéndose una banda correspondiente al peso molecular del monómero de la enzima. Esta interacción GS-PBA resulta ser fundamental para explicar el mecanismo de patogénesis de la EA.
MATERIALES Y MÉTODOS
Material biológico
Se utilizaron ratas Wistar machos de seis meses de edad, mantenidas a una temperatura entre 20-25 °C, con un ciclo luz/oscuridad 12/12 h. Se alimentaron ad libitum con una dieta sólida estándar y en todo momento tuvieron acceso libre al agua. Los animales se sacrificaron por decapitación y se extrajeron rápidamente los cerebros intactos que se conservaron en baño con hielo hasta la preparación del extracto.
Preparación del extracto
La extracción de la enzima se realizó modificando un protocolo previamente publicado (14). En un experimento típico se procesaron aproximadamente 100 g de cerebro en 150 ml de buffer HEPES 10 mM pH 7,4 con NaCl 137 mM; KCl 4,6 mM; KH2PO4 1,1 mM; MgSO4 0,6 mM y EDTA 1,1 mM. Al buffer se le adicionaron los siguientes inhibidores de proteasas: leupeptina (0,5 μg/ ml), pepstatina (0,7 μg/ml), fluoruro de fenilmetilsulfonilo (PMSF) (40 μg/ml) y aprotinina (0,5 μg/ml). Posteriormente, se homogenizaron en el mismo buffer y se centrifugaron a 18000 rpm por 1 h a 4°C. Bajo estas condiciones se obtuvo el sobrenadante (extracto crudo), que se utilizó para el proceso de purificación de la enzima.
Precipitación fraccionada con sulfato de amonio
El extracto crudo obtenido se precipitó con sulfato de amonio ((NH4)2SO4) en el rango de 0 a 20 % de saturación (0- 20 %), luego se dejó reposar durante toda la noche y se centrifugó a 18 000 rpm durante 20 min. El sobrenadante del 20 % de saturación se precipitó nuevamente hasta el 60 % de saturación (20-60 %), repitiendo el proceso anterior. Se obtuvieron entonces al final dos precipitados (rangos 0-20 % y 20-60 % de saturación), y un sobrenadante con el 60 % de saturación que fueron dializados contra agua desionizada y luego contra el buffer HEPES pH 7,4 a 4°C durante toda la noche. Al final la fracción de mayor actividad se concentró por ultrafiltración, utilizando una celda de Amicon con una membrana de tamaño de poro (Cut-off) de 100 kDa, a fin de separar las proteínas de menor peso molecular. La solución se mantuvo en agitación constante a 4°C.
Cuantificación de la actividad enzimática
La actividad de la GS se evaluó en todos los pasos del proceso de purificación mediante la reacción de la γ-glutamiltransferasa, que cuantifica a 492 nm el producto (γ-glutamilhidroxamato) generado por la enzima. La concentración de proteína se determinó por el método del ácido bicinconinico (BCA bicinchoninic acid assay) (15, 16).
Inmunoensayos
La presencia de la enzima también fue evaluada por pruebas de elisa, para lo cual se sensibilizaron placas de 96 pozos con distintas fracciones, siguiendo el método publicado previamente (17). Para el ensayo se colocó 1 mg de proteína por pozo en buffer carbonato 0,1 M pH 9,6 durante 3 h a 37 °C y durante toda la noche a 4 °C. Se bloqueó con PBS-BSA (1,3 %), luego se incubó con 100 ml de IgG anti-GS (1:5000) (generado en conejo) durante 1 h a 37 °C. Se adicionaron 100 ml de IgG (anti-conejo peroxidasa) (1:1000) como anticuerpo de reconocimiento. Posteriormente, se reveló con ácido 2,2 azino-bis (etilbenzoatizoline)- 6-sulfónico (ABTS). Se leyó la absorbancia a 405 nm en un lector de microplaca BioRad® Modelo 550. En cada paso se hicieron tres lavados con PBS-Tween 0,1 %.
Electroforesis
La preparación de los geles se realizó según el método descrito (18). En cada pozo se sembraron 10 mg de proteína disuelta en 5 ml de NH4HCO3 20 mM, más 5 ml de buffer muestra en condiciones no reductoras. Se utilizaron geles de separación T12C2,5 y T5C2,5 para concentración. Luego del corrido, los geles se colorearon con solución de Coomassie R 250 0,1 %.Ensayos cromatográficos
Filtración en gel
Una alícuota de 53 mg de la fracción con mayor actividad obtenida en los ensayos de precipitación se pasó por una columna de Sephacryl S-300 (96 cm x 1,5 cm) equilibrada previamente con HEPES pH 7,4 e inhibidores de proteasa. Se determinó el peso molecular aproximado del complejo enzimático, comparando los volúmenes de elución para las proteínas: IgY (170 kDa), BSA (66 kDa), ovoalbúmina (45 kDa) y tripsinógeno (24 kDa), con el de la fracción de mayor actividad de la enzima.
Intercambio catiónico
Una fracción de 25 mg de proteína enriquecida con GS proveniente de la cromatografía de filtración en gel se colocó en una columna DEAE-Sepharosa (42 cm x 1,5) equilibrada con HEPES pH 7,4 e inhibidores de proteasa. Luego se eluyeron las proteínas retenidas en la columna con buffer HEPES pH 7,4, usando un gradiente discontinuo de NaCl 0,2 M y 0,5 M. Se colectaron las fracciones con mayor actividad eluídas de la cromatografía de intercambio y se sometieron cromatografía de afinidad.Cromatografía de afinidad
Se efectuó acople del péptido PBA 1-40 con un soporte de sepharosa-NHS, para lo cual se modificó un protocolo previamente publicado (19, 20). El PBA 1-40 (4,5 mg) se disolvió en dimetilsulfóxido (DMSO) y se mezcló con 1 ml del soporte sepharosa-NHS durante toda la noche a temperatura ambiente. Después se inactivaron los grupos que no reaccionaron agregando una solución de etanolamina 0,5 M; NaCl 0,5 M a pH 8,3. El soporte se equilibró con HEPES pH 7,4 e inhibidores de proteasa y se aplicaron 10 mg de proteína provenientes de la cromatografía de intercambio iónico en una columna de 1 ml. Se recogieron las fracciones no retenidas y posteriormente se usó alta fuerza iónica (HEPES pH 7,4; NaCl2 M) para eluir la proteína retenida.
Western Blot
Después de realizar la electroforesis en las condiciones previamente descritas, se hizo la transferencia de las proteínas en una membrana de nitrocelulosa por 30 min, usando una cámara semiseca a condiciones de 2 V, 200 mA. Al terminar la transferencia la membrana se bloqueó con PBS-BSA 1,3 % por una hora a temperatura ambiente y luego se incubó con IgG (anti-GS generado en conejo) (1:5000) en PBS-BSA 1,3 % durante 1 h a 37 °C. Luego se adicionó anticuerpo secundario IgG (anti-conejo peroxidasa) (1:1000) en PBS-BSA 1,3 % y se dejó en agitación 1 h a temperatura ambiente. Se reveló con una solución de 50 mg de diaminobencidina (DAB) en 100 ml de PBS y 10 ml de H2O2 al 30 %. La reacción se detuvo con agua desionizada. En cada paso se hicieron tres lavados con PBSTWEEN 0,1 %.RESULTADOS Y DISCUSIÓN
Dado que el objetivo principal de este trabajo fue extraer y purificar la enzima GS de cerebro de rata, se diseñó un protocolo que incluyó diferentes estrategias que se resumen en la (Tabla 1). Adicionalmente, se evidenció la interacción de la GS y el PBA, y se empleó dicha interacción como estrategia de purificación.A partir del extracto crudo que presentó una actividad específica inicial de 0,66 U/mg, se realizaron los ensayos de precipitación fraccionada y en ellos se determinó que la fracción (NH4)2SO4 0-20 % de saturación no presenta actividad específica para GS, mientras que en la fracción (NH4)2SO4 20-60 % de saturación los valores de actividad aumentaron hasta 0,95 U/mg, lo que sugiere que GS se precipita en este rango, dado que la actividad específica obtenida es mayor que en el extracto crudo (Tabla 1). No se encontró actividad específica para el sobrenadante del 60 % de saturación. La fracción precipitada en el rango 20-60 % de saturación se concentró 5 veces por ultrafiltración en una celda de Amicon utilizando una membrana con límite de exclusión de 100 kDa. Todas las fracciones obtenidas en los experimentos de precipitación fueron sometidas a pruebas de elisa (Figura 1). Estos resultados confirman la presencia de GS en la fracción del precipitado 20-60 % de saturación, lo cual corresponde a los resultados presentados en otros estudios en los que se reporta la presencia de GS hepática de rata en precipitados con sulfato de amonio en el rango del 30-55 % de saturación (21) y GS humana entre 20-40 % de saturación (22, 23).
Ensayos cromatográficos
Cromatografía de filtración en gel (FG)
Con el fin de estimar el peso molecular del complejo proteico en las condiciones experimentales, se utilizó un soporte Sephacryl S-300 en una columna (96 cm x 1,5 cm), para lo cual se realizó una curva de calibración a partir de diferentes patrones de proteína de peso molecular conocido. Se midieron los volúmenes de elución de las siguientes proteínas: inmunoglobulina Y, albúmina sérica bovina fracción V (BSA), ovoalbúmina, tripsinógeno y lisozima. Se realizó la curva de calibración de referencia con el valor del logaritmo de los pesos moleculares de cada proteína contra el volumen de elución obtenido (datos no mostrados). Se determinó la actividad específica en cada fracción y se relacionó con el volumen de elución de la GS (correspondiente a la fracción de mayor actividad específica). A partir de este volumen se calculó el peso molecular del complejo a estas condiciones en 137 kDa. En la Figura 2A se muestra el perfil cromatográfico de la cromatografía de filtración en gel (FG). En todos los ensayos se obtuvo el mismo patrón cromatográfico y solo en la fracción uno (FGF1) se evidenció actividad enzimática, recuperándose 1,7 mg/ml de proteína y con un aumento de la actividad específica con relación al extracto crudo (Tabla 1). Lo anterior permite evidenciar que es en la FG-F1 donde predomina la enzima con una pureza 5,4 veces mayor a la obtenida en el extracto crudo. En el perfil electroforético de las fracciones obtenidas en filtración (Figura 2B), se observa que en FG-F1 y FG-F2 predominan bandas de alto y mediano peso molecular (carriles 1 y 2), mientras que en FG-F3 predominan las bandas de peso molecular menor.
Cromatografía de intercambio aniónico (IO)
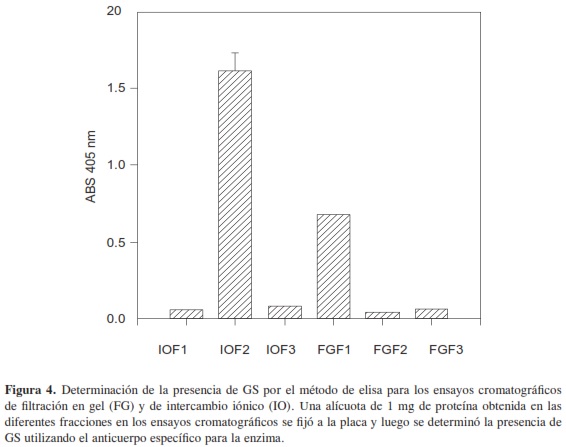
Una fracción de 25 mg de FG-F1 fue colocada en una columna DEAE-sepharosa (42 cm x 1,5 cm). El perfil cromatográfico típico se muestra en la Figura 3A. Se observan tres fracciones: una no retenida (IO-F1) y dos eluidas con un gradiente discontinuo de HEPES pH 7,4; NaCl 0,2 M (IO-F2) y 0,5 M (IO-F3). Los ensayos de actividad muestran que solo en la fracción IO-F2 está presente la enzima, obteniéndose 34 U/mg, lo que corresponde a un valor 51,5 veces mayor que la obtenida para el extracto crudo (Tabla 1). La retención de la enzima en el soporte DEAE-sepharosa indica que la proteína en estas condiciones de pH está cargada negativamente y el incremento en la actividad específica respecto al extracto crudo y al precipitado del 60 % de saturación con (NH4)2SO4 indica menor presencia de contaminantes. Los resultados anteriores evidencian también que al someter el extracto inicial sucesivamente a cromatografía de filtración en gel e intercambio iónico sobre DEAE-sepharosa se favorece la eficiencia del proceso de purificación de la enzima. Esto se hace evidente en el perfil electroforético de las fracciones obtenidas en las cromatografías de intercambio (Figura 3B), ya que en el carril 3 correspondiente a IO-F2 se observa un menor número de bandas predominantes de peso molecular 30, 40, 55 y 60 kDa que podrían ser responsables de la actividad enzimática. Sin embargo, debido a que en este perfil electroforético se observan varias bandas de proteína, se hizo necesario utilizar otros métodos de purificación adicionales. Todas las fracciones obtenidas por filtración en gel e intercambio iónico se sometieron a ensayos de elisa; los resultados para tres ensayos cromatográficos y los triplicados por fracción se muestran en la Figura 4. Estos resultados corroboran la presencia de GS en FG-F1, mientras que en FGF2 y FG-F3 se evidencia la ausencia de la enzima. En las fracciones provenientes de la cromatografía de intercambio iónico se observó presencia de la enzima solo en la fracción IO-F2 y ausencia de esta en IO-F1 y IO-F3, confirmando los resultados de los ensayos de actividad.
Cromatografía de afinidad usando PBA
Para la cromatografía de afinidad se ensayó el acople del péptido beta amiloide 1-40 (PBA 1-40) con sepharosa-NHS, para lo cual se hizo una modificación a un protocolo previamente reportado (19). Se tomaron 4,5 mg de PBA disueltos en 3 ml de DMSO (1,5 mg/ml) y se acoplaron en 1 ml de sepharosa-NHS. Posteriormente, se calculó el porcentaje de acople del péptido sobre la columna en 77 %, es decir 3,5 mg de PBA 1-40/ml de soporte. En estas condiciones se efectuó el acople por aminación reductiva, cuyo intermediario es una base de Schiff que forma aminas secundarias estables entre los grupos carbonilo del soporte y los grupos amino de diferentes residuos del péptido PBA 1-40. En la Figura 5 se presenta la secuencia del péptido con los residuos (subrayados) que favorecen la reacción.
Una fracción de 10 mg de IO-F2 se pasó por la columna de afinidad, obteniéndose el perfil de elución de la Figura 6A, donde se observa una fracción no retenida (CA-PBA-F1) y una fracción retenida (CA-PBA-F2) que se eluyó utilizando alta fuerza iónica (HEPES pH 7,4 con NaCl2 M). En el perfil electroforético (Figura 6B) se observa la presencia de diferentes bandas de proteína correspondientes a la fracción CA-PBA-F1 (carril 2), lo que indica que estas no interactúan con el péptido; el carril 3 corresponde a la fracción CA-PBA-F2 donde se evidenció una sola banda de 45 kDa, responsable de la actividad específica obtenida, indicando la presencia de la enzima. Para confirmar la presencia de GS en las fracciones eluídas con HEPES pH 7,4 y NaCl2 M, se realizó transferencia a una membrana de nitrocelulosa que se reveló con DAB (Figura 6B, carril 4), donde se observa una única banda inmunorreactiva.
Utilizando la cromatografía sobre el soporte sepharosa-PBA se obtienen 0,82 mg de proteína total con una actividad específica de 1050 U/mg y un factor de purificación de 1590 veces mayor que el extracto crudo (Tabla 1). En el ensayo de western-blot se evidencia una sola banda de proteína correspondiente a ∼44 kDa reconocida por el anticuerpo específico contra la enzima. Lo anterior permite evidenciar la pureza de la enzima y establece la interacción GS-PBA como la estrategia final de este proceso. Adicionalmente, este protocolo permite obtener valores de actividad específica mayores a los reportados en otros trabajos para otras enzimas eucarióticas (GS clase II); GS de cerebro humano (179 U/mg) (24), GS de cerebro de oveja (200 U/mg) (25) y GS de cerebro bovino (400 U/mg) (26). Se ha reportado previamente que PBA 1-40 presenta capacidad de interacción con diferentes proteínas, lo que le confiere la característica de ser amiloidogénico o con gran potencial de formación de agregados moleculares insolubles (2), posiblemente debido a la presencia de dos hojas plegadas β que pueden organizarse para formar hojas β paralelas más estables con otros PBA o con otras proteínas formando protofilamentos (27). La identificación de proteínas que interactúan con PBA es fundamental para entender las características que pueden favorecer la formación de agregados solubles (tempranos) e insolubles (tardíos) de gran importancia en la EA. En este trabajo se logró evidenciar la interacción GS-PBA, inmovilizando el PBA 1-40 a un soporte de sepharosa-NHS, lo que permitió purificar la enzima de una mezcla de proteínas, obteniéndose una banda correspondiente al peso molecular del monómero de la enzima. Debido a que la GS fue eluida de la columna utilizando un buffer con una alta fuerza iónica, esto sugiere que las interacciones electrostáticas son las que predominan en la formación del complejo GS-PBA. Por tanto, se espera que los aminoácidos polares presentes especialmente en la región aminoterminal sean responsables de esta interacción.
La GS es fundamental en la compartimentalización del sistema glutamato-glutamina y diversas observaciones sugieren que la actividad de la GS empieza a disminuir a principios de la EA, durante la fase de deterioro cognitivo leve elevando los niveles de amoniaco extracelular, el estrés oxidativo, los procesos inflamatorios y amplificando la cascada de neurodegeneración. Otros estudios muestran que PBA actúa sobre GS causando nitrosilación y disminuyendo la actividad enzimática (28). En este trabajo se evidencia la interacción GS-PBA, lo que contribuye a explicar los hallazgos de otros investigadores en esta área.
CONCLUSIONES
El esquema de purificación empleado en este trabajo consideró los siguientes procesos: precipitación fraccionada con sulfato de amonio, filtración por gel y cromatografía de intercambio. Finalmente, la cromatografía de afinidad usando PBA 1-40 acoplado a sepharosa-NHS permitió establecer la interacción de este péptido con la GS. La importancia de este modelo radica en que puede extrapolarse al humano en el sentido de que existe un 92 % de identidad de secuencia entre la GS de rata y la enzima humana. Por lo anterior se propone que la interacción entre la GS y el PBA 1-40 sea similar a la que se observa con la enzima de rata. Esto podría explicar la baja actividad de la GS y el aumento de iones amonio en la EA.
AGRADECIMIENTOS
Los autores agradecen a la Vicerrectoría Académica de la Pontificia Universidad Javeriana por el apoyo financiero del proyecto No. 000036 titulado “Purificación y caracterización parcial de la glutamina sintetasa de cerebro de rata” y al Grupo de Investigación en Proteínas del Departamento de Química de la Universidad Nacional de Colombia (sede Bogotá).REFERENCIAS
[1] Castellani, R. J.; Rolston, R. K.; Smith, M. A. Alzheimer Disease. Disease a Month. 2010. 56(9): 484-546.
[2] Murphy, R. M. Kinetics of amyloid formation and membrane interaction with amyloidogenic proteins. Biochimica et Biophysica Acta (BBA) Biomembranes. 2007. 1768(8): 1923-1934.
[3] Kang, J.; Lemaire, H.-G.; Unter- beck, A.; Salbaum, J. M.; Masters, C. L.; Grzeschik, K.-H.; Multhaup, G.; Beyreuther, K.; Muller-Hill, B. The precursor of Alzheimer‘s disease amyloid A4 protein resembles a cell-surface receptor. Nature. 1987. 325 (6106): 733-736.
[4] Roher, A. E.; Baudry, J.; Chaney, M. O.; Kuo, Y. M.; Stine, W. B., Emmerling, M. R. Oligomerization and fibril assembly of the amyloid-β protein. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 2000. 1502(1): 31-43.
[5] Tanzi, R. E.; Bertram, L. Twenty Years of the Alzheimer‘s Disease Amyloid Hypothesis: A Genetic Perspective. Cell. 2005. 120(4): 545-555.
[6] Robinson, S. R. Changes in the cellular distribution of glutamine synthetase in Alzheimer‘s disease. Journal of Neuroscience Research. 2001. 66(5): 972-980.
[7] Seiler, N. Ammonia and Alzheimer‘s disease. Neurochemistry International. 2002. 41(2-3): 189-207.
[8] Albrecht, J.; Sonnewald, U.; Waagepetersen, H.; Schousboe, A. Glutamine in the central nervous system: function and dysfunction. Frontier in Bioscience. 2007. 12: 332-343.
[9] Welbourne, T.; Routh, R.; Yudkoff, M.; Nissim, I. The Glutamine/Glutamate Couplet and Cellular Function. Physiology. 2001. 16(4): 157-16.
[10] Felipo, V.; Butterworth, R. F. Neurobiology of ammonia. Progress in Neurobiology. 2002. 67(4): 259-279.
[11] Wyss-Coray, T.; Mucke, L. Inflammation in Neurodegenerative Disease A Double-Edged Sword. Neuron. 2002. 35(3): 419-432.
[12] Koistinaho, M.; Lin, S.; Wu, X.; Esterman, M.; Koger, D.; Hanson, J.; Higgs, R.; Liu, F.; Malkani, S.; Bales, K. R.; Paul, S. M. Apolipo- protein E promotes astrocyte colo- calization and degradation of deposited amyloid-[beta] peptides. Nature Medicine. 2004. 10(7): 719-726.
[13] Butterfield, D. A.; Hensley, K.; Cole, P.; Subramaniam, R.; Akse- nov, M.; Aksenova, M.; Bummer, P. M.; Haley, B. E.; Carney, J.M. Oxidatively Induced Structural Alteration of Glutamine Synthetase Assessed by Analysis of Spin Label Incorporation Kinetics: Relevance to Alzheimer‘s Disease. Journal of Neurochemistry. 1997. 68(6): 2451-2457.
[14] Oliver, C. N.; Starke-Reed, P. E., Stadtman, E. R.; Liu, G. J.; Carney, J. M.; Floyd, R. A. Oxidativedamage to brain proteins, loss of glutamine synthetase activity, and production of free radicals during ischemia/reperfusion induced injury to gerbil brain. Proceedings of the National Academy of Sciences. 1990. 87(13): 5144-5147.
[15] Miller, R. E.; Hackenberg, R.; Gershman, H. Regulation of gluta- mine synthetase in cultured 3T3-L1 cells by insulin, hydrocortisone, and dibutyryl cyclic AMP. Proceedings of the National Academy of Scienc- es. 1978. 75(3): 1418-1422.
[16] Smith, P. K.; Krohn, R. I.; Hermanson, G. T.; Mallia, A. K.; Gartner, F. H.; Provenzano, M. D.; Fujimoto, E. K.; Goeke, N. M.; Ol- son, B. J.; Klenk, D. C. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 1985. 150(1): 76-85.
[17] Vega, N. A. Caracterización Bioquímica Funcional y Biológica de la Lectina de Salvia bogotensis. PhD Tesis. Facultad de Ciencias. Universidad Nacional de Colombia. Bogotá. 2004.
[18] Laemmli, U. K. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4. Nature. 1970. 227(5259): 680-685.
[19] Oyama, R.; Yamamoto, H.; Titani, K. Glutamine synthetase, hemoglo- bin α-chain, and macrophage migration inhibitory factor binding to amyloid β-protein: their identification in rat brain by a novel affinity chromatography and in Alzheimer‘s disease brain by immunoprecipita- tion. Biochimica et Biophysica Acta (BBA) Protein Structure and Molecular Enzymology. 2000. 1479(1-2): 91-102.
[20] Hermanson, G. T. Chapter 2 - The Chemistry of Reactive Groups. Bioconjugate Techniques (Second Edition). New York, Academic Press. 2008. pp. 169-212.
[21] Tiemeier, D. C.; Milman, G. Chi- nese Hamster Liver Glutamine Synthetase. Journal of Biological Chemistry. 1972. 247(8): 2272-2277.
[22] Boksha, I. S.; Tereshkina, E. B.; Burbaeva, G. S. Glutamine Synthetase and Glutamine Synthetase-Like Protein from Human Brain. Journal of Neurochemistry. 2000. 75(6): 2574-2582.
[23] Burbaeva, G. S.; Boksha, I. S.; Tershkina, E. B. Glutamine synthetase from human brain: Purification, properties, possible involvement in Alzheimer‘s disease pathogenesis. Biological Psychiatry. 1997. 42(1, Supplement 1): 93S.
[24] Yamamoto, H.; Konno, H.; Yama- moto, T.; Ito, K.; Mizugaki, M.; Iwasaki, Y. Glutamine Synthetase of the Human Brain: Purification and Characterization. Journal of Neurochemistry. 1987. 49(2): 603-609.
[25] Wedler, F. C.; Denman, R. B.; Roby, W. G. Glutamine synthetase from ovine brain is a manganese(II) enzyme. Biochemistry. 1982. 21(25): 6389-6396.
[26] Maurizi, M. R.; Pinkofsky, H. B.; McFarland, P. J.; Ginsburg, A. Mg2+ is bound to glutamine syn- thetase extracted from bovine or ovine brain in the presence of l-Me- thionine-S-sulfoximine phosphate. Archives of Biochemistry and Bio- physics. 1986. 246(1): 494-500.
[27] Tycko, R. Insights into the Amyloid Folding Problem from Solid-State NMR. Biochemistry. 2003. 42(11): 3151-3159.
[28] Castegna, A.; Aksenov, M.; Ak- senova, M.; Thongboonkerd, V.; Klein, J. B.; Pierce, W. M.; Booze, R.; Markesbery, W. R.; Butter- field, D. A. Proteomic identification of oxidatively modified proteins in alzheimer‘s disease brain. part I: creatine kinase BB, glutamine synthase, and ubiquitin carboxy-ter-minal hydrolase L-1. Free Radical Biology and Medicine. 2002. 562-571.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).