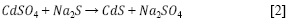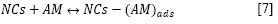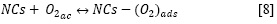Nanocristales para degradación de un colorante contaminante
Nanocrystals for degradation of a pollutant dye
DOI:
https://doi.org/10.15446/rev.colomb.quim.v45n1.58567Palabras clave:
nanopartículas semiconductoras, fotocatálisis, degradación de contaminantes, azul de metileno, aguas residuales (es)semiconductor nanoparticles, degradation of pollutants, methylene blue, photocatalysis, wastewater (en)
La fotoestabilidad de nanocristales (NCs) del grupo II-VI, como CdSe se aprovecha en procesos de fotocatálisis. Sin embargo, el contenido de metales tóxicos limita su aplicación en el ambiente en la remediación de residuos de las industrias textiles, de pieles y de papel. Se comparó la acción catalítica de CdS y ZnS, estabilizadas con dodecil sulfato de sodio y ácido etilendiaminotetraacetico, respectivamente, para el tratamiento fotocatalítico del colorante azul de metileno (AM) con radiación UV. Las dos clases de NCs presentaron bandas de absorción desplazadas hacia 500 nm y bandas de emisión fluorescente a 430-440 nm. Estas características ópticas se atribuyen al tamaño (20-50 y 100-150 nm), confirmado por microscopía electrónica. La degradación del AM por NCs alcanzó rendimientos del 92% y 77% para ZnS y CdS respectivamente, mediante la producción fotocatalítica de radicales hidroxilos capaces de participar en procesos redox. En conclusión, NCs se aprecian como catalizadores eficientes para la remediación de AM, un colorante aromático heterocíclico de amplio uso industrial.
The photo1stability of nanocrystals (NCs) in II-VI group such as CdSe is used for photocatalytic processes. The presence of toxic metals limits their implementation in environmental applications such as synthetic dyes treatment, which are found in textile, leather, and paper industries. NCs ZnS and CdS, stabilized in the presence of ethylendiaminetetraacetic acid and sodium dodecyl sulfate, respectively, were compared in the photocatalytic treatment of methylene blue (MB) under UV light. The two kinds of NCs showed absorption bands displaced towards A77 nm and fluorescent emission bands around 430 nm. These optical properties are attributed to nano size as observed by scanning electron microscopy (20-50 and 100-150 nm). MB degradation by NCs reached yields up to 92% and 77% for ZnS and CdS2 respectively, due to the photocatalytic production of hydroxyl radicals capable of participating in redox processes. In conclusion, NCs catalyzed the remediation of MB, a heterocyclic aromatic dye of broad industrial use.
DOI: https://doi.org/10.15446/rev.colomb.quim.v45n1.58567
Nanocristales para degradación de un colorante contaminante
Nanocrystals for the degradation of a pollutant dye
Nanocristais para a degradação de um corante poluente
Giovanni Andrés Castro Acuña1, Julia Constanza Reyes Cuellar1*
1 Grupo de Investigación en Química Ambiental, Facultad de Ciencias. Universidad Pedagógica y Tecnológica de Colombia.
Avenida Central del Norte Km 7. Tunja, Boyacá.
*Autor para correspondencia: jcore14@hotmail.com
Article citation: Castro-Acuña, G. A.; Reyes-Cuellar, J. C. Nanocristales para degradación de un colorante contaminante. Rev. Colomb. Quim. 2016, 45(1), 27-33. DOI: https://doi.org/10.15446/rev.colomb.quim.v45n1.58567
Recibido: 18 de Enero de 2016. Aceptado: 29 de Marzo de 2016.
Resumen
La fotoestabilidad de nanocristales (NCs) del grupo E-VI, como CdSe se aprovecha en procesos de fotocatálisis. Sin embargo, el contenido de metales tóxicos limita su aplicación en el ambiente en la remediación de residuos de las industrias textiles, de pieles y de papel. Se comparó la acción catalítica de CdS y ZnS, estabilizadas con dodecil sulfato de sodio y ácido etilendiaminotetraacético, respectivamente, para el tratamiento fotocatalítico del colorante azul de metileno (AM) con radiación UV. Las dos clases de NCs presentaron bandas de absorción desplazadas hacia 500 nm y bandas de emisión fluorescente a 430-440 nm. Estas características ópticas se atribuyen al tamaño (20-50 y 100-150 nm), confirmado por microscopía electrónica. La degradación del AM por NCs alcanzó rendimientos del 92% y 77% para ZnS y CdS respectivamente, mediante la producción fotocatalítica de radicales hidroxilos capaces de participar en procesos redox. En conclusión, NCs se aprecian como catalizadores eficientes para la remediación de AM, un colorante aromático heterocíclico de amplio uso industrial.
Palabras clave: Nanopartículas semiconductoras, fotocatálisis, degradación de contaminantes, azul de metileno, aguas residuales.
Abstract
The photo-stability of nanocrystals (NCs) in II-VI group such as CdSe is used for photo-catalytic processes. The presence of toxic metals limits their implementation in environmental applications such as synthetic dyes treatment, which are found in textile, leather, and paper industries. NCs ZnS and CdS, stabilized in the presence of ethylendiaminetetraacetic acid and sodium dodecyl sulfate, respectively, were compared in the photo-catalytic treatment of methylene blue (MB), under UV light. The two kinds of NCs showed absorption bands displaced towards 500 nm and fluorescent emission bands around 430 nm. These optical properties are attributed to nano size as observed by scanning electron microscopy (20-50 and 100-150 nm). MB degradation by NCs reached yields up to 92% and 77% for ZnS and CdS, respectively, due to the photo-catalytic production of hydroxyl radicals capable of participating in redox processes. In conclusion, NCs catalyzed the remediation of MB, a heterocyclic aromatic dye of broad industrial use.
Keywords: Semiconductor nanoparticles, degradation of pollutants, methylene blue, photocatalysis, wastewater.
Resumo
A fotoestabilidade do nanomateriais (NCs) do grupo II-VI como CdSe é usada em processos de fotocatálise. Mas a presença de metais tóxicos limita sua implementação no ambiente para remediar os residuos das industrias têxteis, de couro e de papel. Foi comparada a ação catalítica de ZnS e CdS, estabilizados na presenca de dodecil sulfato de sódio e ácido etilenodiamino tetra-acético, respectivamente, para o tratamento fotocatalítico de azul de metileno (AM) com radiação UV. Os dois tipos de NCs mostraram bandas de absorção perto de 500 nm e bandas de emissao fluorescente a 430-440 nm Estas propriedades ópticas são atribuídas ao tamanho (20-50 y 100-150 nm) confirmado por microscopia electrónica A degradação do AM por NCs alcancou rendimentos de 92% e 77% para ZnS e CdS respectivamente, através da produção fotocatalítica de radicais hidroxilo capazes de participar em processos redox Em conclusão NCs são vistos como catalisadores eficientes para a remediação de AM, um corante de amplia utilização industrial.
Palavras-Chave: Nanopartículas semicondutoras, fotocatálise, degradação de poluentes, azul de metileno, águas residuais.
Introducción
Los nanocristales semiconductores (NCs) son materiales que por su tamaño poseen propiedades optoelectrónicas no disponibles en materiales macroscópicos de igual composición. Desde la primer síntesis de puntos cuánticos en Bell Laboratories en 1983 (1), los NCs, constituidos por un semiconductor como material inorgánico, están transformando los materiales funcionalizados y los dispositivos nanotecnológicos (2). Los NCs presentan densidad de estados electrónicos análogos a los atómicos (3, 4) y despliegan transiciones electrónicas discretas, permitiendo la modulación de la emisión fluorescente y del perfil de excitación, mientras ofrecen una foto-estabilidad excepcional, entre otras características (5, 6). Además, el área superficial de los NCs posibilita modificaciones según distintas reacciones químicas disponibles para una extensa aplicación en determinaciones biológicas, sistemas terapéuticos, sensores y sensibilizadores en celdas solares (7).
El interés por los NCs de compuestos II-VI, que incluyen el selenuro de cadmio (CdSe) y el sulfuro de cadmio (CdS), está relacionado con la propiedad de fluorescencia, su fácil preparación y la brecha energética mayor a 2,5 eV (8-10). Sin embargo, el uso de nanoestructuras de CdSe en el ambiente es limitado debido a la presencia del cadmio, un metal tóxico. Se recurre, entonces, a los NCs de ZnS, con una brecha energética entre 2,8 a 4,1 eV (11, 12).
La síntesis de NCs requiere identificar las moléculas precursoras apropiadas y su concentración para producir especies moleculares o atómicas que contribuyan a la nucleación y crecimiento de la nanoestructura. También, es necesario identificar el tipo de agente estabilizante que pueda prevenir la captura de las especies activas formadas en las trampas superficiales (13, 14). La obtención de NCs solubles en agua requiere de un agente estabilizante como el dodecil sulfato de sodio usado para la preparación de NCs de ZnS. A pesar del éxito del método para producción de NCs de calcogenuros, en el caso de CdS se requiere la aplicación de radiación γ o ultrasonido para su síntesis con el mismo agente estabilizador (15).
Ahora bien, una de las formas de remoción de contaminantes en efluentes industriales, una medida de prevención de la contaminación ambiental, está basada en NCs que participan en procesos de absorción de energía con longitudes de onda iguales a la brecha energética, para promover electrones de la banda de valencia a la banda de conducción, dejando huecos libres en la banda de valencia. La fotocatálisis se fundamenta en esta separación de cargas para formar pares electrón/hueco capaces de migrar a la superficie del semiconductor donde pueden reaccionar directamente con grupos hidroxilo y generar radicales libres en el sistema que, a su vez, participarán en reacciones redox o podrán oxidar especies adsorbidas (16).
Los radicales libres hidroxilo (•OH) son oxidantes eficientes de substratos orgánicos en procesos de oxidación avanzados, lo que los hace potencialmente atractivos para degradar contaminantes que se encuentran en efluentes industriales (17). Revisiones sobre aplicaciones ambientales de nanoestructuras de CdS y ZnS son ofrecidas por Fresno (18), Hoffman et al. (19), y más recientemente, por Durán-Álvarez et al. (20).
Las aguas residuales generadas en procesos de fabricación de textiles, pieles y papel contienen residuos de los colorantes y pigmentos utilizados y, para su tratamiento, se aplican procesos biológicos y de oxidación electroquímica (21, 22). De estos colorantes, destaca el azul de metileno (AM), un compuesto aromático heterocíclico y catiónico, debido a su potencial carcinógeno (23, 24).
En ese sentido, el desarrollo de nanomateriales no tóxicos puede contribuir a la limpieza del ambiente mediante el tratamiento de aguas residuales que contengan colorantes. En el presente trabajo se sintetizaron estructuras de ZnS estabilizadas con dodecil sulfato de sodio y se compararon con estructuras de CdS estabilizado con EDTA, reactivos disponibles en laboratorio no especializados. Los NCs obtenidos se utilizaron como fotocatalizadores para una remediación reactiva basada en la reducción del colorante azul de metileno en procesos independientes de degradación desarrollados bajo irradiación con una lámpara UV.
Materiales y métodos
Reactivos
Sulfuro de sodio (Na2S 9H2O) al 98% de pureza y ácido diaminoetanotetraacético (EDTA) al 99-100% p/p se adquirieron en Panreac; acetato de cinc [Zn(CH3COO-)2] al 98% p/p de pureza, sulfato de cadmio (CdSO4) al 99% p/p de pureza y ácido clorhídrico (HCl) al 37% p/p de pureza se adquirieron en Merck; dodecil sulfato de sodio al 99% p/p de pureza, etanol 95% v/v y azul de metileno (AM) 95% p/p de pureza se compraron en Sigma-Aldrich. El agua tipo I se obtuvo de un sistema de purificación EDM Millipore simplicity™ Water Purification System, SIMS60000.
Síntesis de NCs de ZnS Y CdS
NCs de ZnS se sintetizaron mediante una reacción coloidal simple de acetato de cinc (Zn(CH3COO)22H2O) y sulfuro de sodio (Na2S XH2O), en presencia de dodecil sulfato de sodio actuando como un agente estabilizador de coordinación aniónico (25). El procedimiento consistió en mezclar el acetato de cinc (0,837 g) y SDS (2,100 g) disueltos en agua tipo I (100,0 mL). Se adicionó HC1 0,10 M para ajustar el pH de la solución a 6,0. Por separado, se preparó la solución de Na2S (1,240 g) en 60,0 mL de agua tipo I. Esta solución se adicionó gota a gota a la solución de cinc bajo agitación vigorosa (600 rpm) a 70 °C, observándose formación de turbidez. Después de una hora de reacción, la solución se dejó a temperatura ambiente por 30 min. Los NCs de ZnS se separaron mediante centrifugación a 6000 rpm por 30 min, después se lavaron tres veces con agua desionizada, finalmente la muestra se secó a 90 °C por 24 h. La reacción química se presenta en la ecuación [1], (26).
Los NCs de CdS se sintetizaron a partir de una solución 0,05 M de CdSO4 (0,521 g) en 50 mL de etanol que se mezcló equimolarmente con Na2S (0,196 g) y EDTA 0,02 M bajo agitación continua a 600 rpm, durante 3 h resultando en una solución turbia de color amarillo, esta solución se dejó en reposo durante 12 h. El sólido se obtuvo por centrifugación y se lavó con etanol 50% v/v, seguido de agua tipo I tres veces como método de limpieza. Los NCs de CdS de color amarillo-naranja se secaron a 60 °C en un horno durante 8 h (27). La reacción química se presenta en la ecuación [2] (28).
Caracterización de los materiales nanoestructurados
Los NCs obtenidos en el paso previo se dispersaron en etanol por ultrasonido en un instrumento Cole-Parmer (Modelo 08895-59 de potencia 110W) e inmediatamente se tomaron sus espectros de absorción UV-Vis en un espectrómetro Thermo Scientific GENESYS 10S UV-Vis, en el rango de longitud de onda de 250-550 nm con velocidad de barrido 2 nm/s, utilizando celdas de cuarzo que contenían 1,5 mL de la dispersión. Los espectros de absorción fueron utilizados para establecer las propiedades ópticas de los nanomateriales obtenidos.
Los espectros de fluorescencia de las dispersiones mencionadas se registraron en el fluórometro Fluorolog-3 FL3-22 de Horiba. Presentaron una longitud de onda de excitación de 350 nm en el rango 400-600 nm, con velocidad de escaneo de 1 nm/s y amplitud 3 nm x 3 nm, a temperatura de 20 °C. Las micro imágenes se obtuvieron con un microscopio electrónico de barrido (SEM) FEI modelo Quanta 450 FEG, después de tomar la muestra diluida, depositarla sobre papel de filtro y mantenerla ajustada con cinta de carbón conductivo.
Evaluación de la capacidad fotocatalítica de los NCs
La degradación de AM por los NCs de ZnS y CdS se desarrolló en un reactor de vidrio a temperatura ambiente con irradiación de una lámpara UV GL-58 (potencia 6 W). Esta lámpara se ubicó a 12 cm sobre 10,0 mL de la solución del colorante (50,0 mg/L) con agitación continua, mediante un agitador magnético a 500 rpm.
Los NCs de concentración 10,0 mg/L se dispersaron en un baño de ultrasonido por 10 min. Después se adicionaron al reactor y cada 30 min se obtuvo 1,0 mL de muestra para un periodo total de 2 h. El espectro UV-Vis se registró inmediatamente y se calculó la eficiencia de fotoreacción por el decremento de intensidad a la longitud de onda (640 nm). La eficiencia de decoloración se calculó conforme a la literatura, según la ecuación [3] (29).
Donde C0 y Ct son las concentraciones de AM al inicio y transcurrida la reacción bajo irradiación, respectivamente.
Como control, se llevó a cabo la degradación de AM bajo las condiciones mencionadas, sin agregar los NCs. Esto con el propósito de asegurar que, en este caso, la fotorreacción se desarrolló por la formación de pares de electrón/hueco (e—h+), inducida por la radiación UV absorbida por el medio de reacción, sin la mediación de nanoestructuras.
Resultados y discusión
Caracterización de los NCs de CdS y ZnS
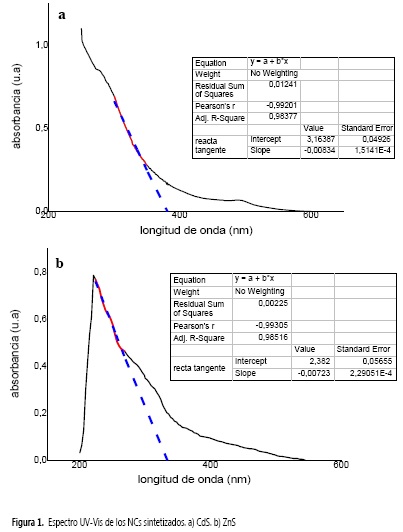
Las Figuras 1a y 1b presentan los espectros de absorción UV-Vis de los NCs de CdS y ZnS obtenidos en forma de polvo, que se dispersaron en etanol mediante ultrasonido.
Los NCs de CdS se encuentran rodeados de EDTA, tensoactivo que sirvió para prevenir la aglomeración de semillas de cristales de cadmio. Después de la excitación óptica de electrones, en el espectro se observa un corrimiento a la región azul de la banda de absorción, que se estableció a 379 nm. La banda energética se determinó gráficamente de la energía mínima (hv) de los fotones que son absorbidos por el semiconductor, en la región donde la absorbancia cambia linealmente, para cada característica espectral por separado (30).
Primero se obtuvo la ecuación de la línea y se estimó el valor de la longitud de onda de corte desde la intersección de la línea tangente de la banda en la región lineal con el eje de la longitud de onda a la absorbancia cero, utilizando la ecuación de ajuste lineal de la curva calculada en la Figura 1a. La banda energética se estableció al sustituir el valor de la absorción en la ecuación 4 (37).
Se observó una absorción a la longitud de onda correspondiente a la energía de la brecha energética. Así, la absorción en el borde de la banda de conducción se calculó a 379 nm, trazando una línea imaginaria desde la región descendiente del espectro que se intercepta con la línea base (Tabla 1), que corresponde a una brecha energética de 3,27 eV (32).
De la literatura, la banda de valencia se ha asignado a los estados 3p del azufre y la banda de conducción a los estados 5s del cadmio (33). Comparando con la brecha energética del material macromolecular CdS, reportado a 520 nm (2,38 eV), se presentó un corrimiento hacia la región azul, debido al confinamiento electrónico en estos nanomateriales (34).
Además, aparece un hombro calculado a 495 nm aproximadamente (2,5 eV), que corresponde a un valor ligeramente superior a la banda energética de 2,38 eV (520 nm) de material CdS (35), que en el caso de capas delgadas de CdS se explica por la presencia de defectos cristalinos incluyendo límites de grano y dislocaciones (36).
Para los NCs de ZnS, se formó una dispersión coloidal estable en el medio de reacción que, en presencia de SDS, permitió la estabilización de las nanoestructuras. Siguiendo el procedimiento de análisis descrito en la Figura 1a, se estableció que los NCs de ZnS presentaron una brecha energética a 330 nm (3,75 eV) a partir de la ecuación de ajuste lineal que se encuentra en la Figura 1b. Este valor resulta mayor al asignado para el material macroscópico ZnS de 3,5 eV (37, 38). Para NCs de ZnS sintetizados a partir de la sal de sulfuro de sodio origina nano materiales con una brecha energética de 3,55 eV, mientras que el material producido a partir de tioacetamida presenta una brecha energética de 3,72 eV según la literatura (39).
Por otro lado, la Figura 2 presenta los espectros de emisión fluorescente de los NCs preparados en el laboratorio. El espectro de emisión fluorescente de NCs de CdS, aplicando una longitud de onda de excitación de 350 nm, consistió en dos bandas amplias: la primera centrada a 396 nm con un hombro a 431 nm y la segunda a 528 nm. Estos valores sugieren la formación de una nanoestructura del semiconductor CdS, no obstante, el hombro sugiere la presencia de aglomerados que producen una ampliación de la fluorescencia excitónica y la segunda fluorescencia, por electrones atrapados que se liberan a 514 nm debido a transiciones electrónicas de la banda de conducción a un nivel aceptor en vacantes originadas por los iones de azufre intersticiales (40, 41). Es importante notar que la baja intensidad de esta última emisión podría resultar de una cobertura suficiente del agente estabilizador, que elimina parcialmente las trampas de electrones en la superficie (42).
En el caso de los NCs de ZnS, las dos bandas amplias características de los semiconductores se observaron a 440 y 570 nm, usando una longitud de onda de excitación de 350 nm. Sin embargo, la emisión por defectos para NCs de ZnS se referencia entre 423-438 nm, por lo tanto, la pequeña banda a 570 nm, si se compara con la intensidad de la emisión excitónica, puede ser causada por la contaminación con otro tipo de átomos metálicos (43).
La Figura 3 muestra las microimágenes de los NCs de CdS y ZnS obtenidas por SEM. A partir de estas se estableció el tamaño promedio en el régimen nanoscópico de 20-50 nm para los NCs de CdS, por lo tanto, su actividad no se ve afectada por el efecto cuántico observado en nanopartículas de diámetro menor al radio de Bohr. Los NCs de ZnS en la Figura 3b se aprecian en conglomerados. Aunque el tamaño de los elementos individuales no es claramente observado a partir de las microimagenes, se estimó en 100-120 nm.
Evaluación de la actividad fotocatalítica de los NCs
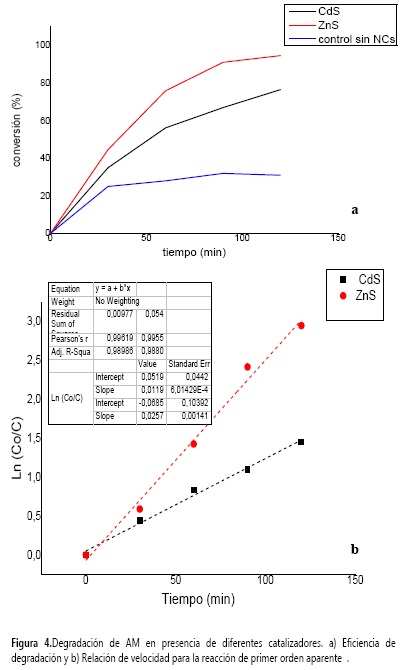
Una vez caracterizados los NCs de CdS y ZnS, se investigó el uso potencial como fotocatalizadores activados por luz UV. Para ello, se desarrolló la fotodegradación del AM (Figura 4)
El proceso de transformación catalítica del AM se desarrolló en la presencia de los NCs por separado a diferentes tiempos y se realizó el seguimiento de la disminución de la banda de absorción del colorante a 640 nm en el espectro visible. A medida que se incrementó el tiempo de exposición, se observó la reducción gradual de la banda característica, que indica la reacción de coloración del AM.
La eficiencia de degradación del colorante AM alcanzó hasta un 92% para los NCs de ZnS y 77% para CdS. El porcentaje de degradación aumentó en la medida que el tiempo de exposición a luz UV se incrementó. El blanco mostró que las moléculas de AM fueron degradadas hasta un 30% en ausencia del catalizador conservando condiciones de irradiación similares a los experimentos.
Para el sistema de ZnS también se observó que la actividad catalítica se detiene después de 90 min de reacción. Esto puede atribuirse a un envenenamiento de la superficie de los NCs, teniendo en cuenta que en el experimento se mantuvo una relación baja entre la concentración de catalizador y la concentración del colorante.
El valor máximo para la degradación de AM, que alcanzó un 92% en presencia de NCs de ZnS, es comparable al obtenido con nanoestructuras de óxido de cobre y óxido de zinc que alcanza el 95% (44) y 100%, respectivamente (45).
A partir de los datos obtenidos, se estableció la velocidad de reacción fotocatalítica siguiendo el modelo cinético ejemplificado por la trasformación de un contaminante aromático policíclico, el benzofurano, que sigue la cinética de reacción descrita en la ecuación 5 (46).
Donde ka es la constante de velocidad de una reacción de primer orden aparente y depende de la concentración (C) de AM. C0 representa la concentración inicial de AM. La constante de velocidad aparente se observa en la Figura 4b con valores de 0,011 min-1 y 0,026 min-1, los cuales representan la fotoactividad catalítica para NCs de CdS y ZnS, respectivamente.
El mecanismo de la reacción fotocatalítica se asocia con la excitación de las nanoestructuras, por su condición de semiconductores, en presencia de luz UV de 350 nm, que corresponde a energía cercana a la brecha energética; esta excitación permite la liberación de electrones (47). Las reacciones químicas involucradas se describen en las ecuaciones 6 a 14:
Interacción del AM con las NCs (adsorción)
Formación de los pares electrón - hueco
Formación de especies oxigenadas reactivas
Degradación de AM
Oxidación de AM por los radicales hidroxilo
Oxidación directa de AM por reacción con los huecos
PD: productos de degradación
Estos electrones interactúan con una molécula de agua en presencia de un oxidante, como el oxígeno disuelto, produciendo radicales libres oxhidrilo (OH•), que son altamente reactivos y se pueden usar en la degradación de las moléculas aniónicas de AM (48).
Conclusiones
Se obtuvieron NCs de CdS y ZnS utilizando reactivos químicos disponibles y bajo las condiciones de síntesis que se encuentran en un laboratorio no especializado. Se encontró que las nanoestructuras poseen características que les permiten actuar como fotocatalizadores para la degradación del AM hasta un 92%. Sin embargo, a los 90 min de reacción para CdS y ZnS, respectivamente, se detuvo la actividad catalítica, debido probablemente a envenenamiento de la superficie de los NCs, o por disminución de los radicales libres disponibles.
Agradecimientos
Los autores agradecen al Dr. Punit Kohli de Southern Illinois University por la adquisición de las microimágenes sobre las muestras sintetizadas durante el desarrollo de la investigación.
Referencias
1. Rossetti, R.; Nakahara, S.; Brus, L.E.J. Quantum size effect in the redox potentials, resonance Raman spectra, and electronic spectra of CdS crystallites in aqueous solution. Chern. Phys. 1983, 79 (2), 1086-1088. DOI: https://doi.org/10.1063/L445834.
2. Wang, X.; Huang, LL; Liang, B.; Liu, Z.; Chen, D.; Shen, G. ZnS nanostructures: synthesis, properties, and applications. Crit. Rev. Solid State Mater. Sci. 2012, 38, 57-90. DOI: https://doi.org/10.1080/10408436.2012.736887.
3. Alivisatos, A. P. Semiconductor clusters, nanocrystals, and quantum dots. Science, 1996, 277, 933-937. DOI: https://doi.org/10.1126/science.271.5251.933.
4. Smith, A.M.; Nie, S. Semiconductor nanocrystals: structure, properties, and band gap engineering. Acc. Chem. Res. 2010, 43, 190-200. DOI: https://doi.org/10.1021/ar9001069.
5. Resch-Genger, U.; Grabolle, M.; Cavaliere-Jaricot, S.; Nitschke, R.; Nann, T. Quantum dots versus organic dyes as fluorescent labels. Nat. Methods 2008, 5, 763-775. DOI: https://doi.org/10.1038/nmeth.1248.
6. Yin, Y; Alivisatos, A.P. Colloidal nanocrystal synthesis and the organic-inorganic interface. Nature 2005, 437, 664-670. DOI: https://doi.org/10.1038/nature04165.
7. Soltani, N.; Saion, E.; Yunus W.M.M.; Erfani, M.; Navasery, M.; Bahmanrokha, G.; Rezae, K. Enhancement of visible light photocatalytic activity of ZnS and CdS nanoparticles based on organic and inorganic coating. Appl. Surf. Sci, 2014, 290, 440-447. DOI: https://doi.org/10.1016/j.apsusc.2013.1L104.
8. Vossmeyer, T.; Katsikas, L.; Giersig, M.; Popovic, I.G.; Weller, H. CdS nanoclusters: Synthesis, characterization, side dependent oscillator strength, temperature shift of the excitonic transition energy and reversible absorbance shift. J. Phys. Chem, 1994, 98, 7665-7673. DOI: https://doi.org/10.1021/j100082a044.
9. Martínez-Castañón, G. A.; Loyola-Rodríguez, J. P.; Reyes-Macías, J. F.; Niño-Martínez, N.; Ruiz, F. Synthesis and optical properties of functionalized cds nanoparticles with different sizes. Superficies y Vacío 2010, 23, 1-4.
10. Lippens, P.E.; Lannoo, M. Calculation of the band gap for small CdS and ZnS crystallites. Phys. Rev. B 1989, 39, 10935-10942. DOI: https://doi.org/10.1103/physrevb.39.10935.
11. Rathore, K. S.; Patidar D.; Janu, Y; Saxena, N. S.; Sharma, K.; Sharma, T P Structural and optical characterization of chemically synthesized ZnS nanoparticles. Chalcogenide Lett. 2008, 5, 105-110.
12. Steigerwald, M. L. Clusters as small solids. Polyhedron 1994, 13, 1245-1252. DOI: https://doi.org/10.1016/s0277-5387(00)80258-2.
13. Peng, X; Wickham, J; Alivisatos, A P Kinetics of II-VI and III-V colloidal semiconductor nanocrystal growth: focusing, of size distributions. J. Am. Chem. Soc. 1998,120, 5343-5344. DOI: https://doi.org/10.1021/ja9805425.
14. Thangadurai, P; Balajai, S.; Manoharan, P. T. Surface modification of CdS quantum dots using thiols- structural and photophysical studies. Nanotechnology 2008, 19, 1435708-1435708-8. DOI: https://doi.org/10.1088/0957-4484/19/43/435708.
15. Rath T., Kunert B., Resel R., Fritz-Popovski G., Saf R., Trimmel G. Investigation of primary crystallite sizes in nanocrystalline ZnS powders: comparison of microwave assisted with conventional synthesis routes Inorg. Chem. 2008, 47, 3014-3022. DOI: https://doi.org/10.1021/ic7017715.
16. Chen, H.; Wang, L. Nanostructure sensitization of transition metal oxides for visible-light photocatalysis. Beilstein J Nanotechnol 2014, 5, 696-710. DOI: https://doi.org/10.3762/bjnano.5.82.
17. Borbón Jara, B.; Medel, A.; Bedolla Valdez, Z.; Núñez, G. A.; Oropeza Guzmán, M. T. Evaluación electroquímica de nanoestructuras Fe/MWCNT-Pt y Fe/MWCNT-Pt-Pd como materiales de cátodos multifuncionales con potencial aplicación en el mejoramiento de la calidad de agua tratada. Mundo Nano 2015, 8, 6-16.
18. Coronado, J.; Fresno, F.; Hernández-Alonso, M.D.; Portela, R. (eds.) Design of advanced photocatalytic materials for energy and environmental applications Green Energy and Technology. Springer Verlag, London, 2013; pp 157-169. DOI: https://doi.org/10.1007/978-1-4471-5061-9.
19. Hoffmann, MR.; Martin, S.T.; Choi, W.; Bahnemannt, D.W. Environmental Applications of Semiconductor Photocatalysis. Chem Rev 1995, 95, 69-96. DOI: https://doi.org/10.1021/cr00033a004.
20. Durán-Álvarez, J. C.; Avella, E.; Zanella, R. Descontaminación de agua utilizando nanomateriales y procesos fotocatalíticos. Mundo Nano 2015, 8, 17-39.
21. Gutiérrez, M.C.; Crespi, M. A review of electrochemical treatments for colour elimination. Color echnol 1999, 115, 342-345. DOI: https://doi.org/10.1111/j.1478-4408.1999.tb00323.x.
22. Torres-Martínez, C.L.; Kho, R.; Mian, O.I.; Mehra, R.K. Efficient photocatalytic degradation of environmental pollutants with mass-produced ZnS nanocrystals, J. Colloid Interface Sci. 2001, 240, 525-532. DOI: https://doi.org/10.1006/jcis.2001.7684.
23. Khan, M.R.; Khan, M.A.; Alothman, Z.A.; Alsohaimi, I.H.; Naushad, M.; Al-Shaalan, N.H. Quantitative determination of methylene blue in environmental samples by solid-phase extraction and ultra-performance liquid chromatography-tandem mass spectrometry: a green approach. RSC Adv. 2014, 4, 34037-34044. DOI: https://doi.org/10.1039/c4ra03504f.
24. Boeningo, M. Carcinogenicity and metabolism of azodyes especially derived from benzidine; U.S Gov. Printing Off, DNHS (NIOSH) publication: Washington, DC, 1994; pp. 80-119.
25. Mansour, S. A.; Al-Kotb, M. S.; Kotkata, M.R Model-free transformation kinetics for ZnS quantumdots synthesized via coloidal reaction. Physic. B 2014, 433, 127-132. DOI: https://doi.org/10.1016/j.physb.2013.10.002.
26. Nazerdeylami, S.; Saieva-_Iranizad, E.S.; Molaei, M. Optical properties of synthesized nanoparticles ZnS using methacryic acid as the capping agent. Int. J. Mod. Phys. Conf. Ser. 2012, 5, 127-133 . DOI: https://doi.org/10.1142/S2010194512001936.
27. Nisha, K.D.; Navaneethan, M.; Hayakawa, Y.; Ponnusamy, S.; Muthamizhchelvan, C Influence of lanthanide ion on the morphology and luminescence properties of cadmium sulphide nanocrystals. J. Alloys Compd. 2011, 509, 5816-5821. DOI: https://doi.org/10.1016/jjallcom.2011.02.130.
28. Pathania, D.; Bhim, S.; Rathore, H.S. Synthesis, characterization and photocatytic application of bovine serum albumin capped cadmum sulphide nanoparticles. Chalcogenide Letters. 2011, 8, 396-404.
29. Zhou, Z.; Bedwell, G. J.; Li, R.; Prevelige, P. E.; Gupta, A. Formation mechanism of chalcogenide nanocrystals confined inside genetically engineered virus-like particles. Sci. Rep. 2014, 4, 3832. DOI: https://doi.org/10.1038/srep03832.
30. Winkelmann, K.; Voiello, T.; Brooks, S. Preparation of CdS Nanoparticles by First-Year Undergraduates. J. Chem. Ed. 2007, 84, 709-710. DOI: http://pubs.acs.org/doi/pdf/10.1021/ed084p709.
31. Shockley, W. Electrons and Holes in Semiconductors. 7a Ed. Van Nostrand.: Princeton, NJ, 1959; p 139.
32. Irimpan, L.; Nampoori, V. P. N.; Radhakrishnan, P.; Krishnan, B.; Deepthy, A. Size-dependent enhancement of nonlinear optical properties in nanocolloids of ZnO. J. Appl. Phys. 2008, 103, 33105-33105. DOI: https://doi.org/10.1063/F2838178.
33. Nishidate, K.; Sato, T.; Matsukura, Y.; Baba, M.; Hasegawa, M.; Sasaki, T. Density-functional electronic structure calculations for native defects and Cu impurities in CdS. Phys. Rev. B 2006, 74, 035210 -1. DOI: https://doi.org/10.1103/PhysRevB.74.035210.
34. Alivisatos, A.P. Perspectives on the physics chemistry of semicoductor nanocrysts. J. Phys. Chem. 1996, 100, 13226-13239. DOI: http://pubs.acs.org/doi/pdf/10.1021/jp9535506.
35. Cao H, Wang G, Zhang S, Zhang X, Rabinovich D: Growth and optical properties of wurtzite-type CdS nanocrystals. Inorg. Chem. 2006, 45: 5103-5108. DOI: https://doi.org/10.1021/ic060440c.
36. Choi, J.Y.; King, K.J.; Yoo, J.B.; Kim, D. Properties of cadmium sulfide thin films deposited by chemical bath deposition with ultasonication. Solar Energy, 1998, 64, 41-47. DOI: https://doi.org/10.1016/S0038-092X(98)00047-4.
37. Antoniadou, M.; Daskalaki, V.M.; Balis, N.; Kondarides, D.I.; Kordulis, C.; Lianos, P. Photocatalysis and photoelectrocatalysis using (CdS-ZnS)/TiO2 combined photocatalysts. Appl. Catal., B 2011, 107, 188-196. DOI: https://doi.org/10.1016/j.apcatb.2011.07.013.
38. Adler, S.L. Theory of the Valence Band Splittings at k=0 in Zinc-Blende and Wurtzite Structures. Phys. Rev. 1962, 126, 118-122. DOI: https://doi.org/10.1103/PhysRev126.118.
39. Balantseva, E.; Camino, B.; Ferrari, A. M.; Berlie, G.Effect of Post-Synthesis Treatments on the Properties of ZnS Nanoparticles: An Experimental and Computational Study. Oil 6 Gas Science and Technology - Revue d'IFP Energies nouvelles 2015, 70, 817-829. DOI: https://doi.org/10.2516/ogst/2015010.
40. Mathew, S.; Ani Joseph, S.; Radhakrishnan, P.; Nampoori, V. P.; Vallabhan, C. P. Shifting of fluorescence peak in CdS nanoparticles by excitation wavelength change. J. Fluoresc. 2011, 21, 1479-84. DOI: https://doi.org/10.1007/s10895-011-0833-3.
41. Lakowicz, J. R.; Gryczynski, I.; Murphy, C. J. Luminescence Spectral Properties of CdS Nanoparticles. J Phys Chem B 1999, 103, 7613-7620. DOI: https://doi.org/10.1021/jp991469n.
42. Liu, S.H.; Qian, X. F.; Yin, J.; Ma, X. D.; Yuan, J. Y.; Zhu, Z. K. Preparation and characterization of polymer-capped CdS nanocrystals. J. Phys. Chem. Solids 2003, 64, 455-458. DOI: https://doi.org/10.1016/s0022-3697(02)00333-5.
43. Khani, O.; Rajabi, H,R.; Yousefi, M. H.; Khosravi, A.A.; Jannesari, M.; Shamsipur, M. Synthesis and characterizations of ultra-small ZnS and Zn(1-x)FexS quantum dots in aqueous media and spectroscopic study of their interactions with bovine serum albumin. Spectrochim. Acta, PartA 2011, 79, 361-369. DOI: https://doi.org/10.1016/j.saa.2011.03.025.
44. Zaman, S.; Zainelabdin, A.; Amin, G.; Nour. O.; Willander, M. Efficient catalytic effect of CuO nanostructures on the degradation of organic dyes. J. Phys. Chem. Solids 2012, 73, 1320-1325. DOI: https://doi.org/10.1016/jjpcs.2012.07.005.
45. Bandekar, G.; Rajurkar, N. S.; Mulla, I. S.; Mulik, U. P.; Amalnerkar, D.P.; Adhyapak, P. V. Synthesis, characterization and photocatalytic activity of PVP stabilized ZnO and modified ZnO nanostructures. Appl. Nanosci., 2014, 4, 199-208. DOI: 10.1007/s13204-012-0189-2.
46. Herrmann, J.M. Heterogeneous photocatalysis: fundamentals and applications to the removal of various types of aqueous pollutants. Catal. Today., 1999, 53, 115-129. DOI: doi:10.1016/S0920- 5861(99)00107-8.
47. Pouretedal, H. R.; Kadkhodaie, A. Synthetic CeO2 nanoparticle catalysis of methylene blue photodegradation: kinetics and mechanism. Chin. J. Catal. 2010, 31, 1328-1334. DOI: https://doi.org/10.1016/s1872-2067(10)60121-0.
48. Soltani, N.; Saiona E.; Yunus W. M. M.; Navasery, M.; Bahmanrokh, G.; Erfani, M.; Zareb, M. R.; Gharibshahi, E. Photocatalytic degradation of methylene blue under visible light using PVP-capped ZnS and CdS nanoparticles. Sol Energy 2013, 97, 147-154. DOI: https://doi.org/10.1016/j.solener.2013.08.023.
Referencias
Rossetti, R.; Nakahara, S.; Brus, L.E.J. Quantum size effect in the redox potentials, resonance Raman spectra, and electronic spectra of CdS crystallites in aqueous solution. Chem. Phys. 1983, 79 (2), 1086-1088. DOI: http://dx.doi.org/10.1063/1.445834.
Wang, X.; Huang, H.; Liang, B.; Liu, Z.; Chen, D.; Shen, G. ZnS nanostructures: synthesis, properties, and applications. Crit. Rev. Solid State Mater. Sci. 2012, 38, 57-90. DOI: http://dx.doi.org/10.1080/10408436.2012.736887
Alivisatos, A. P. Semiconductor clusters, nanocrystals, and quantum dots. Science, 1996, 271, 933-937.DOI: http://dx.doi.org/10.1126/science.271.5251.933
Smith, A.M.; Nie, S. Semiconductor nanocrystals: structure, properties, and band gap engineering. Acc. Chem. Res. 2010, 43, 190-200. DOI: http://dx.doi.org/10.1021/ar9001069
Resch-Genger, U.; Grabolle, M.; Cavaliere-Jaricot, S.; Nitschke, R.; Nann, T. Quantum dots versus organic dyes as fluorescent labels. Nat. Methods 2008, 5, 763-775. DOI: http://dx.doi.org/10.1038/nmeth.1248
Yin, Y.; Alivisatos, A.P. Colloidal nanocrystal synthesis and the organic-inorganic interface. Nature 2005, 437, 664-670. DOI: http://dx.doi.org/10.1038/nature04165
Soltani, N.; Saion, E.; Yunus W.M.M.; Erfani, M.; Navasery, M.; Bahmanrokha, G.; Rezae, K. Enhancement of visible light photocatalytic activity of ZnS and CdS nanoparticles based on organic and inorganic coating. Appl. Surf. Sci, 2014, 290, 440-447.DOI: http://dx.doi.org/10.1016/j.apsusc.2013.11.104
Vossmeyer, T.; Katsikas, L.; Giersig, M.; Popovic, I.G.; Weller, H. CdS nanoclusters: Synthesis, characterization, side dependent oscillator strength, temperature shift of the excitonic transition energy and reversible absorbance shift. J. Phys. Chem, 1994, 98, 7665-7673. DOI: http://dx.doi.org/10.1021/j100082a044
Martínez-Castañón, G. A.; Loyola-Rodríguez, J. P.; Reyes-Macías, J. F.; Niño-Martínez, N.; Ruiz, F. Synthesis and optical properties of functionalized cds nanoparticles with different sizes. Superficies y Vacío 2010, 23, 1-4
Lippens, P.E.; Lannoo, M. Calculation of the band gap for small CdS and ZnS crystallites. Phys. Rev. B 1989, 39, 10935-10942.DOI: http://dx.doi.org/10.1103/physrevb.39.10935
Rathore, K. S.; Patidar D.; Janu, Y.; Saxena, N. S.; Sharma, K.; Sharma, T. P. Structural and optical characterization of chemically synthesized ZnS nanoparticles. Chalcogenide Lett. 2008, 5, 105-110.
Steigerwald, M. L. Clusters as small solids. Polyhedron 1994, 13, 1245-1252. DOI: http://dx.doi.org/10.1016/s0277-5387(00)80258-2
Peng, X.; Wickham, J.; Alivisatos, A.P. Kinetics of II-VI and III-V colloidal semiconductor nanocrystal growth: focusing, of size distributions. J. Am. Chem. Soc. 1998, 120, 5343-5344. DOI: http://dx.doi.org/10.1021/ja9805425
Thangadurai, P; Balajai, S.; Manoharan, P. T. Surface modification of CdS quantum dots using thiols- structural and photophysical studies. Nanotechnology 2008, 19, 1435708-1435708-8. DOI: http://dx.doi.org/10.1088/0957-4484/19/43/435708
Rath T., Kunert B., Resel R., Fritz-Popovski G., Saf R., Trimmel G. Investigation of primary crystallite sizes in nanocrystalline ZnS powders: comparison of microwave assisted with conventional synthesis routes Inorg. Chem. 2008, 47, 3014-3022. DOI: http://dx.doi.org/10.1021/ic7017715
Chen, H.; Wang, L. Nanostructure sensitization of transition metal oxides for visible-light photocatalysis. Beilstein J. Nanotechnol. 2014, 5, 696-710. DOI: http://dx.doi.org/10.3762/bjnano.5.82
Borbón Jara, B.; Medel, A.; Bedolla Valdez, Z.; Núñez, G. A.; Oropeza Guzmán, M. T. Evaluación electroquímica de nanoestructuras Fe/MWCNT-Pt y Fe/MWCNT-Pt-Pd como materiales de cátodos multifuncionales con potencial aplicación en el mejoramiento de la calidad de agua tratada. Mundo Nano 2015, 8, 6-16.
Coronado, J.; Fresno, F.; Hernández-Alonso, M.D.; Portela, R. (eds.) Design of advanced photocatalytic materials for energy and environmental applications. Green Energy and Technology. Springer Verlag, London, 2013; pp 157-169. DOI: http://dx.doi.org/10.1007/978-1-4471-5061-9
Hoffmann, MR.; Martin, S.T.; Choi, W.; Bahnemannt, D.W. Environmental Applications of Semiconductor Photocatalysis. Chem. Rev. 1995, 95, 69-96. DOI: http://dx.doi.org/10.1021/cr00033a004
Durán–Álvarez, J. C.; Avella, E.; Zanella, R. Descontaminación de agua utilizando nanomateriales y procesos fotocatalíticos. Mundo Nano 2015, 8, 17-39
Gutiérrez, M.C.; Crespi, M. A review of electrochemical treatments for colour elimination. Color. Technol. 1999, 115, 342-345. DOI: http://dx.doi.org/10.1111/j.1478-4408.1999.tb00323.x
Torres-Martínez, C.L.; Kho, R.; Mian, O.I.; Mehra, R.K. Efficient photocatalytic degradation of environmental pollutants with mass-produced ZnS nanocrystals, J. Colloid Interface Sci. 2001, 240, 525–532. DOI: http://dx.doi.org/10.1006/jcis.2001.7684
Khan, M.R.; Khan, M.A.; Alothman, Z.A.; Alsohaimi, I.H.; Naushad, M.; Al-Shaalan, N.H. Quantitative determination of methylene blue in environmental samples by solid-phase extraction and ultra-performance liquid chromatography-tandem mass spectrometry: a green approach. RSC Adv. 2014, 4, 34037-34044. DOI: http://dx.doi.org/10.1039/c4ra03504f
Boeningo, M. Carcinogenicity and metabolism of azodyes especially derived from benzidine; U.S Gov. Printing Off, DNHS (NIOSH) publication: Washington, DC, 1994; pp. 80-119.
Mansour, S. A.; Al-Kotb, M. S.; Kotkata, M.F. Model-free transformation kinetics for ZnS quantumdots synthesized via coloidal reaction. Physic. B 2014, 433, 127-132. DOI: http://dx.doi.org/10.1016/j.physb.2013.10.002
Nazerdeylami, S.; Saieva-_Iranizad, E.S.; Molaei, M. Optical properties of synthesized nanoparticles ZnS using methacryic acid as the capping agent. Int. J. Mod. Phys. Conf. Ser. 2012, 5, 127-133 . DOI: http://dx.doi.org/10.1142/S2010194512001936
Nisha, K.D.; Navaneethan, M.; Hayakawa, Y.; Ponnusamy, S.; Muthamizhchelvan, C. Influence of lanthanide ion on the morphology and luminescence properties of cadmium sulphide nanocrystals. J. Alloys Compd. 2011, 509, 5816-5821. DOI: http://dx.doi.org/10.1016/j.jallcom.2011.02.130
Pathania, D.; Bhim, S.; Rathore, H.S. Synthesis, characterization and photocatytic application of bovine serum albumin capped cadmum sulphide nanoparticles. Chalcogenide Letters. 2011, 8, 396-404.
Zhou, Z.; Bedwell, G. J.; Li, R.; Prevelige, P. E.; Gupta, A. Formation mechanism of chalcogenide nanocrystals confined inside genetically engineered virus-like particles. Sci. Rep. 2014, 4, 3832. DOI: http://dx.doi.org/10.1038/srep03832
Winkelmann, K.; Voiello, T.; Brooks, S. Preparation of CdS Nanoparticles by First-Year Undergraduates. J. Chem. Ed. 2007, 84, 709-710. DOI: http://pubs.acs.org/doi/pdf/10.1021/ed084p709
Shockley, W. Electrons and Holes in Semiconductors. 7ª Ed. Van Nostrand.: Princeton, NJ, 1959; p 139
Irimpan, L.; Nampoori, V. P. N.; Radhakrishnan, P.; Krishnan, B.; Deepthy, A. Size-dependent enhancement of nonlinear optical properties in nanocolloids of ZnO. J. Appl. Phys. 2008, 103, 33105-33105. DOI: http://dx.doi.org/10.1063/1.2838178
Nishidate, K.; Sato, T.; Matsukura, Y.; Baba, M.; Hasegawa, M.; Sasaki, T. Density-functional electronic structure calculations for native defects and Cu impurities in CdS. Phys. Rev. B 2006, 74, 035210 -1. DOI: http://dx.doi.org/10.1103/PhysRevB.74.035210
Alivisatos, A.P. Perspectives on the physics chemistry of semicoductor nanocrysts. J. Phys. Chem. 1996, 100, 13226-13239. DOI: http://pubs.acs.org/doi/pdf/10.1021/jp9535506
Cao H, Wang G, Zhang S, Zhang X, Rabinovich D: Growth and optical properties of wurtzite-type CdS nanocrystals. Inorg. Chem. 2006, 45: 5103–5108. DOI: http://dx.doi.org/10.1021/ic060440c
Choi, J.Y.; King, K.J.; Yoo, J.B.; Kim, D. Properties of cadmium sulfide thin films deposited by chemical bath deposition with ultasonication. Solar Energy, 1998, 64, 41-47. DOI: http://dx.doi.org/10.1016/S0038-092X(98)00047-4
Antoniadou, M.; Daskalaki, V.M.; Balis, N.; Kondarides, D.I.; Kordulis, C.; Lianos, P. Photocatalysis and photoelectrocatalysis using (CdS-ZnS)/TiO2 combined photocatalysts. Applied Catalysis B: Environmental 2011, 107, 188-196. DOI: http://dx.doi.org/10.1016/j.apcatb.2011.07.013
Adler, S.L. Theory of the Valence Band Splittings at k=0 in Zinc-Blende and Wurtzite Structures. Phys. Rev. 1962, 126, 118-122. DOI: http://dx.doi.org/10.1103/PhysRev.126.118
Balantseva, E.; Camino, B.; Ferrari, A. M.; Berlie, G.Effect of Post-Synthesis Treatments on the Properties of ZnS Nanoparticles: An Experimental and Computational Study. Oil & Gas Science and Technology – Revue d’IFP Energies nouvelles 2015, 70, 817-829. DOI: http://dx.doi.org/10.2516/ogst/2015010
Mathew, S.; Ani Joseph, S.; Radhakrishnan, P.; Nampoori, V. P.; Vallabhan, C. P. Shifting of fluorescence peak in CdS nanoparticles by excitation wavelength change. J. Fluoresc. 2011, 21, 1479-84. DOI: http://dx.doi.org/10.1007/s10895-011-0833-3
Lakowicz, J. R.; Gryczynski, I.; Murphy, C. J. Luminescence Spectral Properties of CdS Nanoparticles. J. Phys. Chem. B 1999, 103, 7613-7620. DOI: http://dx.doi.org/10.1021/jp991469n
Liu, S.H.; Qian, X. F.; Yin, J.; Ma, X. D.; Yuan, J. Y.; Zhu, Z. K. Preparation and characterization of polymer-capped CdS nanocrystals. J. Phys. Chem. Solids 2003, 64, 455-458. DOI: http://dx.doi.org/10.1016/s0022-3697(02)00333-5
Khani, O.; Rajabi, H,R.; Yousefi, M. H.; Khosravi, A.A.; Jannesari, M.; Shamsipur, M. Synthesis and characterizations of ultra-small ZnS and Zn(1−x)FexS quantum dots in aqueous media and spectroscopic study of their interactions with bovine serum albumin. Spectrochim. Acta, Part A 2011, 79, 361-369. DOI: http://dx.doi.org/10.1016/j.saa.2011.03.025
Zaman, S.; Zainelabdin, A.; Amin, G.; Nour. O.; Willander, M. Efficient catalytic effect of CuO nanostructures on the degradation of organic dyes. J. Phys. Chem. Solids 2012, 73, 1320-1325. DOI: http://dx.doi.org/10.1016/j.jpcs.2012.07.005
Bandekar, G.; Rajurkar, N. S.; Mulla, I. S.; Mulik, U. P.; Amalnerkar, D.P.; Adhyapak, P. V. Synthesis, characterization and photocatalytic activity of PVP stabilized ZnO and modified ZnO nanostructures. Appl. Nanosci., 2014, 4, 199-208. DOI: 10.1007/s13204-012-0189-2
Herrmann, J.M. Heterogeneous photocatalysis: fundamentals and applications to the removal of various types of aqueous pollutants. Catal. Today., 1999, 53, 115-129. DOI: doi:10.1016/S0920- 5861(99)00107-8
Pouretedal, H. R.; Kadkhodaie, A. Synthetic CeO2 nanoparticle catalysis of methylene blue photodegradation: kinetics and mechanism. Chin. J. Catal. 2010, 31, 1328-1334. DOI: http://dx.doi.org/10.1016/s1872-2067(10)60121-0
Soltani, N.; Saiona E.; Yunus W. M. M.; Navasery, M.; Bahmanrokh, G.; Erfani, M.; Zareb, M. R.; Gharibshahi, E. Photocatalytic degradation of methylene blue under visible light using PVP-capped ZnS and CdS nanoparticles. Sol. Energy 2013, 97, 147-154. DOI: http://dx.doi.org/10.1016/j.solener.2013.08.023
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).