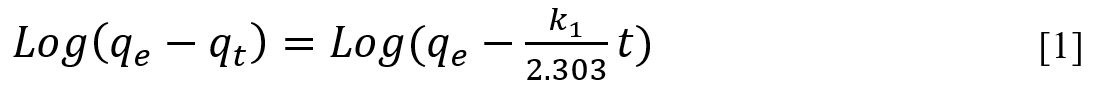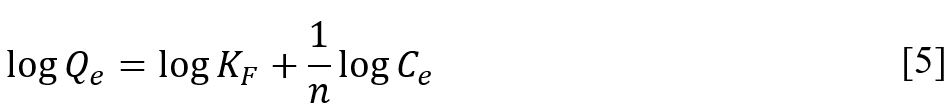Preparación de carbón activado a partir de residuos de palma de aceite y su aplicación para la remoción de colorantes
Preparation of activated carbon from palm oil wastes and their application for methylene blue removal
DOI:
https://doi.org/10.15446/rev.colomb.quim.v46n1.62851Palabras clave:
biomasa, carbón activado, palma de aceite, adsorción, activación química (es)Biomass, activated carbon, palm oil, adsorption, chemical activation (en)
Preparación de carbón activado a partir de residuos de palma
de aceite y su aplicación para la remoción de colorantes
Preparation
of activated carbon from palm oil wastes and their application for methylene
blue removal
Preparação de carvão ativado a partir da resíduos de palmeira de óleo e
sua aplicação para a remoção de corantes
Anyi P. Ramírez, Stephanie Giraldo, Elizabeth Flórez,
Nancy Acelas*
Departamento
de Ciencias Básicas, Universidad de Medellín, Carrera 87 No. 30-65, Medellín,
Colombia
*nyacelas@udem.edu.co
Resumen
En el presente estudio se muestra la
producción de carbón activado a partir de la biomasa residual generada en la
producción de palma de aceite, fibra (F) y cáscara (C). Se realizó activación
química con ZnCl2 y se evalúo la capacidad de remoción de azul de
metileno (AM) para diferentes concentraciones (50, 100 y 150 mg/L). Los
resultados mostraron un buen desarrollo de poro por dicho
método de activación, con áreas superficiales de 835,3 m2/g para la
fibra activada (FA) y 575,1 m2/g para la cáscara activada (CA). Se
encontró un buen ajuste de los datos experimentales al modelo cinético
de pseudo segundo orden y a las isotermas de Langmuir y
Freundlich con capacidades máximas de adsorción de 763,4 y 724,6 mg/g para FA y
CA, respectivamente.
Palabras
clave: biomasa, carbón activado, palma de aceite, adsorción,
activación química.
Abstract
The
production of activated carbon from residual biomass generated in the
production of oil palm, fiber (F) and shell (C) was studied. The chemical
activation was done using ZnCl2 and the adsorption capacity of
methylene blue (AM) at different concentrations (50, 100, and 150 mg/L) was
evaluated. Results showed a good development of pore with surface areas of
835.3 m2/g for activated fiber (FA) and 575.1 m2/g for
activated shell (CA). A good fit of the experimental data with the pseudo second
order kinetic model and with Langmuir and Freundlich isotherms models was found.
In addition, maximum adsorption capacities of 763.4 and 724.6 mg/g for FA and
CA were found, respectively.
Keywords: Biomass, activated carbon, palm oil, adsorption, chemical activation.
Resumo
No presente
estudo é mostrada a produção de carvão ativado a partir da biomassa residual
gerada na produção de fibra de palmeira de óleo (F) e casca (C). A activação
química foi realizada com ZnCl2, foi avaliada a capacidade de
remoção do azul de metileno (AM) para diferentes concentrações (de 50, 100 e 150
mg/L). Os resultados mostraram um bom desenvolvimento do poro pelo método de
ativação estudado para com áreas de superfície de 835,3 m2/g para a
fibras activada (FA) e 575,1 m2/g para a casca activada (CA). Foi encontrado
um bom ajuste dos dados experimentais ao modelo da cinética de pseudo segunda ordem
e a isotermas de Langmuir e Freundlich com capacidades máximas de adsorção de
763,44 e 724,6 mg/g para a FA e CA, respectivamente.
Palavras-chave: biomassa, carvão ativado, palma de óleo, adsorção, ativação
química.
Introducción
La contaminación de los ríos y lagos
generada por el vertimiento de colorantes provenientes de diferentes sectores
industriales (textil, papel, plástico, madera y alimentos) está en continuo
crecimiento. Los
colorantes reducen la penetración de la luz en las corrientes de agua,
generando una reducción en la capacidad de autopurificación de los ríos y lagos,
lo cual produce deterioro de los ecosistemas acuáticos debido a la
microtoxicidad. Por lo anterior, se han creado normas cada vez más estrictas
relacionadas con la eliminación de dichos contaminantes desde aguas residuales
provenientes de las industrias generadoras de dichos residuos, antes de
realizar la descarga a los cuerpos de agua (1).
Lo
anterior conlleva a la búsqueda de nuevos procedimientos
eficientes en la remoción de colorantes en aguas residuales. En este sentido,
técnicas como la adsorción, coagulación, floculación, oxidación, precipitación
y filtración han sido propuestas para dicha remoción. La mayoría de estos
procesos son métodos químicos que producen alta cantidad de lodos, causando
problemas de disposición de residuos. Sin embargo, dentro de las técnicas antes
mencionadas, el proceso de adsorción es un método adecuado y promisorio para
ser utilizado en plantas de tratamiento de aguas residuales con el fin de dar
cumplimiento a las regulaciones vigentes. Este método es de fácil operación y
posee buena relación entre costo y efectividad (2).
Dentro de los materiales adsorbentes
comúnmente usados se encuentra el carbón activado comercial, que, aunque es muy
eficiente en el proceso de adsorción debido a su alta área superficial, buen
volumen de poro y a los diferentes grupos funcionales superficiales activos, presenta
alto costo en su producción. Esto ha motivado la búsqueda de adsorbentes
alternativos que tengan una mejor relación costo-efectividad. Se ha investigado
la conversión de residuos agrícolas en adsorbentes para el tratamiento de aguas
residuales, dado que es ambientalmente amigable y tiene el potencial de reducir
el costo de la disposición de residuos. Actualmente, se ha estudiado la
producción de carbones activados usando precursores renovables y económicos,
por ejemplo, subproductos agrícolas como residuos de coco (3), arroz, cáscaras de huevo (4), talas de árboles (1, 5), residuos de cosechas (6), entre otros (2, 7, 8).
Ahora bien, el aceite de palma es el
aceite vegetal de mayor producción a nivel mundial (9). Del mismo modo, se ha reportado que
la biomasa sólida residual generada en los molinos de aceite de palma es el
doble de la cantidad de aceite producido, dicha biomasa residual incluye: troncos,
frondas, fibras, conchas y racimos vacíos (9, 10). Dada la disponibilidad de esta
biomasa en un solo punto durante todo el año (plantas de beneficio) y las
preocupaciones económicas y ambientales relacionadas con su disposición, los
usos potenciales de dicha biomasa para diferentes propósitos ha llamado cada
vez más la atención. Así, la cáscara de palma de aceite ha demostrado ser un
buen precursor para la producción de carbón activado (10).
Por un lado, la producción de carbón
activado involucra dos etapas: la carbonización de la materia prima y la
posterior activación del carbonizado en el ambiente oxidativo. La carbonización
implica la descomposición térmica destinada a la eliminación de la materia
volátil (MV) y la producción de carbono fijo (CF) con desarrollo de porosidad.
Parámetros como el tipo de biomasa, tiempo, temperatura y tipo de activación
definen la porosidad desarrollada en el material (1, 2, 7, 10).
Por otro lado, el AM es un colorante
catiónico ampliamente utilizado en procesos de tinción y es frecuentemente
investigado debido a su fuerte capacidad de adsorción en sólidos ya que a
menudo sirve como un compuesto modelo en estudios de adsorción de contaminantes
orgánicos desde soluciones acuosas (2, 6, 11).
El
modelo de cinética de pseudo primer orden está basado en la ecuación [1].
|
|
[1] |
Donde k1 es la constante de velocidad de
adsorción de pseudo
primer orden (min-1); qt y qe son las cantidades de AM adsorbidos en
un tiempo t y en el equilibrio respectivamente, t (min).
Al realizar una gráfica de log (qe - qt) en función del tiempo, los valores
de qe y k1 pueden ser determinados a
partir del intercepto y la pendiente, respectivamente (8). El modelo de pseudo segundo orden
se describe mediante la ecuación [2].
|
|
[2] |
Donde 𝑞𝑒 y 𝑞𝑡 es la cantidad de AM adsorbido
(mg/g) en el equilibrio y en el tiempo t (min),
respectivamente, y 𝑘2 es la constante de velocidad de
pseudo segundo orden (g/mg·min). Basados en los datos experimentales de qt y t, la capacidad de adsorción en el
equilibrio (𝑞𝑒) y la constante de velocidad de pseudo
segundo orden (𝑘2) pueden ser determinadas a partir de
un gráfico de t/qt Vs t usando la pendiente y el intercepto,
respectivamente.
Para
describir la interacción
entre el contaminante y el material adsorbente y cuantificar la capacidad de
adsorción en el equilibrio de los carbones pueden usarse los modelos de
isotermas de Langmuir y Freundlich. El
modelo de Langmuir tiene varias suposiciones, entre las que están: (i) una
molécula de adsorbente ocupa un solo sitio de adsorción sobre una superficie
homogénea; (ii) cuando todos los sitios de adsorción están ocupados el
adsorbente se satura (con una capacidad de 𝑄max) y no habrá más adsorción, donde el
adsorbato forma una superficie de espesor de una sola molécula (mono-capa);
(iii) la energía de adsorción no depende de las interacciones entre moléculas
adyacentes de adsorbato, es decir no hay interacción entre ellas (12). La Ecuación [3] se usa ampliamente para describir
este modelo.
|
|
[3] |
Donde
𝐶𝑒 y 𝑄𝑒 representan la concentración de AM
en el equilibrio (mg/L) y la capacidad de adsorción en el equilibrio (mg/g),
respectivamente. 𝑄𝑚 indica la capacidad máxima de
adsorbato (mg/g) adsorbido en el equilibrio cuando el adsorbente está saturado
y la constante KL es
proporcional a la energía de adsorción (L/g). Al graficar 𝐶𝑒/𝑄𝑒 vs 𝐶𝑒, se obtienen líneas rectas, de donde
KL y 𝑄max se
pueden calcular usando el intercepto y la pendiente, respectivamente.
En
el modelo de Langmuir por medio del factor de separación adimensional también
se puede decir si el proceso de adsorción es favorable, lineal, desfavorable o
irreversible. El factor de separación adimensional (RL)
se calcula según la Ecuación [4] (13).
|
|
[4] |
Donde RL es el factor de
separación adimensional, KL
es la constante de Langmuir y Ci es
la concentración inicial de AM.
Para
sistemas heterogéneos es común usar el modelo de Freundlich, el cual maneja los
siguientes supuestos: (i) la energía de adsorción disminuye logarítmicamente
con el incremento lineal del número de sitios ocupados, y (ii) no existe límite
para la cantidad de adsorbato que pueda unirse a la superficie del adsorbente (12). La forma lineal de la ecuación de
Freundlich se da como se muestra en la Ecuación [5].
|
|
[5] |
Donde
𝐾F es
la constante de disociación de Freundlich, la cual presenta altos valores
cuando el adsorbato tiene mayor afinidad hacia los sitios de adsorción o enlace
y la constante 𝑛 es proporcional a la intensidad de
reacción. 𝐾F y
𝑛 se pueden determinar a partir del
intercepto y pendiente de la relación lineal de log
𝑄𝑒 Vs log
𝐶𝑒,
respectivamente.
En
el presente estudio se produjeron carbones activados a partir de residuos
generados en la producción de palma de aceite mediante activación química. Se
evaluó su habilidad de remover AM y se caracterizaron mediante diferentes
técnicas de análisis.
Preparación
y caracterización de los materiales
Para
obtener carbón activado se usaron dos tipos de residuos, F y
C procedentes de la producción de palma de aceite. Para la activación química,
se utilizó la relación, biomasa: ZnCl2 de 1:2 (g:mL) y se dejó en
agitación durante 24 horas. La relación de impregnación fue escogida dado que
ha sido reportado que el incremento del agente activante lleva a obtener
carbones activados con alta área superficial (14-17). Transcurrido
este tiempo, se calcinaron las dos biomasas en una mufla a 550 ºC durante 30
min con una velocidad de calentamiento de 20 °C/min; se lavaron con 50 mL de
HCl 37% (p/p) manteniéndolas en
agitación a 30 ºC durante tres horas.
Las muestras se pasaron por un filtro
(fibra de vidrio Advantec GC 50, Vernon Hills, USA.) y se lavaron con agua
destilada, repitiendo el proceso hasta obtener un pH entre 6 a 7. Finalmente se
secaron en una estufa a 105 ºC durante 1 h. Se obtuvieron dos carbones activados:
FA y CA. Para efectos de comparación se sometieron las dos biomasas solo al
proceso de calcinación a 550 °C durante 30 minutos y se denominaron fibra
calcinada (FC) y cáscara calcinada (CC).
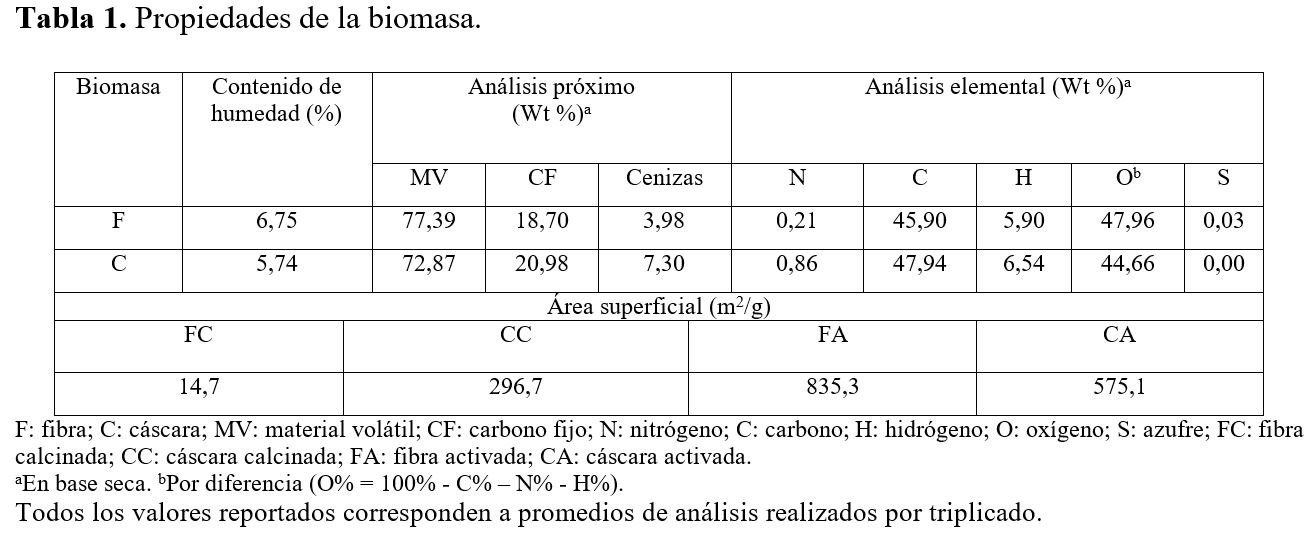
Tabla 1. Propiedades de
la biomasa.
|
Biomasa |
Contenido
de humedad (%) |
Análisis
próximo (Wt
%)a |
Análisis
elemental (Wt %)a |
||||||||
|
MV |
CF |
Cenizas |
N |
C |
H |
Ob |
S |
||||
|
F |
6,75 |
77,39 |
18,70 |
3,98 |
0,21 |
45,90 |
5,90 |
47,96 |
0,03 |
||
|
C |
5,74 |
72,87 |
20,98 |
7,30 |
0,86 |
47,94 |
6,54 |
44,66 |
0,00 |
||
|
Área
superficial (m2/g) |
|||||||||||
|
FC |
CC |
FA |
CA |
||||||||
|
14,7 |
296,7 |
835,3 |
575,1 |
||||||||
F: fibra; C: cáscara; MV:
material volátil; CF: carbono fijo; N: nitrógeno; C: carbono; H: hidrógeno; O:
oxígeno; S: azufre; FC: fibra calcinada; CC: cáscara calcinada; FA: fibra
activada; CA: cáscara activada.
a En base seca. bPor diferencia (O% = 100% - C% – N% - H%).
Todos los valores reportados corresponden a
promedios de análisis realizados por triplicado.
El
análisis próximo (TGA Q500, TA Instruments, New Castle, USA), análisis
elemental (CHN/CHNS/O TrueSpec® Micro, LECO, Michigan, USA) y la humedad
presente en cada una de las biomasas utilizadas determinada por TGA se
presentan en la Tabla 1. Todos los análisis se realizaron por triplicado. Los
carbones activados fueron caracterizados en su área superficial (ASAP 2020,
Micrometrics, Georgia, USA.), siguiendo el método BET (Brunauer, Emmett y
Teller) (14), mediante la adsorción de nitrógeno el cual es un procedimiento
estándar para la determinación de la porosidad de adsorbentes. La morfología se
determinó mediante escanografía de barrido electrónico, SEM-EDS (Philips XL 30
SFEG, Tustin, California, USA)
Pruebas de adsorción
Para los
experimentos de adsorción se usaron soluciones sintéticas de AM (la estructura
química del AM se muestra en la Figura 1) a concentraciones de 50, 100 y 150 mg/L;
las pruebas se realizaron en un montaje tipo Batch a 200 rpm. Mediante el
estudio cinético se pudo determinar el tiempo óptimo de contacto y mediante el
estudio de equilibrio se determinó la capacidad de adsorción de los materiales
en cada solución. Con el fin de determinar la concentración final de AM se
realizó una curva de calibración y se obtuvo la ecuación de la recta (Ecuación [6])
con un R2 de 0.9999. La absorbancia para determinar la concentración
se midió en el espectrofotómetro VIS-DR 3900 (Hach, Loveland,
Colorado, USA) a
una longitud de onda de 665 nm.
|
|
[6] |
Donde
y es la absorbancia y x es la concentración de AM (mg/L).
Figura 1. Estructura química del azul de metileno.
Experimentos de cinética
Para la determinación del tiempo óptimo de contacto
se adicionaron 0,02 g de carbón activado a un erlenmeyer con 50 mL de las
diferentes soluciones de AM. La mezcla se agitó y se tomaron muestras a 5, 10,
15, 20, 25, 30, 45, 60, 90, 120 y 180 min y se midió la absorbancia de cada
muestra.
Con los experimentos de cinética de
adsorción se puede predecir la velocidad a la que un contaminante es removido
desde soluciones acuosas y proporcionar datos que faciliten la comprensión del
mecanismo de adsorción (12). En el presente estudio, se
utilizaron los modelos cinéticos de pseudo primer orden y de pseudo segundo
orden. La adecuación entre valores predichos por los modelos y los datos
experimentales se estimó a partir del coeficiente de correlación, R2.
Para analizar la velocidad de adsorción de
AM dentro del material adsorbente y la cantidad adsorbida a un tiempo
determinado (t) se debe calcular el
balance de masa entre la concentración inicial y la concentración en el tiempo
t de acuerdo a la ecuación [7].
|
|
[7] |
Donde 𝑞𝑡 es la capacidad de
adsorción del adsorbente (mg/g), 𝐶i y 𝐶𝑡 son las concentraciones
iniciales y en el tiempo t de AM en
la solución (mg/L), V es el volumen de la
solución (L) y 𝑤 es la masa del adsorbente (g). Mediante este proceso
también es posible determinar el tiempo óptimo de contacto (12).
Experimentos de equilibrio
Para los experimentos de equilibrio se adicionaron cantidades
entre 0,02 y 0,1 g de adsorbente en un erlenmeyer y 50 mL de las
diferentes soluciones de AM. Después de 2 h de agitación (tiempo óptimo de
contacto) se tomaron las muestras y se midió la absorbancia a 665 nm.
Con estos experimentos se puede
describir cómo se da la interacción entre el contaminante y el material adsorbente,
y son importantes para optimizar el uso de dichos adsorbentes. Por medio de
modelos de isotermas de Langmuir y Freundlich, se cuantificó la capacidad de adsorción
en el equilibrio de los carbones activados y se describió el proceso de
adsorción.
Resultados
y discusión
Caracterización de los materiales
El análisis
próximo (Tabla 1) involucra la determinación de humedad, MV, CF y cenizas
presentes en la biomasa. Puede observarse que tanto la fibra
como la cáscara poseen alto contenido de MV, contenido medio de CF y bajo
contenido de cenizas (materia mineral). Con estos análisis es posible decir que
en el proceso de calcinación se perdió alrededor de un 75 % en masa debido a la
eliminación del MV, quedando el carbono listo para ser activado. Estos
resultados están dentro del rango de valores reportados en la literatura para
residuos de palma, lo que indica que este material puede ser usado para la
fabricación de carbón activado (10, 18).
Para observar
la morfología de los dos tipos de biomasa residual tanto calcinadas como
activadas (FC, FA, CC y CA) se realizó el análisis SEM, el cual se presenta en
la Figura 2. En las micrografías pueden observarse cambios significativos en la
morfología de las biomasas estudiadas. Las imágenes para las biomasas
calcinadas, FC y CC, muestran un bajo desarrollo de porosidad, lo que está de
acuerdo con los valores determinados de áreas superficiales (14,7 m2/g
para la FC y 296,7 m2/g para la CC); esta porosidad es generada por
la liberación de los compuestos volátiles durante el proceso de calcinación (19). Las micrografías para las biomasas activadas (FA y CA) con ZnCl2,
muestran una superficie discontinua causada por la acción de deshidratación del
agente activante (7, 20, 21), que conlleva al buen desarrollo de porosidad y por lo tanto al incremento
del área superficial, con valores de 835,3 m2/g y 575,1 m2/g
para la FA y CA, respectivamente.
Lo anterior
indica que el proceso de activación es más eficiente para la FA dado que el
área superficial es 57 veces mayor con respecto a la FC, mientras que para la cáscara
el proceso de activación sólo incrementa al doble el área superficial. Este
parámetro es uno de los más importantes a tener en cuenta en los carbones
activados dado que es ampliamente conocido que, a mayor área superficial del
sólido poroso, mayores serán los sitios disponibles para el proceso de
adsorción, lo cual implica mayor capacidad de adsorción (22).
|
|
|
Figura 2.
Micrografía SEM de los materiales calcinados y activados. FC: fibra
calcinada; FA: fibra activada; CC: cáscara calcinada; CA: cáscara activada. |
Selección
del adsorbente
Una serie de
experimentos fueron desarrollados con el objetivo de evaluar el potencial
adsorbente de los dos tipos de biomasa, F y C sin ningún tratamiento previo,
con calcinación FC y CC y con el posterior proceso de activación, FA y CA.
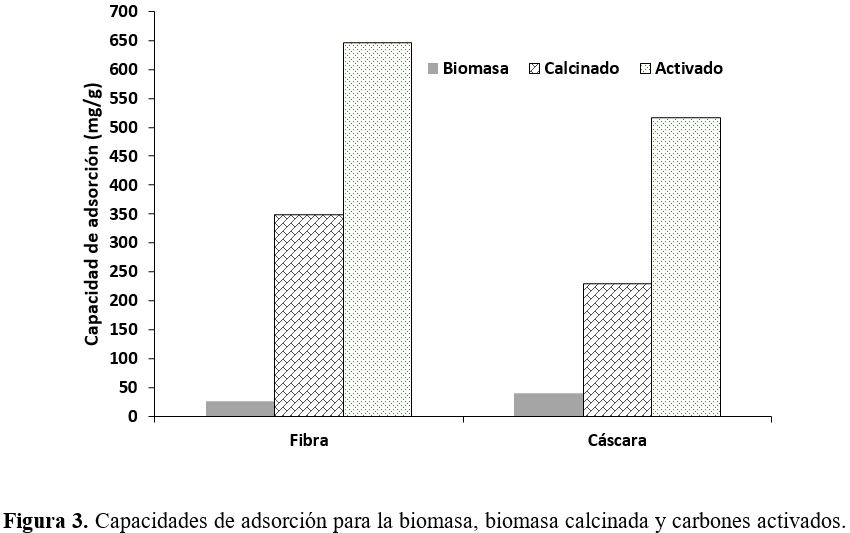
La Figura 3
muestra las capacidades de adsorción para las diferentes muestras trabajadas.
Puede
observarse que las diversas modificaciones realizadas a la biomasa original
generan un impacto positivo en la capacidad de adsorción. Al comparar las dos
biomasas calcinadas (FC y CC) con las biomasas activadas (FA y CA) se puede
encontrar un incremento en la capacidad de remoción del 46 y 56 % para la fibra
y la cáscara, respectivamente. Esta tendencia puede explicarse por el
incremento del área superficial (Tabla 1) en los materiales activados y por la
posible existencia de grupos funcionales superficiales que mejoran dicho
rendimiento. Con las consideraciones antes mencionadas, se seleccionaron la FA
y la CA como adsorbentes para realizar el estudio.
Las diferencias
entre la capacidad de adsorción y el área desarrollada puede estar directamente
relacionada con la composición química de cada biomasa, si bien las dos
biomasas proceden de los residuos de la palma de aceite, cada uno de ellas
presenta diferentes características químicas. En la Tabla 1 puede observarse
que la mayor diferencia en composición para las dos biomasas se encuentra en
los porcentajes de cenizas y material volátil. El material que obtuvo mayor
capacidad de adsorción fue la fibra (646,75 mg/g) (Figura 3), que a su vez
presenta mayor área superficial (835 m2/g). El mayor desarrollo de
área superficial puede estar directamente relacionado con la mayor cantidad de
material volátil que presenta este tipo de biomasa (Tabla 1), el cual puede
generar mayor cantidad de poros durante el proceso de evolución desde el
carbonizado (19). La mayor área superficial desarrollada por la fibra implica
una mayor capacidad de adsorción del AM. Con lo anterior podría concluirse que
el contenido de cenizas no presenta un efecto sinérgico en este proceso de
adsorción dado que la cantidad de cenizas para la cáscara es 1,83 veces mayor
que la encontrada para la fibra.
Efecto del tiempo de contacto y la concentración inicial en el proceso de adsorción
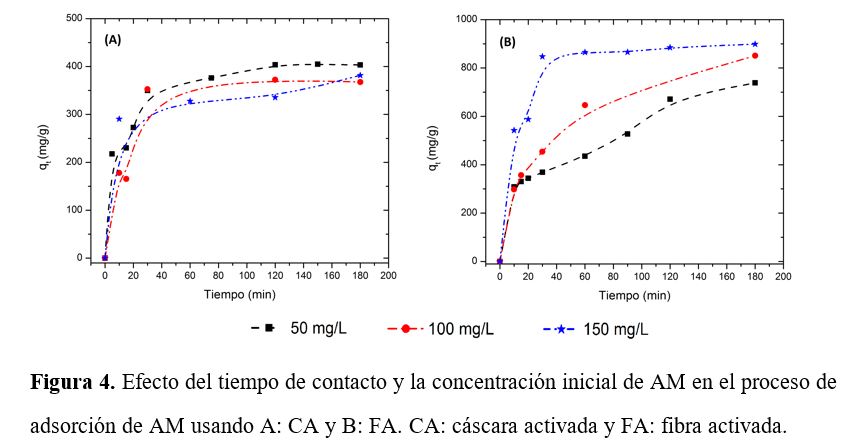
La Figura 4
describe el efecto del tiempo de contacto y de la concentración inicial de AM
en el proceso de adsorción sobre los carbones activados producidos, FA y CA.
Tres concentraciones iniciales, 50, 100 y 150 mg/L fueron seleccionadas para
una dosis constante de adsorbente de 0,02 g a 28 °C. Los resultados muestran que en un inicio hay
adsorción rápida, seguida de una disminución hasta alcanzar el equilibrio.
Figura 4. Efecto del tiempo de contacto y la concentración inicial de AM en el proceso de adsorción de AM usando A: CA y B: FA. CA: cáscara activada y FA: fibra activada.
Esto puede
explicarse porque inicialmente hay alta disponibilidad de sitios activos utilizables
a etapas tempranas del proceso de adsorción. Con la evolución del proceso, la
competencia entre partículas de AM con los grupos funcionales superficiales del
material adsorbente retarda el proceso de adsorción (22). La capacidad de adsorción en el equilibrio incrementa desde 671,1 mg/g
hasta 884,5 mg/g para el FA cuando la concentración inicial de AM incrementa de
50 a 150 mg/L, mientras que para el CA ocurre lo contrario, la capacidad de
adsorción en el equilibrio disminuye desde 403,5 mg/g hasta 335,5 mg/g. La
transferencia de masa incrementa con la concentración, resultando en alta
adsorción de AM. Esta tendencia puede deberse a que la CA se satura rápidamente
a bajas concentraciones, lo que conlleva a que no haya una evidencia en el
efecto del incremento de la concentración inicial en la capacidad de adsorción.
Estos dos resultados dan indicio de la diferencia en la estructura de poro que
presentan los dos materiales.
El caso
contrario se observó en el porcentaje de remoción, a medida que la
concentración inicial incrementa de 50 a 150 mg/L, el porcentaje de remoción
disminuye de 58% a 25% y de 36% a 10% para FA y CA, respectivamente. Con todo
lo anterior, es posible determinar que la adsorción de AM sobre el carbón
activado producido está fuertemente influenciado por la concentración inicial.
Experimentos
de cinética
Los estudios
cinéticos son de gran valor, porque a través de ellos es posible obtener
información relacionada con la velocidad límite del proceso de adsorción y
sobre los diferentes estados de transición que pueden llevar a la formación del
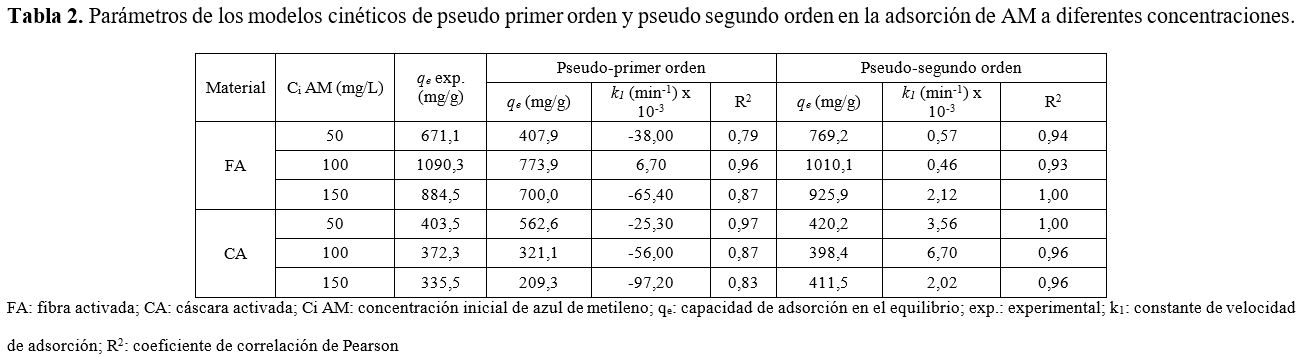
complejo final adsorbato-adsorbente (23). La Tabla 2 muestra los parámetros cinéticos de los modelos pseudo primer
orden y pseudo segundo orden. Para los dos carbones activados producidos se
observó una cinética rápida de adsorción en los primeros 30 min y para garantizar
un buen tiempo de equilibrio se tomó 2 h como el tiempo óptimo de contacto.
Tabla 2. Parámetros de
los modelos cinéticos de pseudo primer orden y pseudo segundo orden en la
adsorción de AM a diferentes concentraciones.
|
Material |
Ci AM (mg/L) |
qe exp. |
Pseudo-primer orden |
Pseudo-segundo orden |
||||
|
qe (mg/g) |
k1 (min-1) x
10-3 |
R2 |
qe (mg/g) |
k1 (min-1) x
10-3 |
R2 |
|||
|
FA |
50 |
671,1 |
407,9 |
-38,00 |
0,79 |
769,2 |
0,57 |
0,94 |
|
100 |
1090,3 |
773,9 |
6,70 |
0,96 |
1010,1 |
0,46 |
0,93 |
|
|
150 |
884,5 |
700,0 |
-65,40 |
0,87 |
925,9 |
2,12 |
1,00 |
|
|
CA |
50 |
403,5 |
562,6 |
-25,30 |
0,97 |
420,2 |
3,56 |
1,00 |
|
100 |
372,3 |
321,1 |
-56,00 |
0,87 |
398,4 |
6,70 |
0,96 |
|
|
150 |
335,5 |
209,3 |
-97,20 |
0,83 |
411,5 |
2,02 |
0,96 |
|
FA: fibra activada; CA: cáscara activada; Ci AM:
concentración inicial de azul de metileno; qe: capacidad de
adsorción en el equilibrio; exp.: experimental; k1: constante de
velocidad de adsorción; R2: coeficiente de correlación de Pearson
Con los datos
obtenidos, puede destacarse que el modelo de pseudo primer orden no es
apropiado para describir los datos experimentales. Esto se puede verificar por los
valores bajos de R2 (0,79 - 0,97) y por los valores altos de
|
|
[8] |
Para el modelo
de pseudo segundo orden, pueden observarse coeficientes de correlación cercanos
a la unidad (R2 > 0,93), y diferencias más pequeñas (
Resultados
similares han sido reportados en la literatura para la remoción de AM usando
carbones activados producidos desde diferentes tipos de biomasas (3, 7, 8).
Experimentos
de equilibrio
Las isotermas
de adsorción son herramientas útiles para predecir cómo las moléculas del
adsorbato están distribuidas sobre la interface sólido-líquido cuando se
alcanza el equilibrio químico dando información importante acerca de la
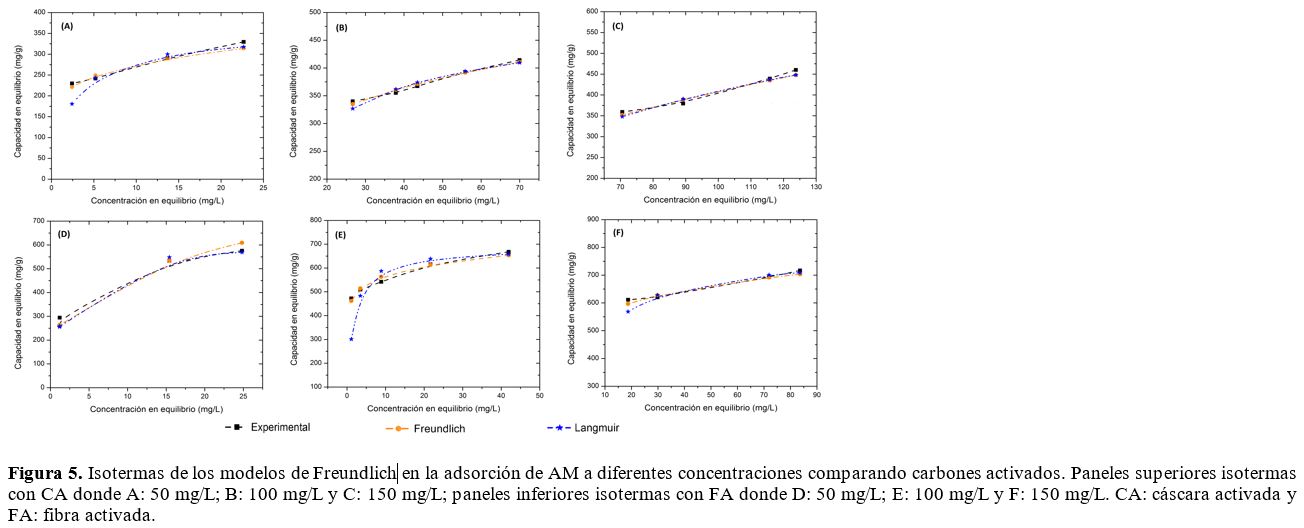
capacidad de adsorción del material. Las isotermas de adsorción del AM sobre
los carbones activados y los respectivos ajustes para los modelos de Langmuir y
Freundlich se muestran en la Figura 5. Los parámetros para cada modelo se
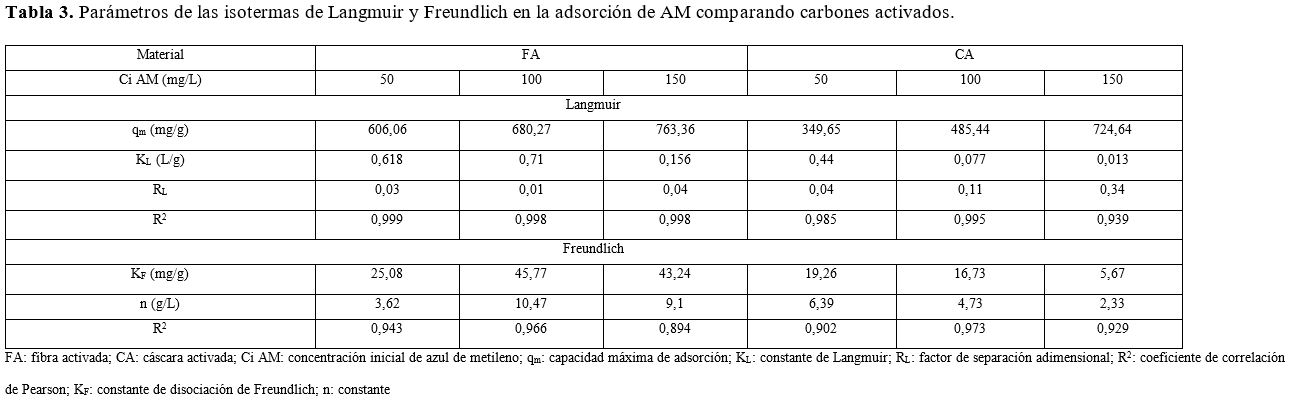
indican en la Tabla 3. De acuerdo a esta, la capacidad máxima de adsorción (qm) es de 763,4 y 724,6 mg/g
para la FA y la CA, respectivamente, en una solución de 150 mg/L. La capacidad
máxima incrementó con el aumento de la concentración inicial de AM. Los altos
valores de R2 para el modelo de Langmuir muestran que este modelo
ajusta de manera satisfactoria los datos experimentales. El modelo de Langmuir
considera que la adsorción ocurre sobre una superficie con sitios homogéneos de
energía que están disponibles para la interacción. Sin embargo, esto es
solamente válido hasta completar la monocapa.
Figura 5. Isotermas de
los modelos de Freundlich en la adsorción de AM a diferentes concentraciones
comparando carbones activados. Paneles superiores isotermas con CA donde A: 50
mg/L; B: 100 mg/L y C: 150 mg/L; paneles inferiores isotermas con FA donde D:
50 mg/L; E: 100 mg/L y F: 150 mg/L. CA: cáscara activada y FA: fibra activada.
El factor de
separación adimensional de las isotermas de Langmuir (RL) es un
parámetro importante que indica si el proceso de adsorción es favorable (0
< RL < 1), lineal (RL
= 1), desfavorable (RL > 1) o irreversible (RL = 0) (26). Los valores de RL a 50 mg/L y 150 mg/L como concentración
inicial de AM están en el rango de 0,01 a 0,04 y de 0,04 a 0,34 para FA y CA,
respectivamente. Lo anterior indica que el proceso de adsorción es favorable
para el rango de concentraciones trabajadas usando los dos tipos de adsorbentes
producidos.
Tabla 3. Parámetros de
las isotermas de Langmuir y Freundlich en la adsorción de AM comparando
carbones activados.
|
Material |
FA |
CA |
||||
|
Ci AM
(mg/L) |
50 |
100 |
150 |
50 |
100 |
150 |
|
Langmuir |
||||||
|
qm
(mg/g) |
606,06 |
680,27 |
763,36 |
349,65 |
485,44 |
724,64 |
|
KL (L/g) |
0,618 |
0,71 |
0,156 |
0,44 |
0,077 |
0,013 |
|
RL |
0,03 |
0,01 |
0,04 |
0,04 |
0,11 |
0,34 |
|
R2 |
0,999 |
0,998 |
0,998 |
0,985 |
0,995 |
0,939 |
|
Freundlich |
||||||
|
KF (mg/g) |
25,08 |
45,77 |
43,24 |
19,26 |
16,73 |
5,67 |
|
n
(g/L) |
3,62 |
10,47 |
9,1 |
6,39 |
4,73 |
2,33 |
|
R2 |
0,943 |
0,966 |
0,894 |
0,902 |
0,973 |
0,929 |
FA: fibra
activada; CA: cáscara activada; Ci AM: concentración inicial de azul de
metileno; qm: capacidad máxima de adsorción; KL:
constante de Langmuir; RL: factor de separación adimensional; R2:
coeficiente de correlación de Pearson; KF: constante de disociación
de Freundlich; n: constante
El modelo de
Freundlich toma en cuenta el postulado que dice que en el proceso de adsorción
ocurre adsorción en multicapas sobre una superficie heterogénea. En la Tabla 3
pueden observarse buenos coeficientes de linealidad (R2 > 0.90), lo cual indica que el
modelo describe de manera satisfactoria los datos experimentales. Los
parámetros
Comparación
con otros adsorbentes
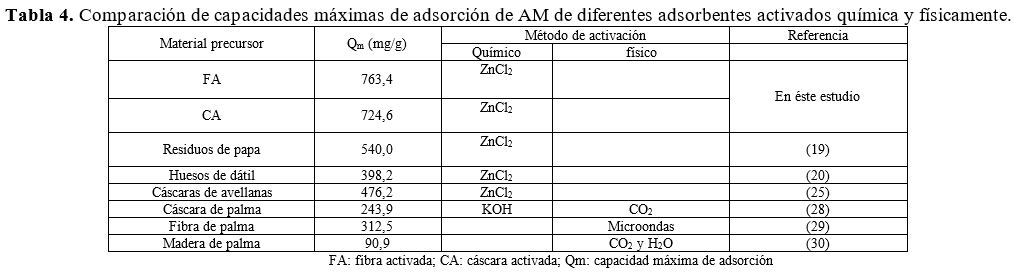
En la Tabla 4
se comparan las capacidades máximas de adsorción de los carbones activados obtenidos
en este estudio con las de otros carbones activados que están reportados en la
literatura (19, 20, 25) y que se obtuvieron con el mismo agente activante (ZnCl2). Adicionalmente,
se presenta la comparación de carbones activados obtenidos de residuos de palma
de aceite preparados por diferentes métodos de activación (28-30). Se puede ver
que la FA y la CA, materiales obtenidos en éste estudio, tienen capacidades
superiores, lo cual sugiere que poseen un gran potencial para aplicarlos como
adsorbentes en la remoción de colorantes desde soluciones acuosas.
Tabla 4. Comparación de
capacidades máximas de adsorción de AM de diferentes adsorbentes activados
química y físicamente.
|
Material precursor |
Qm (mg/g) |
Método de activación |
Referencia |
|
|
Químico |
físico |
|
||
|
FA |
763,4 |
ZnCl2 |
|
En éste estudio |
|
CA |
724,6 |
ZnCl2 |
|
|
|
Residuos de papa |
540,0 |
ZnCl2 |
|
(19) |
|
Huesos de dátil |
398,2 |
ZnCl2 |
|
(20) |
|
Cáscaras de avellanas |
476,2 |
ZnCl2 |
|
(25) |
|
Cáscara de palma |
243,9 |
KOH |
CO2 |
(28) |
|
Fibra de palma |
312,5 |
|
Microondas |
(29) |
|
Madera de palma |
90,9 |
|
CO2 y H2O |
(30) |
FA: fibra activada; CA:
cáscara activada; Qm: capacidad máxima de adsorción
Conclusiones
Los carbones
activados producidos por activación química con ZnCl2 a partir de los
residuos de la palma de aceite, fibra (mesocarpio) y cáscara (endocarpio) exhiben
áreas superficiales de 835,30 y 575,13 m2/g, respectivamente, lo que
indica que pueden ser usados como adsorbentes de AM. Los estudios cinéticos y
de equilibrio para la adsorción de AM se llevaron a cabo a diferentes concentraciones
iniciales y los datos experimentales se ajustaron a los modelos matemáticos. El
modelo de pseudo segundo presentó el mejor ajuste, lo que sugiere que la
quimisorción del AM sobre los carbones activados es la etapa que determina el proceso de adsorción. El modelo de Langmuir
es adecuado para describir la adsorción de AM en los carbones activados
producidos en este trabajo, mostrando una capacidad máxima de adsorción qm de 763,4 y 724,6 mg/g para
FA y CA, respectivamente. Por todo lo anterior, los resultados mostrados en
este estudio permiten concluir que los residuos de palma (fibra y cáscara) son
precursores potenciales para la producción de carbón activado para la adsorción
de contaminantes orgánicos, tal como el AM.
Agradecimientos
Los autores agradecen a
la Universidad de Medellín y a Cenipalma por la cofinanciación del proyecto.
Referencias
1.
Duman, G.; Onal, Y.; Okutuku, C.:
Onenc, S.; Yanik, J. Production of activated carbon from pine cone and evaluation
of its physical, chemical, and adsorption properties. Energy Fuels 2009, 23
(4), 2197-2204. DOI: https://doi.org/10.1021/ef800510m.
2.
Pirsaheb, M.; Rezai, Z.; Mansouri,
A.M.; Rastegar, A.; Alahabadi, A.; Sani, R. et al. Preparation of the activated
carbon from India shrub wood and their application for methylene blue removal:
modeling and optimization. Desalin. Water Treat. 2016, 57 (13), 5888-5902. DOI:
https://doi.org/10.1080/19443994.2015.1008581.
3.
Isah A., U.; Abdulraheem, G.;
Bala, S.; Muhammad, S.; Abdullahi, M. Kinetics, equilibrium and thermodynamics
studies of C.I. Reactive Blue 19 dye adsorption on coconut shell based
activated carbon. Int. Biodeterior. Biodegrad. 2015, 102, 265-273, DOI: https://doi.org/10.1016/j.ibiod.2015.04.006.
4. Ahmad, M.; Rajapaksha, A. U.; Lim, J.
E.; Zhang, M.; Bolan, N.; Mohan, D.; et al. Biochar as a sorbent for
contaminant management in soil and water: A review. Chemosphere 2014, 99,
19-33, DOI: https://doi.org/10.1016/j.chemosphere.2013.10.071.
5.
Hameed, B. H.; Ahmad, A. L.;
Latiff, K. N. A. Adsorption of basic dye (methylene blue) onto activated carbon
prepared from rattan sawdust. Dyes Pigments 2007, 75 (1), 143-149, DOI: https://doi.org/10.1016/j.dyepig.2006.05.039.
6.
Ekrami, E.; Dadashian, F.; Arami,
M. Adsorption of methylene blue by waste cotton activated carbon: equilibrium,
kinetics, and thermodynamic studies. Desalin. Water Treat. 2016, 57 (15), 7098-7108, DOI: 10.1080/19443994.2015.1015173.
7.
Pezoti Jr., O.; Cazetta, A. L.;
Souza, I. P. A. F.; Bedin, K. C.; Martins, A. C.; Silva, T. L.; et al. Adsorption studies of methylene blue onto
ZnCl2-activated carbon produced from buriti shells (Mauritia flexuosa L.). J.
Agr. Eng. Res. 2014, 20 (6), 4401-4407, DOI:
https://doi.org/10.1016/j.jiec.2014.02.007.
8.
Aboua, K. N.; Yobouet, Y. A.; Yao,
K. B.; Goné, D. L.; Trokourey, A. Investigation of dye adsorption onto
activated carbon from the shells of Macoré fruit. J. Environ. Manage. 2015,
156, 10-14, DOI: https://doi.org/10.1016/j.jenvman.2015.03.006.
9.
Garcia-Nunez, J. A.; Rodriguez, D. T.; Fontanilla, C. A.; Ramirez, N. E.; Silva
Lora, E. E.; Frear, C. S.; et al. Evaluation of alternatives for the evolution of palm oil mills into
biorefineries. Biomass Bioenergy 2016, 95, 310-329, DOI:
https://doi.org/10.1016/j.biombioe.2016.05.020.
10.
Hamza, U. D.; Nasri, N. S.; Amin, N.
S.; Mohammed, J.; Zain, H. M. Characteristics of oil palm shell biochar and
activated carbon prepared at different carbonization times. Desalin. Water
Treat. 2016, 57 (17), 7999-8006, DOI: 10.1080/19443994.2015.1042068.
11.
Bedin, K. C.; Martins, A. C.;
Cazetta, A. L.; Pezoti, O.; Almeida, V. C. KOH-activated carbon prepared from
sucrose spherical carbon: Adsorption equilibrium, kinetic and thermodynamic
studies for Methylene Blue removal. Chem. Eng. J. 2016, 286, 476-484, DOI:
https://doi.org/10.1016/j.cej.2015.10.099.
12. Acelas
Soto, N.Y. Remoción y recuperación de fósforo a partir de los residuos
generados en plantas de tratamiento de aguas residuales. Tesis, Universidad de
Antioquia, Medellín, 2013.
13. Tze, M.W.; Aroua, M.K.; Szlachta, M. Palm Shell-based
Activated Carbon for Removing Reactive Black 5 Dye: Equilibrium and Kinetics
Studies. Bio Resources 2015. 11 (1), 1432-1447. DOI:
https://doi.org/10.15376/biores.11.1.1432-1447
14.
Gañán-Gómez, J.; Macías-García, A.;
Díaz-Díez, M. A.; González-García, C.; Sabio-Rey, E. Preparation and
characterization of activated carbons from impregnation pitch by ZnCl2. Appl.
Surf. Sci. 2006, 252 (17), 5976-5979, DOI:
https://doi.org/10.1016/j.apsusc.2005.11.011.
15.
Caturla, F.; Molina, F.; Molina‐Sabio, M.; Rodríguez‐Reinoso, F.; Esteban, A. Electroless plating of
graphite with copper and nickel. J. Electrochem. Soc. 1995, 142 (12),
4084-4090, DOI: 10.1149/1.2048468
16.
Lua, A. C.; Yang, T. Characteristics
of activated carbon prepared from pistachio-nut shell by zinc chloride
activation under nitrogen and vacuum conditions. J. Colloid Interface Sci.
2005, 290 (2), 505-513, DOI: https://doi.org/10.1016/j.jcis.2005.04.063.
17.
Arami-Niya, A.; Daud, W. M. A. W.;
Mjalli, F. S. Using granular activated carbon prepared from oil palm shell by
ZnCl2 and physical activation for methane adsorption. J. Anal. Appl. Pyrolysis
2010, 89 (2), 197-203, DOI: https://doi.org/10.1016/j.jaap.2010.08.006.
18.
Mohammed, M. A. A.; Salmiaton, A.;
Wan Azlina, W. A. K. G.; Mohamad Amran, M. S. Gasification of oil palm empty
fruit bunches: A characterization and kinetic study. Bioresour. Technol. 2012, 110, 628-636, DOI:
https://doi.org/10.1016/j.biortech.2012.01.056.
19.
Zhang, Z.; Luo, X.; Liu, Y.; Zhou,
P.; Ma, G.; Lei, Z.; et al. A
low cost and highly efficient adsorbent (activated carbon) prepared from waste
potato residue. J. Taiwan Inst. Chem. Eng. 2015, 49, 206-211, DOI:
https://doi.org/10.1016/j.jtice.2014.11.024.
20.
Ahmed, M. J.; Dhedan, S. K.
Equilibrium isotherms and kinetics modeling of methylene blue adsorption on
agricultural wastes-based activated carbons. Fluid Phase Equilib. 2012, 317,
9-14, DOI: https://doi.org/10.1016/j.fluid.2011.12.026.
21.
Luna1, D.; González, A.;
Gordon1a, M.; Martín, N. Obtención de carbón activado a partir de la cáscara de
coco. ContactoS 2007, 64,
39-48. http://www.izt.uam.mx/newpage/contactos/anterior/n64ne/carbon_v2.pdf
22.
Islam, M. A.; Benhouria, A.; Asif,
M.; Hameed, B. H. Methylene blue adsorption on factory-rejected tea activated
carbon prepared by conjunction of hydrothermal carbonization and sodium
hydroxide activation processes. J. Taiwan Inst. Chem. Eng. 2015, 52, 57-64,
DOI: https://doi.org/10.1016/j.jtice.2015.02.010.
23.
Sen Gupta, S.; Bhattacharyya, K. G.
Kinetics of adsorption of metal ions on inorganic materials: A review. Adv.
Colloid Interface Sci. 2011, 162 (1–2), 39-58, DOI:
https://doi.org/10.1016/j.cis.2010.12.004.
24.
Acelas, N. Y.; Martin, B. D.; López,
D.; Jefferson, B. Selective removal of phosphate from wastewater using hydrated
metal oxides dispersed within anionic exchange media. Chemosphere 2015, 119
(0), 1353-1360, DOI: https://doi.org/10.1016/j.chemosphere.2014.02.024.
25. Karaçetin, G.; Sivrikaya, S.; Imamoğlu,
M. Adsorption of methylene blue from aqueous solutions by activated carbon
prepared from hazelnut husk using zinc chloride. J. Anal. Appl. Pyrolysis 2014,
110, 270-276, DOI: https://doi.org/10.1016/j.jaap.2014.09.006.
26. Mahapatra, K.; Ramteke, D. S.; Paliwal,
L. J. Production of activated carbon from sludge of food processing industry
under controlled pyrolysis and its application for methylene blue removal. J.
Anal. Appl. Pyrolysis 2012, 95, 79-86, DOI:
https://doi.org/10.1016/j.jaap.2012.01.009.
27.
Vargas, A. M. M.; Cazetta, A. L.;
Martins, A. C.; Moraes, J. C. G.; Garcia, E. E.; Gauze, G. F.; et al. Kinetic and equilibrium studies: Adsorption of food
dyes Acid Yellow 6, Acid Yellow 23, and Acid Red 18 on activated carbon from
flamboyant pods. Chem. Eng. J. 2012, 181–182, 243-250, DOI:
https://doi.org/10.1016/j.cej.2011.11.073.
Recibido: 25 de agosto de 2016; Aceptado: 6 de diciembre de 2016
Resumen
En el presente estudio se muestra la producción de carbón activado a partir de la biomasa residual generada en la producción de palma de aceite, fibra (F) y cáscara (C). Se realizó activación química con ZnCl2 y se evalúo la capacidad de remoción de azul de metileno (AM) para diferentes concentraciones (50, 100 y 150 mg/L). Los resultados mostraron un buen desarrollo de poro por dicho método de activación, con áreas superficiales de 835,3 m2/g para la fibra activada (FA) y 575,1 m2/g para la cáscara activada (CA). Se encontró un buen ajuste de los datos experimentales al modelo cinético de pseudo segundo orden y a las isotermas de Langmuir y Freundlich con capacidades máximas de adsorción de 763,4 y 724,6 mg/g para FA y CA, respectivamente.
Palabras clave
biomasa, carbón activado, palma de aceite, adsorción, activación química.Abstract
The production of activated carbon from residual biomass generated in the production of oil palm, fiber (F) and shell (C) was studied. The chemical activation was done using ZnCl2 and the adsorption capacity of methylene blue (AM) at different concentrations (50, 100, and 150 mg/L) was evaluated. Results showed a good development of pore with surface areas of 835.3 m2/g for activated fiber (FA) and 575.1 m2/g for activated shell (CA). A good fit of the experimental data with the pseudo second order kinetic model and with Langmuir and Freundlich isotherms models was found. In addition, maximum adsorption capacities of 763.4 and 724.6 mg/g for FA and CA were found, respectively.
Keywords
Biomass, activated carbon, palm oil, adsorption, chemical activation.Resumo
No presente estudo é mostrada a produção de carvão ativado a partir da biomassa residual gerada na produção de fibra de palmeira de óleo (F) e casca (C). A activação química foi realizada com ZnCl2, foi avaliada a capacidade de remoção do azul de metileno (AM) para diferentes concentrações (de 50, 100 e 150 mg/L). Os resultados mostraram um bom desenvolvimento do poro pelo método de ativação estudado para com áreas de superfície de 835,3 m2/g para a fibras activada (FA) e 575,1 m2/g para a casca activada (CA). Foi encontrado um bom ajuste dos dados experimentais ao modelo da cinética de pseudo segunda ordem e a isotermas de Langmuir e Freundlich com capacidades máximas de adsorção de 763,44 e 724,6 mg/g para a FA e CA, respectivamente.
Palavras-chave
biomassa, carvão ativado, palma de óleo, adsorção, ativação química.Introducción
La contaminación de los ríos y lagos generada por el vertimiento de colorantes provenientes de diferentes sectores industriales (textil, papel, plástico, madera y alimentos) está en continuo crecimiento. Los colorantes reducen la penetración de la luz en las corrientes de agua, generando una reducción en la capacidad de autopurificación de los ríos y lagos, lo cual produce deterioro de los ecosistemas acuáticos debido a la microtoxicidad. Por lo anterior, se han creado normas cada vez más estrictas relacionadas con la eliminación de dichos contaminantes desde aguas residuales provenientes de las industrias generadoras de dichos residuos, antes de realizar la descarga a los cuerpos de agua (1).
Lo anterior conlleva a la búsqueda de nuevos procedimientos eficientes en la remoción de colorantes en aguas residuales. En este sentido, técnicas como la adsorción, coagulación, floculación, oxidación, precipitación y filtración han sido propuestas para dicha remoción. La mayoría de estos procesos son métodos químicos que producen alta cantidad de lodos, causando problemas de disposición de residuos. Sin embargo, dentro de las técnicas antes mencionadas, el proceso de adsorción es un método adecuado y promisorio para ser utilizado en plantas de tratamiento de aguas residuales con el fin de dar cumplimiento a las regulaciones vigentes. Este método es de fácil operación y posee buena relación entre costo y efectividad (2).
Dentro de los materiales adsorbentes comúnmente usados se encuentra el carbón activado comercial, que, aunque es muy eficiente en el proceso de adsorción debido a su alta área superficial, buen volumen de poro y a los diferentes grupos funcionales superficiales activos, presenta alto costo en su producción. Esto ha motivado la búsqueda de adsorbentes alternativos que tengan una mejor relación costo-efectividad. Se ha investigado la conversión de residuos agrícolas en adsorbentes para el tratamiento de aguas residuales, dado que es ambientalmente amigable y tiene el potencial de reducir el costo de la disposición de residuos. Actualmente, se ha estudiado la producción de carbones activados usando precursores renovables y económicos, por ejemplo, subproductos agrícolas como residuos de coco (3), arroz, cáscaras de huevo (4), talas de árboles (1, 5), residuos de cosechas (6), entre otros (2, 7, 8).
Ahora bien, el aceite de palma es el aceite vegetal de mayor producción a nivel mundial (9). Del mismo modo, se ha reportado que la biomasa sólida residual generada en los molinos de aceite de palma es el doble de la cantidad de aceite producido, dicha biomasa residual incluye: troncos, frondas, fibras, conchas y racimos vacíos (9, 10). Dada la disponibilidad de esta biomasa en un solo punto durante todo el año (plantas de beneficio) y las preocupaciones económicas y ambientales relacionadas con su disposición, los usos potenciales de dicha biomasa para diferentes propósitos ha llamado cada vez más la atención. Así, la cáscara de palma de aceite ha demostrado ser un buen precursor para la producción de carbón activado (10).
Por un lado, la producción de carbón activado involucra dos etapas: la carbonización de la materia prima y la posterior activación del carbonizado en el ambiente oxidativo. La carbonización implica la descomposición térmica destinada a la eliminación de la materia volátil (MV) y la producción de carbono fijo (CF) con desarrollo de porosidad. Parámetros como el tipo de biomasa, tiempo, temperatura y tipo de activación definen la porosidad desarrollada en el material (1, 2, 7, 10).
Por otro lado, el AM es un colorante catiónico ampliamente utilizado en procesos de tinción y es frecuentemente investigado debido a su fuerte capacidad de adsorción en sólidos ya que a menudo sirve como un compuesto modelo en estudios de adsorción de contaminantes orgánicos desde soluciones acuosas (2, 6, 11).
Con el objetivo de predecir la velocidad de adsorción de AM sobre los carbones activados preparados se utilizan los modelos cinéticos de pseudo primer orden y de pseudo segundo orden.
El modelo de cinética de pseudo primer orden está basado en la ecuación [1].
Donde k1 es la constante de velocidad de adsorción de pseudo primer orden (min-1); qt y qe son las cantidades de AM adsorbidos en un tiempo t y en el equilibrio respectivamente, t (min). Al realizar una gráfica de log (qe - qt) en función del tiempo, los valores de qe y k1 pueden ser determinados a partir del intercepto y la pendiente, respectivamente (8) . El modelo de pseudo segundo orden se describe mediante la ecuación [2].
Donde 𝑞𝑒 y 𝑞𝑡 es la cantidad de AM adsorbido (mg/g) en el equilibrio y en el tiempo t (min), respectivamente, y 𝑘2 es la constante de velocidad de pseudo segundo orden (g/mg·min). Basados en los datos experimentales de qt y t, la capacidad de adsorción en el equilibrio (𝑞𝑒) y la constante de velocidad de pseudo segundo orden (𝑘2) pueden ser determinadas a partir de un gráfico de t/qt Vs t usando la pendiente y el intercepto, respectivamente.
Para describir la interacción entre el contaminante y el material adsorbente y cuantificar la capacidad de adsorción en el equilibrio de los carbones pueden usarse los modelos de isotermas de Langmuir y Freundlich. El modelo de Langmuir tiene varias suposiciones, entre las que están: (i) una molécula de adsorbente ocupa un solo sitio de adsorción sobre una superficie homogénea; (ii) cuando todos los sitios de adsorción están ocupados el adsorbente se satura (con una capacidad de 𝑄max) y no habrá más adsorción, donde el adsorbato forma una superficie de espesor de una sola molécula (mono-capa); (iii) la energía de adsorción no depende de las interacciones entre moléculas adyacentes de adsorbato, es decir no hay interacción entre ellas (12) . La Ecuación [3] se usa ampliamente para describir este modelo.
Donde 𝐶𝑒 y 𝑄𝑒 representan la concentración de AM en el equilibrio (mg/L) y la capacidad de adsorción en el equilibrio (mg/g), respectivamente. 𝑄𝑚 indica la capacidad máxima de adsorbato (mg/g) adsorbido en el equilibrio cuando el adsorbente está saturado y la constante KL es proporcional a la energía de adsorción (L/g). Al graficar 𝐶𝑒/𝑄𝑒 vs 𝐶𝑒, se obtienen líneas rectas, de donde KL y 𝑄max se pueden calcular usando el intercepto y la pendiente, respectivamente.
En el modelo de Langmuir por medio del factor de separación adimensional también se puede decir si el proceso de adsorción es favorable, lineal, desfavorable o irreversible. El factor de separación adimensional (RL) se calcula según la Ecuación [4] (13) .
Donde RL es el factor de separación adimensional, KL es la constante de Langmuir y Ci es la concentración inicial de AM.
Para sistemas heterogéneos es común usar el modelo de Freundlich, el cual maneja los siguientes supuestos: (i) la energía de adsorción disminuye logarítmicamente con el incremento lineal del número de sitios ocupados, y (ii) no existe límite para la cantidad de adsorbato que pueda unirse a la superficie del adsorbente (12) . La forma lineal de la ecuación de Freundlich se da como se muestra en la Ecuación [5].
Donde 𝐾F es la constante de disociación de Freundlich, la cual presenta altos valores cuando el adsorbato tiene mayor afinidad hacia los sitios de adsorción o enlace y la constante 𝑛 es proporcional a la intensidad de reacción. 𝐾F y 𝑛 se pueden determinar a partir del intercepto y pendiente de la relación lineal de log 𝑄𝑒 Vs log 𝐶𝑒, respectivamente.
En el presente estudio se produjeron carbones activados a partir de residuos generados en la producción de palma de aceite mediante activación química. Se evaluó su habilidad de remover AM y se caracterizaron mediante diferentes técnicas de análisis.
Materiales y métodos
Preparación y caracterización de los materiales
Para obtener carbón activado se usaron dos tipos de residuos, F y C procedentes de la producción de palma de aceite. Para la activación química, se utilizó la relación, biomasa: ZnCl2 de 1:2 (g:mL) y se dejó en agitación durante 24 horas. La relación de impregnación fue escogida dado que ha sido reportado que el incremento del agente activante lleva a obtener carbones activados con alta área superficial (14, 15, 16, 17). Transcurrido este tiempo, se calcinaron las dos biomasas en una mufla a 550 ºC durante 30 min con una velocidad de calentamiento de 20 °C/min; se lavaron con 50 mL de HCl 37% (p/p) manteniéndolas en agitación a 30 ºC durante tres horas.
Las muestras se pasaron por un filtro (fibra de vidrio Advantec GC 50, Vernon Hills, USA.) y se lavaron con agua destilada, repitiendo el proceso hasta obtener un pH entre 6 a 7. Finalmente se secaron en una estufa a 105 ºC durante 1 h. Se obtuvieron dos carbones activados: FA y CA. Para efectos de comparación se sometieron las dos biomasas solo al proceso de calcinación a 550 °C durante 30 minutos y se denominaron fibra calcinada (FC) y cáscara calcinada (CC).
El análisis próximo (TGA Q500, TA Instruments, New Castle, USA), análisis elemental (CHN/CHNS/O TrueSpec® Micro, LECO, Michigan, USA) y la humedad presente en cada una de las biomasas utilizadas determinada por TGA se presentan en la Tabla 1. Todos los análisis se realizaron por triplicado. Los carbones activados fueron caracterizados en su área superficial (ASAP 2020, Micrometrics, Georgia, USA.), siguiendo el método BET (Brunauer, Emmett y Teller) (14), mediante la adsorción de nitrógeno el cual es un procedimiento estándar para la determinación de la porosidad de adsorbentes. La morfología se determinó mediante escanografía de barrido electrónico, SEM-EDS (Philips XL 30 SFEG, Tustin, California, USA)
Pruebas de adsorción
Para los experimentos de adsorción se usaron soluciones sintéticas de AM (la estructura química del AM se muestra en la Figura 1) a concentraciones de 50, 100 y 150 mg/L; las pruebas se realizaron en un montaje tipo Batch a 200 rpm. Mediante el estudio cinético se pudo determinar el tiempo óptimo de contacto y mediante el estudio de equilibrio se determinó la capacidad de adsorción de los materiales en cada solución. Con el fin de determinar la concentración final de AM se realizó una curva de calibración y se obtuvo la ecuación de la recta (Ecuación [6] donde y es la absorbancia y x es la concentración de AM en mg/L) con un R2 de 0.9999. La absorbancia para determinar la concentración se midió en el espectrofotómetro VIS-DR 3900 (Hach, Loveland, Colorado, USA) a una longitud de onda de 665 nm.
Experimentos de cinética
Para la determinación del tiempo óptimo de contacto se adicionaron 0,02 g de carbón activado a un erlenmeyer con 50 mL de las diferentes soluciones de AM. La mezcla se agitó y se tomaron muestras a 5, 10, 15, 20, 25, 30, 45, 60, 90, 120 y 180 min y se midió la absorbancia de cada muestra.
Con los experimentos de cinética de adsorción se puede predecir la velocidad a la que un contaminante es removido desde soluciones acuosas y proporcionar datos que faciliten la comprensión del mecanismo de adsorción (12). En el presente estudio, se utilizaron los modelos cinéticos de pseudo primer orden y de pseudo segundo orden. La adecuación entre valores predichos por los modelos y los datos experimentales se estimó a partir del coeficiente de correlación, R2.
Para analizar la velocidad de adsorción de AM dentro del material adsorbente y la cantidad adsorbida a un tiempo determinado (t) se debe calcular el balance de masa entre la concentración inicial y la concentración en el tiempo t de acuerdo a la ecuación [7].
Donde 𝑞𝑡 es la capacidad de adsorción del adsorbente (mg/g), 𝐶i y 𝐶𝑡 son las concentraciones iniciales y en el tiempo t de AM en la solución (mg/L), V es el volumen de la solución (L) y 𝑤 es la masa del adsorbente (g). Mediante este proceso también es posible determinar el tiempo óptimo de contacto (12).
Experimentos de equilibrio
Para los experimentos de equilibrio se adicionaron cantidades entre 0,02 y 0,1 g de adsorbente en un erlenmeyer y 50 mL de las diferentes soluciones de AM. Después de 2 h de agitación (tiempo óptimo de contacto) se tomaron las muestras y se midió la absorbancia a 665 nm.
Con estos experimentos se puede describir cómo se da la interacción entre el contaminante y el material adsorbente, y son importantes para optimizar el uso de dichos adsorbentes. Por medio de modelos de isotermas de Langmuir y Freundlich, se cuantificó la capacidad de adsorción en el equilibrio de los carbones activados y se describió el proceso de adsorción.
Resultados y discusión
Caracterización de los materiales
El análisis próximo (Tabla 1) involucra la determinación de humedad, MV, CF y cenizas presentes en la biomasa. Puede observarse que tanto la fibra como la cáscara poseen alto contenido de MV, contenido medio de CF y bajo contenido de cenizas (materia mineral). Con estos análisis es posible decir que en el proceso de calcinación se perdió alrededor de un 75 % en masa debido a la eliminación del MV, quedando el carbono listo para ser activado. Estos resultados están dentro del rango de valores reportados en la literatura para residuos de palma, lo que indica que este material puede ser usado para la fabricación de carbón activado (10, 18).
Para observar la morfología de los dos tipos de biomasa residual tanto calcinadas como activadas (FC, FA, CC y CA) se realizó el análisis SEM, el cual se presenta en la Figura 2. En las micrografías pueden observarse cambios significativos en la morfología de las biomasas estudiadas. Las imágenes para las biomasas calcinadas, FC y CC, muestran un bajo desarrollo de porosidad, lo que está de acuerdo con los valores determinados de áreas superficiales (14,7 m2/g para la FC y 296,7 m2/g para la CC); esta porosidad es generada por la liberación de los compuestos volátiles durante el proceso de calcinación (19). Las micrografías para las biomasas activadas (FA y CA) con ZnCl2, muestran una superficie discontinua causada por la acción de deshidratación del agente activante (7, 20, 21), que conlleva al buen desarrollo de porosidad y por lo tanto al incremento del área superficial, con valores de 835,3 m2/g y 575,1 m2/g para la FA y CA, respectivamente.
Lo anterior indica que el proceso de activación es más eficiente para la FA dado que el área superficial es 57 veces mayor con respecto a la FC, mientras que para la cáscara el proceso de activación sólo incrementa al doble el área superficial. Este parámetro es uno de los más importantes a tener en cuenta en los carbones activados dado que es ampliamente conocido que, a mayor área superficial del sólido poroso, mayores serán los sitios disponibles para el proceso de adsorción, lo cual implica mayor capacidad de adsorción (22).
Selección del adsorbente
Una serie de experimentos fueron desarrollados con el objetivo de evaluar el potencial adsorbente de los dos tipos de biomasa, F y C sin ningún tratamiento previo, con calcinación FC y CC y con el posterior proceso de activación, FA y CA.
La Figura 3 muestra las capacidades de adsorción para las diferentes muestras trabajadas.
Puede observarse que las diversas modificaciones realizadas a la biomasa original generan un impacto positivo en la capacidad de adsorción. Al comparar las dos biomasas calcinadas (FC y CC) con las biomasas activadas (FA y CA) se puede encontrar un incremento en la capacidad de remoción del 46 y 56 % para la fibra y la cáscara, respectivamente. Esta tendencia puede explicarse por el incremento del área superficial (Tabla 1) en los materiales activados y por la posible existencia de grupos funcionales superficiales que mejoran dicho rendimiento. Con las consideraciones antes mencionadas, se seleccionaron la FA y la CA como adsorbentes para realizar el estudio.
Las diferencias entre la capacidad de adsorción y el área desarrollada puede estar directamente relacionada con la composición química de cada biomasa, si bien las dos biomasas proceden de los residuos de la palma de aceite, cada uno de ellas presenta diferentes características químicas. En la Tabla 1 puede observarse que la mayor diferencia en composición para las dos biomasas se encuentra en los porcentajes de cenizas y material volátil. El material que obtuvo mayor capacidad de adsorción fue la fibra (646,75 mg/g) (Figura 3), que a su vez presenta mayor área superficial (835 m2/g). El mayor desarrollo de área superficial puede estar directamente relacionado con la mayor cantidad de material volátil que presenta este tipo de biomasa (Tabla 1), el cual puede generar mayor cantidad de poros durante el proceso de evolución desde el carbonizado (19). La mayor área superficial desarrollada por la fibra implica una mayor capacidad de adsorción del AM. Con lo anterior podría concluirse que el contenido de cenizas no presenta un efecto sinérgico en este proceso de adsorción dado que la cantidad de cenizas para la cáscara es 1,83 veces mayor que la encontrada para la fibra.
Efecto del tiempo de contacto y la concentración inicial en el proceso de adsorción
La Figura 4 describe el efecto del tiempo de contacto y de la concentración inicial de AM en el proceso de adsorción sobre los carbones activados producidos, FA y CA. Tres concentraciones iniciales, 50, 100 y 150 mg/L fueron seleccionadas para una dosis constante de adsorbente de 0,02 g a 28 °C. Los resultados muestran que en un inicio hay adsorción rápida, seguida de una disminución hasta alcanzar el equilibrio.
Esto puede explicarse porque inicialmente hay alta disponibilidad de sitios activos utilizables a etapas tempranas del proceso de adsorción. Con la evolución del proceso, la competencia entre partículas de AM con los grupos funcionales superficiales del material adsorbente retarda el proceso de adsorción (22). La capacidad de adsorción en el equilibrio incrementa desde 671,1 mg/g hasta 884,5 mg/g para el FA cuando la concentración inicial de AM incrementa de 50 a 150 mg/L, mientras que para el CA ocurre lo contrario, la capacidad de adsorción en el equilibrio disminuye desde 403,5 mg/g hasta 335,5 mg/g. La transferencia de masa incrementa con la concentración, resultando en alta adsorción de AM. Esta tendencia puede deberse a que la CA se satura rápidamente a bajas concentraciones, lo que conlleva a que no haya una evidencia en el efecto del incremento de la concentración inicial en la capacidad de adsorción. Estos dos resultados dan indicio de la diferencia en la estructura de poro que presentan los dos materiales.
El caso contrario se observó en el porcentaje de remoción, a medida que la concentración inicial incrementa de 50 a 150 mg/L, el porcentaje de remoción disminuye de 58% a 25% y de 36% a 10% para FA y CA, respectivamente. Con todo lo anterior, es posible determinar que la adsorción de AM sobre el carbón activado producido está fuertemente influenciado por la concentración inicial.
Experimentos de cinética
Los estudios cinéticos son de gran valor, porque a través de ellos es posible obtener información relacionada con la velocidad límite del proceso de adsorción y sobre los diferentes estados de transición que pueden llevar a la formación del complejo final adsorbato-adsorbente (23). La Tabla 2 muestra los parámetros cinéticos de los modelos pseudo primer orden y pseudo segundo orden. Para los dos carbones activados producidos se observó una cinética rápida de adsorción en los primeros 30 min y para garantizar un buen tiempo de equilibrio se tomó 2 h como el tiempo óptimo de contacto.
Con los datos obtenidos, puede destacarse que el modelo de pseudo primer orden no es apropiado para describir los datos experimentales. Esto se puede verificar por los valores bajos de R2 (0,79 - 0,97) y por los valores altos de (Ecuación [8]).
Para el modelo de pseudo segundo orden, pueden observarse coeficientes de correlación cercanos a la unidad (R2 > 0,93), y diferencias más pequeñas (Ecuación [8]) que las encontradas en el modelo de pseudo primer orden para todas las concentraciones trabajadas con los dos carbones activados producidos. Estos resultados indican que hay un ajuste satisfactorio de todos los datos experimentales. Esto sugiere que la quimisorción del AM sobre el carbón activado es la etapa que determina el proceso de adsorción (24, 25). El modelo pseudo segundo orden puede interpretarse como un tipo especial de modelo cinético de Langmuir, suponiendo que la concentración del adsorbato es constante en relación al tiempo y a la cantidad de sitios de enlace sobre la superficie que dependen de la cantidad de adsorbato adsorbido en el equilibrio (7).
Resultados similares han sido reportados en la literatura para la remoción de AM usando carbones activados producidos desde diferentes tipos de biomasas (3, 7, 8).
Experimentos de equilibrio
Las isotermas de adsorción son herramientas útiles para predecir cómo las moléculas del adsorbato están distribuidas sobre la interface sólido-líquido cuando se alcanza el equilibrio químico dando información importante acerca de la capacidad de adsorción del material. Las isotermas de adsorción del AM sobre los carbones activados y los respectivos ajustes para los modelos de Langmuir y Freundlich se muestran en la Figura 5. Los parámetros para cada modelo se indican en la Tabla 3. De acuerdo a esta, la capacidad máxima de adsorción (qm) es de 763,4 y 724,6 mg/g para la FA y la CA, respectivamente, en una solución de 150 mg/L. La capacidad máxima incrementó con el aumento de la concentración inicial de AM. Los altos valores de R2 para el modelo de Langmuir muestran que este modelo ajusta de manera satisfactoria los datos experimentales. El modelo de Langmuir considera que la adsorción ocurre sobre una superficie con sitios homogéneos de energía que están disponibles para la interacción. Sin embargo, esto es solamente válido hasta completar la monocapa.
El factor de separación adimensional de las isotermas de Langmuir (RL) es un parámetro importante que indica si el proceso de adsorción es favorable (0 < RL < 1), lineal (RL = 1), desfavorable (RL > 1) o irreversible (RL = 0) (26). Los valores de RL a 50 mg/L y 150 mg/L como concentración inicial de AM están en el rango de 0,01 a 0,04 y de 0,04 a 0,34 para FA y CA, respectivamente. Lo anterior indica que el proceso de adsorción es favorable para el rango de concentraciones trabajadas usando los dos tipos de adsorbentes producidos.
El modelo de Freundlich toma en cuenta el postulado que dice que en el proceso de adsorción ocurre adsorción en multicapas sobre una superficie heterogénea. En la Tabla 3 pueden observarse buenos coeficientes de linealidad (R2 > 0.90), lo cual indica que el modelo describe de manera satisfactoria los datos experimentales. Los parámetros y dan información importante sobre la interacción del sistema AM-carbón activado. El es definido como el factor de heterogeneidad e indica cuando el proceso de adsorción es lineal (n = 1), físico (n > 1) o químico (n > 1) (27). Los valores determinados para los dos carbones activados muestran valores de dando cuenta de procesos de fisisorción.
Comparación con otros adsorbentes
En la Tabla 4 se comparan las capacidades máximas de adsorción de los carbones activados obtenidos en este estudio con las de otros carbones activados que están reportados en la literatura (19, 20, 25) y que se obtuvieron con el mismo agente activante (ZnCl2). Adicionalmente, se presenta la comparación de carbones activados obtenidos de residuos de palma de aceite preparados por diferentes métodos de activación (25, 26, 27). Se puede ver que la FA y la CA, materiales obtenidos en éste estudio, tienen capacidades superiores, lo cual sugiere que poseen un gran potencial para aplicarlos como adsorbentes en la remoción de colorantes desde soluciones acuosas.
Conclusiones
Los carbones activados producidos por activación química con ZnCl2 a partir de los residuos de la palma de aceite, fibra (mesocarpio) y cáscara (endocarpio) exhiben áreas superficiales de 835,30 y 575,13 m2/g, respectivamente, lo que indica que pueden ser usados como adsorbentes de AM. Los estudios cinéticos y de equilibrio para la adsorción de AM se llevaron a cabo a diferentes concentraciones iniciales y los datos experimentales se ajustaron a los modelos matemáticos. El modelo de pseudo segundo presentó el mejor ajuste, lo que sugiere que la quimisorción del AM sobre los carbones activados es la etapa que determina el proceso de adsorción. El modelo de Langmuir es adecuado para describir la adsorción de AM en los carbones activados producidos en este trabajo, mostrando una capacidad máxima de adsorción qm de 763,4 y 724,6 mg/g para FA y CA, respectivamente. Por todo lo anterior, los resultados mostrados en este estudio permiten concluir que los residuos de palma (fibra y cáscara) son precursores potenciales para la producción de carbón activado para la adsorción de contaminantes orgánicos, tal como el AM.
Agradecimientos
Las autoras agradecen a la Universidad de Medellín y a Cenipalma por la cofinanciación del proyecto.
Referencias
Referencias
Duman, G.; Onal, Y.; Okutuku, C.: Onenc, S.; Yanik, J. Production of activated carbon from pine cone and evaluation of its physical, chemical, and adsorption properties. Energy Fuels 2009, 23 (4), 2197-2204. DOI: https://doi.org/10.1021/ef800510m.
Pirsaheb, M.; Rezai, Z.; Mansouri, A.M.; Rastegar, A.; Alahabadi, A.; Sani, R. et al. Preparation of the activated carbon from India shrub wood and their application for methylene blue removal: modeling and optimization. Desalin. Water Treat. 2016, 57 (13), 5888-5902. DOI: https://doi.org/10.1080/19443994.2015.1008581.
Isah A., U.; Abdulraheem, G.; Bala, S.; Muhammad, S.; Abdullahi, M. Kinetics, equilibrium and thermodynamics studies of C.I. Reactive Blue 19 dye adsorption on coconut shell based activated carbon. Int. Biodeterior. Biodegrad. 2015, 102, 265-273, DOI: http://dx.doi.org/10.1016/j.ibiod.2015.04.006.
Ahmad, M.; Rajapaksha, A. U.; Lim, J. E.; Zhang, M.; Bolan, N.; Mohan, D.; et al. Biochar as a sorbent for contaminant management in soil and water: A review. Chemosphere 2014, 99, 19-33, DOI: http://dx.doi.org/10.1016/j.chemosphere.2013.10.071.
Hameed, B. H.; Ahmad, A. L.; Latiff, K. N. A. Adsorption of basic dye (methylene blue) onto activated carbon prepared from rattan sawdust. Dyes Pigments 2007, 75 (1), 143-149, DOI: http://dx.doi.org/10.1016/j.dyepig.2006.05.039.
Ekrami, E.; Dadashian, F.; Arami, M. Adsorption of methylene blue by waste cotton activated carbon: equilibrium, kinetics, and thermodynamic studies. Desalin. Water Treat. 2016, 57 (15), 7098-7108, DOI: 10.1080/19443994.2015.1015173.
Pezoti Jr., O.; Cazetta, A. L.; Souza, I. P. A. F.; Bedin, K. C.; Martins, A. C.; Silva, T. L.; et al. Adsorption studies of methylene blue onto ZnCl2-activated carbon produced from buriti shells (Mauritia flexuosa L.). J. Agr. Eng. Res. 2014, 20 (6), 4401-4407, DOI: http://dx.doi.org/10.1016/j.jiec.2014.02.007.
Aboua, K. N.; Yobouet, Y. A.; Yao, K. B.; Goné, D. L.; Trokourey, A. Investigation of dye adsorption onto activated carbon from the shells of Macoré fruit. J. Environ. Manage. 2015, 156, 10-14, DOI: http://dx.doi.org/10.1016/j.jenvman.2015.03.006.
Garcia-Nunez, J. A.; Rodriguez, D. T.; Fontanilla, C. A.; Ramirez, N. E.; Silva Lora, E. E.; Frear, C. S.; et al. Evaluation of alternatives for the evolution of palm oil mills into biorefineries. Biomass Bioenergy 2016, 95, 310-329, DOI: http://dx.doi.org/10.1016/j.biombioe.2016.05.020.
Hamza, U. D.; Nasri, N. S.; Amin, N. S.; Mohammed, J.; Zain, H. M. Characteristics of oil palm shell biochar and activated carbon prepared at different carbonization times. Desalin. Water Treat. 2016, 57 (17), 7999-8006, DOI: 10.1080/19443994.2015.1042068.
Bedin, K. C.; Martins, A. C.; Cazetta, A. L.; Pezoti, O.; Almeida, V. C. KOH-activated carbon prepared from sucrose spherical carbon: Adsorption equilibrium, kinetic and thermodynamic studies for Methylene Blue removal. Chem. Eng. J. 2016, 286, 476-484, DOI: http://dx.doi.org/10.1016/j.cej.2015.10.099.
Acelas Soto, N.Y. Remoción y recuperación de fósforo a partir de los residuos generados en plantas de tratamiento de aguas residuales. Tesis, Universidad de Antioquia, Medellín, 2013.
Tze, M.W.; Aroua, M.K.; Szlachta, M. Palm Shell-based Activated Carbon for Removing Reactive Black 5 Dye: Equilibrium and Kinetics Studies. Bio Resources 2015. 11 (1), 1432-1447. DOI: https://doi.org/10.15376/biores.11.1.1432-1447
Gañán-Gómez, J.; Macías-García, A.; Díaz-Díez, M. A.; González-García, C.; Sabio-Rey, E. Preparation and characterization of activated carbons from impregnation pitch by ZnCl2. Appl. Surf. Sci. 2006, 252 (17), 5976-5979, DOI: http://dx.doi.org/10.1016/j.apsusc.2005.11.011.
Caturla, F.; Molina, F.; Molina‐Sabio, M.; Rodríguez‐Reinoso, F.; Esteban, A. Electroless plating of graphite with copper and nickel. J. Electrochem. Soc. 1995, 142 (12), 4084-4090, DOI: 10.1149/1.2048468
Lua, A. C.; Yang, T. Characteristics of activated carbon prepared from pistachio-nut shell by zinc chloride activation under nitrogen and vacuum conditions. J. Colloid Interface Sci. 2005, 290 (2), 505-513, DOI: http://dx.doi.org/10.1016/j.jcis.2005.04.063.
Arami-Niya, A.; Daud, W. M. A. W.; Mjalli, F. S. Using granular activated carbon prepared from oil palm shell by ZnCl2 and physical activation for methane adsorption. J. Anal. Appl. Pyrolysis 2010, 89 (2), 197-203, DOI: http://dx.doi.org/10.1016/j.jaap.2010.08.006.
Mohammed, M. A. A.; Salmiaton, A.; Wan Azlina, W. A. K. G.; Mohamad Amran, M. S. Gasification of oil palm empty fruit bunches: A characterization and kinetic study. Bioresour. Technol. 2012, 110, 628-636, DOI: http://dx.doi.org/10.1016/j.biortech.2012.01.056.
Zhang, Z.; Luo, X.; Liu, Y.; Zhou, P.; Ma, G.; Lei, Z.; et al. A low cost and highly efficient adsorbent (activated carbon) prepared from waste potato residue. J. Taiwan Inst. Chem. Eng. 2015, 49, 206-211, DOI: http://dx.doi.org/10.1016/j.jtice.2014.11.024.
Ahmed, M. J.; Dhedan, S. K. Equilibrium isotherms and kinetics modeling of methylene blue adsorption on agricultural wastes-based activated carbons. Fluid Phase Equilib. 2012, 317, 9-14, DOI: http://dx.doi.org/10.1016/j.fluid.2011.12.026.
Luna1, D.; González, A.; Gordon1a, M.; Martín, N. Obtención de carbón activado a partir de la cáscara de coco. ContactoS 2007, 64, 39-48. http://www.izt.uam.mx/newpage/contactos/anterior/n64ne/carbon_v2.pdf
Islam, M. A.; Benhouria, A.; Asif, M.; Hameed, B. H. Methylene blue adsorption on factory-rejected tea activated carbon prepared by conjunction of hydrothermal carbonization and sodium hydroxide activation processes. J. Taiwan Inst. Chem. Eng. 2015, 52, 57-64, DOI: http://dx.doi.org/10.1016/j.jtice.2015.02.010.
Sen Gupta, S.; Bhattacharyya, K. G. Kinetics of adsorption of metal ions on inorganic materials: A review. Adv. Colloid Interface Sci. 2011, 162 (1–2), 39-58, DOI: http://dx.doi.org/10.1016/j.cis.2010.12.004.
Acelas, N. Y.; Martin, B. D.; López, D.; Jefferson, B. Selective removal of phosphate from wastewater using hydrated metal oxides dispersed within anionic exchange media. Chemosphere 2015, 119 (0), 1353-1360, DOI: http://dx.doi.org/10.1016/j.chemosphere.2014.02.024.
Karaçetin, G.; Sivrikaya, S.; Imamoğlu, M. Adsorption of methylene blue from aqueous solutions by activated carbon prepared from hazelnut husk using zinc chloride. J. Anal. Appl. Pyrolysis 2014, 110, 270-276, DOI: http://dx.doi.org/10.1016/j.jaap.2014.09.006.
Mahapatra, K.; Ramteke, D. S.; Paliwal, L. J. Production of activated carbon from sludge of food processing industry under controlled pyrolysis and its application for methylene blue removal. J. Anal. Appl. Pyrolysis 2012, 95, 79-86, DOI: http://dx.doi.org/10.1016/j.jaap.2012.01.009.
Vargas, A. M. M.; Cazetta, A. L.; Martins, A. C.; Moraes, J. C. G.; Garcia, E. E.; Gauze, G. F.; et al. Kinetic and equilibrium studies: Adsorption of food dyes Acid Yellow 6, Acid Yellow 23, and Acid Red 18 on activated carbon from flamboyant pods. Chem. Eng. J. 2012, 181–182, 243-250, DOI: http://dx.doi.org/10.1016/j.cej.2011.11.073.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. L López, A P Ramirez, S Giraldo, E Flórez, N Y Acelas. (2019). Removal of dyes from aqueous solutions by adsorbent prepared from coffee residues. Journal of Physics: Conference Series, 1386(1), p.012035. https://doi.org/10.1088/1742-6596/1386/1/012035.
2. S Giraldo, A P Ramirez, M Ulloa, E Flórez, N Y Acelas. (2017). Dyes removal from water using low cost absorbents. Journal of Physics: Conference Series, 935, p.012011. https://doi.org/10.1088/1742-6596/935/1/012011.
3. Astrid Quisperima, Sebastián Pérez, Elizabeth Flórez, Nancy Acelas. (2022). Valorization of potato peels and eggshells wastes: Ca-biocomposite to remove and recover phosphorus from domestic wastewater. Bioresource Technology, 343, p.126106. https://doi.org/10.1016/j.biortech.2021.126106.
4. Stephanie Giraldo, Nancy Y. Acelas, Raúl Ocampo-Pérez, Erika Padilla-Ortega, Elizabeth Flórez, Camilo A. Franco, Farid B. Cortés, Angélica Forgionny. (2022). Application of Orange Peel Waste as Adsorbent for Methylene Blue and Cd2+ Simultaneous Remediation. Molecules, 27(16), p.5105. https://doi.org/10.3390/molecules27165105.
5. Anyi Ramirez-Muñoz, Angélica Forgionny, Juan Muñoz-Saldaña, Elizabeth Flórez, Nancy Acelas. (2025). Pharmaceuticals removal from aqueous solution by water hyacinth (Eichhornia crassipes): a comprehensive investigation of kinetics, equilibrium, and thermodynamics. Environmental Science and Pollution Research, 32(7), p.4239. https://doi.org/10.1007/s11356-024-35665-w.
6. Stephanie Giraldo, Irma Robles, Anyi Ramirez, Elizabeth Flórez, Nancy Acelas. (2020). Mercury removal from wastewater using agroindustrial waste adsorbents. SN Applied Sciences, 2(6) https://doi.org/10.1007/s42452-020-2736-x.
7. FRANCISCO PRIETO GARCÍA, ROBERTO A. CANALES-FLORES, JUDITH PRIEO-MÉNDEZ, OTILIO A. ACEVEDO-SANDOVAL, ELENA M. OTAZO-SÁNCHEZ. (2022). EVALUATION OF THREE LIGNOCELLULOSE BIOMASS MATERIALS (BARLEY HUSK, CORN COBS, AGAVE LEAVES) AS PRECURSORS OF ACTIVATED CARBON. Revista de la Facultad de Ciencias, 11(1), p.17. https://doi.org/10.15446/rev.fac.cienc.v11n1.97719.
8. Roberto Antonio Canales-Flores, Francisco Prieto-García. (2022). Obtención de carbones activados a partir de residuos agroindustriales mediante activación química con ácido fosfórico para la adsorción de azul de metileno. Tendencias en energías renovables y sustentabilidad, 1(1), p.527. https://doi.org/10.56845/terys.v1i1.250.
9. Anyi Ramirez-Muñoz, Elizabeth Flórez, Raúl Ocampo-Perez, Nancy Acelas, Moonis Ali Khan. (2024). Effective phosphorus removal using transformed water hyacinth: Performance evaluation in fixed-bed columns and practical applications. PLOS ONE, 19(11), p.e0312432. https://doi.org/10.1371/journal.pone.0312432.
10. S Giraldo, A P Ramirez, E Flórez, N Y Acelas. (2019). Adsorbent materials obtained from palm waste and its potential use for contaminants removal from aqueous solutions. Journal of Physics: Conference Series, 1386(1), p.012036. https://doi.org/10.1088/1742-6596/1386/1/012036.
11. A. Forgionny, C. Jimenez-Orozco, E. Flórez, N. Acelas. (2024). Cadmium Toxicity Mitigation. , p.297. https://doi.org/10.1007/978-3-031-47390-6_12.
12. A P Ramirez, S Giraldo, M Ulloa, E Flórez, N Y Acelas. (2017). Production and characterization of activated carbon from wood wastes. Journal of Physics: Conference Series, 935, p.012012. https://doi.org/10.1088/1742-6596/935/1/012012.
13. Isabel Cristina Páez-Pumar Romer, Isabella Victoria Plazola Santana, Rosa María Rodríguez Bengoechea, Miguel Manuel Pérez Hernández. (2022). Sorption - From Fundamentals to Applications. https://doi.org/10.5772/intechopen.102898.
14. Stephanie Giraldo, Irma Robles, Luis A. Godínez, Nancy Acelas, Elizabeth Flórez. (2021). Experimental and Theoretical Insights on Methylene Blue Removal from Wastewater Using an Adsorbent Obtained from the Residues of the Orange Industry. Molecules, 26(15), p.4555. https://doi.org/10.3390/molecules26154555.
15. João Rodrigo Coimbra Nobre, Leandro Santos Queiroz, Jonnys Paz Castro, Matheus Felipe Freire Pego, Lisiane Nunes Hugen, Carlos Emmerson Ferreira da Costa, Juliana de Jesus Rocha Pardauil, Luís Adriano Santos do Nascimento, Geraldo Narciso da Rocha Filho, José Roberto Zamian, Elias Costa de Souza, Maria Lucia Bianchi. (2023). Potential of agro-industrial residues from the Amazon region to produce activated carbon. Heliyon, 9(7), p.e17189. https://doi.org/10.1016/j.heliyon.2023.e17189.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).