ENTALPÍA DE INMERSIÓN DE MONOLITOS DE CARBÓN ACTIVADO
Downloads
ENTALPIA DE INMERSIÓN DE MONOLITOS DE CARBÓN ACTIVADO EN SOLVENTE APOLAR
IMMERSION ENTHALPY OF ACTIVATED CARBON MONOLITHS IN NONPOLAR SOLVENT
ENTALPIA DE INMERSIÓN DE MONOLITOS DE CARBON ATIVADO EM SOLVENTE APOLAR
Diana P. Vargas1, Liliana Giraldo Gutiérrez1,2, Juan Carlos Moreno3
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Carrera 30 No. 45-03, Bogotá, Colombia.
3 Departamento de Química, Facultad de Ciencias, Universidad de los Andes, Carrera 1 este No. 18A-10, Bogotá, Colombia.
Recibido: 18/04/10 - Aceptado: 30/08/10
RESUMEN
En este trabajo se presentan los resultados obtenidos de la calorimetría de inmersión en benceno sobre monolitos de carbón activado tipo disco y panal, que se obtuvieron mediante activación química de cascara de coco con cloruro de zinc a diferentes concentraciones. Adicionalmente, las estructuras fueron caracterizadas por adsorción de N2 a 77 K. Las entalpías de inmersión determinadas se encuentran entre 73,5 y 164,2 Jg-1; con los datos de inmersión se calculó el área accesible y se comparó con el área obtenida mediante adsorción de N2 a 77K, encontrando una buena correlación. En todas las muestras se observó un aumento de la entalpía de inmersión en benceno con el área superficial, igualmente una disminución de la energía característica con el aumento del volumen de poro.
Palabras clave: monolitos de carbón, activación química, isotermas de adsorción, entalpias de inmersión, energía característica, área superficial accesible.
ABSTRACT
This work presents the results obtained from immersion calorimetry in benzene on activated carbon monoliths disc and honeycomb type that were obtained from coconut shell using chemical activation with zinc chloride at different concentrations. The structures were characterized by adsorption N2 at 77 K. The immersion enthalpies are between 73.5 and 164.2 Jg-1. Using immersion enthalpy data the accessible area was calculated and compared with the area obtained by N2 adsorption at 77K. A good correlation was found. In all the samples was observed an increase in the immersion enthalpy into benzene with the surface area. In addition there was a decrease in the energy characteristic with increasing pore volume.
Key words: carbon monolith, chemistry activation, adsorption isotherm, immersion enthalpy, characteristic energy, accessible surface area.
RESUMO
Neste trabalho se apresentam os resultados obtidos da calorimetría de imersão em benzeno sobre monolitos de carvão ativado tipo disco e panal que se obtiveram mediante activação química de casca de coco com cloreto de zinco a diferentes concentrações. Adicionalmente as estruturas foram caracterizadas por adsorção de N2 a 77 K. As entalpías de imersão determinadas se encontram entre 73,5 e 164,2 Jg-1, com os dados de imersão se calculo o área acessível e se comparo com o área obtida mediante adsorção de N2 a 77K, encontrando uma boa correlação. Em todas as mostras se observo um aumento da entalpía de imersão em benzeno com o área superficial. Ademais se observou uma diminuição da energia característica com o aumento do volume de poro.
Palavras-chave: monolitos de carvão, activação química, isoterma de adsorção, entalpías de inmersão, energia característica, área superficial acessível.
INTRODUCCIÓN
Desde hace milenios el hombre ha explotado y modificado la naturaleza para subsistir, pero en los últimos decenios además ha producido miles de sustancias nuevas que se han difundido por toda la atmósfera, la hidrosfera, los suelos y la biosfera, las cuales amenazan el equilibrio natural de los ecosistemas. La acción del hombre sobre el planeta ha sido tan notable, especialmente en el último siglo, que se puede afirmar que no existe ecosistema que no esté afectado por su actividad. Esta realidad ha venido preocupando a diferentes organismos de protección ambiental, y se han incrementado los estudios alrededor de tecnologías que contribuyan a disminuir la cantidad de contaminantes en fase acuosa y gaseosa. Una de estas nuevas tecnologías es el carbón activado, un material que se prepara artificialmente para que presente propiedades adsorbentes (1). El carbón activado es un material poroso y tiene diferentes formas de presentación, entre ellas las estructuras compactas, como los discos y panales, a los que se han denominado monolitos de carbón. Son múltiples las ventajas que presentan estas formas relativamente nuevas de carbón activado (2). La importancia de los monolitos de carbón activado radica en que gracias a las propiedades que presentan, son múltiples sus aplicaciones en el campo de la catálisis, la adsorción y el almacenamiento de gases, entre otros (3-6). La síntesis de monolitos de carbón, utilizables como soportes o adsorbentes directos, surge como una alternativa a las problemáticas ambientales, y constituye un campo de investigación interesante.
Como los procesos en general presentan durante su evolución un efecto térmico, la técnica calorimétrica permite conocer tanto la magnitud de estos efectos como la variación que se presenta en los sistemas que se involucran, en los que se incluye el instrumento de medida. Los procesos físicos y químicos que ocurren en la superficie de los sólidos generan cantidades de calor que se pueden determinar para caracterizar ciertas interacciones (7-10). Con el aumento en la sensibilidad y la precisión de los métodos para medir pequeñas cantidades de calor, del orden de 10 a 100 mJ, como los que se producen en la interacción sólido-gas y sólido-líquido, las técnicas calorimétricas se usan con mayor frecuencia y en diferentes ámbitos puesto que suministran información complementaria a los amplios estudios de isotermas de adsorción en fase gas-vapor y en fase líquida.
La calorimetría de inmersión se usa para conocer, según las condiciones termodinámicas del sistema, el calor que se producen cuando se ponen en contacto un sólido y un líquido, y por tanto la entalpía de inmersión del proceso de contacto, que se establece para una cantidad específica del sólido que se estudia. Los efectos térmicos resultantes de sumergir un sólido en un solvente, generalmente de tipo no polar, con el cual el sólido no presenta interacciones químicas, se pueden relacionar con el área superficial del sólido considerado, mediante los modelos desarrollados por Dubinin y Stoeckli (10).
En este trabajo se llevan a cabo calorimetrías de inmersión en benceno de seis muestras de monolitos de carbón activado tipo disco y panal, a las que también se les realizan isotermas de adsorción de N2. Con los resultados obtenidos se calcula desde las isotermas de adsorción el área superficial y la energía característica, y desde las entalpías de inmersión el área accesible para cada sólido.
MATERIALES Y MÉTODOS
Preparación de los monolitos
El proceso de obtención consta de una etapa inicial de adecuación del material precursor en la que este se tritura y se tamiza. Luego se impregnan 20 g del precursor en 40 mL de soluciones de ZnCl2 al 20, 32 y 48%P/V durante 7 h a 358 K. Después la temperatura se incrementa hasta 383K por aproximadamente 2 horas hasta alcanzar una consistencia plástica deformable con la presión. A continuación se lleva a una prensa uniaxial, en donde se hace el conformado por prensado a 423 K. Los monolitos se carbonizan en un horno horizontal a una velocidad de calentamiento lineal de 1 K min-1, hasta alcanzar una temperatura de 773 K permaneciendo allí durante 2 horas, con un flujo de N2 de 85 mL min-1. Finalmente, se lavan con ácido clorhídrico 0,1 M y agua destilada hasta pH neutro para eliminar los restos del agente químico usado en la impregnación (11-15).
Isotermas de adsorción de N2
Todos los monolitos de carbón activado fueron caracterizados por adsorción física de N2 a 77 K usando un equipo QUANTACHROME, Autosorb 3-B. El volumen de microporo fue calculado mediante la aplicación de la ecuación de Dubinin-Radushkevich, y el área superficial se obtuvo mediante el método BET.
Determinación de la entalpia de inmersión de los monolitos de carbón activado en benceno
Las muestras se caracterizaron mediante calorimetría de inmersión en benceno (0,37 nm) usando un equipo tipo Calvet (10), previa desgasificación a 10-3 Torr. Se colocaron en la celda alrededor de 10 mL de la solución por utilizar, que se habían mantenido en un termostato a 298 K; se pesó una muestra del monolito de carbón activado del orden de 50 a 100 mg, y se colocó dentro de la celda calorimétrica en una ampolleta de vidrio; se ensambló el microcalorímetro. Cuando el equipo alcanzó una temperatura de 298 K, se inició el registro de potencial de salida por un periodo de aproximadamente 15 minutos tomando lecturas de potencial cada 20 segundos; se procedió a romper la ampolleta de vidrio, se registró el efecto térmico generado y se continuó con las lecturas de potencial por aproximadamente 15 minutos más; finalmente se calibró eléctricamente.
RESULTADOS Y DISCUSIÓN
Las muestras fueron codificadas usando la letra D para los discos y P para los panales seguida de la concentración de ZnCl2 usada para cada muestra. En la Figura 1 se muestran los monolitos obtenidos; estos tienen un diámetro de 1,5 cm, con una altura de 6 mm; en los monolitos tipo panal el tamaño de los canales transversales es de 2 mm. La densidad de los canales por área geométrica en la estructura es de 0,086gcm-3.
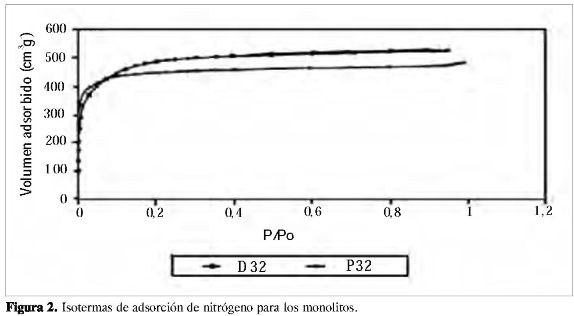
En la Figura 2 se muestran las isotermas de adsorción de los monolitos disco y panal con mayor área superficial para cada serie. Se aprecia que las condiciones experimentales de impregnación, prensado y carbonización empleadas en la preparación permiten la obtención de sólidos microporosos, hecho que se justifica en la forma tipo I de las isotermas. Para la muestra D32 el codo de la isoterma es abierto, lo cual indica que tiene una mayor distribución de tamaño de poro, en comparación con la muestra P32 en la que el codo cerrado indica que el sólido presenta una porosidad estrecha.
Los monolitos de carbón activado preparados presentan áreas superficiales entre 725 y 1.523 m2g-1 y volumen de microporo entre 0,38 y 0,79 cm3g-1, como se presenta en la Tabla 1, resultados que son satisfactorios teniendo en cuenta los reportes recientes en la preparación de estos materiales en los que se han obtenido resultados de área BET entre 500 m2g-1 y 2.500 m2g-1, y un volumen de microporo entre 0,2 y 1,4 cm3g-1 (11-15), y que los materiales monolíticos se preparan a partir de un precursor lignocelulósico sin agregar aglomerantes que pueden obstruir la porosidad que se alcanza en la activación.
En la Tabla 1 se recopilan los datos obtenidos para la caracterización de los monolitos. Se observa que a las concentraciones utilizadas en el estudio, la forma de las estructuras no afecta significativamente el volumen de poro; sin embargo el área superficial difiere entre 100-200 m2g-1 entre la forma panal y disco, siendo la última aquella en la que se obtienen mayores áreas superficiales.
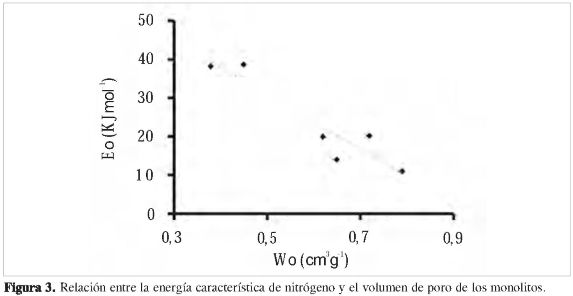
Para el conjunto de muestras se estableció una correlación entre la energía característica y el volumen de poro determinados a partir de la adsorción de nitrógeno (Figura 3). Se evidencia una disminución de la energía característica con el aumento del volumen de poro; este comportamiento se explica porque a menor cubrimiento superficial, la energía de interacción es mayor, y es similar a lo obtenido en un trabajo realizado por S. A. Dastgheib (16).
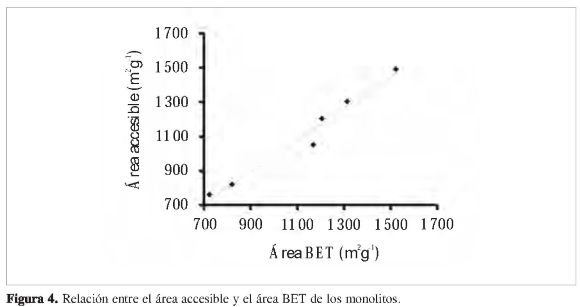
Los resultados indican que para el conjunto de datos la entalpía de inmersión aumenta con el área superficial, lo cual es lógico si se considera que hay una mayor superficie disponible para la molécula sonda, y por ende el efecto térmico aumenta. Así mismo, estudios previos han demostrado que mediante la técnica calorimétrica se puede obtener el área accesible a la molécula sonda (17), la cual es comparable con el área BET obtenida a partir de la adsorción de nitrógeno. De esta manera se calculó el área superficial de cada sólido por aproximación del área superficial accesible, y para hacerlo se tomó como referencia un sólido no poroso Negro de Carbono de área superficial 30 m2g-1, para calcular la entalpía específica con la molécula sonda, el valor de la entalpía específica Δhesp es de 0,110 Jm2 (10). En la Figura 4 se observa el ajuste del conjunto de datos. Al comparar los valores del área superficial accesible con los datos de las áreas superficiales calculadas por las isotermas de adsorción de N2, se puede decir que las desviaciones entre los valores se encuentran entre 0,12 y 2%, y no son tan significativas para las muestras, teniendo en cuenta que cada modelo tiene sus propias características y no hay un modelo absoluto para calcular áreas superficiales. Las consideraciones de este modelo son que el líquido interactúa con la superficie y se toma en cuenta el llenado de los microporos.
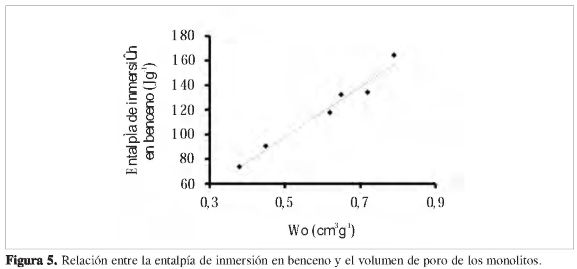
La Figura 5 presenta la relación entre la entalpía de inmersión y el volumen de poro. Se observa un aumento de la entalpía con el volumen de poro, siendo esto coherente dado que hay un mayor espacio en la superficie del sólido para interactuar con la molécula de benceno, lo cual genera un efecto térmico mayor, que es cuantificado mediante la técnica calorimétrica. El calor de inmersión es una medida del volumen de poros accesible a la molécula del líquido de inmersión, y abre así la posibilidad de utilizar la calorimetría de inmersión como una herramienta para obtener una distribución de tamaño de poro en sólidos microporosos. La característica más importante de este enfoque es la asunción de proporcionalidad simple entre el volumen de poro y la entalpía de inmersión, independientemente del papel desempeñado por microporos en el aumento del potencial de adsorción.
CONCLUSIONES
Los valores de las entalpías de inmersión en benceno mostraron una relación directamente proporcional con el área superficial BET, y sus valores se encuentran entre 73,5 y 164,2 Jg1. Se observó una cercanía entre los valores de área superficial BET y área superficial accesible, a pesar de que dichos parámetros se determinaron por técnicas de caracterización diferentes, lo cual ratifica la utilidad de la calorimetría de inmersión como técnica complementaria para la caracterización de materiales adsorbentes.
Los monolitos de carbón activado tipo disco y panal obtenidos presentaron valores de área superficial BET entre 726 y 1.523 m2g-1, y volúmenes de micropore entre 0,38 y 0,79 cm3g-1. Las mejores características se consiguieron en las muestras D32, disco, y P32, panal, las cuales se obtuvieron en las mismas condiciones, variando únicamente la forma de las estructuras.
AGRADECIMIENTOS
Los autores agradecen al convenio marco entre la Universidad de los Andes y la Universidad Nacional de Colombia y al Acta de Acuerdo entre los departamentos de Química de las dos universidades. Se agradece igualmente a las Vicerrectorías de Investigación de las dos instituciones.
REFERENCIAS BIBLIOGRÁFICAS
1. Yates, M.; Blanco, J.; Ávila P.; Martin, M. P. Materiales de porosidad controlada para la protección ambiental. Micropor Mesopor Mater. 2000. 37: 201-208.
2. Ruiz, V.; Blanco, C.; Santamaría, R.; Ramos-Fernández, J. M.; Martínez-Escandell, M.; Sepúlve-da-Escribano, A.; Rodríguez-Reinoso, F. An activated carbon monolith as an electrode material for supercapacitors. Carbon. 2009. 47 (1): 195-200.
3. Liu, L.; Liu, Z.; Zhanggen Huang.; Liu, Z.; Liu, P. Preparation of activated carbon honeycomb monolith directly from coal. Carbon. 2006. 44 (8): 1598-1601.
4. Lozano-Castelló, D.; Cazorla-Amorós, D.; Linares-Solano, A.; Quinn, D. F. Activated carbon monolith for methane storage influence ofbinder. Carbon. 2002. 40 (15): 2817-2825.
5. Ramos Fernández, J. M.; Martínez Escandell, M.; Rodríguez Reinoso, F. Production ofbinderless activated carbon monoliths by KOH activation of carbon mesophase materials. Carbon. 2008. 46: 384-386.
6. Blanco, J.; Ávila, P.; Martin, M. P. Honeycomb monoliths of activated carbons for effluent gas purification. Micropor Mesopor Mater. 2000. 37: 201-208.
7. Menéndez, J. A. On the use of calorimetric techniques for the characterization of carbons: A brief review. Thermochim. 312: 79-86.
8. Rodríguez-Reinoso, F.; Molina-Sabio, M. Textural and chemical characterization of microporous carbons. Advances in Collo and Interfa Scien. 1998. 76-77: 271-294.
9. Moreno, J. C.; Giraldo, L. Determination of the Immersion Enthalpy of activated carbon by Microcalorimetry of the Heat Conduction. Inst. Sci. and Technol. 2000. 28 (2): 171-178.
10. Silvestre-Albero, J.; Gómez de Salazar, C.; Sepúlveda-Escribano, A.; Rodríguez-Reinoso, F. Characterization of microporous solids by Inmersion calorimetry. Collo. and Surface A. 2001. 187: 151-165.
11. Nakagawaa, Y.; Molina-Sabio, M.; Rodríguez-Reinoso, F. Modification of the porous structure along the preparation of activated carbon monoliths with H3PO4 and ZnCl2. Microp. and Mesop. Mater. 2007. 103: 29-34.
12. Almansa, C.; Molina-Sabio, M.; Rodríguez-Reinoso, F. Adsorption of methane into ZnCl2 activated carbon derived disc. Microp. and Mesop. Mater. 2004. 76: 185-191.
13. Molina-Sabio, M.; Almansa, C.; Rodríguez-Reinoso, F. Procedimiento para la obtención de monolitos de carbón activado, monolitos obtenidos y su empleo. Patente España 2165784. 2003.
14. Caturla, F.; Molina-Sabio, M.; Rodríguez-Reinoso, F. Preparation of activated carbon by chemical activation with ZnCl2. Carbon. 1991. 29: 999-1007.
15. Liu, L. Preparation of activated carbon honeycomb monolith directly from coal. Carbon. 2006. 44: 1581-1616.
16. Dastgheib, S. A.; Karanfil, T. The effect of the physical and chemical characteristics of activated carbons on the adsorption energy and affinity coefficient of Dubinin equation. J. Collo. and lnterfa. Scien. 2005.292: 312-321.
17. Moreno, J. C.; Giraldo, L.; Gómez, A. Applicability ofthe Stoeckli-Bansal-Donnet equation for the determination of total area of activated carbons by microcalorimetry of inmersion. Inst. Sci. and Technol. 1998. 26(5): 533-541.
How to Cite
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Download Citation
Article abstract page views
Downloads
License
Authors will retain their copyright and guarantee the journal the right of first publication of their work, which will be simultaneously subject to the Creative Commons Recognition License (CC. Attribution 4.0) that allows third parties to always share the work as the authors and their publication in this journal be indicated.
Authors may adopt other non-exclusive license agreements for the distribution of the version of the published work (eg: deposit it in an institutional archive or publish it in a monographic volume) provideding always the first publication in this Journal.
Authors are allowed and encouraged to disseminate their work through the Internet (eg, in institutional files or on their website) before and during the submission process, which can lead to interesting exchanges and increase citations of the published work (See The effect of open access).