Optimización de la síntesis de aldehído canfolénico a partir del epóxido de α-pineno con Cu/MCM-41
Optimization of the synthesis of campholenic aldehyde from α-pinene epoxide with Cu/MCM-41
Optimização da síntese de aldeído camfolênico desde epóxido de α -pineno com Cu/MCM-41
DOI:
https://doi.org/10.15446/rev.colomb.quim.v47n3.72129Keywords:
Diseño de experimentos, isomerización, aldehído canfolénico, epóxido (es)Experiment design, isomerization, campholenic aldehyde, epoxide (en)
Desenho de experimentos, isomerização, aldeído camfolênico, epóxido (pt)
Downloads
Se sintetizó el catalizador Cu/MCM-41 mediante impregnación húmeda incipiente y se caracterizó por DRX, XPS, TPD-NH3 y adsorción-desorción de N2. Se evaluó el efecto de diferentes condiciones de reacción (temperatura, tiempo, tipo de solvente y cantidad de catalizador) en la isomerización del epóxido de α-pineno para la obtención de aldehído canfolénico con el catalizador Cu/MCM-41, que no había sido reportado previamente para este tipo de reacción. Se partió de un diseño experimental central compuesto mediante análisis de superficie de respuesta. Se encontró que la mejor selectividad fue de 85% (5 mg de catalizador; 70 °C; 0,5 h y el uso de acetato de etilo como solvente). Adicionalmente, se determinaron los principales factores y sus combinaciones que tenían mayor significancia en la síntesis del aldehído ajustado a un modelo polinomial de segundo grado. Se encontró que los factores que tienen mayor influencia en la conversión son la cantidad de catalizador, tiempo de reacción, el tipo de solvente y el factor combinado entre la cantidad de catalizador y el tipo de solvente. En el caso de la selectividad hacia el producto deseado no se encontró ningún factor significativo.
The Cu/MCM-41 catalyst was synthesized by incipient wet impregnation and characterized by XRD, XPS, TPD-NH3, and N2 adsorption-desorption. The effect of different reaction conditions (temperature, time, type of solvent, and amount of catalyst) on the isomerization reaction of α-pinene epoxide was evaluated to obtain camphoric aldehyde with the Cu/MCM-41 catalyst, which had not been previously reported for this kind of reaction. The experiment was based on a central composite experimental design composed by response surface analysis. The best campholenic aldehyde selectivity was found to be 85% (5 mg of catalyst, 70 °C, 0.5 h and the use of ethyl acetate as a solvent). Furthermore, the main factors and their combinations that had the greatest significance in the synthesis were adjusted to a polynomial second order model. The factors with the main influence on conversion were the catalyst amount, reaction time, solvent type, and the combined factor between catalyst amount and the solvent type. In the case of campholenic aldehyde selectivity no significant factor was found.
O catalisador Cu/MCM-41, sintetizado pelo método de impregnação a umidade incipiente, foi caracterizado por DRX, XPS, TPD-NH3 e adsorção-dessorção de N2 e testado na reação de isomerização do epóxido de α-pineno. Diferentes condições de reação foram exploradas a partir de um desenho experimental central composto. A melhor seletividade de aldeído camfolênico encontrada foi de 85% (5 mg de catalisador; 70 ° C; 0,5 h e acetato de etilo como solvente). Além disso, os principais fatores e as combinações entre eles que tiveram influência na síntese do aldeído camfolênico foram ajustados a um modelo polinomial de segunda ordem. Verificou-se que os fatores com a principal influência na conversão foram a quantidade de catalisador, o tempo de reação e o tipo de solvente e o fator combinado entre a quantidade de catalisador e o tipo de solvente. No caso da seletividade do aldeído camfolênico, não foi encontrado um fator significativo.

Química Orgánica y Bioquímica
Optimización de la síntesis de aldehído canfolénico a partir del epóxido de α-pineno con Cu/MCM-41
Optimization of the synthesis of campholenic aldehyde from α-pinene epoxide with Cu/MCM-41
Optimização da síntese de aldeído camfolênico desde epóxido de α -pineno com Cu/MCM-41
Optimización de la síntesis de aldehído canfolénico a partir del epóxido de α-pineno con Cu/MCM-41
Revista Colombiana de Química, vol. 47, núm. 3, 2018
Universidad Nacional de Colombia
Resumen: Se sintetizó el catalizador Cu/MCM-41 mediante impregnación húmeda incipiente y se caracterizó por DRX, XPS, TPD-NH3 y adsorción-desorción de N2. Se evaluó el efecto de diferentes condiciones de reacción (temperatura, tiempo, tipo de solvente y cantidad de catalizador) en la isomerización del epóxido de α-pineno para la obtención de aldehído canfolénico con el catalizador Cu/MCM-41, que no había sido reportado previamente para este tipo de reacción. Se partió de un diseño experimental central compuesto mediante análisis de superficie de respuesta. Se encontró que la mejor selectividad fue de 85% (5 mg de catalizador; 70 °C; 0,5 h y el uso de acetato de etilo como solvente). Adicionalmente, se determinaron los principales factores y sus combinaciones que tenían mayor significancia en la síntesis del aldehído ajustado a un modelo polinomial de segundo grado. Se encontró que los factores que tienen mayor influencia en la conversión son la cantidad de catalizador, tiempo de reacción, el tipo de solvente y el factor combinado entre la cantidad de catalizador y el tipo de solvente. En el caso de la selectividad hacia el producto deseado no se encontró ningún factor significativo.
Palabras clave: diseño de experimentos, isomerización, aldehído canfolénico, epóxido.
Abstract: The Cu/MCM-41 catalyst was synthesized by incipient wet impregnation and characterized by XRD, XPS, TPD-NH3, and N2 adsorption-desorption. The effect of different reaction conditions (temperature, time, type of solvent, and amount of catalyst) on the isomerization reaction of α-pinene epoxide was evaluated to obtain camphoric aldehyde with the Cu/MCM-41 catalyst, which had not been previously reported for this kind of reaction. The experiment was based on a central composite experimental design composed by response surface analysis. The best campholenic aldehyde selectivity was found to be 85% (5 mg of catalyst, 70 °C, 0.5 h and the use of ethyl acetate as a solvent). Furthermore, the main factors and their combinations that had the greatest significance in the synthesis were adjusted to a polynomial second order model. The factors with the main influence on conversion were the catalyst amount, reaction time, solvent type, and the combined factor between catalyst amount and the solvent type. In the case of campholenic aldehyde selectivity no significant factor was found.
Keywords: experiment design, isomerization, campholenic aldehyde, epoxide.
Resumo: O catalisador Cu/MCM-41, sintetizado pelo método de impregnação a umidade incipiente, foi caracterizado por DRX, XPS, TPD-NH3 e adsorção-dessorção de N2 e testado na reação de isomerização do epóxido de α-pineno. Diferentes condições de reação foram exploradas a partir de um desenho experimental central composto. A melhor seletividade de aldeído camfolênico encontrada foi de 85% (5 mg de catalisador; 70 ° C; 0,5 h e acetato de etilo como solvente). Além disso, os principais fatores e as combinações entre eles que tiveram influência na síntese do aldeído camfolênico foram ajustados a um modelo polinomial de segunda ordem. Verificou-se que os fatores com a principal influência na conversão foram a quantidade de catalisador, o tempo de reação e o tipo de solvente e o fator combinado entre a quantidade de catalisador e o tipo de solvente. No caso da seletividade do aldeído camfolênico, não foi encontrado um fator significativo.
Palavras-chave: desenho de experimentos, isomerização, aldeído camfolênico, epóxido.
Introducción
De la isomerización de epóxidos de monoterpenos se obtienen productos de alto valor agregado, por ejemplo, de la isomerización del epóxido de β-pineno se obtienen alcohol perílico y mirtanal cuya aplicación se extiende incluso al tratamiento de enfermedades como el cáncer de próstata o el Alzheimer [1, 2]. El α-pineno, monoterpeno extraído del aceite de trementina [3], se puede epoxidar mediante sistemas catalíticos como complejos de metil-trioxorenio [4], ftalocianinas encapsuladas en sílica [5], nanopartículas de Au-Cu, Au-Co y Au-Ru [6], así como a través de materiales mesoporosos como la MCM-41 con Ti usando H2O2 como agente oxidante [4-7]. El epóxido de α-pineno 1 puede isomerizarse en productos termodinámicamente más estables como el aldehído canfolénico 2, pinocanfona, trans-carveol 3, pinocarveol 4, entre otros (Figura 1). El interés en la reacción de apertura o isomerización de 1 se ha centrado en la síntesis de 2 por su amplia aplicación en la industria de fragancias [8].
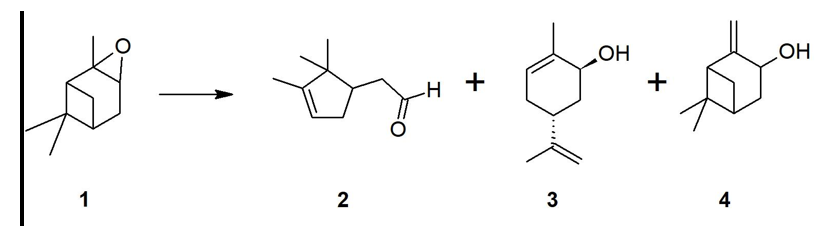
Figura 1. Isomerización del epóxido de α-pineno 1: aldehído canfolénico 2, trans-carveol 3 y pinocarveol 4.
Del mismo modo, se han reportado diferentes catalizadores homogéneos para la isomerización de 1 como el ZnCl2 y ZnBr2 de los cuales se obtuvieron como resultados 100% de conversión y selectividades mayores al 80% hacia 2 en la reacción de apertura de anillo de 1 [9]. Sin embargo, debido a la contaminación generada por el Zn y la compleja separación del catalizador en fase homogénea del medio de reacción, se han preferido diferentes catalizadores heterogéneos [10]. En este sentido, sílicas mesoporosas, modificadas con Fe como MMM-2 y VSB-5, han sido evaluadas para esta isomerización con resultados de conversiones del 95 y 97% y selectividades hacia 2 del 67 y 53%, respectivamente [10]. El uso de MCM-41, zeolitas (ZSM5 y beta-75), sílica y alúmina usando Fe como metal permitió encontrar que el material más activo para la obtención de 2 fue Fe-MCM-41 con una conversión del 100% y selectividad del 66% [11]. Este hecho se ha evidenciado principalmente por el tipo de acidez Lewis presente en el material: con un alto contenido de ácido Brönsted y solventes ligeramente polares como la acetona, y el acetato de etilo, se favorece la formación de 3, mientras que 2 es obtenido bajo solventes apolares (como el tolueno) y presencia de acidez tipo Lewis (Figura 2).
El mecanismo de reacción se ha explicado con la formación de un carbocatión como intermedio que se estabiliza bajo solventes polares y genera la ruptura de la tensión estérica generada por el compuesto bicíclico para producir posteriormente compuestos termodinámicamente más estables como 2 y 3.
![Figura 2. Formación de aldehído canfolénico 2 o trans-carveol
3 usando un medio ácido tipo Lewis o
básico tipo Brönsted. El primer paso y determinante de la reacción es la
formación del carbocatión intermedio. LA = ácido de Lewis; H+ = ácido
de Brönsted. Modificado de [10-11].](https://revistas.unal.edu.co/index.php/rcolquim/article/download/72129/version/57364/68963/408544/309057412002_gf3.png)
Figura 2. Formación de aldehído canfolénico 2 o trans-carveol 3 usando un medio ácido tipo Lewis o básico tipo Brönsted. El primer paso y determinante de la reacción es la formación del carbocatión intermedio. LA = ácido de Lewis; H+ = ácido de Brönsted. Modificado de [10-11].
Se han evaluado otros sistemas como Ce y Sn soportados en sílica en la isomerización de 1. En este caso 3 y trans-sobrerol fueron obtenidos bajo condiciones básicas usando dimetilacetamida, sin embargo, se detectó lixiviación del metal [12]. Usando SnCl2 como catalizador, la máxima conversión reportada fue del 100% y 70% de selectividad hacia 3 (0,5 h; 0,8 mmol de substrato; dimetilacetamida; 140 °C), mientras que con CeCl3 se reportó 100% de conversión y 42% de selectividad hacia el mismo producto (2 h; 0,8 mmol de substrato; dimetilacetamida y 140 °C) [12]. Adicionalmente, diferentes ácidos Lewis como FeCl3, ZnCl2 y H3BO3 soportados en SiO2 y TiO2 fueron evaluados para el re-arreglo de 1, obteniéndose principalmente 2 con una selectividad del 68% a una velocidad de 56x102 min-1 g-1cat (70 °C, ciclohexano como solvente, 300 mg de catalizador y 12 mM de 1) [13]. De la evaluación de compuestos organometálicos (Al, Fe y Cr) en la reacción de isomerización de 1, se obtuvo en el caso de Al3+ conversión del epóxido cercana al 100% y selectividad hacia 2 del 61%, mientras que para Fe se obtuvo selectividad hacia el mismo producto del 56% y, en el caso del Cr, 51% de selectividad (25 mmol de 1, dicloroetano como solvente, 5 mg de catalizador, 30 °C y 30 min) [14]. Con sistemas organometálicos similares (benzenotricarboxilatos) con Cu y usando 1,2-dicloroetano como solvente, se obtuvo 100% de conversión y 84% de selectividad hacia 2 (0,1 g de catalizador; temperatura ambiente; 0,1 g de 1 en 5 mL del solvente) [15].
Aunque se han reportado diferentes sistemas con metales como Fe, Cr, Co y Sn, el Cu soportado no ha sido estudiado detalladamente en sistemas mesoporosos para esta reacción particular. Estructuras metal-orgánicas (Cu-MOF) han sido utilizadas para la apertura de diferentes epóxidos con anilina y alcoholes a temperatura ambiente bajo condiciones libres de solventes [16]. En la reacción del epóxido de estireno con metanol para la producción del respectivo éster con Cu-MOF se reportó 98% de conversión y 99% de selectividad al respectivo producto (2-metoxi-2-fenil etanol). Con el catalizador homogéneo Cu(NO3)2 (10% mol) se obtuvieron conversiones mayores al 90% en la acidólisis en agua de ácidos del tipo α,β-epoxicarboxílicos a 30 °C [17]. En esta investigación se sintetizó el soporte MCM-41 y se modificó con Cu (mediante impregnación húmeda incipiente). Este sistema se evaluó en la reacción de isomerización de 1 usando diferentes condiciones de reacción (temperatura, cantidad de catalizador, tipo de solvente y tiempo) con un diseño central compuesto. Adicionalmente, mediante un análisis de superficie de respuesta se determinaron las condiciones óptimas de conversión de 1 y selectividad hacia 2.
Materiales y métodos
Síntesis de MCM-41 y Cu/MCM-41
Se sintetizó MCM-41 de acuerdo con lo reportado por Grün [18]. En una síntesis típica, 13,3474 g de bromuro de hexadeciltrimetilamonio (Aldrich, 97%) se agregaron a 60 mL de NH4OH (Merck, 25%) y 720 mL de agua desionizada, bajo agitación constante durante 1 h hasta total disolución. Posteriormente, se añadieron 60 g de TEOS (tetraetilortosilicato, Aldrich, 98%) bajo atmósfera inerte y agitación (100 rpm). El sólido obtenido se lavó dos veces con agua desionizada y posteriormente se secó por 24 h a 100 °C. Finalmente, se calcinó a 550 °C por 5 h (a una velocidad de 1 °C/min); el sólido blanco obtenido fue denominado MCM-41. La modificación con Cu fue realizada por impregnación húmeda incipiente. Para ello, 2,7 mL de solución (0,057 g/mL) de la sal precursora (Cu(NO3)2, Aldrich 99,5%) se adicionaron gota a gota sobre el soporte (MCM-41), agitando magnéticamente por 1 h. Posteriormente, el material se secó a 100 °C por 8 h y se calcinó a 550 °C por 4 h a una velocidad de 4 °C/min.
Caracterización de los materiales
Los materiales fueron caracterizados por DRX, XPS, TPD-NH3, espectroscopia Raman y adsorción-desorción de N2. Los patrones de DRX fueron tomados en un difractómetro de polvo marca Bruker modelo D8 ADVANCE con geometría Da Vinci, bajo las siguientes condiciones de operación: voltaje de 40 kV, corriente de 40 mA con una rendija de divergencia de 0,6 mm, así como rendijas de soller primario y secundario a 2,5 °. El muestreo se realizó cada 0,02035 ° (2θ) con radiación Cu Kα1 y filtro de níquel. El detector usado fue lineal Lynx-Eye con un barrido de 4 pasos y un tiempo de muestreo cada 0,6 s.
Los espectros Raman se adquirieron con un espectrómetro raman confocal marca Horiba Jobin Yvon, modelo LabRAM de alta resolución. Se usó una distancia confocal de 800 mm, tamaño para las manchas de laser entre 1 a 300 nm, detector CCD con resolución de 1024 x 256 pixeles, con una rendija de difracción de 1800 y 600 líneas/nm, resolución espectral de 0,3 cm-1 a 600 nm con 1800 lineas/mm, resolución espectral de un micrómetro lateral y dos micrómetros axial con excitación de 600 nm, láser de He/Ne de 633 nm de 17 mW y un láser de diodo de 785 nm a 80 mW.
Los análisis de adsorción-desorción de N2 fueron realizados en un equipo Micromeritics AutoChem II 2920. Para ello, las muestras se desgasificaron antes del tratamiento a 250 °C durante 30 min a una velocidad de calentamiento de 10 °C/min y un flujo de 25 mL/min de 30% de N2 en He. El área superficial se determinó con el análisis de un punto con N2 a 77 K. Para los análisis TPD-NH3, las muestras se trataron a 400 °C por 50 min con un flujo continuo de He (80 mL/min) antes de la desorción de NH3. La desorción fue llevada a cabo hasta 700 °C con una velocidad de 10 °C/min.
El contenido metálico se determinó mediante espectroscopia de absorción atómica; 50 mg de catalizador se disolvieron en ácido clorhídrico y nítrico, y posteriormente se trató en calentamiento. El sobrenadante fue tratado con ácido sulfúrico y los filtrados fueron analizados en equipo de absorción atómica marca Philips modelo PU9100X.
Los espectros XPS fueron obtenidos en un espectrómetro fotoelectrónico de rayos X (NAP-XPS) marca Specs con un analizador PHOIBOS 150 1D-DLD, usando una fuente monocromática de Al-Ka (1486,7 eV; 13 kV; 50 W para el espectro general y 100 W para el espectro de alta resolución) con energía de paso de 100 eV para el espectro general y 50 eV para el espectro de alta resolución. Adicionalmente, se usó el sistema de compensación de carga (Flood Gun) con una energía de 10 eV en todas las muestras.
Metodología computacional
La optimización de la estructura (geometría más estable) del epóxido de α-pineno se realizó utilizando la teoría de los funcionales de la densidad (DFT) con el funcional híbrido B3YLP y una base electrónica 6-31G con el programa Gaussian G09. Lo anterior se realizó con el objetivo de determinar las distancias de enlaces y el tamaño molecular asociado.
Actividad catalítica
La actividad catalítica y la optimización de la conversión de 1 y selectividad a 2 se evaluaron usando diferentes condiciones de reacción según lo establecido en un diseño central compuesto con cuatro factores y tres niveles (Tabla 1). Para ello se seleccionaron como factores del diseño experimental la cantidad de catalizador, temperatura, tiempo de reacción y el tipo de solvente (factor categórico que fue cuantificado usando el valor de la constante dieléctrica, ε). La cantidad de catalizador se varió entre 5 y 25 mg, la temperatura entre 50 y 70 °C, el tiempo entre 0,5 y 2,5 h. Los tipos de solventes evaluados fueron: etanol (ε = 24), acetato de etilo (ε = 6) y tolueno (ε = 2,4). Las temperaturas seleccionadas fueron menores a los puntos de ebullición de los solventes. Los demás parámetros se escogieron teniendo en cuenta un diseño experimental realizado de manera aleatoria.
Las reacciones se realizaron en viales de 2 mL usando una solución 0,25 M (en el solvente correspondiente) de 1, una velocidad de agitación de 750 rpm y catalizador con tamaño de partícula menor a 90 μm para eliminar los problemas de transferencia de masa externa e interna. El seguimiento de los productos de la reacción fue realizado utilizando cromatografía de gases acoplado a un espectrómetro de masas (CG-MS, Agilent 7890A) con una columna DB-WAX (10 m x 0,05 mm x 0,20 μm) y condiciones estándares para el análisis (usando He como gas de arrastre; la temperatura del horno se mantuvo a 70 °C por 3 min y luego se aumentó a 10 °C/min hasta 180 °C, temperatura a la cual permaneció por 1 min). La conversión y selectividad fue calculada según las ecs. (1) y (2), respectivamente:
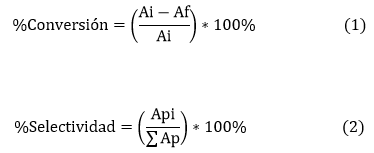
Donde Ai y Af son las áreas iniciales y finales de 1, respectivamente. Api corresponde al área del producto de interés y el denominador en la ecuación (2) corresponde a la suma de todas las áreas de los productos detectados por el cromatógrafo de gases. El tratamiento estadístico y la modelación usando una superficie de respuesta fue analizado usando el paquete Statgraphics®. Los datos experimentales se ajustaron a una ecuación polinómica de segundo grado.
| Corrida | Cantidad de catalizador (mg), x1 | Temperatura (°C), x2 | Tiempo (h), x3 | Tipo de solvente (ε, a.u), x4 | x1 | x2 | x3 | 4 |
| Factores | Codificación de las variables | |||||||
| 1 | 5 | 50 | 2,5 | 6 | -1 | -1 | 1 | 0 |
| 2 | 5 | 50 | 0,5 | 24 | -1 | -1 | -1 | 1 |
| 3 | 15 | 60 | 2,5 | 2,4 | 0 | 0 | 1 | -1 |
| 4 | 5 | 70 | 2,5 | 24 | -1 | 1 | 1 | 1 |
| 5 | 5 | 70 | 0,5 | 6 | -1 | 1 | -1 | 0 |
| 6 | 15 | 50 | 1,5 | 2,4 | 0 | -1 | 0 | -1 |
| 7 | 15 | 60 | 1,5 | 2,4 | 0 | 0 | 0 | -1 |
| 8 | 25 | 50 | 2,5 | 6 | 1 | -1 | 1 | 0 |
| 9 | 5 | 70 | 0,5 | 24 | -1 | 1 | -1 | 1 |
| 10 | 25 | 70 | 2,5 | 24 | 1 | 1 | 1 | 1 |
| 11 | 25 | 70 | 2,5 | 6 | 1 | 1 | 1 | 0 |
| 12 | 15 | 60 | 1,5 | 2,4 | 0 | 0 | 0 | -1 |
| 13 | 25 | 70 | 0,5 | 6 | 1 | 1 | -1 | 0 |
| 14 | 15 | 70 | 1,5 | 2,4 | 0 | 1 | 0 | -1 |
| 15 | 25 | 50 | 0,5 | 6 | 1 | -1 | -1 | 0 |
| 16 | 5 | 50 | 0,5 | 6 | -1 | -1 | -1 | 0 |
| 17 | 15 | 60 | 0,5 | 2,4 | 0 | 0 | -1 | -1 |
| 18 | 25 | 50 | 2,5 | 24 | 1 | -1 | 1 | 1 |
| 19 | 25 | 60 | 1,5 | 2,4 | 1 | 0 | 0 | -1 |
| 20 | 5 | 60 | 1,5 | 2,4 | -1 | 0 | 0 | -1 |
| 21 | 15 | 60 | 1,5 | 24 | 0 | 0 | 0 | 1 |
| 22 | 25 | 50 | 0,5 | 24 | 1 | -1 | -1 | 1 |
| 23 | 5 | 70 | 2,5 | 6 | -1 | 1 | 1 | 0 |
| 24 | 25 | 70 | 0,5 | 24 | 1 | 1 | -1 | 1 |
| 25 | 15 | 60 | 1,5 | 6 | 0 | 0 | 0 | 0 |
| 26 | 5 | 50 | 2,5 | 24 | -1 | -1 | 1 | 1 |
Resultados y discusión
Caracterización del catalizador
Los difractogramas obtenidos antes y después de la incorporación de Cu se presentan en la Figura 3. En el caso del patrón de DRX de la MCM-41 sin modificar presenta tres picos característicos asociados a los índices (1 0 0), (1 1 0) y (2 1 0) (PDF 00-049-1711) en las posiciones 2θ = 2,8°; 4,8° y 5,5°; estas señales indican un orden hexagonal mesoporoso típico en este tipo de material [19]. Usando la reflexión de mayor intensidad que corresponde al pico mejor definido (asociado con el plano (1 0 0)), es posible estimar el tamaño de partícula del cristal formado utilizando la ecuación de Scherrer, ec. (3) [20]:

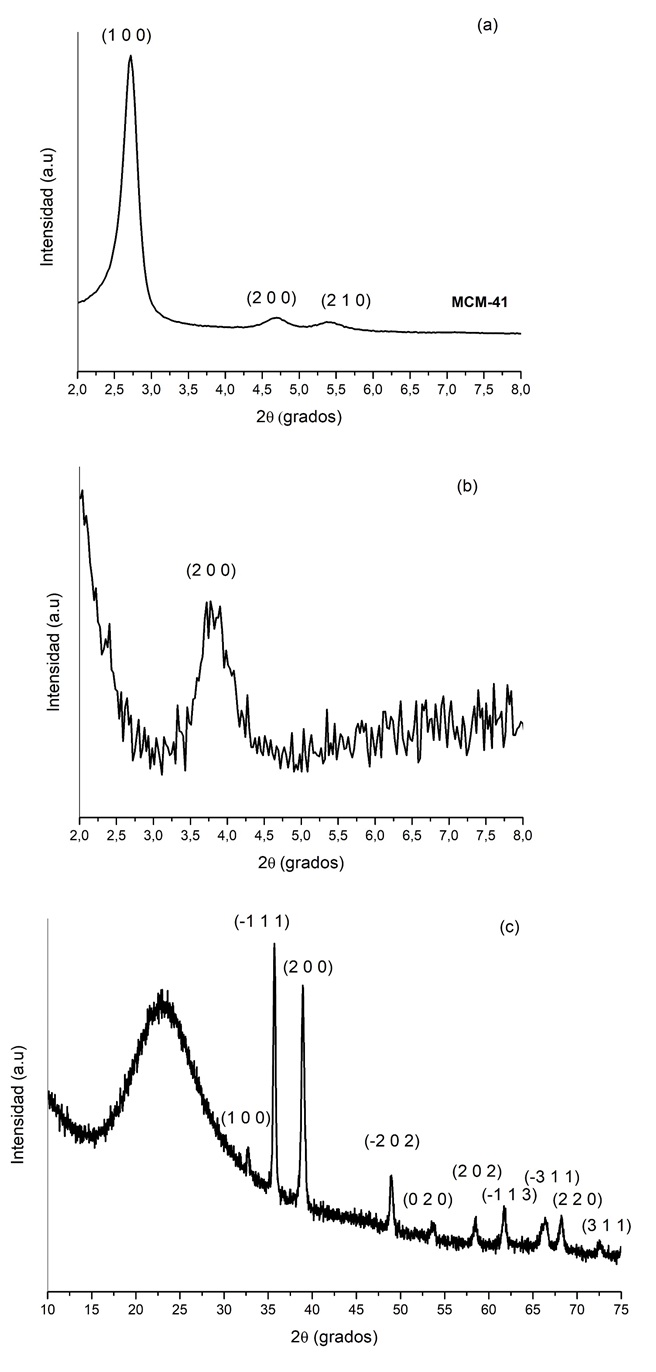
Donde λ corresponde a la longitud de onda utilizada en el experimento (0,1541 nm), d es la distancia en el pico a la mitad de la altura, y θ el ángulo en radianes del pico. El tamaño del cristal asociado al dominio cristalino (1 0 0) del soporte (MCM-41) calculado con la ec. (3) fue de 0,48 nm. En el caso del material modificado con Cu (Figura 3(a)), el pico asociado al plano (1 0 0) de la MCM-41 disminuye considerablemente y desaparece totalmente el pico asociado al plano (2 1 0). Adicionalmente, en el caso del plano (2 0 0) se observa un corrimiento con respecto al material sin modificar, esto puede estar asociado a la pérdida del arreglo ordenado, característico en este tipo de materiales [21]. En el caso de Cu/MCM-41 (Figura 3 (b)), se observan las señales características del CuO (PDF 00-005-0661) a los siguientes ángulos (ángulos altos) (2θ) = 32,6; 35,5; 38,9; 48,7; 53,41; 58,31; 61,6; 66,2; 68,1; 72,4º relacionados respectivamente con los planos (1 1 0), (-1 1 1), (2 0 0), (-2 0 2), (0 2 0), (2 0 2), (-1 1 3), (-3 1 1), (2 2 0) y (3 1 1).
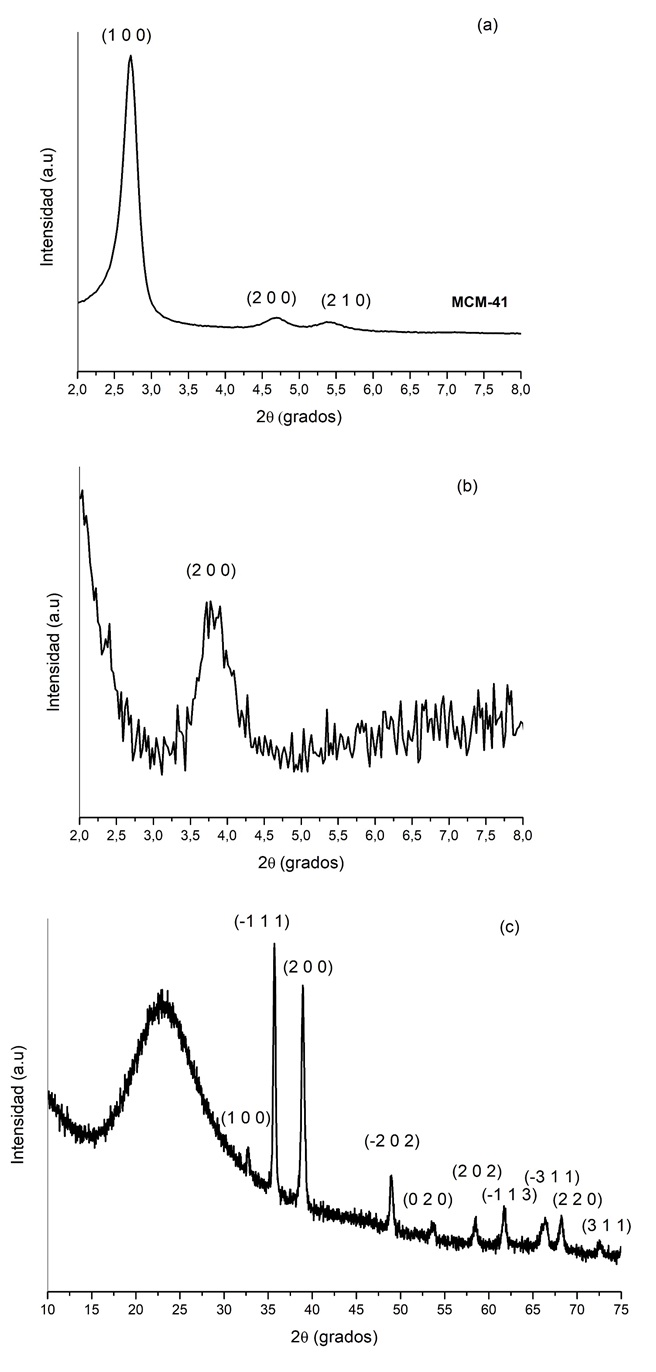
Figura 3. Patrón DRX de MCM-41 (a) y Cu/MCM-41 a ángulos bajos (b) y Cu/MCM-41 a ángulos altos (c).
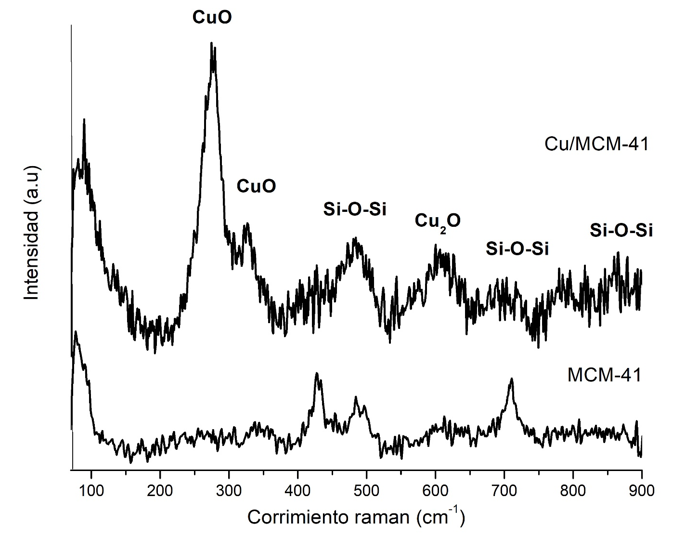
En el espectro Raman (Figura 4) se observan los picos característicos de la MCM-41 a 440, 595, 710 y 982 cm-1 relacionados con las vibraciones simétricas y asimétricas del enlace Si-O-Si, que está directamente asociado con los defectos de red como los grupos silanoles superficiales [22]. En el caso de la modificación con Cu, se observa la pérdida de la señal asociada a la vibración simétrica del enlace Si-O-Si en 440 cm-1, lo cual puede verificar la presencia del metal en la red del material. Sin embargo, las señales típicas en 296 y 346 cm-1, relacionadas con la formación de CuO, y una señal en 623 cm-1, asociada con la formación de una menor fase de Cu2O, evidencian la presencia de Cu sobre la superficie de la MCM-41 [23].
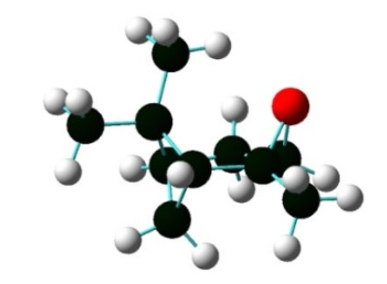
Las propiedades texturales y el análisis de acidez de los materiales MCM-41 y Cu/MCM-41 se presentan en la Tabla 2. Se observa que la incorporación de Cu en el soporte disminuye considerablemente el área superficial del material y el volumen del poro disponible para la reacción. Como el diámetro cinético del sustrato (6,9356 Å), estimado usando la optimización de la estructura con Gaussian G09 (B3YLP/6-31G; Figura 5), es menor al volumen de los poros del catalizador, se asumiría que la reacción de isomerización ocurrirá sobre la superficie y dentro de los poros del material (el diámetro cinético se encuentra dentro del orden de microporosidad).
| Material | Volumen de poro (m3/g) | Área superficial (m2/g) | Acidez (mmol NH3/g) | % Metal* | ||
| Baja (110 °C) | Media (350 °C) | Alta (550 °C) | ||||
| MCM-41 | n.d. | 700,38 | 0,1872 | 0,4821 | 2,0542 | n.a. |
| Cu/MCM-41 | 0,1652 | 475,39 | 0,6440 | 0 | 2,7103 | 4,5 |
La impregnación con Cu aumenta considerablemente en el soporte la acidez fuerte (Tabla 2). En el caso del material sin modificar, la acidez está asociada a los grupos hidroxilos y al átomo de silicio que se encuentran en la superficie (grupos silanoles vecinales). Algo similar fue encontrado en el caso de zeolitas como ZSM-5 modificado con Cu en donde, con respecto al soporte, la incorporación de Cu generaba un aumento en la acidez fuerte y disminuía la cantidad de sitios débiles disponibles en el material [24].
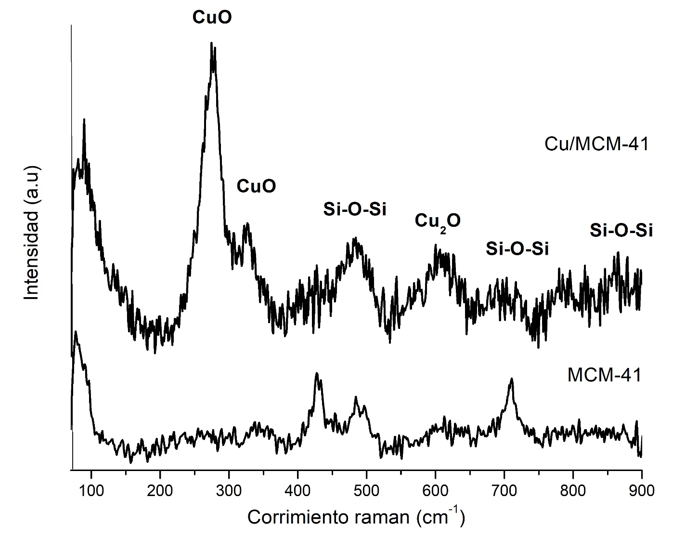
Figura 4. Espectro Raman del catalizador Cu/MCM-41 y del soporte MCM-41.
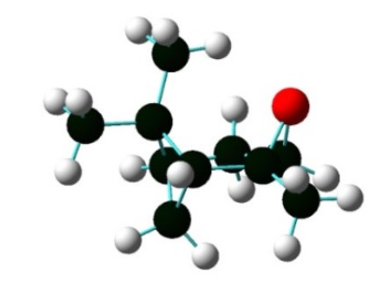
Figura 5. Estructura optimizada del óxido de α-pineno usando B3YLP/6-31G.
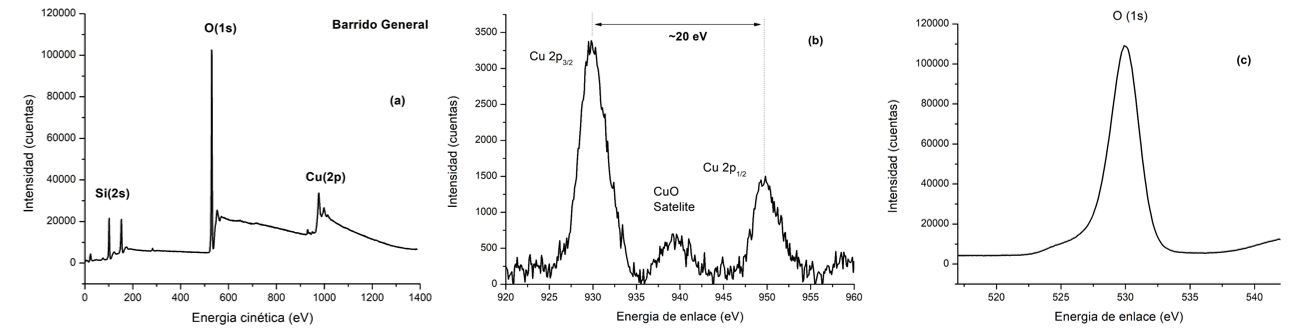
El espectro XPS del material modificado con Cu se presenta en la Figura 6. En el caso del material Cu/MCM-41 en el barrido general se observan las señales típicas del Si(2s), O(1s) y Cu(2p). Específicamente, el espectro XPS de alta resolución para el O(1s) (Figura 6(c)) en 530 eV puede estar relacionado con la presencia de O2- en la fase de CuO que fue evidenciado en los análisis de difracción de rayos X, pero también a una pequeña cantidad de Cu2O, dado que este último tiene una posición alrededor de 530,4 eV [25-26]. En el caso del espectro de alta resolución del Cu (2p) (Figura 6(b)) se observan dos señales típicas asociadas con los estados Cu 2p3/2 y Cu 2p1/2 típicos del CuO, lo cual es evidente con la presencia de la señal satélite y la separación de los dos estados alrededor de 20 eV. Adicionalmente, la separación entre cada estado del Cu(2p) al pico satélite está alrededor de 10 eV lo cual verifica la presencia de CuO [27-30].
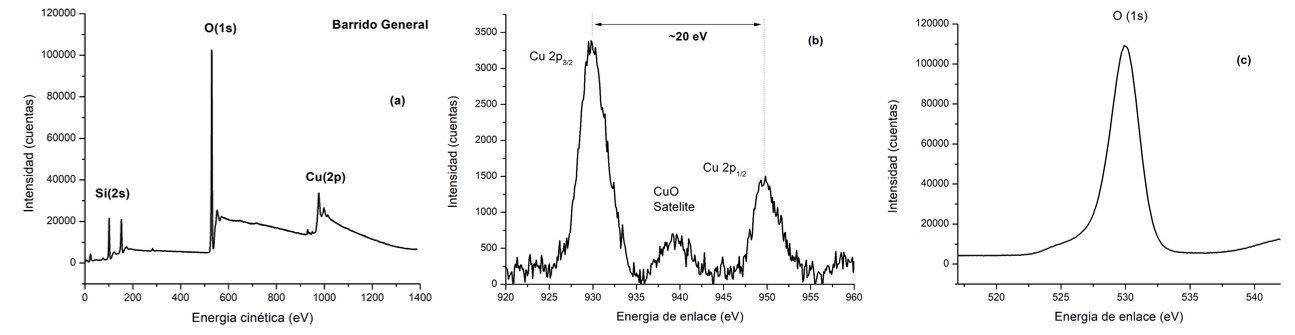
Figura 6. Espectros XPS: Barrido general (a) y de alta resolución para Cu (2p) (b) y O (1s) (c).
Análisis del diseño experimental y superficie de respuesta
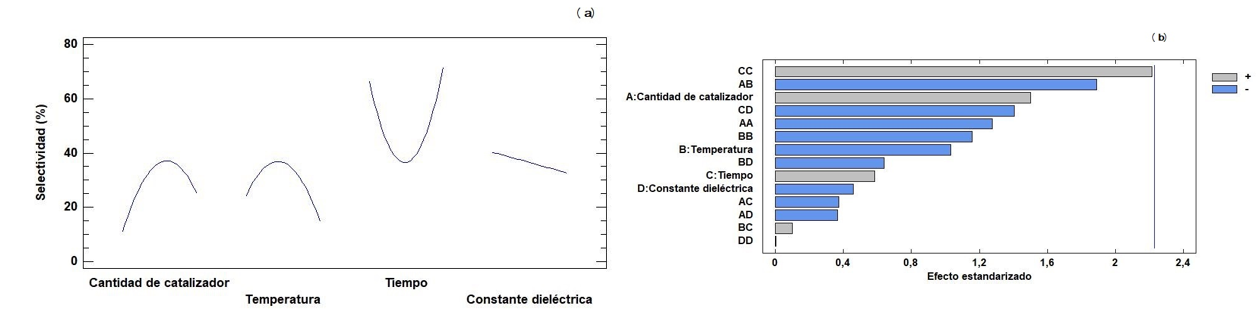
En esta sección se describe la aplicación del diseño experimental central compuesto a los factores que afectan la isomerización de 1. Reportes previos han permitido concluir que la cantidad de catalizador, el tiempo de reacción, la temperatura, así como el uso de solventes apolares como tolueno son los factores que afectan el rendimiento de formación del compuesto 2 [11, 12, 31]. El análisis de los efectos principales y del diagrama de Pareto se muestra en la Figura 7. Con respecto a la selectividad hacia 2 con Cu/MCM-41, la gráfica de efectos principales muestra que, al aumentar la cantidad de catalizador, aumenta la selectividad hasta alrededor de 40% y, posteriormente, disminuye hasta cerca del 20%. La tendencia observada con la temperatura es similar, pero con un cambio más notorio en la selectividad. Esto es contrario al comportamiento del tiempo de reacción, en el que se encuentra el valor máximo de selectividad. Un aumento en la polaridad del solvente disminuye considerablemente la selectividad hacia 2, lo cual coincide con lo reportado previamente por Stekrova et al. [11] (tolueno, 70 °C, Fe/MCM-41), en donde el uso de solventes apolares (de menor constante dieléctrica) favorece la formación de 2, mientras que el uso de solventes polares favorece la formación de trans-carveol (ambos isómeros corresponden a los productos termodinámicamente más estables de la reacción de apertura de 1). En el diagrama de Pareto para la selectividad (Figura 7(b)) se observa que los factores que tienen un efecto positivo son la cantidad de catalizador, el tiempo de reacción y los factores combinados de temperatura y tiempo, así como el efecto de doble tiempo. En comparación con lo encontrado en la conversión, se observa que el tiempo de reacción y la cantidad de catalizador, así como los efectos combinados de temperatura y tiempo, y de cantidad de catalizador y polaridad del solvente, y efectos dobles de constante dieléctrica, tiempo y temperatura son los que presentan el mayor efecto en la conversión. Entre estos factores, el mayor efecto sobre la conversión lo presenta el efecto doble de la constante dieléctrica. Solo en algunos casos se evidenció que la cantidad de catalizador y el tiempo de reacción es el que presenta el mayor efecto sobre la conversión.
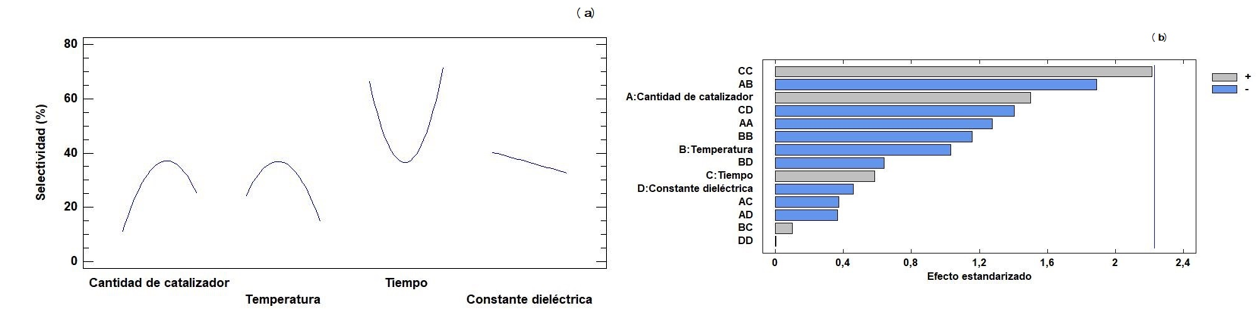
Figura 7. Efectos principales en la selectividad (a) para los diferentes factores estudiados y diagrama de Pareto para las combinaciones y efectos únicos en la selectividad (b).
El análisis ANOVA para la conversión y selectividad se muestran en las Tablas 4 y 5, respectivamente. En el caso de la selectividad, no se encontraron factores que afecten significativamente el modelo. Sin embargo, valores muy cercanos al valor estándar de P (P < 0,05) indican que el factor doble del tiempo es el que tiene más significancia. El valor de regresión para el polinomio de grado 2 ajustado para este modelo fue de 69,1251. Algo similar fue encontrado con el ANOVA realizado para la conversión: según el valor P encontrado (Tabla 5) para cada uno de los factores evaluados, ninguno tiene efecto significativo. Sin embargo, el factor doble del tiempo se encuentra muy cercano al valor P admitido (< 0,05) para ser significativo. En este caso, el valor de ajuste a un modelo polinómico de segundo grado fue 63,8241. Adicionalmente, el error total generado en la conversión es mayor que en el caso de la selectividad (7111,42 vs 3774,62; Tabla 4 y Tabla 5, respectivamente).
| Fuente | Suma de cuadrados | Gl | Cuadrado medio | Razón-F | Valor-P |
| A: Cantidad de catalizador | 849,709 | 1 | 849,709 | 2,25 | 0,1644 |
| B: Temperatura | 402,696 | 1 | 402,696 | 1,07 | 0,3260 |
| C: Tiempo | 128,273 | 1 | 128,273 | 0,34 | 0,5728 |
| D: Constante dieléctrica | 79,0863 | 1 | 79,0863 | 0,21 | 0,6569 |
| AA | 614,803 | 1 | 614,803 | 1,63 | 0,2307 |
| AB | 1349,45 | 1 | 1349,45 | 3,58 | 0,0879 |
| AC | 52,647 | 1 | 52,647 | 0,14 | 0,7166 |
| AD | 50,7399 | 1 | 50,7399 | 0,13 | 0,7215 |
| BB | 504,256 | 1 | 504,256 | 1,34 | 0,2746 |
| BC | 3,78326 | 1 | 3,78326 | 0,01 | 0,9222 |
| BD | 154,787 | 1 | 154,787 | 0,41 | 0,5363 |
| CC | 1849,41 | 1 | 1849,41 | 4,90 | 0,0513 |
| CD | 745,216 | 1 | 745,216 | 1,97 | 0,1903 |
| DD | 0,00969628 | 1 | 0,00969628 | 0,00 | 0,9961 |
| bloques | 147,46 | 1 | 147,46 | 0,39 | 0,5459 |
| Error total | 3774,62 | 10 | 377,462 | ||
| Total (corregido,) | 12225,5 | 25 |
| Fuente | Suma de Cuadrados | Gl | Cuadrado Medio | Razón-F | Valor-P |
| A:Cantidad de catalizador | 1001,7 | 1 | 1001,7 | 1,41 | 0,2627 |
| B:Temperatura | 779,556 | 1 | 779,556 | 1,10 | 0,3197 |
| C:Tiempo | 795,461 | 1 | 795,461 | 1,12 | 0,3151 |
| D:Constante dieléctrica | 210,026 | 1 | 210,026 | 0,30 | 0,5987 |
| AA | 857,794 | 1 | 857,794 | 1,21 | 0,2978 |
| AB | 95,3959 | 1 | 95,3959 | 0,13 | 0,7218 |
| AC | 160,704 | 1 | 160,704 | 0,23 | 0,6447 |
| AD | 55,8688 | 1 | 55,8688 | 0,08 | 0,7850 |
| BB | 32,9233 | 1 | 32,9233 | 0,05 | 0,8340 |
| BC | 69,7033 | 1 | 69,7033 | 0,10 | 0,7607 |
| BD | 60,3595 | 1 | 60,3595 | 0,08 | 0,7767 |
| CC | 40,9485 | 1 | 40,9485 | 0,06 | 0,8152 |
| CD | 320,44 | 1 | 320,44 | 0,45 | 0,5173 |
| DD | 2888,79 | 1 | 2888,79 | 4,06 | 0,0715 |
| Bloques | 142,856 | 1 | 142,856 | 0,20 | 0,6636 |
| Error total | 7111,42 | 10 | 711,142 | ||
| Total (corregido,) | 19657,9 | 25 |
La ecuación polinómica de segundo grado con R2 = 0,6309, obtenida para la predicción de la conversión corresponde a la ec. (4):
Conversión = 398,42 + 10,0336x1 – 12,0009x2- 31,8613x3 - 14,3230x4- 0,26574x1 2 - 0,0188x1x2 - 0,1875x1x3 + 0,0041x1x4+ 0,0943x2 2 + 0,2750x2x3 - 0,0049x2x4+ 9,9286x3 2 - 0,4086x3x4+ 0,5415x4 2 (4)
En el caso de la selectividad a aldehído canfolénico, la ecuación obtenida para este modelo de superficie de respuesta (R2 = 0,6791) corresponde a la ec. (5):
Selectividad = -439,291 + 13,4431x1 + 15,1252x2 - 108,754x3 + 1,1586x4- 0,2331x1 2 - 0,0875x1x2 - 0,025x1x3 - 0,0389x1x4- 0,1181x2 2 + 0,1125x2x3 - 0,0183x2x4+ 37,6905x32 - 0,6473x3x4+ 0,0317x4 2 (5)
La Figura 8 presenta las superficies de respuesta estimadas y obtenidas para la conversión y selectividad. Para la selectividad en función de la cantidad de catalizador y temperatura de reacción (Figura 8(a)), y cantidad de catalizador y tiempo de reacción (Figura 8(b)), se determinaron los máximos correspondientes para la obtención de 2. En la Figura 8(b) se observa una región en donde se obtiene un 100% de selectividad, justamente en la región comprendida entre 5 mg y 1 h de reacción para tolueno como solvente. Particularmente, en el caso del etanol se presenta reacción de solvólisis generado por la inducción del ion etanoato al sitio electrodeficiente del epóxido como ha sido previamente reportado en epóxidos cíclicos como el epóxido de estireno [32].
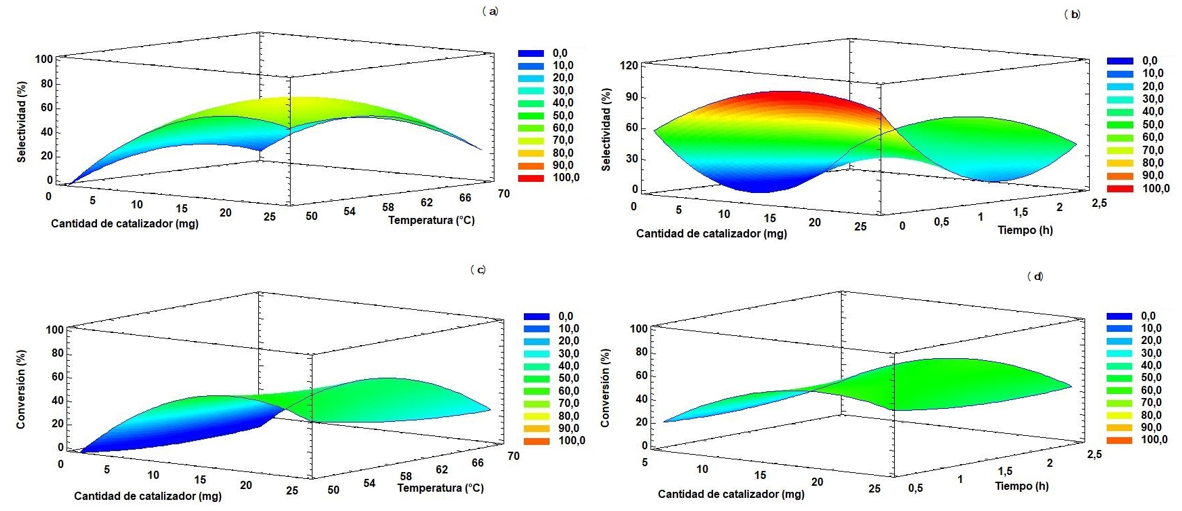
Figura 8. Superficies de respuesta estimadas para la selectividad hacia aldehído canfolénico y conversión de epóxido de α-pineno: (a) selectividad en función de la cantidad de catalizador y temperatura, (b) selectividad en función de la cantidad de catalizador y del tiempo, (c) conversión en función de la cantidad de catalizador y temperatura, (d) conversión en función de la cantidad de catalizador y tiempo.
En el caso de las superficies de respuesta de las Figura 8(c) y (d) no se observan regiones con el 100% de conversión. Sin embargo, durante los diferentes ensayos experimentales se determinó que con 25 mg de catalizador y 2,5 h de reacción se obtienen valores muy cercanos al 100% de conversión. Después de la obtención y aplicación de la superficie de respuesta, se obtuvieron los valores de optimización para la conversión y selectividad (Tabla 6). El valor máximo obtenido para la selectividad es cercano al 84%. Los valores de cantidad de catalizador, temperatura, tiempo y constante dieléctrica del solvente están muy cercanas al valor óptimo obtenido para la conversión. Esta predicción realizada por el modelo polinómico de segundo grado se encuentra en buen ajuste por lo establecido experimentalmente. Adicionalmente, este es el primer reporte en la literatura con catalizadores de Cu en materiales mesoporosos y la consideración del estudio de superficie de respuesta para la obtención del compuesto 2.
| Factor | Valor óptimo para obtener 83,7% de selectividad | Valor óptimo para obtener 75,4% de conversión |
| Cantidad de catalizador (mg) | 17 | 16 |
| Temperatura (°C) | 59 | 50 |
| Tiempo (h) | 2,5 | 2,5 |
| Constante dieléctrica (a.u) | 2,4 | 2,4 |
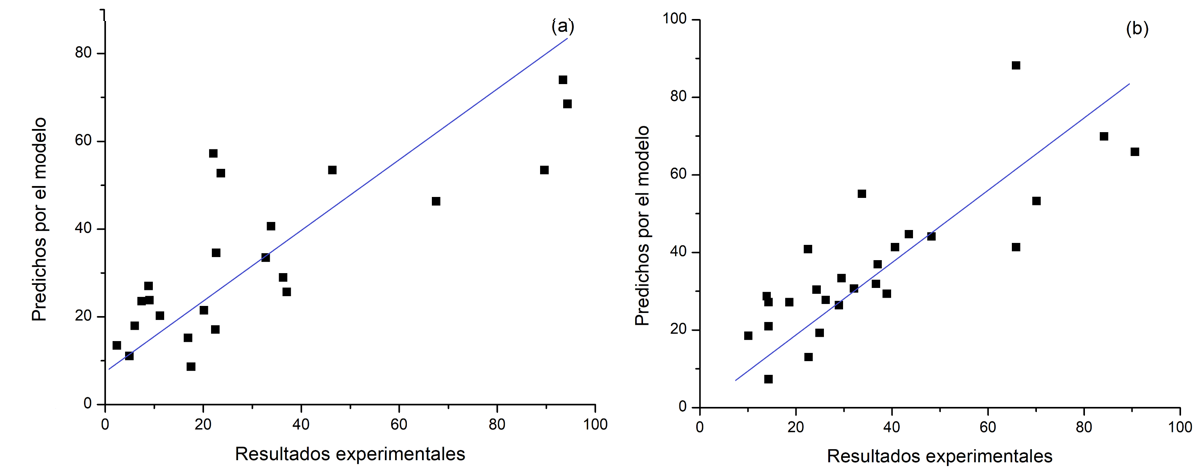
Finalmente, se observa en las Figuras 9(a y b) la correlación entre los resultados experimentales para la conversión del epóxido de α-pineno y selectividad de aldehído canfolénico con respecto a los predichos en las ecuaciones obtenidas para los modelos de superficie (Ecs. (4) y (5)). La distribución obtenida en ambos casos es dispersa respecto a la línea de 45°, aunque se observa una mejor predicción de la selectividad a aldehído canfolénico que de la conversión del epóxido α-pineno.
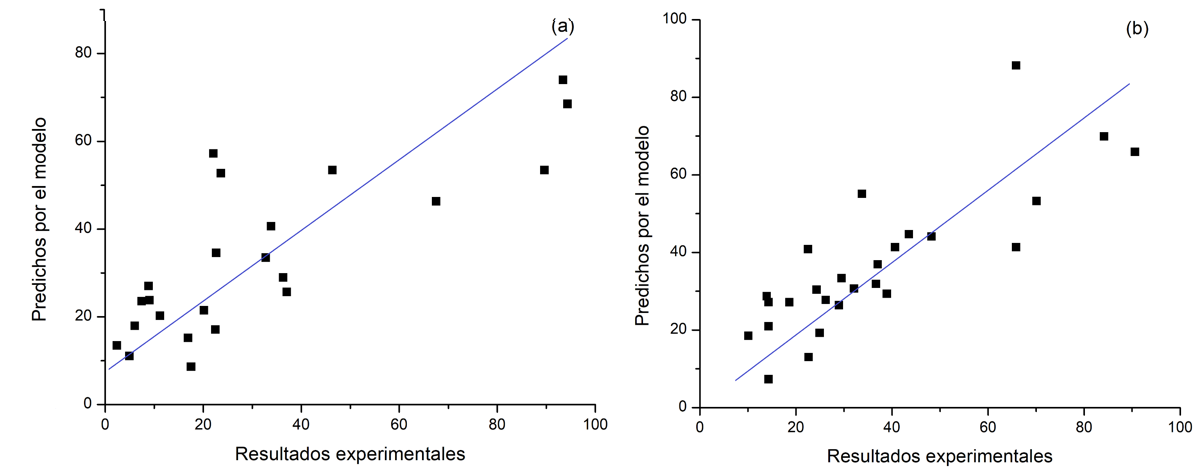
Figura 9. Correlación entre los resultados experimentales y los predichos por el modelo (representados por las ecuaciones (4) y (5)) para la conversión de epóxido de α-pineno (a) y para la selectividad a aldehído canfolénico (b).
Conclusiones
En el material obtenido por incorporación de Cu sobre la superficie del material mesoporoso MCM-41, se identificó la presencia de CuO y una baja cantidad de Cu2O, mediante DRX, XPS y espectroscopia Raman. Adicionalmente, se obtuvo un incremento en la acidez respecto al soporte. El catalizador Cu-MCM-41 se evaluó en la isomerización del epóxido de α-pineno para la obtención de aldehído canfolénico, desarrollándose un diseño experimental estadístico central compuesto en donde se encontraron las condiciones óptimas para la selectividad a aldehído canfolénico (17 mg de catalizador, 59 °C, 2,5 h de reacción, tolueno como solvente) y para la conversión (16 mg de catalizador, 50 °C, 2,5 h de reacción y tolueno como solvente) para las cuales se obtuvieron los valores máximos de conversión y selectividad de 84% y 75% (rendimiento del 63% hacia el aldehído canfolénico), respectivamente. El análisis de superficie de respuesta indicó que en ambos casos solo los factores combinados (del tiempo de reacción y tipo de solvente) son los que tienen una mayor significancia. Sin embargo, el ajuste de los datos experimentales a los modelos polinomiales de segundo grado presentó un factor de correlación (R2) de 0,6694. Los datos aquí reportados sugieren las condiciones con las cuales se puede obtener aldehído canfolénico con una alta selectividad (84%) usando el sistema catalítico Cu soportado en MCM-41.
Referencias
[1] T. Chen, C. Da Fonseca, A. Schönthal. “Preclinical development and clinical use of perillyl alcohol for chemoprevention and cancer therapy” Am. J. Cancer Res. vol. 5, pp. 1580-1593, 2015.
[2] D. Kauffmann, A. Dogra, M. Wink. “Myrtenal inhibits acetylcholinesterase, a known alzheimer target” J. Pharm. Pharmacol. vol. 63, pp. 1368-1371, 2011. DOI: https://doi.org/10.1111/j.2042-7158.2011.01344.x.
[3] H. Pakdel, S. Sarron, C. Roy. “Alpha-terpineol from hydration of crude sulfate turpentine oil” J. Agric. Food Chem. vol. 49, pp. 4337-4341, 2001. DOI: https://doi.org/10.1021/jf010341b.
[4] T. Michel, D. Betz, M. Cokoja, V. Sieber, F. Kühn. “Epoxidation of alpha-pinene catalyzed by methyltrioxorhenium (VII): Influence of additives, oxidants and solvents” J. Mol Catal. A Chem. vol. 340, pp. 9-14, 2011. DOI: https://doi.org/10.1016/j.molcata.2011.03.017.
[5] J. Becerra, L. González, A. Villa. “Kinetic study of alpha-pinene allylic oxidation over FePcCl16- NH2-SiO2 catalyst” J. Mol Catal. A Chem. vol. 423, pp. 12-21, 2016. DOI: https://doi.org/10.1016/j.molcata.2016.05.029.
[6] S. Ajaikumar, J. Ahlkvist, W. Larsson, A. Shchykarev, A. Leino, K. Kordas, J. Mikkola, Oxidation of alpha-pinene over gold containing bimetallic nanoparticles supported on reducible TiO2 by deposition- precipitation method. Appl. Catal., A. vol. 392, pp. 11-18, 2011. DOI: https://doi.org/10.1016/j.apcata.2010.10.015.
[7] S. Casuscelli, G. Eimer, A. Canepa, A. Heredia, C. Poncio, M. Crivello, C. Perez, A. Aguilar, E. Herrero. “Ti-MCM-41 as catalyst for α-pinene oxidation: Study of the effect of Ti content and H2O2 addition on activity and selectivity” Catal. Today. vol. 133-135, pp. 678-683, 2008. DOI: https://doi.org/10.1016/j.cattod.2007.12.104.
[8] P. Kunkeler, J. Van der Waal, J. Bremmer, B. Zuudeeg, R. Downing, H. Bekkum. “Application of zeolite titanium beta in the rearrangement of alpha-pinene epoxide to campholenic aldehyde” Catal. Lett. vol. 53, pp. 135-138, 1998. DOI: https://doi.org/10.1023/A:1019049704709.
[9] J. Kaminska, M. Schwegler, A. Hoefnagel, V. Bekkum. “The isomerization of alpha pinene oxide with Brönsted and Lewis acids” Recl. Trav. Chim. Pays-Bas. vol. 111, pp. 432-437, 1992. DOI: https://doi.org/10.1002/recl.19921111004.
[10] M. Timofeeva, V. Panchenko, Z. Hasan, N. Khan, M. Mel’gunov, A. Abel, M. Matrosova, K.Volcho, S. Jhung. “Effect of iron content on selectivity in isomerization of α-pinene oxide to campholenic aldehyde over Fe-MMM-2 and Fe-VSB-5” Appl. Catal., A. vol. 469, pp. 427-433, 2014. DOI: https://doi.org/10.1016/j.apcata.2013.10.016.
[11] M. Stekrova, N. Kumar, A. Aho, I. Sinev, W. Grünert, J. Dahl, J. Roine, S. Arzumanov, P. Mäki-Arvela, D. Murzin. “Isomerization of alpha-pinene oxide using Fe- supported catalysts: Selective synthesis of campholenic aldehyde” Appl. Catal., A., vol. 470, pp. 162-176, 2014. DOI: https://doi.org/10.1016/j.apcata.2013.10.044.
[12] V. Costa, K. Rocha, L. Sousa, P. Dutenhefner, E. Gusevskaya. “Isomerization of alpha- pinene oxide over cerium and tin catalysts: Selective synthesis of trans-carveol and trans-sobrerol” J. Mol Catal. A Chem. vol. 345, pp. 69-74, 2011. DOI: https://doi.org/10.1016/j.molcata.2011.05.020.
[13] G. Neri, G. Rizzo, C. Crisafulli, L. De Luca, A. Donato, M. Musolino, R. Pietropaolo. “Isomerization of alpha-pinene oxide to campholenic aldehyde over Lewis acids supported on silica and titania nanoparticles” Appl. Catal., A. vol. 295, pp. 116-125, 2005. DOI: https://doi.org/10.1016/j.apcata.2005.07.027.
[14] M. Timofeeva, V. Panchenko, A. Abel, N. Abedin, I. Ahmed, A. Ayupov, K. Volcho, S. Jhung. “Rearrangement of alpha pinene oxide to campholenic aldehyde over the trimesate metal-organic frameworks MIL-100, MIL-110, MIL-96” J. Catal. vol. 311, pp. 114-120, 2014. DOI: https://doi.org/10.1016/j.jcat.2013.11.006.
[15] L. Alaerts, E. Seguin, H. Poelman, F. Thibault-Starzyk, P. Jacobs, D. De vos. “Probing the lewis acidity and the catalytic activity of the metal-organic framework [Cu3(btc)2] (BTC=Benzene-1,3,5-tricarboxylate)” Chem. Eur. J. vol. 12, pp. 7353-7363, 2006. DOI: https://doi.org/10.1002/chem.200600220.
[16] J. Dongmei, T. Mallat, F. Krumeich, A. Baiker. “Copper-based metal-organic framework for the facile ring opening of epoxides” J. Catal. vol. 257, pp. 390-395, 2008. DOI: https://doi.org/10.1016/j.jcat.2008.05.021.
[17] D. Amantini, F. Fringuelli, O. Piermatti, S.Tortoioli, L. Vaccaro. “Nucleophilic ring opening of 1,2-epoxides in aqueous medium” Arkivoc. vol. 11, pp. 293-311, 2002. DOI: https://doi.org/10.3998/ark.5550190.0003.b26.
[18] M. Grün, K. Unger, A. Matsumoto, K. Tsutsumi. “Novel pathways for the preparation of mesoporous MCM-41 materials: control of porosity and morphology” Microporous Mater. vol. 27, pp. 207-216, 1999. DOI: https://doi.org/10.1016/S1387-1811(98)00255-8.
[19] J. Aquino, C. Souza, A. Araujo. “Synthesis and characterization of sulfate-supported MCM-41 material” Int. J. Inorg. Mater. vol. 3, pp. 467-470, 2001. DOI: https://doi.org/10.1016/S1466-6049(01)00042-3.
[20] M. Verma, V. Kumar, A. Katoch. “Sputtering based synthesis of CuO nanoparticles and their structural, thermal and optical studies” Mater. Sci. in Semicond. Process. vol. 76, pp. 55-60, 2018. DOI: https://doi.org/10.1016/j.mssp.2017.12.018.
[21] M. Salam, M. Betiha, S. Shaban, A. Elsabagh, R. El-Aal, F. Kad., “Synthesis and characterization of MCM-41supported nano zirconia” Egypt. J. Petrol. vol. 24, pp. 49-57, 2015. DOI: https://doi.org/10.1016/j.ejpe.2015.02.005.
[22] G. Zhang, J. Long, X. Wang, Z. Zhang, W. Dai, P. Liu, Z. Li, L.Wu, X. Fu. “ Catalytic role of Cu sites of Cu/MCM-41 in phenol hydroxylation” Lang. Art. Vol 26, pp. 1362-1371. DOI: https://doi.org/la902436s.
[23] Y. Deng, A. Handoko, Y. Du, S. Xi, B. Siang. “In Situ raman spectroscopy of copper and copper oxides surfaces during electrochemical oxygen evolution reaction: Identification of Cu(II) oxides as catalytically active species” ACS Catalysis. vol. 6, pp. 2473-2481. 2016. DOI: https://doi.org/10.1021/acscatal.6b00205.
[24] C. Li, J. Ma, Z. Xiao, S. Hector, R. Liu, S. Zuo, Z. Xie, A. Zhang, H. Wu, Q. Liu. “Catalytic cracking of Swida wilsoniana oil for hydrocarbon biofuel over Cu- modified ZSM-5 zeolite” Fuel. vol. 218, pp. 59-66, 2018. DOI: https://doi.org/10.1016/j.fuel.2018.01.026.
[25] C. Oruc, A. Altindal. “Structural and dielectric properties of CuO nanoparticles” Ceram. Int. vol. 43, pp. 10708-10714, 2017. DOI: https://doi.org/10.1016/j.ceramint.2017.05.006.
[26] M. Natile, A. Galenda, A. Glisenti. “CuO/CeO2 nanocomposites: an XPS study” Surf. Sci. Spectra. vol. 16, pp. 13-26, 2009. DOI: https://doi.org/10.1116/11.20061005.
[27] N. Pauly, S. Tougaard. “Primary excitation spectra in XPS and AES of Cu, CuO: Relative importance of surface and core hole effects” Surf. Sci. vol. 641, pp. 326-329, 2015. DOI: https://doi.org/10.1016/j.susc.2015.02.009.
[28] Z. Chen, B. Zhao, X. Fu, R. Sun, C. Wong. “CuO nanorods supported Pd nanoparticles as high performance electrocatalysts for glucose detection” J. Electroanal. Chem. vol. 807, pp. 220-227, 2017. DOI: https://doi.org/10.1016/j.psep.2017.05.016.
[29] C. Dong, C. Chen, C. Kao, C. Hung. “Synthesis, characterization, and application of CuO-modified TiO2 electrode exemplied for ammonia electro-oxidation” Process Saf. Environ. Prot. vol. 112, pp. 243-253, 2017. DOI: https://doi.org/10.1016/j.psep.2017.05.016.
[30] M. Gopiraman, I. Chung. “Highly active and cost-effective CuO-based nanocomposite with unique morphology for catalytic synthesis of imines under solvent-free conditions” J. Taiwan Inst. Chem. Eng. vol. 81, pp. 455-464, 2017. DOI: https://doi.org/10.1016/j.jtice.2017.08.021.
[31] Y. Woong, N. Kim, W. Ahn, H. Rhee. “Redox mesoporous molecular sieve as a bifunctional catalyst for the one-pot synthesis of campholenic aldehyde from α-pinene” J. Mol Catal. A Chem. vol. 174, pp. 249-254, 2001. DOI: https://doi.org/10.1016/S1381-1169(01)00192-3.
[32] S. Bruno, A. Gomes, T. Oliveira, M. Antunes, A. Lopes, A. Valente, I. Goncalves, M. Pillinger. “Catalytic alcoholysis of epoxides using metal-free cucurbituril-based solids” Org. Biomol. Chem. Comm. vol. 14, pp. 3873-3877, 2016. DOI: https://doi.org/10.1039/c6ob00512h.
Notas de autor
aida.villa@udea.edu.co
Resumen
Se sintetizó el catalizador Cu/MCM-41 mediante impregnación húmeda incipiente y se caracterizó por DRX, XPS, TPD-NH3 y adsorción-desorción de N2. Se evaluó el efecto de diferentes condiciones de reacción (temperatura, tiempo, tipo de solvente y cantidad de catalizador) en la isomerización del epóxido de α-pineno para la obtención de aldehído canfolénico con el catalizador Cu/MCM-41, que no había sido reportado previamente para este tipo de reacción. Se partió de un diseño experimental central compuesto mediante análisis de superficie de respuesta. Se encontró que la mejor selectividad fue de 85% (5 mg de catalizador; 70 °C; 0,5 h y el uso de acetato de etilo como solvente). Adicionalmente, se determinaron los principales factores y sus combinaciones que tenían mayor significancia en la síntesis del aldehído ajustado a un modelo polinomial de segundo grado. Se encontró que los factores que tienen mayor influencia en la conversión son la cantidad de catalizador, tiempo de reacción, el tipo de solvente y el factor combinado entre la cantidad de catalizador y el tipo de solvente. En el caso de la selectividad hacia el producto deseado no se encontró ningún factor significativo.
Palabras clave
diseño de experimentos, isomerización, aldehído canfolénico, epóxido.Abstract
The Cu/MCM-41 catalyst was synthesized by incipient wet impregnation and characterized by XRD, XPS, TPD-NH3, and N2 adsorption-desorption. The effect of different reaction conditions (temperature, time, type of solvent, and amount of catalyst) on the isomerization reaction of α-pinene epoxide was evaluated to obtain camphoric aldehyde with the Cu/MCM-41 catalyst, which had not been previously reported for this kind of reaction. The experiment was based on a central composite experimental design composed by response surface analysis. The best campholenic aldehyde selectivity was found to be 85% (5 mg of catalyst, 70 °C, 0.5 h and the use of ethyl acetate as a solvent). Furthermore, the main factors and their combinations that had the greatest significance in the synthesis were adjusted to a polynomial second order model. The factors with the main influence on conversion were the catalyst amount, reaction time, solvent type, and the combined factor between catalyst amount and the solvent type. In the case of campholenic aldehyde selectivity no significant factor was found.
Keywords
experiment design, isomerization, campholenic aldehyde, epoxide.Resumo
O catalisador Cu/MCM-41, sintetizado pelo método de impregnação a umidade incipiente, foi caracterizado por DRX, XPS, TPD-NH3 e adsorção-dessorção de N2 e testado na reação de isomerização do epóxido de α-pineno. Diferentes condições de reação foram exploradas a partir de um desenho experimental central composto. A melhor seletividade de aldeído camfolênico encontrada foi de 85% (5 mg de catalisador; 70 ° C; 0,5 h e acetato de etilo como solvente). Além disso, os principais fatores e as combinações entre eles que tiveram influência na síntese do aldeído camfolênico foram ajustados a um modelo polinomial de segunda ordem. Verificou-se que os fatores com a principal influência na conversão foram a quantidade de catalisador, o tempo de reação e o tipo de solvente e o fator combinado entre a quantidade de catalisador e o tipo de solvente. No caso da seletividade do aldeído camfolênico, não foi encontrado um fator significativo.
Palavras-chave
desenho de experimentos, isomerização, aldeído camfolênico, epóxido.Introducción
De la isomerización de epóxidos de monoterpenos se obtienen productos de alto valor agregado, por ejemplo, de la isomerización del epóxido de β-pineno se obtienen alcohol perílico y mirtanal cuya aplicación se extiende incluso al tratamiento de enfermedades como el cáncer de próstata o el Alzheimer [1, 2]. El α-pineno, monoterpeno extraído del aceite de trementina [3], se puede epoxidar mediante sistemas catalíticos como complejos de metil-trioxorenio [4], ftalocianinas encapsuladas en sílica [5], nanopartículas de Au-Cu, Au-Co y Au-Ru [6], así como a través de materiales mesoporosos como la MCM-41 con Ti usando H2O2 como agente oxidante [4-7]. El epóxido de α-pineno 1 puede isomerizarse en productos termodinámicamente más estables como el aldehído canfolénico 2, pinocanfona, trans-carveol 3, pinocarveol 4, entre otros (Figura 1). El interés en la reacción de apertura o isomerización de 1 se ha centrado en la síntesis de 2 por su amplia aplicación en la industria de fragancias [8].
Figura 1. Isomerización del epóxido de α-pineno 1: aldehído canfolénico 2, trans-carveol 3 y pinocarveol 4.
Del mismo modo, se han reportado diferentes catalizadores homogéneos para la isomerización de 1 como el ZnCl2 y ZnBr2 de los cuales se obtuvieron como resultados 100% de conversión y selectividades mayores al 80% hacia 2 en la reacción de apertura de anillo de 1 [9]. Sin embargo, debido a la contaminación generada por el Zn y la compleja separación del catalizador en fase homogénea del medio de reacción, se han preferido diferentes catalizadores heterogéneos [10]. En este sentido, sílicas mesoporosas, modificadas con Fe como MMM-2 y VSB-5, han sido evaluadas para esta isomerización con resultados de conversiones del 95 y 97% y selectividades hacia 2 del 67 y 53%, respectivamente [10]. El uso de MCM-41, zeolitas (ZSM5 y beta-75), sílica y alúmina usando Fe como metal permitió encontrar que el material más activo para la obtención de 2 fue Fe-MCM-41 con una conversión del 100% y selectividad del 66% [11]. Este hecho se ha evidenciado principalmente por el tipo de acidez Lewis presente en el material: con un alto contenido de ácido Brönsted y solventes ligeramente polares como la acetona, y el acetato de etilo, se favorece la formación de 3, mientras que 2 es obtenido bajo solventes apolares (como el tolueno) y presencia de acidez tipo Lewis (Figura 2).
El mecanismo de reacción se ha explicado con la formación de un carbocatión como intermedio que se estabiliza bajo solventes polares y genera la ruptura de la tensión estérica generada por el compuesto bicíclico para producir posteriormente compuestos termodinámicamente más estables como 2 y 3.
Figura 2. Formación de aldehído canfolénico 2 o trans-carveol 3 usando un medio ácido tipo Lewis o básico tipo Brönsted. El primer paso y determinante de la reacción es la formación del carbocatión intermedio. LA = ácido de Lewis; H+ = ácido de Brönsted. Modificado de [10-11].
Se han evaluado otros sistemas como Ce y Sn soportados en sílica en la isomerización de 1. En este caso 3 y trans-sobrerol fueron obtenidos bajo condiciones básicas usando dimetilacetamida, sin embargo, se detectó lixiviación del metal [12]. Usando SnCl2 como catalizador, la máxima conversión reportada fue del 100% y 70% de selectividad hacia 3 (0,5 h; 0,8 mmol de substrato; dimetilacetamida; 140 °C), mientras que con CeCl3 se reportó 100% de conversión y 42% de selectividad hacia el mismo producto (2 h; 0,8 mmol de substrato; dimetilacetamida y 140 °C) [12]. Adicionalmente, diferentes ácidos Lewis como FeCl3, ZnCl2 y H3BO3 soportados en SiO2 y TiO2 fueron evaluados para el re-arreglo de 1, obteniéndose principalmente 2 con una selectividad del 68% a una velocidad de 56x102 min-1 g-1cat (70 °C, ciclohexano como solvente, 300 mg de catalizador y 12 mM de 1) [13]. De la evaluación de compuestos organometálicos (Al, Fe y Cr) en la reacción de isomerización de 1, se obtuvo en el caso de Al3+ conversión del epóxido cercana al 100% y selectividad hacia 2 del 61%, mientras que para Fe se obtuvo selectividad hacia el mismo producto del 56% y, en el caso del Cr, 51% de selectividad (25 mmol de 1, dicloroetano como solvente, 5 mg de catalizador, 30 °C y 30 min) [14]. Con sistemas organometálicos similares (benzenotricarboxilatos) con Cu y usando 1,2-dicloroetano como solvente, se obtuvo 100% de conversión y 84% de selectividad hacia 2 (0,1 g de catalizador; temperatura ambiente; 0,1 g de 1 en 5 mL del solvente) [15].
Aunque se han reportado diferentes sistemas con metales como Fe, Cr, Co y Sn, el Cu soportado no ha sido estudiado detalladamente en sistemas mesoporosos para esta reacción particular. Estructuras metal-orgánicas (Cu-MOF) han sido utilizadas para la apertura de diferentes epóxidos con anilina y alcoholes a temperatura ambiente bajo condiciones libres de solventes [16]. En la reacción del epóxido de estireno con metanol para la producción del respectivo éster con Cu-MOF se reportó 98% de conversión y 99% de selectividad al respectivo producto (2-metoxi-2-fenil etanol). Con el catalizador homogéneo Cu(NO3)2 (10% mol) se obtuvieron conversiones mayores al 90% en la acidólisis en agua de ácidos del tipo α,β-epoxicarboxílicos a 30 °C [17]. En esta investigación se sintetizó el soporte MCM-41 y se modificó con Cu (mediante impregnación húmeda incipiente). Este sistema se evaluó en la reacción de isomerización de 1 usando diferentes condiciones de reacción (temperatura, cantidad de catalizador, tipo de solvente y tiempo) con un diseño central compuesto. Adicionalmente, mediante un análisis de superficie de respuesta se determinaron las condiciones óptimas de conversión de 1 y selectividad hacia 2.
Materiales y métodos
Síntesis de MCM-41 y Cu/MCM-41
Se sintetizó MCM-41 de acuerdo con lo reportado por Grün [18]. En una síntesis típica, 13,3474 g de bromuro de hexadeciltrimetilamonio (Aldrich, 97%) se agregaron a 60 mL de NH4OH (Merck, 25%) y 720 mL de agua desionizada, bajo agitación constante durante 1 h hasta total disolución. Posteriormente, se añadieron 60 g de TEOS (tetraetilortosilicato, Aldrich, 98%) bajo atmósfera inerte y agitación (100 rpm). El sólido obtenido se lavó dos veces con agua desionizada y posteriormente se secó por 24 h a 100 °C. Finalmente, se calcinó a 550 °C por 5 h (a una velocidad de 1 °C/min); el sólido blanco obtenido fue denominado MCM-41. La modificación con Cu fue realizada por impregnación húmeda incipiente. Para ello, 2,7 mL de solución (0,057 g/mL) de la sal precursora (Cu(NO3)2, Aldrich 99,5%) se adicionaron gota a gota sobre el soporte (MCM-41), agitando magnéticamente por 1 h. Posteriormente, el material se secó a 100 °C por 8 h y se calcinó a 550 °C por 4 h a una velocidad de 4 °C/min.
Caracterización de los materiales
Los materiales fueron caracterizados por DRX, XPS, TPD-NH3, espectroscopia Raman y adsorción-desorción de N2. Los patrones de DRX fueron tomados en un difractómetro de polvo marca Bruker modelo D8 ADVANCE con geometría Da Vinci, bajo las siguientes condiciones de operación: voltaje de 40 kV, corriente de 40 mA con una rendija de divergencia de 0,6 mm, así como rendijas de soller primario y secundario a 2,5 °. El muestreo se realizó cada 0,02035 ° (2θ) con radiación Cu Kα1 y filtro de níquel. El detector usado fue lineal Lynx-Eye con un barrido de 4 pasos y un tiempo de muestreo cada 0,6 s.
Los espectros Raman se adquirieron con un espectrómetro raman confocal marca Horiba Jobin Yvon, modelo LabRAM de alta resolución. Se usó una distancia confocal de 800 mm, tamaño para las manchas de laser entre 1 a 300 nm, detector CCD con resolución de 1024 x 256 pixeles, con una rendija de difracción de 1800 y 600 líneas/nm, resolución espectral de 0,3 cm-1 a 600 nm con 1800 lineas/mm, resolución espectral de un micrómetro lateral y dos micrómetros axial con excitación de 600 nm, láser de He/Ne de 633 nm de 17 mW y un láser de diodo de 785 nm a 80 mW.
Los análisis de adsorción-desorción de N2 fueron realizados en un equipo Micromeritics AutoChem II 2920. Para ello, las muestras se desgasificaron antes del tratamiento a 250 °C durante 30 min a una velocidad de calentamiento de 10 °C/min y un flujo de 25 mL/min de 30% de N2 en He. El área superficial se determinó con el análisis de un punto con N2 a 77 K. Para los análisis TPD-NH3, las muestras se trataron a 400 °C por 50 min con un flujo continuo de He (80 mL/min) antes de la desorción de NH3. La desorción fue llevada a cabo hasta 700 °C con una velocidad de 10 °C/min.
El contenido metálico se determinó mediante espectroscopia de absorción atómica; 50 mg de catalizador se disolvieron en ácido clorhídrico y nítrico, y posteriormente se trató en calentamiento. El sobrenadante fue tratado con ácido sulfúrico y los filtrados fueron analizados en equipo de absorción atómica marca Philips modelo PU9100X.
Los espectros XPS fueron obtenidos en un espectrómetro fotoelectrónico de rayos X (NAP-XPS) marca Specs con un analizador PHOIBOS 150 1D-DLD, usando una fuente monocromática de Al-Ka (1486,7 eV; 13 kV; 50 W para el espectro general y 100 W para el espectro de alta resolución) con energía de paso de 100 eV para el espectro general y 50 eV para el espectro de alta resolución. Adicionalmente, se usó el sistema de compensación de carga (Flood Gun) con una energía de 10 eV en todas las muestras.
Metodología computacional
La optimización de la estructura (geometría más estable) del epóxido de α-pineno se realizó utilizando la teoría de los funcionales de la densidad (DFT) con el funcional híbrido B3YLP y una base electrónica 6-31G con el programa Gaussian G09. Lo anterior se realizó con el objetivo de determinar las distancias de enlaces y el tamaño molecular asociado.
Actividad catalítica
La actividad catalítica y la optimización de la conversión de 1 y selectividad a 2 se evaluaron usando diferentes condiciones de reacción según lo establecido en un diseño central compuesto con cuatro factores y tres niveles (Tabla 1). Para ello se seleccionaron como factores del diseño experimental la cantidad de catalizador, temperatura, tiempo de reacción y el tipo de solvente (factor categórico que fue cuantificado usando el valor de la constante dieléctrica, ε). La cantidad de catalizador se varió entre 5 y 25 mg, la temperatura entre 50 y 70 °C, el tiempo entre 0,5 y 2,5 h. Los tipos de solventes evaluados fueron: etanol (ε = 24), acetato de etilo (ε = 6) y tolueno (ε = 2,4). Las temperaturas seleccionadas fueron menores a los puntos de ebullición de los solventes. Los demás parámetros se escogieron teniendo en cuenta un diseño experimental realizado de manera aleatoria.
Las reacciones se realizaron en viales de 2 mL usando una solución 0,25 M (en el solvente correspondiente) de 1, una velocidad de agitación de 750 rpm y catalizador con tamaño de partícula menor a 90 μm para eliminar los problemas de transferencia de masa externa e interna. El seguimiento de los productos de la reacción fue realizado utilizando cromatografía de gases acoplado a un espectrómetro de masas (CG-MS, Agilent 7890A) con una columna DB-WAX (10 m x 0,05 mm x 0,20 μm) y condiciones estándares para el análisis (usando He como gas de arrastre; la temperatura del horno se mantuvo a 70 °C por 3 min y luego se aumentó a 10 °C/min hasta 180 °C, temperatura a la cual permaneció por 1 min). La conversión y selectividad fue calculada según las ecs. (1) y (2), respectivamente:
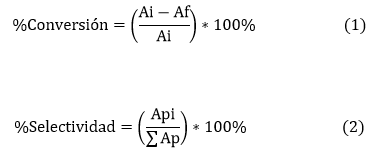
Donde Ai y Af son las áreas iniciales y finales de 1, respectivamente. Api corresponde al área del producto de interés y el denominador en la ecuación (2) corresponde a la suma de todas las áreas de los productos detectados por el cromatógrafo de gases. El tratamiento estadístico y la modelación usando una superficie de respuesta fue analizado usando el paquete Statgraphics®. Los datos experimentales se ajustaron a una ecuación polinómica de segundo grado.
Tabla 1. Diseño central compuesto: cuatro factores-tres niveles.
| Corrida | Cantidad de catalizador (mg), x1 | Temperatura (°C), x2 | Tiempo (h), x3 | Tipo de solvente (ε, a.u), x4 | x1 | x2 | x3 | 4 |
| Factores | Codificación de las variables | |||||||
| 1 | 5 | 50 | 2,5 | 6 | -1 | -1 | 1 | 0 |
| 2 | 5 | 50 | 0,5 | 24 | -1 | -1 | -1 | 1 |
| 3 | 15 | 60 | 2,5 | 2,4 | 0 | 0 | 1 | -1 |
| 4 | 5 | 70 | 2,5 | 24 | -1 | 1 | 1 | 1 |
| 5 | 5 | 70 | 0,5 | 6 | -1 | 1 | -1 | 0 |
| 6 | 15 | 50 | 1,5 | 2,4 | 0 | -1 | 0 | -1 |
| 7 | 15 | 60 | 1,5 | 2,4 | 0 | 0 | 0 | -1 |
| 8 | 25 | 50 | 2,5 | 6 | 1 | -1 | 1 | 0 |
| 9 | 5 | 70 | 0,5 | 24 | -1 | 1 | -1 | 1 |
| 10 | 25 | 70 | 2,5 | 24 | 1 | 1 | 1 | 1 |
| 11 | 25 | 70 | 2,5 | 6 | 1 | 1 | 1 | 0 |
| 12 | 15 | 60 | 1,5 | 2,4 | 0 | 0 | 0 | -1 |
| 13 | 25 | 70 | 0,5 | 6 | 1 | 1 | -1 | 0 |
| 14 | 15 | 70 | 1,5 | 2,4 | 0 | 1 | 0 | -1 |
| 15 | 25 | 50 | 0,5 | 6 | 1 | -1 | -1 | 0 |
| 16 | 5 | 50 | 0,5 | 6 | -1 | -1 | -1 | 0 |
| 17 | 15 | 60 | 0,5 | 2,4 | 0 | 0 | -1 | -1 |
| 18 | 25 | 50 | 2,5 | 24 | 1 | -1 | 1 | 1 |
| 19 | 25 | 60 | 1,5 | 2,4 | 1 | 0 | 0 | -1 |
| 20 | 5 | 60 | 1,5 | 2,4 | -1 | 0 | 0 | -1 |
| 21 | 15 | 60 | 1,5 | 24 | 0 | 0 | 0 | 1 |
| 22 | 25 | 50 | 0,5 | 24 | 1 | -1 | -1 | 1 |
| 23 | 5 | 70 | 2,5 | 6 | -1 | 1 | 1 | 0 |
| 24 | 25 | 70 | 0,5 | 24 | 1 | 1 | -1 | 1 |
| 25 | 15 | 60 | 1,5 | 6 | 0 | 0 | 0 | 0 |
| 26 | 5 | 50 | 2,5 | 24 | -1 | -1 | 1 | 1 |
Resultados y discusión
Caracterización del catalizador
Los difractogramas obtenidos antes y después de la incorporación de Cu se presentan en la Figura 3. En el caso del patrón de DRX de la MCM-41 sin modificar presenta tres picos característicos asociados a los índices (1 0 0), (1 1 0) y (2 1 0) (PDF 00-049-1711) en las posiciones 2θ = 2,8°; 4,8° y 5,5°; estas señales indican un orden hexagonal mesoporoso típico en este tipo de material [19]. Usando la reflexión de mayor intensidad que corresponde al pico mejor definido (asociado con el plano (1 0 0)), es posible estimar el tamaño de partícula del cristal formado utilizando la ecuación de Scherrer, ec. (3) [20]:

Donde λ corresponde a la longitud de onda utilizada en el experimento (0,1541 nm), d es la distancia en el pico a la mitad de la altura, y θ el ángulo en radianes del pico. El tamaño del cristal asociado al dominio cristalino (1 0 0) del soporte (MCM-41) calculado con la ec. (3) fue de 0,48 nm. En el caso del material modificado con Cu (Figura 3(a)), el pico asociado al plano (1 0 0) de la MCM-41 disminuye considerablemente y desaparece totalmente el pico asociado al plano (2 1 0). Adicionalmente, en el caso del plano (2 0 0) se observa un corrimiento con respecto al material sin modificar, esto puede estar asociado a la pérdida del arreglo ordenado, característico en este tipo de materiales [21]. En el caso de Cu/MCM-41 (Figura 3 (b)), se observan las señales características del CuO (PDF 00-005-0661) a los siguientes ángulos (ángulos altos) (2θ) = 32,6; 35,5; 38,9; 48,7; 53,41; 58,31; 61,6; 66,2; 68,1; 72,4º relacionados respectivamente con los planos (1 1 0), (-1 1 1), (2 0 0), (-2 0 2), (0 2 0), (2 0 2), (-1 1 3), (-3 1 1), (2 2 0) y (3 1 1).
Figura 3. Patrón DRX de MCM-41 (a) y Cu/MCM-41 a ángulos bajos (b) y Cu/MCM-41 a ángulos altos (c).
En el espectro Raman (Figura 4) se observan los picos característicos de la MCM-41 a 440, 595, 710 y 982 cm-1 relacionados con las vibraciones simétricas y asimétricas del enlace Si-O-Si, que está directamente asociado con los defectos de red como los grupos silanoles superficiales [22]. En el caso de la modificación con Cu, se observa la pérdida de la señal asociada a la vibración simétrica del enlace Si-O-Si en 440 cm-1, lo cual puede verificar la presencia del metal en la red del material. Sin embargo, las señales típicas en 296 y 346 cm-1, relacionadas con la formación de CuO, y una señal en 623 cm-1, asociada con la formación de una menor fase de Cu2O, evidencian la presencia de Cu sobre la superficie de la MCM-41 [23].
Las propiedades texturales y el análisis de acidez de los materiales MCM-41 y Cu/MCM-41 se presentan en la Tabla 2. Se observa que la incorporación de Cu en el soporte disminuye considerablemente el área superficial del material y el volumen del poro disponible para la reacción. Como el diámetro cinético del sustrato (6,9356 Å), estimado usando la optimización de la estructura con Gaussian G09 (B3YLP/6-31G; Figura 5), es menor al volumen de los poros del catalizador, se asumiría que la reacción de isomerización ocurrirá sobre la superficie y dentro de los poros del material (el diámetro cinético se encuentra dentro del orden de microporosidad).
Tabla 2. Propiedades texturales y porcentaje de metal del soporte MCM-41 y Cu/MCM-41.
| Material | Volumen de poro (m3/g) | Área superficial (m2/g) | Acidez (mmol NH3/g) | % Metal* | ||
| Baja (110 °C) | Media (350 °C) | Alta (550 °C) | ||||
| MCM-41 | n.d. | 700,38 | 0,1872 | 0,4821 | 2,0542 | n.a. |
| Cu/MCM-41 | 0,1652 | 475,39 | 0,6440 | 0 | 2,7103 | 4,5 |
*Determinado por análisis de absorción atómica. n.a.= no aplica. n.d. = no determinado.
La impregnación con Cu aumenta considerablemente en el soporte la acidez fuerte (Tabla 2). En el caso del material sin modificar, la acidez está asociada a los grupos hidroxilos y al átomo de silicio que se encuentran en la superficie (grupos silanoles vecinales). Algo similar fue encontrado en el caso de zeolitas como ZSM-5 modificado con Cu en donde, con respecto al soporte, la incorporación de Cu generaba un aumento en la acidez fuerte y disminuía la cantidad de sitios débiles disponibles en el material [24].
Figura 4. Espectro Raman del catalizador Cu/MCM-41 y del soporte MCM-41.
Figura 5. Estructura optimizada del óxido de α-pineno usando B3YLP/6-31G.
El espectro XPS del material modificado con Cu se presenta en la Figura 6. En el caso del material Cu/MCM-41 en el barrido general se observan las señales típicas del Si(2s), O(1s) y Cu(2p). Específicamente, el espectro XPS de alta resolución para el O(1s) (Figura 6(c)) en 530 eV puede estar relacionado con la presencia de O2- en la fase de CuO que fue evidenciado en los análisis de difracción de rayos X, pero también a una pequeña cantidad de Cu2O, dado que este último tiene una posición alrededor de 530,4 eV [25-26]. En el caso del espectro de alta resolución del Cu (2p) (Figura 6(b)) se observan dos señales típicas asociadas con los estados Cu 2p3/2 y Cu 2p1/2 típicos del CuO, lo cual es evidente con la presencia de la señal satélite y la separación de los dos estados alrededor de 20 eV. Adicionalmente, la separación entre cada estado del Cu(2p) al pico satélite está alrededor de 10 eV lo cual verifica la presencia de CuO [27-30].
Figura 6. Espectros XPS: Barrido general (a) y de alta resolución para Cu (2p) (b) y O (1s) (c).
Análisis del diseño experimental y superficie de respuesta
En esta sección se describe la aplicación del diseño experimental central compuesto a los factores que afectan la isomerización de 1. Reportes previos han permitido concluir que la cantidad de catalizador, el tiempo de reacción, la temperatura, así como el uso de solventes apolares como tolueno son los factores que afectan el rendimiento de formación del compuesto 2 [11, 12, 31]. El análisis de los efectos principales y del diagrama de Pareto se muestra en la Figura 7. Con respecto a la selectividad hacia 2 con Cu/MCM-41, la gráfica de efectos principales muestra que, al aumentar la cantidad de catalizador, aumenta la selectividad hasta alrededor de 40% y, posteriormente, disminuye hasta cerca del 20%. La tendencia observada con la temperatura es similar, pero con un cambio más notorio en la selectividad. Esto es contrario al comportamiento del tiempo de reacción, en el que se encuentra el valor máximo de selectividad. Un aumento en la polaridad del solvente disminuye considerablemente la selectividad hacia 2, lo cual coincide con lo reportado previamente por Stekrova et al. [11] (tolueno, 70 °C, Fe/MCM-41), en donde el uso de solventes apolares (de menor constante dieléctrica) favorece la formación de 2, mientras que el uso de solventes polares favorece la formación de trans-carveol (ambos isómeros corresponden a los productos termodinámicamente más estables de la reacción de apertura de 1). En el diagrama de Pareto para la selectividad (Figura 7(b)) se observa que los factores que tienen un efecto positivo son la cantidad de catalizador, el tiempo de reacción y los factores combinados de temperatura y tiempo, así como el efecto de doble tiempo. En comparación con lo encontrado en la conversión, se observa que el tiempo de reacción y la cantidad de catalizador, así como los efectos combinados de temperatura y tiempo, y de cantidad de catalizador y polaridad del solvente, y efectos dobles de constante dieléctrica, tiempo y temperatura son los que presentan el mayor efecto en la conversión. Entre estos factores, el mayor efecto sobre la conversión lo presenta el efecto doble de la constante dieléctrica. Solo en algunos casos se evidenció que la cantidad de catalizador y el tiempo de reacción es el que presenta el mayor efecto sobre la conversión.
Figura 7. Efectos principales en la selectividad (a) para los diferentes factores estudiados y diagrama de Pareto para las combinaciones y efectos únicos en la selectividad (b).
El análisis ANOVA para la conversión y selectividad se muestran en las Tablas 4 y 5, respectivamente. En el caso de la selectividad, no se encontraron factores que afecten significativamente el modelo. Sin embargo, valores muy cercanos al valor estándar de P (P < 0,05) indican que el factor doble del tiempo es el que tiene más significancia. El valor de regresión para el polinomio de grado 2 ajustado para este modelo fue de 69,1251. Algo similar fue encontrado con el ANOVA realizado para la conversión: según el valor P encontrado (Tabla 5) para cada uno de los factores evaluados, ninguno tiene efecto significativo. Sin embargo, el factor doble del tiempo se encuentra muy cercano al valor P admitido (< 0,05) para ser significativo. En este caso, el valor de ajuste a un modelo polinómico de segundo grado fue 63,8241. Adicionalmente, el error total generado en la conversión es mayor que en el caso de la selectividad (7111,42 vs 3774,62; Tabla 4 y Tabla 5, respectivamente).
Tabla 3. Análisis ANOVA para la selectividad.
| Fuente | Suma de cuadrados | Gl | Cuadrado medio | Razón-F | Valor-P |
| A: Cantidad de catalizador | 849,709 | 1 | 849,709 | 2,25 | 0,1644 |
| B: Temperatura | 402,696 | 1 | 402,696 | 1,07 | 0,3260 |
| C: Tiempo | 128,273 | 1 | 128,273 | 0,34 | 0,5728 |
| D: Constante dieléctrica | 79,0863 | 1 | 79,0863 | 0,21 | 0,6569 |
| AA | 614,803 | 1 | 614,803 | 1,63 | 0,2307 |
| AB | 1349,45 | 1 | 1349,45 | 3,58 | 0,0879 |
| AC | 52,647 | 1 | 52,647 | 0,14 | 0,7166 |
| AD | 50,7399 | 1 | 50,7399 | 0,13 | 0,7215 |
| BB | 504,256 | 1 | 504,256 | 1,34 | 0,2746 |
| BC | 3,78326 | 1 | 3,78326 | 0,01 | 0,9222 |
| BD | 154,787 | 1 | 154,787 | 0,41 | 0,5363 |
| CC | 1849,41 | 1 | 1849,41 | 4,90 | 0,0513 |
| CD | 745,216 | 1 | 745,216 | 1,97 | 0,1903 |
| DD | 0,00969628 | 1 | 0,00969628 | 0,00 | 0,9961 |
| bloques | 147,46 | 1 | 147,46 | 0,39 | 0,5459 |
| Error total | 3774,62 | 10 | 377,462 | ||
| Total (corregido,) | 12225,5 | 25 |
Tabla 4. Análisis ANOVA para la conversión.
| Fuente | Suma de Cuadrados | Gl | Cuadrado Medio | Razón-F | Valor-P |
| A:Cantidad de catalizador | 1001,7 | 1 | 1001,7 | 1,41 | 0,2627 |
| B:Temperatura | 779,556 | 1 | 779,556 | 1,10 | 0,3197 |
| C:Tiempo | 795,461 | 1 | 795,461 | 1,12 | 0,3151 |
| D:Constante dieléctrica | 210,026 | 1 | 210,026 | 0,30 | 0,5987 |
| AA | 857,794 | 1 | 857,794 | 1,21 | 0,2978 |
| AB | 95,3959 | 1 | 95,3959 | 0,13 | 0,7218 |
| AC | 160,704 | 1 | 160,704 | 0,23 | 0,6447 |
| AD | 55,8688 | 1 | 55,8688 | 0,08 | 0,7850 |
| BB | 32,9233 | 1 | 32,9233 | 0,05 | 0,8340 |
| BC | 69,7033 | 1 | 69,7033 | 0,10 | 0,7607 |
| BD | 60,3595 | 1 | 60,3595 | 0,08 | 0,7767 |
| CC | 40,9485 | 1 | 40,9485 | 0,06 | 0,8152 |
| CD | 320,44 | 1 | 320,44 | 0,45 | 0,5173 |
| DD | 2888,79 | 1 | 2888,79 | 4,06 | 0,0715 |
| Bloques | 142,856 | 1 | 142,856 | 0,20 | 0,6636 |
| Error total | 7111,42 | 10 | 711,142 | ||
| Total (corregido,) | 19657,9 | 25 |
La ecuación polinómica de segundo grado con R2 = 0,6309, obtenida para la predicción de la conversión corresponde a la ec. (4):
La ecuación polinómica de segundo grado con R2 = 0,6309, obtenida para la predicción de la conversión corresponde a la ec. (4):
Conversión = 398,42 + 10,0336x1 – 12,0009x2- 31,8613x3 - 14,3230x4- 0,26574x1 2 - 0,0188x1x2 - 0,1875x1x3 + 0,0041x1x4+ 0,0943x2 2 + 0,2750x2x3 - 0,0049x2x4+ 9,9286x3 2 - 0,4086x3x4+ 0,5415x4 2 (4)
En el caso de la selectividad a aldehído canfolénico, la ecuación obtenida para este modelo de superficie de respuesta (R2 = 0,6791) corresponde a la ec. (5):
Selectividad = -439,291 + 13,4431x1 + 15,1252x2 - 108,754x3 + 1,1586x4- 0,2331x1 2 - 0,0875x1x2 - 0,025x1x3 - 0,0389x1x4- 0,1181x2 2 + 0,1125x2x3 - 0,0183x2x4+ 37,6905x32 - 0,6473x3x4+ 0,0317x4 2 (5)
La Figura 8 presenta las superficies de respuesta estimadas y obtenidas para la conversión y selectividad. Para la selectividad en función de la cantidad de catalizador y temperatura de reacción (Figura 8(a)), y cantidad de catalizador y tiempo de reacción (Figura 8(b)), se determinaron los máximos correspondientes para la obtención de 2. En la Figura 8(b) se observa una región en donde se obtiene un 100% de selectividad, justamente en la región comprendida entre 5 mg y 1 h de reacción para tolueno como solvente. Particularmente, en el caso del etanol se presenta reacción de solvólisis generado por la inducción del ion etanoato al sitio electrodeficiente del epóxido como ha sido previamente reportado en epóxidos cíclicos como el epóxido de estireno [32].
Figura 8. Superficies de respuesta estimadas para la selectividad hacia aldehído canfolénico y conversión de epóxido de α-pineno: (a) selectividad en función de la cantidad de catalizador y temperatura, (b) selectividad en función de la cantidad de catalizador y del tiempo, (c) conversión en función de la cantidad de catalizador y temperatura, (d) conversión en función de la cantidad de catalizador y tiempo.
En el caso de las superficies de respuesta de las Figura 8(c) y (d) no se observan regiones con el 100% de conversión. Sin embargo, durante los diferentes ensayos experimentales se determinó que con 25 mg de catalizador y 2,5 h de reacción se obtienen valores muy cercanos al 100% de conversión. Después de la obtención y aplicación de la superficie de respuesta, se obtuvieron los valores de optimización para la conversión y selectividad (Tabla 6). El valor máximo obtenido para la selectividad es cercano al 84%. Los valores de cantidad de catalizador, temperatura, tiempo y constante dieléctrica del solvente están muy cercanas al valor óptimo obtenido para la conversión. Esta predicción realizada por el modelo polinómico de segundo grado se encuentra en buen ajuste por lo establecido experimentalmente. Adicionalmente, este es el primer reporte en la literatura con catalizadores de Cu en materiales mesoporosos y la consideración del estudio de superficie de respuesta para la obtención del compuesto 2.
Tabla 5. Valores óptimos de selectividad y conversión.
| Factor | Valor óptimo para obtener 83,7% de selectividad | Valor óptimo para obtener 75,4% de conversión |
| Cantidad de catalizador (mg) | 17 | 16 |
| Temperatura (°C) | 59 | 50 |
| Tiempo (h) | 2,5 | 2,5 |
| Constante dieléctrica (a.u) | 2,4 | 2,4 |
Finalmente, se observa en las Figuras 9(a y b) la correlación entre los resultados experimentales para la conversión del epóxido de α-pineno y selectividad de aldehído canfolénico con respecto a los predichos en las ecuaciones obtenidas para los modelos de superficie (Ecs. (4) y (5)). La distribución obtenida en ambos casos es dispersa respecto a la línea de 45°, aunque se observa una mejor predicción de la selectividad a aldehído canfolénico que de la conversión del epóxido α-pineno.
Figura 9. Correlación entre los resultados experimentales y los predichos por el modelo (representados por las ecuaciones (4) y (5)) para la conversión de epóxido de α-pineno (a) y para la selectividad a aldehído canfolénico (b).
Conclusiones
En el material obtenido por incorporación de Cu sobre la superficie del material mesoporoso MCM-41, se identificó la presencia de CuO y una baja cantidad de Cu2O, mediante DRX, XPS y espectroscopia Raman. Adicionalmente, se obtuvo un incremento en la acidez respecto al soporte. El catalizador Cu-MCM-41 se evaluó en la isomerización del epóxido de α-pineno para la obtención de aldehído canfolénico, desarrollándose un diseño experimental estadístico central compuesto en donde se encontraron las condiciones óptimas para la selectividad a aldehído canfolénico (17 mg de catalizador, 59 °C, 2,5 h de reacción, tolueno como solvente) y para la conversión (16 mg de catalizador, 50 °C, 2,5 h de reacción y tolueno como solvente) para las cuales se obtuvieron los valores máximos de conversión y selectividad de 84% y 75% (rendimiento del 63% hacia el aldehído canfolénico), respectivamente. El análisis de superficie de respuesta indicó que en ambos casos solo los factores combinados (del tiempo de reacción y tipo de solvente) son los que tienen una mayor significancia. Sin embargo, el ajuste de los datos experimentales a los modelos polinomiales de segundo grado presentó un factor de correlación (R2) de 0,6694. Los datos aquí reportados sugieren las condiciones con las cuales se puede obtener aldehído canfolénico con una alta selectividad (84%) usando el sistema catalítico Cu soportado en MCM-41.
Referencias
References
T. Chen, C. Da Fonseca, A. Schönthal. “Preclinical development and clinical use of perillyl alcohol for chemoprevention and cancer therapy” Am. J. Cancer Res. vol. 5, pp. 1580-1593, 2015.
D. Kauffmann, A. Dogra, M. Wink. “Myrtenal inhibits acetylcholinesterase, a known alzheimer target” J. Pharm. Pharmacol. vol. 63, pp. 1368-1371, 2011. DOI: https://doi.org/10.1111/j.2042-7158.2011.01344.x.
H. Pakdel, S. Sarron, C. Roy. “Alpha-terpineol from hydration of crude sulfate turpentine oil” J. Agric. Food Chem. vol. 49, pp. 4337-4341, 2001. DOI: https://doi.org/10.1021/jf010341b.
T. Michel, D. Betz, M. Cokoja, V. Sieber, F. Kühn. “Epoxidation of alpha-pinene catalyzed by methyltrioxorhenium (VII): Influence of additives, oxidants and solvents” J. Mol Catal. A Chem. vol. 340, pp. 9-14, 2011. DOI: https://doi.org/10.1016/j.molcata.2011.03.017.
J. Becerra, L. González, A. Villa. “Kinetic study of alpha-pinene allylic oxidation over FePcCl16- NH2-SiO2 catalyst” J. Mol Catal. A Chem. vol. 423, pp. 12-21, 2016. DOI: https://doi.org/10.1016/j.molcata.2016.05.029.
S. Ajaikumar, J. Ahlkvist, W. Larsson, A. Shchykarev, A. Leino, K. Kordas, J. Mikkola, Oxidation of alpha-pinene over gold containing bimetallic nanoparticles supported on reducible TiO2 by deposition- precipitation method. Appl. Catal., A. vol. 392, pp. 11-18, 2011. DOI: https://doi.org/10.1016/j.apcata.2010.10.015.
S. Casuscelli, G. Eimer, A. Canepa, A. Heredia, C. Poncio, M. Crivello, C. Perez, A. Aguilar, E. Herrero. “Ti-MCM-41 as catalyst for α-pinene oxidation: Study of the effect of Ti content and H2O2 addition on activity and selectivity” Catal. Today. vol. 133-135, pp. 678-683, 2008. DOI: https://doi.org/10.1016/j.cattod.2007.12.104.
P. Kunkeler, J. Van der Waal, J. Bremmer, B. Zuudeeg, R. Downing, H. Bekkum. “Application of zeolite titanium beta in the rearrangement of alpha-pinene epoxide to campholenic aldehyde” Catal. Lett. vol. 53, pp. 135-138, 1998. DOI: https://doi.org/10.1023/A:1019049704709.
J. Kaminska, M. Schwegler, A. Hoefnagel, V. Bekkum. “The isomerization of alpha pinene oxide with Brönsted and Lewis acids” Recl. Trav. Chim. Pays-Bas. vol. 111, pp. 432-437, 1992. DOI: https://doi.org/10.1002/recl.19921111004.
M. Timofeeva, V. Panchenko, Z. Hasan, N. Khan, M. Mel’gunov, A. Abel, M. Matrosova, K.Volcho, S. Jhung. “Effect of iron content on selectivity in isomerization of α-pinene oxide to campholenic aldehyde over Fe-MMM-2 and Fe-VSB-5” Appl. Catal., A. vol. 469, pp. 427-433, 2014. DOI: https://doi.org/10.1016/j.apcata.2013.10.016.
M. Stekrova, N. Kumar, A. Aho, I. Sinev, W. Grünert, J. Dahl, J. Roine, S. Arzumanov, P. Mäki-Arvela, D. Murzin. “Isomerization of alpha-pinene oxide using Fe- supported catalysts: Selective synthesis of campholenic aldehyde” Appl. Catal., A., vol. 470, pp. 162-176, 2014. DOI: https://doi.org/10.1016/j.apcata.2013.10.044.
V. Costa, K. Rocha, L. Sousa, P. Dutenhefner, E. Gusevskaya. “Isomerization of alpha- pinene oxide over cerium and tin catalysts: Selective synthesis of trans-carveol and trans-sobrerol” J. Mol Catal. A Chem. vol. 345, pp. 69-74, 2011. DOI: https://doi.org/10.1016/j.molcata.2011.05.020.
G. Neri, G. Rizzo, C. Crisafulli, L. De Luca, A. Donato, M. Musolino, R. Pietropaolo. “Isomerization of alpha-pinene oxide to campholenic aldehyde over Lewis acids supported on silica and titania nanoparticles” Appl. Catal., A. vol. 295, pp. 116-125, 2005. DOI: https://doi.org/10.1016/j.apcata.2005.07.027.
M. Timofeeva, V. Panchenko, A. Abel, N. Abedin, I. Ahmed, A. Ayupov, K. Volcho, S. Jhung. “Rearrangement of alpha pinene oxide to campholenic aldehyde over the trimesate metal-organic frameworks MIL-100, MIL-110, MIL-96” J. Catal. vol. 311, pp. 114-120, 2014. DOI: https://doi.org/10.1016/j.jcat.2013.11.006.
L. Alaerts, E. Seguin, H. Poelman, F. Thibault-Starzyk, P. Jacobs, D. De vos. “Probing the lewis acidity and the catalytic activity of the metal-organic framework [Cu3(btc)2] (BTC=Benzene-1,3,5-tricarboxylate)” Chem. Eur. J. vol. 12, pp. 7353-7363, 2006. DOI: https://doi.org/10.1002/chem.200600220.
J. Dongmei, T. Mallat, F. Krumeich, A. Baiker. “Copper-based metal-organic framework for the facile ring opening of epoxides” J. Catal. vol. 257, pp. 390-395, 2008. DOI: https://doi.org/10.1016/j.jcat.2008.05.021.
D. Amantini, F. Fringuelli, O. Piermatti, S.Tortoioli, L. Vaccaro. “Nucleophilic ring opening of 1,2-epoxides in aqueous medium” Arkivoc. vol. 11, pp. 293-311, 2002. DOI: http://dx.doi.org/10.3998/ark.5550190.0003.b26.
M. Grün, K. Unger, A. Matsumoto, K. Tsutsumi. “Novel pathways for the preparation of mesoporous MCM-41 materials: control of porosity and morphology” Microporous Mater. vol. 27, pp. 207-216, 1999. DOI: https://doi.org/10.1016/S1387-1811(98)00255-8.
J. Aquino, C. Souza, A. Araujo. “Synthesis and characterization of sulfate-supported MCM-41 material” Int. J. Inorg. Mater. vol. 3, pp. 467-470, 2001. DOI: https://doi.org/10.1016/S1466-6049(01)00042-3.
M. Verma, V. Kumar, A. Katoch. “Sputtering based synthesis of CuO nanoparticles and their structural, thermal and optical studies” Mater. Sci. in Semicond. Process. vol. 76, pp. 55-60, 2018. DOI: https://doi.org/10.1016/j.mssp.2017.12.018.
M. Salam, M. Betiha, S. Shaban, A. Elsabagh, R. El-Aal, F. Kad., “Synthesis and characterization of MCM-41supported nano zirconia” Egypt. J. Petrol. vol. 24, pp. 49-57, 2015. DOI: https://doi.org/10.1016/j.ejpe.2015.02.005.
G. Zhang, J. Long, X. Wang, Z. Zhang, W. Dai, P. Liu, Z. Li, L.Wu, X. Fu. “ Catalytic role of Cu sites of Cu/MCM-41 in phenol hydroxylation” Lang. Art. Vol 26, pp. 1362-1371. DOI: https://doi.org/la902436s.
Y. Deng, A. Handoko, Y. Du, S. Xi, B. Siang. “In Situ raman spectroscopy of copper and copper oxides surfaces during electrochemical oxygen evolution reaction: Identification of Cu(II) oxides as catalytically active species” ACS Catalysis. vol. 6, pp. 2473-2481. 2016. DOI: https://doi.org/10.1021/acscatal.6b00205.
C. Li, J. Ma, Z. Xiao, S. Hector, R. Liu, S. Zuo, Z. Xie, A. Zhang, H. Wu, Q. Liu. “Catalytic cracking of Swida wilsoniana oil for hydrocarbon biofuel over Cu- modified ZSM-5 zeolite” Fuel. vol. 218, pp. 59-66, 2018. DOI: https://doi.org/10.1016/j.fuel.2018.01.026.
C. Oruc, A. Altindal. “Structural and dielectric properties of CuO nanoparticles” Ceram. Int. vol. 43, pp. 10708-10714, 2017. DOI: https://doi.org/10.1016/j.ceramint.2017.05.006.
M. Natile, A. Galenda, A. Glisenti. “CuO/CeO2 nanocomposites: an XPS study” Surf. Sci. Spectra. vol. 16, pp. 13-26, 2009. DOI: https://doi.org/10.1116/11.20061005.
N. Pauly, S. Tougaard. “Primary excitation spectra in XPS and AES of Cu, CuO: Relative importance of surface and core hole effects” Surf. Sci. vol. 641, pp. 326-329, 2015. DOI: https://doi.org/10.1016/j.susc.2015.02.009.
Z. Chen, B. Zhao, X. Fu, R. Sun, C. Wong. “CuO nanorods supported Pd nanoparticles as high performance electrocatalysts for glucose detection” J. Electroanal. Chem. vol. 807, pp. 220-227, 2017. DOI: https://doi.org/10.1016/j.psep.2017.05.016.
C. Dong, C. Chen, C. Kao, C. Hung. “Synthesis, characterization, and application of CuO-modified TiO2 electrode exemplied for ammonia electro-oxidation” Process Saf. Environ. Prot. vol. 112, pp. 243-253, 2017. DOI: https://doi.org/10.1016/j.psep.2017.05.016.
M. Gopiraman, I. Chung. “Highly active and cost-effective CuO-based nanocomposite with unique morphology for catalytic synthesis of imines under solvent-free conditions” J. Taiwan Inst. Chem. Eng. vol. 81, pp. 455-464, 2017. DOI: https://doi.org/10.1016/j.jtice.2017.08.021.
Y. Woong, N. Kim, W. Ahn, H. Rhee. “Redox mesoporous molecular sieve as a bifunctional catalyst for the one-pot synthesis of campholenic aldehyde from α-pinene” J. Mol Catal. A Chem. vol. 174, pp. 249-254, 2001. DOI: https://doi.org/10.1016/S1381-1169(01)00192-3.
S. Bruno, A. Gomes, T. Oliveira, M. Antunes, A. Lopes, A. Valente, I. Goncalves, M. Pillinger. “Catalytic alcoholysis of epoxides using metal-free cucurbituril-based solids” Org. Biomol. Chem. Comm. vol. 14, pp. 3873-3877, 2016. DOI: https://doi.org/10.1039/c6ob00512h.
How to Cite
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Download Citation
CrossRef Cited-by
1. Julián E. Sánchez-Velandia, Sol M. Mejía, Aida L. Villa. (2020). Reaction Mechanism of the Isomerization of Monoterpene Epoxides with Fe3+ as Active Catalytic Specie: A Computational Approach. The Journal of Physical Chemistry A, 124(19), p.3761. https://doi.org/10.1021/acs.jpca.9b09622.
2. Julián E. Sánchez-Velandia, John F. Gelves, Marco A. Márquez, Ludovic Dorkis, Aída-Luz Villa. (2020). Catalytic Isomerization of α-Pinene Epoxide Over a Natural Zeolite. Catalysis Letters, 150(11), p.3132. https://doi.org/10.1007/s10562-020-03225-9.
3. Julián E. Sánchez-Velandia, Andrea Agudelo-Cifuentes, Aida L. Villa. (2019). Kinetics of the isomerization of α-pinene epoxide over Fe supported MCM-41 and SBA-15 materials. Reaction Kinetics, Mechanisms and Catalysis, 128(2), p.1005. https://doi.org/10.1007/s11144-019-01656-z.
4. Julián E. Sánchez-Velandia, Aída Luz Villa. (2022). Selective synthesis of high-added value chemicals from α-pinene epoxide and limonene epoxide isomerization over mesostructured catalysts: Effect of the metal loading and solvent. Catalysis Today, 394-396, p.208. https://doi.org/10.1016/j.cattod.2021.09.011.
5. Dhanaji R. Naikwadi, Shilpa Dabas, Krishnan Ravi, Amravati S. Singh, Jacky H. Advani, Saravanan Subramanian, Ankush V. Biradar. (2023). Recent Advances and Challenges in the Valorization of α‐Pinene toward Value‐Added Chemicals. Advanced Sustainable Systems, 7(11) https://doi.org/10.1002/adsu.202300157.
Dimensions
PlumX
Article abstract page views
Downloads
License
Copyright (c) 2018 Revista Colombiana de Química

This work is licensed under a Creative Commons Attribution 4.0 International License.
Authors will retain their copyright and guarantee the journal the right of first publication of their work, which will be simultaneously subject to the Creative Commons Recognition License (CC. Attribution 4.0) that allows third parties to always share the work as the authors and their publication in this journal be indicated.
Authors may adopt other non-exclusive license agreements for the distribution of the version of the published work (eg: deposit it in an institutional archive or publish it in a monographic volume) provideding always the first publication in this Journal.
Authors are allowed and encouraged to disseminate their work through the Internet (eg, in institutional files or on their website) before and during the submission process, which can lead to interesting exchanges and increase citations of the published work (See The effect of open access).




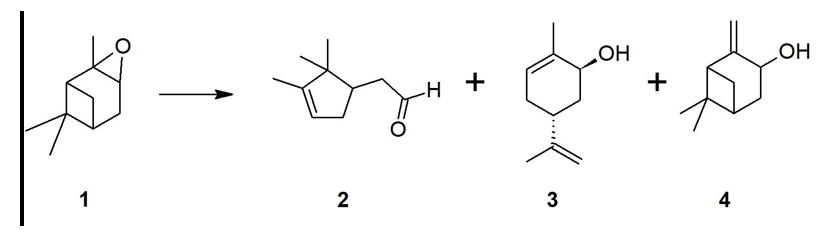
![Figura 2. Formación de aldehído canfolénico 2 o trans-carveol
3 usando un medio ácido tipo Lewis o
básico tipo Brönsted. El primer paso y determinante de la reacción es la
formación del carbocatión intermedio. LA = ácido de Lewis; H+ = ácido
de Brönsted. Modificado de [10-11].](https://revistas.unal.edu.co/index.php/rcolquim/article/download/72129/version/57364/68964/408562/309057412002_gf3.png)