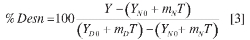ESTABILIZACIÓN DE HOLO-alfa-LACTOALBÚMINA EN PRESENCIA DE POLIOLES
Palabras clave:
holo-alfa-lactoalbúmina, desnaturalización, polioles, estabilidad térmica. (es)ESTABILIZACIÓN DE HOLO-α-LACTOALBÚMINA EN PRESENCIA DE POLIOLES
HOLO-α-LACTALBUMIN STABILIZATION IN THE PRESENCE OF POLYOLS
ESTABILIDADE TÉRMICA DA HOLO-α-LACTOALBUMINA EM PRESENÇA DE POLIÓIS
Alberto R. Alois1, José M. Lozano2, Carmen M. Romero13
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá. Bogotá, Colombia.
2 Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, Bogotá, Colombia. Fundación Instituto de Inmunología de Colombia, FIDIC, cra. 50 No. 26-00, Bogotá, Colombia.
3 Autor para correspondencia: cmromeroi@unal.edu.co
Recibido: 09/03/09 - Aceptado: 17/08/09
RESUMEN
En este trabajo se presenta un estudio sistemático sobre el efecto de las soluciones acuosas de eritritol, xilitol, sorbitol e inositol con diferentes concentraciones, sobre la estabilidad térmica de la holo-α-lactoalbúmina bovina con pH 6,5 usando espectroscopia UV-VIS. Los resultados obtenidos muestran que los polioles usados estabilizan la holo-α-lactoalbúmina en un grado significativamente menor al reportado para otras proteínas. Se sugiere que este menor efecto de estabilización ocurre debido a que esta proteína presenta un estado desnaturalizado parcialmente desdoblado.
Palabras clave: holo-α-lactoalbúmina, desnaturalización, polioles, estabilidad térmica.
ABSTRACT
In this work we present a systematic study of the effect of aqueous solutions of erythritol, xylitol, sorbitol and inositol on thermal stability of bovine holo-α-lactalbumin at pH 6,5 using UV-VIS spectroscopy. The results show that the polyols used stabilize the holo-α-lactoalbumin in a significant lesser extent than the reported for others proteins. It is suggested that the lower stabilization achieved for this protein is the result of a partially unfolded denaturated state that this protein presents.
Key words: holo-α-lactalbumin, denaturation, polyols, thermal stability.
RESUMO
Neste trabalho é apresentado um estudo sistemático acerca do efeito de soluções aquosas de eritritol, xilitol, sorbitol e inositol a diferentes concentrações sobre a estabilidade térmica da holo-α-lactoalbumina bovina a pH 6,5 usando espectroscopia UV-VIS. Os resultados obtidos mostram que os polióis usados estabilizam a holo-α-lactoalbumina num grado significativamente menor ao reportado para outras proteínas. Se sugere que este menor efeito de estabilização ocorre devido a que esta proteína apresenta um estado desnaturalizado parcialmente desdobrado.
Palavras-chave: holo-α-lactoalbumina, desnaturalização, polióis, estabilidade térmica.
INTRODUCCION
La α-lactoalbúmina bovina es la segunda proteína más abundante del suero de leche (1, 2), y posee actividades biológicas demostradas y potenciales aplicaciones en la industria farmacéutica y alimentaria como bactericida (3), inductor de apoptosis de células tumorales (4), agente de gelación, formador de espuma y emulsificante (5). Por esta razón, se ha estudiado ampliamente. La α-lactoalbúmina es una proteína globular pequeña que está constituida por 123 aminoácidos y posee un peso molecular próximo a 14 kDa (6). Por encima de pH 5,1 la α-lactoalbúmina se encuentra en su forma monomérica, por lo menos hasta pH 8,1. Esta proteína puede unirse con varios cationes, entre los cuales se encuentran calcio, magnesio, manganeso, sodio y zinc (7, 8). La α-lactoalbúmina es estabilizada por cuatro puentes disulfuros (9) y posee dos formas dependiendo de si se encuentra unida al Ca2+ (forma holo) o no (forma apo). Desde el punto de vista termodinámico, la unión del ión calcio estabiliza la proteína aumentando la temperatura de desnaturalización y la energía libre de Gibbs (10). Estructuralmente, sin embargo, los cambios son relativamente pequeños. El punto isoeléctrico de la holo-α-lactoalbúmina se ha reportado en el rango entre 4,2 y 4,8 (9), siendo el valor más utilizado en la literatura el de 4,5.
Varios estudios se han desarrollado sobre la estabilidad térmica de esta proteína. Para el caso de la holo-α-lactoalbúmina los estudios calorimétricos muestran que a pH 8,0 el proceso de desnaturalización ocurre a través de un proceso reversible de dos estados (9).
Diversos factores afectan la estabilidad conformacional de las proteínas, dentro de ellos, la adición de compuestos orgánicos de bajo peso molecular tiene gran importancia. Desde hace algún tiempo se sabe que algunos cosolventes, entre los cuales se encuentran los polioles, son capaces de estabilizar el estado nativo de las proteínas (11-15). Para explicar este fenómeno se han propuesto diferentes teorías y modelos que plantean desde la hi-dratación preferencial de la proteína con la correspondiente exclusión de los aditivos de su esfera de hidratación (16), hasta la modificación de la estructura del agua por parte del cosolvente. Sin embargo, dada la variedad y complejidad de las interacciones que intervienen en la estabilidad de la proteína, tanto en el nivel intramolecular entre los grupos constituyentes como con el solvente, el mecanismo de estabilización no ha sido completamente dilucidado (12, 13, 17-20).
Para contribuir a la interpretación del papel del solvente en la estabilidad de proteínas, en el presente trabajo se estudia el efecto de las soluciones acuosas de eritritol, xilitol, sorbitol e inositol con diferentes concentraciones, sobre la estabilidad térmica de la holo-a-lactoalbúmina bovina usando espectroscopia UV-VIS.
MATERIALES Y MÉTODOS
Los reactivos usados fueron eritritol 99,9%, xilitol 99%, sorbitol 99,9% y meso-inositol 99% (Sigma). Holo-α-lactoalbúmina bovina (2,3 mol de Ca2+: mol de proteína, 100% por SDS-PAGE) (Sigma Chemical Co.) que se utilizó sin posterior purificación. Todos los demás reactivos utilizados fueron de grado analítico o mejor.
Para determinar la influencia del pH sobre los parámetros de desnaturalización de la proteína y la reversibilidad del proceso, se prepararon diferentes soluciones de proteína en buffer de fosfato, acetato y HEPES 10 mM con diferente pH entre 3,1 y 8,0, utilizando agua bidestilada fresca, con conductividad inferior a 2 µS/rn. La concentración de proteína disuelta se determinó a través de espectroscopia UV-VIS, usando un coeficiente de extinción de E1%=20,9 g-1 L cm-1 a 280 nm.
La temperatura de desnaturalización, así como los parámetros termodinámicos, se determinaron a partir de las curvas de desnaturalización térmica. Para establecer el grado de reversibilidad, se obtuvieron los perfiles de desnaturalización térmica de la proteína en buffer, calentando la proteína hasta una temperatura previamente fijada, superior a la temperatura de desnaturalización, manteniéndola a esta temperatura durante cinco minutos y luego enfriando a temperatura ambiente (293,15 K). Luego de cinco minutos con estas condiciones, se repitió el calentamiento y se registró nuevamente el perfil de desnaturalización. El grado de reversibilidad del proceso de desnaturalización se calculó como la relación entre las entalpías del segundo y primer calentamiento.
Para evaluar el efecto de los polioles sobre el proceso de desnaturalización de la proteína, se preparó una soluciónbuffer de fosfato 10 mM pH 6,5 a partir de soluciones de NaHPO4 10 mM y NaH2PO4 10 mM a la cual se adicionaron cantidades pesadas de los cosolutos seleccionados, utilizando una balanza Precisa con una precisión de 1x10-5 g. Posteriormente se disolvieron 2,00 mg de proteína en las soluciones hasta lograr las concentraciones de proteína deseadas.
La obtención de las curvas de desnaturalización de la proteína disuelta en buffer y en las soluciones de polioles se realizó utilizando un espectrofotómetro de doble haz UV-VIS Lambda 20, con un sistema de control de temperatura Peltier y una precisión de 0,1 K. El seguimiento de la desnaturalización se realizó siguiendo la variación de la absorbancia de la muestra a 281,0 nm. Para todos los experimentos se utilizó una rampa de temperatura de 1,0 K/min.
Teniendo en cuenta la información reportada en literatura y los resultados obtenidos en este trabajo, la desnaturalización puede presentarse como un proceso entre dos estados: un estado nativo y un estado desnaturalizado. Los parámetros de desnaturalización de la proteína en buffer y en las soluciones de polioles a diferentes concentraciones se obtuvieron ajustando los datos experimentales de absorbancia a 281 nm en función de la temperatura a las ecuaciones:


En donde Y es la absorbancia observada a la temperatura T (K). YN0 y YD0 son los valores de la absorbancia para la forma nativa y la forma desdoblada, respectivamente, calculados a partir de los intercep-tos de la región lineal de la curva de ab-sorbancia en función de La temperatura. mN y mD se refieren a las pendientes correspondientes a la variación lineal de la absorbancia con la temperatura para los estados nativo y desnaturalizado. ΔG0 es la energía libre de Gibbs de desnaturalización y ΔH0(Tm) es la entalpia de desnaturalización a la temperatura media de desnaturalización, Tm. La capacidad calorífica de desnaturalización, ΔCp, se considera constante en el rango de temperatura de estudio. El porcentaje de proteína desnaturalizada se calculó con la ecuación [3]:
Para establecer la reversibilidad del proceso se utilizó la ecuación [4]:
Donde ΔH10 (Tm ) es la entalpia de desnaturalización que se calcula a partir del primer calentamiento de la muestra, y ΔH20 (Tm ) es la entalpia que se obtiene al someter la misma muestra a un segundo calentamiento después de haber estado cinco minutos a la temperatura final de calentamiento.
RESULTADOS Y DISCUSIÓN
La dependencia de la temperatura media de desnaturalización y de la entalpía de desnaturalización con el pH de la holo-α-lactoalbúmina se muestra en la Figura 1. Se observa que a pH altamente ácido hay una considerable reducción de la estabilidad del estado nativo de la proteína, lo que se ve reflejado en una temperatura y entalpías de desnaturalización considerablemente inferiores si se les compara con los valores obtenidos alrededor de pH neutro, donde se observa poca variación de estos parámetros. Un comportamiento similar fue reportado por Griko y colaboradores (24). Con un pH alrededor del punto isoeléctrico de la proteína (pI = 4,2-4,8) (7, 25) no se pudieron obtener los perfiles de desnaturalización debido al alto grado de agregación que presenta la proteína al calentarse a estas condiciones.
Los efectos de la concentración de proteína, el pH y la temperatura final de calentamiento sobre la reversibilidad del proceso de desnaturalización, se muestran en la Figura 2. La temperatura final de calentamiento para el estudio de influencia del pH sobre la reversibilidad del proceso de desnaturalización fue de 353 K pues se observa que en el rango de pH estudiado, el proceso de desnaturalización es altamente reversible (>90%) si la temperatura final de calentamiento no sobrepasa los 353 K. Una notable disminución de la reversibilidad del proceso se observa cuando la temperatura final de calentamiento es mayor o igual a 363 K y si la concentración de proteína es mayor o igual a 0,32 mg/mL. Sin embargo, la reversibilidad del proceso es alrededor del 100% a temperaturas tan altas como 363 K si la concentración de proteína es de 0,13 mg/mL. En términos generales, el proceso de desnaturalización a todas las condiciones estudiadas es altamente reversible, sin embargo, se escogieron como condiciones para realizar el estudio de la influencia de los polioles, la menor concentración de proteína por poseer el mayor rango de reversibilidad y pH 6,5 por ser el pH que se obtiene al disolver la proteína en agua bidestilada.
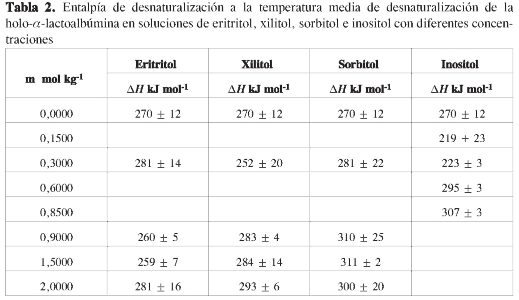
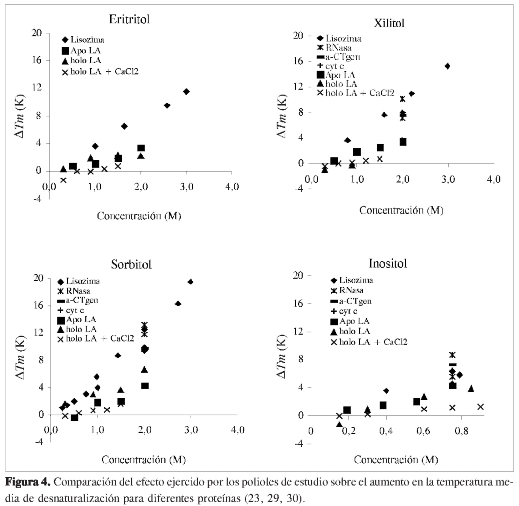
Los perfiles de desnaturalización obtenidos por espectroscopia UV se muestran en la Figura 3 y los parámetros de desnaturalización que se obtuvieron a partir de ellos se muestran en las Tablas 1 a 3. Los parámetros de desnaturalización de la holo-α-lactoalbúmina obtenidos en este trabajo, se encuentran en buen acuerdo con literatura, aunque son ligeramente inferiores a los obtenidos por otros autores en condiciones similares (pH = 6,5:Tm = 333 K, ΔH = 303 kJ mol-1) . En todos los casos y con concentraciones altas de los polioles, se observó un aumento en la temperatura de desnaturalización y un li gero incremento en la entalpía del proce so. Sin embargo, al comparar estos resultados con los obtenidos para otras proteí nas (Figura 4), se observa que el efecto que tienen estos polioles sobre la estabili dad de la holo-α-lactoalbúmina es considerablemente menor que los reportados para otras proteínas en varios trabajos (23, 29, 30).
Los resultados obtenidos muestran que el efecto ejercido por los polioles sobre la estabilidad de las proteínas no es independiente de la proteína en cuestión, sino que depende de la naturaleza y propiedades de la proteína misma. Kaushik y Bhat (19) sugieren que el grado de estabilización depende de factores intrínsecos de la proteína y particularmente de las características superficiales de la misma. Particularmente algunas teorías sugieren que la estabilización depende del cambio de volumen en el proceso de desnaturalización (26) y de la diferencia de superficie expuesta al solvente que existe entre la proteína desnaturalizada y la proteína en su estado nativo (27). Griko, Freire y Privalov (24) presentan evidencia de que en el estado desnaturalizado, la holo-α-lactoalbúmina se encuentra lejos de estar completamente desdoblada, lo cual podría explicar la menor estabilización que ejercen los polioles estudiados sobre esta proteína, a la luz de teorías como la del aumento de la tensión superficial y la de aglomeración (crowding), aunque esta última es difícilmente aplicable a sustancias de bajo peso molecular como los polioles aquí analizados (18). Otra posible explicación para este fenómeno, sería la exposición incompleta de los residuos del interior de la proteína en el estado desnaturalizado, debido a un estado desnaturalizado desdoblado solo parcialmente, lo cual produciría una menor interacción del poliol con estos residuos, afectando el grado de estabilización (20).
Sekhar y Prakash (28), estudiaron el comportamiento del parámetro de interacción preferencial de la lactoalbúmina nativa con sorbitol, glicerol y sacarosa y encontraron que estos cosolventes son preferencialmente excluidos de la superficie de la lactoalbúmina en forma similar a como son excluidos del dominio de otras proteínas. A pesar de esto, en este trabajo se encontró que la estabilización ejercida por estas substancias sobre el estado nativo de la holo-α-lactoalbúmina bovina es menor que el presentado para otras proteínas (29, 30). Cabe mencionar que siendo la proteína tan sensible al medio, las diferencias en las condiciones experimentales entre el estudio mencionado y el presente trabajo pueden representar una razón adicional para las diferencias encontradas.
Las hipótesis planteadas para explicar las observaciones aquí descritas no son excluyentes y podrían ser complementarias; sin embargo, para su comprobación se necesita una descripción experimental detallada de la estructura de las proteínas en su estado desnaturalizado, la cual hasta la fecha no se ha podido realizar, principalmente debido a la naturaleza misma de este estado y a que las técnicas disponibles requerirían concentraciones de proteína cuyo proceso de agregación interferiría con los resultados obtenidos.
AGRADECIMIENTOS
A Colciencias y a La Universidad Nacional de Colombia, sede Bogotá, por su soporte financiero, y a la Universidad Nacional de Colombia, sede Manizales, por facilitar el equipo en el que se realizaron las determinaciones.
REFERENCIAS BIBLIOGRÁFICAS
1. Eigelet, W. N.; Butler, J. E.; Ernstrom, C. A.; Farrell, H.M. Jr.; Harwalkar, V. R.; Jenness, R.; McL. Whitney, R. Nomenclature of proteins of cow's milk: fifth revision. J. Dairy Sci. 1984. 67 (8): 1599-1631.
2. Ye, X.; Yoshida, S.; Ng, T. B. Isolation of lactoperoxidase, lactofe-rrin, alpha-lactalbumin, ß-lactoglobulin B and ß-lactoglobulin A from bovine rennet whey using ion exchange chromatography. Int. J. Biochem. Cell Biol. 2000. 32 (11-12): 1143-1150.
3. Hakansson, A.; Svensson, M.; Mossberg, A. K.; Sabharwal, H.; Linse, S.; Lazou, I.; Lõnnerdal, B.; Svanborg, C. A folding variant of alpha-lactalbumin with bactericidal activity against Streptococcus pneumo-niae. Mol. Microbiol. 2000. 35 (3): 589-600.
4. Svensson, M.; Fast, J.; Mossberg, A. K.; Düringer, C.; Gustafsson, L.; Hallgren, O.; Brooks, C. L.; Berliner, L.; Linse, S.; Svanborg, C. Alpha-Lactalbumin unfolding is not sufficient to cause apoptosis, but is required for the conversion to HAMLET (human alpha-lactalbumin made lethal to tumor cells). Protein Sci. 2003. 12(12): 2794-2804.
5. McGuffey, M. K. Thermal Stability of a-Lactalbumin. Ph. D. thesis, North Carolina State University, Raleigh, 2004, p. 141.
6. Slangen, C. J.; Visser, S. Use of mass spectrometry to rapidly characterize the heterogeneity of bovine a-Lactalbumin. J. Agric. Food Chem.1999. 47 (11): 4549-4556.
7. Van der Ven, C. Biochemical and functional characterization of casein and whey protein hydrolysates. Ph. D. thesis, Wageningen Universiteit, The Netherlands, 2002, p. 155.
8. Permyakov, E. A.; Berlinerb, L. J. alpha-Lactalbumin: structure and function. FEBS Lett. 2000. 473 (3): 269-274.
9. Hendrix, T.; Griko, Y. V.; Privalov, P. L. A calorimetric study of the influence of calcium on the stability of bovine alpha-lactalbumin. Biophys. Chem.2000. 84 (1): 27-34.
10. Relkin, P.; Eynard, L; Launay, B. Thermodynamic parameters of ß-Lactoglobulin and alpha-Lactalbumin. A DSC study of denaturation by heating. Thermochim. Acta1992. 204 (1): 111-121.
11. Navea, S.; de Juan, A.; Tauler, R. Detection and resolution of intermediate species in protein folding processes using fluorescence and circular dichroism spectroscopies and multivariate curve resolution anal. Chem.2002, 74 (23): 6031-6039.
12. Gerlsma, S. Y. The Effects of Polyhydric and Monohydric Alcohols on the Heat Induced Reversible Denaturation of Chymotrypsinogen A. Eur. J. Biochem. (1970). 14(1): 150-153.
13. Haque, I.; Singh, R.; Moosavi-Movahedi, A. A.; Ahmad, F. Effect of polyol osmolytes on DeltaGD, the Gibbs energy of stabilisation of proteins at different pH values. Biophys. Chem.2005. 117 (1): 1-12.
14. Auton, M.; Ferreon, A. C. M.; Bolen, D. W. Metrics that differentiate the origins of Osmolyte effects on protein stability: A test of the surface tension proposal. J. Mol. Biol.2006. 361 (5): 983-992.
15. Romero, C. M.; Lozano, J. M.; Sancho, J.; Giraldo, G. I. Thermal stability of ß-lactoglobulin in the presence of aqueous solution of alcohols and polyols. Int. J. Biol. Macromol. 2007. 40 (5): 423-428.
16. Timasheff, S. N. Fifty years of solvent denaturation: John A. Schellman. Biophys. Chem.2002. 96 (2-3): 91-101.
17. Xie, G.; Timasheff, S. N. Mechanism of the stabilization of ribonuclease A by sorbitol: preferential hydration is greater for the denatured than for the native protein. Protein Sci. 1997. 6(1): 211-221.
18. Davis-Searles, P. R.; Saunders, A. J.; Erie, D. A.; Winzor, D. J.; Pielak, G. J. Interpreting the effects of small uncharged solutes on protein folding equilibria. Annu. Rev. Biophys. Biomol. Struct.2001. 30: 271-306.
19. Kaushik, J.; Bhat, R. Thermal stability of proteins in aqueous polyol solutions: Roleofthesurfacetensionof water in the stabilizing effect of polyols. J. Phys. Chem. B.1998 102 (36): 7058-7066.
20. Xie, G.; Timasheff, S. N. The thermodynamic mechanism of protein stabilization by Trehalose. Biophys. Chem.1997. 64 (1-3): 25-43.
21. Wetlaufer, D. B. Osmometry and general characterization of alpha-lac-talbumin. C.R. Trav. Lab. Carlsberg.1961. 32: 125-138.
22. Cooper, A. En: Protein: A Comprehensive Treatise. G. Allen. Ed. 1999. pp. 217-270.
23. Apenten, R. K. O. Thermodynamic parameters for 3-state thermal dena-turation of human and bovine a-lac-talbumin. Thermochim. Acta1995. 262: 1-12.
24. Griko, Y. V.; Freire, E.; Privalov, P. L. Energeticofthea-Lactalbumin states: a calorimetric and statistical thermodynamic study. Biochem.1994. 33 (7): 1889-1899.
25. Relkin, P.; Launay, B.; Eynard, L. Effect of sodium and calcium adition on thermal denaturation of apo-alpha-lactaalbumin: a differential scanning calorimetric study. J. Dairy Sci.1993. 76(1): 36-47.
26. Lee, J. C.; Timasheff, S. N. Thesta-bilization of proteins by sucrose. J. Biol Chem.1981. 256 (1): 7193-7201.
27. Cioci, F.; Lavecchia, R.; Marrelli, L. Effect of surface tension on the conformational stability of erythrocyte carbonic anhydrase. Fluid Phase Equilib. 1996. 116 (1-2): 118-125.
28. Sekhar, G.; Prakash, V. Interaction of selected cosolvents with Bovine alpha-Lactalbumin. Int. J. Biol. Macromol. 2008. 42 (4): 348-355.
29. Fujita, Y.; Iwasa, Y.; Noda, Y. The effect of polyhydric alcohols on the thermal denaturation of lysozyme as measured by differential scanning calorimetry. Bull. Chem. Soc. Jpn. 1982. 55 (5): 1896-1990.
30. Wimmer, R.; Olsson, M.; Neves, M. T.; Hatti-Kaul, R.; Petersen, S. B.; Müller, N. Towards a molecular level understanding of protein stabilization: the interaction between lysozyme and sorbitol. J. Biotechnol. 1997. 55 (2): 85-100.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).