Cáncer y terapéutica con productos de la colmena: Revisión sistemática de los estudios experimentales
Cancer therapy with bee products. Systematic review of experimental studies
Palabras clave:
Cáncer (Neoplasias), Apiterapia, Veneno de abejas, Miel (es)Neoplasms, Apitherapy, Bee Venoms, Honey (en)
Antecedentes. Los productos de la colmena se han utilizados desde hace más de dos milenios con fines terapéuticos. Conceptos teóricos basados en la composición de los productos hacen pensar que podrían ser de utilidad en el manejo del cáncer.
Objetivo. Resumir la evidencia experimental disponible en la actualidad sobre el uso de los productos de la colmena en el manejo del cáncer.
Material y métodos. Se realizó una revisión sistemática de los estudios experimentales publicados a través de las bibliotecas digitales PUBMED, LiLACS y OVID en los cuales se evaluara la utilidad del uso de los distintos productos de la colmena sobre cultivos de células tumorales o sobre modelos animales de cáncer. Se realizó un análisis cualitativo de la información y se construyeron tablas de resumen.
Resultados. La búsqueda arrojó un total de 391 resultados de los cuales únicamente 55 cumplieron los criterios de inclusión. El veneno de abejas, la miel y el propóleo son los productos con un mayor número de publicaciones. La mayoría son estudios in vitro y son pocos los modelos en animales realizado. Se describen los mecanismos de acción a través de los cuales estos podrían llegar a ejercer acciones farmacológicas útiles en el manejo del cáncer.
Conclusión. La aplicación de los productos de la colmena en el cáncer es un campo incipiente pero prometedor de investigación. Existe evidencia experimental que documenta la plausibilidad biológica de este uso. Es necesario realizar modelos animales que permitan describir el comportamiento de los productos y documentar su seguridad y utilidad terapéutica en el cáncer.
Background. The beehive products have been used for more than two millennia with therapeutic purposes. Theoretical models based on the composition of products suggest that might be useful in cancer management. Objective. To summarize experimental evidence available to date on the use of beehive products in cancer management.
Methods. A systematic review of experimental studies published was performed through PUBMED, LILACS and OVID databases in which evaluate the usefulness of the beehive products on tumor cell cultures or animal models of cancer. A qualitative analysis of information was performed and summary tables were constructed.
Results. A total of 391 articles was founded of 55 met the inclusion criteria. Bee venom, honey and propolis are the products with a greater number of publications. Most are studies invitro and few animal models that have been made. Mechanisms of action through which they may come to exert pharmacological properties useful in cancer management were described.
Conclusion. Application of beehive products in cancer is a nascent but promising field of research. Experimental evidence documents biological plausibility of this application. Animal models are needed to help describe the behavior of products and document their safety and therapeutic use in cancer.
Investigación original
CÁNCER Y TERAPÉUTICA CON PRODUCTOS DE LA COLMENA. REVISIÓN SISTEMÁTICA DE LOS ESTUDIOS EXPERIMENTALES
Cancer therapy with bee products. Systematic review of experimental studies
Andrés Jagua-Gualdrón1
1 Médico Cirujano, Universidad Nacional de Colombia, Bogotá. Director del Grupo de Investigación en Desarrollo de fármacos y terapia con productos de la Colmena, Bee Venom Company, Bogotá D.C. Colombia. Salud Comunitaria, E.S.E. Hospital San Rafael de Fusagasugá.
Correspondencia: ajaguag@unal.edu.co
Recibido: 23/05/11/ Enviado a pares: 13/06/11/ Aceptado publicación: 31/05/12/
Resumen
Antecedentes. Los productos de la colmena se han utilizados desde hace más de dos milenios con fines terapéuticos. Conceptos teóricos basados en la composición de los productos hacen pensar que podrían ser de utilidad en el manejo del cáncer.
Objetivo. Resumir la evidencia experimental disponible en la actualidad sobre el uso de los productos de la colmena en el manejo del cáncer.
Material y métodos. Se realizó una revisión sistemática de los estudios experimentales publicados a través de las bibliotecas digitales PUBMED, LiLACS y OVID en los cuales se evaluara la utilidad del uso de los distintos productos de la colmena sobre cultivos de células tumorales o sobre modelos animales de cáncer. Se realizó un análisis cualitativo de la información y se construyeron tablas de resumen.
Resultados. La búsqueda arrojó un total de 391 resultados de los cuales únicamente 55 cumplieron los criterios de inclusión. El veneno de abejas, la miel y el propóleo son los productos con un mayor número de publicaciones. La mayoría son estudios in vitro y son pocos los modelos en animales realizado. Se describen los mecanismos de acción a través de los cuales estos podrían llegar a ejercer acciones farmacológicas útiles en el manejo del cáncer.
Conclusión. La aplicación de los productos de la colmena en el cáncer es un campo incipiente pero prometedor de investigación. Existe evidencia experimental que documenta la plausibilidad biológica de este uso. Es necesario realizar modelos animales que permitan describir el comportamiento de los productos y documentar su seguridad y utilidad terapéutica en el cáncer.
Palabras clave: Cáncer (Neoplasias), Apiterapia, Veneno de abejas, Miel (DeCS).
Summary
Background. The beehive products have been used for more than two millennia with therapeutic purposes. Theoretical models based on the composition of products suggest that might be useful in cancer management. Objective. To summarize experimental evidence available to date on the use of beehive products in cancer management.
Methods. A systematic review of experimental studies published was performed through PUBMED, LILACS and OVID databases in which evaluate the usefulness of the beehive products on tumor cell cultures or animal models of cancer. A qualitative analysis of information was performed and summary tables were constructed.
Results. A total of 391 articles was founded of 55 met the inclusion criteria. Bee venom, honey and propolis are the products with a greater number of publications. Most are studies invitro and few animal models that have been made. Mechanisms of action through which they may come to exert pharmacological properties useful in cancer management were described.
Conclusion. Application of beehive products in cancer is a nascent but promising field of research. Experimental evidence documents biological plausibility of this application. Animal models are needed to help describe the behavior of products and document their safety and therapeutic use in cancer.
Key words: Neoplasms, Apitherapy, Bee Venoms, Honey (MeSH).
Introducción
Los productos de la colmena (miel, propóleo, polen, jalea real, veneno de abejas) se han utilizado desde tiempos ancestrales con múltiples finalidades, entre otras, para el cuidado de las heridas, tos, artritis y esclerosis múltiple (1-3), esto se ha conocido como apiterapia. Su uso en el cáncer también ha sido descrito (3), aunque, como para muchos de los otros usos que se les da a los productos, los reportes son más bien anecdóticos.
La composición de estos productos se ha estudiado y, se han encontrado posibles mecanismos, a través de los cuales puedan ser útiles en el tratamiento de enfermedades.
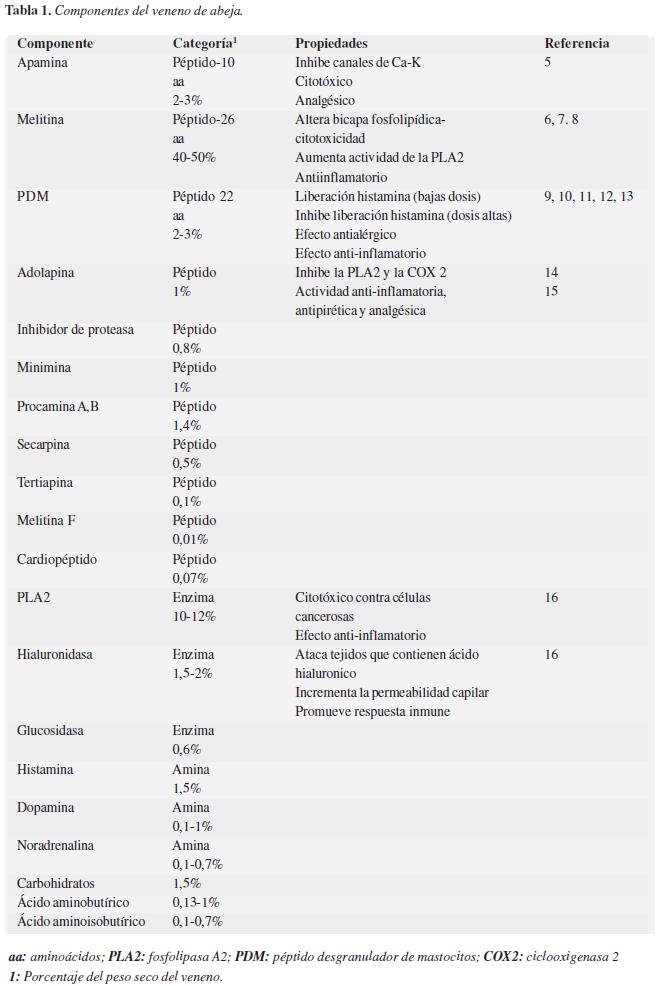
El veneno de abejas (VA) está compuesto por al menos 18 compuestos con actividad farmacológica incluyendo enzimas, péptidos y aminas biogénicas (4). La melitina, el péptido desgranulador de mastocitos y la apamina son los tres principales y más estudiados componentes del VA responsables de la mayor parte de los efectos analgésicos, antiinflamatorios y antineoplásicos del veneno. En la tabla número 1 se resumen los principales componentes del VA y las propiedades estudiadas de cada uno de ellos. Los modelos realizados en animales han permitido establecer que la aplicación del VA no produce alteraciones graves en las funciones corporales y, al contrario, posee actividades analgésicas y antinflamatorias (17-21). Su utilidad en enfermedades como la artritis reumatoide, artrosis y dolor crónico ya se ha descrito (22-24).
La miel de abejas es un fluido dulce y viscoso producto de la transformación enzimática que hacen las abejas del néctar de las flores. Está compuesta en su mayor proporción por carbohidratos (79%), agua (20%) y otros componentes como oligoelementos, proteínas, vitaminas, enzimas, antibióticos, entre otros (25, 26). Se ha estudiado su utilidad para el manejo de la tos, cuidado de las heridas y trastornos del colesterol (27-29).
El propóleo es una sustancia que las abejas producen trasformando las resinas que toman de los árboles. Se compone de resinas (50%), cera de abejas (30%), aceítes esenciales (5-10%), polen (5%) y otros materiales orgánicos como los flavonoides (5%) (30). El propóleo posee actividad antiinflamatoria, antioxidante y antibacterial (31-33). Tanto la miel como el propóleo varían en su composición según la región geográfica donde se encuentren. Lamentablemente este es un campo incipiente de investigación y existen vacios en el conocimiento de la composición de los productos.
La jalea real es un producto viscoso y es el alimento de las larvas jóvenes y la abeja reina. Está compuesta por agua, azúcares, proteínas, lípidos, aminoácidos, cenizas y vitaminas (34). La jalea real sensibiliza las células a la acción de la insulina y podría mejorar el perfil lipídico (35-37). El polen está compuesto por agua, glucosa y fructosa, proteínas, aminoácidos, lípidos, carotenoides y cenizas (38). Popularmente se utiliza como suplemento nutricional y en el manejo del estreñimiento.
El cáncer es la primera y segunda causa de muerte en los paises desarrollados y en vías de desarrollo (39). En Colombia cada año se presentan 223.3/100.000 casos en hombres y 212.9/100.000 en mujeres (40). Esta incidencia es similar a la incidencia calculada en todo el mundo (41).
A pesar de los avances que se han logrado en el tratamiento de los diferentes tipos de cáncer la búsqueda de nuevos y mejores medicamentos antineoplásicos continúa. Investigaciones recientes han generado gran interés por la exploración de venenos y productos de animales e insectos por sus potenciales aplicaciones en el tratamiento del cáncer (42), entre ellos, los productos de la colmena.
La información disponible en este campo es aun escasa y no se ha realizado ningún abordaje sistemático ni descriptivo. El objetivo de esta revisión es resumir y exponer la evidencia experimental de estudios invitro y en modelos animales acerca del uso de los productos de la colmena en el manejo y prevención del cáncer.
Material y métodos
Se realizó una revisión sistemática de la literatura con análisis cualitativo de los estudios encontrados.
Búsqueda de la información
Se realizó una búsqueda a través de las bibliotecas electrónicas PUBMED, LILAC y OVID de estudios publicados en idioma inglés y español, entre los años 2001 y 2011 utilizando las palabras clave MeSH: "apitherapy" AND "Cancer", "Bee Venom" AND "Cancer", "propolis" AND "Cancer", "honey" AND "Cancer", "Royal Jelly" AND "Cancer", "Bee pollen" AND "Cancer".
Criterios de inclusión
Se incluyeron los estudios experimentales realizados en cultivos celulares de cualquier linaje de células cancerosas y en modelos animales en los cuales se evaluara la utilidad de los productos de la colmena o de alguno de sus componentes (veneno de abejas, propóleo, jalea real, miel, polen de abejas) sobre el crecimiento celular, proliferación o aparición de metástasis.
Variables de estudio
Se tuvieron en cuenta: tipo de estudio (in vitro, modelo animal), linaje celular utilizado, producto evaluado (VA, miel, propóleo, jalea real, polen de abejas), efecto logrado (disminución del tamaño del tumor primario, disminución del número de metástasis, disminución del conteo celular, disminución de la viabilidad celular), año de publicación, mecanismo de acción estudiado.
Extracción, presentación y análisis de la información recolectada
La información se resumió construyendo una tabla que incluyó las variables de estudio ya mencionadas. Cuando en el artículo no se reportaba alguna de estas porque no era objetivo del estudio la casilla se rotuló como IND (información no disponible).
Criterios de exclusión
Se excluyeron los estudios en los cuales faltaran datos sobre el 50% o más de las variables de estudio (3 o más). Combinación del producto con alguna otra sustancia o inmunoconjugado.
Resultados
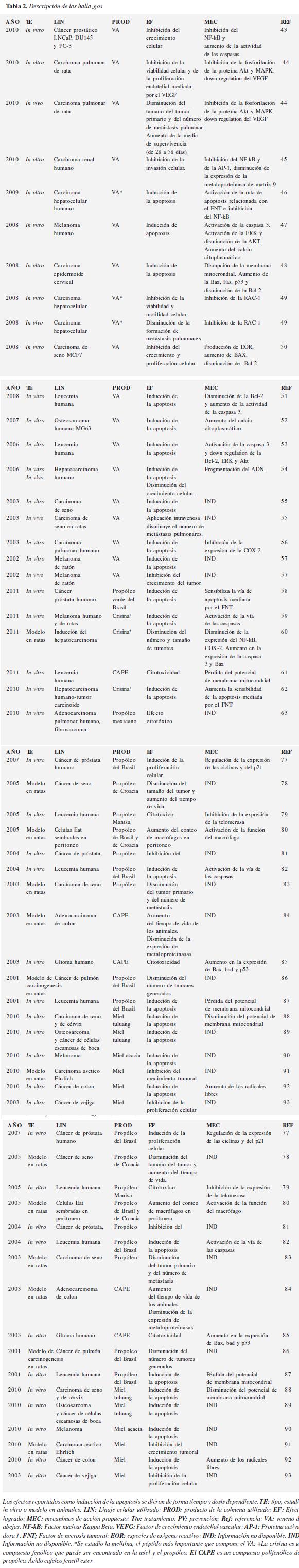
En esta sección se hace una descripción breve de los hallazgos por cada producto de la colmena. En total se incluyeron 62 estudios de los productos veneno de abejas, propóleo y miel de abejas. Se excluyeron 4 estudios por presentar información insuficiente y 1 por combinar el producto (propóleo) con otros medicamentos. No se encontraron artículos sobre jalea real y polen.
En todos los estudios se reportan efectos positivos del uso de los productos. En la tabla 2 se presentan la descripción, para cada estudio incluidas las variables.
Veneno de abejas
Se encontraron 191 resultados de estudios con VA. De ellos 19 cumplían con los criterios de inclusión, cuatro de ellos fueron excluidos por presentar información insuficiente. En cinco de los artículos se utilizaron técnicas in vivo y en modelos en ratas. Los demás estudios fueron con técnicas In vitro.
Los mecanismos de acción mencionados incluyen la inhibición del NF-kB (factor nuclear Kappa-Beta), aumento de la actividad de las caspasas, inhibición de proteínas quinasas y sensibilización de la ruta de apoptosis mediada por el factor de necrosis tumoral. A través de esto se logra la disminución del crecimiento celular y se induce la apoptosis. En los modelos animales se reporta la disminución del tamaño del tumor primario y del número de metástasis.
Propóleo
Se encontraron 156 resultados de los cuales 37 cumplían con los criterios de inclusión, 1 estudio fue excluido por combinarse el propóleo con otros medicamentos y cinco estudios no se pudieron conseguir.
Siete de estos estudios eran modelos en ratas. En ellos se reportó disminución del tamaño tumoral y del número de metástasis. Los mecanismos de acción estudiados fueron el aumento de proteínas proapoptóticas (bax, bad), alteraciones en el flujo de energía en la membrana mitocondrial, inhibición del NF-kB, disminución de la actividad de las metaloproteinasas y aumento de la actividad del macrófago.
Miel de abejas
La búsqueda arrojó 158 resultados de los cuales seis cumplían con los criterios de inclusión. De estos unos fueron modelo en ratas. La miel induce la apoptosis en los cultivos celulares. El único mecanismo estudiado fue la disminución del potencial de membrana mitocondrial.
Jalea real
Se encontraron 15 resultados ninguno de ellos cumplió con los criterios de inclusión.
Polen
La búsqueda arrojó 7 resultados ninguno de ellos cumplió los criterios de inclusión.
Discusión
La apiterapia es el uso terapéutico de los productos de las abejas, veneno de abejas, miel, polen, jalea real y propóleo. El origen histórico de la terapia es difícil de establecer aunque se reconoce que desde los comienzos de las civilizaciones los productos de la abeja eran empleados por sus propiedades curativas (94). Las aplicaciones incluyen el manejo de la artritis y la inflamación, artrosis, esclerosis múltiple, neuralgia e inflamación crónica (95-97).
El uso de los productos de la colmena en el tratamiento de las personas con cáncer constituye un campo creciente y relativamente nuevo de la investigación. La mayor parte de la información disponible en este campo del conocimiento proviene de relatos anecdóticos y de algunos estudios experimentales en el laboratorio. Esta revisión sistemática agrupó los estudios experimentales y es la primera aproximación sistemática que se hace de este tema.
Efectos reportados y mecanismos de acción
La mayoría de los estudios identificados e incluidos a través de esta revisión desarrollaron modelos in vitro. En ellos se establecieron mecanismos de acción a través de los cuales el veneno de abejas, propóleo y miel de abejas ejercen sus acciones antineoplasicas sobre diferentes cultivos celulares. Estos productos inducen la muerte celular a través de la inhibición del NF-kB, aumento de la actividad de las caspasas, inhibición de proteínas quinasas relacionadas con la señal de supervivencia celular, aumento en la expresión de proteínas de la apoptosis, alteraciones en el flujo energético en la mitocondria y sensibilización de la acción del factor de necrosis tumoral.
Los mecanismos de acción con los cuales se explica la acción de los tres productos de la colmena (veneno de abejas, miel, propóleo) contra las células neoplásicas son congruentes con las teorías científicas aceptadas en la actualidad. La activación sostenida del NF-kB se ha relacionado con alteraciones en la trascripción de genes relacionados con la inflamación y la pérdida del control del crecimiento y proliferación celular en el cáncer (98). Las alteraciones en el potencial de la membrana de la mitocondria, la activación de las caspasas y el aumento en los niveles de proteínas proapoptóticas como la bax y bad conducen a la muerte de las células neoplásicas (99) y son mecanismos mediante los cuales actúan nuevos medicamentos estudiados en la actualidad para el tratamiento del cáncer (100, 101).
El concepto de causalidad
La búsqueda de la causa de las enfermedades es una tarea que ha desarrollado la humanidad durante toda su historia. En principio el concepto de causalidad estuvo ligado a lo mágico-religioso (102). El concepto de causalidad ha pasado por el paradigma de miasma, teoría de gérmenes y la caja negra (103).
En la actualidad el concepto de causalidad se encuentra inmerso en el paradigma de la caja negra, el modelo de las causas suficientes y necesarias, el desenlace potencial, las causas múltiples y la estadística bayesiana (104-108).
Los criterios de causalidad son una herramienta a través de la cual se hace una aproximación práctica al concepto de causa desde el marco del paradigma vigente (109). Los criterios de Bradford Hill son utilizados en la actualidad para la aplicación práctica del concepto de causalidad en medicina e incluyen: fuerza de la asociación, consistencia, especificidad, temporalidad, relación dosis respuesta, plausibilidad biológica, coherencia, experimentación y analogía (110).
A través de esta revisión se ha tratado de acceder al criterio de causalidad de plausibilidad biológica y consistencia. El cuerpo de evidencia reunido muestra la posibilidad de la acción de los productos de la colmena, especialmente el veneno de abejas y propóleo en células neoplásicas. La ausencia de estudios que no reporten efectos de los productos de la colmena sobre cultivos celulares o en modelos animales podría ser debido o bien a que se cumple el criterio de consistencia (muchos autores repiten las observaciones) o bien a un sesgo de publicación.
Limitaciones y futuros estudios
Las limitaciones de esta revisión son haber incluido únicamente estudios en dos idiomas y no haber realizado un análisis estadístico de la información; no obstante, la homegeneidad y el tipo de diseño incluido dificultaban esta aproximación. Se deben desarrollar más modelos animales y, en el futuro, ensayos clínicos en humanos de la fase I a la IV para demostrar su seguridad y eficacia.
El veneno, el propóleo y la miel de abejas ejercen efectos antineoplásicos en cultivos celulares y modelos en ratas y existe un sustento de los mecanismos de acción a través de los cuales se logran estos efectos. En su conjunto estos estudios constituyen una importante evidencia de la plausibilidad biológica del uso del VA, el propóleo y la miel de abejas en el cáncer.
Referencias
1. Beck BF. Bee venom therapy; bee venom, its nature and its effect on arthritis and rheumatoid conditions, p. 197, Appleton-Century Croft, New York. 1935.
2. Caldwell JR. Venoms, copper and zinc in the treatment of arthritis. Rheum Dis Clin North Am. 1999; 25: 919-28.
3. Hellner M, Winter D, Von Georgi R, Münstedt K. Apitherapy: usage and experience in german beekeepers. Evid Based Complement Alternat Med. 2008; 5: 475-79.
4. Vick JA, Shipman WH. Effects of whole bee venom and its fractions (apamin and mellitin) on plasma cortisol levels in the dog. Toxicon. 1972; 10:377-80.
5. Banks BE, Brown C, Burgess GM, Burnstock G, Claret M, Cocks TM, et al. Apamin blocks certain neurotransmitter-induced increases in potassium permeability. Nature. 1979; 282:415-17.
6. Shier WT. Activation of high levels of endogenous phospholipase A2 in cultured cells. Proc Natl Acad Sci USA. 1979; 76:195-99.
7. Lad PJ, Shier WT. Activation of microsomal guanylate cyclase by a cytotoxic polypeptide: melittin. Biochem Biophys Res Commun. 1979; 89:315-21.
8. Terwilliger TC, Eisenberg D. The structure of melittin: II. Interpretation of the structure. J Biol Chem. 1982; 257:6016-22.
9. Habermann E. Bee and wasp venoms. Science. 1972; 177:314-22.
10 Buku A, Condie BA, Price JA, Mezei M. Ala12]MCD peptide: a lead peptide to inhibitors of immunoglobulin E binding to mast cell receptors. J Pept Res. 2005; 66:132-7.
11. Buku A. Mast cell degranulating peptide: a prototypic peptide in allergy and inflammation. Peptides. 1999; 20: 215-30.
12. Buku A, Price JA, Mendlawitz M, Masur S. Mast cell degranulating peptide binds to RBL-2H3 mast cell receptors and inhibits IgE binding. Peptides. 2001; 22: 1993-8.
13. Billingham MEJ, Marley J, Hanson JM, Shipolini EA, Vernon CA. An anti-inflammatory peptide from bee venom. Nature. 1973; 245:163-64.
14. Shkenderov S, Koburova K. Adolapin-a newly isolated analgetic and anti-inflammatory polypeptide from bee venom. Toxicon 1982; 20: 317-321.
15. Koburova KL, Michailova SG, Shkenderov ASV. Further investigation on the anti-inflammatory properties of adolapin-bee venom polypeptide. Cta Physiol Pharmacol Bulg. 1985; 11:50-5.
16. Son DJ, Lee JW, Lee YH, Song HS, Lee CK, Hong JT. Therapeutic application of anti-arthritis, pain-releasing, and anti-cancer effects of bee venom and its constituent compounds. Pharmacol Ther. 2007; 115: 246-70.
17. Kim HW, Kwon yb, Ham TW, Roh DH, Yoon SY, Kang SY, et ál. General pharmacological profiles of bee venom and its water soluble fractions in rodent models. J Vet Sci. 2004; 5:309-18.
18. Yoon SY, Kim HW, Roh DH, Kwon YB, Jeon TO, Han HJ, et ál. The anti-inflammatory effect of peripheral bee venom stimulation is mediated by central muscarinic type 2 receptors and activation of sympathetic preganglionic neurons. Brain Res. 2005; 1049: 210-16.
19. Kwon YB, Yoon SY, Kim HW, Roh DH, Kang SY, Ryu YN, et ál. Substancial role of locus coeruleus-noradrenergic activation and capsaicin-insensitive primary afferent fibbers in bee venom´s antiinflammatory effect. Neurosci Res. 2006; 55:197-203.
20. Yoon SY, Kwon YB, Kim HW, Roh DH, Seo HS, Han HJ, et ál. Peripheral bee venom´s anti-inflammatory effect involves activation of the coeruleospinal pathway and sympathetic preganglionic neurons. Neurosci Res. 2007; 59:51-9.
21. Park HJ, Lee SH, Son DJ, Oh KW, Kim KH, Song HS, et ál. Antiarthritic effect of bee venom inhibition of inflammation mediator generation by suppression of NF-kappaB through interaction with the p50 subunit. Arthritis Rheum. 2004; 50: 3504-15.
22. Li J, Ke T, He C, Cao W, Wei M, Zhang L, et ál. The anti-arthritic effects of synthetic melittin on the complete Freund's adjuvant-induced rheumatoid arthritis model in rats. Am J Chin Med. 2010; 38:1039-49.
23. Lee MS, Pittler MH, Shin BC, Kong JC, Ernst E. Bee venom acupuncture for musculoskeletal pain: a review. J Pain. 2008; 9:289-97.
24. Kwon YB, Kim JH, Yoon JH, Lee JD, Han HJ, Mar WC, et al. The analgesic efficacy of bee venom acupuncture for knee osteoarthritis: a comparative study with needle acupuncture. Am J Chin Med. 2001; 29: 187-99.
25. Ruiz-Matute AI, Weiss M, Sammataro D, Finely J, Sanz ML. Carbohydrate composition of high-fructose corn syrups (HFCS) used for bee feeding: effect on honey composition. J Agric Food Chem. 2010; 58: 7317-22.
26. Bogdanov S, Jurendic T, Sieber R, Gallmann P. Honey for nutrition and health: a review. J Am Coll Nutr. 2008; 27:677-89.
27. Shadkam MN, Mozaffari-Khosravi H, Mozayan MR. A comparison of the effect of honey, dextromethorphan, and diphenhydramine on nightly cough and sleep quality in children and their parents. J Altern Complement Med. 2010; 16:787-93.
28. Song JJ, Salcido R. Use of honey in wound care: an update. Adv Skin Wound Care. 2011; 24:40-4.
29. Münstedt K, Hoffmann S, Hauenschild A, Bülte M, Von Georgi R, Hackethal A. Effect of honey on serum cholesterol and lipid values. J Med Food. 2009; 12:624-28.
30. Teixeira EW, Message D, Negri G, Salatino A, Stringheta PC. Seasonal Variation, Chemical Composition and Antioxidant activity of Brazilian Propolis Samples. Evid Based Complement Alternat Med. 2010; 7:307-15.
31. Kayaoglu G, Omürlü H, Akca G, Gürel M, Gençay O, Sorkun K, et ál. Antibacterial Activity of Propolis versus Conventional Endodontic Disinfectants against Enterococcus faecalis in Infected Dentinal Tubules. J Endod. 2011; 37:376-81.
32. Hu F, Hepburn HR, Li Y, Chen M, Radloff SE, Daya S. Effects of ethanol and water extracts of propolis (bee glue) on acute inflammatory animal models. J Ethnopharmacol. 2005; 100:276-83.
33. Fonseca YM, Marquele-Oliveira F, Vicentini FT, Furtado NA, Sousa JP, Lucisano-Valim YM, et ál. Evaluation of the Potential of Brazilian Propolis against UV-Induced Oxidative Stress. Evid Based Complement Alternat Med. 2011; 2011:863-917.
34. Broto P. Composición y propiedades de la jalea real. Disponible desde url http://exa.unne.edu.ar/bioquimica/inmunoclinica/documentos/composicion_propiedades_Jalea_Real.pdf (consultada el 1 de marzo del 2011).
35. Münstedt K, Bargello M, Hauenschild A. Royal jelly reduces the serum glucose levels in healthy subjects. J Med Food. 2009; 12:1170-72.
36. Zamami Y, Takatori S, Goda M, Koyama T, Iwatani Y, Jin X, Takai-Doi S, Kawasaki H. Royal jelly ameliorates insulin resistance in fructose-drinking rats. Biol Pharm Bull. 2008; 31:2103-07.
37. Guo H, Saiga A, Sato M, Miyazawa I, Shibata M, Takahata Y, et ál. Royal jelly supplementation improves lipoprotein metabolism in humans. J Nutr Sci Vitaminol. 2007; 53:345-48.
38. Del Risco Rios CA. Polen-Pan de Abejas: Composición, Nutrición, Acción en la Salud Humana y Microbiología. Disponible desde URL http://www.culturaapicola.com.ar/apuntes/alimentacion/35_polen_pan_de_abejas.pdf (Consultada el 28 de febrero del 2011).
39. World Health Organization. The global burden of disease: 2004 update. Geneva: World Health Organization; 2008.
40. Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin 2011. En prensa.
41. Piñeros M, Murillo RH. Incidencia de cáncer en Colombia: Importancia de las fuentes de información en la obtención de cifras estimativas. Revista Colombiana de Cancerologia. 2004; 8:5-14.
42. Lewis RJ, Garcia ML. Therapeutic potential of venom peptides. Nat Rev Drug Discov. 2003; 2:790- 802.
43. Park MH, Choi MS, Kwak DH, Oh KW, Yoon DY, Han SB, et ál. Anti-cancer effect of bee venom in prostate cancer cells through activation of caspase pathway via inactivation of NF-êB. Prostate 2010. En prensa.
44. Huh JE, Baek YH, Lee MH, Choi DY, Park DS, Lee JD. Bee venom inhibits tumor angiogenesis and metastasis by inhibiting tyrosine phosphorylation of VEGFR-2 in LLC-tumor-bearing mice. Cancer Lett. 2010; 292:98-110.
45. Park JH, Jeong YJ, Park KK, Cho HJ, Chung IK, Min KS, et ál. Melittin suppresses PMA-induced tumor cell invasion by inhibiting NF-kappaB and AP-1-dependent MMP-9 expression. Mol Cells. 2010; 29: 209-15.
46. Wang C, Chen T, Zhang N, Yang M, Li B, Lü X, et ál. Melittin, a major component of bee venom, sensitizes human hepatocellular carcinoma cells to tumor necrosis factor-related apoptosis-inducing ligand (TRAIL)-induced apoptosis by activating CaMKIITAK1- JNK/p38 and inhibiting IkappaBalpha kinase- NFkappaB. J Biol Chem. 2009; 284:3804-13.
47. Tu WC, Wu CC, Hsieh HL, Chen CY, Hsu SL. Honeybee venom induces calcium-dependent but caspase- independent apoptotic cell death in human melanoma A2058 cells. Toxicon. 2008; 52:318-29.
48. Ip SW, Wei HC, Lin JP, Kuo HM, Liu KC, Hsu SC, et ál. Bee venom induced cell cycle arrest and apoptosis in human cervical epidermoid carcinoma Ca Ski cells. Anticancer Res. 2008; 28:833-42.
49. Liu S, Yu M, He Y, Xiao L, Wang F, Song C, et ál. Melittin prevents liver cancer cell metastasis through inhibition of the Rac1-dependent pathway. Hepatology. 2008; 47:1964-73.
50. Ip SW, Liao SS, Lin SY, Lin JP, Yang JS, Lin ML, et ál. The role of mitochondria in bee venom-induced apoptosis in human breast cancer MCF7 cells. In Vivo. 2008; 22:237-45.
51. Moon DO, Park SY, Choi YH, Kim ND, Lee C, Kim GY. Melittin induces Bcl-2 and caspase-3-dependent apoptosis through downregulation of Akt phosphorylation in human leukemic U937 cells. Toxicon. 2008; 51:112-120.
52. Chu ST, Cheng HH, Huang CJ, Chang HC, Chi CC, Su HH, et ál. Phospholipase A2-independent Ca2+ entry and subsequent apoptosis induced by melittin in human MG63 osteosarcoma cells. Life Sci. 2007; 80:364- 69.
53. Moon DO, Park SY, Heo MS, Kim KC, Park C, Ko WS, et ál. Key regulators in bee venom-induced apoptosis are Bcl-2 and caspase-3 in human leukemic U937 cells through downregulation of ERK and Akt. Int Immunopharmacol. 2006; 6:1796-1807.
54. Hu H, Chen D, Li Y, Zhang X. Effect of polypeptides in bee venom on growth inhibition and apoptosis induction of the human hepatoma cell line SMMC-7721 invitro and Balb/c nude mice in-vivo. J Pharm Pharmacol. 2006; 58: 83-9.
55. Orsoliae N, Sver L, Verstovsek S, Terzae S, Basae I. Inhibition of mammary carcinoma cell proliferation in vitro and tumor growth in vivo by bee venom. Toxicon. 2003; 41:861-70.
56. Jang MH, Shin MC, Lim S, Han SM, Park HJ, Shin I, et ál. Bee venom induces apoptosis and inhibits expression of cyclooxygenase-2 mRNA in human lung cancer cell line NCI-H1299. J Pharmacol Sci. 2003; 91:95-104.
57. Liu X, Chen D, Xie L, Zhang R. Effect of honey bee venom on proliferation of K1735M2 mouse melanoma cells in-vitro and growth of murine B16 melanomas invivo. J Pharm Pharmacol. 2002; 54:1083-9.
58. Szliszka E, Zydowicz G, Janoszka B, Dobosz C, Kowalczyk-Ziomek G, Krol W. Ethanolic extract of Brazilian green propolis sensitizes prostate cancer cells to TRAIL-induced apoptosis. Int J Oncol. 2011; 38:941- 53.
59. Pichichero E, Cicconi R, Mattei M, Canini A. Chrysin-induced apoptosis is mediated through p38 and Bax activation in B16-F1 and A375 melanoma cells. Int J Oncol. 2011; 38:473-83.
60. Khan MS, Devaraj H, Devaraj N. Chrysin abrogates early hepatocarcinogenesis and induces apoptosis in N-nitrosodiethylamine-induced preneoplastic nodules in rats. Toxicol Appl Pharmacol. 2011; 252:85-94.
61. AvcÝ CB, Gündüz C, Baran Y, Sahin F, YÝlmaz S, Dogan ZO, et ál. Caffeic acid phenethyl ester triggers apoptosis through induction of loss of mitochondrial membrane potential in CCRF-CEM cells. J Cancer Res Clin Oncol. 2011; 137:41-7.
62. Li X, Wang JN, Huang JM, Xiong XK, Chen MF, Ong CN, et ál. Chrysin promotes tumor necrosis factor (TNF)-related apoptosis-inducing ligand (TRAIL) induced apoptosis in human cancer cell lines. Toxicol In Vitro 2010. En prensa.
63. Li F, Awale S, Tezuka Y, Kadota S. Cytotoxicity of constituents from Mexican propolis against a panel of six different cancer cell lines. Nat Prod Commun. 2010; 5:1601-6.
64. Lin WL, Liang WH, Lee YJ, Chuang SK, Tseng TH. Antitumor progression potential of caffeic acid phenethyl ester involving p75(NTR) in C6 glioma cells. Chem Biol Interact. 2010; 188:607-15.
65. Seda Vatansever H, Sorkun K, Ismet Deliloðlu Gurhan S, Ozdal-Kurt F, Turkoz E, Gencay O, et ál. Propolis from Turkey induces apoptosis through activating caspases in human breast carcinoma cell lines. Acta Histochem. 2010; 112:546-56.
66. Popolo A, Piccinelli LA, Morello S, Cuesta-Rubio O, Sorrentino R, Rastrelli L, et ál. Antiproliferative activity of brown Cuban propolis extract on human breast cancer cells. Nat Prod Commun. 2009; 4:1711-16.
67. Li F, Awale S, Tezuka Y, Kadota S. Cytotoxic constituents of propolis from Myanmar and their structure- activity relationship. Biol Pharm Bull. 2009; 32: 2075-8.
68. Szliszka E, Czuba ZP, Bronikowska J, Mertas A, Paradysz A, Krol W. Ethanolic Extract of Propolis Augments TRAIL-Induced Apoptotic Death in Prostate Cancer Cells. Evid Based Complement Alternat Med 2009. En prensa.
69. Ishihara M, Naoi K, Hashita M, Itoh Y, Suzui M. Growth inhibitory activity of ethanol extracts of Chinese and Brazilian propolis in four human colon carcinoma cell lines. Oncol Rep. 2009; 22:349-54.
70. Szliszka E, Czuba ZP, Domino M, Mazur B, Zydowicz G, Krol W. Ethanolic extract of propolis (EEP) enhances the apoptosis- inducing potential of TRAIL in cancer cells. Molecules. 2009; 14:738-54.
71. Lee KW, Kang NJ, Kim JH, Lee KM, Lee DE, Hur HJ, et ál. Caffeic acid phenethyl ester inhibits invasion and expression of matrix metalloproteinase in SK-Hep1 human hepatocellular carcinoma cells by targeting nuclear factor kappa B. Genes Nutr. 2008; 2:319-22.
72. Chen MJ, Chang WH, Lin CC, Liu CY, Wang TE, Chu CH, et ál. Caffeic acid phenethyl ester induces apoptosis of human pancreatic cancer cells involving caspase and mitochondrial dysfunction. Pancreatology. 2008; 8:566-76.
73. Inoue K, Saito M, Kanai T, Kawata T, Shigematsu N, Uno T, et ál. Anti-tumor effects of watersoluble propolis on a mouse sarcoma cell line in vivo and in vitro. Am J Chin Med. 2008; 36:625-34.
74. Diaz-Carballo D, Freistã Hler M, Malak S, Bardenheuer W, Reusch HP. Mucronulatol from Caribbean propolis exerts cytotoxic effects on human tumor cell lines. Int J Clin Pharmacol Ther. 2008; 46: 226-35.
75. Li F, Awale S, Tezuka Y, Kadota S. Cytotoxic constituents from Brazilian red propolis and their structure- activity relationship. Bioorg Med Chem. 2008; 16: 5434-40.
76. Huang WJ, Huang CH, Wu CL, Lin JK, Chen YW, Lin CL, et ál. Propolin G, a prenylflavanone, isolated from Taiwanese propolis, induces caspasedependent apoptosis in brain cancer cells. J Agric Food Chem. 2007; 55:7366-76.
77. Li H, Kapur A, Yang JX, Srivastava S, McLeod DG, Paredes-Guzman JF, et ál. Antiproliferation of human prostate cancer cells by ethanolic extracts of Brazilian propolis and its botanical origin. Int J Oncol. 2007; 31:601-6.
78. Orsoliae N, Terziae S, Mihaljeviae Z, Sver L, Basiae I. Effects of local administration of propolis and its polyphenolic compounds on tumor formation and growth. Biol Pharm Bull. 2005; 28:1928-33.
79. Gunduz C, Biray C, Kosova B, Yilmaz B, Eroglu Z, Sahin F, et ál. Evaluation of Manisa propolis effect on leukemia cell line by telomerase activity. Leuk Res. 2005; 29:1343-6.
80. Orsoliae N, Kosalec I, Basiae I. Synergistic antitumor effect of polyphenolic components of water soluble derivative of propolis against Ehrlich ascites tumour. Biol Pharm Bull. 2005; 28:694-700.
81. Russo A, Cardile V, Sanchez F, Troncoso N, Vanella A, Garbarino JA. Chilean propolis: antioxidant activity and antiproliferative action in human tumor cell lines. Life Sci. 2004; 76:545-58.
82. Aso K, Kanno S, Tadano T, Satoh S, Ishikawa M. Inhibitory effect of propolis on the growth of human leukemia U937. Biol Pharm Bull. 2004; 27:727-30.
83. Orsoliae N, Sver L, Terziae S, Tadiae Z, Basiae I. Inhibitory effect of water-soluble derivative of propolis and its polyphenolic compounds on tumor growth and metastasizing ability: a possible mode of antitumor action. Nutr Cancer. 2003; 47:156-63.
84. Liao HF, Chen YY, Liu JJ, Hsu ML, Shieh HJ, Liao HJ, et ál. Inhibitory effect of caffeic acid phenethyl ester on angiogenesis, tumor invasion, and metastasis. J Agric Food Chem. 2003; 51:7907-12.
85. Lee YJ, Kuo HC, Chu CY, Wang CJ, Lin WC, Tseng TH. Involvement of tumor suppressor protein p53 and p38 MAPK in caffeic acid phenethyl ester-induced apoptosis of C6 glioma cells. Biochem Pharmacol. 2003; 66:2281-9.
86. Kimoto T, Koya-Miyata S, Hino K, Micallef MJ, Hanaya T, Arai S, et ál. Pulmonary carcinogenesis induced by ferric nitrilotriacetate in mice and protection from it by Brazilian propolis and artepillin C. Virchows Arch. 2001; 438:259-70.
87. Kimoto T, Aga M, Hino K, Koya-Miyata S, Yamamoto Y, Micallef MJ, et ál. Apoptosis of human leukemia cells induced by Artepillin C, an active ingredient of Brazilian propolis. Anticancer Res. 2001; 21: 221-8.
88. Fauzi AN, Norazmi MN, Yaacob NS. Tualang honey induces apoptosis and disrupts the mitochondrial membrane potential of human breast and cervical cancer cell lines. Food Chem Toxicol 2010. En prensa.
89. Ghashm AA, Othman NH, Khattak MN, Ismail NM, Saini R. Antiproliferative effect of Tualang honey on oral squamous cell carcinoma and osteosarcoma cell lines. BMC Complement Altern Med. 2010; 10: 49.
90. Pichichero E, Cicconi R, Mattei M, Muzi MG, Canini A. Acacia honey and chrysin reduce proliferation of melanoma cells through alterations in cell cycle progression. Int J Oncol. 2010; 37:973-81.
91. Jaganathan SK, Mondhe D, Wani ZA, Pal HC, Mandal M. Effect of honey and eugenol on Ehrlich ascites and solid carcinoma. J Biomed Biotechnol. 2010; 2010: 989163.
92. Jaganathan SK, Mandal M. Involvement of nonprotein thiols, mitochondrial dysfunction, reactive oxygen species and p53 in honey-induced apoptosis. Invest New Drugs. 2010; 28:624-33.
93. Swellam T, Miyanaga N, Onozawa M, Hattori K, Kawai K, Shimazui T, et ál. Antineoplastic activity of honey in an experimental bladder cancer implantation model: in vivo and in vitro studies. Int J Urol. 2003; 10:213-19.
94. Munstedt K, Hackethal A, Schimidt K. Bee venom therapy, bee venom acupuncture of apipunture: what is the evidence behind the various health claims?. Am Bee J. 2005; 145:665-8.
95. Hauser RA, Daguio M, Wester D, Hausser M, Kirchman A, Skinkis C. Bee-venom therapy for treating multiple sclerosis: A clinical tiral. Altern Complement Ther. 2001; 7:37-45.
96. Kwon YB, Lee JD, Lee HJ, Han HJ, Mar WC, Kang Sk, et ál. Bee venom injection into an acupuncture point reduces arthritis associated edema and nociceptive responses. Pain. 2001; 90:271-80.
97. Lee MS, Pittler MH, Shin BC, Kong JC, Ernst E. Bee venom acupuncture for musculoskeletal pain: a review. J Pain. 2008; 9:289-97.
98. Thu YM, Richmond A. NF-êB inducing kinase: a key regulator in the immune system and in cancer. Cytokine Growth Factor Rev. 2010; 21:213-26.
99. Verdin E, Hirschey MD, Finley LW, Haigis MC. Sirtuin regulation of mitochondria: energy production, apoptosis, and signaling. Trends Biochem Sci. 2010; 35:669-75.
100. George RE, Lahti JM, Adamson PC, Zhu K, Finkelstein D, Ingle AM, et ál. Phase I study of decitabine with doxorubicin and cyclophosphamide in children with neuroblastoma and other solid tumors: a Children's Oncology Group study. Peadiatr Blood Cancer. 2010; 55:629-38.
101. Cao X, Rodarte C, Zhang L, Morgan CD, Littlejohn J, Smythe WR. Bcl2/bcl-xL inhibitor engenders apoptosis and increases chemosensitivity in mesothelioma. Cancer Biol Ther. 2007; 6:246-52.
102. Coe R. Sociología de la medicina. Segunda edición. Madrid: editorial alianza. Páginas 218-251.
103. Susser M, Susser E. Choosing a future for epidemiology: I. Eras and paradigms. Am J Public Health. 1996; 86:668-73.
104. West S, Thoemmmes F. Campbells and rubins perspectives on causal inference. Psychol Methods. 2010; 15:18-37.
105. Kaufman JS, Poole C. Looking back on causal thinking in the health sciences. Annu Rev Public Health. 2000; 21:101-19.
106. Hafeman DM, Schwartz S. Opening the black box: a motivation for the assessment of mediation. Int J Epidemiol. 2009; 38:838-45.
107. Hofler M. Causal inference based on counterfactuals. BMC Med Res Methodol. 2005; 5:28.
108. Rothman KJ, Greenland S. Causation and causal inference in epidemiology. Am J Public Health. 2005; 95:S144-S150.
109. Weed DL. On the use of causal criteria. Int J Epidemiol. 1997; 26:1137-41.
110. Bradford Hill A. The environment and disease: association or causation?. Proc R Soc Med. 1965; 58: 295-300.
Referencias
Beck BF. Bee venom therapy; bee venom, its nature and its effect on arthritis and rheumatoid conditions, p. 197, Appleton-Century Croft, New York. 1935.
Caldwell JR. Venoms, copper and zinc in the treatment of arthritis. Rheum Dis Clin North Am. 1999; 25: 919-28.
Hellner M, Winter D, Von Georgi R, Münstedt K. Apitherapy: usage and experience in german beekeepers. Evid Based Complement Alternat Med. 2008; 5: 475-79.
Vick JA, Shipman WH. Effects of whole bee venom and its fractions (apamin and mellitin) on plasma cortisol levels in the dog. Toxicon. 1972; 10:377-80.
Banks BE, Brown C, Burgess GM, Burnstock G, Claret M, Cocks TM, et al. Apamin blocks certain neurotransmitter-induced increases in potassium permeability. Nature. 1979; 282:415-17.
Shier WT. Activation of high levels of endogenous phospholipase A2 in cultured cells. Proc Natl Acad Sci USA. 1979; 76:195-99.
Lad PJ, Shier WT. Activation of microsomal guanylate cyclase by a cytotoxic polypeptide: melittin. Biochem Biophys Res Commun. 1979; 89:315-21.
Terwilliger TC, Eisenberg D. The structure of melittin: II. Interpretation of the structure. J Biol Chem. 1982; 257:6016-22.
Habermann E. Bee and wasp venoms. Science. 1972; 177:314-22.
Buku A, Condie BA, Price JA, Mezei M. Ala12]MCD peptide: a lead peptide to inhibitors of immunoglobulin E binding to mast cell receptors. J Pept Res. 2005; 66:132-7.
Buku A. Mast cell degranulating peptide: a prototypic peptide in allergy and inflammation. Peptides. 1999; 20: 215-30.
Buku A, Price JA, Mendlawitz M, Masur S. Mast cell degranulating peptide binds to RBL-2H3 mast cell receptors and inhibits IgE binding. Peptides. 2001; 22: 1993-8.
Billingham MEJ, Marley J, Hanson JM, Shipolini EA, Vernon CA. An anti-inflammatory peptide from bee venom. Nature. 1973; 245:163-64.
Shkenderov S, Koburova K. Adolapin-a newly isolated analgetic and anti-inflammatory polypeptide from bee venom. Toxicon 1982; 20: 317-321.
Koburova KL, Michailova SG, Shkenderov ASV. Further investigation on the anti-inflammatory properties of adolapin-bee venom polypeptide. Cta Physiol Pharmacol Bulg. 1985; 11:50-5.
Son DJ, Lee JW, Lee YH, Song HS, Lee CK, Hong JT. Therapeutic application of anti-arthritis, pain-releasing, and anti-cancer effects of bee venom and its constituent compounds. Pharmacol Ther. 2007; 115: 246-70.
Kim HW, Kwon yb, Ham TW, Roh DH, Yoon SY, Kang SY, et ál. General pharmacological profiles of bee venom and its water soluble fractions in rodent models. J Vet Sci. 2004; 5:309-18.
Yoon SY, Kim HW, Roh DH, Kwon YB, Jeon TO, Han HJ, et ál. The anti-inflammatory effect of peripheral bee venom stimulation is mediated by central muscarinic type 2 receptors and activation of sympathetic preganglionic neurons. Brain Res. 2005; 1049: 210-16.
Kwon YB, Yoon SY, Kim HW, Roh DH, Kang SY, Ryu YN, et ál. Substancial role of locus coeruleus-noradrenergic activation and capsaicin-insensitive primary afferent fibbers in bee venom´s antiinflammatory effect. Neurosci Res. 2006; 55:197-203.
Yoon SY, Kwon YB, Kim HW, Roh DH, Seo HS, Han HJ, et ál. Peripheral bee venom´s anti-inflammatory effect involves activation of the coeruleospinal pathway and sympathetic preganglionic neurons. Neurosci Res. 2007; 59:51-9.
Park HJ, Lee SH, Son DJ, Oh KW, Kim KH, Song HS, et ál. Antiarthritic effect of bee venom inhibition of inflammation mediator generation by suppression of NF-kappaB through interaction with the p50 subunit. Arthritis Rheum. 2004; 50: 3504-15.
Li J, Ke T, He C, Cao W, Wei M, Zhang L, et ál. The anti-arthritic effects of synthetic melittin on the complete Freund's adjuvant-induced rheumatoid arthritis model in rats. Am J Chin Med. 2010; 38:1039-49.
Lee MS, Pittler MH, Shin BC, Kong JC, Ernst E. Bee venom acupuncture for musculoskeletal pain: a review. J Pain. 2008; 9:289-97.
Kwon YB, Kim JH, Yoon JH, Lee JD, Han HJ, Mar WC, et al. The analgesic efficacy of bee venom acupuncture for knee osteoarthritis: a comparative study with needle acupuncture. Am J Chin Med. 2001; 29: 187-99.
Ruiz-Matute AI, Weiss M, Sammataro D, Finely J, Sanz ML. Carbohydrate composition of high-fructose corn syrups (HFCS) used for bee feeding: effect on honey composition. J Agric Food Chem. 2010; 58: 7317-22.
Bogdanov S, Jurendic T, Sieber R, Gallmann P. Honey for nutrition and health: a review. J Am Coll Nutr. 2008; 27:677-89.
Shadkam MN, Mozaffari-Khosravi H, Mozayan MR. A comparison of the effect of honey, dextromethorphan, and diphenhydramine on nightly cough and sleep quality in children and their parents. J Altern Complement Med. 2010; 16:787-93.
Song JJ, Salcido R. Use of honey in wound care: an update. Adv Skin Wound Care. 2011; 24:40-4.
Münstedt K, Hoffmann S, Hauenschild A, Bülte M, Von Georgi R, Hackethal A. Effect of honey on serum cholesterol and lipid values. J Med Food. 2009; 12:624-28.
Teixeira EW, Message D, Negri G, Salatino A, Stringheta PC. Seasonal Variation, Chemical Composition and Antioxidant activity of Brazilian Propolis Samples. Evid Based Complement Alternat Med. 2010; 7:307-15.
Kayaoglu G, Omürlü H, Akca G, Gürel M, Gençay O, Sorkun K, et ál. Antibacterial Activity of Propolis versus Conventional Endodontic Disinfectants against Enterococcus faecalis in Infected Dentinal Tubules. J Endod. 2011; 37:376-81.
Hu F, Hepburn HR, Li Y, Chen M, Radloff SE, Daya S. Effects of ethanol and water extracts of propolis (bee glue) on acute inflammatory animal models. J Ethnopharmacol. 2005; 100:276-83.
Fonseca YM, Marquele-Oliveira F, Vicentini FT, Furtado NA, Sousa JP, Lucisano-Valim YM, et ál. Evaluation of the Potential of Brazilian Propolis against UV-Induced Oxidative Stress. Evid Based Complement Alternat Med. 2011; 2011:863-917.
Broto P. Composición y propiedades de la jalea real. Disponible desde url http://exa.unne.edu.ar/bioquimica/inmunoclinica/documentos/composicion_propiedades_Jalea_Real.pdf (consultada el 1 de marzo del 2011).
Münstedt K, Bargello M, Hauenschild A. Royal jelly reduces the serum glucose levels in healthy subjects. J Med Food. 2009; 12:1170-72.
Zamami Y, Takatori S, Goda M, Koyama T, Iwatani Y, Jin X, Takai-Doi S, Kawasaki H. Royal jelly ameliorates insulin resistance in fructose-drinking rats. Biol Pharm Bull. 2008; 31:2103-07.
Guo H, Saiga A, Sato M, Miyazawa I, Shibata M, Takahata Y, et ál. Royal jelly supplementation improves lipoprotein metabolism in humans. J Nutr Sci Vitaminol. 2007; 53:345-48.
Del Risco Rios CA. Polen-Pan de Abejas: Composición, Nutrición, Acción en la Salud Humana y Microbiología. Disponible desde URL http://www.culturaapicola.com.ar/apuntes/alimentacion/35_polen_pan_de_abejas.pdf (Consultada el 28 de febrero del 2011).
World Health Organization. The global burden of disease: 2004 update. Geneva: World Health Organization; 2008.
Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin 2011. En prensa.
Piñeros M, Murillo RH. Incidencia de cáncer en Colombia: Importancia de las fuentes de información en la obtención de cifras estimativas. Revista Colombiana de Cancerologia. 2004; 8:5-14.
Lewis RJ, Garcia ML. Therapeutic potential of venom peptides. Nat Rev Drug Discov. 2003; 2:790- 802.
Park MH, Choi MS, Kwak DH, Oh KW, Yoon DY, Han SB, et ál. Anti-cancer effect of bee venom in prostate cancer cells through activation of caspase pathway via inactivation of NF-êB. Prostate 2010. En prensa.
Huh JE, Baek YH, Lee MH, Choi DY, Park DS, Lee JD. Bee venom inhibits tumor angiogenesis and metastasis by inhibiting tyrosine phosphorylation of VEGFR-2 in LLC-tumor-bearing mice. Cancer Lett. 2010; 292:98-110.
Park JH, Jeong YJ, Park KK, Cho HJ, Chung IK, Min KS, et ál. Melittin suppresses PMA-induced tumor cell invasion by inhibiting NF-kappaB and AP-1-dependent MMP-9 expression. Mol Cells. 2010; 29: 209-15.
Wang C, Chen T, Zhang N, Yang M, Li B, Lü X, et ál. Melittin, a major component of bee venom, sensitizes human hepatocellular carcinoma cells to tumor necrosis factor-related apoptosis-inducing ligand (TRAIL)-induced apoptosis by activating CaMKIITAK1- JNK/p38 and inhibiting IkappaBalpha kinase- NFkappaB. J Biol Chem. 2009; 284:3804-13.
Tu WC, Wu CC, Hsieh HL, Chen CY, Hsu SL. Honeybee venom induces calcium-dependent but caspase- independent apoptotic cell death in human melanoma A2058 cells. Toxicon. 2008; 52:318-29.
Ip SW, Wei HC, Lin JP, Kuo HM, Liu KC, Hsu SC, et ál. Bee venom induced cell cycle arrest and apoptosis in human cervical epidermoid carcinoma Ca Ski cells. Anticancer Res. 2008; 28:833-42.
Liu S, Yu M, He Y, Xiao L, Wang F, Song C, et ál. Melittin prevents liver cancer cell metastasis through inhibition of the Rac1-dependent pathway. Hepatology. 2008; 47:1964-73.
Ip SW, Liao SS, Lin SY, Lin JP, Yang JS, Lin ML, et ál. The role of mitochondria in bee venom-induced apoptosis in human breast cancer MCF7 cells. In Vivo. 2008; 22:237-45.
Moon DO, Park SY, Choi YH, Kim ND, Lee C, Kim GY. Melittin induces Bcl-2 and caspase-3-dependent apoptosis through downregulation of Akt phosphorylation in human leukemic U937 cells. Toxicon. 2008; 51:112-120.
Chu ST, Cheng HH, Huang CJ, Chang HC, Chi CC, Su HH, et ál. Phospholipase A2-independent Ca2+ entry and subsequent apoptosis induced by melittin in human MG63 osteosarcoma cells. Life Sci. 2007; 80:364- 69.
Moon DO, Park SY, Heo MS, Kim KC, Park C, Ko WS, et ál. Key regulators in bee venom-induced apoptosis are Bcl-2 and caspase-3 in human leukemic U937 cells through downregulation of ERK and Akt. Int Immunopharmacol. 2006; 6:1796-1807.
Hu H, Chen D, Li Y, Zhang X. Effect of polypeptides in bee venom on growth inhibition and apoptosis induction of the human hepatoma cell line SMMC-7721 invitro and Balb/c nude mice in-vivo. J Pharm Pharmacol. 2006; 58: 83-9.
Orsoliae N, Sver L, Verstovsek S, Terzae S, Basae I. Inhibition of mammary carcinoma cell proliferation in vitro and tumor growth in vivo by bee venom. Toxicon. 2003; 41:861-70.
Jang MH, Shin MC, Lim S, Han SM, Park HJ, Shin I, et ál. Bee venom induces apoptosis and inhibits expression of cyclooxygenase-2 mRNA in human lung cancer cell line NCI-H1299. J Pharmacol Sci. 2003; 91:95-104.
Liu X, Chen D, Xie L, Zhang R. Effect of honey bee venom on proliferation of K1735M2 mouse melanoma cells in-vitro and growth of murine B16 melanomas invivo. J Pharm Pharmacol. 2002; 54:1083-9.
Szliszka E, Zydowicz G, Janoszka B, Dobosz C, Kowalczyk-Ziomek G, Krol W. Ethanolic extract of Brazilian green propolis sensitizes prostate cancer cells to TRAIL-induced apoptosis. Int J Oncol. 2011; 38:941- 53.
Pichichero E, Cicconi R, Mattei M, Canini A. Chrysin-induced apoptosis is mediated through p38 and Bax activation in B16-F1 and A375 melanoma cells. Int J Oncol. 2011; 38:473-83.
Khan MS, Devaraj H, Devaraj N. Chrysin abrogates early hepatocarcinogenesis and induces apoptosis in N-nitrosodiethylamine-induced preneoplastic nodules in rats. Toxicol Appl Pharmacol. 2011; 252:85-94.
AvcÝ CB, Gündüz C, Baran Y, Sahin F, YÝlmaz S, Dogan ZO, et ál. Caffeic acid phenethyl ester triggers apoptosis through induction of loss of mitochondrial membrane potential in CCRF-CEM cells. J Cancer Res Clin Oncol. 2011; 137:41-7.
Li X, Wang JN, Huang JM, Xiong XK, Chen MF, Ong CN, et ál. Chrysin promotes tumor necrosis factor (TNF)-related apoptosis-inducing ligand (TRAIL) induced apoptosis in human cancer cell lines. Toxicol In Vitro 2010. En prensa.
Li F, Awale S, Tezuka Y, Kadota S. Cytotoxicity of constituents from Mexican propolis against a panel of six different cancer cell lines. Nat Prod Commun. 2010; 5:1601-6.
Lin WL, Liang WH, Lee YJ, Chuang SK, Tseng TH. Antitumor progression potential of caffeic acid phenethyl ester involving p75(NTR) in C6 glioma cells. Chem Biol Interact. 2010; 188:607-15.
Seda Vatansever H, Sorkun K, Ismet Deliloðlu Gurhan S, Ozdal-Kurt F, Turkoz E, Gencay O, et ál. Propolis from Turkey induces apoptosis through activating caspases in human breast carcinoma cell lines. Acta Histochem. 2010; 112:546-56.
Popolo A, Piccinelli LA, Morello S, Cuesta-Rubio O, Sorrentino R, Rastrelli L, et ál. Antiproliferative activity of brown Cuban propolis extract on human breast cancer cells. Nat Prod Commun. 2009; 4:1711-16.
Li F, Awale S, Tezuka Y, Kadota S. Cytotoxic constituents of propolis from Myanmar and their structure- activity relationship. Biol Pharm Bull. 2009; 32: 2075-8.
Szliszka E, Czuba ZP, Bronikowska J, Mertas A, Paradysz A, Krol W. Ethanolic Extract of Propolis Augments TRAIL-Induced Apoptotic Death in Prostate Cancer Cells. Evid Based Complement Alternat Med 2009. En prensa.
Ishihara M, Naoi K, Hashita M, Itoh Y, Suzui M. Growth inhibitory activity of ethanol extracts of Chinese and Brazilian propolis in four human colon carcinoma cell lines. Oncol Rep. 2009; 22:349-54.
Szliszka E, Czuba ZP, Domino M, Mazur B, Zydowicz G, Krol W. Ethanolic extract of propolis (EEP) enhances the apoptosis- inducing potential of TRAIL in cancer cells. Molecules. 2009; 14:738-54.
Lee KW, Kang NJ, Kim JH, Lee KM, Lee DE, Hur HJ, et ál. Caffeic acid phenethyl ester inhibits invasion and expression of matrix metalloproteinase in SK-Hep1 human hepatocellular carcinoma cells by targeting nuclear factor kappa B. Genes Nutr. 2008; 2:319-22.
Chen MJ, Chang WH, Lin CC, Liu CY, Wang TE, Chu CH, et ál. Caffeic acid phenethyl ester induces apoptosis of human pancreatic cancer cells involving caspase and mitochondrial dysfunction. Pancreatology. 2008; 8:566-76.
Inoue K, Saito M, Kanai T, Kawata T, Shigematsu N, Uno T, et ál. Anti-tumor effects of watersoluble propolis on a mouse sarcoma cell line in vivo and in vitro. Am J Chin Med. 2008; 36:625-34.
Diaz-Carballo D, Freistã Hler M, Malak S, Bardenheuer W, Reusch HP. Mucronulatol from Caribbean propolis exerts cytotoxic effects on human tumor cell lines. Int J Clin Pharmacol Ther. 2008; 46: 226-35.
Li F, Awale S, Tezuka Y, Kadota S. Cytotoxic constituents from Brazilian red propolis and their structure- activity relationship. Bioorg Med Chem. 2008; 16: 5434-40.
Huang WJ, Huang CH, Wu CL, Lin JK, Chen YW, Lin CL, et ál. Propolin G, a prenylflavanone, isolated from Taiwanese propolis, induces caspasedependent apoptosis in brain cancer cells. J Agric Food Chem. 2007; 55:7366-76.
Li H, Kapur A, Yang JX, Srivastava S, McLeod DG, Paredes-Guzman JF, et ál. Antiproliferation of human prostate cancer cells by ethanolic extracts of Brazilian propolis and its botanical origin. Int J Oncol. 2007; 31:601-6.
Orsoliae N, Terziae S, Mihaljeviae Z, Sver L, Basiae I. Effects of local administration of propolis and its polyphenolic compounds on tumor formation and growth. Biol Pharm Bull. 2005; 28:1928-33.
Gunduz C, Biray C, Kosova B, Yilmaz B, Eroglu Z, Sahin F, et ál. Evaluation of Manisa propolis effect on leukemia cell line by telomerase activity. Leuk Res. 2005; 29:1343-6.
Orsoliae N, Kosalec I, Basiae I. Synergistic antitumor effect of polyphenolic components of water soluble derivative of propolis against Ehrlich ascites tumour. Biol Pharm Bull. 2005; 28:694-700.
Russo A, Cardile V, Sanchez F, Troncoso N, Vanella A, Garbarino JA. Chilean propolis: antioxidant activity and antiproliferative action in human tumor cell lines. Life Sci. 2004; 76:545-58.
Aso K, Kanno S, Tadano T, Satoh S, Ishikawa M. Inhibitory effect of propolis on the growth of human leukemia U937. Biol Pharm Bull. 2004; 27:727-30.
Orsoliae N, Sver L, Terziae S, Tadiae Z, Basiae I. Inhibitory effect of water-soluble derivative of propolis and its polyphenolic compounds on tumor growth and metastasizing ability: a possible mode of antitumor action. Nutr Cancer. 2003; 47:156-63.
Liao HF, Chen YY, Liu JJ, Hsu ML, Shieh HJ, Liao HJ, et ál. Inhibitory effect of caffeic acid phenethyl ester on angiogenesis, tumor invasion, and metastasis. J Agric Food Chem. 2003; 51:7907-12.
Lee YJ, Kuo HC, Chu CY, Wang CJ, Lin WC, Tseng TH. Involvement of tumor suppressor protein p53 and p38 MAPK in caffeic acid phenethyl ester-induced apoptosis of C6 glioma cells. Biochem Pharmacol. 2003; 66:2281-9.
Kimoto T, Koya-Miyata S, Hino K, Micallef MJ, Hanaya T, Arai S, et ál. Pulmonary carcinogenesis induced by ferric nitrilotriacetate in mice and protection from it by Brazilian propolis and artepillin C. Virchows Arch. 2001; 438:259-70.
Kimoto T, Aga M, Hino K, Koya-Miyata S, Yamamoto Y, Micallef MJ, et ál. Apoptosis of human leukemia cells induced by Artepillin C, an active ingredient of Brazilian propolis. Anticancer Res. 2001; 21: 221-8.
Fauzi AN, Norazmi MN, Yaacob NS. Tualang honey induces apoptosis and disrupts the mitochondrial membrane potential of human breast and cervical cancer cell lines. Food Chem Toxicol 2010. En prensa.
Ghashm AA, Othman NH, Khattak MN, Ismail NM, Saini R. Antiproliferative effect of Tualang honey on oral squamous cell carcinoma and osteosarcoma cell lines. BMC Complement Altern Med. 2010; 10: 49.
Pichichero E, Cicconi R, Mattei M, Muzi MG, Canini A. Acacia honey and chrysin reduce proliferation of melanoma cells through alterations in cell cycle progression. Int J Oncol. 2010; 37:973-81.
Jaganathan SK, Mondhe D, Wani ZA, Pal HC, Mandal M. Effect of honey and eugenol on Ehrlich ascites and solid carcinoma. J Biomed Biotechnol. 2010; 2010: 989163.
Jaganathan SK, Mandal M. Involvement of nonprotein thiols, mitochondrial dysfunction, reactive oxygen species and p53 in honey-induced apoptosis. Invest New Drugs. 2010; 28:624-33.
Swellam T, Miyanaga N, Onozawa M, Hattori K, Kawai K, Shimazui T, et ál. Antineoplastic activity of honey in an experimental bladder cancer implantation model: in vivo and in vitro studies. Int J Urol. 2003; 10:213-19.
Munstedt K, Hackethal A, Schimidt K. Bee venom therapy, bee venom acupuncture of apipunture: what is the evidence behind the various health claims?. Am Bee J. 2005; 145:665-8.
Hauser RA, Daguio M, Wester D, Hausser M, Kirchman A, Skinkis C. Bee-venom therapy for treating multiple sclerosis: A clinical tiral. Altern Complement Ther. 2001; 7:37-45.
Kwon YB, Lee JD, Lee HJ, Han HJ, Mar WC, Kang Sk, et ál. Bee venom injection into an acupuncture point reduces arthritis associated edema and nociceptive responses. Pain. 2001; 90:271-80.
Lee MS, Pittler MH, Shin BC, Kong JC, Ernst E. Bee venom acupuncture for musculoskeletal pain: a review. J Pain. 2008; 9:289-97.
Thu YM, Richmond A. NF-êB inducing kinase: a key regulator in the immune system and in cancer. Cytokine Growth Factor Rev. 2010; 21:213-26.
Verdin E, Hirschey MD, Finley LW, Haigis MC. Sirtuin regulation of mitochondria: energy production, apoptosis, and signaling. Trends Biochem Sci. 2010; 35:669-75.
George RE, Lahti JM, Adamson PC, Zhu K, Finkelstein D, Ingle AM, et ál. Phase I study of decitabine with doxorubicin and cyclophosphamide in children with neuroblastoma and other solid tumors: a Children's Oncology Group study. Peadiatr Blood Cancer. 2010; 55:629-38.
Cao X, Rodarte C, Zhang L, Morgan CD, Littlejohn J, Smythe WR. Bcl2/bcl-xL inhibitor engenders apoptosis and increases chemosensitivity in mesothelioma. Cancer Biol Ther. 2007; 6:246-52.
Coe R. Sociología de la medicina. Segunda edición. Madrid: editorial alianza. Páginas 218-251.
Susser M, Susser E. Choosing a future for epidemiology: I. Eras and paradigms. Am J Public Health. 1996; 86:668-73.
West S, Thoemmmes F. Campbells and rubins perspectives on causal inference. Psychol Methods. 2010; 15:18-37.
Kaufman JS, Poole C. Looking back on causal thinking in the health sciences. Annu Rev Public Health. 2000; 21:101-19.
Hafeman DM, Schwartz S. Opening the black box: a motivation for the assessment of mediation. Int J Epidemiol. 2009; 38:838-45.
Hofler M. Causal inference based on counterfactuals. BMC Med Res Methodol. 2005; 5:28.
Rothman KJ, Greenland S. Causation and causal inference in epidemiology. Am J Public Health. 2005; 95:S144-S150.
Weed DL. On the use of causal criteria. Int J Epidemiol. 1997; 26:1137-41.
Bradford Hill A. The environment and disease: association or causation?. Proc R Soc Med. 1965; 58: 295-300.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2012 Revista de la Facultad de Medicina

Esta obra está bajo una licencia Creative Commons Reconocimiento 3.0 Unported.
-