Niveles séricos del factor neurotrófico derivado del cerebro durante la gestación normal y la preeclampsia
Serum Levels of Brain Derived Neurotrophic Factor during Normal Pregnancy and Preeclampsia
DOI:
https://doi.org/10.15446/revfacmed.v64n2.51230Palabras clave:
Preeclampsia, Factor neurotrófico derivado del encéfalo, Embarazo (es)Pre-Eclampsia, Brain-Derived Neurotrophic Factor, Pregnancy (en)
Introducción. La preeclampsia (PE) es una de las principales causas de mortalidad materna y perinatal en el mundo, aparece en la segunda mitad de la gestación y actualmente no hay marcadores que la detecten en forma temprana. Dadas las propiedades angiogénicas del factor neurotrófico derivado del cerebro (BDNF) y la disfunción endotelial de los vasos sanguíneos presente en la PE, se ha propuesto una posible asociación entre el BDNF y PE.
Objetivo. Determinar si existe asociación entre niveles séricos de BDNF durante el embarazo y la preeclampsia.
Materiales y métodos. Estudio de cohorte prospectivo longitudinal. Se seleccionaron 13 pacientes quienes desarrollaron PE y 31 gestantes de curso normal. Se midieron variables antropométricas y niveles de BDNF, glicemia, insulina y perfil lipídico en la gestación temprana, media y tardía. Se practicó un modelo de regresión logística para verificar si los niveles de BDNF, en conjunto con otras variables, pueden explicar el desarrollo de PE.
Resultados. Los niveles de BDNF no variaron significativamente entre el grupo de gestantes que desarrollaron preeclampsia y las que no: en gestación temprana 25.3 y 23.3ng/ml, en gestación media 28 y 24.7ng/ml y en gestación tardía 25.4 y 27.4ng/ml, respectivamente. Se hallaron diferencias entre los dos grupos en el peso, la insulina y la evaluación del modelo homeostático (HOMA). Se encontró asociación entre niveles de BDNF y peso e IMC y glucemia en las gestantes que no desarrollaron PE. Se practicó un modelo de regresión logística en el que la PE se explicó mejor con variables como IMC, PAS y HOMA, pero no con BDNF.
Conclusiones. El BDNF puede participar en la regulación del peso corporal y el metabolismo de la glucosa en mujeres gestantes, pero el nivel de BDNF, solo o en conjunto con otras variables, no puede explicar la preeclampsia.
Introduction. Preeclampsia (PE) is one of the major causes of maternal and perinatal mortality in the world. PE appears during the second half of pregnancy and there are currently no markers for its early detection. Given the angiogenic properties of brain derived neurotrophic factor (BDNF) and the endothelial dysfunction of blood vessels that occurs during PE, an association between BDNF and PE has been proposed.
Objective. To determine if there is an association between BDNF serum levels and PE during pregnancy.
Materials and Methods. Prospective longitudinal cohort study. 13 patients who developed PE and 31 patients with normally coursing pregnancies were selected. Anthropometric variables, BDNF serum levels, glycemia, insulin and lipid profile in early, mid-term and late pregnancies were measured.
Results. No significant differences were observed in BDNF levels between women who developed PE and those who did not; in early pregnancy the levels were 25.3 and 23.3 ng/ml, for mid-term pregnancy 28 and 24.7 ng/ml and for late pregnancy 25.4 and 27.4 ng/ml for PE and normal pregnancy, respectively. An association between BDNF and weight and BMI and serum glucose was found in women who did not develop PE. A logistic regression model was carried out where PE was better explained through variables such as BMI, SBP and homoeostasis model assessment (HOMA), however BDNF was not taken into account here.
Conclusions. BDNF might have a role in regulating body weight and glucose metabolism in pregnant women but there is no evidence to suggest that BDNF alone or in combination with other variables can account for PE.
INVESTIGACIÓN ORIGINAL
DOI: https://doi.org/10.15446/revfacmed.v64n2.51230
Niveles séricos del factor neurotrófico derivado del cerebro durante la gestación normal y la preeclampsia
Serum Levels of Brain Derived Neurotrophic Factor during Normal Pregnancy and Preeclampsia
Liza Colorado-Barbosa1 • Cristian Benites-Barrera1 • Rubén Darío Contreras-Escorcia1 • María Fernanda Garcés-Gutiérrez2 • Jorge Eduardo Caminos-Pinzón2 • Ariel Iván Ruiz-Parra1,3 • Edith Ángel-Müller1
Recibido: 12/06/2015 Aceptado: 03/11/2015
1 Universidad Nacional de Colombia - Sede Bogotá - Facultad de Medicina - Departamento de Obstetricia y Ginecología - Bogotá, D.C. - Colombia.
2 Universidad Nacional de Colombia - Sede Bogotá - Facultad de Medicina - Departamento de Ciencias Fisiológicas - División de Bioquímica - Bogotá, D.C. - Colombia.
3 Universidad Nacional de Colombia - Sede Bogotá - Facultad de Medicina - Instituto de Investigaciones Clínicas - Bogotá, D.C. - Colombia.
Correspondencia: Edith Ángel-Müller. Departamento de Obstetricia y Ginecología, Facultad de Medicina, Universidad Nacional de Colombia. Carrera 30 No. 45-03, edificio 471, Oficina 111 Teléfono: +57 1 3165000, extensión: 15122. Bogotá, D.C. Colombia. Correo electrónico: eangelm@unal.edu.co.
| Resumen |
Introducción. La preeclampsia (PE) es una de las principales causas de mortalidad materna y perinatal en el mundo, aparece en la segunda mitad de la gestación y actualmente no hay marcadores que la detecten en forma temprana. Dadas las propiedades angiogénicas del factor neurotrófico derivado del cerebro (BDNF) y la disfunción endotelial de los vasos sanguíneos presente en la PE, se ha propuesto una posible asociación entre el BDNF y PE.
Objetivo. Determinar si existe asociación entre niveles séricos de BDNF durante el embarazo y la preeclampsia.
Materiales y métodos. Estudio de cohorte prospectivo longitudinal. Se seleccionaron 13 pacientes quienes desarrollaron PE y 31 gestantes de curso normal. Se midieron variables antropométricas y niveles de BDNF, glicemia, insulina y perfil lipídico en la gestación temprana, media y tardía. Se practicó un modelo de regresión logística para verificar si los niveles de BDNF, en conjunto con otras variables, pueden explicar el desarrollo de PE.
Resultados. Los niveles de BDNF no variaron significativamente entre el grupo de gestantes que desarrollaron preeclampsia y las que no: en gestación temprana 25.3 y 23.3ng/ml, en gestación media 28 y 24.7ng/ml y en gestación tardía 25.4 y 27.4ng/ml, respectivamente. Se hallaron diferencias entre los dos grupos en el peso, la insulina y la evaluación del modelo homeostático (HOMA). Se encontró asociación entre niveles de BDNF y peso e IMC y glucemia en las gestantes que no desarrollaron PE. Se practicó un modelo de regresión logística en el que la PE se explicó mejor con variables como IMC, PAS y HOMA, pero no con BDNF.
Conclusiones. El BDNF puede participar en la regulación del peso corporal y el metabolismo de la glucosa en mujeres gestantes, pero el nivel de BDNF, solo o en conjunto con otras variables, no puede explicar la preeclampsia.
Palabras clave: Preeclampsia; Factor neurotrófico derivado del encéfalo; Embarazo (DeCS).
Colorado-Barbosa L, Benites-Barrera C, Contreras-Escorcia RD, Garcés-Gutiérrez, MF, Caminos-Pinzón JE, Ruiz-Parra AI, et al. Niveles séricos del factor neurotrófico derivado del cerebro durante la gestación normal y la preeclampsia. Rev. Fac. Med. 2016;64(2):199-206. Spanish. doi: https://doi.org/10.15446/revfacmed.v64n2.51230.
Abstract
Introduction. Preeclampsia (PE) is one of the major causes of maternal and perinatal mortality in the world. PE appears during the second half of pregnancy and there are currently no markers for its early detection. Given the angiogenic properties of brain derived neurotrophic factor (BDNF) and the endothelial dysfunction of blood vessels that occurs during PE, an association between BDNF and PE has been proposed.
Objective. To determine if there is an association between BDNF serum levels and PE during pregnancy.
Materials and Methods. Prospective longitudinal cohort study. 13 patients who developed PE and 31 patients with normally coursing pregnancies were selected. Anthropometric variables, BDNF serum levels, glycemia, insulin and lipid profile in early, mid-term and late pregnancies were measured.
Results. No significant differences were observed in BDNF levels between women who developed PE and those who did not; in early pregnancy the levels were 25.3 and 23.3 ng/ml, for mid-term pregnancy 28 and 24.7 ng/ml and for late pregnancy 25.4 and 27.4 ng/ml for PE and normal pregnancy, respectively. An association between BDNF and weight and BMI and serum glucose was found in women who did not develop PE. A logistic regression model was carried out where PE was better explained through variables such as BMI, SBP and homoeostasis model assessment (HOMA), however BDNF was not taken into account here.
Conclusions. BDNF might have a role in regulating body weight and glucose metabolism in pregnant women but there is no evidence to suggest that BDNF alone or in combination with other variables can account for PE.
Keywords: Pre-Eclampsia; Brain-Derived Neurotrophic Factor; Pregnancy (MeSH).
Colorado-Barbosa L, Benites-Barrera C, Contreras-Escorcia RD, Garcés-Gutiérrez, MF, Caminos-Pinzón JE, Ruiz-Parra AI, et al. [Serum Levels of Brain Derived Neurotrophic Factor during Normal Pregnancy and Preeclampsia]. Rev. Fac. Med. 2016;64(2):199-206. Spanish. doi: https://doi.org/10.15446/revfacmed.v64n2.51230.
Introducción
La preeclampsia (PE) es una enfermedad específica del embarazo que hasta hace poco se caracterizaba por el desarrollo de novo después de 20 semanas de gestación, por hipertensión y por proteinuria concurrente, algunas veces con manifestaciones clínicas de un compromiso multiorgánico (1).
El Colegio Americano de Ginecólogos y Obstetras ha instaurado un nuevo patrón para el diagnóstico de PE ya que muchas pacientes con dicha enfermedad no presentaban los niveles de proteinuria requeridos para el diagnóstico y no se les iniciaba tratamiento oportuno; es por esto que actualmente esta complicación se diagnostica por la presión arterial alta y persistente desarrollada de novo después de la semana 20 de gestación o en el puerperio y se asocia a uno o más de los siguientes criterios: proteinuria, trombocitopenia, función renal o hepática alterada, dolor en abdomen superior, edema pulmonar o alteraciones en sistema nervioso central como convulsiones y/o alteraciones visuales (2).
La preeclampsia es una de las principales causas de mortalidad materna en el mundo (3); en Colombia, la proporción para el periodo 2010-2012 fue del 21.5%, siendo esta la segunda causa de muerte materna (4). La PE se ha estudiado durante muchos años y se considera que su fisiopatología, aunque es poco clara, implica diversos factores para su desarrollo. Sin embargo, se sabe que uno de los mecanismos que se asocia con su ocurrencia es la disfunción endotelial mediada por diferentes factores intrínsecos y extrínsecos que influyen en su patogénesis (5).
Desde el desarrollo folicular, hasta la receptividad endometrial e implantación trofoblástica, ocurren una serie de interacciones mediadas por factores de crecimiento, citoquinas, prostaglandinas, hormonas y moléculas de adhesión, las cuales desencadenan un gran número de cascadas de señalización (6) que culminan en el desarrollo placentario. Las alteraciones en la expresión normal y la acción de estos factores moleculares resultan en un fracaso absoluto o parcial de la implantación y en la formación anormal de la placenta en ratones y humanos.
En los últimos años, se han definido muchos de los factores involucrados en el desarrollo fetal, como es el caso de las neurotrofinas entre las cuales se encuentra el factor neurotrófico derivado del cerebro (BDNF) (7). El BDNF es un miembro de la familia de las neurotrofinas afines al receptor de tirosina quinasa B (TrkB), que actúa activando cascadas de señalización desencadenadas por la fosfolipasa C gamma, MAPK y el Fosfatidilinositol 3 kinasa (8). Las neurotrofinas se expresan no solo en el sistema nervioso central (SNC), sino en otro tipo de tejidos celulares, donde desempeñan funciones importantes en la diferenciación, proliferación y supervivencia de diferentes tipos de células. Las neurotrofinas están implicadas en procesos como la maduración del folículo, el crecimiento tumoral, la angiogénesis y la inmunomodulación (9).
El BDNF también se expresa en la placenta donde es intermediario en la proliferación y supervivencia de las células trofoblásticas mediante funciones autocrinas y paracrinas influidas por la expresión del receptor TrkB y su ligando BDNF (10,11). Se ha localizado el BDNF en el corión membranoso, en el trofoblasto y en el endotelio, mientras que el TrkB se ha localizado inmunológicamente en la decidua, en el trofoblasto y en el endotelio (12). Hay evidencia que relaciona al BDNF con varias funciones metabólicas como el control del peso, la ingesta, los niveles de insulina y por tanto la glicemia (13). En condiciones desfavorables en el útero, el BDNF tiene un papel protector en el tejido de las vellosidades humanas.
Estudios recientes han reportado que el BDNF se encuentra elevado en pacientes con PE al ser comparadas con gestantes no preeclámpticas (14). Teniendo como hipótesis que el BDNF se eleva en la preeclampsia, el objetivo de este estudio fue comparar los niveles de BDNF durante los tres trimestres en gestantes normales y en pacientes que desarrollaron preeclampsia para determinar si pueden ser predictores de este desenlace; el objetivo secundario fue correlacionar los niveles de BDNF con otras variables clínicas y bioquímicas durante la gestación.
Materiales y métodos
Población de estudio
La población incluida en este estudio de cohorte prospectivo longitudinal fueron mujeres gestantes atendidas en el Hospital Engativá, institución de segundo nivel de la red distrital de Bogotá D.C., durante los años 2013 y 2014. El estudio fue aprobado por el Comité de Ética de la Universidad Nacional de Colombia y por el Comité de Investigaciones del Hospital Engativá.
Se realizó un estudio de casos y controles anidado en una cohorte longitudinal-prospectiva en la que se estudiaron 451 mujeres sanas en los tres trimestres de la gestación y a los tres y seis meses después del parto; para este caso específico se escogieron en forma aleatoria 31 gestantes con desenlaces normales y 13 con preeclampsia. Se investigó si los biomarcadores de resistencia a la insulina aumentados durante la gestación se asociaban con desenlaces adversos materno perinatales y síndrome metabólico a los seis meses posparto.
El tamaño de muestra se calculó para un estudio de cohortes, utilizando el programa STATCAL y siguiendo los siguientes criterios: nivel de confianza del 95%, poder del 80%, razón expuestos no expuestos de 1:1 —se consideran expuestas las gestantes con marcadores de resistencia a la insulina positivos—, frecuencia esperada del desenlace —síndrome metabólico— en el grupo no expuesto del 10% —gestante sin resistencia a la insulina según el índice HOMA-IR— y riesgo relativo clínicamente significativo de 2.0.
En la cohorte se incluyeron en forma consecutiva mujeres con edad gestacional menor a 14 semanas, que asistían a su control prenatal, que se valoraron con control clínico y paraclínico en cada trimestre y de quienes se obtuvieron los desenlaces maternos y fetales de la gestación. Los criterios de exclusión fueron historia de diabetes mellitus, diabetes gestacional, enfermedad vascular, hipertensión crónica, enfermedad renal, síndrome de ovarios poliquísticos o antecedentes de preeclampsia.
Se midieron las variables edad gestacional, peso, índice de masa corporal y presión arterial y se realizaron tomas de sangre venosa en ayunas para la medición de BDNF y análisis bioquímicos como glicemia, insulina y perfil lipídico —colesterol total, HDL, LDL, VLDL y triglicéridos— en la gestación temprana, media y tardía —semanas 11-13, 24-26 y 34-37—. El diagnóstico de PE se realizó con la presencia de hipertensión después de la semana 20 de gestación y proteinuria significativa asociada u otra disfunción necesaria para el diagnóstico.
Medición de los niveles de BDNF
Los niveles circulantes de BDNF fueron medidos con el kit comercial de ELISA —Cat. # ab99978. Abcam®— de acuerdo con las instrucciones del fabricante. Este es un ensayo inmunoabsorbente ligado a enzimas para la medición cuantitativa in vitro de BDNF humano en suero, plasma y sobrenadantes de cultivo celular a través de un método de detección colorimétrico (15).
Análisis estadístico
Se realizó la estadística descriptiva de las variables al analizar los datos con el programa Stata 11.0. La distribución de las variables cuantitativas se evaluó con la prueba de Shapiro-Wilk y se presentó la mediana —rango intercuartílico— o la media (+/- SD) según si las variables se distribuyen en forma normal o no. Las variables que no se distribuían normal se transformaron logarítmicamente, pero si con la transformación se distribuían en forma normal se aplicó la prueba t-Student para comparación de medias. De lo contrario, se aplicó la prueba no paramétrica de Wilcoxon. Para los análisis de correlación entre variables cuantitativas se utilizó el índice de correlación de Spearman.
Resultados
Características de la madre y del neonato al nacimiento
La población estudiada fue de 44 mujeres gestantes, de las cuales 13 desarrollaron PE. La media de edad fue de 22 años con rango de 19-27.
Las características antropométricas y bioquímicas de las mujeres gestantes, según gestación normal y gestación con PE, se muestran en la Tabla 1. En las pacientes que desarrollaron PE, se encontró un peso significativamente mayor comparado con las gestantes normales durante toda la gestación. Igualmente, se encontraron diferencias entre los dos grupos al comparar los niveles de insulina y HOMA en los primeros seis meses de gestación, siendo mayores en las pacientes con preeclampsia. No se encontraron diferencias estadísticamente significativas en las demás variables bioquímicas analizadas entre los dos grupos. En los datos de distribución normal se muestra la media y la desviación estándar (DE), en los datos de distribución no normal se muestra la mediana y el rango intercuartil (RIQ). P<0.05 fue considerado estadísticamente significativo.
Tabla 1. Características antropométricas y bioquímicas de las gestantes normales y con preeclampsia en los tres periodos de la gestación. Hospital Engativá, Bogotá, D.C. 2013-2014.
|
Variable |
EP |
MP |
LP |
||||||
|
EN (n=25) |
PE (n=13) |
P |
EN (n=25) |
PE (n=13) |
P |
EN (n=25) |
PE (n=13) |
P |
|
|
Peso (kg) media (DE) |
53 (50-57) |
60.6 (54-65.5) |
0.02 |
58.7 (55-61) |
66.9 (58-75) |
0.02 |
61.8 (60-66) |
77.9 (63-83) |
0.01 |
|
IMC (kg/m2) mediana (RIQ) |
22.07 (21.12-23.4) |
23.14 (21.45-24.9) |
0.17 |
23.9 (22.61-25) |
25.81 (23.42-29.1) |
0.06 |
25.08 (24.45-27.12) |
29.63 (26.23-30.63) |
0.00 |
|
EG (sem) mediana (RIQ) |
12.1 (+/-0.7) |
12.2 (+/-0.7) |
0.69 |
24.4 (24.1-25.4) |
24.3 (24-24.5) |
0.23 |
34.4 (34-35) |
35.2 (34.5-35.6) |
0.12 |
|
PAS (mmHg) mediana (RIQ) |
100 (98-110) |
108 (100-110) |
0.25 |
110 (90-110) |
104 (100-110) |
0.97 |
102 (96-110) |
110 (106-120) |
0.02 |
|
PAD (mmHg) mediana (RIQ) |
62 (60-70) |
60 (60-68) |
0.66 |
60 (60-70) |
62 (60-66) |
0.63 |
61 (60-70) |
70 (60-70) |
0.68 |
|
PAM (mmHg) media (DE) |
77 (+/-7.1) |
78 (+/-6.2) |
0.56 |
77.3 (+/-8.4) |
76.8 (+/-5.7) |
0.85 |
76.67 (70.67-83.33) |
80 (76.67-83.33) |
0.09 |
|
Glicemia (mg/dl) mediana (RIQ) |
80 (+/-9) |
79.8 (+/-7.4) |
0.95 |
74.1 (+/-7.3) |
75.7 (+/-6.9) |
0.51 |
72 (69-77) |
73 (69-78) |
0.54 |
|
Insulina (µUI/ml) mediana (RIQ) |
7.6 (5-10.3) |
12.3 (10.9-13.5) |
0.01 |
12 (8.9-14.7) |
13.3 (10.9-20.1) |
0.05 |
11.5 (+/-4.9) |
13.5 (+/-5.4) |
0.27 |
|
HOMA-IR mediana (RIQ) |
1.47 (0.94-1.86) |
2.33 (1.9-2.8) |
0.02 |
2.28 (1.64-2.75) |
2.48 (2.17-3.82) |
0.05 |
2.1 (+/-1) |
2.6 (+/-1.2) |
0.27 |
|
Colesterol (mg/dl) media (DE) |
162.2 (+/-40.7) |
171.7 (+/-38.7) |
0.49 |
217.1 (+/-39.6) |
222.5 (+/-53) |
0.75 |
234.5 (+/-39.9) |
234.6 (+/-50.1) |
0.99 |
|
HDL (mg/dl) media (DE) |
53.3 (+/-12.7) |
51.9 (+/-13.3) |
0.75 |
62.8 (+/-11.3) |
62.9 (+/-16.1) |
0.98 |
59 (+/-11.8) |
59.7 (+/-18.4) |
0.90 |
|
LDL (mg/dl) media (DE) |
97.7 (+/-42.6) |
122.8 (+/-41.8) |
0.09 |
155.2 (+/-48.6) |
156.7 (+/-68.2) |
0.95 |
169.2 (+/-45.5) |
165.5 (+/-61.1) |
0.85 |
|
VLDL (mg/dl) media (DE) |
17.92 (14.82-24.48) |
19 (15.02-27.18) |
0.52 |
30.04 (23.78-38.2) |
30.64 ( 26.14-39.58) |
0.86 |
40.46 (31.44-46.88) |
43.74 (30.88-61.78) |
0.27 |
|
TG (mg/dl) mediana (RIQ) |
89.6 (74.1-122.4) |
95 (75.1-135.9) |
0.52 |
150.2 (118.9-191) |
153.2 (130.7-197.9) |
0.86 |
202.3 (157.2-234.4) |
218.7 (154.4-308.9) |
0.27 |
|
BDNF (ng/ml) media (DE) |
23.3 (+/-7) |
25.3 (+/ 7.3) |
0.42 |
24.7 (+/-6.8) |
28 (+/-6.2) |
0.15 |
27.4 (+/-7.8) |
25.4 (+/-6.4) |
0.41 |
IMC: índice de masa corporal; EG: edad gestacional; PAS: presión arterial sistólica; PAD: presión arterial diastólica; PAM: presión arterial media;
HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; VLDL: lipoproteínas de muy baja densidad; TG: triglicéridos; BDNF: factor neurotrófico derivado del cerebro; EP: primer trimestre; MP: segundo trimestre; LP: tercer trimestre; GN: gestantes no preeclampticas; PE: gestantes preeclámpticas.Fuente: Elaboración propia.
En el momento del parto, los grupos difieren en las variables edad gestacional y peso neonatal, siendo menores en las pacientes con PE. En cuanto a la vía del parto, las pacientes con PE tuvieron un mayor porcentaje de cesárea (p=0.0068, prueba chi cuadrado) (Tabla 2).
Tabla 2. Variables clínicas maternas y neonatales al momento del parto en gestantes normales versus gestantes preeclámpticas. Hospital Engativá, Bogotá, D.C. 2013-2014.
|
Determinantes |
Desenlace |
||
|
Embarazo normal (n=25) |
Mujeres preeclámpticas (n=13) |
Valor P |
|
|
EG (sem) mean (DE) |
39.5 (38.6-40.2) |
37.1 (35.5-38.6) |
0.00 |
|
PAS (mmHg) mediana (RIQ) |
110 (108-110) |
140 (131.5-147) |
0.00 |
|
PAD (mmHg) mediana (RIQ) |
70 (65-74) |
90 (80.5-96) |
0.00 |
|
PAM (mmHg) mean (DE) |
83.33 (78.67-86.67) |
107.2 (98.17-111) |
0.00 |
|
PF mean (DE) (g) |
3103.2 (+/-336.1) |
2679.2 (+/-453.6) |
0.01 |
|
NV |
76% |
31% |
|
|
NC |
24% |
69% |
0.0068 |
EG: edad gestacional; PAS: presión arterial sistólica; PAD: presión arterial diastólica; PAM: presión arterial media; PF: peso fetal; NV: nacimientos vía vaginal; NC: nacimientos vía cesárea. Fuente: Elaboración propia.
Comportamiento de los niveles de BDNF
Inicialmente se contrastaron los grupos de pacientes según edad gestacional y condición de enfermedad. En cada comparación se evaluó la prueba de hipótesis de diferencia de medias; valores de p inferiores a 0.05 correspondieron a una diferencia significativa. Los niveles de BDNF no variaron entre los dos grupos y tampoco se encontraron diferencias significativas en los niveles de BDNF entre los trimestres de gestación (Figura 1). Se utilizó la prueba t-Student y la prueba no paramétrica de Wilcoxon para ratificar los resultados.
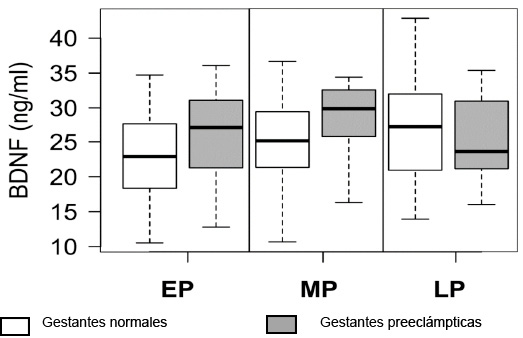
Figura 1. Niveles séricos de BDNF en gestantes normales y con preeclampsia durante la gestación temprana, media y tardía. Hospital Engativá, Bogotá, D.C. 2013-2014. EP: Primer trimestre; MP: Segundo trimestre; LP: Tercer trimestre. Fuente: Elaboración propia.
El diagrama de caja y bigotes muestra los niveles de BDNF (ng/ml) en gestantes preeclámpticas y no preeclámpticas en los tres trimestres de la gestación. No se observan diferencias estadísticamente significativas.
Correlaciones parciales univariadas entre BDNF y variables en estudio
Para este análisis se tomaron únicamente las gestantes normales. Se calculó la correlación de Spearman entre BDNF y las demás variables, controlando el efecto que tiene la edad gestacional. Se omitió la variable VLDL pues sus correlaciones son iguales a la de triglicéridos (Tabla 3).
Tabla 3. Correlación entre el nivel de BDNF y las demás variables clínicas y bioquímicas en gestantes normales y con preeclampsia. Hospital Engativá, Bogotá, D.C. 2013-2014.
|
Variable |
EP |
MP |
LP |
|||
|
Spearman |
Valor P |
Spearman |
Valor P |
Spearman |
Valor P |
|
|
Peso |
0.41 |
0.04 |
0.01 |
0.96 |
0.44 |
0.02 |
|
Talla |
0.34 |
0.09 |
-0.14 |
0.50 |
0.02 |
0.94 |
|
IMC |
0.23 |
0.26 |
0.36 |
0.07 |
0.47 |
0.01 |
|
PAS |
-0.08 |
0.72 |
-0.24 |
0.25 |
0.17 |
0.43 |
|
PAD |
-0.10 |
0.64 |
-0.06 |
0.78 |
0.17 |
0.42 |
|
PAM |
-0.08 |
0.69 |
-0.06 |
0.79 |
0.25 |
0.22 |
|
Glicemia |
-0.14 |
0.49 |
-0.49 |
0.01 |
-0.19 |
0.36 |
|
Insulina |
0.03 |
0.88 |
-0.08 |
0.70 |
-0.05 |
0.82 |
|
HOMA-IR |
0.01 |
0.96 |
-0.22 |
0.30 |
-0.07 |
0.75 |
|
Colesterol |
0.26 |
0.21 |
0.11 |
0.59 |
-0.20 |
0.34 |
|
HDL |
-0.17 |
0.42 |
0.25 |
0.23 |
-0.32 |
0.11 |
|
LDL |
0.18 |
0.38 |
0.22 |
0.29 |
-0.29 |
0.16 |
|
TG |
0.14 |
0.50 |
0.06 |
0.78 |
0.02 |
0.93 |
IMC: índice de masa corporal; PAS: presión arterial sistólica; PAD: presión arterial diastólica; PAM: presión arterial media; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; TG: triglicéridos; EP: primer trimestre; MP: segundo trimestre; LP: tercer trimestre. Fuente: Elaboración propia.
Se encontró que el BDNF se asocia principalmente con el peso, el IMC y la glucemia, aunque estas asociaciones no son constantes durante toda la gestación: hay una correlación negativa significativa (r=-0.49, p=0.01) entre BDNF y glucemia únicamente en el segundo trimestre.
Análisis de regresión logística con la condición de preclampsia como variable dependiente
En última instancia, se estudió si el BDNF en conjunto con otras variables podría llegar a explicar la condición de preeclampsia. Se pretendió usar un modelo de regresión logístico para explicar la probabilidad de que una mujer sufriera de PE en función de las variables en estudio. Ninguno de los modelos incluyó el BDNF como variable explicativa de la PE. No hay evidencia estadística para concluir que el nivel de BDNF, en conjunto con otras variables, pueda explicar la PE.
Discusión
Este estudio no encontró diferencias estadísticamente significativas entre los niveles séricos de BDNF en gestantes que desarrollaron preeclampsia y aquellas que no, lo que sugiere que esta variable no sería un biomarcador útil para predecir el desarrollo de PE. Además, se evidenció que los niveles de insulina sérica y del índice HOMA-IR durante la gestación temprana y media fueron significativamente más altos en el grupo de gestantes que desarrolló PE. Estos resultados concuerdan con hallazgos contemporáneos que sugieren la existencia de una relación entre la elevación de marcadores de resistencia a la insulina y la presentación de desenlaces adversos durante el embarazo, incluida la PE (16-19).
También se encuentra que, durante toda la gestación, los valores de peso fueron significativamente más altos en el grupo de gestantes que desarrollaron PE y que durante el tercer trimestre el de IMC fue significativamente mayor en las preeclámpticas que en las normales. Se sabe que la obesidad es un factor de riesgo para el desarrollo de PE (20-22), siendo considerado el principal factor de riesgo atribuible para este trastorno en países desarrollados (23). A la luz de estos hallazgos, debe considerarse la implementación de medidas dirigidas a realizar un control adecuado del metabolismo de carbohidratos y del peso de las mujeres gestantes para reducir el riesgo de preeclampsia.
Se encuentra una correlación significativa entre los niveles séricos de BDNF de gestantes que no desarrollaron PE y los valores de IMC, peso y glicemia; sin embargo, estas correlaciones no fueron consistentes durante toda la gestación. Las correlaciones fueron positivas para el peso en el primer y tercer trimestres y para el IMC en el tercer trimestre, y negativa para la glicemia en el segundo trimestre. Al BDNF se atribuye la capacidad de ejercer control sobre el apetito y las distintas vías metabólicas.
Hay estudios que sugieren que las propiedades trópicas del BDNF en el metabolismo incluyen la regulación del metabolismo de la glucosa (24-26) y de otras vías metabólicas que afectan las fluctuaciones de peso (27,28). Los hallazgos en este estudio insinuan que el BDNF podría participar en la regulación del peso corporal y el metabolismo de la glucosa en mujeres gestantes, así como ocurre en otras situaciones fisiológicas
Una fortaleza de este estudio es que se trata de una cohorte, en la cual las mismas pacientes fueron controladas en forma longitudinal y se midieron todas las variables relacionadas con el metabolismo de los carbohidratos y los lípidos. Una limitación del estudio es el tamaño de la muestra, determinada por el bajo número de desenlaces. En este estudio solo se presentaron pacientes con preeclampsia moderada, no hubo pacientes con preeclampsia severa, y en estas circunstancias los resultados solo son extrapolables para este desenlace y no es posible obtener conclusiones para enfermedad severa. No obstante, los criterios diagnósticos del desenlace fueron seguidos estrictamente.
Conclusiones
Los hallazgos de este estudio sugieren que el BDNF podría participar en la regulación del peso corporal y el metabolismo de la glucosa en gestantes. El BDNF, solo o en conjunto con otras variables, no es útil como un marcador predictor de preeclampsia.
Conflicto de intereses
Ninguno declarado por los autores.
Financiación
El presente trabajo recibió apoyo financiero por medio del Programa Nacional de Semilleros de Investigación, Creación e Innovación de la Universidad Nacional de Colombia 2013-2015 y recursos del proyecto financiado por Colciencias (Cod. 110154531660).
Agradecimientos
Ninguno declarado por los autores.
Referencias
1. Steegers E, Von Dadelszen P, Duvekot J, Pijnenborg R. Pre-eclampsia. Lancet. 2010;376(9741):631-44. http://doi.org/d3cbtp.
2. American College of Obstetricians and Gynecologists, Task Force on Hypertension in Pregnancy. Hypertension in pregnancy. Report of the American College of Obstetricians and Gynecologists’ Task Force on Hypertension in Pregnancy. Obstet Gynecol. 2013;122(5):1122-31.
3. Say L, Chou D, Gemmill A, Tunçalp Ö, Moller AB, Daniels J, et al. Global Causes of Maternal Death: a WHO Systematic Analysis. Lancet Glob Health. 2014;2(6):e323-33. http://doi.org/bf35.
4. Ministerio de Salud y Protección Social de Colombia, Dirección de Epidemiología y Demografía, Grupo asís. Análisis de Situación de Salud según regiones Colombia. Bogotá, D.C.: MinSalud; 2013.
5. Ziniga FA, Ormazabal V, Gutiérrez N, Aguilera V, Radojkovic C, Veas C, et al. Role of lectin-like oxidized low density lipoprotein-1 in fetoplacental vascular dysfunction in preeclampsia. Biomed Res. Int. 2014;2014:353616. http://doi.org/bf36.
6. Álvarez-Díaz A, Rodríguez EH, editors. Revisiones en Biología celular y molecular. Bilbao: Servicio Editorial de la Universidad del País Vasco; 2010.
7. Guzeloglu-Kayisli O, Kayisli UA, Taylor HS. The Role of Growth Factors and Cytokines during Implantation: Endocrine and Paracrine Interactions. Semin. Reprod. Med. 2009;27(1):62-79. http://doi.org/fhv5hf.
8. Reichardt LF. Neurotrophin-regulated signalling pathways. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2006;361(1473):1545-64. http://doi.org/d8gw5t.
9. Huang EJ, Reichardt LF. Trk receptors: Roles in neuronal signal transduction. Annu. Rev. Biochem. 2003;72:609-42.
http://doi.org/dnt7zf.
10. Kawamura K, Kawamura N, Fukuda J, Kumagai J, Hsueh AJ, Tanaka T. Regulation of preimplantation embryo development by brain-derived neurotrophic factor. Dev. Biol. 2007;311(1):147-58. http://doi.org/fcn49w.
11. Kawamura K, Kawamura N, Sato W, Fukuda J, Kumagai J, Tanaka T. Brain-derived neurotrophic factor promotes implantation and subsequent placental development by stimulating trophoblast cell growth and survival. Endocrinology. 2009;150(8):3774-82. http://doi.org/c8bnqq.
12. Fujita K, Tatsumi K, Kondoh E, Chigusa Y, Mogami H, Fujii T, et al. Differential expression and the anti-apoptotic effect of human placental neurotrophins and their receptors. Placenta. 2011;32(10):737-44. http://doi.org/fsxv4t.
13. Rios M. BDNF and the central control of feeding: accidental bystander or essential player? Trends Neurosci. 2012;36(2):83-90. http://doi.org/bf38.
14. D’Souzaa V, Patila V, Pisala H, Randhira K, Joshia A, Mehendaleb S, et al. Levels of brain derived neurotrophic factors across gestation in women with preeclampsia. Int. J. Dev. Neurosci. 2014;37:36-40. http://doi.org/bf39.
15. BDNF Human ELISA Kit (ab99978). Cambridge: Abcam discover more. [cited 2014 Sep 30]. Available from: http://goo.gl/ZZC0vN.
16. Stekkinger E, Scholten R, van der Vlugt MJ, van Dijk AP, Janssen MC, Spaanderman ME. Metabolic syndrome and the risk for recurrent pre-eclampsia: a retrospective cohort study. BJOG. 2013;120(8):979-86. http://doi.org/bf4b.
17. Hermes W, Franx A, van Pampus MG, Bloemenkamp KW, Bots ML, van der Post JA, et al. Cardiovascular risk factors in women who had hypertensive disorders late in pregnancy: a cohort study. Am. J. Clin. Exp. Obstet. Gynecol. 2013;208(6):474.e1–8.
18. Hoirisch-Clapauch S, Benchimol-Barbosa PR. Markers of insulin resistance and sedentary lifestyle are predictors of preeclampsia in women with adverse obstetric results. Braz. J. Med. Biol. Res. 2011;44(12):1285-90. http://doi.org/dnr3pd.
19. Morteza A, Abdollahi A, Bandarian M. Serum nitric oxide syntheses and lipid profile of the mothers with IUGR pregnancies uncomplicated with preeclampsia. Does insulin resistance matter? Gynecol. Endocrinol. 2012;28(2):139-42. http://doi.org/cq5bfk.
20. Gaillard R, Durmuş B, Hofman A, Mackenbach JP, Steegers EA, Jaddoe VW. Risk factors and outcomes of maternal obesity and excessive weight gain during pregnancy. Obesity (Silver Spring). 2013;21(5):1046-55. http://doi.org/bf4c.
21. Jeyabalan A. Epidemiology of preeclampsia: impact of obesity. Nutr. Rev. 2013;71(Suppl 1):S18-25. http://doi.org/bf4d.
22. Bigelow CA, Pereira GA, Warmsley A, Cohen J, Getrajdman C, Moshier E, et al. Risk factors for new-onset late postpartum preeclampsia in women without a history of preeclampsia. Am. J. Obstet. Gynecol. 2014;210(4):338.e1-8. http://doi.org/f2qtnh.
23. Roberts JM, Bodnar LM, Patrick TE, Powers RW. The Role of Obesity in Preeclampsia. Pregnancy Hypertens. 2011;1(1):6-16. http://doi.org/d3qcr8.
24. Marosi K, Mattson MP. BDNF mediates adaptive brain and body responses to energetic challenges. Trends Endocrinol. Metab. 2014;25(2):89-98. http://doi.org/bf4f.
25. Shu X, Zhang Y, Xu H, Kang K, Cai D. Brain-derived neurotrophic factor inhibits glucose intolerance after cerebral ischemia. Neural Regen. Res. 2013;8(25):2370-8.
http://doi.org/bf4g.
26. Fujinamia A, Ohtab K, Obayashic H, Fukuid M, Hasegawad G, Nakamurad N, et al. Serum brain-derived neurotrophic factor in patients with type 2 diabetes mellitus: Relationship to glucose metabolism and biomarkers of insulin resistance. Clin. Biochem. 2008;41(10-11):812-7.
http://doi.org/bn9nb6.
27. Cordeira J, Rios M. Weighing in the role of BDNF in the central control of eating behavior. Mol. Neurobiol. 2011;44(3):441-8. http://doi.org/bbxvz9.
28. Zhang XY, Zhou DF, Wu GY, Cao LY, Tan YL, Haile CN, et al. BDNF levels and genotype are associated with antipsychotic-induced weight gain in patients with chronic schizophrenia. Neuropsychopharmacology. 2008;33(9):2200-5.
http://doi.org/dr2kt3.
Referencias
Steegers E, Von Dadelszen P, Duvekot J, Pijnenborg R. Pre-eclampsia. Lancet. 2010;376(9741):631-44. http://doi.org/d3cbtp.
American College of Obstetricians and Gynecologists, Task Force on Hypertension in Pregnancy. Hypertension in pregnancy. Report of the American College of Obstetricians and Gynecologists' Task Force on Hypertension in Pregnancy. Obstet Gynecol. 2013;122(5):1122-31.
Say L, Chou D, Gemmill A, Tunçalp Ö, Moller AB, Daniels J, et al. Global Causes of Maternal Death: a WHO Systematic Analysis. Lancet Glob Health. 2014;2(6):e323-33. http://doi.org/bf35.
Ministerio de Salud y Protección Social de Colombia, Dirección de Epidemiología y Demografía, Grupo asís. Análisis de Situación de Salud según regiones Colombia. Bogotá, D.C.: MinSalud; 2013.
Ziniga FA, Ormazabal V, Gutiérrez N, Aguilera V, Radojkovic C, Veas C, et al. Role of lectin-like oxidized low density lipoprotein-1 in fetoplacental vascular dysfunction in preeclampsia. Biomed Res. Int. 2014;2014:353-616. http://doi.org/bf36.
Álvarez-Díaz A, Rodríguez EH, editors. Revisiones en Biología celular y molecular. Bilbao: Servicio Editorial de la Universidad del País Vasco; 2010.
Guzeloglu-Kayisli O, Kayisli UA, Taylor HS. The Role of Growth Factors and Cytokines during Implantation: Endocrine and Paracrine Interactions. Semin. Reprod. Med. 2009;27(1):62-79. http://doi.org/fhv5hf.
Reichardt LF. Neurotrophin-regulated signalling pathways. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2006;361(1473):1545-64. http://doi.org/d8gw5t.
Huang EJ, Reichardt LF. Trk receptors: Roles in neuronal signal transduction. Annu. Rev. Biochem. 2003;72:609-42. http://doi.org/dnt7zf.
Kawamura K, Kawamura N, Fukuda J, Kumagai J, Hsueh AJ, Tanaka T. Regulation of preimplantation embryo development by brain-derived neurotrophic factor. Dev. Biol. 2007;311(1):147-58. http://doi.org/fcn49w.
Kawamura K, Kawamura N, Sato W, Fukuda J, Kumagai J, Tanaka T. Brain-derived neurotrophic factor promotes implantation and subsequent placental development by stimulating trophoblast cell growth and survival. Endocrinology. 2009;150(8):3774-82. http://doi.org/c8bnqq.
Fujita K, Tatsumi K, Kondoh E, Chigusa Y, Mogami H, Fujii T, et al. Differential expression and the anti-apoptotic effect of human placental neurotrophins and their receptors. Placenta. 2011;32(10):737-44. http://doi.org/fsxv4t.
Rios M. BDNF and the central control of feeding: accidental bystander or essential player? Trends Neurosci. 2012;36(2):83-90. http://doi.org/bf38.
D'Souzaa V, Patila V, Pisala H, Randhira K, Joshia A, Mehendaleb S, et al. Levels of brain derived neurotrophic factors across gestation in women with preeclampsia. Int. J. Dev. Neurosci. 2014;37:36-40. http://doi.org/bf39.
BDNF Human ELISA Kit (ab99978). Cambridge: Abcam discover more. [cited 2014 Sep 30]. Available from: http://goo.gl/ZZC0vN.
Stekkinger E, Scholten R, van der Vlugt MJ, van Dijk AP, Janssen MC, Spaanderman ME. Metabolic syndrome and the risk for recurrent pre-eclampsia: a retrospective cohort study. BJOG. 2013;120(8):979-86. http://doi.org/bf4b.
Hermes W, Franx A, van Pampus MG, Bloemenkamp KW, Bots ML, van der Post JA, et al. Cardiovascular risk factors in women who had hypertensive disorders late in pregnancy: a cohort study. Am. J. Clin. Exp. Obstet. Gynecol. 2013;208(6):474.e1-8.
Hoirisch-Clapauch S, Benchimol-Barbosa PR. Markers of insulin resistance and sedentary lifestyle are predictors of preeclampsia in women with adverse obstetric results. Braz. J. Med. Biol. Res. 2011;44(12):1285-90. http://doi.org/dnr3pd.
Morteza A, Abdollahi A, Bandarian M. Serum nitric oxide syntheses and lipid profile of the mothers with IUGR pregnancies uncomplicated with preeclampsia. Does insulin resistance matter? Gynecol. Endocrinol. 2012;28(2):139-42. http://doi.org/cq5bfk.
Gaillard R, Durmuş B, Hofman A, Mackenbach JP, Steegers EA, Jaddoe VW. Risk factors and outcomes of maternal obesity and excessive weight gain during pregnancy. Obesity (Silver Spring). 2013;21(5):1046-55. http://doi.org/bf4c.
Jeyabalan A. Epidemiology of preeclampsia: impact of obesity. Nutr. Rev. 2013;71(Suppl 1):S18-25. http://doi.org/bf4d.
Bigelow CA, Pereira GA, Warmsley A, Cohen J, Getrajdman C, Moshier E, et al. Risk factors for new-onset late postpartum preeclampsia in women without a history of preeclampsia. Am. J. Obstet. Gynecol. 2014;210(4):338.e1-8. http://doi.org/f2qtnh.
Roberts JM, Bodnar LM, Patrick TE, Powers RW. The Role of Obesity in Preeclampsia. Pregnancy Hypertens. 2011;1(1):6-16. http://doi.org/d3qcr8.
Marosi K, Mattson MP. BDNF mediates adaptive brain and body responses to energetic challenges. Trends Endocrinol. Metab. 2014;25(2):89-98. http://doi.org/bf4f.
Shu X, Zhang Y, Xu H, Kang K, Cai D. Brain-derived neurotrophic factor inhibits glucose intolerance after cerebral ischemia. Neural Regen. Res. 2013;8(25):2370-8. http://doi.org/bf4g.
Fujinamia A, Ohtab K, Obayashic H, Fukuid M, Hasegawad G, Nakamurad N, et al. Serum brain-derived neurotrophic factor in patients with type 2 diabetes mellitus: Relationship to glucose metabolism and biomarkers of insulin resistance. Clin. Biochem. 2008;41(10-11):812-7. http://doi.org/bn9nb6.
Cordeira J, Rios M. Weighing in the role of BDNF in the central control of eating behavior. Mol. Neurobiol. 2011;44(3):441-8. http://doi.org/bbxvz9.
Zhang XY, Zhou DF, Wu GY, Cao LY, Tan YL, Haile CN, et al. BDNF levels and genotype are associated with antipsychotic-induced weight gain in patients with chronic schizophrenia. Neuropsychopharmacology. 2008;33(9):2200-5. http://doi.org/dr2kt3.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Licencia
Derechos de autor 2016 Revista de la Facultad de Medicina

Esta obra está bajo una licencia Creative Commons Reconocimiento 3.0 Unported.
-





















