MÉTODO EXTENDIDO DE HILDEBRAND EN LA ESTIMACIÓN DE LA SOLUBILIDAD DE LA INDOMETACINA EN MEZCLAS ACETATO DE ETILO + ETANOL
Palabras clave:
indometacina, estimación de solubilidad, método extendido de solubilidad de Hildebrand, mezclas binarias. (es)MÉTODO EXTENDIDO DE HILDEBRAND EN LA ESTIMACIÓN DE LA SOLUBILIDAD DE LA INDOMETACINA EN MEZCLAS ACETATO DE ETILO + ETANOL
EXTENDED HILDEBRAND SOLUBILITY APPROACH IN THE ESTIMATION OF INDOMETHACIN SOLUBILITY IN ETHYL ACETATE + ETHANOL MIXTURES
MÉTODO AMPLIADO DE HILDEBRAND NA ESTIMAÇÃO DA SOLUBILIDADE DA INDOMETACINA EM MISTURAS DO ACETATO DE ETILO + ETANOL
Miller A. Ruidiaz, Fleming Martínez1
1 Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá. Bogotá, Colombia. fmartinezr@unal.edu.co
Recibido: 14/04/09 - Aceptado: 31/08/09
RESUMEN
La indometacina (IMC) es un anti-inflamatorio no esteroidal de amplio uso en la actualidad, sin embargo, sus propiedades fisicoquímicas aún no han sido estudiadas en su totalidad. En la presente investigación, se aplicó el método extendido de
solubilidad de Hildebrand (MESH) al estudio de la solubilidad de la IMC en mezclas binarias acetato de etilo + etanol a 298,15 K. Se obtuvo una adecuada capacidad predictiva del MESH al utilizar un modelo polinómico regular de quinto orden, relacionando el parámetro de interacción W con el parámetro de solubilidad de las mezclas solventes. Sin embargo, las desviaciones obtenidas en la solubilidad estimada, fueron de magnitud semejante a las obtenidas al calcular esta propiedad directamente, utilizando una regresión empírica regular del mismo orden, de la solubilidad experimental del fármaco en función del parámetro de solubilidad de las mezclas disolventes.
Palabras clave: indometacina, estimación de solubilidad, método extendido de solubilidad de Hildebrand, mezclas binarias.
ABSTRACT
Indomethacin (IMC) is a widely used as a non-steroidal anti-inflammatory drug, whose physicochemical properties have not been thoroughly studied. In this work the Extended Hildebrand Solubility Approach (EHSA) was applied to evaluate the solubility of IMC in ethyl acetate + ethanol mixtures at 298.15 K. A good predictive capacity of EHSA was found using regular polynomial models in order five, when the W interaction parameter is related to the solubility parameter of the mixtures. Nevertheless, the deviations obtained in the estimated solubility with respect to experimental solubility were oi the same order when compared with those obtained directly by means oian empiric regression oi the experimental solubility as a iunction oi the mixtures solubility parameters.
Key words: indomethacin, solubility estimation, extended Hildebrand solubility approach, binary mixtures.
RESUMO
A indometacina (IMC) é um anti-inflamatorio não esteroidal de amplo uso na atualidade, no entanto suas propriedades físico-químicas ainda não foram totalmente estudadas. Na presente investigação, aplicou-se o Método Estendido de Solubilidade de Hildebrand (MESH) ao estudo da solubilidade da IMC em misturas binárias acetato de etilo etanol a 298,15 K. Obteve-se uma adequada capacidade preditiva do MESH ao utilizar um modelo polinomial regular de quinta ordem relacionando o parâmetro de interação W com o parâmetro de solubilidade das misturas solventes. No entanto, os desvios obtidos na solubilidade estimada, foram de magnitude semelhante às obtidas ao calcular estaproprieda-de diretamente, utilizando uma regressão empírica regular da mesma ordem, da solubilidade experimental do fármaco em função do parâmetro de solubilidade das misturas dissolventes.
Palavras-chave: indometacina, estimação da solubilidade, método ampliado de solubilidade de Hildebrand, misturas binárias.
INTRODUCCION
La indometacina (IMC) es un fármaco analgésico y anti-inflamatorio ampliamente utilizado en la terapéutica actual para el tratamiento sintomático de varios procesos agudos o crónicos relacionados con dolor e inflamación (1). De otro lado, es bien sabido que las diferentes propiedades fisicoquímicas, tales como la solubilidad y los volúmenes ocupados por los principios activos y los otros componentes presentes en la solución, se tornan muy importantes para el diseñador farmacéutico, ya que el conocimiento de estas propiedades, facilita de manera sustancial el desarrollo de medicamentos (2).
Por lo anterior, en la presente investigación se expone un estudio fisicoquímico de la estimación de la solubilidad de la IMC en mezclas binarias formadas por acetato de etilo y etanol, solventes utilizados en procesos tales como la microen-capsulación de fármacos. El estudio está basado en el método extendido de solubilidad de Hildebrand (MESH), desarrollado para su aplicación práctica en sistemas de interés farmacéutico (3-5). Esta investigación amplía lo presentado en la literatura sobre la predicción de la solubilidad de otros analgésicos y anti-inflamatorios en mezclas cosolventes (6-9).
ASPECTOS TEÓRICOS
La solubilidad ideal (X2id) de un soluto sólido en un solvente líquido para obtener una solución líquida, se calcula adecuadamente mediante la expresión:
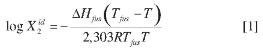
en la cual, ΔHfus es la entalpía de fusión del soluto, R es la constante de los gases (8,314 J mol-1 K-1), es la temperatura absoluta de fusión del soluto y Tfus la temperatura absoluta de la solución. Por otro lado, la solubilidad real (X2) se calcula adicionando el término de no-idealidad (log γ2) a la expresión anterior (10), para obtener la siguiente ecuación:
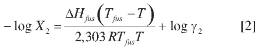
El término γ2 es el coeficiente de actividad del soluto en la solución saturada y debe ser determinado experimentalmente para soluciones reales, sin embargo, se han desarrollado diferentes técnicas para hacer estimados razonables de este término, destacándose la referente a las soluciones regulares (11), en las cuales, a diferencia de las soluciones ideales, se permite un ligero cambio entálpico positivo. La solubilidad en las soluciones regulares se obtiene a partir de:

donde, V2 es el volumen molar parcial del soluto (cm3 mol-1), φ es la fracción volumétrica del solvente en la solución saturada y δ1 y δ2 son los parámetros de solubilidad del solvente y del soluto, respectivamente. El parámetro de solubilidad δ, se calcula como ((ΔHV - RT)/ V1)1/2, donde ΔHV es la entalpía de vaporización y Vl es el volumen molar del líquido.
La mayoría de soluciones de interés farmacéutico se desvían notoriamente del comportamiento de las soluciones regulares (debido al tipo de interacciones presentes, en particular, la formación de enlaces de hidrógeno, y además, a la diferencia entre los volúmenes molares de solutos y solventes). Así, a comienzos de los años ochenta del siglo pasado, Martin et al. plantearon el MESH, que ha resultado muy útil para estimar la solubilidad de varios fármacos en sistemas cosolventes binarios y ternarios (3-5). Por lo tanto, si se introduce el término A, definido como V2 φ12 /(2,303 RT), entonces, la solubilidad real de un soluto en cualquier sistema solvente se puede calcular a partir de:
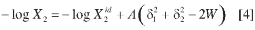
en la cual, el término Wes igual a 2Kδ1δ2, donde K es el parámetro de Walker (10). El factor W compensa las desviaciones respecto al comportamiento de soluciones regulares, y se calcula a partir de datos experimentales como:
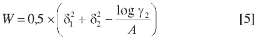
donde γ2 como se indicó anteriormente, es el coeficiente de actividad del soluto en la solución, y se calcula como el cociente X2id/ X2.
Los valores obtenidos experimentalmente para el factor W pueden ser correlacionados mediante análisis de regresión, usando polinomios regulares de orden superior en función del parámetro de solubilidad de las mezclas solventes, así:
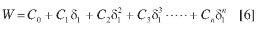
Estos modelos polinómicos pueden ser utilizados para estimar la solubilidad por cálculo reverso (regresión en el cálculo, usando la ecuación obtenida a partir de los datos experimentales), resolviendo esta propiedad a partir del factor W obtenido de la regresión polinómica. Es conveniente mencionar que, entre más términos contenga el polinomio utilizado en la regresión, mejor será su ajuste a los datos experimentales; sin embargo, para definir el orden del polinomio por utilizar, se debe confirmar que este sea significativamente menor que el número de puntos evaluados experimentalmente.
MATERIALES Y MÉTODOS
En esta investigación se utilizaron los siguientes materiales: indometacina BP (12), acetato de etilo R. A. Merck (AcOEt), etanol absoluto R. A. Merck (EtOH), tamiz molecular Merck (números 3 y 4, tamaños de poro 0,3 y 0,4 nm, respectivamente), filtros Durapore® 0,45 µm Millipore Corp.
Preparación de las mezclas solventes
El etanol absoluto utilizado fue tratado con tamiz molecular para garantizar la deshidratación del mismo antes de preparar las mezclas solventes, lo cual se verificó mediante el valor de densidad obtenido (0,7854 g cm-3 a 25,0 °C), el cual es coincidente con lo presentado en la literatura (13, 14). De esta forma, se prepararon mezclas binarias AcOEt + EtOH en composiciones desde 0,00 hasta 100,00% m/m de AcOEt, variando de 10,00 en 10,00% m/m por pesada, en una balanza analítica Ohaus Pioneer TM PA214 de sensibilidad ± 0,1 mg.
Determinación de la solubilidad
Se colocó cerca de 20 g de las diferentes mezclas AcOEt + EtOH y de los solventes puros en frascos de vidrio ámbar NP [Tipo IV, según la farmacopea de Estados Unidos, y destinados exclusivamente a productos no parenterales (15)], y en cada uno se adicionó un exceso de IMC, se taparon los frascos y se colocaron en un baño termostático Julabo SW23 con agitación a 313,15 K durante al menos 72 horas. Posteriormente se ajustó la temperatura en 298,15 K, dejando las muestras durante al menos 24 horas para permitir la precipitación del exceso de fármaco disuelto. Se tomaron muestras de las soluciones sobrenadantes, que fueron filtradas para eliminar partículas sólidas no disueltas, y se determinó la densidad utilizando un densímetro digital DMA 45 Anton Paar (precisión ± 0,0001 g cm-3) conectado a un termostato recirculante Neslab RTE 10 Digital Plus (Thermo Electron Company) a 298,15 K. La concentración del fármaco se determinó por balance de masa pesando una determinada cantidad de solución y permitiendo la evaporación del solvente hasta obtener un valor de masa constante. Todos los procedimientos indicados se realizaron al menos tres veces y los respectivos resultados fueron promediados.
Cálculo de las contribuciones volumétricas
Puesto que en las ecuaciones [3], [4] y [5] se requieren las contribuciones volumétricas de cada componente, en este trabajo se utilizó el volumen específico aparente del soluto (VEA2) para calcular estas contribuciones. El valor de VEA2 (16), se calcula como:
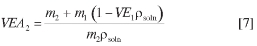
en la cual, m2 y m1 son las masas de soluto y solvente en la solución saturada, respectivamente; VE1 es el volumen específico del solvente; y psoln es la densidad de la solución. El volumen molar aparente se calcula multiplicando VEA2 por la masa molar del fármaco.
RESULTADOS Y DISCUSIÓN
En la Tabla 1 se presenta la composición másica y volumétrica de las mezclas solventes junto con las respectivas densidades y parámetros de solubilidad a 298,15 K. La fracción volumétrica (φ) se halló suponiendo aditividad de volúmenes (17). El parámetro de solubilidad de las mezclas (δmix) se calculó mediante aditividad en términos volumétricos de acuerdo con: 
En la Tabla 2 se presentan algunas propiedades fisicoquímicas del fármaco (18, 19), mientras que en la Tabla 3 se presentan la densidad de las soluciones saturadas de IMC y la solubilidad del fármaco, expresada en porcentaje másico y en fracción molar. Se obtuvo buena concordancia en los valores de solubilidad respecto a los presentados por Ojanen (20). En la Figura 1 se presenta la solubilidad experimental y la solubilidad calculada usando el modelo de soluciones regulares (Ec.[3]) en función del parámetro de solubilidad de las mezclas solventes.
A partir de los valores de densidad de las mezclas solventes (Tabla 1) y de las soluciones saturadas (Tabla 3), junto con la solubilidad en porcentaje másico (Tabla 3), se calcularon las fracciones volumétricas del solvente y los volúmenes molares aparentes del soluto (V2) en las soluciones saturadas. Estos valores también se presentan en la Tabla 3.
En la literatura (10), tradicionalmente se ha asumido como constante el valor del volumen molar del soluto en la solución, al emplear este tipo de tratamientos pre-dictivos de la solubilidad. En el caso de solutos sólidos, este valor generalmente es calculado por métodos de contribución de grupos, dentro de los cuales el más popular es el propuesto por Fedors (21). Sin embargo, como se aprecia en la Tabla 3, el valor de esta propiedad no es constante, sino que depende de la composición del medio solvente, lo cual, probablemente, es debido a las diferentes clases de interacciones intermoleculares presentes en estas soluciones. Por lo tanto, en este trabajo se utilizaron los volúmenes obtenidos experimentalmente, en lugar del valor calculado por el método de Fedors (21), o sea, 230,0 cm3 mol-1 (Tabla 4). De otro lado, la fracción volumétrica de la mezcla solvente en la solución saturada tradicionalmente se ha calculado según la expresión:

en la cual, el término V1 es el volumen molar del solvente, que, en el caso de mezclas disolventes, se ha calculado mediante el método de aditividad lineal de volúmenes
como: 
Sin embargo, es bien sabido que en el caso de mezclas con fuerte presencia de enlaces de hidrógeno y grandes diferencias en los volúmenes molares de los componentes, los volúmenes de mezcla no son propiamente aditivos, y por esta razón, en este trabajo se usaron las fracciones volumétricas obtenidas experimentalmente (Tabla 3).
Así mismo, en la Tabla 3 también se presentan los logaritmos de los coeficientes de actividad del fármaco en las diferentes mezclas, calculados utilizando la solubilidad ideal del fármaco a 298,15 K X2= 7,123 x 10-3).
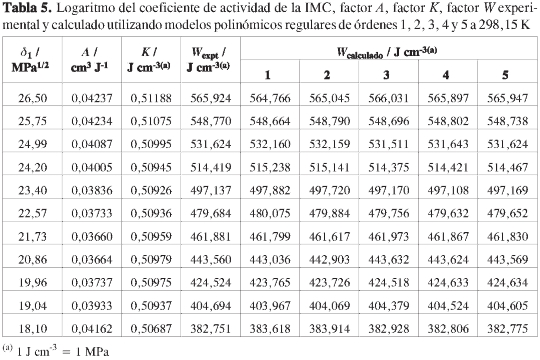
De otro lado, en la Tabla 5 se presentan los factores A, K y W. Para el cálculo del parámetro W se utilizó como valor del parámetro de solubilidad del fármaco, el obtenido en la mezcla solvente donde se consiguió la mayor solubilidad (20,86 MPa1/2), el cual es diferente al calculado combinando los métodos de Fedors (21) y de Van Krevelen, según lo descrito por Barton (22), esto es, 24,5 MPa1/2 (Tabla 4). Esta diferencia en los dos valores de δ2 podría indicar que el cálculo por contribución de grupos no es adecuado en el caso de la IMC, a diferencia de lo encontrado en el caso del acetaminofeno (6, 7).
Como se indicó anteriormente, el factor W responde por las desviaciones presentadas por las soluciones reales respecto a las soluciones regulares, debido principalmente a interacciones específicas de tipo unión de hidrógeno, presentes en estos sistemas estudiados. El fármaco y los dos solventes considerados en este estudio pueden fácilmente establecer estas uniones, ya sea como donores o como aceptores de hidrógeno.
En la Figura 2 se presenta la variación del factor W con respecto al parámetro de solubilidad de las mezclas solventes, donde puede observarse un comportamiento que se desvía ligeramente de la linealidad. En la Tabla 5se presentan los valores calculados o normalizados del factor W, obtenidos utilizando polinomios regulares de grados 1 a 5, donde es bien claro que estos valores dependen del tipo de modelo utilizado en la regresión. Comportamientos similares han sido descritos en la literatura para otros fármacos (3, 6-9).
En la Tabla 6 se presentan los valores de solubilidad obtenidos por cálculo reverso utilizando los valores del factorW obtenidos mediante las regresiones polinómicas de diferente orden que han sido presentados en la Tabla 5. Como criterio de comparación, en la Tabla 6 se presentan los porcentajes de diferencia entre la solubilidad experimental y la calculada, usando los diferentes modelos de regresión.
Puede observarse que en la medida en que los polinomios se van haciendo más complejos, se van obteniendo mejores concordancias entre los valores calculados y los experimentales, lo que se confirma al verificar los porcentajes de desviación promedios (0,9 % y 0,7%, para los órdenes 4 y 5, respectivamente). De forma diferente a lo encontrado en otros estudios (6-9), en este caso el incremento más notable en la concordancia obtenida se presenta al pasar del orden 2 al 3, si bien en el siguiente paso también se encuentra un incremento significativo, mientras que en el paso del orden 4 al 5, aparentemente no hay cambio; sin embargo, para los cálculos siguientes se utilizó el modelo con menor desviación general, esto es, el orden 5 (Ec. [9]).

en la cual, a = -5,362146 x 103, b = + 1,160953 x 103, c = -96,93783, d = +4,130963, e = -8,834996 x 10-2, f = +7,599881 x 10-4 y r2 = 0,9999992.
Una reflexión que podría surgir respecto a la concordancia obtenida al comparar la solubilidad experimental con la calculada a partir de modelos de regresión construidos sobre datos experimentales directos o procesados, es la relativa a la justificación de cálculos complejos involucrando otras variables del sistema (Ec. [4] y Tablas 5 y 6), en lugar de la simple regresión de solubilidad en función del parámetro de solubilidad de las mezclas disolventes (Tabla 3 y Figura 1). Por lo tanto, en la Tabla 7 se comparanlas solubilidades experimentales, las calculadas directamente como un polinomio regular de grado 5 de X2 en función del parámetro de solubilidad de las mezclas (Figura 1, Ec. [10]), y las calculadas indirectamente involucrando los parámetros W obtenidos del polinomio de quinto grado (Tabla 6, Ec. [9]). Así mismo, en esta tabla se presentan los porcentajes de diferencia respecto a los valores experimentales.

en la cual, a = +23,77672, b = -5,579632, c = +0,5134071, d = -2,318533 x 10-2, e = +5,149850 x 10-4, f = -4,510777 x 10-6 y r2 = 0,9995831.
En la Tabla 7 puede observarse que aparentemente no hay diferencias significativas entre los valores calculados por los dos métodos, lo que se verifica mediante los promedios de desviación, para los cálculos directo (0,5%) y por el método extendido de Hildebrand (0,7%), respectivamente. A diferencia de lo encontrado en el estudio del acetaminofeno (6, 7), y en concordancia con lo observado en el caso del ibuprofeno y el naproxeno en otros sistemas solventes (8,9), en el caso de la IMC, los resultados previos estarían demostrando una escasa practicidad del MESH, método que a su vez implica experimentación adicional (entre la que se destaca la determinación de densidades y de algunas propiedades relativas a la fusión del soluto). Sin embargo, debe tenerse presente que este método considera la solubilidad desde un enfoque fisicoquímico sistemático muy racional, y además, únicamente haría falta encontrar un método efectivo para calcular el parámetro K de Walker, con el cual se calcularía el término W, según la expresión 2Kδ1δ2, mencionada anteriormente, ya que los términos δ1 y δ2 serían conocidos, con lo cual, a su vez, podría calcularse directamente la solubilidad del fármaco en cualquier composición disolvente.
CONCLUSIONES
En esta investigación se ha utilizado satisfactoriamente el MESH en el estudio de la solubilidad de la IMC en mezclas AcOEt + EtOH, utilizando para este fin, valores experimentales del volumen molar y del parámetro de solubilidad del fármaco. En particular, se ha encontrado una buena capacidad predictiva, utilizando un modelo polinómico de quinto orden del parámetro de interacción W en función del parámetro de solubilidad de las mezclas solventes. Sin embargo, al comparar los resultados obtenidos directamente y aquellos obtenidos con el MESH, se encuentra que no hay mejoría significativa en el carácter predictivo al pasar desde el método estrictamente empírico hasta el método propuesto por Martin et ál., lo cual pondría en tela de juicio el valor pre-dictivo de este método.
AGRADECIMIENTOS
A la DIB de la Universidad Nacional de Colombia (UNC) por el apoyo financiero, y al Departamento de Farmacia de la UNC por facilitar los equipos e instalaciones requeridos para el desarrollo de esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Raffa, R. B. Analgesic, antipyretic, and anti-inflammatory drugs. En: Remington: the science and practice of pharmacy. 21 ed. A. Gennaro (ed). Philadelphia: Lippincott Williams & Wilkins. 2005. pp. 1524-1542.
2. Jiménez, F.; Martínez, F. Una estrategia para la selección sistemática de vehículos en el diseño de formas farmacéuticas líquidas homogéneas. Rev. Colomb. Cienc. Quím. Farm. 1995. 24(1): 19-23.
3. Martin, A.; Newburger, J.; Adjei, A. Extended Hildebrand approach: solubility ofcaffeine in dioxane-water mixtures. J. Pharm. Sci. 1980.69 (6): 659-661.
4. Martin, A.; Wu, P. L. Extended Hildebrand solubility approach: p-Hydroxibenzoic acid in mixtures ofdioxane and water. J. Pharm. Sci. 1981. 72 (6): 587-592.
5. Martin, A.; Miralles, M. J. Extended Hildebrand solubility approach: solubility oftolbutamide, acetohexamide, and sulfisomidine in binary solvent mixtures. J. Pharm. Sci. 1982. 71 (4): 439-442.
6. Martínez, F. Aplicación del método extendido de Hildebrand al estudio de la solubilidad del acetaminofén en mezclas etanol-propilenoglicol. Acta Farm. Bonaerense. 2005. 24 (2): 215-224.
7. Martínez, F. Utilidad del método extendido de Hildebrand en el estudio de la solubilidad del acetaminofén en mezclas agua-propilenoglicol. Rev. Acad. Colomb. Cienc. 2005 . 29 (112): 429-438.
8. Pacheco, D. P.; Manrique, Y. J.; Vargas, E. F.; Barbosa, H. J.; Martínez F. Validez del método extendido de Hildebrand en la predicción de las solubilidades de ibuprofén y naproxén en mezclas propilenoglicol-etanol. Rev. Colomb. Quím. 2007. 36 (1): 55-72.
9. Aragón, D. M.; Pacheco, D. P.; Ruidiaz, M. A.; Sosnik, A. D.; Martínez, F. Método extendido de Hildebrand en la predicción de la solubilidad de naproxeno en mezclas cosolventes etanol + agua. Vitae, Rev. Fac. Quím. Farm.2008.15(1): 113-122.
10. Martin, A.; Bustamante, P. El parámetro de solubilidad en las ciencias farmacéuticas. Anal. Real Acad. Farm.1989. 55 (2): 175-202.
11. Hildebrand, J. H.; Prausnitz, J. M.; Scott, R. L. Regular and related solutions. New York: Van Nostrand Reinhold. 1970.
12. BP 1988. The British Pharmacopoeia, Vol. I. Her Majesty's Stationery Office. London. 1988. p. 310.
13. Resa, J. M.; González, C.; Goenaga, J. M.; Iglesias, M. Temperature dependence of excess molar volumes of ethanol + water + ethyl acetate. J. Solution Chem. 2004 . 33 (2): 169-198.
14. Belda, R.; Herraez, J. V.; Diez, O. Rheological study and thermodynamic analysis of the binary system (water/ethanol): influence of concentration. Phys. Chem. Liq. 2004. 42 (5): 467-476.
15. US Pharmacopeia. 23. ed. Rockville, MD: United States Pharmacopeial Convention. 1994.
16. Jiménez, J. A.; Martínez, F. Thermodynamic study of the solubility of acetaminophen in propylene glycol + water cosolvent mixtures. J. Braz. Chem. Soc. 2006. 17 (1): 125-134.
17. Connors, K. A. Thermodynamics of pharmaceutical systems: an introduction for students of pharmacy. Hoboken, N.J.: Wiley-Interscience. 2002. pp. 61-66.
18. Budavari, S.; O'Neil, M. J.; Smith, A.; Heckelman, P. E.; Obenchain, Jr. J. R.; Gallipeau, J. A. R.; D'Arecea, M. A. The Merck index: an encyclopedia of chemicals, drugs, and biologicals. 13 ed. Whitehouse Station (NJ): Merck & Co., Inc. 2001. p. 892.
19. Forster, A.; Hempenstall, J.; Tucker, I.; Rades, T. Selection of excipients for melt extrusion with two poorly water-soluble drugs by solubility parameter calculation and thermal analysis. Int. J. Pharm. 2001. 226(1, 2): 147-161.
20. Ojanen, S. Drug loading of mesoporous silicon particles. M.Sc. Thesis. Department of Chemical Technology, Faculty of Technology, Lappeenranta University of Technology, Lappeenranta, Finland, 2008, pp. 1-125.
21. Fedors, R. F. A method for estimating both the solubility parameters and molar volumes of liquids. Polymer Eng. Sci. 1974. 14(2): 147-154.
22. Barton, A. Handbook of solubility paramet0.ers and other cohesion parameters. 2nd ed. New York: CRC Press. 1991. pp. 157-193.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).